细胞膜-胞浆-核膜蛋白分步提取方法
膜蛋白提取

1分离组织膜蛋白的方法:1、取组织,加入10ml Buffer A 于冰上充分匀浆。
2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。
3、100000g,4℃离心1hr。
弃去上清,沉淀用适量的Buffer B重悬,冰上孵育2hr后分装至EP管,Eppendorf台式离心机10000rpm,4℃离心30min。
4、收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
2取约0.1g肝组织,加入2ml粉碎缓冲液,冰浴中超声粉碎,每次20秒,间隔30秒,共3次,4°c 105xg条件下离心2小时,上清液为胞浆蛋白,沉淀部分加入1ml胞膜蛋白提取液,超声粉碎,4°c 105xg条件下离心2小时,上清液为胞膜蛋白。
样品蛋白含量测定采用酚试剂法。
3我们实验室提取膜蛋白的方法如下:1.将细胞种于T75 或T175的培养瓶中培养数天,细胞铺满瓶底后,吸去培养液。
将PBS/EDTA 溶液(NaCl:0.1M,NaH2PO4:0.01M,EDTA:0.04%)加入量以覆盖细胞为止,置于培养箱或在超净台内消化3~5分钟,如仍未脱落瓶底,用吸管吹打,使细胞完全脱落。
2.收集细胞悬液于10毫升或50毫升的离心管中,1000rpm离心10分钟,去上清液。
细胞膜蛋白的提取

细胞膜蛋白的提取1. 引言细胞膜蛋白是细胞膜上的蛋白质,它们在细胞的结构和功能中起着重要的作用。
细胞膜蛋白具有多种功能,包括细胞识别、信号转导、运输和通道形成等。
为了研究细胞膜蛋白的结构和功能,科学家需要从细胞中提取这些蛋白质。
本文将介绍细胞膜蛋白的提取方法和步骤。
2. 细胞膜蛋白的提取方法2.1 细胞膜蛋白的提取原理细胞膜蛋白是细胞膜上的蛋白质,与细胞膜紧密结合。
因此,提取细胞膜蛋白需要破坏细胞膜,并保持蛋白质的完整性。
常用的细胞膜蛋白提取方法包括机械破碎法、化学溶解法和超声波法等。
2.2 机械破碎法机械破碎法是一种常用的细胞膜蛋白提取方法。
其步骤如下:1.制备细胞悬浮液:将培养的细胞收集,并用缓冲液洗涤,得到细胞悬浮液。
2.破碎细胞:将细胞悬浮液置于低温条件下,加入适量的缓冲液,然后用高速搅拌器或超声波破碎仪破碎细胞,使细胞膜破裂。
3.离心:将破碎后的细胞悬浮液进行离心,分离出上清液和沉淀。
4.收集上清液:将上清液转移到新的离心管中,这个上清液中含有细胞膜蛋白。
2.3 化学溶解法化学溶解法是另一种常用的细胞膜蛋白提取方法。
其步骤如下:1.制备细胞悬浮液:将培养的细胞收集,并用缓冲液洗涤,得到细胞悬浮液。
2.加入溶解剂:向细胞悬浮液中加入适量的溶解剂,如磷酸盐缓冲液或甘油,使细胞膜破裂。
3.搅拌:将细胞悬浮液与溶解剂充分混合,并用搅拌器搅拌一定时间,使细胞膜蛋白溶解在溶液中。
4.离心:将溶解后的细胞悬浮液进行离心,分离出上清液和沉淀。
5.收集上清液:将上清液转移到新的离心管中,这个上清液中含有细胞膜蛋白。
2.4 超声波法超声波法是一种快速、高效的细胞膜蛋白提取方法。
其步骤如下:1.制备细胞悬浮液:将培养的细胞收集,并用缓冲液洗涤,得到细胞悬浮液。
2.加入超声波溶解剂:向细胞悬浮液中加入适量的超声波溶解剂,如磷酸盐缓冲液,使细胞膜破裂。
3.超声波处理:将细胞悬浮液置于超声波处理器中,进行超声波处理,使细胞膜破裂。
提取膜蛋白的方法

提取膜蛋白的方法提取膜蛋白是一项关键的实验步骤,用于研究膜蛋白的结构和功能。
本文将介绍几种常用的膜蛋白提取方法。
1. 浸泡法浸泡法是一种简单的膜蛋白提取方法。
将细胞或组织样品置于适当的缓冲液中,如磷酸盐缓冲液或生理盐水中,并加入一些溶解剂(如阴离子洗涤剂)以破坏膜结构。
浸泡一段时间后,离心以分离出溶液中的膜蛋白。
2. 磷脂双层溶液法磷脂双层溶液法利用磷脂双层膜的特性来提取膜蛋白。
首先,将细胞或组织样品放入含有磷脂双层的液体中。
磷脂双层膜与细胞膜相似,可吸附并保持膜蛋白的结构和功能。
然后,用洗涤液洗涤磷脂双层,使膜蛋白释放到洗涤液中。
3. 超声法超声法是一种物理方法,通过超声波的能量来提取膜蛋白。
将细胞或组织样品置于含有缓冲液的管中,并使用超声波处理。
超声波的能量可以破坏细胞膜结构,使膜蛋白溶解到缓冲液中。
然后,对溶液进行离心,将膜蛋白分离出来。
4. 酸碱提取法酸碱提取法利用pH的变化来提取膜蛋白。
首先,将细胞或组织样品放入酸性或碱性溶液中,并搅拌。
酸性或碱性环境可以破坏细胞膜结构,使膜蛋白溶解到溶液中。
然后,通过调整pH值,使膜蛋白沉淀,进一步提纯。
5. 亲水基质法亲水基质法是一种通过亲水基质与疏水膜蛋白的选择性结合来提取膜蛋白的方法。
细胞或组织样品与亲水基质接触,亲水基质与细胞膜的亲水区域结合,使膜蛋白释放到溶液中。
然后,通过离心和洗涤步骤来分离和纯化膜蛋白。
这些方法在膜蛋白的研究中应用广泛,但根据具体的实验目的和样品特性,可以选择适合的方法进行膜蛋白提取。
实验中还应注意选择合适的缓冲液、溶液浓度和温度,并结合离心、洗涤等步骤进行蛋白的纯化和分离。
此外,需要根据实验目的选择合适的检测方法,如SDS-PAGE、Western blot等来确定提取的膜蛋白的质量和纯度。
总之,膜蛋白提取是膜生物学研究的重要一环,不同方法适用于不同的样品和实验要求。
正确选择和操作提取方法可以高效地提取膜蛋白,并为后续研究提供可靠的样品。
细胞提取蛋白步骤

细胞提取蛋白步骤细胞提取蛋白是生物学研究中常用的实验方法之一,通过提取细胞内的蛋白质,可以进一步进行蛋白质分析、鉴定和功能研究。
下面将详细介绍细胞提取蛋白的步骤。
一、细胞培养和采集在进行细胞提取蛋白实验之前,首先需要进行细胞培养。
常用的细胞培养基有DMEM、RPMI-1640等,根据实验需要选择合适的培养基。
将细胞培养在含有适宜浓度的培养基中,放置在恒温培养箱中,保持适宜的温度、湿度和二氧化碳浓度。
当细胞生长到适当密度时,可以进行下一步的细胞采集。
二、细胞裂解将培养好的细胞放入离心管中,用PBS或生理盐水进行洗涤,去除细胞外的干扰物。
然后加入裂解缓冲液,常用的裂解缓冲液有RIPA 缓冲液、NP-40缓冲液等。
裂解缓冲液中含有蛋白酶抑制剂、磷酸酯酶抑制剂等,可以保护蛋白质不被降解。
将细胞裂解液置于冰上,用超声波仪或搅拌器进行充分裂解,直至细胞完全破碎。
三、离心分离将裂解后的细胞溶液离心,以去除细胞碎片、细胞核和细胞膜等残渣。
离心分离的条件根据实验需要进行调整,一般在12000×g的条件下离心10-15分钟。
离心后,上清液即为含有目标蛋白质的提取液。
四、蛋白质浓度测定使用BCA法、Lowry法或Bradford法等方法,测定蛋白质的浓度。
根据实验需要,可以使用不同的测定方法。
五、蛋白质保存和分析将提取的蛋白质分装到离心管中,并存储在-80摄氏度的冰箱中。
根据实验需要,可以进行蛋白质的分析和鉴定。
常用的方法有SDS-PAGE电泳、Western blotting、质谱分析等。
这些方法可以用来确定蛋白质的分子量、表达量以及与其他蛋白质的相互作用等。
细胞提取蛋白是一项复杂的实验技术,需要注意以下几点:1. 实验前要准备好所需的试剂和设备,确保实验过程的顺利进行。
2. 在细胞裂解过程中,要注意避免蛋白质的降解和氧化,可以添加蛋白酶抑制剂和抗氧化剂等。
3. 细胞裂解后的提取液要尽量避免冻融,以免对蛋白质的活性造成影响。
(完整word版)膜蛋白提取

(完整word版)膜蛋白提取1分离组织膜蛋白的方法:1、取组织,加入10ml Buffer A 于冰上充分匀浆。
2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。
3、100000g,4℃离心1hr。
弃去上清,沉淀用适量的Buffer B 重悬,冰上孵育2hr后分装至EP管,Eppendorf台式离心机10000rpm,4℃离心30min。
4、收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
2取约0.1g肝组织,加入2ml粉碎缓冲液,冰浴中超声粉碎,每次20秒,间隔30秒,共3次,4°c 105xg条件下离心2小时,上清液为胞浆蛋白,沉淀部分加入1ml胞膜蛋白提取液,超声粉碎,4°c 105xg条件下离心2小时,上清液为胞膜蛋白。
样品蛋白含量测定采用酚试剂法。
3我们实验室提取膜蛋白的方法如下:1.将细胞种于T75 或T175的培养瓶中培养数天,细胞铺满瓶底后,吸去培养液。
将PBS/EDTA 溶液(NaCl:0.1M,NaH2PO4:0.01M,EDTA:0.04%)加入量以覆盖细胞为止,置于培养箱或在超净台内消化3~5分钟,如仍未脱落瓶底,用吸管吹打,使细胞完全脱落。
2.收集细胞悬液于10毫升或50毫升的离心管中,1000rpm离心10分钟,去上清液。
膜-胞浆蛋白提取方法

膜-胞浆蛋白提取方法膜-胞浆蛋白提取方法膜蛋白和胞浆蛋白提取试剂盒产品组成:产品组成规格试剂 A 试剂 B 试剂 C蛋白酶抑制剂混合物蛋白稳定剂BB-3111-150T 10ml 20ml 10ml 250μl 100ulBB-3111-2 100T 20ml 40ml 20ml 500μl 200ul储存条件:蛋白酶抑制剂、蛋白稳定剂-20℃保存;蛋白提取液2-8℃保存。
有效期:一年。
产品简介:哺乳动物跨膜蛋白承当各种生物功能,在疾病的发生、开展过程中扮演重要角色。
膜蛋白样品的制备需要充分考虑到与下游的胶分析^p 及质谱分析^p 等应用配套,因此膜蛋白样本制备成为一个难以逾越的挑战。
传统制备膜蛋白样品的方法是使用去污剂和外表活性剂增溶。
去污剂处理睬使膜蛋白丧失其天然构造,因此阻碍了膜蛋白的功能研究。
贝博膜蛋白和胞浆蛋白提取试剂盒是一种基于化学而非去污剂方法的高产膜蛋白提取试剂盒。
本试剂盒提供配套试剂,适用于从细胞和动物组织提取膜蛋白和胞浆蛋白。
提取过程简单方便,可在1小时内完成。
提取的膜蛋白不仅纯度高,保持天然活性,而且绝少穿插污染。
提取的蛋白可用于Western Blotting、转录活性分析^p 、Gel shift凝胶阻滞实验、免疫共沉淀、酶活性测定等蛋白研究。
应用实例:1 4 4图片说明:用膜蛋白和胞浆蛋白提取试剂盒提取细胞样本的'SDA-PAGE的电泳考染照片和Western照片。
图1泳道中1、4分别为Marker、膜蛋白样本。
图2为以上样品的EGFR的WB结果照片。
使用方法:A.细胞蛋白提取①1. 取5-10×106个以上细胞,在4℃,500g条件下离心2-3分钟,小心汲取培养基,尽可能吸干,搜集细胞。
2. 用冷PBS洗涤细胞两次,每次洗涤后尽可能吸干上清。
3. 细胞样品中参加200μl冷的试剂 A,2ul蛋白酶抑制剂混合物,2ul蛋白稳定剂,高速涡旋振荡15秒,置冰上10-15分钟。
膜蛋白分离

5、收集水相留作分析
6、用500ul冰冷的buffer C溶解去污剂相沉淀,冰浴2min后加温,在按步骤6再次离心
7、按步骤8再次抽提去污剂相,用buffer C将洗涤后的去污剂相稀释到初始体积
8、用等量的buffer A分别稀释水相与去污相,并进行免疫沉淀实验
buffer C : 0.5ug/ml Leupeptin,20uM pmsf,50mMTris-cl(PH=7.0),
2)分离细胞膜蛋白的方法:
1、细胞放在冰上,去除上清,用pH7。4的冷磷酸盐缓冲液洗涤单层细胞两次
2、加入1ml2%TritonX溶液冰浴15min
3、刮下单层细胞,4度下10 000g 5min离心
试剂:
1、2%tritonX114:2%TritonX114、50mmol/L Tris HCl(pH7。5)、蛋白酶抑制剂
2、缓冲液A(含0。5mol/LNaCl的RIPA buffer)
3、buffer C
10mmol/L Tris HCl(pH7.5)
150mmol/L NaCl
5mmol/L EDTA(PH7.5)
1)分离细胞膜蛋白的方法:
1 冰上刮下细胞后将细胞溶于有蛋白酶抑制剂的缓冲液A中,于室温与液氮罐中反复冻融2次。
2 5000转4度离心,驱除核及未裂解的细胞。
3 取上清12000转4度离心10分钟取沉淀溶于有蛋白酶抑制剂的缓冲液B中。
4 12000转4度离心10分钟取沉淀溶于有蛋白酶抑制剂的缓冲液C中提取后测蛋白浓度,SDS-PAGE电泳,分装后-20度保存备用。
胞浆、胞核提取(细胞)

胞浆/胞核提取(细胞)
一、胞浆蛋白的提取
1、估计细胞的量
5*1051*1065*106
Cytosol Extraction Buffer A(ul) 25 50-100 300-500 Cytosol Extraction Buffer B(ul) 1.2-1.5 3-6 18-30
Nuclear Extraction Buffer (ul) 5-10 20 100
2、每个培养皿PBS洗两次,吸干PBS(冰上操作)
3、每个培养皿加入150ul CEB-A,把细胞刮下,每个皿刮80次,直到无滑腻感,说明细胞全部刮下,将细胞转入EP管,注射器抽吸10次左右,充分裂解细胞
4、冰上孵育20min,每5min震荡10s
5、离心1000*g,4℃,5min,把上清液吸入新EP管内,为胞浆蛋白,沉淀物包含粗制核蛋白(尽量把上清吸干净)
一、细胞胞核蛋白的提取
1、粗制核蛋白由上述步骤5得到,去除膜成分,用100ul CEB-A加入5ul CEB-B,漩涡震荡10s,冰上孵育1min,在低温离心机中以1000*g,4℃,5min,倒上清,并收集细胞碎片
2、用100ul CEB-A清洗细胞核碎片,1000*g,4℃,5min,去上清
3、加入70-100ul 冰的NEB转移到粗制细胞核中涡旋
4、将EP管放到冰上孵育30min,并间隔震荡5次
5、1200*g,4℃,5min
6、将含有核蛋白的上清液转移到新的离心管中,-20℃保存。
细胞膜蛋白的提取

细胞膜蛋白的提取
细胞膜蛋白的提取可以通过以下步骤进行:
1. 细胞收集:从所需的细胞类型中收集足够数量的细胞。
可以使用细胞培养方法培养细胞,或者从活体组织中分离细胞。
2. 细胞破碎:将细胞用适当的方法破碎,以释放细胞内的蛋白。
可以使用机械方法(如超声波破碎器或高压细胞击碎器)或化学方法(如洗涤液或界面活性剂)来破碎细胞。
3. 蛋白质提取:使用适当的缓冲液或溶液将细胞破碎物悬浮并离心,以去除细胞碎片和细胞核。
随后,可以使用不同的方法来提取膜蛋白,例如溶解细胞膜并提取蛋白。
4. 蛋白质纯化:使用不同的技术来纯化细胞膜蛋白。
这包括以蛋白质的特定性质为基础的方法,例如亲和层析、凝胶过滤层析、离子交换层析等。
5. 蛋白质浓缩:将纯化的细胞膜蛋白浓缩到所需的浓度。
可以使用蛋白质浓缩技术,例如氨基酸纤维柱、浓缩管或旋转蒸发器等。
6. 蛋白质鉴定:利用蛋白质检测方法,如SDS-PAGE、Western blotting或质谱分析等,确定提取的蛋白质的纯度和数量。
细胞膜蛋白的提取过程需根据实验目的和具体需求来选择和优化各个步骤。
核与胞质蛋白提取方法
细胞质与细胞核蛋白提取方法
注意:红色斜体字成分可用蛋白酶抑制剂混合物代替,使用前加入
方法如下:
1.将细胞收集到EP管中,离心(4000r/min,5min,4度)。
2.用PBS洗三次,离心同上,弃上清。
3.加入100微升缓冲液A,冰上孵育10min,离心(14000r/min,1min),弃上清。
4.将沉淀重悬于60微升缓冲液B中,混匀,冰上30min,离心(14000r/min,15min,0度),收集上清,弃沉淀。
(核蛋白提取后可用裂解液A透析2h,合并用于IP;或用其他溶液稀释后用浓缩离心管替换溶液后用于IP或其他实验)
裂解液A的作用主要用于释放胞浆蛋白和膜蛋白,裂解液B用于释放核蛋白,NP-40既是一种表面活性剂又是一种去垢剂,它的作用是既可破坏细胞膜(较温和),又可结合释出的蛋白防止沉淀,所以通过第一步离心去上清后大部分胞浆蛋白和膜蛋白可去掉。
细胞膜蛋白的提取方法

细胞膜蛋白的提取方法
生物侠们,还在实验室奋战吗?还在为科研经费不够发愁吗?今天我就给各位通宵达旦的大侠们带来一个福音。
下面就让我替他给你讲讲,抓紧时间啊!
首先你需要一株需要提前膜蛋白的细胞、NP40、氯化钠、Tris-Hcl、SDS、脱氧胆酸钠和PMSF,东西齐全了,就开始配裂解液吧。
下面是配方哦!
RIPA Buffer For100ml:
150mM NaCl5ml3M NaCl
50mM TrisHCl pH8.05ml1M TrisHCl pH8.0
1mM EDTA pH8.00.2ml0.5M EDTA pH8.0
1%NP-405ml20%NP-40
0.1%SDS1ml10%SDS
0.1%Deoxycholate100mg Deoxycholate
那东西都齐全了,那么来开始讲步骤吧!
1.收集细胞,将1000转离心收集的(最好低温哦)细胞悬于裂解液中20分钟;
2.就12000离心吧,收集沉淀哦;
3.在加入裂解液;
4.然后超声10-15次,每次2秒,间隔15秒;
5.再12000低温离心,收集上清,开始做实验咯!。
膜蛋白的提取方法

膜蛋白的提取方法
膜蛋白的提取方法通常包括以下几个步骤:
1. 细胞裂解:将包含膜蛋白的细胞或组织用不同的方式进行裂解,例如超声波处理、酸碱处理、高压处理等。
2. 膜蛋白分离:通过离心、过滤等方法将膜蛋白分离出来。
3. 纯化:采用膜层联萃取、柱层析、电泳等方法对膜蛋白进行纯化。
4. 确认:通过蛋白质定量、SDS-PAGE、Western blot等方法验证膜蛋白的存在和纯度。
常见的膜蛋白提取方法有:
1. 酸性洗涤法:利用低pH值时,膜蛋白和膜脂亲性增强的特性,将细胞裂解物在酸性条件下洗涤获得膜蛋白。
2. 有机溶剂提取法:利用膜蛋白亲性较强的有机溶剂,如丙酮、甲醇等,将膜蛋白从细胞裂解物中提取出来。
3. 离心法:通过离心分离膜细胞,从而获得膜蛋白。
4. 免疫亲和层析法:利用特异性抗体将目标膜蛋白从混合蛋白中分离纯化。
以上方法的选择需根据具体情况来定,不同的细胞类型或膜蛋白性质有着不同的最佳提取方法。
胞浆胞核蛋白提取

胞浆胞核蛋白提取
1 细胞密度80%-90%时,取出细胞置于冰上。
2 使用预冷的PBS缓冲液冲洗3遍,去除残留液体。
3 向培养瓶中加入300ul的胞质溶胶提取缓冲液A(cytosol extraction buffer A, CEB-
A),刮取细胞至1.5ml进口离心管中。
4 在涡旋震荡混匀器上震荡30s,冰上静置10min,每5min震荡一次。
5 加入30ul的胞质溶胶提取缓冲液B(cytosol extraction buffer B, CEB-B),
涡旋震荡混匀10s,冰上放置1min.
6 4℃离心,1000g,5min。
7 吸取上清,既得到胞浆蛋白。
8 加入100ul的CEB-A,清洗核沉淀,4℃离心,1000g,5min。
9 弃上清,加入40ul的核提取缓冲液(nuclear extraction buffer,NEB)
涡旋震荡混匀10s,冰上放置30min,每5min涡旋震荡10s。
10 4℃离心,1000g,5min。
11 吸取上清,既得到核蛋白。
12 分装至0.2进口EP管中,-80℃保存。
细胞核蛋白和细胞浆蛋白的提取方法

蛋白质分离与提取是生命科学研究基础中的基础,分离细胞核蛋白和细胞浆蛋白,不仅可以
用于研究蛋白在细胞内的定位,而且很多时候分离出来的核蛋白可以用于转录调控方面的研究,例如WB,EMSA(也称gel shift),footprinting,报告基因,酶活性分析等。
Abbkine细胞核蛋白&胞浆蛋白提取试剂盒(KTP3001)
细胞核蛋白&胞浆蛋白提取试剂盒组分:原理:通过细胞浆蛋白抽提试剂,在低渗透压条件下,使细胞充分膨胀,然后破坏细胞膜,释放出细胞浆蛋白,然后通过离心得到细胞核沉淀。
最后通过高盐的细胞核蛋白抽提试剂抽提得到细胞核蛋白。
∙细胞浆蛋白溶液A (CES A)
∙细胞浆蛋白溶液B (CES B)
∙核提取溶液 (NES)
∙DTT (500X)
∙蛋白酶抑制剂 (100X)
∙
另外还有蛋白酶抑制剂套装(Cocktail)
特点:
多功能—适合从新鲜的哺乳动物组织和培养细胞中提取蛋白,提取的蛋白纯度高且保持天
然活性,绝少交叉污染。
快速方便—不到两小时就能纯化出非变性的活性蛋白质。
兼容性好—适用于各种下游检测,包括蛋白质印迹、凝胶转移检测、蛋白质分析、报告基因检测和酶活性检测等。
蛋白质分离提取效果展示:
使用α-tubulin内参抗体(A01080)分别检测胞浆蛋白与核蛋白提取物。
使用Histone H3内参抗体(A01070)分别检测胞浆蛋白与核蛋白提取物。
*C : Cytoplasmic ,胞浆蛋白;N : Nuclear ,核蛋白。
膜蛋白的分离方法

膜蛋白的分离方法
膜蛋白是一类位于细胞膜上的蛋白质,它们在细胞的代谢、信号传递、物质运输等方面起着重要作用。
以下是一些常见的膜蛋白分离方法:
1.超速离心法:利用超速离心机产生的强大离心力,将细胞膜和膜蛋白分离开来。
这种方法常用于制备纯净的细胞膜和膜蛋白。
2.电泳法:通过电泳技术,可以根据膜蛋白的电荷性质和分子量大小,将其分离开来。
电泳法包括聚丙烯酰胺凝胶电泳(PAGE)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)等。
3.层析法:层析法是一种基于膜蛋白物理化学性质差异的分离方法。
常用的层析技术包括凝胶过滤层析、离子交换层析、亲和层析等。
4.浮选分离法:利用浮力密度的差异,通过离心使不同密度的膜蛋白在溶液中分层,从而实现分离。
5.免疫沉淀法:基于抗体与抗原的特异性结合,使用特异性抗体将目标膜蛋白从混合物中沉淀出来。
6.密度梯度离心法:根据膜蛋白的密度差异,将其在密
度梯度介质中进行离心分离。
7.膜蛋白提取试剂盒:市面上有一些商业化的膜蛋白提取试剂盒,它们通常结合了多种分离技术,简化了膜蛋白的提取过程。
需要根据具体的实验需求和膜蛋白的特性选择合适的分离方法。
在膜蛋白分离过程中,需要注意保持膜蛋白的活性和稳定性,避免蛋白质的变性和降解。
膜蛋白的提取方法-全攻略

膜蛋白的提取方法-全攻略一、膜蛋白简介膜蛋白在细胞中扮演着重要的角色:例如被熟知的识别、信号转导、运输等功能,也是用药的理想的靶点,虽动物细胞主要有9种膜脂,而膜蛋白的种类繁多,多数膜蛋白分子数目较少,但却赋予细胞膜非常重要的生物学功能。
根据膜蛋白分离的难易及其与脂分子的结合方式,膜蛋白可分为两大类型:外在膜蛋白、内在膜蛋白。
(1) 外在膜蛋白为水溶性蛋白,靠离子键或其它较弱的键与膜表面的蛋白质分子或脂分子结合,因此只要改变溶液的离子强度甚至提高温度就可以从膜上分离下来,膜结构并不被破坏。
(2) 内在膜蛋白与膜结合非常紧密,一般只有用去垢剂(detergent)使其膜解后才可分离出来。
附注:使用分级抽提方法获得的“膜蛋白”中只有很少一部分是具备多跨膜区的整合膜蛋白。
二、膜蛋白的提取方法谈及蛋白分离,我们想到:超速离心,盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法……有时这些方法常常组合到一起对特定的物质进行分离纯化。
由于蛋白质种类繁多,不同的蛋白质由于结构和组成的差异,其溶解度也各不相同.根据蛋白质的溶解特性,同时可选择不同的溶剂提取,分为水溶液提取和有机溶剂提取.但是与胞质蛋白,核蛋白提取不同之处在于膜蛋白是嵌在膜中的,水溶性不好,基本方法就是用不同的离心速度去掉胞质蛋白等,然后用去污剂把蛋白从膜中释放出来。
膜蛋白分离纯化的重要步骤是选择适当的增溶用表面活性剂,一般常用的有胆酸盐,CHAPS(一种离子去污剂),Emulgen和Lubrol等表面活性剂。
1)先分离膜,然后提取;如选用冷热交替法、反复冻融法、超声破碎法、玻璃匀浆法、自溶法和酶处理法使得细胞破碎,然后通过梯度离心得到含有膜蛋白的粗组分。
(例如:用液氮研磨组织,加入匀浆缓冲液及蛋白酶抑制剂,然后差速离心、蔗糖密度梯度离心。
收集37%与41%间的成分,即为质膜部分。
裂解即可收集膜蛋白)2)用特殊的去污剂选择性的分离。
细胞和动物组织核蛋白的提取方法

细胞和动物组织核蛋白的提取方法产品组成 310001 310002规格 50 assays 100 assaysBuffer A (Cytoplasmic Extraction Reagent) 10ml 20mlBuffer B (Nuclear Extraction Reagent) 10ml 20ml蛋白酶抑制剂混合物 250ul 500ul使用方法:A.细胞蛋白提取1. 取5-10×106个细胞,在4℃,500×g条件下离心2-3分钟,小心吸取培养基,尽可能吸干,收集细胞。
2. 用冷PBS洗涤细胞两次,每次洗涤后尽可能吸干上清。
3. 每20ul细胞压积中加入200μl冷的Buffer A,2ul蛋白酶抑制剂混合物,高速涡旋振荡15秒,置冰上10分钟。
4. 再次高速涡旋振荡5秒,然后在4℃,16000×g条件下离心5分钟。
5. 快速将上清吸入另一预冷的干净离心管,即可得到胞浆蛋白,请置于冰上或-80℃冰箱保存备用。
6. 在沉淀中加入200μl冷的Buffer B,2ul蛋白酶抑制剂混合物,高速涡旋振荡15秒。
7. 置冰上40分钟,每隔10分钟高速涡旋振荡15秒。
8. 在4℃,16000×g条件下离心10分钟。
9. 快速将上清吸入另一预冷的干净离心管,即可得到核蛋白。
B.组织蛋白提取1. 取适量组织样本剪碎,加冷PBS,用组织匀浆器匀浆至无明显肉眼可见固体(或用液氮研磨),冰上静置5分钟,小心将上清吸入另一预冷的干净离心管。
2. 在4℃,500×g条件下离心2-3分钟,弃上清。
3. 按照细胞蛋白的提取方法的第3步骤往下操作即可。
上述蛋白提取物请分装后于-80℃冰箱保存备用。
注意事项:1. 实验过程中的所有BestBio-贝博生物试剂须预冷;所有器具须放-20℃冰箱预冷。
2. 整个过程须保持样品处于低温状态。
储存条件:-20℃保存。
有效期:一年。
细胞膜和细胞器的分离提纯方法

细胞膜和细胞器的分离提纯方法细胞中的膜结构是整个细胞及多种细胞器的界膜,对于保持细胞和细胞器的独立性是必不可少的,同时,很多重要的功能是在膜结构上完成的。
为了研究细胞膜和细胞器的结构与功能,首先要分离出形态与结构完整的、具有生物活性的、纯度高的样品。
在研究工作中,分离细胞膜和细胞器可以用以下方法。
首先是制备一定量的细胞,细胞的来源可以是培养细胞,也可以是某种组织。
培养细胞的收集相对简单一些,直接用胰蛋白酶将细胞从培养瓶上消化下来,制成细胞悬浮液。
比较易碎的组织细胞的收集如肝、脾等,可采用匀浆的方法,稍加研磨就可制成细胞悬液。
有些结缔组织,直接研磨不易分离出细胞,可先用适量的胶原蛋白酶处理。
细胞制备出来后,进行匀浆处理。
匀浆的方法有多种,如用高速打碎机破碎,低渗,玻璃珠与细胞共振荡,冻融法,超声波打碎等。
可根据实验需要和实验室条件来选择。
无论选择哪种方法,都要尽可能保持膜的完整性。
整个操作过程要避免过于激烈,pH、离子强度和渗透压等条件要适中,一般常用中性和等渗溶液。
匀浆产生的细胞裂解物,可通过一系列差速离心再加上一个梯度离心来分离细胞膜与细胞器,梯度是根据细胞器的大小、密度和沉降特性来设计的。
匀浆分步分离的第一步是差速离心,在一系列的离心过程中离心力逐渐加大,并且将细胞器加入具有密度梯度的介质中离心,常用的分离介质有蔗糖、甘油、葡聚糖等。
由于每种细胞器的大小和沉降特性不同,因此,可被分离开来。
如果只是分离细胞中的某种细胞器,可直接根据那种细胞器所对应的相对离心力,在细胞匀浆后进行离心分离。
哺乳动物红细胞的结构比较简单,其细胞膜可用低渗离心的方法分离出来。
如果是独特的细胞膜,可根据表面电荷的密度采用电泳的方法分离,也可以采用凝胶过滤的方法分离。
来源:人教版高中生物学新教材必修1教师用书。
细胞核膜蛋白提取方法

细胞核膜蛋白提取试剂盒
产ห้องสมุดไป่ตู้组成:
产品组成 BB-3174-1 BB-3174-2 规格 50T 100T 细胞核提取液A 20ml 40ml 细胞核提取液B 25ml 50ml 膜蛋白溶解液 10ml 20ml 蛋白酶抑制剂混合物 250ul 500ul
储存条件: 蛋白提取液2-8℃保存;蛋白酶抑制剂-20℃保存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ቤተ መጻሕፍቲ ባይዱ
浴10 分钟,37℃下②1000g-2000g 力离心5 分钟,此时溶液分为两层
(对着光线看),上层为核内蛋白,下层是核膜蛋白约为20-40μl。小心移除上 层,用1-2 倍体积的提取液D 溶解下层即为细胞核膜蛋白。 9. 在步骤6 中所得到的上清(I)中加入5ul 提取液C,充分混匀。37℃水浴10 分钟。
10. 37℃下② 1000g 离心3 分钟,此时溶液分为两层(对着光线看),上层是胞浆
蛋白部分,下层是细胞膜蛋白部分约为40-50μl。 11. 将上清吸入另一预冷的干净离心管,即可得到胞浆蛋白。
12. 用80-200μl 冰冷的提取液D 溶解步骤10 中的下层部分,即得细胞膜蛋白。 13. 将上述蛋白提取物定量③后分装于-80℃冰箱保存备用或直接用于下游实验④。
织匀浆器匀浆至无明显肉眼可见固体(或用液氮研磨),冰上静置5 分钟,小心将匀浆吸入 另一预冷的干净离心管。在4℃,500g 条件下离心2-3 分钟,弃上清。)
3. 用冷PBS 洗涤细胞两次,每次洗涤后尽可能吸干上清。 4. 每5×106 个细胞中加入400ul 冷的蛋白提取液A,混匀后,在4℃条件下用试 剂盒所配针筒反复吸吹细胞,使细胞完全破裂。 5. 在4℃,1000g 条件下离心5 分钟。 6. 快速将上清(I)吸入另一预冷的干净离心管,在沉淀中加入200μl 冷的提取液 B,高速涡旋振荡15 秒。 7. 将混匀的提取液B 置2-8℃振荡1-2 小时,至沉淀充分裂解,沉淀明显减少。8. 37℃水
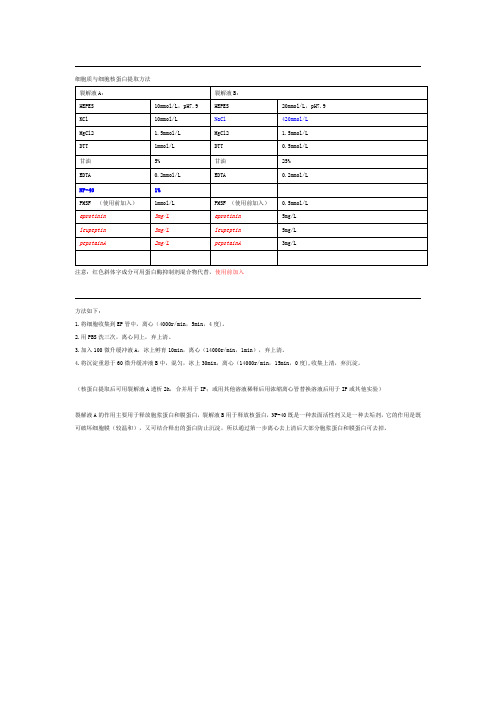
细胞膜/胞浆/核膜蛋白分步提取试剂盒
储存条件: 蛋白酶抑制剂-20℃保存; 磷酸酶抑制剂2-8℃保存; 蛋白提取液2-8℃保存。 有效期: 一年。
产品简介: 贝博细胞膜蛋白/胞浆蛋白/核膜蛋白提取试剂盒(货号:BB-31042)适用于从各种原代或传 代细胞和各种实体组织,如脑、脊髓、神经结或纤维、脂肪、肝脏、消化道、肾脏、心脏、 肌肉、血管、 结缔组织等哺乳动物组织中分步提取细胞膜蛋白/胞浆蛋白/细胞核膜蛋白/核内蛋白。提取 过程简单方便,可在2 小时内完成。该试剂盒含有的蛋白酶抑制剂混合物,阻止了蛋白酶对 蛋白的降解,为提取高纯度的蛋白提供了保证。本试剂盒含有的独特配方能够溶解细胞膜包 括细胞质膜和核膜。提取的蛋白可用于Western Blotting、蛋白质电泳、免疫共沉淀等下 游蛋白研究。
