配合物理论简介课件
配合物ppt课件

.
19
结构不同→性质不同
A是
。
顺式
反式
B是
。
[ Pt(NH3)2Cl2]
配合物 颜色 极性 溶解度 抗癌活性
A 棕黄色 极性 0.2577 有活性
B 淡黄色 非极性 0.0366 无活性
.
20
哪一种结构的[ Pt(NH3)2Cl2] 易溶解于H2O,为什么?
[Ag(NH3)2]+ OH-
[Fe(CN)6]4- K+
[AlF6]3-
Na+
Ag+ Fe2+ Al3+
NH3 CNF-
Ni(CO)4
Ni(CO)4
无
[Co(NH3)5Cl] Cl2
[Co(NH3)5Cl]2+
Cl-
Ni
CO
Co3+ NH3和Cl-
配位 数 2 6 6
4
6
.
12
(1)配合物整体(包括内界和外界)应显电中性;
由提供孤电子对的配位体与接受孤电子对的中心 原子(或离子)以配位键结合形成的化合物称为配位化 合物,简称配合物。
2. 形成条件
(1) 中心原子(或离子)必须存在空轨道。 (2) 配位体具有提供孤电子对的原子。
.
8
二、配合物的组成
[Cu(NH3)4] SO4
中心离子 配位体 配位数 外界离子
内界
外界
.
21
[Pt(NH3)4Cl2]
哪种结构的[ Pt(NH3)2Cl4] 在H2O中溶解度较大,试写 出其结构式。
课件12:2.2.3 配合物理论简介

H2O
(2)加BaCl2溶液,有白色沉淀
以上现象说明什么问题?
结论: (1) 有新微粒生成; (2) 溶液中几乎无Cu2+,存在于新微粒中; (3) 溶液中有大量SO42-存在,说明在与浓氨水反应前后 SO42-无变化,未参与新微粒的形成。
综合以上实验现象分析归纳得出:
深蓝色溶液的本质是NH3与Cu2+形成了新的微粒。 [Cu(NH3)4]2+
b.配位体:提供孤对电子或π电子
① 阴离子、中性分子 ② 配体中直接与中心原子结合的原子叫配位原子。 配位原子必须是含有孤对电子的原子。
常见的配位原子是VA、VIA、VIIA 卤素原子X、O、S、N、P、C。
c.配位数:直接同中心原子配位的配位体的数目
配位数 常 见 金 属 离 子 配 位 数
1价金属离子
天蓝色溶液
H2O
2+
H2O Cu OH2
H2O
深蓝色溶液
NH3
2+
H3N Cu NH3
NH3
配位键的稳定性
Cu2+ OH2 < Cu2+
NH3 < H+
NH3
天蓝色溶液
H2O
2+
H2O Cu OH2 H2O
H+
HN H
H
(4)配合物的性质 ✓配合物具有一定的稳定性,配位键越强,配合物越稳定。 过渡金属离子远比主族金属易形成配合物,且形成的配合物 的稳键的表示方法 A B H O H
(4)配位键的键参数
H
同其他相同原子形成的共价键键参数完全相同
2. 配合物 通常把接受孤电子对的金属离子(或原子)与
(1) 定义: 某些提供孤电子对的分子或离子以配位键结合 形成的化合物称为配位化合物,简称配合物
化学选修3-配合物理论简介-课件省名师优质课赛课获奖课件市赛课一等奖课件

A.[Co(NH3) 4Cl2] Cl
B.[Co(NH3) 3Cl3]
C.[Co(NH3) 6] Cl3
D.[Co(NH3) 5Cl] Cl2
稳定性逐渐增强
化学
[Cu(H2O)4]2+ 天蓝色
可溶
Cu(OH)2
蓝色
难溶
[Cu(NH3)4]2+深蓝色 可溶来自配合物旳形成对性质旳影响
配位键特点
1
配位键是 一种特殊 旳共价键
2
具有共价 键旳饱和 性与方向 性
特殊共价键 饱和性方向性
化学
3
键参数与 一般共价 键旳键参 数相同
键参数
配合物
化学
金属离子(原子)与某些分子或 离子(称为配体)以配位键结合 形成旳化合物
配合物旳形成条件
化学
金属原子或离子 要有配位键存在
NH4Cl 、 [Cu(H2O)4]SO4是否是配合物?
深蓝色溶液
[Cu(NH3)4 ]SO4
2、配合物
化学
(1) 定义 通常把接受孤电子正确金属离子(或原子)与某些提供孤电子正确分子 或离子以配位键结合形成旳化合物称为配位化合物,简称配合物
(2) 配合物旳构成 Cu(H2O)4 SO4 读作:硫酸四水合铜
(3)配合物旳命名
化学
①配离子(从左向右,配位数→配体→合→ 中心原子或中心离子)
电子对予以体 电子对接受体
H2O
2+
H2O Cu OH2
H2O
配位键
配位键定义
化学
提供孤电子正确原子与接受孤电子正确原子之间形成 旳共价键
配位键形成条件
化学
一方提供孤电子对 一方提供空轨道
第3课时配合物理论简介

第3课时配合物理论简介一配位键1.配位键的概念是成键原子一方提供孤电子对,另一方提供空轨道形成的共价键,是一类特殊的共价键。
2.配位键表示方法:A→B,其中A是,B是。
如:NH4+3.配位键的形成条件①成键原子一方能提供孤电子对。
如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
①成键原子另一方能提供空轨道。
如H+、Al3+、B及过渡金属的原子或离子。
4.配位键的特点:配位键是σ键,特殊的共价键,同样具有饱和性和方向性。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
5.常见含配位键的物质:NH+4、H3O+、CO、AlO2-、[B(OH)4]-、H2SO4二配位化合物1.配合物的概念把与某些以结合形成的化合物称为配位化合物,简称配合物。
如[Cu(NH3)4]SO4、[Ag(NH3)2]OH、NH4Cl等均为配合物。
2.配合物的形成上述实验现象产生的原因主要是配离子的形成。
以配离子[Cu(NH3)4]2+为例,NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
配离子[Cu(NH3)4]2+可表示为3.配合物的组成配合物[Cu(NH3)4]SO4其组成如下图所示:(1)中心原子是提供空轨道接受孤电子对的原子。
中心原子一般都是带正电荷的阳离子(此时又叫中心离子),过渡金属离子最常见的有Fe3+、Ag+、Cu2+、Zn2+等。
(2)配体是提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。
配体中直接同中心原子配位的原子叫做配位原子。
配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O 中的O原子等。
(3)配位数是直接与中心原子形成的配位键的数目。
如[Fe(CN)6]4-中Fe2+的配位数为6。
形成配合物的条件形成配合物的中心原子(离子)必须存在空轨道,配体一般都存在着孤电子对。
《配合物的价键理论》课件

能量最低原则
总结词
能量最低原则是指在形成配合物时,系 统会自发地向着能量最低的状态演化。
VS
详细描述
能量最低原则是化学中的基本原理之一, 它指出在自然演化过程中,系统会自发地 向着能量最低的状态演化。在配合物的形 成过程中,这个原则同样适用。配合物通 常会形成能量最低的稳定结构,这是因为 能量较低的稳定状态可以使整个系统的能 量降低,使其更加稳定。
美国化学家鲍林提出现代价键理论。
1950年代
量子化学计算方法的出现,为价键理论提供 了更精确的理论框架。
价键理论的重要性
解释配合物的结构和性质
价键理论能够解释配合物的空间构型、稳定 性、磁性等性质,帮助人们更好地理解配合 物的结构和性质之间的关系。
指导新材料的合成与应用
通过价键理论,可以预测和设计具有特定性质和功 能的配合物新材料,为实际应用提供指导。
《配合物的价键理论 》ppt课件
目 录
• 配合物的价键理论简介 • 配合物的价键理论基本原理 • 配合物的价键理论的应用 • 配合物的价键理论的挑战与展望 • 配合物的价键理论案例分析
01
配合物的价键理论简介
定义与概念
配合物的价键理论
价键理论是研究配合物结构的理论之一,主要关注配 体与中心原子之间的相互作用和电子配置。
THANKS
感谢观看
泡利不相容原理
总结词
泡利不相容原理是指在同一个原子或分子中,不可能 存在两个或以上具有相同量子状态的电子。
详细描述
泡利不相容原理是量子力学中的基本原理之一,它指出 在同一个原子或分子中,不可能存在两个或以上具有相 同量子状态的电子。这个原理的原因是基于电子的自旋 和波函数的性质。由于电子是费米子,它们的自旋状态 必须是正或负,因此在一个有限的空间范围内,不可能 存在两个完全相同的电子状态。这个原理在配合物的价 键理论中也非常重要,因为它是保证配合物中电子配置 稳定的一个重要因素。
配合物的基本概念PPT课件

2. 螯合H物2C
O
O
多齿配体与单个中心离子(或原子)所形成的配合
物
C H2
C O 乙氨酸铜
第14页/共60页
3.多核配合物
一个配位原子同时与二个中心离子结合所形成的配合物,即含有多个中心原子或离 子的配合物。
多核配合物
OH [ ( H2O )4Fe
OH
Fe ( H2O )4]4 +
第15页/共60页
离子,但也有电中性的原子,其中以过渡金属离子居多,如Fe3+、Cu2+、Co2+、 Ag+等;少数高氧化态的非金属元素也可作中心离子,如BF4-、SiF62-中的B(Ⅲ)、 Si(Ⅳ)等。中心原子如[Ni(CO)4)、[Fe(CO)5]中的Ni、Fe原子。
第5页/共60页
(2) 配位体与配位原子
在配合物中与形成体结合的离子或中性分子
第16页/共60页
配合物的新定义
配合物是由一定数量的可以给出孤对电子对或电子的离子或分子(统称配体) 与接受孤对电子或电子的离子或原子(统称中心原子)以配合键结合形成的化合 物。
第17页/共60页
四、复盐与配合物
复盐:由两种或两种以上的盐组成的盐。
如光卤石KMgCl3·3H2O、明矾KAl(SO4)2·12H2O、 冰晶石Na3AlF6、磷灰石Ca5(PO4)3F、黄玉 Al2(SiO4)F2等。
几何异构——顺式和反式。
第23页/共60页
例如:
四 氯 铂 酸 钾 K2[PtCl4] 用 氨 水 处 理 得 到 一 种 棕 黄 色 的 配 合 物 , 经 测 定 , 组 成 为 [ PtCl2(NH3)2], 有极性,有抗癌活性,在水中的溶解度是 0.26g/100gH2O;
配合物-PPT课件

离子键:电负性相差较大(>1.7)的金属元素与非金属元素分
别变成具稳定的(八电子构型)正、负离子后,通过离子间的 静电引力而形成分子。
共价键:电负性相近的原子中的未成对电子,可通过共享的方
式配对成键。
5
离域键:自由电子分布在多个原子周围形ቤተ መጻሕፍቲ ባይዱ的一种位置不定
⑤ [Co(en)3]2(SO4)3 硫酸三(乙二胺)合钴(Ⅲ)
⑥ [Cr(OH)3H2O(en)] 三羟•水•乙二胺合铬(Ⅲ)
⑦ [Cr(H2O)4Cl2]Cl &@#!$%¶
16
1.5.2 桥基多核配合物的命名
在桥联基团或原子的前面冠以希腊字母- ,并加圆点与配合物 其它部分隔开。两个或多个桥联基团,用二( - )等表示;如
19
2.1.1 顺-反异构
同种配体处于相邻位置者 称为顺式异构体,同种配 体处于对角位置者称为反 式异构体。 MA2B2类型的平面正方型 配合物具有顺反异构体。 如[Pt(NH3)2Cl2]。
20
MA2B4类型的四角双锥配合物也具有顺反异构体。如 [Co(NH3)4Cl2]+配离子。
21
2.1.2 面-经异构
中配配配 外
心位位体 界
()
离 子
原 子
体
位 数
离 子
配合物一般可表示为
[M(L)l]
如:[Ni(CO)4];[PtCl4(en)]
[M(L)l]Xn
[Ag(NH3)2]Cl;[Co(en)2Br2]Cl
Kn[M(L)l]
Na2[Sn(OH)6];K3[Fe(CN)6]
[M(L)l]m+或[M(L)l]m-
配合物第1课时PPT课件

配合物的应用
一、科学研究中的应用
1、离子鉴定:
Ni2+与丁二肟反应,生成血红色配合物。
2、离子分离:
2 Zn( NH 3 ) 4 (溶液) Zn NH 3 H 2O 3 Al ห้องสมุดไป่ตู้ Al(OH ) 3 (沉淀) 2
配合物的应用
二、工业催化中的应用
乙烯催化氧化制乙醛
配合物的应用
五、配合物与生物固氮
将大气中游离态氮 转化为化合态氮的过 程叫氮的固定
合氮酶中Fe-Mo中 心结构示意图
问题解决
现有两种配合物晶体[Co(NH3)6]Cl3和 [Co(NH3)5Cl]Cl2,一种为橙黄色,另一 种为紫红色。请设计实验方案将这两种配合 物区别开来。
提示:先写出两者的电离方程式进行比较。
2+
实验2-2 已知硫酸铜与足量氨水反 应后溶解是因为生成[Cu(NH3)4]2+ , 其结构简式为: HN
3
NH3 Cu NH3 NH3
2+
试写出实验中发生的两个反应的离子方程式?
Cu 2+ +2NH3 .H2O Cu(OH)2 +2 NH4 +
Cu(OH)2 + 4NH3 . H2O 蓝色沉淀
问题解决
具体步骤: 1、称取相同质量的两种晶体,分别配成溶液。 2、向两种溶液中加入足量的AgNO3溶液。 3、静置,过滤。 4、洗涤沉淀,干燥 5、称量。 结果:所得固体质量多的即为[Co(NH3)6]Cl3, 所得固体质量少的即为[Co(NH3)5Cl]Cl2 。
课堂小结
一、配合物的概念:配位键 二、配合物的组成:配位体+中心原子
第一章配合物基本概念讲课文档

按成键特点分类
3 新型配合物
• 中心离子和配体之间有强的π键性 • 中心原子具有反常低的氧化数,甚至为-1和0
• 化合物有较大的共价性
Fe
1829年,Zeise盐
1951年,二茂铁
现在三十六页,总共五十三页。
60年代,簇状配合物
配位化合物的命名
1、配离子 1)配体名称放在中心原子之前; 2)不同配体之间以圆点(·)隔开; 3)配体数目以二、三、四表示(一可省略); 4)最后一个配体名称后缀以“合”字;
现在十页,总共五十三页。
配位数
在配合物中,中心离子接受配体提供的孤电子 对的数目,或配合物中与中心离子直接相连的 配位原子的数目。
影响 因素
内部因素 外部因素
空间 电荷
中心原子 配体
浓度、温度等
现在十一页,总共五十三页。
影响中心原子的配位数因素
中心原子 的影响
配体的影响
外界条件 的影响
离 子 半 径 Cr(CN)63-, Mo(CN)74: 氧 化 数 PtIICl42-, PtIVCl62:
NH3 氨
CO
羰
水
NO 亚硝酰
乙二胺
三苯基膦
(Py) 吡啶
现在三十八页,总共五十三页。
有机配体的命名:
烃基配体------采用烃基配体的有机名称 如:K2[Cu(C2H)],三(乙炔基)合铜(Ⅰ)酸钾 [Fe(CO)4(C2C6H5)2],四羰基·二(苯乙炔基)合铁(Ⅱ) 有机阴离子------采用“根”字结尾 如:CH3CO2-,乙酸根;、(CH3)2N-,二甲胺根; 注意: 有机配体一律用括号括起来 有机配体命名时均采用系统命名法,不能用俗名
第一章配合物基本概念文档ppt
-配合物理论简介(上课用)PPT课件

Fe(SCN)3 2021 [Ni(CO)4]
16
(4)多配体配合物,配位数等于配体数数量之和。
K[PtCl5(NH3)] [Co(NH3)4Cl2]Cl (5)常见的中心离子:
过渡金属原子或离子:Fe Co Ni Cu Zn等
常见的配体: NH3 X- CN SCN- H2O
(6)配位数与中心离子电荷数的关系
叶绿素结构示意图
2021
1
第二节 分子的立体结构
四、配合物理论简介
宁夏育才中学勤行学区
高二化学组
李丽
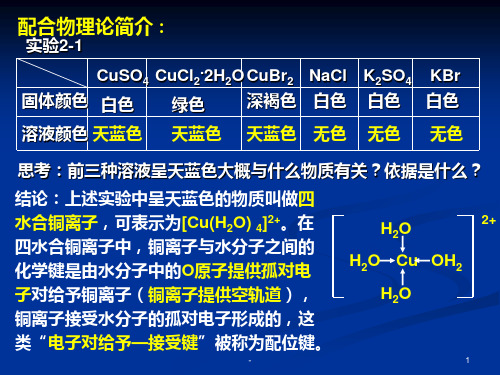
为什么CuSO4 •5H2O晶体是蓝 色而无水CuSO4 是白色?
CuSO4•5H2O
实验探究[2—1]
向盛有固体样品的试管中,分别加1/3试管
水溶解固体,观察实验现象并填写下表
固体
溶液 颜色
CuSO4
完全电离出外界离子和内界配离子,但内界配
离子电离程度很小。
[Ag(NH3)2]OH K3[Fe(CN)6] [Co(NH3)4Cl2]Cl
注意:电离方程式的书2写021。
18
(3)形成配合物前后性质的改变
①颜色的改变 [实验2-3]在盛有氯化铁溶液(或任何含有的Fe3+溶 液)的试管中滴加硫氰化钾(KSCN)溶液。
(2) 配合物的组成
内界 外界 配离子
[Cu(NH3)4] SO4
中心离子 配体 配位数
配合物
中心原子或离子 内界(配离子) 配体
配位数
外界
2021
配位原子
13
内界 外界 配离子
[Cu(NH3)4] SO4
中心原子 配位体 配位数
①中心原子:也称配位体形成体,是电子对 接受体,一般是金属离子,特别是过渡金 属离子。特点:有空轨道。
配合物理论简介ppt课件

NH3
2+
[ ] H3N Cu NH3
NH3
[Cu(NH3)4]2+离子
12
【继续实验2-2】
往深蓝色透明溶液中加入极性小的溶剂 (乙醇),静置,现象是__深__蓝__色__晶__体__析__出____。
深蓝色晶体是___[_C_u__(_N_H__3_)_4]_S_O__4_·_H__2O_____ 原因是乙醇溶解后,降低了[Cu(NH3)4]SO4
9
原因分析:
第一步得蓝色沉淀
Cu2++
第二步沉淀溶解,得深蓝色透明溶液
Cu(OH)2+4NH3·H2O = [Cu(NH3)4]2+ + 2OH-+4H2O
总反应的离子方程式
Cu2++4NH3·H2O = [Cu(NH3)4]2++4H2O
10
平面正方形
现象:生成血红色溶液 原因:生成[Fe(SCN)n]3-n
(n=1~6)
Fe3++3SCN— = Fe(SCN)3
作用:检验或鉴定Fe3+
18
结论
①配位键的强度有大有小。当遇上配合能力 更强的配体时,一种配离子可能会转变成另 一种更稳定的配离子。 ②配离子中的中心离子,通常是金属离子,尤 其是过渡金属离子;配位体中的配位原子,通 常是主族非金属原子。
CuSO4•5H2O CuSO4 •5H2O晶1 体
第二节 分子的立体结构 四、配合物理论简介
2
学生 实验[2—1]
实验 向盛有固体样品的试管中,分别加 入适量水,振荡,溶解固体,观察溶
液颜色并填写下表
固体 ①CuSO4 ②K2SO4 ③CuCl2•2H2O
选修三配合物PPT课件
-
2
实验2-2 已知氢氧化铜与足量氨水反应 后溶解是因为生成了[Cu(NH3) 4]2+ ,其 结构简式为:
NH3
2+
H3N Cu NH3
NH3
试写出实验中发生的两个反应的离子方程式?
Cu 2+ +2NH3 .H2O
Cu(OH)2 +2 NH4 +
Cu(OH)2 + 4NH3 . H2O
蓝色沉淀
[Cu(NH3) 4]2+ +2OH—+4H2O
[Co(NH3)2(en)2](NO3)3 配位数6
*中心离子的电荷高,对配位体的吸引力较强,有 利于形成配位数较高的配合物。 *中心离子半径越大,其周围可容纳配体就越多, 配位数越大。
常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 2
+3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)
用二、三、四等数字表示配位体数。不同配位名 称之间用圆点“·”分开。 阴离子次序为:简单 离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。
-
11
1.配位阴离子配合物--配位阴离子“酸”外
界K2[SiF6]
六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)]
五氯·一氨合铂(Ⅳ)酸钾
-
13
形成配合物时性质的改变
1、颜色的改变 Fe3+ + nNCS- == [Fe(NCS)n](n-3)-
2、溶解度的改变: AgCl + HCl =[AgCl2]- + H+ AgCl + 2NH3 == [Ag(NH3)2]+ + ClAu + HNO3 + 4HCl == H[AuCl4] + NO + 2H2O 3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Fe S
Mo
固氮酶中Fe—Mo中心结构示意图
3 工程项目管理规划
第二代铂类抗癌药(碳铂)
3 工程项目管理规划
O C NH3
CH2
Pt2+
配合物的应用
a 在生命体中的应用 b 在医药中的应用
叶绿素 血红蛋白
酶 含锌的配合物 含锌酶有80多种
维生素B12 钴配合物
抗癌药物
c 配合物与生物固氮
A.[Co(NH3) 4Cl2] Cl
B.[Co(NH3) 3Cl3]
C.[Co(NH3) 6] Cl3
D.[Co(NH3) 5Cl] Cl2
3 工程项目管理规划
[Cu(H2O)4]2+ 天蓝色 可溶
稳
定
Cu(OH)2
蓝 色 难溶
性 逐
渐
增
[Cu(NH3)4]2+ 深蓝色 可溶
强
3 工程项目管理规划
固氮酶 镀银工业
d 在生产生活中的应用
3 工程项目管理规划
王水溶金 H[AuCl4] 照相技术的定影 电解氧化铝的助熔剂 Na3[AlF6]
配合物理论简介小结
1、配位键
定义 “电子对给予—接受共价键”
一方提供孤电子对
配位键的形成条件
2、配合物
一方提供空轨道
定义
配合物的组成
配合物的性质
配合物的应用
3 工程项目管理规划
Cu(OH)2 + 4NH3 . H2O
蓝色沉淀
Cu(OH)2 +2 NH4 +
[Cu(NH3)4]2+ +2OH- +4H2O
深蓝色溶液
3 工程项目管理规划
[Cu(NH3)4 ]SO4
2、配合物
(1) 定义
通常把接受孤电子对的金属离子 (或原子)与某些提供孤电子对的 分子或离子以配位键结合形成的化 合物称为配位化(合配物离子,)简称配合物
3 工程项目管理规划
配合物的形成条件
金属原子或离子 要有配位键存在
NH4Cl 、 [Cu(H2O)4]SO4是否是配合物?
配位键与配合物的关系? 判断CuSO4+NH3·H2O能否形成配合物?
3 工程项目管理规划
实验探究CuSO4+NH3·H2O
天蓝色 溶液
蓝色 沉淀
深蓝色 溶液
Cu 2+ +2NH3 . H2O
配合物的形成对性质的影响
Fe3+ +3 SCN- =[ Fe(SCN)3]
颜色的改变
AgOH+ 2NH3=[Ag(NH3)2]+ + OH-
溶解度的改变
HbO2+CO = HbCO+O2
3 工程项目管理规划
稳定性增强
你知道吗?
血红素(含铁配合物) 叶绿素(含镁配合物)
3 工程项目管理规划
维生素B12 (含钴配合物)
课堂练习
1、指出下列配合物的内界并填下表
配合物 [Ag(NH3)2]OH
[Ni(CO)4]
K[Pt(NH3)Cl3]
外界 中心原子 配位体 配位数
OH-
Ag+
NH3
2
——
Ni
CO
4
K+
Pt2+ NH3、Cl- 4
3 工程项目管理规划
2、向下列配合物的水溶液中加入AgNO3溶液
不能生成 AgCl沉淀的是( B )
配位键表示方法
AB
电子对 给予体
电子对 接受体
3 工程项目管理规划
H
+
HN H
H
配位键特点
1
配位键是 一种特殊 的共价键
特殊共价键
2
具有共价 键的饱和 性与方向 性
3
键参数与 一般共价 键的键参 数相同
饱和性方向性 键参数
3 工程项目管理规划
配合物
金属离子(原子)与某些分子或 离子(称为配体)以配位键结合 形成的化合物
[Cu(NH3)4] SO4 硫酸四氨合铜
3 工程项目管理规划
配合物的组成
配位原子 配离子的电荷数
[Cu(NH3)4]2+ SO42-
中心离子 配 体 配位数 外界离子
内 界(配离子) 外 界
中配配内由配外与如配如能子离心位位界中离界内K如提位配配够:内子4有3原原数心子界外:供[体位位很提F工F完的界X程e子 子 原 的 发难e孤X体体全供项、电(能、目电-C(子电生、电电中的管空完C荷离NO理离离(荷电O全规o子提数数):轨、划:、6H电]子离数性[对等供目的C[道SC离-Nu、、于)子匹u的(孤,外接i,N(、NC中NH) 配而分电即H配界受3NC、)心3内4)与 的子子配]4-为孤u合、2]界离P+S、配 阴或⇋O对位等(电离S子物K4Z=体 离CC子离的键子和[+unCN)很2结 子子、4u+原的配对+,-(难、N4合 或A体子数NH的电NHHg3电而 阳离)i,目金、34[2](,O2荷构离+C常属P+其、数SOt成子见O、原电N)的442。离的-A]子H代无程u3配或数、及度外位和离很C离界小O原子子。
(2) 配合物的组成 Cu(H2O)4 SO4
中 配配 心 体位
读作:硫酸四水合铜离 数
子
3 工程项目管理规划
(3)配合物的命名
①配离子(从左向右,配位数→配体→合→ 中心原子或中心离子) ②配合物→类似于酸、碱、盐
练习:
K3[Fe(CN)6] 六氰合铁酸钾
[Ag(NH3)2]OH 氢氧化二氨合银 K[Pt(NH3)Cl3] 三氯一氨合铂酸钾
高二选修3 物质结构与性质
第二章第二节 分子的立体构型 ——配合物理论简介
化学
Fe3++3SCN- = Fe(SCN)3
在溶液中为 什么不能大 量共存?为 什么不打沉 淀符号?
3 工程项目管理规划
配合物理论简介
什么是配位键?
配位键属于 哪一类化学键?
3 工程项目管理规划
实验探究
固体颜色 溶液颜色 无色离子 天蓝色离子
CuSO4 白色 天蓝色
CuCl2·2H2O NaCl 绿 色 白色 天蓝色 无 色
Na+ Cl- K+ SO42Cu2+
K2SO4 白色 无色
四种溶液中哪些离子呈无色? 什么离子呈天蓝色?
3 工程项目管理规划
Байду номын сангаас
H2O
2+
H2O Cu OH2
H2O
交流与讨论
Cu2+与H2O是如何结合成[Cu(H2O)4]2+
H2O Cu2+
提供孤电子对 空轨道接受孤电子对
电子对给予体 电子对接受体
H2O
2+
H2O Cu OH2
H O 3 工程2项目管理规划
配位键
配位键定义
提供孤电子对的原子与接受孤电子对的原子之间形成 的共价键
3 工程项目管理规划
配位键形成条件
一方提供孤电子对 一方提供空轨道
想一想:NH4+是否含有配位键? 3 工程项目管理规划
化学
我们的生活
我们的未来
感谢下 载
3 工程项目管理规划
