大学物理第四章ppt
合集下载
大学物理第四章--功和能

a
a
l
xdx
2l
前已得出:
Af
mg(l a)2
2l
mg(l 2 a2 ) mg(l a)2 1 mv2
2l
2l
2
得v
g l
1
(l 2 a 2 ) (l a)2 2
§3 保守力的功与势能 一、 保守力
rB
B
两个质点之间的引力
B
第四章 功和能
§4.1 功 §4.2 动能定理 §4.3 保守力功与势能 §4.4 功能原理机械能守恒定律
§1 功和功率
一、恒力做功 直线运动
A=Fcos S
记作A F S F r
F
F
M
M
S
位移无限小时:
dA
F
dr
dA称为元功
功等于质点受的力和它的位移的点积(标积)
例1一水平放置的弹簧,其一端固定,另一端系一小球,求小
球的位置由A到B的过程中弹力对它所做的功。(在O处弹簧无 形变)
解:根据胡克定律 F F kx
W F dr
xB Fdx
xA
xB xA
kxdx
O
1 2
A
k xB2
B
xA2
1 2
k xA2
作用在质点
上.在该质点从坐标原点运动到(0,2R)位
置过程中,力
F
对它所作的功为多少?
y
b
b
A a F.dr a (Fxdx Fydy)
R
x O
例4 如图,水平桌面上有质点 m ,桌面的摩 擦系数为μ 求:两种情况下摩擦力作的功
a
l
xdx
2l
前已得出:
Af
mg(l a)2
2l
mg(l 2 a2 ) mg(l a)2 1 mv2
2l
2l
2
得v
g l
1
(l 2 a 2 ) (l a)2 2
§3 保守力的功与势能 一、 保守力
rB
B
两个质点之间的引力
B
第四章 功和能
§4.1 功 §4.2 动能定理 §4.3 保守力功与势能 §4.4 功能原理机械能守恒定律
§1 功和功率
一、恒力做功 直线运动
A=Fcos S
记作A F S F r
F
F
M
M
S
位移无限小时:
dA
F
dr
dA称为元功
功等于质点受的力和它的位移的点积(标积)
例1一水平放置的弹簧,其一端固定,另一端系一小球,求小
球的位置由A到B的过程中弹力对它所做的功。(在O处弹簧无 形变)
解:根据胡克定律 F F kx
W F dr
xB Fdx
xA
xB xA
kxdx
O
1 2
A
k xB2
B
xA2
1 2
k xA2
作用在质点
上.在该质点从坐标原点运动到(0,2R)位
置过程中,力
F
对它所作的功为多少?
y
b
b
A a F.dr a (Fxdx Fydy)
R
x O
例4 如图,水平桌面上有质点 m ,桌面的摩 擦系数为μ 求:两种情况下摩擦力作的功
大学物理第四章刚体转动

进动和章动在自然界中实例
陀螺仪
地球极移
陀螺仪的工作原理即为进动现象。当 陀螺仪受到外力矩作用时,其自转轴 将绕某固定点作进动,通过测量进动 的角速度可以得知外力矩的大小和方 向。
地球极移是指地球自转轴在地球表面 上的移动现象,其产生原因与章动现 象类似。地球极移的周期约为18.6年 ,且极移的幅度会受到地球内部和外 部因素的影响。
天体运动
许多天体的运动都涉及到进动和章动 现象。例如,月球绕地球运动时,其 自转轴会发生进动,导致月球表面的 某些特征(如月海)在地球上观察时 会发生周期性的变化。同时,行星绕 太阳运动时也会发生章动现象,导致 行星的自转轴在空间中的指向发生变 化。
感谢观看
THANKS
02
刚体定轴转动动力学
转动惯量定义及计算
转动惯量定义
刚体绕定轴转动时,其惯性大小的量度称为转动惯量,用字母$J$表示。它是一个与刚体质量分布和转轴位置有 关的物理量。
转动惯量计算
对于形状规则的均质刚体,可以直接套用公式计算其转动惯量;对于形状不规则的刚体,则需要采用间接方法, 如分割法、填补法等,将其转化为规则形状进行计算。
刚体性质
刚体是一个理想模型,它在力的作用 下,只会发生平动和转动,不会发生 形变。
转动运动描述方式
01
02
03
定轴转动
平面平行运动
ห้องสมุดไป่ตู้
定点转动
物体绕一固定直线(轴)作转动。
物体上各点都绕同一固定直线作 不同半径的圆周运动,同时物体 又沿该固定直线作平动。
物体绕一固定点作转动。此时物 体上各点的运动轨迹都是绕该固 定点的圆周。
非惯性系下刚体转动描述方法
欧拉角描述法
大学物理——第4章-振动和波

A sin1 + A sin2 2 tan = 1 A cos1 + A cos2 1 2
合成初相 与计时起始时刻有关.
v A 2
ω
v A
2
O
x2
1
v A 1
x1
xx
分振动初相差2 1与计时起始时刻无关,但它对合成振幅 是相长还是相消合成起决定作用.
20
讨 论
2 A = A2 + A2 + 2A A2 cos(2 1) 1 1
F = kx
3
l0
k
m
A
F = kx = ma
k 令ω = m
2
A x = Acos(ωt +)
o
x
积分常数,根据初始条件确定
a = ω2 x
dx = ω2 x dt 2
2
dx υ = = Aω sin( ωt +) dt
dx 2 a = 2 = Aω cos(ωt +) dt
4
2
x = Acos(ωt +)
15
π
例 4-3 有两个完全相同的弹簧振子 A 和 B,并排的放在光滑 的水平面上,测得它们的周期都是 2s ,现将两个物体从平衡 位置向右拉开 5cm,然后先释放 A 振子,经过 0.5s 后,再释 放 B 振子,如图所示,如以 B 释放的瞬时作为时间的起点, (1)分别写出两个物体的振动方程; (2)它们的相位差是多少?分别画出它们的 x—t 图.
5cm
O
x
16
解: (1)振动方程←初始条件
x0 = 0.05m, υ0 = 0 , T = 2s
2π ω= = π rad/s T
2 υ0 2 A = x0 + 2 = 0.05m ω υ0 对B振子: tan B = = 0 B = 0 x0ω
合成初相 与计时起始时刻有关.
v A 2
ω
v A
2
O
x2
1
v A 1
x1
xx
分振动初相差2 1与计时起始时刻无关,但它对合成振幅 是相长还是相消合成起决定作用.
20
讨 论
2 A = A2 + A2 + 2A A2 cos(2 1) 1 1
F = kx
3
l0
k
m
A
F = kx = ma
k 令ω = m
2
A x = Acos(ωt +)
o
x
积分常数,根据初始条件确定
a = ω2 x
dx = ω2 x dt 2
2
dx υ = = Aω sin( ωt +) dt
dx 2 a = 2 = Aω cos(ωt +) dt
4
2
x = Acos(ωt +)
15
π
例 4-3 有两个完全相同的弹簧振子 A 和 B,并排的放在光滑 的水平面上,测得它们的周期都是 2s ,现将两个物体从平衡 位置向右拉开 5cm,然后先释放 A 振子,经过 0.5s 后,再释 放 B 振子,如图所示,如以 B 释放的瞬时作为时间的起点, (1)分别写出两个物体的振动方程; (2)它们的相位差是多少?分别画出它们的 x—t 图.
5cm
O
x
16
解: (1)振动方程←初始条件
x0 = 0.05m, υ0 = 0 , T = 2s
2π ω= = π rad/s T
2 υ0 2 A = x0 + 2 = 0.05m ω υ0 对B振子: tan B = = 0 B = 0 x0ω
复旦大学大学物理力学课件Ch4_part_I-1
W Ek
力对空间的累积作用 标量 惯性系 内力作功不一定为零 合外力为零, 作功不一定为零
I P
力对时间的累积作用 矢量 惯性系 内力冲量为零 合外力为零, 总的冲量一定为零
动量守恒定律
t2 n n F外力dt mi vi mi vi 0 P t1 i 1 i 1
t
动量定理的成立条件——惯性系。
利用动量定理计算平均冲力
F (t2 t1 ) Fdt
I Fdt =P mv 2 - mv1
P F= t
•应用: 利用冲力: 增大冲力,减小作用时间 ——冲床 避免冲力: 减小冲力,增大作用时间 ——轮船靠岸时的缓冲
力的效果 力的瞬时效果 牛顿定律是动量定理 关系 的微分形式 适用对象 质点 适用范围 惯性系 解题分析 必须研究质点在每时 刻的运动情况
力对时间的积累效果 动量定理是牛顿定律的 积分形式 质点、质点系 惯性系 只需研究质点(系)始 末两状态的变化
动能定理和动量定理的比较
动能定理 动量定理 都是从牛顿定律推出
一、冲量
1, 若质点受恒力的作用, I =Ft 在t 时间内所受的冲量为:
2, 若质点受变力的作用, 在t1t2 时间内所受的冲量为:
t
F
F
I = Fn tn
t2 t1
t 1 t 2 t1
F (t )
t n t2
积分形式
t2 I = Fdt
dp dv dM F M u dt dt dt
y h h v1
v2
1 2 h v1t ' gt ' 2
t 1s
'
大学物理第4章PPT课件

设有两个质点m1和m2相互作用,把它们看成一个系统,若 m1受到m2的作用力是f1,发生的位移为dr1;m2受到m1的作用 力是f2,发生的位移为dr2,则这一对相互作用的内力的功为
dW=dW1+dW2
第一节 功 和 功 率
因为
所以
f1=-f2
dW=f1·dr1+f2·dr2=f1·dr1-f1·dr2=f1·(dr1-dr2)=f2·dr12 4- 5) 在式(4- 5)中, dr12是m1相对于m2的位移,此相对位移与参考系的 选择无关.由式(4- 5)分析可知,系统内的质点没有相对位移时,一对相互
第二节 动能 动能定理
动量是矢量,不但有大小,而且有方向,这是机械运动 的性质;动能是标量,而且永远为正,它是能量的一种形式, 能量并不限于机械运动.除了动能外,还有其他各种形式的能 量,如电能、热能、光能、原子能等.动能与这些能量是可以 相互转化的.
另外,与动量变化相联系的是力的冲量,冲量是力的时 间累积作用,其效果是使物体的动量发生变化.而与动能变化 相联系的是力所做的功,功是力的空间累积作用,其效果是使 物体的动能发生变化.这两个物理量各自遵从一定的规律,它 们是从不同侧面来描写物体机械运动的物理量.
力做的功等于力的大小与位移沿力的方向的分量的乘积.由
此看出,功是力的空间累积作用.功也可以用力F与位移Δr的标
积表示,即
W=F·Δr
(4- 2)
功是一个标量,但有正负之分,功的正负由F与Δr之间的
夹角θ决定.在国际单位制中,功的单位是牛顿·米(N·m).
第一节 功 和 功 率
2. 变力的功
式(4- 2)为恒力做功的定义式,但在一般情况下作用 在物体上的力不一定都是恒力,质点也不一定做直线运动.这 时,不能直接用式(4- 2)来讨论变力的功,那么如何计算 变力的功呢?设有一个质点,在大小和方向都随时间变化的 力F作用下,沿任意曲线从a点运动到b点,如图4-2所示.
dW=dW1+dW2
第一节 功 和 功 率
因为
所以
f1=-f2
dW=f1·dr1+f2·dr2=f1·dr1-f1·dr2=f1·(dr1-dr2)=f2·dr12 4- 5) 在式(4- 5)中, dr12是m1相对于m2的位移,此相对位移与参考系的 选择无关.由式(4- 5)分析可知,系统内的质点没有相对位移时,一对相互
第二节 动能 动能定理
动量是矢量,不但有大小,而且有方向,这是机械运动 的性质;动能是标量,而且永远为正,它是能量的一种形式, 能量并不限于机械运动.除了动能外,还有其他各种形式的能 量,如电能、热能、光能、原子能等.动能与这些能量是可以 相互转化的.
另外,与动量变化相联系的是力的冲量,冲量是力的时 间累积作用,其效果是使物体的动量发生变化.而与动能变化 相联系的是力所做的功,功是力的空间累积作用,其效果是使 物体的动能发生变化.这两个物理量各自遵从一定的规律,它 们是从不同侧面来描写物体机械运动的物理量.
力做的功等于力的大小与位移沿力的方向的分量的乘积.由
此看出,功是力的空间累积作用.功也可以用力F与位移Δr的标
积表示,即
W=F·Δr
(4- 2)
功是一个标量,但有正负之分,功的正负由F与Δr之间的
夹角θ决定.在国际单位制中,功的单位是牛顿·米(N·m).
第一节 功 和 功 率
2. 变力的功
式(4- 2)为恒力做功的定义式,但在一般情况下作用 在物体上的力不一定都是恒力,质点也不一定做直线运动.这 时,不能直接用式(4- 2)来讨论变力的功,那么如何计算 变力的功呢?设有一个质点,在大小和方向都随时间变化的 力F作用下,沿任意曲线从a点运动到b点,如图4-2所示.
大学物理上册全章节及习题ppt课件

大学物理上册 全章节PPT及 习题
• 6、切向加速度和法向加速度
dv at dt
d dt
v2 an
2 2 a a a t n
• 7、角速度和角加速度
d d 2 2 d t dt
an 2r
v r
at r
a a v u a e • 8、相对运动 v
e x i n 质点系的动能定理: W W E E k k 0
五、保守力的功 势能
保守力的功: F d势能: E p kx l 2 Mm 引力势能: E G p W ( E E ) E 保 pb pa p r
• 9、牛顿第二定律
2 d v d r F m a m m2 dt dt
第二章
一、牛顿三定律
质点动力学
牛顿第一定律:惯性定律 d v 牛顿第二定律 Fm m a d t 牛顿第三定律:作用力与反作用力 二、动量定理 动量守恒定律 t2 质点动量定理 m v v d I 2-m 1 Ft
六、功能原理 机械能守恒定律
ex in 功能原理: W W E E nc 0
0
动能和势能之和 ——机械能
机械能守恒 E E0
第三章 刚体力学
一、定轴转动定律
1)受力分析
M J
质点:牛顿第二定律 F ma 2)列方程: 刚体:转动定律 M J 无滑动条件:a R
固有长度
相对静止时测得棒的长度叫固有长度,相对棒长 方向运动时,测得长度要变短,长度只沿运动方向 收缩。
二、洛仑兹变换 x ut x' 2 2 1 u / c 洛 仑 y' y 兹 变 z 'z u 换 t 2 x 式 c t 1 u2 / c2
• 6、切向加速度和法向加速度
dv at dt
d dt
v2 an
2 2 a a a t n
• 7、角速度和角加速度
d d 2 2 d t dt
an 2r
v r
at r
a a v u a e • 8、相对运动 v
e x i n 质点系的动能定理: W W E E k k 0
五、保守力的功 势能
保守力的功: F d势能: E p kx l 2 Mm 引力势能: E G p W ( E E ) E 保 pb pa p r
• 9、牛顿第二定律
2 d v d r F m a m m2 dt dt
第二章
一、牛顿三定律
质点动力学
牛顿第一定律:惯性定律 d v 牛顿第二定律 Fm m a d t 牛顿第三定律:作用力与反作用力 二、动量定理 动量守恒定律 t2 质点动量定理 m v v d I 2-m 1 Ft
六、功能原理 机械能守恒定律
ex in 功能原理: W W E E nc 0
0
动能和势能之和 ——机械能
机械能守恒 E E0
第三章 刚体力学
一、定轴转动定律
1)受力分析
M J
质点:牛顿第二定律 F ma 2)列方程: 刚体:转动定律 M J 无滑动条件:a R
固有长度
相对静止时测得棒的长度叫固有长度,相对棒长 方向运动时,测得长度要变短,长度只沿运动方向 收缩。
二、洛仑兹变换 x ut x' 2 2 1 u / c 洛 仑 y' y 兹 变 z 'z u 换 t 2 x 式 c t 1 u2 / c2
大学物理_第四章__动量和角动量

1
d (mv ) dm d v dm dv 0 F m v dt m dt dt dt dt ma
物理意义:物体所受合外力的冲量等于物体动量的增量。
I mv2 mv1
——质点的动量定理
I x mvx 2 mvx1 I y mvy 2 mvy1 直角坐标分量式为 I z mvz 2 mvz1 注意: t2 1. I Fdt P2 P1 为矢量式,使用中
I x px mvBx mv Ax
mvB mv A cos45
vB
O
B
vA
x
0.683kg m s
1
A
I y p y mvBy mv Ay mv A sin45 0.283kg m s1
总冲量: 大小 I
2 0.739 N s Ix I2 y
球与棒脱离到飞至最高点过程机械能守恒
1 2 mv 2 mgh 2
v2 2 gh
2.据动量原理作矢量图:
3.解析式:
p2
2 2 I P P2 P 1
p I
7.3 (N S) 2 1 P 0 tan 1 34.99 P I 7.3 365N F 0.02 t
v1 0 P 1 0
l
2
T
m
1
mg
EP 0
v2 ?
1 2 机械能守恒 1 2 m 2gl(1 cos ) mv 2 mgl (1 cos ) 2
I合
P2 m v2
例2.一重锤从高度h=1.5m处自静止下落,锤与被加工的 工件碰撞后末速为0。若打击时间 t 为 10 1 s、 10 -2 s、 10 -3 s 和10 -4 s ,试计算这几种情形下平均冲击力与重力的比值.
d (mv ) dm d v dm dv 0 F m v dt m dt dt dt dt ma
物理意义:物体所受合外力的冲量等于物体动量的增量。
I mv2 mv1
——质点的动量定理
I x mvx 2 mvx1 I y mvy 2 mvy1 直角坐标分量式为 I z mvz 2 mvz1 注意: t2 1. I Fdt P2 P1 为矢量式,使用中
I x px mvBx mv Ax
mvB mv A cos45
vB
O
B
vA
x
0.683kg m s
1
A
I y p y mvBy mv Ay mv A sin45 0.283kg m s1
总冲量: 大小 I
2 0.739 N s Ix I2 y
球与棒脱离到飞至最高点过程机械能守恒
1 2 mv 2 mgh 2
v2 2 gh
2.据动量原理作矢量图:
3.解析式:
p2
2 2 I P P2 P 1
p I
7.3 (N S) 2 1 P 0 tan 1 34.99 P I 7.3 365N F 0.02 t
v1 0 P 1 0
l
2
T
m
1
mg
EP 0
v2 ?
1 2 机械能守恒 1 2 m 2gl(1 cos ) mv 2 mgl (1 cos ) 2
I合
P2 m v2
例2.一重锤从高度h=1.5m处自静止下落,锤与被加工的 工件碰撞后末速为0。若打击时间 t 为 10 1 s、 10 -2 s、 10 -3 s 和10 -4 s ,试计算这几种情形下平均冲击力与重力的比值.
大学物理力学第四章功与能

(1)一对力的功与相对移动的路径无关,而只决 定于相互作用物体的始末相对位置,这样的一对 力称为保守力 (如:万有引力、弹力、重力)
(2)保守力B的环流 为零A。
y
A
F dr l1
F
A B
dr
l2
B
B
F dr
l1
l1
A F dr l2
F dr
A
l2
B
0
o
x
非保守力——▲ 摩擦力(耗散力):作功为负,
1 2
m2v2 B 2
1 2
m2v2
2 A
B1
B2
B1
B2
F1 • d r1 F 2 • d r2 f 1 • d r1 f 2 • d r2
A1
A2
A1
A2
1 2
m1v1B 2
1 2
m2v2B 2
1 2
m1v1A2
1 2
m2v2 A2
Aext Aint EkB EkA
外力与内力对质点系做的功之和等于质 点系总动能的增量。-----质点系的动能定理
A
rAB
B
A F r cos
F r
恒力的功与物体的具体路径无关,
只和起点和终点位置有关.
2. 变力做功
A
F1
r1
F2
r2
F3
r3
...
Fi
ri
...
ri i
定义: element work元功
Fi
dA F dr 视为恒力,直线
r3
F3
r2 r1
F2
F1
A
B
AAB L
E。
n
n
(2)保守力B的环流 为零A。
y
A
F dr l1
F
A B
dr
l2
B
B
F dr
l1
l1
A F dr l2
F dr
A
l2
B
0
o
x
非保守力——▲ 摩擦力(耗散力):作功为负,
1 2
m2v2 B 2
1 2
m2v2
2 A
B1
B2
B1
B2
F1 • d r1 F 2 • d r2 f 1 • d r1 f 2 • d r2
A1
A2
A1
A2
1 2
m1v1B 2
1 2
m2v2B 2
1 2
m1v1A2
1 2
m2v2 A2
Aext Aint EkB EkA
外力与内力对质点系做的功之和等于质 点系总动能的增量。-----质点系的动能定理
A
rAB
B
A F r cos
F r
恒力的功与物体的具体路径无关,
只和起点和终点位置有关.
2. 变力做功
A
F1
r1
F2
r2
F3
r3
...
Fi
ri
...
ri i
定义: element work元功
Fi
dA F dr 视为恒力,直线
r3
F3
r2 r1
F2
F1
A
B
AAB L
E。
n
n
大学物理A1 课件 第4章 狭义相对论

x = ax + bt + e t = ct + dx + f
v
o
P x , y , z , t
x x
S系看 x =0点,
设 t = t =0 时,在o=o点 发出一光信号, 在两个参考 代入以上方程组可得 系中测得的光到达某时空 x = a(x vt)(1)点的事件为p和p '
(2) 长度收缩是“测量”结果,不是“视觉”效 应。
例4-2. 静系中子的平均寿命为2.210-6s。 据报导,在一组高能物理实验中,当它 的速度为u=0.9966c时通过的平均距离为 8km。试说明这一现象:(1) 用经典力学 计算与上述结果是否一致;(2) 用时间膨 胀说明;(3) 用尺缩效应说明。
1 v2 c 2
l l0 1 v c
2
2
原长:在相对于观察者静止 l 的参考系中测得的物体长度。 0
长度收缩:运动物体的长度小于原长, l
当
l0
v c l l0
注意:长度收缩只发生在运动的方向上。
结论:
(1) 相对于观察者运动物体沿运动方向长度缩短了— — 长度收缩 (动尺缩短)
事件 1 A M 发生
B
k
事件 2 发生
K’系:1、2 两事件同时发生
K 系1事件先于2 事件发生
结论:“同时性”具有相对性 ——光速不变原理的直接结果
4.2.2 时间延缓
火车系:
S 系
理想实验:爱因斯坦火车 M y
d
o
A'
, t1 ) I(x1
x1
x
, t2 ) II(x1
0
1 2
大学物理热学 第四章 (热力学第一定律)

19
理学院 物理系 陈强
第四章 热力学第一定律
四. 理想气体的内能和CV、Cp
对理想气体, 内能仅是温度T的函数, 是状态函数.
U U (T )
所以, 不论对等体或等压过程均有:
dU dU dU dT dT V dT p
理想气体的定容摩尔热容为
Q L 4 . 06 10 J
4
外界对系统作功为
W p ( V g V l ) ... 3 . 05 10 J
3
Q
由热力学第一定律, 水的内能增量为
U Q W 3 . 75 10 J
4
16
理学院 物理系 陈强
第四章 热力学第一定律
绝热
• 微观本质不同:作功 有序; 传热 无序
8
理学院 物理系 陈强
第四章 热力学第一定律
准静态过程中功的计算 如图,dW pSdx pdV
dW:外界对系统作的元功
dV 0 膨胀 , dW 0
S p dx
dV 0 压缩 ,
dW 0
从状态I(p1,V1,T1)变化到状态II (p2,V2,T2)
T1+dT
系统T1 T2
T1+2dT
T1+3dT
5
例1:气体被压缩的过程
例2:系统的加热过程
理学院 物理系 陈强
第四章 热力学第一定律
对一定量气体,任何一个平衡态都对应于状态图(如 P-V图,P-T图或V-T图)中的一点。反之亦然;
一定量气体的任何一个准静态过程都可用系统的 状态图(如P-V图,P-T图或V-T图)中一条光滑连 续曲线表示,反之亦如此。
理学院 物理系 陈强
第四章 热力学第一定律
四. 理想气体的内能和CV、Cp
对理想气体, 内能仅是温度T的函数, 是状态函数.
U U (T )
所以, 不论对等体或等压过程均有:
dU dU dU dT dT V dT p
理想气体的定容摩尔热容为
Q L 4 . 06 10 J
4
外界对系统作功为
W p ( V g V l ) ... 3 . 05 10 J
3
Q
由热力学第一定律, 水的内能增量为
U Q W 3 . 75 10 J
4
16
理学院 物理系 陈强
第四章 热力学第一定律
绝热
• 微观本质不同:作功 有序; 传热 无序
8
理学院 物理系 陈强
第四章 热力学第一定律
准静态过程中功的计算 如图,dW pSdx pdV
dW:外界对系统作的元功
dV 0 膨胀 , dW 0
S p dx
dV 0 压缩 ,
dW 0
从状态I(p1,V1,T1)变化到状态II (p2,V2,T2)
T1+dT
系统T1 T2
T1+2dT
T1+3dT
5
例1:气体被压缩的过程
例2:系统的加热过程
理学院 物理系 陈强
第四章 热力学第一定律
对一定量气体,任何一个平衡态都对应于状态图(如 P-V图,P-T图或V-T图)中的一点。反之亦然;
一定量气体的任何一个准静态过程都可用系统的 状态图(如P-V图,P-T图或V-T图)中一条光滑连 续曲线表示,反之亦如此。
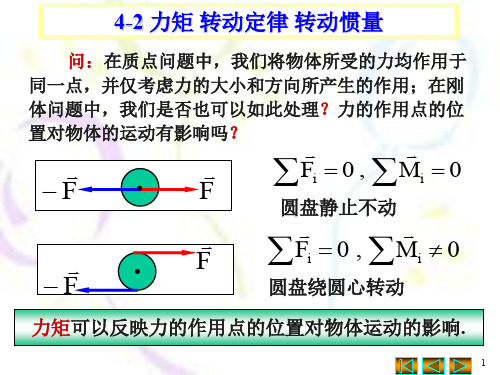
大学物理-第四章-力矩 转动定律 转动惯量
0
3
8
以上各例说明:
(1)刚体的转动惯量 与刚体的质量有关, 与刚体的质量分布有关, 与轴的位置有关。
(2)质量元的选取:
线分布 dm dx(或dl)
面分布 dm ds
体分布 dm dv
线分布
面分布
体分布
9
习题4-11: 质量为m1和m2 的两物体A、B 分别悬挂在图示的组合轮两端.设两轮的半 径分别为R 和r,两轮的转动惯量分别为J1 和J2 ,轮与轴承间、绳索与轮间的摩擦力 均略去不计,绳的质量也略去不计.试求两 物体的加度度和绳的张力.
解: 系统角动量守恒
J11 J22 (J1 J2 )
J11 J 22
(J1 J2 )
22
习题4-16:一质量为m′、半径为R 的均匀圆盘,通过 其中心且与盘面垂直的水平轴以角速度ω转动,若在 某时刻,一质量为m 的小碎块从盘边缘裂开,且恰好 沿垂直方向上抛,问它可能达到的高度是多少? 破裂
Lz x mv y ymv x
15
2 刚体定轴转动的角动量
L mirivi ( miri2 )
i
i
z
L J
二 刚体定轴转动的角动量定理
dL d(J) M
dt dt
O ri
v i
mi
t2 Mdt
t1
L2 L1
dL
J2
J1
非刚体定轴转动的角动量定理
20
有许多现象都可以用角 动量守恒来说明. 它是自然 界的普遍适用的规律.
花样滑冰 跳水运动员跳水
飞轮
1
2
航天器调姿
大学物理第四章狭义相对论基础描述PPT课件

20
②当 u时c,
略变换:
x x ut
y y
z z
t t
1
u c
2 2
洛 1仑兹变换可以简化为伽利
x x ut y y z z t t
即伽利略变换是洛仑兹变换在低速时的近似。
可见洛仑兹变换有更为普遍的意义。
性系都是等价的。
--伽利略相对性原理
2.力学规律在所有惯性系中相同数学表达形式。
3.时间和空间都是绝对的,无关联的。
4
二、伽利略变换 在参考系中发生的一个物理事件要用四个坐标
(x、y、z、t)来描述。
设S系和S'系都是惯性参照系,且:
S'系相对于S系沿x轴以速度u 运动,
开始时t=t' =0坐标原点O和O'重合。
二、爱因斯坦假设 1.1905年爱因斯坦在他的论文中,大胆地提出 两条假设,这就是狭义相对论的基本原理。 2.两条基本假设: (1)相对性原理
在所有惯性系里,一切物理定律都相同。 即:具有相同的数学表达式。
所有惯性系都是等价的。
这是牛顿相对性原理的推广。即在所有惯性系里 ,不但力学定律成立,而且电磁定律、光的定律 、原子物理定律和其它物理定律都同样成立。 13
揭示了时间、空间与引力的关系。
相对论严格地考察了时间、空间、物质和运动 这些物理学的基本概念,给出了科学而系统的时 空观和物质观,从而使物理学在逻辑上成为完美 的科学体系。
3
4-1 力学相对性原理 伽利略变换
一、 力学相对性原理
1.表述:描述力学现象的规律不随观察者所选的
惯性系而改变,或者说,研究力学规律时一切惯
x
1 2
1 2
18
①两坐标间的变换关系:
②当 u时c,
略变换:
x x ut
y y
z z
t t
1
u c
2 2
洛 1仑兹变换可以简化为伽利
x x ut y y z z t t
即伽利略变换是洛仑兹变换在低速时的近似。
可见洛仑兹变换有更为普遍的意义。
性系都是等价的。
--伽利略相对性原理
2.力学规律在所有惯性系中相同数学表达形式。
3.时间和空间都是绝对的,无关联的。
4
二、伽利略变换 在参考系中发生的一个物理事件要用四个坐标
(x、y、z、t)来描述。
设S系和S'系都是惯性参照系,且:
S'系相对于S系沿x轴以速度u 运动,
开始时t=t' =0坐标原点O和O'重合。
二、爱因斯坦假设 1.1905年爱因斯坦在他的论文中,大胆地提出 两条假设,这就是狭义相对论的基本原理。 2.两条基本假设: (1)相对性原理
在所有惯性系里,一切物理定律都相同。 即:具有相同的数学表达式。
所有惯性系都是等价的。
这是牛顿相对性原理的推广。即在所有惯性系里 ,不但力学定律成立,而且电磁定律、光的定律 、原子物理定律和其它物理定律都同样成立。 13
揭示了时间、空间与引力的关系。
相对论严格地考察了时间、空间、物质和运动 这些物理学的基本概念,给出了科学而系统的时 空观和物质观,从而使物理学在逻辑上成为完美 的科学体系。
3
4-1 力学相对性原理 伽利略变换
一、 力学相对性原理
1.表述:描述力学现象的规律不随观察者所选的
惯性系而改变,或者说,研究力学规律时一切惯
x
1 2
1 2
18
①两坐标间的变换关系:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.1 理想气体的压强和温度
4.1.1 状态参量 4.1.3 统计假设
平衡态
4.1.2 理想气体模型 4.1.4 理想气体状态方程
4.1.5 理想气体的压强
4.1.6 理想气体的温度
4.1 理想气体的压强和温度
热运动 微观粒子 微观量 宏观量
4.1.1 状态参量
1.状态参量 2.平 衡 态
平衡态
描述系统状态的物理量.
4.1.4 理想气体状态方程
根据大量实验定律总结得到:
v-摩尔数
pV
M
RT vRT
M 气体质量 μ-摩尔质量 R-普适常数 R= 8.31 J mol1 K 1
4.1.5 理想气体的压强
设边长为 l 的正方形容器中有N 个分子每个 分子的质量为m ,第i 个分子的速度为vi , 其分 量为 vix viy viz y 2 2 2 2 vi vix viy viz
在压强不太大、温度不太低的情况下,实际气体可 近视看作理想气体.
4.1.3 统计假设
气体处于平衡状态时,在没有外力场的条件下, 分子向每一个方向运动的可能性是相同的,容器中任 一位置处单位体积内的分子数目相同. 结论 1.沿空间各方向运动的分子数目是相等的;
2.一个体积元中飞向前、后、左、右、上、下 的分子数 各为1/6; 3.分子速度在各个方向上的分量的各种平均 值相等,例如 1 2 2 2 2 v x v y vz 0 v x v y v z 3 v
p pV T nk Nk
2.67 105 10 3 23 193(K) 23 10 1.38 10
4.2 能均分定理 理想气体的热力学能 4.2.1 自由度
4.2.2 能量按自由度均分定理 4.2.3 理想气体的热力学能 4.2.4 例题分析
4.2.1 自由度
(1)一摩尔理想气体 的热力学能为 (2)质量为M,摩尔质量为
i i E0 kTN 0 RT 2 2
的理想气体的热力学能为
结 论
M i E RT 2
1.一定质量的某种理想气体的热力学能完全决定于 气体的热力学温度T,与气体的压强和温度无关.
2.一定质量的理想气体在不同的状态变化过程中, 只要温度的变化量相等,那么它的热力学能的变化量 也相同,而与过程无关.
热力学能和机械能的区别 1.物体的机械能的大小与参照系及势能 零点的选择有关,可以为零;
2.物体内部的分子永远处于运动中,其 热力学能永远不等于零.
4.2.4 例题分析
1. 一容器被中间的隔板分成相等的两半. 一半装有氦气,温度为250 K ;另一半装有氧 气,温度为310 K . 二者压强相等. 求去掉隔 板后两种气体混合后的温度. 解 混合前 He : p0V0 1 RT1 T2 1 O2 : p0V0 2 RT2 2 T1
N
N
2 ix
式中
v v i 1 N
2 x
N
2 ix
表示容器中N个分子在 x 轴 方向的速度分量平方的平均值 (简称方均值)
——统计平均量
Nm 2 vx A1面所受到的各分子的冲力之和 F l
由统计假设有
v2
2 2 vx v2 v y z
2 ix
v
i 1
N
2 i
N
2 x
能量按自由度均分定理 在温度为T 的平衡态下,气体分子每个 1 自由度的平均动能都等于 kT 2
4.2.3
理想气体的热力学能(气体内能)
1.定义
气体的热力学能是指它所包含的所有分子的 动能和分子间因相互作用而具有的势能的总和. 2.理想气体的热力学能
对于理想气体,由于分子间的相互作用力可 以忽略不计,所以,其热力学能就是它的所有分 子的动能之和. 设某种气体分子的自由度为 i ,则一个分子 i 的平均动能为 kT 2
理想气体的热力学温度T 与气体分子的平均平动动 能成正比。
k 1.38 10 23 J K 1
结 论 宏观量 T 是标 志分子热运动剧烈程度 的物理量,分子无规则 运动越剧烈,气体的温 度越高.
方均根v kT m
2
3 3 v kT RT m
系统内的各状态参量不随
时间变化的状态.
4.1.2 理想气体模型
1.理想气体 (宏观表述) 在任何情况下满足三大实验 ①玻意耳定理 ②盖· 吕萨克定律 定律的气体 ③查理定律 (理想气体状态方程).
2.理想气体必 须满足的三个条件(微观力学模型)
A) B) C) 可视为质点,遵从牛顿运动定律; 除碰撞外,分子之间以及分子与器壁之间都没有相 互作用; 分子间以及分子与器壁间的碰撞是完全弹性碰撞.
4.1.6 理想气体的温度
M p RT V
设每个分子的质量为 m , 气体分子的 总个数为N , No 为阿佛加德罗常数.
R 式中 k N0
——玻耳 兹曼常数
Nm N R p RT T nkT VN 0 m V N0
2 因为 p nkT p n 3 所以 3 kT T 2 2 3k
(3)设气体的热力学能为E M Mi pV RT E RT , 2 5 i E pV pV 2 2 5 5 2 8.31 10 1.20 10 2
4 2.49 10( J)
3. 储有氧气(处于标准状态)的容器以速 率v =100m· s-1 作定向运动, 当容器突然停止运动 时, 全部定向运动的动能都变为气体分子热运动 的动能, 此时气体的温度和压强为多少? 解 对于标准状态有: T0 273K , p0 1atm 1.013 10 5 Pa 1 M5 3 2 因为 Mv R(T T0 ), 32 10 kg 2 2 2 v 280.7 (K) 所以 T T0 5R 又因为 p0 nkT0 , p nkT
偶然性 规律性
1859年,麦克斯韦从理论上导出了气体分子 的速率分布规律,——麦克斯韦速率分布律.
2.研究方法
把速率分成若相等的区间,然后求出各区 间的分子数是多少,即在v — v+dv区间内的分 子数dN是多少,或者dN 占分子总数N的百分比 dN/N是多少.
在速率区间 dv 足够小的情况下
dN f (v )dv N
定义 确定一个物体在空间的位置需要引入的
独立坐标的数目叫该物体的自由度. 单原子分子 三个平动 x y z 双原子分子 三个平动 x y z
二个转动 三原子以上分子 三个平动
(因为 cos 2 cos 2 cos 2 1)
x y z 三个转动
说明
经典理论中,不考虑振动自由度.
2
在同一温度下,质量大的分子其方均根速率小.
例 求0℃时氢气分子和氧气分子的平均平动动 能和方均根速率. T 273.15 K H 2.02103 kg mol 解: o 32103 kg mol
2 2
氢气和氧气分子的平均平动动能相同
3 3 kT 1.38 10 23 273 .15 5.65 10 21 (J) 2 2
氢气的方均根速率为
2 vH 2
氧气的方均根速率
2 vO 2
3RT
3 8.31 273.15 2.02 103
3RT
3 8.31 273.15 32.00 103
1840(m s 1 )
461 (m s 1 )
例 贮于体积为 1 10 3 m 3容器中的某种气体,分 子总数 N 10 23 ,每个分子的质量为 5 1026 kg , 1 分子的方均根速率为400 m s.求气体的压强和 气体分子的总平动动能以及气体的温度. 解: 由公式
联立求解可得
3 5 T2 T2 2 284 (K) T2 3T2 5 2T1 2
2. 体积为V =1. 2010-2 m3 的容器中储有 氧气, 其压强 p =8. 31 105Pa, 温度T =300 K , 求:(1)单位体积中的分子数 ; (2)分子的 平均平动动能;(3)气体的热力学能. 解 (1)单位体积中的分子数为 5 8 . 31 10 p n kT 1.38 10 23 300 2.00 1026 (m3 ) (2)分子的平均平动动能为 3 3 kt kT 1.38 10 23 300 2 2 6.21 10 21 (J)
理想气体的压强公式
1 2 p nm v 3
式中 讨 论
或
2 1 2 2 p n( m v ) n 3 2 3
——平均平动动能
1 mv 2 2
1.在上面公式推导过程中忽略了气体分子的相互碰 撞,但由于分子间是完全弹性碰撞,结果仍相同. 2.上式是气体分子运动论的重要结论,虽不能用实 验来直接验证,但可以解释和推证许多实验事实.
v
i 1
N
N
v
i 1
N
2 iy
N
2 v iz i 1
N
N
2 2 vx v2 v y z
1 2 v v 3 1 F 1 Nm 2 2 2 nm v nm v p v x A1 面所受到 3 S l2 l x 的压强为 N ——分子数密度 n 3 l
所以
碰撞后的速度分量为
vix viy viz
分子动量的增量为
A2
A1 vi
m
x
mvix mvix 2mvix
z
2l 与A1面发生两次连续碰撞所需要的时间为 v ix v ix 单位时间内碰撞的次数为 2l 单位时间内第 i 个分 y 子作用于A1面的总冲 量为 2 A1 A2 vix mvix vi 2mvix 2l l x m 第 i 个分子作 2 mvix 用于A1面的平 Fi z l 均冲力
4.1.1 状态参量 4.1.3 统计假设
平衡态
4.1.2 理想气体模型 4.1.4 理想气体状态方程
4.1.5 理想气体的压强
4.1.6 理想气体的温度
4.1 理想气体的压强和温度
热运动 微观粒子 微观量 宏观量
4.1.1 状态参量
1.状态参量 2.平 衡 态
平衡态
描述系统状态的物理量.
4.1.4 理想气体状态方程
根据大量实验定律总结得到:
v-摩尔数
pV
M
RT vRT
M 气体质量 μ-摩尔质量 R-普适常数 R= 8.31 J mol1 K 1
4.1.5 理想气体的压强
设边长为 l 的正方形容器中有N 个分子每个 分子的质量为m ,第i 个分子的速度为vi , 其分 量为 vix viy viz y 2 2 2 2 vi vix viy viz
在压强不太大、温度不太低的情况下,实际气体可 近视看作理想气体.
4.1.3 统计假设
气体处于平衡状态时,在没有外力场的条件下, 分子向每一个方向运动的可能性是相同的,容器中任 一位置处单位体积内的分子数目相同. 结论 1.沿空间各方向运动的分子数目是相等的;
2.一个体积元中飞向前、后、左、右、上、下 的分子数 各为1/6; 3.分子速度在各个方向上的分量的各种平均 值相等,例如 1 2 2 2 2 v x v y vz 0 v x v y v z 3 v
p pV T nk Nk
2.67 105 10 3 23 193(K) 23 10 1.38 10
4.2 能均分定理 理想气体的热力学能 4.2.1 自由度
4.2.2 能量按自由度均分定理 4.2.3 理想气体的热力学能 4.2.4 例题分析
4.2.1 自由度
(1)一摩尔理想气体 的热力学能为 (2)质量为M,摩尔质量为
i i E0 kTN 0 RT 2 2
的理想气体的热力学能为
结 论
M i E RT 2
1.一定质量的某种理想气体的热力学能完全决定于 气体的热力学温度T,与气体的压强和温度无关.
2.一定质量的理想气体在不同的状态变化过程中, 只要温度的变化量相等,那么它的热力学能的变化量 也相同,而与过程无关.
热力学能和机械能的区别 1.物体的机械能的大小与参照系及势能 零点的选择有关,可以为零;
2.物体内部的分子永远处于运动中,其 热力学能永远不等于零.
4.2.4 例题分析
1. 一容器被中间的隔板分成相等的两半. 一半装有氦气,温度为250 K ;另一半装有氧 气,温度为310 K . 二者压强相等. 求去掉隔 板后两种气体混合后的温度. 解 混合前 He : p0V0 1 RT1 T2 1 O2 : p0V0 2 RT2 2 T1
N
N
2 ix
式中
v v i 1 N
2 x
N
2 ix
表示容器中N个分子在 x 轴 方向的速度分量平方的平均值 (简称方均值)
——统计平均量
Nm 2 vx A1面所受到的各分子的冲力之和 F l
由统计假设有
v2
2 2 vx v2 v y z
2 ix
v
i 1
N
2 i
N
2 x
能量按自由度均分定理 在温度为T 的平衡态下,气体分子每个 1 自由度的平均动能都等于 kT 2
4.2.3
理想气体的热力学能(气体内能)
1.定义
气体的热力学能是指它所包含的所有分子的 动能和分子间因相互作用而具有的势能的总和. 2.理想气体的热力学能
对于理想气体,由于分子间的相互作用力可 以忽略不计,所以,其热力学能就是它的所有分 子的动能之和. 设某种气体分子的自由度为 i ,则一个分子 i 的平均动能为 kT 2
理想气体的热力学温度T 与气体分子的平均平动动 能成正比。
k 1.38 10 23 J K 1
结 论 宏观量 T 是标 志分子热运动剧烈程度 的物理量,分子无规则 运动越剧烈,气体的温 度越高.
方均根v kT m
2
3 3 v kT RT m
系统内的各状态参量不随
时间变化的状态.
4.1.2 理想气体模型
1.理想气体 (宏观表述) 在任何情况下满足三大实验 ①玻意耳定理 ②盖· 吕萨克定律 定律的气体 ③查理定律 (理想气体状态方程).
2.理想气体必 须满足的三个条件(微观力学模型)
A) B) C) 可视为质点,遵从牛顿运动定律; 除碰撞外,分子之间以及分子与器壁之间都没有相 互作用; 分子间以及分子与器壁间的碰撞是完全弹性碰撞.
4.1.6 理想气体的温度
M p RT V
设每个分子的质量为 m , 气体分子的 总个数为N , No 为阿佛加德罗常数.
R 式中 k N0
——玻耳 兹曼常数
Nm N R p RT T nkT VN 0 m V N0
2 因为 p nkT p n 3 所以 3 kT T 2 2 3k
(3)设气体的热力学能为E M Mi pV RT E RT , 2 5 i E pV pV 2 2 5 5 2 8.31 10 1.20 10 2
4 2.49 10( J)
3. 储有氧气(处于标准状态)的容器以速 率v =100m· s-1 作定向运动, 当容器突然停止运动 时, 全部定向运动的动能都变为气体分子热运动 的动能, 此时气体的温度和压强为多少? 解 对于标准状态有: T0 273K , p0 1atm 1.013 10 5 Pa 1 M5 3 2 因为 Mv R(T T0 ), 32 10 kg 2 2 2 v 280.7 (K) 所以 T T0 5R 又因为 p0 nkT0 , p nkT
偶然性 规律性
1859年,麦克斯韦从理论上导出了气体分子 的速率分布规律,——麦克斯韦速率分布律.
2.研究方法
把速率分成若相等的区间,然后求出各区 间的分子数是多少,即在v — v+dv区间内的分 子数dN是多少,或者dN 占分子总数N的百分比 dN/N是多少.
在速率区间 dv 足够小的情况下
dN f (v )dv N
定义 确定一个物体在空间的位置需要引入的
独立坐标的数目叫该物体的自由度. 单原子分子 三个平动 x y z 双原子分子 三个平动 x y z
二个转动 三原子以上分子 三个平动
(因为 cos 2 cos 2 cos 2 1)
x y z 三个转动
说明
经典理论中,不考虑振动自由度.
2
在同一温度下,质量大的分子其方均根速率小.
例 求0℃时氢气分子和氧气分子的平均平动动 能和方均根速率. T 273.15 K H 2.02103 kg mol 解: o 32103 kg mol
2 2
氢气和氧气分子的平均平动动能相同
3 3 kT 1.38 10 23 273 .15 5.65 10 21 (J) 2 2
氢气的方均根速率为
2 vH 2
氧气的方均根速率
2 vO 2
3RT
3 8.31 273.15 2.02 103
3RT
3 8.31 273.15 32.00 103
1840(m s 1 )
461 (m s 1 )
例 贮于体积为 1 10 3 m 3容器中的某种气体,分 子总数 N 10 23 ,每个分子的质量为 5 1026 kg , 1 分子的方均根速率为400 m s.求气体的压强和 气体分子的总平动动能以及气体的温度. 解: 由公式
联立求解可得
3 5 T2 T2 2 284 (K) T2 3T2 5 2T1 2
2. 体积为V =1. 2010-2 m3 的容器中储有 氧气, 其压强 p =8. 31 105Pa, 温度T =300 K , 求:(1)单位体积中的分子数 ; (2)分子的 平均平动动能;(3)气体的热力学能. 解 (1)单位体积中的分子数为 5 8 . 31 10 p n kT 1.38 10 23 300 2.00 1026 (m3 ) (2)分子的平均平动动能为 3 3 kt kT 1.38 10 23 300 2 2 6.21 10 21 (J)
理想气体的压强公式
1 2 p nm v 3
式中 讨 论
或
2 1 2 2 p n( m v ) n 3 2 3
——平均平动动能
1 mv 2 2
1.在上面公式推导过程中忽略了气体分子的相互碰 撞,但由于分子间是完全弹性碰撞,结果仍相同. 2.上式是气体分子运动论的重要结论,虽不能用实 验来直接验证,但可以解释和推证许多实验事实.
v
i 1
N
N
v
i 1
N
2 iy
N
2 v iz i 1
N
N
2 2 vx v2 v y z
1 2 v v 3 1 F 1 Nm 2 2 2 nm v nm v p v x A1 面所受到 3 S l2 l x 的压强为 N ——分子数密度 n 3 l
所以
碰撞后的速度分量为
vix viy viz
分子动量的增量为
A2
A1 vi
m
x
mvix mvix 2mvix
z
2l 与A1面发生两次连续碰撞所需要的时间为 v ix v ix 单位时间内碰撞的次数为 2l 单位时间内第 i 个分 y 子作用于A1面的总冲 量为 2 A1 A2 vix mvix vi 2mvix 2l l x m 第 i 个分子作 2 mvix 用于A1面的平 Fi z l 均冲力
