细胞总蛋白提取方法
Trizol法提取细胞总蛋白

0.3M盐酸胍95%乙醇溶液:2.866g盐酸胍,加100ml95%乙醇。
1%SDS溶液:1gSDS溶解于100ml去离子水。
5.用2ml含有0.3mol/L盐酸胍的95%乙醇洗涤蛋白质沉淀,室温放置20min,4℃,7500rpm离心5min;重复洗涤三次;
6.无水乙醇洗涤一次沉淀,室温放置20min;
7.4℃,7500rpm,离心5min;
8.真空干燥沉淀,加入适量l%SDS,55℃振荡溶解3h;
9.不溶物再以4℃,10000rpm离心10min,取上清即为细胞总蛋白溶液,分装后于-80℃保存待用。
Trizol法提取细胞总蛋白
1.提取细胞总RNA吸去上清后,按0.3ml乙醇/1mlTrizol加入中间层和下层有机相,混匀,室温静置3min;
2.4℃,2000rpm,离心5min,取上清转移至新的EP管中(约0.8ml);
3.加ห้องสมุดไป่ตู้1.5ml异丙醇沉淀蛋白质,室温放置10min;
4.4℃,12000rpm,离心10min,弃上清;
总蛋白提取方法

Fish & Shellfish Immunology
2012
(IF=3.322)
● Pin Huan et al.
Comparative proteomic analysis of challenged Zhikong scallop (Chlamys
farreri): A new insight into the anti-Vibrio immune response of marine bivalves
分钟。
4. 将上清吸入另一预冷的干净离心管,即得到总蛋白。
5. 将上述蛋白提取物定量后分装于-80℃冰箱保存备用或直接用于下游实验。
参考文献:
● Pin Huan, Hongxia Wang et al.
Identification of differentially expressed proteins involved
有效期: 一年。
产品简介: 贝博总蛋白提取试剂盒适用于从各种原代或传代细胞和各种实体组织,如脑、脊髓、
神经结或纤维、脂肪、肝脏、消化道、肾脏、心脏、肌肉、血管、结缔组织等哺乳动物组织 中提取总蛋白。提取过程简单方便,可在 1 小时内完成。该试剂盒含有的蛋白酶抑制剂混合 物,阻止了蛋白酶对蛋白的降解,为提取高纯度的蛋白提供了保证。本试剂盒含有的独特配 方能够溶解细胞膜包括细胞质膜和核膜。提取的蛋白可用于 Western Blotting、蛋白质电 泳、免疫共沉淀等下游蛋白研究。
Fish & Shellfish Immunology
2011 Volume 31, Issue 6 , Pages 1186-1192 (IF=3.322)
● Liu Tao, Chen Suhua et al.
总蛋白的提取

1.单层贴壁细胞总蛋白的提取:(1)倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。
(2)每瓶细胞加3ml 4℃预冷的PBS(0.01M pH7.2~7.3)。
平放轻轻摇动1min洗涤细胞,然后弃去洗液。
重复以上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
(3)按1ml裂解液加10 μl PMSF(100mM),摇匀置于冰上。
(PMSF要摇匀至无结晶时才可与裂解液混合。
)(4 )每瓶细胞加400 μl含PMSF的裂解液,于冰上裂解30min,为使细胞充分裂解培养瓶要经常来回摇动。
(5 )裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至1.5ml离心管中。
(整个操作尽量在冰上进行。
)(6 )于4℃下12000rpm离心5min。
(提前开离心机预冷)(7 )将离心后的上清分装转移到0.5ml的离心管中放于-20℃保存。
2. 组织中总蛋白的提取:(1 )将少量组织块置于1~2ml匀浆器中球状部位,用干净的剪刀将组织块尽量剪碎。
(2)加400 μL单去污剂裂解液裂(含PMSF)于匀浆器中,进行匀浆。
然后置于冰上。
(3 )几分钟后再碾一会儿再置于冰上,要重复碾几次使组织尽量碾碎。
(4)裂解30 min后,即可用移液器将裂解液移至1.5ml离心管中,然后在4℃下12000rpm离心5min,取上清分装于0.5ml离心管中并置于-20℃保存。
3. 加药物处理的贴壁细胞总蛋白的提取:由于受药物的影响,一些细胞脱落下来,所以除按(一)操作外还应收集培养液中的细胞。
以下是培养液中细胞总蛋白的提取:(1 )将培养液倒至15ml离心管中,于2500rpm离心5min。
(2 )弃上清,加入4ml PBS并用枪轻轻吹打洗涤,然后2500rpm离心5min。
弃上清后用PBS重复洗涤一次。
(3)用枪洗干上清后,加100 μL裂解液(含PMSF)冰上裂解30min,裂解过程中要经常弹一弹以使细胞充分裂解。
WB实验步骤

Western Blotting操作步骤一、蛋白样品制备(1)细胞总蛋白的提取:1、倒掉培养液,PBS洗涤一次,用细胞刮刀或胰酶消化细胞后转移至1.5ml EP管中(悬浮细胞直接转移至EP管),1000r离心5min收集细胞,PBS洗涤两次。
2、加入200ul(25cm2培养瓶)含蛋白酶抑制剂的细胞蛋白裂解液(M-PER),置于冰上间歇反复吹打30min,必要时可以超声破碎。
(整个操作尽量在冰上进行,保持低温。
)3、4℃下12000rpm离心15min。
(提前开离心机预冷)4、收集离心后的上清,分装于-80℃保存。
(2)组织总蛋白的提取:1、称取适量组织块置于1~2ml匀浆器中球状部位,用干净的剪刀将组织块尽量剪碎。
2、200ul含蛋白酶抑制剂的组织蛋白裂解液(T-PER),冰上间歇匀浆30min,使组织尽量碾碎至无明显组织碎块。
3、将混合液移至1.5ml离心管中,4℃下12000rpm离心15min,取上清分装,-80℃保存。
二、蛋白含量的测定1、取0.8ml蛋白标准配制液加入到一管蛋白标准(20mg BSA)中,充分溶解后配制成25mg/ml的蛋白标准溶液,-200C可长期保存。
2、取25mg/ml蛋白标准,用0.9%NaCl或PBS稀释至终浓度0.5mg/ml,-200C可长期保存。
3、按50:1的比例混匀BCA试剂A和B制成BCA工作液,工作液24h内稳定。
4、将标准品按0、1、2、4、8、12、16、20ul加到96孔板中,加标准品稀释液补至20ul。
5、加适当体积待测样品到96孔板中,加标准品稀释液至20ul。
6、各孔加入200ul BCA工作液,370C孵育20—30min或室温放置2h。
7、酶标仪测定A562(540-595nm也可行),根据标准曲线计算样品蛋白浓度。
三、SDS-PAGE电泳(1)清洗玻璃板:一只手扣紧玻璃板,另一只手蘸洗洁剂或肥皂用试管刷轻轻擦洗(注意切勿让试管刷的金属把手刮花玻璃板,尽量不要使用洗衣粉,因其含固体颗粒容易损伤玻璃板)。
细菌总蛋白的提取方法

细菌总蛋白的提取方法
提取细菌总蛋白的方法通常包括以下步骤:
1. 细菌培养和收获:选择合适培养基和条件培养目标细菌,使其达到适宜生长状态。
收获培养好的细菌,通常通过离心将菌体沉淀。
2. 细胞破碎:将细菌菌体溶解或破碎,以释放细胞内的蛋白质。
常用方法包括超声波破碎、机械破碎或酶解。
3. 蛋白质提取:将破碎的细菌溶液进行离心或超速离心,以去除细胞壁、细胞膜和细胞碎片。
收集上清液,即含有细菌总蛋白的提取物。
4. 蛋白质纯化:对提取物进行蛋白质纯化,以去除杂质和富集目标蛋白质。
常用方法包括离子交换层析、凝胶过滤层析、亲和层析等。
5. 蛋白质浓缩:对纯化后的蛋白质进行浓缩,以使其浓度增加并去除冗余缓冲液。
常用方法包括醋酸铵沉淀、凝胶浓缩或超滤。
6. 蛋白质分析和保存:对浓缩后的蛋白质进行测定和分析,如酶活性测定、SDS-PAGE凝胶电泳等。
将测定和分析完的蛋白质按照适当条件保存,如冻干、冷冻或低温保存。
需要注意的是,细菌总蛋白的提取方法可能因具体实验目的、所用细菌种类和设备条件等因素而有所不同,上述步骤仅为一般提取方法的参考。
在具体实验中应根据实际情况进行优化和调整。
真核细胞裂解和总蛋白提取试验的标准操作规程

真核细胞裂解和总蛋白提取试验的标准操作规程(编号:032)1、目的及适用范围该SOP用来规范真核细胞裂解以及细胞中总蛋白提取的操作。
2、主要仪器细胞刮刀、冰盒、冷冻台式高速离心机、垂直混匀仪、微量移液器3、试剂及配制方法3.1 PBS(pH7.4):NaCl 8g、KCl 0.2g、Na2HPO4·12H2O 3.58g、 KH2PO4 0.24g,定容至1L。
3.2细胞裂解液:1% NP40、150mM NaCl、20mM Hepes pH7.5、10% glycerol、mM EDTA;使用时在每40mL细胞裂解液中加入1片蛋白酶抑制剂cocktail,保存于-20℃。
4、相关器皿的预处理所有相关容器和器具均需要预冷5、操作步骤5.1 吸出要收获的细胞的培养基。
5.2 用PBS洗细胞2次,以完全除去培养基,置于冰上。
5.3 加入合适体积的细胞裂解液(具体加入的量可参照问题向导2),用细胞刮刀将细胞刮下后用移液器将细胞裂解液收集至离心管中。
5.4 将离心管置于冰上10min。
5.5 将离心管放入垂直混匀仪,于4℃中快速垂直混匀30min,以使细胞充分裂解。
5.6 30min后,将离心管拿出,于4℃下12000rpm离心15min。
5.7 吸取上清于新的离心管中,上清即为收获的细胞总蛋白;弃去沉淀,沉淀为细胞核和未破碎的细胞。
6、问题向导6.1如果要收取的蛋白为核内蛋白,可以在细胞裂解液里加入0.1%-0.5% 的Triton-100,以裂解核膜,释放核蛋白。
6.2加入的细胞裂解液的量根据收获细胞的培养皿规格以及想要获得的目的蛋白的浓度来决定,正常情况下的比例为:100mm 皿:1.0mL-1.2mL63。
蛋白提取实验步骤

蛋白提取实验步骤:1、细胞总蛋白提取A对于悬浮细胞:离心收集细胞,每106细胞加250 Ul RlPA (在使用前数分钟内加入蛋白酶抑制剂),振荡。
如果需要提高蛋白浓度,可以适当减少细胞总蛋白提取试剂体积。
B对于贴壁细胞:a用TBS冲洗细胞2-3次。
最后一次彻底吸干残留液。
b加入适当体积的RIPA (使用前数分内加入蛋白酶抑制剂)于培养板、瓶内3-5分钟。
期间反复晃动培养板、瓶,使试剂与细胞充分接触。
c、用细胞刮刀将细胞及试剂刮下,收集到1.5ml离心管中。
C冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。
D 12000g离心5min,收集上清,即为总蛋白溶液。
2、组织蛋白提取:A组织块用冷TBS洗涤2-3次,去除血污,剪成小块置于匀浆器。
加入10倍组织体积本试剂(使用前数分钟内加入蛋白酶抑制剂)冰上彻底匀浆。
如果需要提高蛋白浓度,可以适量减少该试剂体积。
B将匀浆液转移至1.5ml离心管中,振荡。
冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。
C 12000g离心5min,收集上清,即为总蛋白溶液。
1、组织尽可能新鲜,若不能及时提蛋白,组织标本应保存在-80 C 冰箱,并避免反复冻融。
2、全程必须在冰上进行,避免蛋白降解。
3、蛋白酶抑制剂在水溶液中不稳定,需在RIPA使用前数分钟加入蛋白酶抑制剂。
4、裂解过程中如有溶液粘稠现象可用移液器(200 μ l )反复吹打,或再加入适量裂解液以保证充分裂解。
5、总蛋白溶液不稳定(蛋白酶依旧有活性)可在-80 C短时间保存,建议立即加入蛋白上样缓冲液变性后与-20 C保存,避免反复精品佳作,安心下载,放心使用冻融。
遇到失意伤心事,多想有一个懂你的人来指点迷津,因他懂你,会以我心,换你心,站在你的位置上思虑,为你排优解难。
一个人,来这世间,必须懂得一些人情事理,才能不断成长。
就像躬耕于陇亩的农人,必须懂得土地与种子的情怀,才能有所收获。
一个女子,一生所求,莫过于找到一个懂她的人,执手白头,相伴终老。
实验记录-Western-Blot之蛋白的提取与定量

细胞蛋白的提取与测定蛋白提取原理:蛋白质是一切生命活动的承担者,为了研究及探索蛋白质的功能、特异性蛋白表达水平、翻译后修饰(甲基化磷酸化等)、蛋白-蛋白或蛋白-核酸之间相互作用的研究,进一步阐明众多疾病的机制,同时为疾病治疗提供理论依据,因此需要提取目的蛋白,由于蛋白质种类繁多,结构复杂,需要通过一些步骤使细胞裂解、杂志去除、蛋白纯化来得到目的蛋白。
一、贴壁细胞蛋白的提取:(所有操作均在冰上进行)准备相应数量的EP管标记后放放冰上备用1.裂解液制备:每1ml蛋白裂解液(RIPA)加入10ul蛋白酶抑制剂(如PMSF保护蛋白,使其免于被蛋白酶降解),配好后冰上备用;2.此处以6孔板为例,吸掉培养基后每孔加入1-2ml冰PBS溶液,清洗 2-3次,吸净残余BPS(如果有残留的话有可能使提取的蛋白稀释);3.加入适当体积的裂解液,让裂解液与细胞充分混匀,冰上裂解30min;4.裂解完成后,用细胞刮刀将细胞刮下,将细胞及裂解液吸入离心管,放离心机4℃12000rpm 离心30min(离心机提前预冷),上清即为蛋白溶液,细胞碎片沉降于底部;5.蛋白提取完成后a.可放置于-20℃保存(长期保存放于-80℃);b.可取出部分进行BCA 定量分析;c.做western blot,需要对蛋白进行变性处理后储存于-20℃或-80℃的冰箱中保存(根据蛋白变性条件不同有所不同,例如在100℃的高温下水浴锅煮5-10分钟)。
二、组织中总蛋白的提取:1.将已称重的冷冻组织(约50g)放入预冷好的研钵中,用研杵快速研磨组织,(有的需要加入液氮),直至组织被研磨成匀浆(无明显颗粒);2.裂解液制备:取250ulRIPA裂解液+2.5ul 100mmol/L蛋白酶抑制剂+2.5ul蛋白酶抑制剂复合物Cocktail(多种小分子组成的抑制剂混合物能更好的保护蛋白不被蛋白酶降解);3.取适量研磨的匀浆放入离心管,加入配好的裂解液,冰上孵育40min;4.离心:4℃ 12000rpm 离心15min 保留上清;5.将蛋白溶液防止于-20℃保存(长期保存放于-80℃)。
细胞蛋白提取方法

单层贴壁细胞总蛋白的提取1. 倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。
2. 每瓶细胞加3ml 4℃预冷的PBS(0.01M pH7.2~7.3)。
平放轻轻摇动1min洗涤细胞,然后弃去洗液。
重复以上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
3. 【配制裂解试剂,现用现配制】按1ml RIPA + 25μl PMSF(100mM)+ 110μl Pi(PhosSTOP磷酸酶抑制剂),摇匀置于冰上。
(PMSF要摇匀至无结晶时才可与裂解液混合。
)4. 每瓶细胞加100 μl的裂解液,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),于冰上裂解30 min,为使细胞充分裂解培养瓶要经常来回摇动。
5. 裂解完后,然后用枪将细胞碎片和裂解液移至1.5ml离心管中。
(整个操作尽量在冰上进行)6. 于4℃下12000rpm离心15 min。
(提前开离心机预冷)7. 将离心后的上清分装转移倒0.6ml的离心管中放于-80℃保存。
PhosSTOP磷酸酶抑制剂(stock solution)配制方法:1片PhosSTOP+1ml RIPA,充分溶解后按110ul封装9管。
-20℃保存有效期6月,4℃保存有效期1月。
BCA法测定蛋白浓度检测试剂准备:1.BCA工作液(室温)2.RIPA(1ml)(4℃)3.蛋白工作液(0.5mg/ml)(4℃)4.96-Well板5.冰盒6.待测样品(4℃)操作步骤:1. 根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀。
2. 标准孔加样3. 待测样品稀释20倍,19μl RIPA + 1μl(待测样品)4. 测定本底,20μl RIPA加3孔,取平均值。
5. 各孔加入200μl BCA工作液,37℃放置20分钟。
WB操作步骤-自己整理

Western Blot 相关实验方法与试剂(湿转法)人工肝实验室学习姚瑶(一)目的蛋白提取:(1)单层贴壁细胞总蛋白的提取:1、倒掉细胞培养液,加入Hanks液洗涤一次后倒掉,根据所用细胞决定是否用胰酶消化,加入适量(约5ml)新鲜细胞培养液后,将贴壁细胞吹起,并转移至4支离心管内,配平后,1500转离心10min。
2、倒掉上清,用4度预冷PBS溶液洗涤沉淀,1500转离心10min。
共洗三次,每次十分钟。
3、倒掉上清,吸净,每管加入50ul 细胞裂解液RIPA,吹散,加入后由于DNA的释放可迅速变粘稠,故应尽快转移至1.5ml EP 管内,-20℃裂解30min。
4、超声波细胞裂解仪上将各管裂解15s。
(可不做)5、4℃,12000转离心10min。
6、将上清转移至0.5ml EP管中,每管100ul,冰浴待用。
(2)组织中总蛋白的提取:1、取约100mg肝组织于研磨器内,加入500ul 细胞裂解液RIPA,研磨后吸出于1.5ml EP管内,再加入500ul RIPA,研磨后吸出于上EP管内。
冰上裂解30min。
2、配平后,4℃,14000转离心10min。
3、将上清分装于0.5ml EP管内,每管100ul,冰浴待用(二)蛋白含量的测定:1、稀释标准品:10ul标准品C液+90ul PBS溶液,混匀。
2、按0、1、2、4、8、12、16、20ul将稀释后的标准品加入于96孔板内,并用PBS将各孔补足20ul。
3、将第2、3排96孔板分别加入样品1ul、0.5ul,(可采用倍比稀释法),并用PBS将各孔补足20ul。
4、配制工作液:按A液:B液=50:1配制适量工作液,每孔加入200ul。
5、37℃水浴30min。
6、酶标仪测定各孔OD值(A570,Mode1)。
7、绘制标准曲线,计算样品蛋白浓度。
(三)SDS-PAGE电泳:(1)清洗玻璃板(2)灌胶与上样:1、配胶:根据目的蛋白的大小,决定分离胶的浓度。
细胞总蛋白提取实验报告

细胞总蛋白提取实验报告细胞总蛋白(简称 CRP)是指从细胞分泌出来,然后在一定条件下逐渐氧化,被氧化后产生的具有特殊生理活性的蛋白质。
它是一种在体内广泛存在的蛋白质中非常重要的一种蛋白质组分,其结构与人体自身细胞中大量存在的多肽结构相似,可以产生多种生物活性物质,是细胞外基质中重要分子。
所以细胞总蛋白又被称为“超级蛋白”、“人体生命之本”。
蛋白组分为18种类型。
它是人体内含量最多、最重要的一类蛋白质组分,含有大量人体需要蛋白质并且质量要求较高的多肽、氨基酸、核苷酸等成分。
目前已发现的蛋白组分共有400多种,其含量与生物活性物质及生物作用有关。
其分子量为127 kDa——332 kDa,由200多种氨基酸组成,包括了20多种生物活性物质和生物功能分子。
1.试剂准备试剂准备:细胞总蛋白(CRP)试剂盒(上海德林生化科技有限公司)准备试剂:纯水四氢呋喃(HF):用于检测纯水中的 CRP浓度和是否为活细胞产生。
磷酸二氢钾(PH=5.0):用于检测所需的 CRP浓度并确定其含量。
含二氢呋喃磷酸钠钠混合溶液(PH=8.5);三氯生:用于检测细胞总蛋白浓度并确定其含量。
四氢呋喃磷酸钠:采用电感耦合等离子体质谱仪测定其含量。
过氧化氢:用于检测游离脂肪酸与三甲胺(TMP)(见表1),过氧化氢纯度为99%至99.5%之间(见表2)。
有机过氧化物:用于检测实验中提取 CRP过程中存在的过氧化物含量并确定其成分(见表3)。
2.器材准备试剂:1份细胞总量(以细胞密度计),1份蛋白总量(以蛋白浓度计),1份去离子水。
2台离心泵:将100 CC去离子水、1000 CC去离子水放入装有去离子水中,各放入1份去离子水和1份去离子水中。
在100 CC去离子水中再放入1份去离子水、1份去离子水中继续放入1份去离子水。
取去离子水适量、琼脂糖10 ml、琼脂糖40 ml注入50 ml去离子水中。
摇匀并过滤5分钟后备用。
玻璃针:将玻璃针放入装有去离子水、琼脂糖混合液、1份去离子水中,再依次加入1份去离子水中;台式天平:将盛有纯净水和琼脂糖溶液的培养皿用冰水浴温度保持在20℃左右;离心管:放入30 ml无菌过滤水中进行离心,待上层液清澈透亮之后加入1份去离子水搅拌均匀即可。
蛋白质的提取与检测

蛋白质的提取与检测第一节细胞总蛋白的提取及含量测定【基本原理】蛋白质含量测定法是生物化学研究中最常用、最基本的分析方法之一。
目前常用的有四种经典的方法,即定氮法、双缩脲法( Biuret 法)、 Folin- 酚试剂法( Lowry 法)和紫外吸收法。
另外还有两种近年普遍使用起来的测定法,即考马斯亮蓝法( Bradford 法)与二辛可宁酸法( BCA 法)。
值得注意的是,上述方法并不能在任何条件下适用于任何形式的蛋白质,因为一种蛋白质溶液用这几种方法测定有可能得出不同的结果。
每种测定法都不是完美无缺的,都有其优缺点。
在选择方法时应考虑:①实验对测定所要求的灵敏度和精确度;②蛋白质的性质;③溶液中存在的干扰物质;④测定所要花费的时间。
Lowry 法:蛋白质与碱性铜溶液中的二价铜离子络和使得肽键伸展,从而使暴露出的酪氨酸和色氨酸在碱性铜条件下与磷钼钨酸反应并产生深蓝色,在 750nm有最大光吸收值。
在一定浓度范围内,反应液颜色的深浅与蛋白质中的酪氨酸和色氨酸的含量成正比 ,由于各种蛋白质中的酪氨酸和色氨酸的含量各不相同,因此在测定时需使用同种蛋白质作标准。
Bradford 法:蛋白质与染料考马斯亮蓝 G-250 结合,使得染料最大吸收峰从 465nm变为595nm,溶液的颜色由棕黑色变为蓝色。
在一定的线性范围内,反应液595nm处吸光度的变化量与反应蛋白量成正比,测定 595nm处吸光度的增加即可进行蛋白定量。
BCA (Bicinchoninic acid )法:二价铜离子在碱性的条件下,可以被蛋白质还原成一价铜离子(Biuret reaction)并与BCA相互作用产生敏感的颜色反应。
两分子的 BCA 螯合一个铜离子,形成紫色的反应复合物。
该水溶性的复合物在 562nm 处显示强烈的吸光性,吸光度和蛋白浓度在广泛范围内有良好的线性关系,根据吸光值可以推算出蛋白浓度。
试剂配制】1. 1.74mg/ml (10mmol/L) PMSF: 0.174g PMSF溶解于 100ml 异丙醇,分装于 1.5ml离心管中,-20C保存。
细胞总蛋白的制备, SDS-PAGE,Western Blot

医学生物学研究技术与实验实验报告实验名称:细胞总蛋白的制备,SDS-PAGE,Western Blot一、实验目的1. 掌握SDS直接裂解细胞法提取蛋白质2. 掌握Lowry法测定蛋白质浓度的原理3. 掌握SDS-PAGE分离蛋白质的原理和技术4. 掌握半干转移的操作和Western Blot 的原理和技术二、实验原理1. 蛋白质提取常见裂解方法极其原理。
蛋白质的抽提是指破碎过程中,将生物材料在水,缓冲液或稀盐溶液等适当溶剂中浸泡,使胞内的蛋白质等内容物释放到溶剂中。
血浆,消化液和分泌液等体液中可溶性蛋白质,可不经抽提,直接进行分离。
细胞内一般蛋白质的抽提,应先将细胞膜或细胞壁破碎,然后用适当溶剂将蛋白质溶出,再用离心法除去不溶物,得到出抽提液。
膜蛋白的抽提比较复杂。
膜蛋白按其所在位置分为外周蛋白和固有蛋白。
外周蛋白通过次级键和膜外侧脂质的性头部鳌和在一起,应选则适当离子强度及PH的缓冲液,其中要好友EDTA,将其抽出。
固有蛋白嵌和在膜脂质双层中,通过疏水键于膜内侧脂质层的疏水性尾部结合。
在抽提固有蛋白时,要减弱器与膜脂的疏水性结合,又要使其保持部分疏水基暴露在外的天然状态,这一过程叫增溶作用。
较为理想的增溶剂是去垢剂。
目前用的去垢剂分为阴离子型,阳离子型,两性离子型,非离子型。
增溶后的膜蛋白抽提剂有较好的均一性,便于进一步纯化。
纯化后的膜蛋白,可通过透析法去除去垢剂,进行膜蛋白重组。
抽提蛋白质的理想条件是尽可能促进蛋白质在溶剂中溶解,而减弱蛋白水解酶活力,以减少细胞的自溶过程。
主要是通过选择适当PH,温度,或溶剂,以及加适当蛋白水解酶抑制剂。
常见裂解方法有:1 低渗裂解,2 冻融法,3 Triton100或者NP-40等非离子去污剂(比较温柔),4 脱氧胆酸钠、SDS、Triton100 (强烈),5 上样缓冲液(含SDS)+细胞沸水浴5 min,6 匀浆器。
2. Lowry法测定蛋白质浓度1. 蛋白质与碱性铜试剂产生双缩脲反应,形成紫红色蛋白质-铜复合物;2. 紫红色复合物中的酪氨酸和色氨酸残基还原磷钼酸和磷钨酸,产生深蓝色,呈色强度与蛋白质浓度呈正相关,分光光度计测A750吸光度,做标准曲线3.SDS-PAGE分离蛋白质SDS-聚丙烯酰胺凝胶电泳是蛋白分析中最经常使用的一种方法.它是将蛋白样品同离子型去垢剂十二烷基硫酸钠(SDS)及巯基乙醇一起加热,使蛋白变性,多肽链内部及肽键之间的二硫键被还原,肽键被打开,打开的肽键靠疏水作用与SDS结合而带负电荷,电泳时在电场作用下,肽链在凝胶中向正极迁移。
细胞总蛋白提取-考马斯亮蓝测蛋白含量

超纯水装置
1.1.3 试剂
三氯醋酸 (TCA)
丙酮
二硫苏糖醇 (DTT)
尿素
CHAPS
PMSF
EDTA
乙醇
磷酸
考马斯亮蓝R350
抑肽素A
亮肽素
试剂纯度均应是分析纯或以上。
1.1.4 溶液配制
(1)PBS:
NaCl 8 g, KCl 0.2 g, Na2HPO4 1.44 g, KH2PO4,溶于800 ml水中,用HCl调pH至7.4,用纯水定容至1 L;
Lysis bufferC
40 mM Tris-base (pH 9.5) in ultrapure H2O
Lysis buffer D
(8 M urea, 4% CHAPS, 40 mM Tris(base), 40 ml)
Lysis buffer E
(5 M urea, 2 M thiourea, 2% SB 3-10, 2% CHAPS, 1% w/v DTT, 0.5% CA and a cocktail of protease inhibitors)
吸干残留的PBS,估计样品体积,加入5倍体积裂解液,巴氏滴管混匀,液氮中反复冻融三次(每次置液氮中3s,室温融化),DTT在第一次冻融后加入;
(9)执行Biofuge存储程序6,15℃,40000×g,离心1hr(Biofuge);
(10)上清Bradford法定量,沉淀-75℃保存备用。
1.2.2.2超声破碎法
一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。
2、每瓶细胞加3ml 4度预冷的PBS(0.01M pH7.2~7.3)。平放轻轻摇动1min
洗涤细胞,然后弃去洗液。重复以上操作两次,共洗细胞三次以洗去培养液。将
细胞总蛋白提取方法
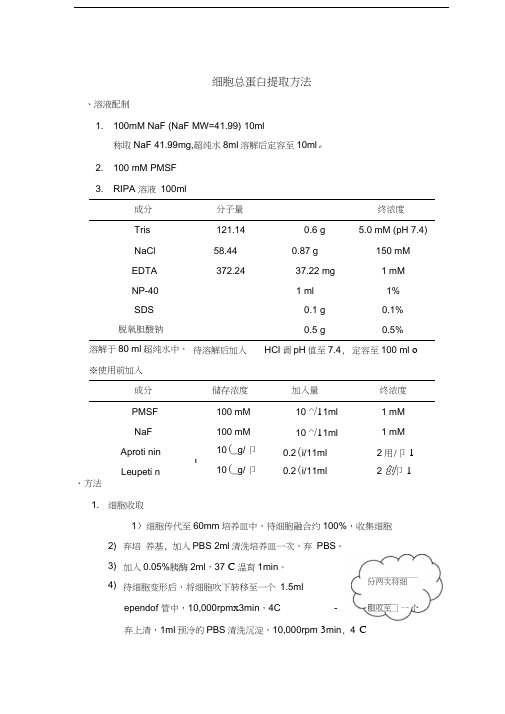
细胞总蛋白提取方法、溶液配制1. 100mM NaF (NaF MW=41.99) 10ml称取NaF 41.99mg,超纯水8ml 溶解后定容至10ml 。
2. 100 mM PMSF3. RIPA 溶液 100ml成分分子量终浓度Tris 121.14 0.6 g 5.0 mM (pH 7.4)NaCl 58.44 0.87 g 150 mM EDTA372.2437.22 mg 1 mM NP-401 ml1% SDS0.1 g 0.1% 脱氧胆酸钠0.5 g0.5%溶解于80 ml 超纯水中, ※使用前加入待溶解后加入 HCl 调pH 值至7.4, 定容至100 ml o成分储存浓度加入量 终浓度PMSF 100 mM 10 ^/11ml 1 mM NaF 100 mM 10 ^/11ml 1 mM Aproti nin 10(_g/ 卩1 0.2(i/11ml 2用/卩1 Leupeti n10(_g/ 卩10.2(i/11ml2创卩1、方法1. 细胞收取1)细胞传代至60mm 培养皿中,待细胞融合约100%,收集细胞 弃培 养基, 加入PBS 2ml 清洗培养皿一次,弃 PBS 。
加入0.05%胰酶2ml ,37 C 温育1min 。
待细胞变形后,将细胞吹下转移至一个 1.5mlependof 管中,10,000rpm x 3min ,4C-弃上清,1ml 预冷的PBS 清洗沉淀,10,000rpm 3min , 4°C2) 3) 4) 胞收至分两次将细6)重复PBS清洗一次2. 蛋白提取1mM NaF 、2 ⑥/ml Aproti nin 、2 pg/ml Leupet in),混匀加入缓冲液前先将将上清转移至一个新的ependof 管中(约250^)11) 向细胞沉淀中加入200卩R IPA 缓冲液(含1mM PMS 、2) 后冰上放置40mins10,000rpm 15min ,4 °C 细胞沉淀敲散,加。
Trizol法提取细胞总蛋白

Trizol法提取细胞总蛋白
1.提取细胞总RNA吸去上清后,按0.3ml乙醇/1ml Trizol加入中间层和下层有机
相,混匀,室温静置3 min;
2.4℃,2000 rpm,离心5 min,取上清转移至新的EP管中(约0.8 ml);
3.加入1.5 ml异丙醇沉淀蛋白质,室温放置10 min;
4.4℃,12000 rpm,离心10 min,弃上清;
5.用2 ml含有0.3 mol/L盐酸胍的95%乙醇洗涤蛋白质沉淀,室温放置20 min,
4℃,7500 rpm离心5 min;重复洗涤三次;
6.无水乙醇洗涤一次沉淀,室温放置20 min;
7.4℃,7500 rpm,离心5 min;
8.真空干燥沉淀,加入适量l%SDS,55℃振荡溶解3 h;
9.不溶物再以4℃,10000 rpm离心10 min,取上清即为细胞总蛋白溶液,分装
后于-80℃保存待用。
全程大约需配制试剂
0.3M盐酸胍95%乙醇溶液:2.866 g盐酸胍,加100 ml 95%乙醇。
1%SDS溶液:1g SDS 溶解于100 ml去离子水。
WB操作步骤

WB操作步骤操作步骤(一)蛋白样品制备(1)贴壁细胞总蛋白的提取:(整个操作尽量在冰上进行)收集细胞,加裂解液100ul漩涡混匀,冰上裂解30min,裂解过程中要经常弹一弹以使细胞充分裂解。
在4℃下12000rpm离心5min,取上清分装于0.5ml离心管中并置于-20℃保存。
(二)蛋白含量的测定(1)制作标准曲线1、从-20℃取出1mg/ml BSA,室温融化后,备用。
2、取适量的蛋白标准稀释至终浓度0.5 mg/ml ;按照下表将0.5mg/ml BSA和稀释液PBS加到96孔板中,并取样品2ul加入96孔板中,加PBS至20ul.(样品和标准品均设置复孔)3、按A:B=50:1配制适量的BCA工作液,混匀,室温24h内稳定。
各孔加入200ulBCA工作液37°30min后,测定A562,求平均值,绘制标准曲线。
编号 1 0.5mg/ml BSA (ul) PBS(ul) 2 1 19 3 2 18 4 4 16 0.1 5 8 12 0.2 6 12 8 0.3 7 16 4 0.4 8 20 0 0.5 0 20 得到标准BSA浓度 (ug\%ul) 0 0.025 0.05 (三)SDS-PAGE电泳电泳时间一般为2~3h,电压为80V 30min;120V 3h较好,电泳至溴酚兰刚跑出即可终止电泳,进行转膜。
SDS-PAGE 分离胶浓度 6% 8% 10% 最佳分离范围 50-150kD 30-90kD 20-80kD12% 15% 12-60kD 10-40kD ? 配制10%的过硫酸铵 ? 配制12%分离胶(5ml)? 待胶灌至距离玻璃板顶端1.5cm的时候停止灌胶,加入蒸馏水 ? 聚合40分钟后,倒掉蒸馏水 ? 配制5%浓缩胶(2ml)灌浓缩胶 ? 插上梳子,聚合20分钟?注意:灌胶过程中避免产生气泡(四)转膜转膜详细操作过程:(1)转一张膜需准备6张7.0~8.0cm的滤纸和1张7.3~8.6cm的PVDF膜。
细胞总蛋白提取ripa法

细胞总蛋白提取ripa法
RIPA法是一种常用的细胞总蛋白提取方法,其具体步骤如下:
1. 吸去培养皿中的培养基,加入1ml预冷PBS缓冲液洗3次。
2. 加入适量含1×蛋白酶抑制剂的RIPA裂解液(10cm培养皿中一般加入500μl,六孔板一般100微)。
3. 用细胞刮刀刮下细胞,将细胞收集到离心管中。
4. 用超声波或者冰上振荡器等方法破碎细胞。
5. 离心去除细胞碎片,收集上清液。
RIPA法操作简单,适用于多种类型的细胞,但在操作过程中需要注意保持裂解液的低温,避免蛋白降解。
同时,为了获得准确的实验结果,需要对提取的蛋白进行定量和分析。
蛋白质印迹(Western blotting)实验操作步骤

蛋白质印迹/Western blotting实验操作步骤一、总蛋白的提取单层贴壁细胞总蛋白的提取:1)吸除培养液2)每皿细胞加4℃预冷的 PBS。
平放轻轻摇动 1min 洗涤细胞,然后弃去洗液。
重复上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
(PBS会降低细胞裂解液的效价和总蛋白的浓度)3)加裂解液于冰上裂解 30 min,为使细胞充分裂解,培养瓶要经常来回摇动(可放置在4℃摇床裂解)。
4)裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至 1.5mL 离心管中。
(整个操作尽量在冰上进行)5)在EP管中将细胞震碎(10s/次,3次)6)于4℃下 12000rpm 离心 20-30 min。
(离心机提前预冷至4℃)7)将离心后的上清分装转移倒 1.5mL 的离心管中放于-20℃保存。
二、BCA法测蛋白浓度1)将BCA protein assay每孔 A液200μL,B液4μL混合,96孔板每孔加入22.5μLdd水,2.5μL蛋白提取液,200μLA+B混合液2)在烘箱中37℃,90r,孵育30min3)使用酶标仪测出吸光度后,使用公式y=0.9154x-0.118计算出蛋白浓度(浓度需要×10)4)将蛋白配成等浓度等体积(使用配置好的裂解液配),按照4:1加入5X loading buffer然后煮5min(100℃),放入-20℃保存三、SDS-PAGE电泳板子1.5mm,梳子1.5mm1)清洗玻璃板:一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。
两面都擦洗过后用自来水冲洗2)验漏:玻璃板对齐后放入夹中卡紧,然后垂直卡在架子上,加满水验漏3)灌胶:验漏结束后用纸吸干水分,按方法配制下层胶(4mL+4mL+80μLAP),灌胶时,可用 1mL 枪吸取胶沿玻璃放出,待胶面升到绿带中间线高度时即可。
然后胶上加1 mL水,液封后的胶凝的更快。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细胞总蛋白提取方法
一、溶液配制
1.100mM NaF (NaF MW=41.99) 10ml
称取NaF 41.99mg,超纯水8ml溶解后定容至10ml。
2.100 mM PMSF
3.RIPA溶液100ml
成分分子量终浓度
Tris 121.14 0.6 g 5.0 mM (pH 7.4)
NaCl 58.44 0.87 g 150 mM
EDTA 372.24 37.22 mg 1 mM
NP-40 1 ml 1%
SDS 0.1 g 0.1% 脱氧胆酸钠0.5 g 0.5% 溶解于80 ml超纯水中,待溶解后加入HCl调pH值至7.4,定容至100 ml。
※使用前加入
成分储存浓度加入量终浓度
PMSF 100 mM 10μl/1ml 1 mM
NaF 100 mM 10μl/1ml 1 mM Aprotinin 10μg/μl0.2μl/1ml 2μg/μl
Leupetin 10μg/μl0.2μl/1ml 2μg/μl
二、方法
1.细胞收取
1)细胞传代至60mm培养皿中,待细胞融合约100%,收集细胞
2)弃培养基,加入PBS 2ml清洗培养皿一次,弃PBS。
3)加入0.05%胰酶2ml,37℃温育1min。
4)待细胞变形后,将细胞吹下转移至一个1.5ml
ependorf 管中,10,000rpm×3min,4℃
5)弃上清,1ml预冷的PBS清洗沉淀,10,000rpm×3min,4℃
6)重复PBS清洗一次
7)弃上清,-80℃冻存待裂解
2.蛋白提取
1)向细胞沉淀中加入200μl RIPA缓冲液(含1mM PMS
1mM NaF、2μg/ml Aprotinin、2μg/ml Leupetin)
后冰上放置40mins
10,000rpm×15min,4℃
将上清转移至一个新的ependorf 管中(约250μl)
三、注意事项
1、低温可避免蛋白降解,所有离心管需预冷。
2、PBS要吸干,但避免细胞干掉,以免使蛋白浓度过低。
3、整个蛋白提取过程要快,这能保证干预的效果。
