α螺旋、β折叠和转角
蛋白质结构预测
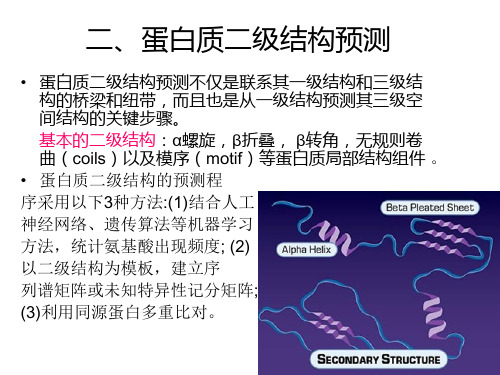
序列基序识别 二硫键识别 折叠子识别 残基接触预测 结构域预测
结构表面识别
预测蛋白质表面结构功能关键区域
5
PredictProtein Secondary Structure
PredictProtein Secondary Structure
H:螺旋 E:折叠 L:环 e:暴露表面﹥16%残基 b:其它残基
3
PredictProtein提交界面
序列提交窗口
分析方法程序详解
PROFsec(默认) PROFacc(默认) 序列预测
基于轮廓(profile)的神经网络算法预测蛋 白质二级结构 基于轮廓(profile)的神经网络算法预测残 基溶剂可及性
PHDhtm(默认)
ASP(默认) COILS(默认) PROFtmb ProSite(默认) SEG(默认) PredictNLS(默认) DISULFIND(默认) AGAPE PROFcon ProDom(默认) CHOP ConSeq
22
SWISS-MODEL
• SWISS-MODEL是一个蛋白质3D结构数据库,库中收录的蛋白质结
构都是使用SWISS-MODEL同源建模方法得来的。
– /
• 基于同源建模法与PDB数据库已知结构的蛋白质序列比对 进行预测
23
SWISS-MODEL
蛋白质三维结构预测
方法 特点 工具
同源建模法 基于序列同源比对,对于序列相似度>30% SWISS-MODEL, CPHmodels ( Homology/Comparativ 的序列模拟比较有效,最常用的方法 e modelling ) 线串法/折叠识别法 (Threading/Fold recognition) 从头预测法 ( Ab initio/De novo methods ) “串”入已知的各种蛋白质折叠骨架内,适 于对蛋白质核心结构进行预测,计算量大 基于分子动力学,寻找能量最低的构象, 计算量大,只能做小分子预测
了解点冷知识,蛋白质二级结构预测

了解点冷知识,蛋白质二级结构预测上一次小师弟给大家介绍了从蛋白质一级结构预测相关信息的网站——也即ExPASy ProParam的使用,今天我再给大家介绍一下蛋白质二级结构的预测。
在介绍具体的网站和软件使用之前,我想先介绍一下蛋白质二级结构预测的基础知识。
蛋白质二级结构有如下几种模式:α螺旋(当然,也存在其他形式的螺旋),β折叠,转角(turn),以及无规则卷曲(random coil)。
其中,无规则卷曲并不是一类真正的二级结构,只是作为一种分类,用来表示此类结构没有规则的二级结构。
需要说明的是,无规则卷曲也不是完全随机(random)折叠,其氨基酸分布以及折叠还是有一定规律的,只不过他们的结构非常灵活易变(flexible)。
甚至有研究表明,某些无规则卷曲是有明确而稳定的结构的。
关于二级结构的分类,更详细的可以参考DSSP(Dictionary of Protein Secondary Structure)分类系统,一共将蛋白质二级结构分为8类,其分类依据是二级结构中的氢键结合模式。
Loop,作为另一个在蛋白质二级结构层面的概念,并不是单指上述某一个类型的二级结构,而是一类多样化的二级结构,可以包括转角、无规则卷曲(long loops也被称作无规则卷曲)以及其它连接二级结构的氨基酸链。
Loops多数位于蛋白质分子表面,含有较多亲水氨基酸,具有灵活的构象,可以作为蛋白质的结合位点(比如抗体的抗原结合位点就由6个loop组成)以及酶的催化位点。
二级结构图片在蛋白质二级结构和三节结构之间,还存在两个概念,超二级结构和结构域。
超二级结构在很多教科书中也称作mofit(structural motif: 结构模体/结构基序,或者folding motif:折叠花式)。
超二级结构是指相邻二级结构在三维折叠中相互靠近所形成的组合,分为简单超二级结构和复杂超二级结构。
简单超二级结构一般只包含3个及3个以下的二级结构,我们熟悉的αα,ββ,以及βαβ结构模体就属于简单超二级结构,锌指结构(αββ)也是一种简单的超二级结构。
蛋白质一级结构二级结构三级结构四级结构解释

蛋白质一级结构二级结构三级结构四级结构解释【摘要】蛋白质是生物体内重要的大分子,负责许多生物学功能。
蛋白质的结构可分为四个级别:一级结构指的是氨基酸的简单线性排列,二级结构是氨基酸的局部区域形成α螺旋或β折叠,三级结构是整个蛋白质分子的空间构象,四级结构是多个蛋白质分子相互组装在一起形成的复合物。
蛋白质的结构决定了其功能,例如酶的特异性和亲和力。
蛋白质的结构与功能高度相关,对于研究蛋白质功能和疾病治疗有着重要意义。
蛋白质的结构从简单到复杂,具有多种不同层次的组织关系,这些不同级别的结构相互作用,共同决定了蛋白质的生物学功能。
【关键词】蛋白质,一级结构,二级结构,三级结构,四级结构,解释,总结1. 引言1.1 蛋白质概述蛋白质是生物体内功能性非常重要的大分子,它们参与了生物体内的几乎所有生物过程。
蛋白质是由氨基酸分子通过肽键连接而成的多肽链,具有多种结构和功能。
蛋白质的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
一级结构是指蛋白质的氨基酸序列,即多肽链的线性排列方式。
二级结构是指多肽链中氨基酸的局部空间构象,包括α-螺旋和β-折叠等。
三级结构是指整个多肽链的立体空间结构,由各个二级结构元素的折叠方式决定。
四级结构则是由多个多肽链之间的相互排列和交互作用所形成的整体结构。
通过这四个层次的结构,蛋白质可以实现其特定的生物功能,如催化化学反应、传递信号等。
蛋白质的结构和功能密切相关,任何一个层次的结构改变都可能影响到其功能。
对蛋白质结构的深入理解对于揭示其功能机制具有重要意义。
2. 正文2.1 蛋白质一级结构蛋白质的一级结构指的是它的氨基酸序列。
氨基酸是组成蛋白质的基本单位,共有20种不同的氨基酸,它们通过肽键连接在一起形成多肽链。
蛋白质的氨基酸序列是由基因决定的,不同的基因编码不同的氨基酸序列,从而确定了蛋白质的结构和功能。
在蛋白质的一级结构中,氨基酸序列的特定顺序决定了蛋白质的二级结构。
第三章 蛋白质-B(2013)

-折叠或β -转角)组合在一起,形成有规则的、在空间
上能辩认的二级结构组合体称为蛋白质的超二级结构 基本组合方式:α α ;β ×β ;β β β
超二级结构类型
αα
β ×β
β αβ
β -迂回
βββ
回形拓扑结构
(四)蛋白质的结构域
结构域 domain,motif(模块) 在二级结构及超二级结构的基础上,多肽 链进一步卷曲折叠,组装成几个相对独立的、 近似球形的三维实体。
Steps in protein identification by mass spectrometry
In-gel digestion With trypsin
MS analysis of Peptide fingerprinting
Database Search
m/z Acquired MS spectrum
第三节 蛋白质的结构
蛋白质分子的构象与结构层次
蛋白质都有自己特有的天然空间结构,称为构象。 一级结构: 氨基酸顺序 二级结构: α螺旋、β折叠、β转角,无规卷曲 三级结构: α螺旋、β折叠、β转角、松散肽段 四级结构: 多亚基聚集
一级结构
primary structure
蛋 白 质 结 构 的 主 要 层 次
MALDI-TOF analysis
Protein Peptides 678.8 679.3
Selected Parent Ion
MS/MS
Specific protein identified
Database Search
(三)多肽与蛋白质的人工合成
氨基保护:叔丁氧甲酰氯(BOC-Cl)、苄氧酰氯(CBZ-Cl)、 对甲苯磺酰氯Tosyl-Cl)。 羧基保护:苄酯、叔丁酯(成盐、成酯) 羧基活化:酰氯法(PCL5)、叠氮法、混合酸酐法、
蛋白质的结构层次

折叠,转角,无规卷曲等)构成的总三维结 构。包括一级结构中相距远的肽段之间的几何 关系和侧链在三维空间中彼此间的相互关系。 • 简言之,是指蛋白质多肽链所有原子在空间上 的排列。
线照射、高压和表面张力等或化学因素如有机
( 溶剂、脲、胍、酸碱等的影响,生物活性丧失,
一 溶解度降低,以及其它物理化学性质发生改变,
) 蛋
这种过程称为蛋白质的变性(denaturation)。
白 • 变性后高级结构破坏,一级结构不变
质
的 变
性
蛋白质的变性
热、紫外线照射、高 压和表面张力、有机溶 剂、脲、胍、酸碱
蛋白质结构层次
蛋白质结构的层次
一级结构: 氨基酸序列 二级结构:α螺旋,β折叠等
超二级结构 结构域(domain) 三级结构:所有原子空间位置 四级结构:多亚基蛋白
六、超二级结构和结构域
(一)超二级结构 由若干相邻的二级结构元件组合在一起,彼此相 互作用,形成的有规则的二级结构组合。
1、 αα :由两股平行或反平行的右手螺旋段相互 缠绕而成的左手卷曲螺旋或称超螺旋。 2、βαβ:由两段平行-折叠股和一段作为连接的 螺旋组成。 3、ββ:由若干反平行折叠片组合而成。
• 2、膜内在蛋白:有的一大部分埋入膜的 脂双分子层,有的横跨脂双层。跨膜部 分主要由-螺旋或-折叠构成。
膜周边蛋白和膜内在蛋白(跨膜蛋白)
-螺旋
N-连接
O-连接四糖: 2Neu5Ac, Gal,GalNAc
糖红 蛋细 白胞 的上 跨血 膜型
九、蛋白质折叠和结构预测
氨基酸之间的连接方式

氨基酸之间的连接方式一、引言氨基酸是构成蛋白质的基本组成单元,它们通过特定的连接方式形成了多肽链。
多肽链的连接方式决定了蛋白质的结构和功能。
本文将深入探讨氨基酸之间的连接方式,包括肽键的形成、多肽链的方向性以及二级、三级结构的形成等内容。
二、肽键的形成肽键是氨基酸之间的共价键连接,通过一个缩水反应(脱水反应)形成。
具体步骤如下:1.两个氨基酸的羧基(-COOH)与氨基(-NH2)发生酯化反应,生成酯键。
2.在酯键的作用下,羧基上的氧原子与氨基上的氢原子发生结合,生成肽键。
3.肽键形成后,羧基和氨基中的一个氧原子和一个氢原子组成水分子被释放。
三、多肽链的方向性多肽链具有肽键的方向性,即一个氨基酸的氨基与下一个氨基酸的羧基之间形成肽键。
这种方向性决定了多肽链的N端和C端。
具体规律如下:1.多肽链的N端是氨基(-NH2)自由基,C端是羧基(-COOH)自由基。
2.多肽链的生长方向是N端到C端的方向,也就是从左到右的方向。
四、二级结构:α螺旋和β折叠多肽链通过肽键的连接方式形成了二级结构,主要包括α螺旋和β折叠。
1. α螺旋α螺旋是多肽链以螺旋形式紧密排列的结构。
其特点如下:•α螺旋由多个氨基酸残基组成,每个氨基酸间相隔3.6个残基。
•每个氨基酸残基占据一个螺旋周期,螺旋周期中的每个氨基酸的侧链朝向螺旋轴的外侧。
•α螺旋的稳定性来自于氢键的形成,每个氨基酸残基的羧基氢原子与下一个氨基酸残基的氨基氧原子之间形成氢键。
2. β折叠β折叠是多肽链以平行或反平行的方式相互堆叠形成的结构。
其特点如下:•β折叠与螺旋不同,多个氨基酸残基之间没有明显的周期性。
•β折叠的稳定性同样来自于氢键的形成,相邻氨基酸残基的羧基氮原子和氨基氧原子之间形成氢键。
•β折叠通常由四个或更多的氨基酸残基组成。
五、三级结构:蛋白质的立体结构蛋白质的三级结构是由二级结构进一步折叠而成,决定了蛋白质的空间构型和功能。
1. α螺旋的三级结构α螺旋在三级结构中通常与其他二级结构相结合,例如与β折叠形成β-α-β结构。
蛋白质的二级结构

这种由蛋白质分子发生变异所导致的疾病, 称为“分子病”。
一个残基的改变为什么会 带来如此大的变化呢?
镰刀状细胞贫血病是血红蛋白分子突变引起的
血红蛋白单个(2个)氨基酸的改变影响功能:
Hb Sβ链第六位谷氨酸突变为缬氨酸。
谷氨酸:亲水、带负电荷;缬氨酸:疏水、不带电
Hb S分子表面 多了一个疏水侧链 Hb S分子三维 结构发生改变
(四)、蛋白质的变性作用
1、蛋白质变性的概念:天然蛋白质受物理或化学因素 的影响后,使其失去原有的生物活性,并伴随着物理化 学性质的改变,但并未导致其一级结构的变化,这种作 用称为蛋白质的变性。 2、使蛋白质变性的因素 (1)物理因素:高温、高压、射线等 (2)化学因素:强酸、强碱、重金属盐等
3、变性的本质: 分子中各种次级键断裂,使其空间构象从紧密有 序的状态变成松散无序的状态,一级结构不破坏。 4、蛋白质变性后的表现: (1)生物学活性消失 (2)理化性质改变:溶解度下降,粘度增加,紫 外吸收增加,侧链反应增强,对酶的作用敏感, 易被水解。
蛋白质的二级结构
肽键
肽键由于共振而具有部分双键性质,因此, 1) 肽键比一般C-N键短,且不能自由旋转 2) 肽键原子及相邻的a碳原子组成肽平面 3) 相邻的a碳原子呈反式构型
拉氏图
印度学者Ramachandran 等人根 据原子的范德华半径确定了非键合 原子间的最小接触距离。根据最小 接触距离,确定哪些成对二面角所 规定的两个相邻肽单位的构象是允 许的,哪些是不允许的,并在图上 标出,此图称为拉氏图。
(一)蛋白质的两性电离
蛋白质分子除两端的氨基和羧基可解离外,
氨基酸残基侧链中某些基团,在一定的溶液pH条
件下都可解离成带负电荷或正电荷的基团。
动物生物化学名词解释

动生化名词解释1.氨基酸的等电点:当溶液在某一特定的pH 值时,氨基酸以两性离子的形式存在,正电荷数与负电荷数相等,净电荷为零,在直流电场中既不向正极移动也不向负极移动,这时溶液的pH 值称为该氨基酸的等电点,用pI 表示。
2.肽键:是指键,是一个氨基酸的α–COOH 基和另一个氨基酸的α–NH2基所形成的酰胺键。
3.多肽链:由许多氨基酸残基通过肽键彼此连接而成的链状多肽,称为多肽链。
4.肽平面:肽链主链的肽键具有双键的性质,因而不能自由旋转,使连接在肽键上的六个原子共处于一个平面上,此平面称为肽平面。
5.蛋白质的一级结构:多肽链上各种氨基酸残基的排列顺序,即氨基酸序列。
6.肽单位:多肽链上的重复结构,如C α–CO–NH–C α称为肽单位,每一个肽单位实际上就是一个肽平面。
7.多肽:含有三个以上的氨基酸的肽统称为多肽。
8.氨基酸残基:多肽链上的每个氨基酸,由于形成肽键而失去了一分子水,成为不完整的分子形式,这种不完整的氨基酸被称为氨基酸残基。
9.蛋白质二级结构:多肽链主链骨架中,某些肽段可以借助氢键形成有规律的构象,如α–螺旋、β–折叠和β–转角;另一些肽段则形成不规则的构象,如无规卷曲。
这些多肽链主链骨架中局部的构象,就是二级结构。
10.超二级结构:在球状蛋白质分子的一级结构顺序上,相邻的二级结构常常在三维折叠中相互靠近,彼此作用,从而形成有规则的二级结构的聚合体,就是超 二级结构。
11.结构域:在较大的蛋白质分子里,多肽链的三维折叠常常形成两个或多个松散连接的近似球状的三维实体,即是结构域。
它是球蛋白分子三级结构的折叠单位。
12.蛋白质三级结构:指一条多肽链在二级结构(超二级结构及结构域)的基础上,进一步的盘绕、折叠,从而产生特定的空间结构。
或者说三级结构是指多肽链中所有原子的空间排布。
维系三级结构的力有疏水作用力、氢键、范德华力、盐键(静电引力)。
另外二硫键在某些蛋白质中也起着非常重要的作用。
(完整版)蛋白质结构与功能的关系

蛋白质结构与功能的关系蛋白质的结构包括一级结构、二级结构、三级结构、四级结构。
一级结构是蛋白质的一级结构指在蛋白质分子从N-端至C-端的氨基酸排列顺序。
一级结构是蛋白质空间构象和特异生物学功能的基础,但不是决定蛋白质空间构象的唯一因素。
蛋白质的二级结构是指多肽链的主链骨架本身在空间上有规律的折叠和盘绕,它是由氨基酸残基非侧链基团之间的氢键决定的。
常见的二级结构有α螺旋、三股螺旋、β折叠、β转角、β凸起和无规卷曲。
α螺旋中肽链骨架围绕一个轴以螺旋的方式伸展,它可能是极性的、疏水的或两亲的。
β折叠是肽链的一种相当伸展的结构,有平行和反平行两种。
如果β股交替出现极性残基和非极性残基,那么就可以形成两亲的β折叠。
β转角指伸展的肽链形成180°的U形回折结构而改变了肽链的方向。
β凸起是由于β折叠股中额外插入一个氨基酸残基而形成的,它也能改变多肽链的走向。
无规卷曲是在蛋白质分子中的一些极不规则的二级结构的总称。
无规卷曲无固定走向,有时以环的形式存在,但不是任意变动的。
从结构的稳定性上看,右手α螺旋>β折叠> U型回折>无规卷曲,但在功能上,酶与蛋白质的活性中心通常由无规卷曲充当,α右手螺旋和β折叠一般只起支持作用。
蛋白质的三级结构是指多肽链在二级结构的基础上,进一步盘绕、卷曲和折叠,形成主要通过氨基酸侧链以次级键以及二硫键维系的完整的三维结构。
三级结构通常由模体和结构域组成。
稳定三级结构的化学键包括氢键、疏水键、离子键、范德华力、金属配位键和二硫键。
模体可用在一级结构上,特指具有特殊生化功能的序列模体,也可被用于功能模体或结构模体,相当于超二级结构。
结构模体是结构域的组分,基本形式有αα、βαβ和βββ等。
常见的模体包括:左手超螺旋、右手超螺旋、卷曲螺旋、螺旋束、α螺旋-环-α螺旋、Rossmann卷曲和希腊钥匙模体。
结构域是在一个蛋白质分子内的相对独立的球状结构和/或功能模块,由若干个结构模体组成的相对独立的球形结构单位,它们通常是独自折叠形成的,与蛋白质的功能直接相关。
蛋白质二级结构的基本类型

蛋白质二级结构的基本类型蛋白质二级结构的主要形式包括α-螺旋、β-折叠、β-转角、Ω环和无规卷曲。
蛋白质二级结构是指多肽主链骨架原子沿一定的轴盘旋或折叠而形成的特定的构象,即肽链主链骨架原子的空间位置排布,不涉及氨基酸残基侧链。
知识拓展:α-螺旋结构的特点是:①肽链主链像螺旋状盘曲,每隔3.6个氨基酸残基沿中心轴螺旋上升一圈,螺距为0.54nm,即每个氨基酸残基沿中心轴旋转100°,沿轴上升0.15nm,螺旋的直径约为0.5nm。
②α-螺旋中氨基酸残基的侧链伸向外侧。
相邻的螺圈之间形成链内氢键,氢键的取向几乎与中心轴平行。
从N-末端出发,氢键是由每个氨基酸残基的C==O与前面第4个氨基酸的N—H之间形成的。
α-螺旋的稳定靠氢键维持。
α-螺旋有左手螺旋和右手螺旋两种,但天然蛋白质的α-螺旋,绝大多数都是右手螺旋,右手螺旋比左手螺旋稳定。
β-折叠结构的特点是:①肽链按层排列,主链呈锯齿状。
相邻肽链主链上的N—H和C==O之间形成氢键,β-折叠靠氢键维持其结构的稳定性。
②相邻肽链走向可以平行,也可以反平行。
肽链的N端在同侧为平行式,在不同侧为反平行式,从能量角度考虑,反平行式更为稳定。
③肽链中氨基酸残基的R侧链交替分布在片层的上下。
④反平行折叠结构中重复周期(肽链同侧两个相邻的同一基团之间的距离)为0.7nm,而平行式的重复周期为0.65nm。
⑤在纤维状蛋白质中,β-折叠可以在不同肽链之间形成,而球状蛋白质中的β-折叠既可以在不同肽链之间形成,也可以在同一肽链的不同肽段之间形成。
β-转角:是在球状蛋白质中存在的一种二级结构。
β-转角是由多肽链上4个连续的氨基酸残基组成,主链骨架以180°回折,其中第一个氨基酸残基的C==O与第四个氨基酸残基的N—H之间形成氢键,是一种不很稳定的环形结构。
由于β-转角结构,可使多肽链走向发生改变,目前发现的β-转角多数都处在球状蛋白质分子的表面,在这里改变多肽链的方向阻力比较小。
分子生物学第三讲
Bidirectional replication (双向复制) of a circular bacterial replicon
orign daughter DNA
terminal A single termination site is roughly 180o opposite the unique origin
RNA is unstable at higher pH
(DNase) 底物 (RNase) 作用方式 核酸内切酶 核酸外切酶
End of review
双脱氧链终止法
3’-TAGCACGATACTGTC-5’ 5’-ATCGTGCTATGACAG-3’
DNA复制 DNA Replication
子代
新合成 的链
子代
半保留复制
15N
labeled DNA
15N
labeling experiment
DNA半保留复制的生物学意义:
DNA的半保留复制表明DNA在代谢上的稳定性, 保证亲代的遗传信息稳定地传递给后代。
Replicon 复制子
Replicon is any piece of DNA which replicates as a single unit. It contains an origin and sometimes a terminus. 能进行复制的DNA 单位,从起始位点到终止位点的全部DNA. Origin(复制起始位点) is the DNA sequence where a replicon initiates its replication. A-T rich.
教学要求:
1. 理解DNA复制的半保留机制和半不连续复制
2. 掌握细菌DNA复制过程及有重要作用的酶和
α螺旋β折叠和转角

Swissprot已经有>140000条蛋白质序列 PDB中已知结构的只有其中的约10%
为什么要研究蛋白质结构?
对于未知功能或新发现的蛋白质分子, 通过结构分析,可以进行功能注释,指 导设计进行功能确认的生物学实验
分析蛋白质结构有助于药物设计研究
有助于了解蛋白质相互作用,这对于生 物学、医学和药学都是非常重要
通过实验方法得到蛋白质结构花费高且 耗时长
蛋白质生物学基础
蛋白质
一个蛋白质分子是由有序的氨基酸链折叠 而成的(从30到30000个残基不等)
氨基酸
20种不同的氨基酸
•Alanine, Ala, A •Valine, Val, V •Phenylalanine, Phe, F •Proline, Pro, P •Methionine, Met, M •Isoleucine, Ile, I •Leucine, Leu, L •Aspartic acid, Asp, D •Glutamic acid, Glu, E •Lysine, Lys, K •Arginine, Arg, R
力的数据库搜索工具的加入 准确率>70%
二级结构预测常用方法
Chou-Fasman方法 GOR 方法 基于氨基酸疏水性的预测方法 人工神经网络方法 最邻近方法
Chou-Fasman方法
基于单个氨基酸残基统计的经验参数方法,由 Chou和Fasman在1974 & 1978提出
通常为蛋白质空间结构预测的第一步
二级结构预测方法的第一代方法
第一代方法:
基于单个氨基酸残基统计分析,从有限的数 据集中提取各种残基形成特定二级结构的倾 向,以此作为二级结构预测的依据
《2024年蛋白质的β-发夹、β(γ)-转角及四类简单超二级结构预测》范文

《蛋白质的β-发夹、β(γ)-转角及四类简单超二级结构预测》篇一一、引言蛋白质作为生命活动中不可或缺的生物大分子,其三维结构的构建和解析一直是生物学与化学领域的重点研究方向。
其中,蛋白质的二级结构预测,特别是β-发夹、β(γ)-转角以及四类简单超二级结构的预测,对于理解蛋白质的功能和结构具有重要意义。
本文将详细探讨这些二级结构的预测方法及其实践应用。
二、β-发夹结构预测β-发夹是蛋白质中常见的二级结构之一,由一系列平行的β-折叠组成,通过一个或多个氢键连接形成发夹状的结构。
预测β-发夹结构主要依赖于生物信息学方法和计算机算法。
首先,通过同源建模或从头计算等方法获取蛋白质的三维结构模型;然后,利用相关软件对模型进行二级结构预测,识别出β-发夹区域。
此外,还可以结合实验数据如核磁共振(NMR)谱图、X射线晶体衍射等数据进行验证和修正。
三、β(γ)-转角结构预测β(γ)-转角是蛋白质中连接两个或多个二级结构单元的短而无规则区域,其结构较为复杂且多变。
预测β(γ)-转角结构主要依赖于序列分析和结构比对等方法。
首先,通过分析蛋白质序列中的氨基酸组成和排列规律,识别出潜在的转角区域;然后,结合已知的蛋白质结构数据库,进行结构比对和预测。
此外,还可以利用机器学习等方法对转角结构进行分类和预测。
四、四类简单超二级结构预测四类简单超二级结构主要包括α螺旋、β转角、β折叠和无规则卷曲等。
这些超二级结构是蛋白质中更为复杂的二级结构的组合形式。
预测这些超二级结构主要依赖于序列分析和能量计算等方法。
首先,通过分析蛋白质序列中的氨基酸组成和排列规律,确定可能的超二级结构类型;然后,利用能量计算等方法评估各种超二级结构的稳定性,从而确定最终的超二级结构类型。
五、实践应用蛋白质的β-发夹、β(γ)-转角及四类简单超二级结构的预测在生物医学领域具有广泛的应用价值。
首先,这些预测结果有助于理解蛋白质的功能和作用机制,为药物设计和疾病治疗提供理论依据。
蛋白质常见的二级结构-概述说明以及解释

蛋白质常见的二级结构-概述说明以及解释1.引言1.1 概述蛋白质是生物体内最重要的有机大分子之一,它们是构成细胞的基本组成部分,并在体内执行各种重要的生物学功能。
为了实现这些功能,蛋白质需要具备特定的空间结构。
蛋白质的结构可以分为四个级别,即一级、二级、三级和四级结构。
其中,二级结构是指蛋白质链上局部区域内氢键的形成导致的局部结构,常见的二级结构包括α-螺旋、β-折叠和β-转角。
α-螺旋是最常见的蛋白质二级结构之一。
在α-螺旋中,多肽链以螺旋形式延伸,其中每个氨基酸残基占据螺旋的一个角度位置。
螺旋的形成主要依赖于氢键的作用,其中螺旋中的氢键使得多肽链呈螺旋形状稳定存在。
α-螺旋的结构紧密,稳定性较高,常见于蛋白质中的内部区域,起到支撑和稳定蛋白质结构的作用。
β-折叠是另一种常见的蛋白质二级结构。
在β-折叠中,多肽链以折叠的形式延伸,形成多个折叠片段。
相邻折叠片段之间通过氢键连接,使得整个结构稳定存在。
β-折叠的结构松散,常见于蛋白质的表面区域,具有较高的灵活性。
β-折叠可以形成平行或反平行的排列方式,其中平行排列中折叠片段的N-末端和C-末端位于同一侧,而反平行排列则位于相对侧面。
β-转角是连接α-螺旋和β-折叠的区域,通常由3个残基组成。
β-转角的结构较为灵活,可以使蛋白质具有更多的构象自由度。
它在蛋白质中起到链接不同区域的作用,使得蛋白质形成完整的三维结构。
总而言之,蛋白质的二级结构对于其空间结构和功能具有重要影响。
通过对蛋白质二级结构的进一步研究,我们可以更好地理解蛋白质的结构与功能之间的关系,为药物设计和生物技术的发展提供基础。
在接下来的章节中,我们将详细介绍常见的蛋白质二级结构及其特点。
1.2 文章结构文章结构部分介绍了整篇文章的组织和安排。
本文将按照以下结构进行展开:第一部分为引言。
在引言中,对蛋白质的二级结构进行概述,包括其重要性和研究意义。
同时,引言还介绍了本文的结构和目的。
第二部分是正文。
蛋白质的结构与功能-2

---蛋白质二级结构的基础是肽键平面。
肽键平面/肽单元(peptide unit)
由于C=O双键中的π电子云与N原子上
的未共用电子对发生“电子共振”,使
肽键具有部分双键的性质,不能自由旋
转。
O C
O
C N
¨ N
+
共振形式
肽键中C-N键具有部分双键性质 ——组成酰胺的原子处于同一平面
肽单元——由于肽键具有部分双键的性
含有四级结构的蛋白质,单独的亚基一般没有 生物学活性,只有完整的四级结构寡聚体才有生 物学活性
血红蛋白(hemoglobin)分子中亚基的空间排布
牛 胰 岛 素 一 级 结 构
胰岛素分子 的三级结构
胰岛素是两条链通过二硫键 链接起来的,并没有亚基, 也就不存在四级结构了
总结:蛋白质结构的层次
空间位阻的意义
游离在溶液中的铁卟啉结合CO的能力比O2大25000倍,但 在肌红蛋白中,仅比O2大250倍。原因是由于空间位阻 造成的。这样可以防止代谢过程中产生的CO占据O2的结 合部位。 疏水环境的意义 通常O2与Fe(Ⅱ)接触会使Fe(Ⅱ)氧化为Fe(Ⅲ),血红素也 是一样。但在肌红蛋白内部,由于疏水的环境, Fe(Ⅱ)不易被氧化。 微环境的作用:固定血红素基,保护血红素铁免遭氧化; 为O2提供一个合适的结合部位.
胰岛素分子的三级结构
溶菌酶分子的三级结构
• 肌红蛋白 (Mb)
C 端 N端
(二)结构域
大分子蛋白质的三级结构常可分割成一个或 数个球状或纤维状的区域,折叠得较为紧密,各 行使其功能,称为结构域(domain) 。 结构域是三级结构层次上的局部折叠区。
蛋白质的折叠

蛋白质的折叠赵顺喆摘要:蛋白质是生命机体的基本组成部分,它是连接分子运作和生物功能的一个主要组成部分, 在生物体内占有特殊的地位。
而蛋白质作为生命信息的表达载体,它折叠所形成的特定空间结构是其具有生物学功能的基础。
然而,蛋白质通过什么方式折叠的问题却由于理论和实践的种种困难成为当今科学界的一大难题。
本文简要介绍了蛋白质折叠的基础知识,折叠机理研究的几个理论模型,以及研究的进展。
关键词:组织层次、理论模型、天然态、去折叠态、熔球态前言:蛋白质分子的折叠过程是指蛋白质分子从一般的状态变化到基态的复杂过程.它能使我们了解氨基酸序列是如何决定蛋白质分子结构,预测其结构及结构所表现出来的蛋白质分子的性能.在这个过程中氨基酸与氨基酸紧密接触(Residue -residue contact)的相互作用起着十分重要的作用。
蛋白质在生物体内,生命信息的流动可以分为两个部分:第一部分是储存于DNA序列中的遗传信息通过转录和翻译传入蛋白质的一级序列中,这是一维信息之间的传递,三联子密码介导了这一传递过程;第二部分是肽链经过疏水塌缩、空间盘曲、侧链叠集等折叠过程形成非常特定的复杂的空间结构,同时获得生物活性,从而将生命信息表达出来;因此这个一维信息向三维信息的转化过程是表现生命活力所必需的。
1.蛋白质的组织层次蛋白质有着各异的三维空间结构,这种结构称之为天然态结构,并且其内部结构组织具有层次性,因此我们引入组织层次的概念。
蛋白质结构可以分为四个组织层次,即一级结构、二级结构、三级结构和四级结构。
1.1一级结构一级结构又称初级结构(primary structure),指形成肽链的氨基酸序列,即指蛋白质分子中氨基酸残基的顺序,包括肽链中氨基酸的数目、种类和顺序。
肽键是蛋白质中氨基酸之间的主要连接方式,肽键具有部分双键的性质,所以整个肽单位是一个刚性的平面结构。
蛋白质的一级结构是由编码它的基因确定的,不同生物同种(或同源)蛋白质一级结构之间的差别可以反映出进化关系。
生物化学考研精解名词解释答案(上)免费版

生化考研精解名词解释答案(上)温馨提示:部分解释不是采自教材,如有疑问,请参考课本!第一章糖类(p6)6.构型(configurati on):在立体化学中,因分子中存在不对称中心而产生的异构体中的原子或取代基团的空间排列关系。
有D型和L型两种。
构型的改变要有共价键的断裂和重新组成,从而导致光学活性的变化。
7.构象(conformation):分子中由于共价单键的旋转所表现出的原子或基团的不同空间排列。
指一组结构而不是指单个可分离的立体化学形式。
构象的改变不涉及共价键的断裂和重新组成,也无光学活性的变化。
12.差向异构体(epimer):在立体化学中,含有多个手性碳原子的立体异构体中,只有一个手性碳原子的构型不同,其余的构型都相同的非对映体叫差向异构体。
14.异头碳(anomeric carbon):单糖由直链变成环状结构时,羰基碳原子成为新的手性中心,导致C1差向异构化,产生两个非对映异构体。
在环状结构中,半缩醛碳原子称为异头碳原子。
15.半缩醛(hemiacetal):醛基和一个醇基缩合形成的产物。
通过该反应,使单糖形成环状结构。
16.变旋(mutarotation):当一种旋光异构体如糖,溶于水中转变成几种不同旋光异构体的平衡混合物时,随着时间而发生的旋光变化。
18.糖苷键(glycosidic bond):一个单糖或糖链还原端半缩醛上的羟基与另一个分子(如醇、糖、嘌呤或嘧啶)的羟基、胺基或巯基之间缩合形成的缩醛键或缩酮键。
常见的糖苷键有O-糖苷键和N-糖苷键。
19.还原糖(reducing sugar):能够还原斐林(H.von Fehling)试剂或托伦斯(B.Tollens)试剂的糖称为还原糖,所有的单糖(除二羟丙酮),不论醛糖、酮糖都是还原糖。
大部分双糖也是还原糖,蔗糖例外。
22.淀粉(starch):由D-葡萄糖单体组成的同聚物。
包括直链淀粉和支链淀粉两种类型,为植物中糖类的主要贮存形式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二级结构倾向性因子
定义:Pi=Ai/Ti(i=α,β, t, c)
说明:
➢i表示二级结构态,如α螺旋、 β折叠、转角 和无规则卷曲等
➢ Ti是所有被统计残基处于二级结构态i的比例 ➢ Ai是第A种残基处于结构态i的比例 ➢ Pi>100表示该残基倾向于形成二级结构i;
Pi<100表示倾向于形成其它二级结构
蛋白质二级结构
a-helix (30-35%) a-螺旋
b-sheet / b-strand (20-25%) b-折叠
Coil (40-50%) 无规则卷曲 Loop 环 b-turn b-转角
α螺旋
Β折叠
反平行 β-折叠
平行 β-折叠
蛋白质结构分类
蛋白质3D 结构
转角或卷曲
TS
P(H) 69 77 P(E) 147 75
P T AE LMR
57 69 142 151 121 145 98 55 147 83 37 130 105 93
STG
77 69 57 75 147 75
β折叠规则
➢延伸(extension): 从折叠核向两端延 伸,直到4肽片段P(β)的平均值<100 为止
GOR方法
由Garnier, Osguthorpe & Robson三个 人发明
GOR是一种基于信息论与贝叶斯统计学的 方法
GOR方法针对与它N端紧邻的8个残基和C
端紧邻的8个残基的残基窗进行二级结构
预测
j
GOR方法
通过对已知二级结构的蛋白样本集进行 分析,计算出中心残基的二级结构分别 为螺旋、折叠和转角时每种氨基酸出现 在窗口中各个位置的频率,从而得到 17×20的得分矩阵
第二代方法:
➢ 基于氨基酸片段的统计分析,片段的长度通常为 11-21个氨基酸
➢ 最常用方法:GOR method (1978) ➢ 准确率稍高于60%
存在许多不同的算法:
➢ 统计信息(Statistical information) ➢ 神经网络(Neural networks) ➢ 多变量统计学(Multivariate statistics) ➢ 图论(Graph theory) ➢ 最邻近方法(Nearest Neighborhood Methods)
helix sheet turns
TSPTAELMRSTG <>
EEEEEEE T
Residue totals: H: 2 percent: H: 16.7
E: 7 E: 58.3
T: 1 T: 8.3
SOURCE: /o_fasta/cgi/garnier.cgi
得用矩阵中的值来计算待预测序列中每 个残基形成螺旋、折叠或转角的概率
准确率在60-65%之间
基于氨基酸疏水性的预测方法
基于物理化学性质进行二级结构预测的 方法
X-射线衍射法
慢且费用高 不能应用于
所有的蛋白
二级结构预测
预测的基本依据:每一段相邻的氨Biblioteka 酸残基具 有形成一定二级结构的倾向
蛋白质中约85%的氨基酸残基处于3种基本二级 结构状态(α螺旋、β折叠和转角)
二级结构预测的目标是判断每一个氨基酸残基 是否处于α螺旋、β折叠和转角(或其它状态) 之一的二级结构态,即三态
T S P T AE LMRS T G
P(H) 69 77 57 69 142 151 121 145 98 77 69 57
α螺旋规则
➢ 延伸(extension): 从螺旋核向两端延伸,直 到4肽片段P(a)的平均值 < 100
T S P T AE LMRS T G
P(H) 69 77 57 69 142 151 121 145 98 77 69 57
α螺旋
Β折叠
环或转角
蛋白质结构分类
Class (<10) 结构类 Folds (<1000) 折叠子 Superfamily 超家族
➢序列或结构相似 Family 家族
➢序列相似性> 25% ~ 30% ➢同源染色体
蛋白质结构预测
蛋白质的结构决定其生物学功能
蛋白质的结构由蛋白质序列决定
第一、二代方法存在的问题
预测准确率均小于70% 在预测β折叠方面很不理想,准确
率只有28-48%,只考虑了局部信息 能够预测的螺旋与折叠都比较短
二级结构预测方法的第三代方法
第三代方法:
➢ 通过运用多序列比对显著改善了预测方法 ➢ 相似序列往往具有相似结构理论在大的相互
作用方面提供了有利线索 ➢ 序列相似性>30%往往具有相似的蛋白结构 ➢PSI-BLAST (Alstchul et. al. 1997)强有
Chou-Fasman参数
Name Alanine Arginine Aspartic Acid Asparagine Cysteine Glutamic Acid Glutamine Glycine Histidine Isoleucine Leucine Lysine Methionine Phenylalanine Proline Serine Threonine Tryptophan Tyrosine Valine
已知序列的蛋白质数量与已测定结构的 蛋白质数量的差距正逐步拉大
➢ Swissprot已经有>140000条蛋白质序列 ➢ PDB中已知结构的只有其中的约10%
为什么要研究蛋白质结构?
对于未知功能或新发现的蛋白质分子, 通过结构分析,可以进行功能注释,指 导设计进行功能确认的生物学实验
分析蛋白质结构有助于药物设计研究
➢ 当按上述方法延伸后的片段的P(a) 平均值>100, 且P(a) 的平均值大于P(β) 的值 时,则这个 片段的二级结构就预测为α螺旋
β折叠规则
预测β折叠:
➢发现核位点(nucleation site):沿着 蛋白质序列寻找折叠核,相邻的5个残 基中如果至少有3个残基倾向于形成β 折叠,即有3个残基对应的P(β)>100, 则认为是折叠核
通过统计分析,获得每个残基出现于特定二级 结构构象的倾向性因子,利用这些倾向性因子 预测蛋白质的二级结构
每种氨基酸残基出现在各种二级结构中的倾向 或者频率是不同的,存在偏好性
准确性在 50-60%之间 /fasta_ww
w/chofas.htm
P(turn) 66 95 146 156 119 74 98 156 95 47 59 101 60 60 152 143 96 96 114 50
f(i) 0.06 0.07 0.147 0.161 0.149 0.056 0.074 0.102 0.14 0.043 0.061 0.055 0.068 0.059 0.102 0.12 0.086 0.077 0.082 0.062
蛋白质结构预测
蛋白质结构为什么如此重要的?
DNA 序列
蛋白质序列
转录&翻译
蛋白质结构
折叠
氨基酸序列只有折叠成特定的空间结构才具有相 应的活性和相应的生物学功能
为什么要研究蛋白质结构?
生物体中许多重要的功能由蛋白质完成
➢ 催化作用、营养物质运输、生长和分化控制和生物 信号的识别和传递等等
分析蛋白质结构、功能及其关系是蛋白 质组计划中的一个重要组成部分
从数学上讲,蛋白质结构预测的问题是 寻找一种从蛋白质的氨基酸线性序列到 蛋白质所有原子三维坐标的映射
自然界存在的蛋白质数目有限,蛋白质 结构预测是可能的
从实验上测定蛋白质结构
X-射线衍射法
➢ 最准确 ➢ 在体外进行 ➢ 需要结晶的蛋白
NMR(核磁共振)
➢ 较准确 ➢ 在体内 ➢ 不需要结晶 ➢ 限定在小分子量蛋白
f(i+3) 0.058 0.085 0.081 0.091 0.128 0.064 0.098 0.152 0.054 0.056 0.07 0.095 0.055 0.065 0.068 0.106 0.079 0.167 0.125 0.053
每个残基 出现在转 角1-4 位的频率
α螺旋规则
预测α螺旋:
➢发现核位点(nucleation site):沿着蛋 白质序列寻找α螺旋核,相邻的6个残基 中如果至少有4个残基倾向于形成α螺旋, 即有4个残基对应的P(a)>100,则认为是 螺旋核
T S P T AE LMRS T G
P(H) 69 77 57 69 142 151 121 145 98 77 69 57
有助于了解蛋白质相互作用,这对于生 物学、医学和药学都是非常重要
通过实验方法得到蛋白质结构花费高且 耗时长
蛋白质生物学基础
蛋白质
一个蛋白质分子是由有序的氨基酸链折叠 而成的(从30到30000个残基不等)
氨基酸
20种不同的氨基酸
•Alanine, Ala, A •Valine, Val, V •Phenylalanine, Phe, F •Proline, Pro, P •Methionine, Met, M •Isoleucine, Ile, I •Leucine, Leu, L •Aspartic acid, Asp, D •Glutamic acid, Glu, E •Lysine, Lys, K •Arginine, Arg, R
力的数据库搜索工具的加入 ➢ 准确率>70%
二级结构预测常用方法
Chou-Fasman方法 GOR 方法 基于氨基酸疏水性的预测方法 人工神经网络方法 最邻近方法
Chou-Fasman方法
基于单个氨基酸残基统计的经验参数方法,由 Chou和Fasman在1974 & 1978提出
