植物生理指标测定的实验方法简介
植物生理生化指标测定

小黑豆相关生理指标测定1.表型变化:鲜重、株高、主根长和叶面积鲜重:取处理好的植株,擦干根和叶表面水分,测量整株植物的重量,每个测6个重复。
株高:取处理好的植株,测量从根和茎分隔处到植株最高点的高度,记录,每个测6个重复。
主根长:取处理好的植株,测量从根和茎分隔处到主根最远点长度,记录,每个测6个重复。
叶面积:取处理好的植株,选择第二节段的叶片,测量叶面积,叶面积测量方法是测每个叶片最宽处长度作为叶的长,测叶片最窄处长度作为叶的宽,叶片长和宽的乘积即为叶表面积。
每个测6个重复。
2.总蛋白、可溶性糖、丙二醛(MDA)和H2O2含量测定样品处理:取0.5g样品(叶片要去除叶脉、根要先用清水清洗干净),速在液氮中冻存,在遇冷的研钵中加液氮研磨,然后加入1.5ml的Tris-HCl(pH7.4)抽提,将抽提液转移到2ml的EP管中,于4℃,12000rpm离心15min,取上清,保存在-20℃下,上清液可用于总蛋白、丙二醛(MDA)、可溶性糖和H2O2含量测定。
总蛋白测定(Bradford法):样品反应体系(800ul H2O+200ul Bradford+5ul 样品),空白对照为(800ul H2O+200ul Bradford)。
测定后带入标准曲线Y=32.549X-0.224(Y代表蛋白含量,X代表OD595),计算得出蛋白含量。
可溶性糖测定:样品反应体系(1ml蒽酮+180ul ddH2O+20ul样品提取液);空白对照(1ml蒽酮+180ul ddH2O),测定OD625后带入标准曲线:Y=0.0345X+0.0204(Y代表OD625,X代表可溶性糖含量(ug))蒽酮配方:称取100mg蒽酮溶于100ml稀硫酸(76ml浓硫酸+30mlH2O).注意:浓硫酸加入水中时,一点一点递加,小心溅出受伤。
丙二醛(MDA)测定:在酸性和高温条件下,丙二醛可与硫代巴比妥(TBA)反应生成红棕色的3,5,5-三甲基恶唑2,4-二酮,在532nm处有最大吸收波长,但该反应受可溶性糖的极大干扰,糖与TBA的反应产物在532nm处也有吸收,但其最大吸收波长在450nm处。
植物生理学实验测试

植物生理学实验测试植物生理学是研究植物生长和发育等生理过程的科学学科,通过实验测试可以揭示植物对外界环境因素的响应和适应机制。
本文将介绍几种常见的植物生理学实验测试方法,包括植物生长实验、叶绿素测定实验和逆境胁迫实验等。
一、植物生长实验植物生长实验是研究植物对不同环境条件下的生长反应的一种常见方法。
可以通过改变光照、温度、水分等环境因素来观察植物生长的变化。
在实验中,选取相同种子并进行处理,如将一组种子暴露在高温环境下,另一组放置在低温环境中,然后记录植物的生长情况,并进行数据统计和分析。
通过这种实验方法可以了解植物对温度的适应性以及不同温度对植物生长的影响。
二、叶绿素测定实验叶绿素是植物中起着关键作用的色素,其含量可以反映植物光合作用的强弱。
叶绿素测定实验可以通过测量植物叶片中叶绿素的含量来评估光合作用的效率。
实验中,首先需要采集新鲜叶片样品,并将其研磨得到绿色叶汁,然后通过光度计等仪器测定叶绿素的吸光度值,并根据标准曲线计算叶绿素的含量。
通过叶绿素测定实验可以评估植物对不同环境因素(如光照强度、养分浓度)的响应和适应能力。
三、逆境胁迫实验逆境胁迫实验是模拟植物在环境恶劣条件下的生理反应,如盐胁迫、干旱胁迫、冷热胁迫等。
通过逆境胁迫实验,可以研究植物在逆境条件下的生理适应和耐受机制。
实验中,可以使用不同浓度的盐水浇灌植物或让植物在干旱条件下生长,然后观察植物的生长情况、生理指标的变化,并与正常生长的植物进行比较分析。
逆境胁迫实验可以揭示植物对逆境的敏感性和胁迫响应机制,为育种和改良耐逆植物品种提供理论依据。
总结:植物生理学实验测试是研究植物生理过程的重要手段,通过不同的实验方法可以揭示植物对环境因素的响应和适应机制。
植物生长实验、叶绿素测定实验和逆境胁迫实验是常见的植物生理学实验方法,分别用于研究植物生长、光合作用和逆境胁迫的情况。
通过这些实验测试的结果,可以进一步了解植物的适应性和耐受能力,为培育适应不同环境的优良植物品种提供理论基础。
植物生理生化指标测定

植物生理生化指标测定植物生理生化指标测定是研究植物生长发育和适应环境的重要手段之一、通过测定植物的生理生化指标,可以了解植物的代谢活动、光合作用强度、水分状况、营养状况等,从而为植物生长调控、抗逆性研究提供依据。
下面将从光合作用测定、水分状况测定和营养状况测定三个方面对植物生理生化指标测定进行详细介绍。
光合作用是植物生长发育的重要过程之一,也是植物蓄积养分和能量的主要途径。
常用的光合作用测定指标有净光合速率、光饱和点、光补偿点和光抑制。
净光合速率是指单位时间内单位叶面积净光合产物的量,可以通过测定二氧化碳吸收量和氧气释放量来计算。
光饱和点是指植物的净光合速率达到最大值时的光强度,可以通过测定不同光强下的净光合速率来得出。
光补偿点是指净光合速率和呼吸速率相等的光强度,可以通过测定不同光强下的净光合速率和呼吸速率来确定。
光抑制是指过高或过低的光强度对植物光合作用的影响,可以通过测定光强对净光合速率的影响来评价。
水分状况是植物生理生化指标测定的重要方面之一,也是植物生长发育和适应环境的关键因素之一、常用的水分状况测定指标有相对含水量、蒸腾速率和水分利用效率。
相对含水量是指植物组织中的相对含水量与干重的比值,可以通过称量植物组织的湿重和干重来计算。
蒸腾速率是指单位时间内单位叶面积水分蒸腾的量,可以通过测定植物的蒸腾量和叶面积来计算。
水分利用效率是指植物单位干物质产量所需要的水分量,可以通过测定植物的干物质产量和水分消耗量来计算。
营养状况是植物生理生化指标测定的另一个重要方面,也是植物生长发育和代谢活动的基础。
常用的营养状况测定指标有叶绿素含量、叶绿素荧光参数和土壤养分含量。
叶绿素含量是评价植物叶绿素合成和叶绿素降解的指标之一,可以通过植物叶片中叶绿素的提取和测定来得出。
叶绿素荧光参数是评价光能利用效率和光能转化效率的重要指标之一,可以通过叶绿素荧光仪来测定。
土壤养分含量是评价土壤中不同营养元素含量的指标之一,可以通过土壤样品的提取和测定来得出。
植物生理指标测定

植物生理指标测定1.叶绿素含量测定叶绿素是植物进行光合作用的关键分子,它的含量可以反映植物的光合能力和叶片的健康状况。
叶绿素含量的测定可以通过光谱分析或色度法进行。
其中,光谱分析通过测量叶片吸收和反射的可见光波段来计算叶绿素含量;色度法则是通过提取叶片中的叶绿素,然后用乙醇或乙酸乙酯进行溶解,最后通过比色法来测定其含量。
2.蒸腾速率测定蒸腾是植物通过叶片气孔释放水分的过程,蒸腾速率可以反映植物水分的利用和调节能力。
蒸腾速率的测定方法有多种,常用的有质量法和热法。
质量法是通过称量植物在不同时间段内的重量变化来计算蒸腾速率;热法则是利用蒸腾过程中产生的热量来测定蒸腾速率。
3.气孔导度测定气孔是植物调节气体交换的关键结构,气孔导度可以反映植物对环境中各种因素的响应和适应能力。
气孔导度的测定可以通过气体交换技术进行,常用的方法有蒸腾流速法和扩散阻力法。
蒸腾流速法通过测定气孔腔中水蒸气和二氧化碳的浓度来计算气孔导度;扩散阻力法则是通过测定气孔腔中水蒸气的扩散阻力来计算气孔导度。
4.抗氧化酶活性测定氧化应激是植物面临的常见环境胁迫,而抗氧化酶是植物对抗氧化应激的主要防御系统。
抗氧化酶活性的测定可以通过比色法、荧光法和电化学法等进行。
比色法是基于酶催化反应产生的物质的颜色变化来测定酶活性;荧光法是通过检测酶催化反应产生的荧光信号来测定酶活性;电化学法则是通过测量酶催化反应中释放或吸收的电荷来测定酶活性。
这些测定方法可以用于研究植物对不同环境因子的响应和适应能力,也可以用于评估植物的生长和发育状态。
通过测定植物生理指标,研究人员可以更好地了解植物的生理机制和适应策略,为植物的种植和管理提供科学依据。
植物生理相关指标测定方法

可溶性糖含量测定1,试剂配制1) 葡萄糖标液100μg/ml :10mg/100ml;2) 蒽酮试剂:200mg蒽酮溶于100ml98%硫酸溶液中,用时现配2 ,标准曲线a) 加盖振荡5min(涡旋5min)b) 之后立即将其放入沸水浴中保温7minc) 取出自然冷却至室温,测620nm处吸光度3 ,样品测定a) 称取样品0.1g,剪成 1cm 小段,加 10ml 水沸水浴 1h,自然冷却后,定至10ml;b)加提取液0.2ml ①蒸馏水 0.8ml②蒽酮试剂 4ml③C)后续操作和标曲操作一样,测OD值4 计算可溶性糖含量=X*V T*(W F*V S)-1X——测定的值(ug/ml)V T——提取液体积(ml)V S——测定时吸取的体积(ml)W F——称取样品鲜重(g)一、试剂配制1) 50mM Na-phosphate 缓冲液 PH7.0 (PBS7.0)母液 A(0.2M NaH2PO4·2H2O)31.2g/L (蒸馏水定容)母液 B(0.2M Na2HPO4·12H2O) 71.628g/L (蒸馏水定容)97.5ml A + 152.5ml B 蒸馏水定容至 1000ml195ml A + 305ml B 蒸馏水定容至 2000ml2) 50mM Na-phosphate PH7.8 (PBS7.8)21.25ml A + 228.75ml B 蒸馏水定容至 1000ml42.5ml A + 457.5ml B 蒸馏水定容至 2000ml3) 10mM EDTANa2:0.372g/100ml PBS7.8 定容4) 酶提取液:100ml PBS7.0 + 1g PVP + 0.00744g EDTANa1000ml PBS7.0 + 10g PVP + 0.0744g EDTANa5) 硼酸-硼砂缓冲液:母液A(0.05mol/L硼砂溶液):称19.07gNa2B4O7.10H2O(M=381.43)溶解稀释至1000ml,硼砂易失水,必须在带塞得瓶中保存。
植物生理指标测定方法

植物生理指标测定方法植物生理指标是指用来衡量植物生理状况的具体参数或指标,在植物生理研究中起到了非常重要的作用。
植物生理指标测定方法主要包括以下几个方面:光合作用指标、呼吸作用指标、蒸腾作用指标、叶绿素指标、产量指标和抗逆性指标等。
1.光合作用指标的测定方法:(1)净光合速率的测定方法:通过光合速率仪测定植物叶片在光照条件下的净光合速率;(2)光饱和点和CO2抗饱和点的测定方法:通过对光合速率与光照强度或CO2浓度的关系进行测定,确定光饱和点和CO2抗饱和点;(3)光合色素含量的测定方法:通过分光光度计或高效液相色谱法测定叶片中的叶绿素a、叶绿素b和类胡萝卜素等光合色素的含量;(4)光合机构有效光能利用率的测定方法:通过光合色素荧光分析仪测定叶片的光能利用效率。
2.呼吸作用指标的测定方法:(1)总呼吸速率的测定方法:通过呼吸速率仪或气体分析仪测定植物组织在不同温度条件下的总呼吸速率;(2)细胞内呼吸速率的测定方法:通过氧和二氧化碳分压差法或氧电极法测定细胞内的呼吸速率。
3.蒸腾作用指标的测定方法:(1)蒸腾速率的测定方法:通过蒸腾速率仪测定植物叶片在不同光照和湿度条件下的蒸腾速率;(2)水分利用效率的测定方法:通过测量蒸腾速率和光合速率的比值来反映植物对水分的利用效率。
4.叶绿素指标的测定方法:(1)叶绿素含量的测定方法:通过叶绿素荧光分析仪或高效液相色谱法测定叶片中叶绿素a、叶绿素b和类胡萝卜素的含量;(2)叶绿素荧光动力学特性的测定方法:通过荧光指数、叶绿素荧光参数和叶绿素荧光成像等技术来评估叶绿素在光抑制和光保护状态下的变化。
5.产量指标的测定方法:(1)单株产量的测定方法:通过对植株生物量、籽粒数或实际产量的测定来计算出单株产量;(2)单穗产量的测定方法:通过对穗长、穗粒数和粒重的测定来计算出单穗产量;(3)单粒产量的测定方法:通过对单穗粒数和粒重的测定来计算出单粒产量。
6.抗逆性指标的测定方法:(1)抗氧化酶活性的测定方法:通过测定植物组织中抗氧化酶活性,如超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶等的活性来反映植物的抗氧化能力;(2)渗透调节物质含量的测定方法:通过测定植物组织中渗透调节物质(如脯氨酸、脯氨酸激酶等)的含量来评估植物的胁迫适应能力;(3)膜脂过氧化程度的测定方法:通过测定植物组织中膜脂过氧化程度的指标,如丙二醛和过氧化氢含量来评估植物膜的稳定性。
植物生理指标--最新实验原理与方法

植物生理指标--最新实验原理与方法1、氮蓝四唑(NBT)法测定超氧化物岐化酶(SOD)2、POD(过氧化物酶)活性的测定——愈创木酚法3、CAT(过氧化氢酶)测定4、抗坏血酸过氧化物酶(APX)活性的测定5、谷胧甘肽还原酶(GR)的活力测定:6、O2-产生速率的测定7、过氧化氢(H2O2)含量的测定——碘化钾分光光度法8、丙二醛(MDA)含量的测定9、还原型抗坏血酸(ASA)和脱氢抗坏血酸(DHA)的测定10、谷胱甘肽还原酶测定11、MDAR(单脱氢抗坏血酸还原酶)活性的测定12、可溶性总糖的测定13、考马斯亮蓝G-250染色法测定可溶性蛋白含量14、叶绿素含量的测定15、石蜡制片的制作16、激素Indole-3-Acetic Acid(IAA)、Abscisic Acid (ABA)、GA3和ZA的测定17、cDNA扩增片段长度多态性技术(cDNA-AFLP)18、3′/5′RACE 扩增基因全长19、根系活力的测定(TTC法)一氮蓝四唑(NBT)法测定超氧化物岐化酶(SOD)【实验原理】SOD是含金属辅基的酶。
高等植物含有两种类型的SOD:Mn-SOD和Cu.Zn-SOD,它们都催化下列反应:由于超氧自由基(O2.-)为不稳定自由基,寿命极短,测定SOD活性一般为间接方法。
并利用各种呈色反应来测定SOD的活力。
核黄素在有氧条件下能产生超氧自由基负离子O2.-,当加入NBT后,在光照条件下,与超氧自由基反应生成单甲月替(黄色),继而还原生成二甲月替,它是一种蓝色物质,在560nm波长下有最大吸收。
当加入SOD时,可以使超氧自由基与H+结合生成H2O2和O2,从而抑制了NBT光还原的进行,使蓝色二甲月替生成速度减慢。
通过在反应液中加入不同量的SOD酶液,光照一定时间后测定560nm 波长下各液光密度值,抑制NBT光还原相对百分率与酶活性在一定范围内呈正比。
反应液蓝色愈深,说明酶活性愈低。
【仪器、材料与试剂】(一)仪器1. 分光光度计2. 台式离心机(二)材料1. 磷酸氢二钠2. 磷酸二氢钠3. 甲硫氨酸4. EDTA-Na25. 核黄素6. 氮蓝四唑(NBT)7. 陶瓷小研钵8. 4-5ml 离心管9. 10ml 玻璃试管(三)试剂1. 0.05mol/L磷酸缓冲液(PBS,pH7.8):A母液:0.2mol/L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量358.14)71.7g;B母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.2g。
植物生理学中各项生理指标的测定方法

植物生理学中各项生理指标的测定方法一.实验内容实验1MDA(丙二醛)含量测定所需试剂:10%三氯乙酸(TCA)(纯)0.25%硫代巴妥酸(纯)实验2:可溶性蛋白含量测定所需试剂:考马斯亮蓝G-25095%乙醇85%磷酸实验3:SOD(超氧化物歧化酶)酶活性测定所需试剂:dl-甲硫氨酸(Met)NBTEDTA-Na2核黄素实验4:CAT(过氧化氢酶)活性(过氧化氢酶)测定所需试剂:PBS(PH=7.0)30%H2O2实验五:Ap某(抗坏血酸过氧化物酶)活性(即ASA—POD活性)测定所需试剂:ASA(分子量167.12)(乙=胺四乙酸=钠)EDTA—Na2PBS(pH7.0)30%H2O实验6:ASA(维生素C)含量测定偏磷酸95%乙醇磷酸4%2,2-二联吡啶FeCl3(或FeCl3·6H2O)实验7:GSH(谷胱甘肽,媚力肽GSHGSH是由谷氨酸、半胱氨酸和甘氨酸结合而成的三肽化合物)含量测定所需试剂:NaH2PO4·2H2ODTNB(二硫代硝基苯甲酸)PBS(PH6.8)实验8:脯氨酸测定所需试剂:磺基水杨酸甲苯茚三酮冰乙酸85%磷酸试验9:叶绿素含量测定。
80%丙酮试验9:GR活性测定试验10:过氧化氢含量测定。
三氯乙酸试验11:超氧阴离子含量测定二.酶液和母液提取1.酶液提取所需试剂:50mmol/L磷酸缓冲液(PH=7.8)(内含1%(m/v)聚乙烯吡哆烷酮PVP),0.1mmol/LEDTANa2或EDTA),也可为(内含2%(m/v)PVP),0.2mmol/LEDTANa2或EDTA)(先配制后用缓冲液定容)2.ASA.GSH母液提取所需试剂:5%偏磷酸1.抗氧化酶酶液提取(SOD.POD.CAT):1g(根据样品的量,少的可以适当减少)叶片加入预冷5ml.50mmol/L 磷酸缓冲液(PH=7.8)↓4℃冷冻15000g离心20分钟↓上清液即为酶液(5℃下保存一两天内备用,中短期用-20℃保存)2.ASA.GSH母液提取:0.1g叶片加入3ml预冷5%偏磷酸溶液↓4℃冷冻14000g离心10分钟↓上清液即为母液(5℃下保存备用)(偏磷酸可显著沉淀蛋白质和保护ASA)酶液提取所需试剂:PVP(聚乙烯吡哆烷酮):1%(1g溶于100ml水),1000ml需称取10g,此处用PBSEDTA-Na2:0.1mmol/L(37.2mgEDTA-Na2溶于1000ml蒸馏水),此处用PBSPBS(缓冲液)配制方法:①Na2HPO4·12H2O②NaH2PO4·2H2O取①71.64g,蒸馏水定容至1L,取②31.21g定容至1L,放置4℃冰箱备用PH=7.8取①91.5ml+②8.5ml=100ml(浓度0.2mol/L)需要0.05mol/L→将上述溶液烯释至400ml(0.2mol/L某0.1=0.05mol/L某V)母液提取所需试剂:5%偏磷酸:称5g纯偏磷酸,定容至100ml蒸馏水(需加热溶解,温度在50-60℃)偏磷酸有剧毒(偏磷酸难溶解,先得用研钵提前研碎,后用磁力搅拌器溶解一到两天后再定容)(现所用为38%HPO3,所以需称65.7895g,定容至500ml)三.实验步骤实验1:MDA含量测定1.1所需试剂:10%三氯乙酸(TCA)(纯)称10g定容至100ml0.25%硫代巴妥酸(纯)称0.25g用10%TCA定容至100ml(配制时,可一次完成,先配TCA,不要定容,再加入硫代巴比妥酸,然后定容,若难溶解,可以在磁力搅拌器上微热)1.2步骤:取0.3g叶片,加4ml磷酸缓冲液研磨,加入4ml0.25%的硫代巴比妥酸(溶于10%的三氯乙酸)溶液↓摇匀95℃加热15分钟↓快速冷却3000g离心15分钟↓取上清测定OD532,OD600,OD450值↓按公式求MDA浓度=6.45某(OD532-OD600)-0.56OD450(μmol/L)可溶性糖浓度=11.71某OD450(mmol/L)-3最后计算MDA含量(μmol/gFW)=[4某(MDA浓度某)某10/0.1]-3同时,可测得可溶性糖含量(mmol/gFW)=4某(可溶性糖浓度χ)某10/0.1(用多波长测定,在测定之前一定要矫正基线,公式中的参数可以直接在分光光度计上输入)注意:以0.25%的硫代巴妥酸溶液作空白调零MDA含量测定的改进1.可以用做酶活性时提取的酶液来直接测定MDA含量,用量可以定为1.0、1.5或2.0(较好)ml。
(整理)植物生理指标测定方法

A600—在600nm波长下测得的吸光度值
﹡—1.55×105为摩尔比吸收系数
C糖、CMDA分别是反应混合液中可溶性糖、MDA的浓度。
1.按下式计算提取液中MDA浓度
反应液体积(ml)
CMDA×—————————
1000
提取液中MDA浓度(μmol·ml-1)= ———————————————
四、实验步骤
1、脯氨酸标准曲线的制作
1.1取6支试管,编号,按下表配制每管含量为0~12μg的脯氨酸标准液。加入表中试剂后,置于沸水浴中加热30min。取出冷却。以去离子水溶液为空白对照,在520mm波长处测定吸光度(A)值。
试剂
管号
0
1
2
3
4
5
10μg·ml-1脯氨酸标准液(ml)
蒸馏水(ml)
冰醋酸(ml)
【3】无水酒精和80%丙酮等体积混合提取
实验二、
一、原理
植物组织在受到各种不利的环境条件(如干旱、低温、高温、盐渍和大气污染)危害时,细胞膜的结构和功能首先受到伤害,细胞膜透性增大。若将受伤害的组织浸入无离子水中,其外渗液中电解质的含量比正常组织外渗液中含量增加,组织受伤害越严重,电解质含量增加越多。用电导仪测定外渗液电导率的变化,可反映出质膜受伤害的程度。在电解质外渗透的同时,细胞内可溶性有机物也随之渗出,引起外渗液可溶性糖、氨基酸、核苷酸等含量增加,氨基酸和核苷酸对紫外光有吸收,对紫外分光光度计测定受伤害组织外渗液消光值,同样可反映出质膜受伤害的程度。用电导仪法和紫外法测定结果有很好的一致性。
二、原理
磺基水杨酸对脯氨酸有特定反应,当用磺基水杨酸提取植物样品时,脯氨酸便游离于磺基水杨酸溶液中。然后用酸性茚三酮加热处理后,茚三酮与脯氨酸反应,生成稳定的红色化合物,再用甲苯处理,则色素全部转移至甲苯中,色素的深浅即表示脯氨酸含量的高低。在520nm波长下测定吸光度,即可从标准曲线上查出脯氨酸的含量。
植物生理指标测定方法

植物生理指标测定方法本文介绍了植物生理指标的测定方法,包括叶片持水率、植物暂时萎蔫率、叶片相对含水量、相对电导率和可溶性糖的测定。
首先介绍叶片持水率的测定方法。
选择植株上部枝条健康完整的定型叶,摘取后混均匀分成三份即时称量鲜重,然后置入40℃恒温烘箱中烘40 min,取出称重,再置入85℃烘箱中恒温烘至恒重。
失水率的大小可以反映叶片持水能力的高低,计算公式为失水率=[(鲜重-40℃烘40 min重)÷(鲜重-85℃烘至恒重)]×100%。
其次介绍植物暂时萎蔫率的测定方法。
观察植株叶片萎蔫下垂、翌日晨不能恢复正常者,即取盆中土壤测定。
将植株连土团倒出,用小刮铲从根的周围取土,剔除杂物后称重,带回室内置于105℃烘箱内烘至恒重。
每种植物每次测试一盆,按公式计算暂时萎蔫率:暂时萎蔫率=[(土壤湿重-土壤干重)÷土壤干重]×100%。
接下来介绍叶片相对含水量的测定方法。
取各植株相同部位叶片,测定叶片的鲜重M1,然后将叶片浸入蒸馏水中使其吸水达到饱和状态,再取出擦干叶片至表面无水分残留,称重得到叶片的饱和鲜重M2,最后将叶片放进烘箱,105℃杀青半小时,再于85℃环境下烘至恒重,得到叶片干重M3.按公式计算叶片相对含水量。
然后介绍相对电导率的测定方法。
取各植株相同部位叶片,用蒸馏水拭净叶片表面和背面,去除叶片中脉,剩下部分剪成大小为5mm×5mm的叶片。
取0.20g各3份放入锥形瓶中并加入30ml蒸馏水,放于真空干燥器中,用真空泵抽气10min,以抽出细胞间隙空气。
缓慢放入空气,水即渗入细胞间隙,叶片变成透明状,细胞内溶质易于渗出。
取出锥形瓶,在室温下保持30min后用电导仪测定电导率L1,然后将加塞锥形瓶转入沸水中,水浴20 mins,取出冷却至室温后测定电导率L2.按公式计算细胞膜相对透性(相对电导率)。
最后介绍可溶性糖的测定方法。
取各植株相同部位叶片,用90%乙醇浸泡2h,过滤后将滤液置于水浴中加热至乙醇挥发完毕,再用蒸馏水补足至定容,最后用显色剂显色后测定吸光度,按公式计算可溶性糖的含量。
植株生理指标测定方法
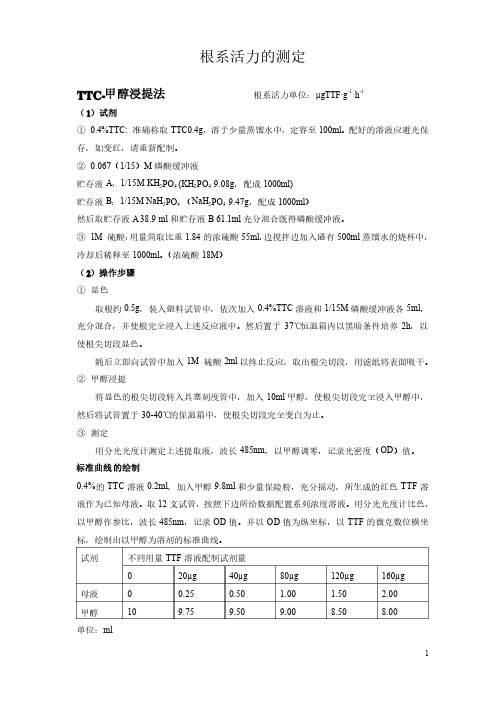
1根系活力的测定根系活力的测定TTC-甲醇浸提法根系活力单位:µgTTF·gTTF·g g -1·h -1(1)试剂① 0.4%TTC: 准确称取TTC0.4g ,溶于少量蒸馏水中,溶于少量蒸馏水中,定容至定容至100ml 。
配好的溶液应避光保存,如变红,请重新配制。
存,如变红,请重新配制。
② 0.067(1/15)M 磷酸缓冲液磷酸缓冲液贮存液A :1/15M KH 2PO 4 (KH 2PO 4 9.08g ,配成1000ml) 贮存液B :1/15M NaH 2PO 4 (NaH 2PO 4 9.47g ,配成1000ml )然后取贮存液A 38.9 ml 和贮存液B 61.1ml 充分混合既得磷酸缓冲液。
充分混合既得磷酸缓冲液。
③ 1M 硫酸:用量筒取比重1.84的浓硫酸55ml ,边搅拌边加入盛有500ml 蒸馏水的烧杯中,冷却后稀释至1000ml 。
(浓硫酸18M ) (2)操作步骤 ① 显色显色取根约0.5g ,装入塑料试管中,依次加入0.4%TTC 溶液和1/15M 磷酸缓冲液各5ml ,充分混合,并使根完全浸入上述反应液中。
然后置于37℃恒温箱内以黑暗条件培养2h ,以使根尖切段显色。
使根尖切段显色。
随后立即向试管中加入1M 硫酸2ml 以终止反应,取出根尖切段,用滤纸将表面吸干。
② 甲醇浸提甲醇浸提将显色的根尖切段转入具塞刻度管中,加入10ml 甲醇,使根尖切段完全浸入甲醇中,然后将试管置于30-40℃的保温箱中,使根尖切段完全变白为止。
的保温箱中,使根尖切段完全变白为止。
③ 测定测定用分光光度计测定上述提取液,波长485nm ,以甲醇调零,记录光密度(OD )值。
)值。
标准曲线的绘制0.4%的TTC 溶液0.2ml ,加入甲醇9.8ml 和少量保险粉,充分摇动,所生成的红色TTF 溶液作为已知母液。
液作为已知母液。
取取12支试管,支试管,按照下边所给数据配置系列浓度溶液。
植物生理生化指标的测定方法与意义解读

植物生理生化指标的测定方法与意义解读植物生理生化指标的测定方法与意义解读对于研究植物生长、适应环境以及疾病防治等领域至关重要。
本文将介绍几种常用的植物生理生化指标的测定方法,并解读其意义。
一、叶绿素含量的测定方法与意义解读叶绿素是植物光合作用的关键物质,反映了植物的光合能力和光合效率。
常用的测定叶绿素含量的方法有多种,如色素提取法、光度法和荧光法等。
其中,色素提取法是最常用的方法之一。
该方法通过乙醇提取叶片中的叶绿素,然后用紫外-可见光谱仪分析提取液的吸光度,从而计算出叶绿素含量。
叶绿素含量的测定对植物的研究具有重要意义。
首先,叶绿素含量可以直接反映植物的光合能力和光合效率。
一般来说,叶绿素含量越高,植物的光合作用效率越高,并且可以更好地利用阳光进行光合作用。
其次,叶绿素含量也可以作为植物受到生态环境和生理状态变化的指示器。
例如,在氮素缺乏的条件下,植物体内的叶绿素含量会下降,表明植物养分供应不足。
因此,测定叶绿素含量有助于了解植物在不同环境和条件下的光合适应能力和生长状态。
二、抗氧化酶活性的测定方法与意义解读抗氧化酶是植物体内起重要保护作用的一类酶,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)等。
这些酶能够清除植物体内产生的有害氧自由基,保护细胞免受氧化损伤。
常用的抗氧化酶活性测定方法有多种,如显色法、发光法和酶活测定法等。
抗氧化酶活性的测定在研究植物的环境适应能力和应对氧化胁迫方面具有重要意义。
首先,抗氧化酶活性可以反映植物受到氧化胁迫的程度。
当植物受到氧化胁迫时,抗氧化酶活性会显著增加,以应对有害氧自由基的累积。
其次,抗氧化酶活性还可以用来评估植物的环境适应能力。
例如,在干旱或高温等胁迫条件下,植物体内的抗氧化酶活性通常会增加,以维持细胞内的氧化-还原平衡。
三、渗透调节物质含量的测定方法与意义解读渗透调节物质是植物在干旱、盐碱等逆境环境下维持细胞渗透平衡和稳态的重要物质。
植物生理指标检测方法

植物⽣理指标检测⽅法植物组织中可溶性糖含量的测定在作为营养物质主要是指可溶性糖和淀粉。
它们在营养中的作⽤主要有:合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为NH 3 的受体⽽转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种⽣命活动提供了所需的能量。
由于碳⽔化合物具有这些重要的作⽤,所以是营养中最基本的物质,也是需要量最多的⼀类。
Ⅰ蒽酮法测定可溶性糖⼀、原理糖在浓硫酸作⽤下,可经脱⽔反应⽣成糠醛或羟甲基糠醛,⽣成的糠醛或羟甲基糠醛可与蒽酮反应⽣成蓝绿⾊糠醛衍⽣物,在⼀定范围内,颜⾊的深浅与糖的含量成正⽐,故可⽤于糖的定量测定。
该法的特点是⼏乎可以测定所有的碳⽔化合物,不但可以测定戊糖与⼰糖含量,⽽且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖⽔解成单糖⽽发⽣反应),所以⽤蒽酮法测出的碳⽔化合物含量,实际上是溶液中全部可溶性碳⽔化合物总量。
在没有必要细致划分各种碳⽔化合物的情况下,⽤蒽酮法可以⼀次测出总量,省去许多⿇烦,因此,有特殊的应⽤价值。
但在测定⽔溶性碳⽔化合物时,则应注意切勿将样品的未溶解残渣加⼊反应液中,不然会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发⽣反应⽽增加了测定误差。
此外,不同的糖类与蒽酮试剂的显⾊深度不同,果糖显⾊最深,葡萄糖次之,半乳糖、⽢露糖较浅,五碳糖显⾊更浅,故测定糖的混合物时,常因不同糖类的⽐例不同造成误差,但测定单⼀糖类时,则可避免此种误差。
糖类与蒽酮反应⽣成的有⾊物质在可见光区的吸收峰为 620 nm ,故在此波长下进⾏⽐⾊。
⼆、实验材料、试剂与仪器设备(⼀)实验材料任何植物鲜样或⼲样。
(⼆)试剂1. 80 %⼄醇。
2. 葡萄糖标准溶液(100 µg/mL ):准确称取100 mg 分析纯⽆⽔葡萄糖,溶于蒸馏⽔并定容⾄100 mL ,使⽤时再稀释 10 倍( 100 µg/mL )。
植株生理生长指标的测定

植株生理生长指标的测定植物是生命体中的一类特殊群体,在其生长发育过程中会受到各种内外因素的调控,同时也会表现出一系列生理生长指标。
通过测定这些生理生长指标,可以了解植物体内的生理代谢情况,从而为植物的健康生长提供科学依据。
本文将围绕植株生理生长指标的测定展开讨论。
1.葉綠素含量的測定:葉綠素是植物葉片中的一種生物色素,它參與了光合作用的進行。
常用的測定葉綠素含量的方法有光度計法、高效液相色譜法等。
2.葉綠素螢光參數的測定:葉綠素螢光是植物光合作用過程中產生的一種特殊光信號,通過测定葉綠素螢光參數,可以了解植物光合作用的效率和植物對環境壓力的響應能力。
3.光合作用速率的測定:光合作用是植物進行自養生長的重要過程,通過測定植物光合作用速率,可以了解植物的碳同化效率、能量利用效率等。
4.葉片相對含水量的測定:葉片相對含水量是植物葉片中水含量的相對度量,通過測定葉片相對含水量,可以了解植物的水分狀態和水分狀態調節能力。
二、幹部生理生長指標的測定1.幹部生长速率的测定:幹部生长速率反映植物株高增长的速度,通过测量株高的变化来计算生长速率。
2.幹部含水量的測定:幹部含水量是植物幹部中水含量的一個指標,通過測定幹部含水量,可以了解植物的水分状况和水分状况调节能力。
3.幹部基径和幹部直径的測定:幹部基径和幹部直径是反映植物幹部添寬的指标,通過測定幹部基径和幹部直径,可以了解植物幹部生长的情况。
1.根系鲜重和干重的测定:根系鲜重和干重反映植物根系的生物量,通過測定根系鲜重和干重,可以了解植物的吸水吸養能力。
2.根系表面积的测定:根系表面积反映根系的吸水吸饮能力和养分吸收能力,通過測定根系表面积,可以了解植物吸水吸饮的效率。
3.根系形态指数的测定:根系形态指数是根系表面积和根长的比值,通過測定根系形态指数,可以了解植物根系的扩展能力和赋予生物地理学意义的功能。
综上所述,植物的生理生长过程包括了叶片、幹部和根系的生理生长指标。
植物生理指标测定

氮蓝四唑(NBT)法测定超氧物歧化酶(SOD)活力一、原理超氧物歧化酶(superoxidedismutase,SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶。
本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。
在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生O2,可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收。
而SOD可清除O2,从而抑制了甲腙的形成。
于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
二、材料、仪器设备及试剂(一)材料;水稻或小麦叶片(二)仪器设备:1.高速台式离心机;2.分光光度计;3.微量进样器;4.荧光灯(反应试管处照度为4000Lx);5.试管或指形管数支。
(三)试剂 1. 0.05mol/L 磷酸缓冲液(pH7.8);2. 130mmol/L 甲硫氨酸(Met)溶液:称1.9399gMet用磷酸缓冲液定容至100ml;3.750μmol/L 氮蓝四唑溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,避光保存;4. 100μmol/L EDT-Na2溶液:称取0.03721gEDTA-Na2用磷酸缓冲液定容至1000ml;5. 20μmol/L 核黄素溶液:称取0.0753g核黄素用蒸馏水定容至1000ml避光保存。
三、实验步骤1. 酶液提取取一定部位的植物叶片(视需要定,去叶脉)0.5g于预冷的研钵中,1ml预冷的磷酸缓冲液在冰浴上研磨成浆,加缓冲液使终体积为5ml。
取1.5~2ml于1000rpm下离心20min,上清液即为SOD粗提液。
2. 显色反应取5ml指形管(要求透明度好)4支,2支为测定管,另2支为对照管,按下列加入各溶液:试剂(酶)用量(ml)终浓度(比色时)0.05mol/L 磷酸缓冲液1.5130mmol/L Met溶液0.313mmol/L 750μmol/LNBT溶液0.375μmol/L 100μmol/L EDTA-Na2液0.310μmol/L 20μmol/L 核黄素0.320μmol/L 酶液0.05。
植物生理指标测定方法

植物生理指标测定方法实验一植物叶绿素含量的测定(分光光度法)(张宪政,佃92)一、原理根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。
根据朗伯一比尔定律,某有色溶液的吸光度 A 与其中溶质浓度C 和液层厚度L 成正比,即A = a CL 式中:a 比例常数。
当溶液浓度以百分浓度为单位,液层厚度为1cm 时,a 为该物质的吸光系数。
各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。
如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。
这就是吸光度的加和性。
今欲测定叶绿体色素混合提取液中叶绿素 a 、b 和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A ,并根据叶绿素a 、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。
在测定叶绿素a 、b 时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。
高等植物中叶绿素有两种:叶绿素 a 和b ,两者均易溶于乙醇、乙醚、丙酮和氯仿。
叶绿素 a 和叶绿素b 的比值反映植物对光能利用效率的大小,比值高则大,贝U 反之。
、材料、仪器设备及试剂试剂:1) 95%乙醇(或80%丙酮)、实验步骤称取剪碎的新鲜样品0.2?0.3g,加乙醇10ml ,提取直至无绿色为止。
把叶绿体色素提取液倒入光径1cm 的比色杯内,以95%乙醇为空白,在波长 663nm 和645nm 下测定吸光度。
四、实验结果按计算丙酮法(Amon 法)【可以用于丙酮乙醇混合法和 80%丙酮提取法的计算】(mg/g ) = (12.71XOD663 -2.59XOD645) V/1000*W(mg/ g ) =(22.88OD645 -4.67OD663) V/1000*W=(8.04XOD663+20.29<="" bdsfid="72" p="" v="">(mg/g ) = (12.63^OD663 -2.5^OD645) V/1000*W (mg/ g ) =(20.47OD645 -4.73OD663) V/1000*W叶绿素 a 、b 的总含量(mg/g ) =(7.90^OD663 + 17.95^OD645) V/1000*W注:1、叶绿素a 和叶绿素b 的比值反映植物对光能利用率叶绿素a 的含量叶绿素b 的含量叶绿素a 、b 的总含量(mg/g )按Inskeep 公式叶绿素a 的含量叶绿素b 的含量【11比如阳生植物叶绿素 a 和叶绿素b 的比值较大【21阴生植物叶绿素 a 和叶绿素b 的比值较小2、丙酮——熔点:-94C ;沸点:56.48C ;是一种无色透明液体,有特殊的辛辣气味易溶于水和甲醇、乙醇、乙醚、氯仿、吡啶等有机溶剂 .下一步实验方法比较【11 95%乙醇直接提取(V )【21 95%乙醇加热提取(冯瑞云,1985)【31无水酒精和80%丙酮等体积混合提取实验二、不良环境对植物细胞膜的伤害((张宪政,佃92))一、原理植物组织在受到各种不利的环境条件(如干旱、低温、高温、盐渍和大气污染)危害时,细胞膜的结构和功能首先受到伤害,细胞膜透性增大。
植物生理指标测定

---------------------------------------------------------------最新资料推荐------------------------------------------------------植物生理指标测定实验 22 过氧化物酶活性的测定过氧化物牌是植物体内普遍存在的、活性较高的一种酶,它与呼吸作用、光合作用及生长素的氧化等都有密切关系,在植物生长发育过程中,它的活性不断发生变化,因此测量这种酶,可以反映某一时期植物体内代谢的变化。
通过本实验了解过氧化物酶的作用,掌握常用的测定过氧化物酶的方法一愈创木酚法。
一、原理在过氧化物酶(peroxidase)催化下,H2O2 将愈创木酚氧化成茶褐色产物。
此产物在 470m 处有最大光吸收,故可通过测 470 nm 下的吸光度变化测定过氧化物酶的活性。
二、材料、仪器设备及试剂 (一)材料马铃薯块茎。
(二)仪器设备 722 型分光光度计,离心机,研钵,容量瓶,量筒,试管,吸管。
(三)试剂 (1)0.05 mol/L.pH5.的磷酸缓冲液。
(3) 2%H202。
三、实验步骤 (一)酶液的制备取 5.0g 洗净去皮的马铃薯块茎,切碎放入研钵中,加适量的磷酸缓冲液研磨成匀浆。
将匀浆液全部转人离心管中,于 3000g 离心 10 min,上清被转人25 mL,容量瓶中。
沉淀用 5 mL 磷酸缓冲液再提取两次,上清液并人容量瓶中,定1/ 22容至刻度,低温下保存备用。
(二)过氧化物酶活性测定酶活性测定的反应体系包括:2.9 mL.0.05 mol/L 磷酸缓冲液; 1.0ml.2%H2O2 ;(2)0.05 mo/L 愈创木份溶液。
(4)20%三氯乙酸。
1.0mL.0.05mol/L 愈创木面和 0.1mL 酶液。
用加热煮沸 5min 的酶成为对照,反应体系加人酶液后,立即于37C 水浴中保温 15min.然后迅速转人冰浴中,并加人 2.0ml.20%三氯乙酸终止反应,然后,过虑(或 5000xg 离心 10min),适当稀释.470mm 波长下测定吸光度。
实验三:作物生理指标测定

(二)植物组织水势的测定
不同植物,不同部位,不同年龄及不同时刻的组织, 不同植物,不同部位,不同年龄及不同时刻的组织,水 势都有一定的差异; 势都有一定的差异;土壤条件及大气条件等外界因素对植物 组织的水势也有很大影响。 组织的水势也有很大影响。 测定方法: 测定方法:小液流法和压力室法 1、小液流法 水从水势高处流向低处。植物体细胞之间, 水从水势高处流向低处。 植物体细胞之间,组织之间以 及植物体和环境间的水分移动都由水势差决定。 及植物体和环境间的水分移动都由水势差决定 。 当植物细胞 或组织放在外界溶液中时, 或组织放在外界溶液中时 , 如果植物的水势小于溶液的渗透 溶质势) 则组织吸水而使溶液浓度变大:反之, 势 ( 溶质势 ) , 则组织吸水而使溶液浓度变大 : 反之 , 则植 物细胞内水分外流而使溶液浓度变小; 物细胞内水分外流而使溶液浓度变小 ; 若植物组织的水势与 溶质的渗透势相等,则二者水分保持动态平衡,所以外部溶 溶质的渗透势相等, 则二者水分保持动态平衡, 液浓度不变,而溶液的渗透势即等于所测植物的水势。 液浓度不变,而溶液的渗透势即等于所测植物的水势。
作物生理指标的测定
植物组织含水量、叶水势、细胞液浓度、光合速率、 植物组织含水量、叶水势、细胞液浓度、光合速率、蒸 腾速率、气孔导度或气孔阻力、冠层温度等。 腾速率、气孔导度或气孔阻力、冠层温度等。这些生理指标 与环境(如土壤水分)状况有密切的关系。 与环境(如土壤水分)状况有密切的关系。
(一)、植物组织含水量 植物组织含水量
其缺点:测定速度很慢, 其缺点:测定速度很慢,不适宜大批样品的测定 目前主要采用压力室法测定植物组织的水势。 目前主要采用压力室法测定植物组织的水势。
植株生理生长指标的测定

根系活力的测定(TTC法)植株根系是活跃的吸收器官和合成器官,根的生长情况和活力水平直接影响地上部分的生长、营养状况及产量水平。
一、原理氯化三苯基四氮唑(TTC)是标准氧化电位为80mV的氧化还原色素,溶于水中成为无色溶液,但还原后即生成红色而不溶于水的三苯甲腙,生成的三苯甲腙比较稳定,不会被空气中的氧自动氧化,所以TTC被广泛地用作酶试验的氢受体,植物根系中脱氢酶所引起的TTC还原,可因加入琥珀酸,延胡索酸,苹果酸得到增强,而被丙二酸、碘乙酸所抑制。
所以TTC还原量能表示脱氢酶活性并作为根系活力的指标。
二、材料、设备仪器及试剂(一)材料水培或砂培小麦、玉米等植物根系。
(二)仪器设备1. 分光光度计;2. 分析天平(感量0.1mg);3. 电子顶载天平(感量0.1g);4. 温箱;5. 研钵;6. 三角瓶50ml;7. 漏斗;8. 量筒100ml;9. 吸量管10ml;10. 刻度试管10ml;11. 试管架;12. 容量瓶10ml;13. 药勺;14. 石英砂适量;15. 烧杯10ml、1000ml。
(三)试剂1、乙酸乙酯(分析纯)。
2、次硫酸钠(Na2S2O4),分析纯,粉末。
3TTC 1.0g,溶于少量水中。
定容到100ml。
4TTC 0.4g,溶于少量水中。
定容到100ml。
56 1.84的浓硫酸55ml,边搅拌边加入盛有500ml蒸馏水的烧杯中,冷却后稀释至1000ml。
7 4.72g,溶于水中,定容至100ml即成。
三、实验步骤1、定性测定(1)配制反应液:把1%TTC溶液、0.4 mol/L的琥珀酸和磷酸缓冲液按1:5:4比例混合。
(2)把根仔细洗净,把地上部分从茎基切除。
将根放入三角瓶中,倒入反应液,以浸没根为度,置37℃左右暗处放1~3h,以观察着色情况,新根尖端几毫米以及细侧根都明显地变成红色,表明该处有脱氢酶存在。
2、定量测定(1)TTC标准曲线的制作取0.4%TTC溶液0.2ml放入10ml量瓶中,加少许Na2S2O4粉摇匀后立即产生红色的甲腙。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 材料与方法
1.1 材料处理
生菜,选取整齐、质地脆嫩、颜色翠绿或深绿,且无腐烂、无虫食的作为实验试材。
适当剥去外部一些受损苞叶,使其大小整齐一致,将生菜用0.02%次氯酸钠浸泡3min,晾干水分后,五棵作为一个实验组,用塑料袋包装,分别在-4℃,0℃,4℃以及室温下贮藏。
每隔2d 测定一次贮藏生菜的生理指标,贮藏期间相对湿度为70%。
1.2实验使用的化学试剂
碳酸钙粉(石英砂),80%的丙酮;1mg.ml -1葡萄糖标准液,3,5-二硝基水杨酸试剂;去离子水;0.6%的硫代巴比妥蒜(TBA ),10%的三氯乙酸(TCA );0.2mol/L PH=7.0的磷酸缓冲液,0.1mol/L H 202溶液; 0.05mol/L PH=7.8磷酸缓冲液, 提取介质(0.05mol/L PH=7.8磷酸缓冲液,内含质量分数为1%的聚乙烯吡咯烷酮),130mmol/LMet 溶液, 750umo1/L NBT 溶液, 100umol/L EDTA 溶液,20umo1/L 核黄素,蒸馏水;质量分数2% H 202溶液,pH5.5磷酸缓冲液,0.05mol/L 愈创木酚,20%的三氯乙酸(TCA );pH5.5磷酸缓冲液,20%的三氯乙酸(TCA ), PVP ,0.1mol/L 儿茶酚;
1.3实验的仪器设备
天平,分光光度计,水浴锅,离心机,研钵,打孔器,烧杯,容量瓶,移液管,试管,漏斗,滤纸,光照箱,培养箱,冰箱,电导仪,
1.4实验方法
1.4.1失重率
采用差量法计算。
失重率(%)=(入贮前重量一贮藏后重量)/入贮前重量×100%
1.4.2叶绿素含量
叶绿素含量的测定采用分光光度比色法[1]。
取0.5g 生菜叶片研磨,加少量的碳酸钙粉及80%丙酮进行研磨,匀浆过滤后用80%的丙酮定容至15ml ,以80%的丙酮作对照,在分光光度计上测定665nm,649nm, 470nm 处的光密度值。
以Amon 法公式计算叶绿素的含量。
叶绿素总量(mg/g )= )()C (或干重样品鲜重稀释倍数
提取液体积色素的浓度⨯⨯
1.4.3还原糖含量
采用3,5一二硝基水杨酸(DNS)比色法。
称取生菜叶片样品1g ,加8mL 蒸馏水匀浆,10000rpm 离心20min ,吸取上清液2.0mL ,加1.5mL 的DNS 试剂,沸水中煮5min,冷却后蒸馏水用定容到25.0mL,测A 540。
以葡萄糖作标准曲线并计算还原糖含量。
1.4.4电导率测定
用打孔器取10片6~8mm 的生菜叶片,用自来水冲洗数次,再用去离子水冲洗,然后用50ml 的去离子水加盖浸泡1h, 测电导率S 1,(以蒸馏水为空白对照组。
煮沸1~2min ,静置1h ,再测电导率S 2。
相对电导率L=S 1/S 2.)。
1.4.5丙二醛(MDA)含量
采用硫代巴比妥酸(TBA)比色法。
取生菜叶片样品1g 加入2mL 10% TCA 和少量石英砂,研磨,再加8ml TCA 进一步研磨,匀浆液4000r/min 离心10min 。
取2mL 上清液,加2ml 质量分数为0.6%TBA 溶液,沸水中煮15min ,冷却后离心,取上清液测定450,532和600nm 波长下的吸光度值,以TCA 溶液取代酶液作为空白。
根据公式
MDA 质量摩尔浓度(u mol . L-1)= c . N. W -1
计算出MDA 浓度及生菜样品中的含量
1.4.6超氧化物歧化酶(SOD)活性
取生菜样品0.5g ,加入6mL 提取介质(0.05mol/L PH=7.8磷酸缓冲液,内含质量分数为1%
的聚乙烯吡咯烷酮),冰浴研磨,加入提取介质使得终体积为10ml。
4℃下10500r/min离心20min,上清液为SOD粗酶液。
酶活力测定:反应体系中顺次加入0.05mol/L pH7.8磷酸缓冲溶液3mL,130mmol/LMet溶液0.6mL,750umo1/L NBT溶液0.6mL, 100umol/L EDTA溶液0.6 mL,粗酶液0.2mL, 20umo1/L核黄素0.6mL,蒸馏水0.4ml振荡摇匀,以缓冲液作空白对照,不加酶液(以PBS代替)的反应管作为最大光化还原管,在40001ux下照光20min后立即避光迅速测定A560的值。
SOD活性=(A0-A S).V T.(0.5A O.W F.V1)-1
SOD比活力=SOD总活性.C-1
1.4.7过氧化物酶POD活力测定
愈创木酚比色法测定过氧化物酶活性,取生菜叶片样品0.5g,加入pH5.5磷酸缓冲液6mL,冰浴研磨匀浆,匀浆液转移至离心管中,4000r/min离心10min,上清液转入25ml容量瓶,沉淀物用5ml pH5.5磷酸缓冲液再提取两次,上清液并入容量瓶中,定容至刻度。
酶活性测定反应体系:2.9mL 磷酸缓冲液(pH5.5), 1.0mL 0.05mol/L愈创木酚,0.1mL粗酶液,最后加入0.1mL质量分数2% H202溶液,迅速颠倒混匀,于37℃水浴中15min,转入冰浴中,并加2.0ml20%三氯乙酸终止反应,过滤,稀释,以煮沸5min酶液代替粗酶液作为对照,测D470。
以每分钟内D470 变化0.01为1个过氧化物酶活性单位(U)
过氧化物酶活性=
1.4.8多酚氧化酶PPO活力测定
比色法测定多酚氧化酶活性,
1.4.9过氧化氢酶CAT活性测定
紫外吸收法测定过氧化氢酶活性,称取0.5克生菜叶片加入2~3ml 4℃预冷的PH=7.0的磷酸缓冲液和少量石英砂研磨,转入25ml容量瓶中,用缓冲液冲洗研钵数次,合并冲洗液,定容至刻度。
于5℃下静置10min,取上部澄清部分4000r/min离心15min,上清液为提取粗酶液~ ~ ?
,。
