乙醇脱氢酶(ADH)提取液摘要
生化实验六 酵母醇脱氢酶的提取与纯化

总活力=活力单位数/ml 酶液X总体积(ml) 比活力=活力单位数/mg蛋白=总活力/总蛋白mg
每一步总活力 酶的回收率: 第一步总活力 ×100%
实验材料、试剂和器材
材料:酵母 试剂:3.0 mol/L 乙醇 、
0.06 mol/L焦磷酸钠(pH 8.5)、 0.0015 mol/L NAD+ 、 0.01 mol/L K2HPO4、 丙酮 (预冷)、 0.066 mol/L Na2HPO4 仪器:离心机、可见光分光光度计、紫外光分光光度计、水浴锅
(四) 有机溶剂沉淀酶蛋白
在上清中按100 ml加55 ml丙酮的比例,加入 预冷丙酮,混匀,静置5 min,4℃,5000 rpm离 心5 min。弃上清,沉淀溶于5.0 ml 0.01mol/L K2HPO4中,体积为V4,取2个1 ml分别于1.5 ml 离心管中(一管用于测蛋白浓度,一管用于测酶 活力) 。
(二) 热变性去除杂蛋白
剩余的上清在55℃保温15 min,间歇搅拌,冰 浴冷却,5000 rpm离心5 min,取上清,量体积V2 ,取2个1 ml分别于1.5 ml离心管中(一管用于测蛋 白浓度,一管用于测酶活力) , 4℃保存备用, 剩余上清置冰浴中。
(三) 有机溶剂沉淀杂蛋白
将置于冰浴中上清,加上清体积一半的 预冷丙酮,混匀, 4℃静置5 min ,5000 rpm ,离心5 min,取上清,量体积V3,取2个1 ml分别于1.5 ml离心管中,4℃保存备用(一 管用于测蛋白浓度,一管用于测酶活力) , 剩余上清倒入已置于冰浴中的50 ml离心管。
考马斯亮蓝G-250与蛋白质结合,最大 吸收波长在595nm,在0~100μg/ml,吸光度 与蛋白质含量成正比。
蛋白质与G-250反应在2 min内达到平 衡,且稳定,可检测微克级的蛋白质。
解酒酶乙醇脱氢酶及乙醛脱氢酶

解酒酶乙醇脱氢酶及乙醛脱氢酶全文共四篇示例,供读者参考第一篇示例:解酒酶是一种存在于人体内的重要酶类,主要作用是帮助身体分解酒精,加速酒精的代谢过程。
乙醇脱氢酶和乙醛脱氢酶是两种与酒精代谢密切相关的重要酶类。
本文将对这两种酶进行详细介绍,探讨它们在解酒过程中的作用机制和重要性。
乙醇脱氢酶,又称为醇脱氢酶或ADH,是一种催化乙醇向乙醛转化的重要酶,存在于人体的胃、肝等器官中。
它通过氧化乙醇的过程来降低血液中乙醇的浓度,减轻身体对乙醇的不良反应。
乙醇脱氢酶的作用机制主要涉及四个步骤:乙醇被氧化为乙醛,乙醛再被氧化为乙酸,氧化反应伴随着还原辅酶NAD+还原为NADH,最终生成的乙酸通过三羧酸循环进入细胞内能量代谢途径。
乙醇脱氢酶在解酒过程中发挥着重要作用。
当人体摄入大量酒精后,血液中的乙醇浓度会迅速升高,导致中枢神经系统受损,出现头晕、恶心、昏迷等症状。
此时,乙醇脱氢酶开始发挥作用,加速乙醇向乙醛的转化过程,从而减少血液中乙醇的含量,缓解酒精对人体的毒性。
乙醇脱氢酶在解酒过程中具有非常重要的生理功能。
另一种与乙醇代谢相关的酶是乙醛脱氢酶,又称为醛脱氢酶或ALDH。
乙醛脱氢酶主要作用是将乙醛氧化为乙酸,进一步降低血液中乙醛的浓度,从而减轻酒精对身体的危害。
乙醛在人体内是一种毒性很强的物质,容易损伤细胞和器官,导致多种健康问题。
乙醛脱氢酶通过氧化乙醛产生的乙酸与三羧酸循环相结合,将乙醇完全代谢成水和二氧化碳,减少了对身体的损害。
乙醛脱氢酶在解酒过程中也扮演着重要的角色。
乙醛是一种对人体有害的物质,会导致头痛、眩晕、呕吐等不适症状。
乙醛脱氢酶能够加速乙醛向乙酸的转化,将有害的乙醛代谢成对身体无害的乙酸,从而缓解酒精对身体的损害。
乙醛脱氢酶也参与了酒精代谢的整个过程,帮助身体更有效地清除酒精,恢复健康状态。
乙醇脱氢酶和乙醛脱氢酶是两种与解酒密切相关的重要酶类。
它们通过促进乙醇和乙醛的代谢过程,加速酒精在体内的清除,减少对身体的损害。
醋酸杆菌醇脱氢酶粗酶液的特性研究

氢 酶进 行 初 步 的 分 离纯化 , 研 究其 酶 学特 性 。结 果 表 明 : D 比 活 力从 粗 酶 液 的 02 1 / 提 高到 040Um , 并 A H . mg 0 U . / g 6
纯化 倍 数 为 229 其 最适 作 用 p . ; 8 H值 为 75 8 ,H值 为 78时 酶 活 力 达 到 最 大 ,H 值 为 7 . .p ~0 . p . 0时酶 较 为 稳 定 ; 适 作 最
ac h ld rn t e fr n ain wih a ei cd b cei .ADH r m c t b c e p lo o u gh e me tto t c tc a i a tra i fo A eo a tr s .CCT CC 0 0 s M2 9 61 wa p ma l e a ae n p r e y te atn u t o t mmo i m uf t s p e i i n,a d is i i r r y s p r td a d u f d b h s l g o t meh d wi a i i i h n u s lae a r cpt t n t a p o ete r t de .Th e u t h we h tte ADH cii s i rv d fo 02 mg o r d rp riswe e su id e r s ls s o d t a h a t t wa mp o e m .01 U/ fc u e vy r
( n d n olg f o dS in, h o u n5 2 0 , u n d n , hn ) Yig o g l eo o ce c n eh oo y S a g a iesy S ag a 0 5 G a g o g C ia C e F t 1
乙醇脱氢酶法测定血浆中乙醇

乙醇脱氢酶法测定血浆中乙醇西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)345乙醇脱氢酶法测定血浆中乙醇伏建峰,史清海,路西春,高华,丁艳萍(兰州军区乌鲁木齐总医院,新疆乌鲁木齐830000)论着?摘要:目的:建立一种快速测定血浆中乙醇浓度的新方法.方法:选用三(羟甲基)氨基甲烷一盐酸(Tris—HCL)作为缓冲体系,在碱性条件下,乙醇脱氢酶(ADH)催化乙醇转化成乙醛,同时生成还原型辅酶I(NADH).在340Bill波长处检测吸光度的变化,对照标准计算乙醇的浓度.结果:ADH最适用量为753KU/L,辅酶I(NAD)最适浓度为60.0mmol/L,检测过程仅需90s,线性范围可达0~68.60mmol/L,变异系数(CV)为2.31%~3.25%,回收率为98.4%~101%,与美国DADE试剂盒比较具有良好的相关,^y:0.985,Y=0.987x+0.024.结论:本法测定血浆中乙醇无需除蛋白,具有快速,简便等优点,可用于自动生化分析仪及手工操作,适于临床常规运用.关键词:实验室诊断;乙醇;乙醇脱氢酶;检测;临床应用中图分类号:R446.1文献标识码:A文章编号:1o07—8622(2005)05—0345—03 Determinationofalcoholinplasmabyalcoholdehydrogenasemethod FUJian—feng,SHIQing—hai,LUXi—chun,eta1.(UrumchiGeneralHospitalofLanzhouCommand,PLA,830000,China)Abstract:0bjective:Toestablishanewmethodforrapidmeasuringalcohol(ALC)inplasma. Methods:(hydroxymethy1)aminomethane—hydrochloride(Tris—HCL)burwasusedinthisstudy.Intheconditionofalkalescence,alcoholdehydrogenase(ADH)catalyzedtheoxidationofALCtoacetaldehyd e,withthesimultaneous productionofdeoxidizednicotinamideadeninedinucleotide(NADH).Thevarianceofabsor bancewasdeterminedbyafilterof340nm.TheconcentrationofALCwascalculatedaccordingtothestandard.Resul ts:ThemostadaptquantityofADHwas753KU/L.andthebestconcentrationoftheNADwas60.0mmoL/L.Itco stonly90Sinthewholereaction.Therangeoflinearitywasfromzeroto68.60mmo1/L.Thecoemcientofva riationfCVindifferentconcentrationswasfrom2.31%to3.25%.Therecoveryraterangedfrom98.4%to10 1%.ComparedwithDADE(America)reagentsmethod,theregressionequationwasobtained.Conclusion: ThisADHmethodfor measuringtheconcentrationofALCinplasmaisrapidandsimplewithoutremovingprotein.I tcouldbeusedboth automaticallyandmanuallyandsuitableforclinicalapplication.Keywords:Laboratorydiagnosis;Alcohol;Alcoholdehydrogenase;Testing;Clinicalappli cation饮酒过量可引起以神经精神症状为主的疾病,称为酒精中毒(alcoholpoisoning)或乙醇中毒(etha.nolpoisoning)….一次饮用大量酒类饮料会对中枢神经系统产生先兴奋后抑制作用,重度中毒可使呼吸,心跳抑制而死亡.鉴于酒精中毒的后果严重,所以迅速测定血浆中乙醇浓度,对早期诊断和处理急性酒精中毒具有非常重要的f临床价值.作者报道一种新的酶终点法测定血浆中乙醇浓度,无需除蛋白,收稿日期:2005—06—23作者简介:伏建峰(1967一),男,副主任技师,Tel:0991—4992736, Email:****************整个检测过程仅需90S,可用于自动生化分析仪及手工操作,适于临床常规运用.1原理选用三(羟甲基)氨基甲烷一盐酸(s—HCL)作为缓冲体系,在碱性条件下,乙醇脱氢酶(ADH)催化乙醇转化成乙醛,同时生成还原型辅酶I(NADH).在340nm波长处检测吸光度的变化,对照标准计算乙醇的浓度.2材料与方法2.1试剂:ADH,辅酶I(NAD)为Sigma产品,三(羟甲基)氨基甲烷(Tris)为国产分析纯.试剂I:346西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)ADH16.8mg溶于10ml重蒸水.试剂II:NAD238.8mg溶于6ml重蒸水.试剂III:Tris10.70g溶于1O0ml重蒸水,检{贝0前与0.1mol/LHCL按5:1(V/V)混合.2.2标准液:分别加入100,200,300和400Ixl无水乙醇到50ml蒸馏水中,制备出的标准液浓度分别为17.15,34.30,51.45和68.60mmol/L,储存于具塞容器中备用.2.3混合血浆制备:采集40位健康体检者肘部静脉血各2ml,NaF抗凝,离心后制备混合血浆.2.4标准血浆:分别加入20,40,60,80l无水乙醇到10ml混合血浆中,混匀.制备出的标准血浆浓度分别为17.15,34.30,51.45和68.60mmol/L,以1m1分装,一20~C储存备用.2.5仪器:XL型生化分析仪(美国杜邦).2.6自动分析参数:反应类型:终点法;反应温度:37~C;波长:340nm(主)/380nm(次);样品3l,试剂I25l,试剂II130Ixl,试剂III340Ixl;反应时间:90s.3实验与结果3.1ADH用量的选择:取ADH(单位:KU/L)活性分别为:27,54,108,215,323,430,538,645,753,860,968的酶工作液分别测定高浓度(51.45retool/ L)的乙醇标准液,图1结果表明,ADH用量在753 KU/L以上最适.3.2NAD浓度选择:在pH10.5,ADH为753KU/L条件下,观察NAD浓度(mmol/L)为10,20,30,40,5O,6O,7O,8O,9O时对反应进程的影响,NAD最适浓度为60.0retool/L.3.3缓冲体系的选择:配制pH9~11的各种缓冲液:甘氨酸一NaOH,KH2PO4一K2HPO4,Na2CO3一NaHCO和Tris—Hcl等,在相同条件下,观察其对反应进程的影响,riffs—Hcl较为适宜.3.4缓冲液浓度及pH的选择:分别配制pH为:8.0,8.5,9.0,9.5,10.0,10.5,11.0的Tris—Hcl溶液,结果显示pHlO.5时较为适宜,同时确定Tris浓度为882.9mmoL/L.3.5反应动力学曲线:选择低,中,高(17.15,34.30,68.6mmol/L)三个不同浓度标准血浆,用本法在XL上观察反应进程,图2结果表明,不同浓度的样品60s内吸光度上升最快,70~80s曲线平缓, 90s后吸光度基本一致,因此选择90s为反应终点时间图2ADH法检测三个不同乙醇浓度标准血浆反应进程曲线3.6线性范围:取浓度为0,17.15,34.30,51.45,68.60mmol/L的标准血浆用本法测定,乙醇在0~68.60rnmol/L范围内线性良好.3.7精密度试验:选择低,中,高(17.15,34.30,51.45mmol/L)三个不同浓度标准血浆,用本法重复测定20次,批内变异系数分别为3.25%,2.31%和2.40%.3.8回收试验::在已知乙醇浓度为20,0rnmol/L的标本内分别加入低,中,高三种浓度(17,15,34.30,51.45rnmol/L)的乙醇标准液,回收率分别为1O0%,101%及98.4%.3.9干扰试验:将同体积蒸馏水和同体积不同浓度的干扰物,分别加入到等体积的混合血浆中,前者为对照样品,其余为含不同浓度干扰物质的检测样品,每个样品重复测定5次,取均值.检测样品与对照样品比较,偏差<±5%,说明该浓度物质对检测无显着干扰.测定结果显示,本法至少能去除30mmol/L的乙醛.此外,胆红素<500ixmol/L,血红蛋白<5g/L,甘油三脂<10.0mmol/L时,测定结果未见明显干扰.3.1O对比试验:选取40份不同乙醇含量的血浆分别用本法与美国DADE试剂盒对比测定,结果经回归分析::0.985,Y:0.987x+0.024.3.1l临床应用:健康体检且无饮酒习惯者40例,清晨空腹采血,用本法测定血浆乙醇含量,结果0西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)347 mmoL/L36例,0.5~1.5mmoL/IA例;交通管理部门送检疑有酒后驾车者27例,血浆乙醇浓度在l0.8—39.0mmol/L,平均为21.4mmol/L,其中24人最终承认饮过酒;酒后反应迟钝并呕吐者8例,血浆乙醇浓度为20.5~39.7mmol/L;酒后昏迷者3例,血浆乙醇浓度分别为55.2,59.1和62.8mmol/L.4讨论ADH法检测乙醇最早由Hadjiioanno提出并沿用至今,传统方法需除蛋白,且反应时间较长(约300s),由于乙醇极易挥发,很难确保其检测的准确性.本法选择Tris—HCL作为缓冲体系,加之选用高活力的ADH,促使样品中有限的乙醇快速转化成乙醛,整个检测过程仅需90s且不用除蛋白,经方法学评价,各项指标均较为满意:线性范围可达0~68.60mmol/L,变异系数(CV)为2.31%~3.25%,回收率为98.4%~101%,与美国DADE试剂盒比较具有良好的相关.ADH工作环境为碱性,甘氨酸一NaOH,KH2PO4一K2HPO4,Na2CO3一NaHCO3和Tris—Hcl 等缓冲体系均可选用.在我们的实验中,甘氨酸一NaOH,KH2PO一K2HPO缓冲体系不甚理想;Na2CO3一NaHCO3和Tris—Hcl缓冲体系较为理想, 由于Na2CO,一NaHCO,缓冲液容易结晶,不利于存储,作者选择Tris—Hcl作为缓冲体系,该缓冲体系含有两性离子,有利于发挥酶的活力.不同文献报道的ADH的最适pH值也有很大差别,范围大致为8.8~10.9L2"J,可能由试验条件及ADH的来源不同所致,作者所选用ADH来自酵母,在本试验条件下,ADH的最适pH值为l0.5.乙醛是乙醇的氧化产物,其产量增多可抑制ADH的活性,试验中当乙醛浓度达30.0mmol/L时,仍未见其对ADH有明显的抑制作用,推测可能是s—Hcl和乙醛结合生成一种复合物,且此反应不可逆,使乙醛迅速被移走,反应得以快速进行.酶法自动分析已经普及,血中乙醇的酶学测定法分为两种:乙醇氧化酶法和ADH法.乙醇氧化酶法的试剂组成简单,缺点是特异性差,甲醇对测定干扰很大,可出现假阳性.ADH法相对特异,受甲醇或异丙醇的干扰极小,此外ADH较乙醇氧化酶更易得到且成本较低,因此ADH法更适宜常规操作,易于推广应用.参考文献:[1]BishopML,Duben—EngelkirkJL,FodyEP.Clinical chemistry[M].FourthEdition,PhiladelphiaUSA:Lippin. cottWilliamsWilkins,2000.508—610.[2]胡建强,刘凤兰.血清乙醇脱氢酶活性测定及其临床应用[J].天津医科大学学报,2001,7(1):110—111.[3]陈金来,刘毅,郭妹,等.酶法血清乙醇测定试剂盒的初步评价及临床意义[J].天津医科大学学报,2002,8 (4):506—508.[4]1wamotoR,KubotaH,HosokiT,eta/.Completeaminoacid sequenceandcharacterizationofthereactionmechanismofa glucosamine—inducednovelalcoholdehydrogenasefrom Agrobacteriumradiobacter(tumefaciens)[J].ArchBio. chemBiophys,2002,398(2):203—212.[5]张红霞,邓振华,谢娜,等.酒后驾车血液呼气中乙醇检测方法评价[J].刑事技术,2003,5:36—39.《西北国防医学杂志》征订启事<西北国防医学杂志=》为兰州军区联勤部卫生部主办的国,内外公开发行的综合性医药卫生学术性期刊,是"中国科技论文统计源"期刊,已被<中国科学引文数据库》等国内重要数据库收录,也被美国化学文摘(CA)和俄罗斯文摘杂志(JA)收录,刊出省部级以上各类基金资助论文及获奖论文占有较高比例,多次在军内外期刊质量评比中获奖.本刊刊登军内外医务工作者有关基础医学,临床医学,军事医学,文献综述,讲座,护理,卫生科技管理等方面的学术文章.主要栏目有:述评,论着,临床研究,高原医学,经验交流,护理,综述,讲座,卫生行政等.我们希望本刊能对广大医务工作者有所裨益,并热切欢迎对我刊给予扶持和指导.<西北国防医学杂志》(前身为<兰后卫生=》),1979年创刊,2002年改为双月刊,大16开本,80页,逢双月末出版,每期定价10.0o元.<西北国防医学杂志>国内邮发代号54—101,欢迎在当地邮局订阅,也可直接向编辑部订阅,全年70.0o元(含邮费).编辑部地址:兰州市小西湖西街98号;邮政编码:730050联系电话:(0931)8975420;E—mail:************。
酒精在细胞内的代谢过程

酒精在细胞内的代谢过程酒精是一种常见的化学物质,也是一种广泛使用的饮料成分。
当我们饮用含有酒精的饮料时,它会进入我们的体内,并在细胞内发生代谢过程。
本文将详细介绍酒精在细胞内的代谢过程。
酒精的代谢主要发生在肝脏中。
当我们饮用酒精时,它首先进入胃和小肠,并通过血液循环被输送到肝脏。
在肝脏内,酒精会经历三个主要的代谢步骤:氧化、还原和解酶。
第一个步骤是氧化。
酒精首先被酒精脱氢酶(ADH)氧化成乙醛。
这是一个重要的步骤,因为乙醛是一种有毒物质,它会对细胞产生损害。
然而,肝脏中的醛脱氢酶(ALDH)可以将乙醛进一步氧化为乙酸,这是一种相对较为无害的物质。
第二个步骤是还原。
在肝脏中,乙酸可以通过还原反应转化为乙醇。
这个过程是由乙醇脱氢酶(ADH)完成的。
乙醇脱氢酶将乙酸还原为乙醇,这是酒精的一种形式。
这个过程可能是为了回收能量,因为乙醇可以通过酶的作用进一步产生ATP,从而为细胞提供能量。
第三个步骤是解酶。
在肝脏中,乙醇可以通过解酶系统进一步代谢。
解酶系统包括细胞色素P450酶和醛脱氢酶。
细胞色素P450酶能够将乙醇转化为乙醛,而醛脱氢酶则将乙醛进一步氧化为乙酸。
这些酶的作用是为了将乙醇代谢为无害的乙酸,以便进一步排出体外。
酒精的代谢速度是一个个体差异很大的过程。
一般来说,肝脏每小时可以代谢约7克到10克的纯酒精。
然而,这个速度会受到多种因素的影响,包括个体的性别、体重、饮酒速度和饮酒习惯等。
此外,长期饮酒会导致肝脏中酶的表达水平发生改变,从而影响酒精的代谢速度。
尽管酒精在体内的代谢过程是相对复杂的,但我们必须认识到酒精对身体的负面影响。
酒精代谢产生的乙醛是一种有毒物质,它可以对细胞产生损害,并引起多种健康问题,如肝脏疾病、胃炎和神经系统问题等。
因此,适度饮酒是非常重要的,过量饮酒可能会对身体造成严重的损害。
酒精在细胞内的代谢过程主要发生在肝脏中,包括氧化、还原和解酶等步骤。
这些代谢过程旨在将酒精代谢为无害的物质,以便进一步排出体外。
乙醇体内的代谢过程

乙醇体内的代谢过程乙醇(酒精)是一种常见的中枢神经系统抑制剂,广泛用作消毒剂、溶剂和饮品。
在人体内,乙醇经过一系列代谢过程进行消化和排泄。
本文将介绍乙醇在体内的代谢途径、影响因素以及潜在的健康影响。
1. 乙醇的摄入和吸收乙醇主要通过口腔、胃和小肠进行摄入。
在胃中,大约20%的乙醇被胃黏膜直接吸收,其余80%则通过小肠壁进入血液循环。
2. 乙醇的主要代谢途径2.1 酒精脱氢酶(ADH)通路大部分乙醇在肝脏中发生代谢。
首先,乙醇被乙醇脱氢酶(ADH)催化转化为乙醛。
这个过程产生一个氧化还原反应,并消耗辅因子NAD+,使得NAD+转变为NADH。
2.2 乙醛脱氢酶(ALDH)通路乙醛进一步被乙醛脱氢酶(ALDH)催化转化为乙酸。
这个过程同样伴随着一个氧化还原反应,并消耗NAD+,使得NAD+再生。
2.3 微粒体通路在肝细胞的微粒体中,存在另一种代谢途径,即通过细胞色素P450酶系统将乙醇氧化为乙醛。
2.4 其他代谢途径除了肝脏中的代谢外,部分乙醇还可在胃、肺、肾和大脑等组织中发生代谢。
3. 乙醇代谢的影响因素3.1 酒精浓度乙醇摄入量越高,血液中的乙醇浓度就越高。
高浓度的乙醇会增加ADH和ALDH的活性,导致更快的代谢速率。
3.2 饮食因素摄入食物可以减缓乙醇吸收速率,并降低血液中的峰值浓度。
此外,一些食物中的成分,如蔬菜和水果中的维生素C,可以增加ADH和ALDH的活性,促进乙醇代谢。
3.3 性别差异女性相对于男性来说,在相同剂量的乙醇摄入下,血液中的乙醇浓度更高。
这是因为女性体内相对较少的水分和较低的肝酶活性导致乙醇代谢速率较慢。
3.4 遗传因素个体间存在遗传差异,某些人可能具有较高的ADH和ALDH活性,从而更快地代谢乙醇。
这些差异可能影响一个人对乙醇耐受性和易感性。
4. 乙醇代谢与健康影响4.1 酒精代谢产物与毒性乙醛是一种有毒物质,可以损害细胞结构和功能。
长期大量饮酒可导致肝脏疾病、胃肠道疾病、神经系统损伤等健康问题。
乙醇脱氢酶(ADH)提取液

乙醇脱氢酶(ADH)提取液简介:乙醇脱氢酶(Alcohol dehydrogenase,ADH)的系统名为乙醇:辅酶I 氧化还原酶(alcohol:NAD+oxidoreductase),大量存在于人和动物肝脏、植物及微生物细胞之中,是一种含锌金属酶,具有广泛的底物特异性。
乙醇脱氢酶够以烟酰胺腺嘌呤二核苷酸(NAD)为辅酶,催化伯醇和醛之间的可逆反应:CH3CH2OH+NAD+→CH3CHO +NADH+H+。
在人和哺乳动物体内,乙醇脱氢酶与乙醛脱氢酶(ALDH)构成了乙醇脱氢酶系,参乙醇脱氢酶与体内乙醇代谢,是人和动物体内重要的代谢酶。
作为生物体内主要短链醇代谢的关键酶,它在很多生理过程中起着重要作用。
丙酮酸脱羧酶(PDC)、乙醇脱氢酶(ADH)是乙醇发酵途径的关键酶,无氧呼吸途径代谢产物的过程积累对细胞产生毒性,影响线粒体结构和三羧酸循环的相关酶活性。
Leagene 乙醇脱氢酶(ADH)提取液主要用于裂解植物组织,提取样品中的乙醇脱氢酶。
该试剂仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、蒸馏水2、离心管或试管3、匀浆器或研钵4、低温离心机操作步骤(仅供参考):1、取植物组织清洗干净,切碎。
2、配制乙醇脱氢酶提取工作液:取出乙醇脱氢酶提取液和PMSF,恢复至室温,混匀,即配即用,不易久置,否则蛋白酶抑制剂PMSF 的效率会有所下降。
3、加入预冷的乙醇脱氢酶提取工作液,冰浴情况下充分匀浆或研磨。
4、离心,留取上清液即为乙醇脱氢酶粗提液,保存,用于乙醇脱氢酶的检测或其他用途。
编号名称CS0436Storage 试剂(A):乙醇脱氢酶提取液500ml4℃避光试剂(B):PMSF1ml 4℃使用说明书1份计算:组织或植物粗酶液获得率(ml)=上清液体积(ml)/组织或植物质量×100%注意事项:1、实验材料应尽量新鲜,如取材后不立即使用,应存于-20-80℃。
2、待测样品中不能含有磷酸酶抑制剂,同时需避免反复冻融。
从酵母细胞中分离纯化醇脱氢酶

从酵母细胞中分离纯化醇脱氢酶柳畅先,吴士筠,胡卫钊(中南民族大学化学与生命科学学院,武汉,430074)摘要:本文报道了从酵母细胞中提取醇脱氢酶,并进一步纯化的过程。
采用硫酸铵分级沉淀,SephadexG-100葡聚糖凝胶层析,DEAE-cellulose离子交换层析技术。
收得率为2.5%,纯化倍数为26.2。
关键词:醇脱氢酶;分离纯化;酵母菌中图分类号:O658醇脱氢酶(ADH)除了在食品等工业中的作用之外,其在科学研究和分析测定中也具有重要价值,是酶法测定乙醇或乙醛含量的工具酶。
沉淀法和层析法至今仍是广泛采用的分离蛋白质和酶的重要手段[1]。
国内外在这方面的研究从20世纪70年代以来有很大进展,各种类型的层析技术用于生物大分子的分离,并得到迅速发展。
用离子交换层析、亲和层析等方法分离纯化ADH 和其它蛋白质[2~5],经过4~5个纯化步骤后,纯化倍数可达100多倍。
我国在酶的分离纯化技术上,酶制品的活性程度上,与国际先进水平相比还有较大的差距。
所以对于酶分离纯化技术的研究,具有重要的意义。
我们从酵母细胞中分离出醇脱氢酶,并通过硫酸铵分段盐析、凝胶层析以及离子交换层析对该酶进行纯化,用较少的步骤得到了相对高的纯化倍数。
1实验部分1.1 仪器、试剂、菌种及培养基HYA型恒温摇床;LRH-250-G型光照培养箱;GL-20B型高速冷冻离心机(中国科学院武汉科学仪器厂);78-1型磁力加热搅拌器(杭州仪表电机厂)。
硫酸铵;Sephadex G-100(Promega公司);DEAE-cellulose;牛血清白蛋白[BSA](上海伯奥生物科技公司);三羟甲基氨基甲烷[Tris](北京化学试剂公司);氧化型烟酰胺腺嘌呤二核苷酸[NAD](武汉中健科技发展有限公司)。
酵母菌;牛肉膏蛋白胨液体培养基;琼脂斜面培养基。
1.2 实验方法1.2.1 菌体培养将酵母菌种接种于斜面培养基中,37℃培养24h后,再将菌种接种于液体培养基中,在恒温摇床37℃培养10h。
啤酒废酵母中乙醇脱氢酶提取工艺的研究

摘 要 : 以废 弃 的 啤 酒 酵母 为 原料 , 用超 声辅 助 的 方 法对 其 中的 ADH 进 行 了提 取 . 采 实验 考 察 了料 液 比 、 酒酵母 用量 、 H、 声波 功 率 、 声 全 程 时 间 和提 取 液 浓度 对 ADH 提 取 效 果 啤 p 超 超 的影 响 , 进一 步通 过 I 3 ) 交 试 验 对 ADH 的提 取 工 艺进 行 了优 化 , 到 了啤 酒 废 酵母 中 (。 正 得
应 5mi , 即 置于 沸水 中灭活 , 3 0n 波 长处 检测 吸 光 度值 . 白对 照 用 蒸 馏 水代 替 加 NAD 其余 n立 于 4 m 空 ,
均相 同.
ADH 酶 活 力 ( mI) 义 : ADH 在 3 ℃ 每 分 钟 氧 化 乙 醇 脱 氢 生 成 乙 醛 , 还 原 N 为 U/ 定 将 7 即 AD NADH, 3 0n 处测 定 的 吸光 度变 化 0 0 1作 为一 个活 力单 位 ( . 在 4 m .0 U) 1 2 2 ADH 的提 取 方法 . .
* 收 稿 E期 :0 7 9 1 t 2 0 —0 — 7
作 者 简 介 : 跟 年 ( 2 , , 西 省 泾 阳县 人 , 授 , 究 方 向 : 物 制 药 毛 1 6 一) 男 陕 9 教 研 生
维普资讯
・4 ・ 2
陕 西 科 技 大 学 学 报
1 2 3 AD 提取 工艺 的单 因素 实验 . . H
在 ADH 提 取实验 中 , 固定其 他 条件 , 以提 取 液 中 ADH 活 力 为 指标 , 分别 对 料 液 比 、 品处 理 量 、 样 提 取液 p 超 声波 功率 、 H、 超声 全 程时 间和 提取 液浓 度进 行考 察 , 以确定 各影 响 因素 的适 宜水 平.
实验酵母醇脱氢酶的提纯及其性质的研究报告

实验三酵母醇脱氢酶的提纯及其性质的研究醇脱氢酶(ADH)是生物体内重要的氧化还原催化剂之一,在生物催化、生物医学领域都有较为广泛的应用。
生物体内的很多醇类代谢都是通过醇脱氢酶催化完成的。
醇脱氢酶来源广泛,种类繁多,可按肽链长度分为短链、中链、长链醇脱氢酶,所含肽链氨基酸残基数分别为250、375和600~750,酵母醇脱氢酶(YADH)是其中研究和应用最为广泛的一种。
酵母醇脱氢酶以NAD+/NADH为辅酶,可逆催化醇和醛/酮之间的氧化还原反应。
酵母醇脱氢酶为四聚体,单个亚基肽链含347个氨基酸残基,亚基相对分子质量为35 000。
(一)酵母醇脱氢酶的提纯一、实验目的1. 学习和掌握醇脱氢酶提纯的原理和方法;2. 掌握醇脱氢酶活力的测定方法。
二、实验原理以酵母为原料,利用热变性、有机溶剂沉淀蛋白质等方法,提取具有一定纯度的酵母醇脱氢酶。
在提纯过程中,每经一步提纯处理,都需测定酶蛋白质含量和活力,并计算得比活力(本实验中比活力=活力单位数/mg蛋白质)。
唯有比活力提高了,才证明所用提纯措施有效,酶制剂的纯度提高了。
醇脱氢酶的辅酶NAD(以NAD为辅酶的醇脱氢酶,它只作用于一级醇、二级醇和半缩醛脱氢酶,动物醇脱氢酶还能催化环一级醇脱氢,酵母醇脱氢酶无此活力。
另有以NADP为辅酶的醇脱氢酶,它只作用于一级醇。
),它能催化乙醇脱氢变成乙醛,脱下的氢则使NAD+还原。
CH3CH2OH+NAD+→CH3CHO+NADH+H+当有过量的醇存在时,NAD+ 被还原的速度与酶活力成正比,酶活力愈高,单位时间产生的NADH愈多。
NADH对340nm紫外线有较强吸收,NAD+ 无此能力,因此可用测定A340nm 的方法测得反应体系中NADH含量,从而得知酶活力的大小。
0本实验用Folin-酚试剂法测定蛋白质含量三、实验材料、仪器和试剂1.实验仪器:(1)干酵母粉:将鲜酵母分散成小块,放在搪瓷盘吹干。
干燥后,研磨成粉末。
乙醇脱氢酶的作用

乙醇脱氢酶的作用乙醇脱氢酶(Alcohol dehydrogenase,简称ADH)是一种重要的酶类,在生物体内发挥着重要的作用。
它主要参与乙醇代谢的过程,将乙醇氧化为乙醛,是人体中降解乙醇的关键酶。
乙醇是我们日常生活中常见的饮酒成分,也是一种有害物质。
当我们饮酒后,乙醇会进入体内,通过呼吸、尿液和汗液排出,其中最主要的代谢途径就是通过肝脏中的乙醇脱氢酶进行氧化代谢。
乙醇脱氢酶能够催化乙醇氧化成为乙醛,生成的乙醛再进一步氧化成为乙酸,最终通过三羧酸循环代谢成二氧化碳和水。
在人体中,乙醛是一种有毒物质,会对身体造成伤害,而ADH的作用就是将乙醇迅速氧化为乙醛,避免乙醇在体内过度积累。
乙醛虽然也是有害的,但其毒性远远小于乙醇,同时乙醛还可以通过乙醛脱氢酶进一步代谢为乙酸,从而减少对身体的损害。
乙醇脱氢酶的活性受多种因素的影响,如遗传因素、环境因素、营养因素等。
在一些人体内,ADH的活性较高,可以更快速地代谢乙醇,因此他们能够更好地承受饮酒带来的影响。
而在另一些人体内,由于ADH活性较低,乙醇代谢较慢,容易出现乙醇中毒的情况。
除了在乙醇代谢中的作用外,乙醇脱氢酶还参与了其他一些生物体内的代谢过程。
例如,在植物中,ADH参与了植物的生长和发育过程,对植物的逆境适应性起着重要作用。
此外,乙醇脱氢酶还在一些微生物中发挥着重要作用,参与了微生物的代谢途径,对微生物的生长和繁殖起着关键作用。
总的来说,乙醇脱氢酶作为一种重要的酶类,在生物体内发挥着重要的作用。
它不仅参与了乙醇代谢的过程,还在其他生物体内代谢过程中发挥着重要作用。
对于人类健康和生物体内代谢平衡来说,乙醇脱氢酶的作用至关重要,我们应该加强对其研究,更好地了解其作用机制,为人类健康和生物科学研究提供更多的帮助。
酵母醇脱氢酶实验报告

0.1
0.079
0.05
0.037
0
0
0
0.1
0.2
结合标准曲线数据整理结果为:
y
0.187 0.3
0.241 0.4
2015 年 3 月-6 月 0.275
0.5
0.6
结论:最终酶制剂的比活力提高了四倍多,提纯确实有效。
8
南京大学生科院 13 级
酵母醇脱氢酶的相关研究
2015 年 3 月-6 月
结论:有酶活力的是 6 号管。酶活力为 11.5U,比活力为 284U。比 活力又有一些提高,层析有些效果。
11
南京大学生科院 13 级
酵母醇脱氢酶的相关研究
2015 年 3 月-6 月
实验三:酵母醇脱氢酶的专一性
一、目的
了解醇脱氢酶的专一性。
二、原理
用不同的醇(乙醇、正丙醇、甲醇)作底物,观察醇脱氢酶的专一性。 反应方程式:
5、收集与侧定 用部分收集器收集洗脱液,每管 4m1.紫外检侧仪 280 处检测。记录吸收值,绘 制洗脱曲线. 本实验在用 280nm 检侧的同时需测定酶的活力大小,收集 280nm 峰和活力峰 重叠的区域.将收集液反复冷冻干燥得纯的酵母醇脱氢酶,用实验二的方法测定酶 的比活力.
六、结果
实验数据记录如下图:
醇脱氢酶的辅酶 NAD 它能催化乙醇脱氢变为乙醛,脱下的氢则使 NAD+还原. 当有过量醇存在时,NAD+被还原的速度与酶活成正比,酶活力越高,单位时间产 生的 NADH 越多.NADH 对 340nm 紫外线有较强的吸收. NAD+无此能力.因此可用 测定 A340 的方法测得反应体系中 NADH 含量,从而得知酶活力的大小。
酒精代谢实验报告

一、实验目的1. 了解人体酒精代谢的基本过程。
2. 掌握酒精代谢过程中相关酶的作用。
3. 探讨不同因素对酒精代谢的影响。
二、实验原理人体内酒精代谢主要通过肝脏进行,主要由两种酶催化:酒精脱氢酶(ADH)和乙醛脱氢酶(ALDH)。
酒精在ADH的催化下,首先被氧化成乙醛,然后乙醛在ALDH 的催化下进一步被氧化成乙酸,最终乙酸被转化为二氧化碳和水,从而完成酒精的代谢。
三、实验材料与仪器1. 实验材料:- 酒精(体积分数为50%)- 乙醛(体积分数为10%)- 酒精脱氢酶(ADH)- 乙醛脱氢酶(ALDH)- pH试纸- 氧化酶- 水浴锅- 移液器- 试管- 离心机2. 实验仪器:- pH计- 光度计- 热水浴- 冰箱四、实验步骤1. 将50%的酒精溶液稀释至一定浓度,作为实验用酒精。
2. 将乙醛溶液稀释至一定浓度,作为实验用乙醛。
3. 分别设置两组实验,一组为对照组,另一组为实验组。
4. 对照组:向试管中加入一定量的稀释酒精溶液,用pH试纸检测其pH值。
5. 实验组:向试管中加入一定量的稀释酒精溶液,再加入适量的ADH和ALDH,用pH试纸检测其pH值。
6. 观察并记录两组实验的pH值变化。
7. 将实验组试管中的溶液离心,取上清液,用氧化酶检测其中的乙醛含量。
8. 将实验组试管中的溶液再次离心,取上清液,用光度计检测其中的酒精含量。
9. 比较对照组和实验组的pH值变化、乙醛含量和酒精含量。
五、实验结果与分析1. 对照组实验结果显示,酒精溶液的pH值随着时间逐渐降低,说明酒精在人体内代谢过程中,会产生酸性物质。
2. 实验组实验结果显示,酒精溶液的pH值在加入ADH和ALDH后,降低速度明显减慢,说明ADH和ALDH对酒精代谢过程有催化作用。
3. 氧化酶检测结果显示,实验组上清液中的乙醛含量明显低于对照组,说明ADH 和ALDH在酒精代谢过程中,将乙醛转化为乙酸,减少了乙醛的积累。
4. 光度计检测结果显示,实验组上清液中的酒精含量明显低于对照组,说明ADH 和ALDH在酒精代谢过程中,将酒精转化为乙醛,减少了酒精的积累。
小鼠乙醇脱氢酶(ADH)说明书
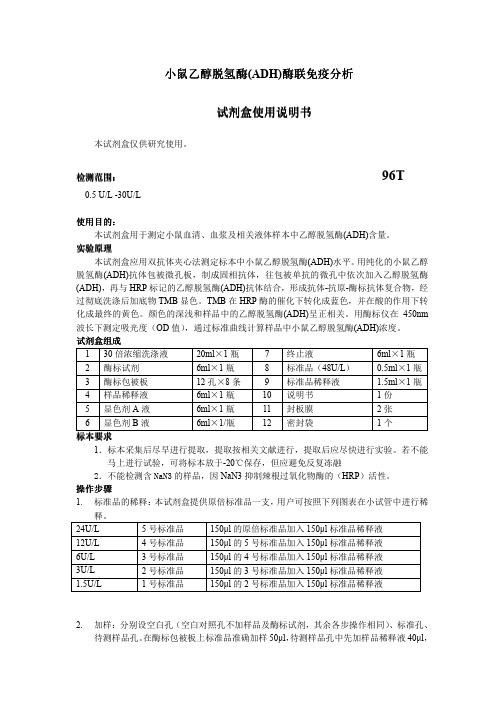
小鼠小鼠乙醇脱氢酶乙醇脱氢酶(ADH)酶联免疫酶联免疫分析分析分析试剂试剂盒使用说明书盒使用说明书盒使用说明书本试剂盒仅供研究使用。
检测范围检测范围:: 96T0.5 U/L -30U/L使用目的使用目的::本试剂盒用于测定小鼠血清、血浆及相关液体样本中乙醇脱氢酶(ADH)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中小鼠乙醇脱氢酶(ADH)水平。
用纯化的小鼠乙醇脱氢酶(ADH)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入乙醇脱氢酶(ADH),再与HRP 标记的乙醇脱氢酶(ADH)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的乙醇脱氢酶(ADH)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠乙醇脱氢酶(ADH)浓度。
试剂盒组成 1 30倍浓缩洗涤液 20ml ×1瓶 7 终止液6ml ×1瓶 2 酶标试剂 6ml ×1瓶 8 标准品(48U/L ) 0.5ml ×1瓶 3 酶标包被板 12孔×8条 9 标准品稀释液 1.5ml ×1瓶 4 样品稀释液 6ml ×1瓶 10 说明书 1份 5 显色剂A 液 6ml ×1瓶 11 封板膜 2张 6显色剂B 液6ml ×1/瓶12密封袋1个标本标本要求要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP )活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
24U/L 5号标准品 150µl 的原倍标准品加入150µl 标准品稀释液 12U/L 4号标准品 150µl 的5号标准品加入150µl 标准品稀释液 6U/L 3号标准品 150µl 的4号标准品加入150µl 标准品稀释液 3U/L 2号标准品 150µl 的3号标准品加入150µl 标准品稀释液 1.5U/L1号标准品150µl 的2号标准品加入150µl 标准品稀释液2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
人类乙醇脱氢酶基因型鉴定实验报告

人类乙醇脱氢酶基因型鉴定实验报告人类乙醇脱氢酶基因型鉴定实验报告酒精是一种常见的神经系统抑制剂,它会让人产生感觉的放松和愉悦,并且也会增加人们对危险和冒险的倾向。
然而,在接触酒精时,每个人的反应可能会存在差异,这是因为乙醇代谢速率的遗传变异可能会影响个体对酒精的敏感性和酒精耐受能力。
因此,研究乙醇代谢的相关基因变异可以为精准的药物治疗和预防酒精滥用提供重要的指导和支持。
本实验旨在通过检测人类乙醇脱氢酶(ADH)的基因型,探索ADH基因多态性对酒精代谢能力的影响,并为相关药物治疗提供参考。
实验方法本实验选取了50名年龄在18-35岁之间的健康成年人作为研究对象,均为中国汉族人。
通过采集被试者的口腔黏膜细胞,提取DNA,然后进行基因型分析。
在此基础上,分析ADH1B*1、ADH1B*2、ADH1B*3、ADH1C*1、ADH1C*2、ADH4*1和ADH4*2这7个ADH基因突变位点的基因型分布情况,并进一步分析这些基因型与乙醇代谢速率的相关性。
结果和分析实验结果表明,ADH基因突变位点的基因型频率在被试者中存在差异。
其中,ADH1B*2位点的基因型频率最高,为36%,其次是ADH1C*1和ADH1C*2位点的基因型频率,分别为26%和22%。
而ADH1B*1、ADH1B*3、ADH4*1和ADH4*2位点的基因型频率较低,分别为6%、6%、2%和2%。
进一步分析发现,ADH1B*2位点的基因型与乙醇代谢速率之间存在很大的关联性。
具体来说,该基因型的个体乙醇代谢速率较快,一般较为耐酒,容易产生饮酒后仍然保持理智和冷静的感觉。
而ADH1C*1和ADH1C*2位点的基因型与乙醇代谢速率关联性较小,可能会导致人体对酒精的摄入量有较大的差异。
结论和建议通过本实验的研究,我们可以初步认识到酒精代谢的遗传变异对人们饮酒行为的影响。
ADH基因突变位点的分布和相应基因型的差异,可能导致不同个体对酒精的代谢能力不同,甚至在同等条件下出现酒精含量差异较大的现象。
一种测定乙醇脱氢酶活性的循环催化流动分析法

一种测定乙醇脱氢酶活性的循环催化流动分析法王恒;李永生;高秀峰;田甜;林玉莲【摘要】基于乙醇(EtOH)/乙醇脱氢酶(ADH)/氧化型辅酶I(NAD+)催化反应体系,建立了一种用于ADH活性测定的循环催化流动分析法(RCFA),并优选该测定体系的实验条件,得到如下参:Tris-HCl缓冲液浓度(pH 8.9)为0.1 mol/L.EtOH的浓度为15.6 mol/L,NAD+浓度为9.0 mmol/L,ADH用量20 μL/次,反应液流速为0.98 mL/min,反应液体积为2 mL;ADH的测定范围为0.6~50 U/L,检出限为0.14 U/L,相对标准偏差≤1.3%(n=11).RCFA法具有测定过程简便、快速、自动化特点,能对ADH催化反应过程进行连续循环检测,可对ADH活性变化实现动态研究.RCFA法使反应液循环不但节省了大量的试剂和酶量、降低了测定成本,而且循环测定时不存在人为误差,提高了测定结果的准确度.【期刊名称】《酿酒科技》【年(卷),期】2010(000)010【总页数】4页(P100-102,114)【关键词】循环催化流动分析;乙醇脱氢酶;乙醇;氧化型辅酶I;酿酒酵母菌【作者】王恒;李永生;高秀峰;田甜;林玉莲【作者单位】四川大学化学工程学院,四川,成都,610065;四川大学化学工程学院,四川,成都,610065;四川大学华西基础医学与法医学院,四川,成都,610041;四川大学化学工程学院,四川,成都,610065;四川大学化学工程学院,四川,成都,610065【正文语种】中文【中图分类】TQ920.1%Q55%O65乙醇脱氢酶(Alcohol dehydrogenase,ADH)是生物体内一种重要的代谢酶,具有广泛的底物特异性[1]。
目前ADH被广泛应用,例如,ADH用于制作测定乙醇浓度的生物电极和乙醇生物传感器[2-3],酿酒发酵中ADH与乙醛脱氢酶结合为酵母菌提供能量并使细胞免受过量乙醇的毒害 [4],ADH与乙醛脱氢酶的结合用于生产食醋[5],ADH也是人体重要的生理指标之一[6-7]。
羟基类固醇脱氢酶代谢乙醇

羟基类固醇脱氢酶代谢乙醇
羟基类固醇脱氢酶是一种酶,它在生物体内参与羟基类固醇
(如胆固醇、雄二酮等)的代谢过程。
乙醇是一种常见的酒精,它
在人体内会经过代谢作用转化为乙醛和乙酸,这一过程主要发生在
肝脏中。
羟基类固醇脱氢酶在乙醇代谢中起到重要作用的原因是,
它参与调节肝脏中NADH/NAD+比值,影响乙醇代谢途径的选择。
具体来说,乙醇在肝脏内主要通过酒精脱氢酶(ADH)途径代谢,生成乙醛,然后再被乙醛脱氢酶代谢成乙酸。
然而,当乙醇摄入过
量时,肝脏中的NADH/NAD+比值升高,这会抑制乙醇代谢途径,导
致乙醇通过细胞色素P450系统氧化代谢,这一过程中羟基类固醇脱
氢酶会参与调节NADH/NAD+比值,影响乙醇的代谢途径选择。
此外,羟基类固醇脱氢酶还可能通过影响肝细胞内胆固醇的合
成与代谢,间接影响乙醇代谢。
总的来说,羟基类固醇脱氢酶在乙
醇代谢中扮演着重要的调节作用,其活性和水平可能会影响乙醇代
谢的速率和途径选择。
这对于理解乙醇代谢途径的调控机制,以及
相关疾病的发病机理具有重要意义。
大肠杆菌中乙醇生物合成途径的构建

大肠杆菌中乙醇生物合成途径的构建乙醇是一种重要的化学物质,它通常用于制造汽油和柴油等汽车燃料,也用于制造工业级的化学产品,如溶剂、医药、涂料和清洁剂。
然而,由于传统的化学方法产生的乙醇对环境造成破坏,研究人员正在寻求更加安全、可持续的乙醇合成方法。
直到近年来,生物乙醇产生的技术才逐渐实现。
近年来,生物乙醇的研究层出不穷,其中一个重要的技术是通过大肠杆菌的乙醇生物合成途径实现生物乙醇的合成。
在大肠杆菌中,有一种酶叫做乙醇脱氢酶(ADH),它可以将乙醇和氢气转化为乙醛和水。
使用这种酶,可以从碳源(如淀粉和糖)中制造乙醇。
国内外许多科学家们正在努力研究如何构建这种乙醇生物合成途径,以及如何提高乙醇合成效率。
首先,研究人员试图对现有的乙醇脱氢酶进行优化和改造,以提高其乙醇合成效率。
其中一种方法是改变乙醇脱氢酶的活性环境,比如改变水的pH值、添加化学促进剂、添加抑制剂等。
研究发现,这些环境改变可以显著地影响乙醇脱氢酶的活性,从而提高乙醇生物合成途径的效率。
另外,研究人员还利用基因工程技术对乙醇脱氢酶进行改造,以建立更加高效的乙醇生物合成途径。
通过此方法,研究人员可以根据自己的要求调节乙醇脱氢酶的表达,从而提高其合成效率。
例如,一些科学家已经通过编码小分子抑制剂来调节乙醇脱氢酶的表达,从而提高乙醇合成的效率。
另一方面,乙醇生物合成途径也可以通过基因变异和突变来实现。
这方法利用了一种叫做质粒改造(plasmid engineering)的技术,可以通过调节基因表达来改变乙醇脱氢酶的活性。
通过这一方法,研究人员可以改变乙醇生物合成的水平,从而提高乙醇合成的效率。
此外,科学家们还可以利用全基因组技术来构建乙醇生物合成途径,也就是将多个基因组织到一起,以构建一个完整的乙醇生物合成系统。
这种技术为乙醇生物合成提供了新的可能性,可以大大提高乙醇合成的效率。
综上所述,大肠杆菌中乙醇生物合成途径的构建是一个重要课题。
当前研究人员发现,在乙醇脱氢酶的优化和改造、基因变异和突变、质粒改造和全基因组技术等方面取得了很大进展,从而可以提高乙醇生物合成的效率。
乙醇脱氢酶和乙醇化学

乙醇脱氢酶和乙醇化学
乙醇,也称为乙醇醇,是一种天然的无色液体,它的化学式是
C2H5OH,有时也被称为乙醇醇,乙醛或乙醇醚。
乙醇是人类社会中重要的植物性有机物,如甘蔗、大米和橡子类植物中含有少量乙醇。
乙醇脱氢酶(ADH)是一种重要的脱氢酶活性,它可以将乙醇分解为乙醛(C2H5O),然后被进一步分解为二氧化碳和水。
研究表明,乙醇脱氢酶可以激活乙醇氧化反应,抑制乙醇的积累,从而维护血液中的乙醇浓度。
乙醇的化学反应非常复杂,可以按它们的反应类型分类。
其中,乙醇的氧化反应是其最重要的反应;其次是内分泌反应,它主要涉及乙醇与其他有机物的反应包括脱氢、还原和缩合;最后是水解反应,指乙醇与水反应形成乙醛、甲醛和其他有机物。
乙醇可作为工业原料和汽油的添加剂,也是酿造啤酒、烈酒和其他酒精饮料的主要原料之一。
此外,乙醇混合物也被广泛用于清洁汽车燃料系统,甚至可用作制冷剂。
乙醇的摄取量也与某些健康问题有关,包括肝脏受损、中枢神经系统损伤和心血管疾病。
因此,治疗病患者服药时应进行有效管理,以防止乙醇摄取过多而导致不良反应。
乙醇脱氢酶和乙醇化学在许多方面都具有重要意义。
它们在解决人类健康问题中发挥着重要作用,同时也是制造酒精饮料和其他化学品的重要原料。
因此,研究乙醇脱氢酶和乙醇化学的基础理论和应用研究对于人们的健康和社会繁荣具有重要的意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙醇脱氢酶(ADH)提取液
摘要
主要用于裂解植物组织,提取样品中的乙醇脱氢酶
产品介绍
乙醇脱氢酶(Alcohol dehydrogenase,ADH)的系统名为乙醇:辅酶I氧化还原酶(alcohol:NAD+ oxidoreductase),大量存在于人和动物肝脏、植物及微生物细胞之中,是一种含锌金属酶,具有广泛的底物特异性。
乙醇脱氢酶够以烟酰胺腺嘌呤二核苷酸(NAD)为辅酶,催化伯醇和醛之间的可逆反应:CH3CH2OH+ NAD+→CH3CHO
+NADH+ H+。
在人和哺乳动物体内,乙醇脱氢酶与乙醛脱氢酶(ALDH)构成了乙醇脱氢酶系,参乙醇脱氢酶与体内乙醇代谢,是人和动物体内重要的代谢酶。
作为生物体内主要短链醇代谢的关键酶,它在很多生理过程中起着重要作用。
丙酮酸脱羧酶(PDC)、乙醇脱氢酶(ADH)是乙醇发酵途径的关键酶,无氧呼吸途径代谢产物的过程积累对细胞产生毒性,影响线粒体结构和三羧酸循环的相关酶活性。
乙醇脱氢酶(ADH)提取液主要用于裂解植物组织,提取样品中的乙醇脱氢酶。
该试剂仅用于科研领域,不宜用于临床诊断或其他用途。
