含氮有机化合物(精选)
14含氮有机化合物
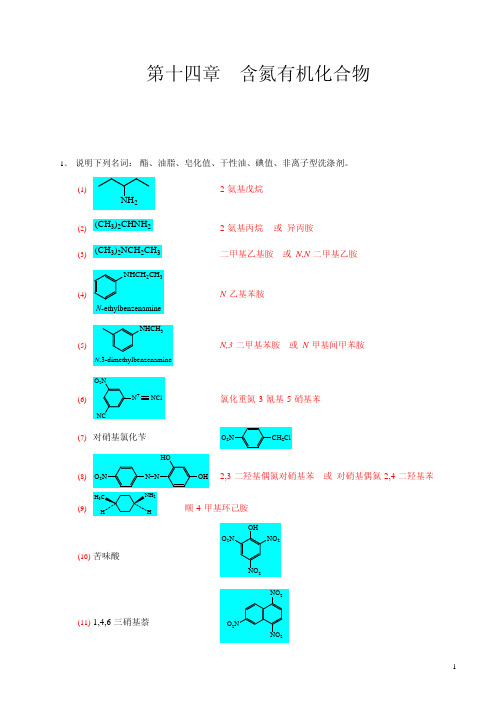
第十四章含氮有机化合物1、 说明下列名词: 酯、油脂、皂化值、干性油、碘值、非离子型洗涤剂。
(1)2-氨基戊烷NH2(2)(CH3)2CHNH2 (CH3)2NCH2CH3NHCH2CH32-氨基丙烷或 异丙胺 或 N,N-二甲基乙胺(3)二甲基乙基胺(4)N-乙基苯胺N-ethylbenzenamineNHCH3(5)N,3-dimethylbenzenamineO2NN,3-二甲基苯胺或 N-甲基间甲苯胺(6)NCN+NCl-氯化重氮-3-氰基-5-硝基苯(7) 对硝基氯化苄HOO2NCH2Cl(8)O2NH3CN=NNH2 HOH2,3-二羟基偶氮对硝基苯或 对硝基偶氮-2,4-二羟基苯(9)H顺-4-甲基环己胺OH O2N NO2(10) 苦味酸NO2NO2(11) 1,4,6-三硝基萘O2N NO212、 按其碱性的强弱排列下列各组化合物,并说明理由。
(1) 吸电子基使碱性降低,供电子基使碱性增强,所以有:O2N NH2<NH2<H3CNH2(2) 吸电子基使碱性降低,供电子基使碱性增强,所以有:CH3NH2>NH3>CH3CONH23、 比较正丙醇、正丙胺、甲乙胺、三甲胺和正丁烷的沸点高低并说明理由。
解:五种化合物中,按形成氢键的可能、能力可推知其沸点从高到低的次序是: 正丙醇 97.4 > 正丙胺 47.8 > 甲乙胺 36.5 > 三甲胺 > 正丁烷 2.5 -0.54、 如何完成下列转变: (1)CH2=CHCH2Br NaCN CH2=CHCH2CN(2)O CH3NH2 OHCH2=CHCH2CH2NH2 LiAlH4heatH2 NCH3 Pd NHCH3NHCH3(3)(CH3)C-COOH(4)SOCl2(CH3)3C-COClCH2N2(CH3)C-COCH2ClKOH CH3CH2CH2CH2Br ROH CH3CH2CH=CH2 O NNa HBr OH-, H2O CH3CH2CH(CH3)Br COONa + CH3CH2-CH-CH3 COONa NH2 O O NCH(CH3)CH2CH3 O5、 完成下列反应,并指出最后产物的构型是(R)或(S)。
有机化学 含氮有机化合物
第十三章含氮有机化合物名称结构式名称结构式氨NH3胺RNH2,ArNH2R2NH (Ar)2NHR3N (Ar)3N氢氧化铵NH4OH季铵碱R4N+OH-铵盐NH4Cl季铵盐R4N+Cl-硝酸HO-NO2硝基化合物R-NO2 Ar-NO2亚硝酸HO-NO亚硝基化合物R-NO Ar-NO13.1硝基化合物由硝酸和亚硝酸可以导出四类含氮的有机物,即硝酸酯、亚硝酸酯、硝基化合物和亚硝基化合物H O NO2 R O NO2R NO2硝酸硝酸酯(补充)硝基化合物H O N O R O N O R N O亚硝酸亚硝酸酯亚硝基化合物一、 硝基化合物的命名和结构硝酸酯和亚硝酸酯的命名与有机酸酯的命名相同,如CH 3ONO 2CH 2CH 2ONO硝酸甲酯 亚硝酸乙酯(补充)2 硝基和亚硝基化合物中将硝基和亚硝基看作为取代基CH 3NO 2NO 2CH 3NO硝基甲烷 邻硝基甲苯 对亚硝基甲苯CH 3硝酸酯和芳香多硝基化合物都有爆炸性,常被用做炸药,如CH2ONO2CHONO2CH2ONO2O2NCH3NO2NO2三硝基甘油酯2,4,6-三硝基甲苯(TNT)硝基化合物的结构,可表示为由一个N=O和一个N→O配位键组成。
OR NO电子衍射法证明,硝基中两个氮氧键长是完全相同的,CH3NO2 分子中的两个N—O键的键长均为0.122nm。
原因:硝基中氮原子以sp2杂化,三个原子形成共平面的σ键。
二、硝基化合物的性质1、物理性质颜色多为淡黄色沸点比相应的卤代烃高, 常温下为高沸点的液体或结晶固体溶解性不溶于水,易溶于有机溶剂,液体的硝基化合物是有机化合物的良好的溶剂但是因为硝基化合物有毒性,可透过皮肤被机体吸收,生产上很少采用它,例如硝基苯有剧毒;多硝基化合物有爆炸性, 如2,4,6-三硝基甲苯(TNT)为烈性炸药2、脂肪族硝基化合物的化学性质(1)脂肪族硝基化合物的酸性硝基为吸电子基团,脂肪族硝基化合物中的-氢原子很活泼,显弱酸性,可与碱作用生成盐从而溶于碱中O R CH2NOOH R CH NORCH NO NaOH [ RCHNO ] - +H O2 2 + 2 Na + 2(2)与羰基化合物的缩合反应:有α-氢的硝基化合物,在碱性条件下可与醛或酮发生缩合反应,类似于羟醛缩合。
有机化学 含氮化合物

1°硝基使卤苯易水解、氨解
O N =O
Cl
δ
O N =O
δ
Cl
Cl + NaOH
H2O
OH
200 ℃
Cl 10% NaOH 400 oC 32MPa
Cl NO2 NaOH 溶液 130 oC
OH
ONa NO2 H
OH NO2
Cl NO2 Na2CO3 溶液
100℃ NO2
ONa NO2 H
NO2
OH NO2
N-亚硝基二甲胺
• 俗称二甲基亚硝基胺(Dimethylnitrosamine, NDMA),黄色液体,可 溶于水、乙醇、乙醚、二氯甲烷。由二甲胺与亚硝酸盐在酸性条件下反 应而生成。
• 在环境中广泛存在。生产和使用NDMA的车间空气中,如轮胎厂可达 0.12-1.5μg/m3,皮革厂可达1.2-47μg/m3,火箭燃料厂为36μg/m3。在 鱼、肉等动植食品中可达0.1-300μg/kg。在烟草、蔬菜、谷类中均可检 出。属高毒。经消化道、呼吸道吸收迅速,经皮肤吸收缓慢。主要引起 肝脏损害。
NaOR
CH2N2 + (CH3)2C=CH-COCH3
HgO
(C6H5)2C=NHNH2
(C6H5)2C=N2
重氮二苯甲烷
HNO2, 0 oC
H2N-CH2CO2Et
N2=CHCO2Et
重氮乙酸乙酯
2. 重氮化合物的性质
CH2N2: 有毒气体, b.p., -24oC, 纯净状态易爆炸.大多在乙醚中使用.
O
碳烯 (carbene, 卡宾) 和类碳烯 (carbenoids)
R2C
or
碳烯 (carbene, 卡宾)的制备
有机化学 含氮有机化合物
第十三章含氮有机化合物
⑵芳环上的亲核取代反应
(i)芳环的特征反应是亲电取代反应
邻位或对位被硝基取代的芳香卤代物,由于强吸电子基硝基的影响,使苯环上的电子云密度降低,不利于亲电试剂的进攻,容易发生亲核取代反应。
Cl
NO 2
O 2N
NO 2
2NH 3
NH 2
O 2N
NO 2
NO 2
NH 4Cl
氮原子与脂肪烃基相连的是脂肪胺(R-NH 2),与芳香环直接相连的为芳香胺(Ar-NH 2)
按照分子中所含氨基的数目,有一元、二元或多元胺
注意“氨”、“胺”、“铵”字的用法,在表示基时,如氨基、亚氨基,用“氨”;表示NH 3的烃基衍生物时,用“胺”;而季铵类化合物则用“铵”。
-NH 2(氨基)、-NH-(亚氨基)
(CH3CH2)2NH CH3CH2NH CH3
N CH3N
CH3
CH3
①气相:(CH 3)3N
(CH 3)2NH CH 3NH 2NH 3
>>>(CH 3)3N (CH 3)2NH CH 3NH 2NH 3
>>>②水溶液相:
3°2°
1°3°
2°1°原因:CH 3的+I 效应使N 上电子云密度增加,与H +
的结合力增加,碱性增强。
K b ×10
5
59.542.5 6.73 1.8
(教材错误)。
有机含氮化合物

具有鉴别意义旳吸收是出现于1650~1580 cm-1区域内旳N—H 键旳弯曲振动和出现于910~650cm-1旳N—H键摇晃振动吸收峰。 脂肪伯胺旳弯曲振动吸收在1615cm-1附近,是中或强吸收;摇晃振 动吸收在910~770 cm-1内,该吸收峰宽而且强。
45
仲胺旳N—H伸缩振动只出现一种吸收峰,脂肪仲胺此峰旳吸 收强度一般很弱,芳仲胺则要强得多,且峰形锋利对称。
25
如主治感冒和咳喘旳麻黄碱,具有解痉镇痛、解有机磷中毒和 散瞳作用旳莨菪(làngdàng)碱(阿托品)等均是胺旳衍生物:
26
27
15.2.1 胺旳分类和命名
1.分类
(1)按照氮原子连接旳烃基数目不同,可把胺分为伯(1°)、仲(2°) 和叔(3°)胺。
式中旳R、R´和R˝能够是相同旳烃基,也能够是不同旳。
11
此类合成麝香称为硝基麝香,年用量约为1000 t (吨)左右, 约占目前世界上商品化人造麝香旳50%,其中葵子麝香是已知硝 基麝香中使用最广泛旳产品。许多芳香族硝基化合物能使血红蛋 白变性,所以过多地吸入它们旳蒸气、粉尘或长久与皮肤接触, 均能引起中毒。
12
在芳香族硝基化合物旳红外光谱中,因为硝基中旳氮氧键旳 不对称伸缩振动和对称伸缩振动,在1540 cm-1和1350 cm-1附近产 生两个很强旳吸收峰。C—N键旳伸缩振动吸收峰出目前870cm-1附 近。
19
(3)硝基对其邻、对位取代基旳影响
硝基是强旳吸电基,连于芳环上旳硝基不但使其所在芳环上旳 亲电取代反应较难进行,而且经过吸电旳共轭和诱导效应对其邻、 对位存在旳取代基(如—X,—OH,—COOH,—NH2等)也会产生明 显旳影响(对其间位旳取代基影响较小)。它使其邻、对位旳卤原子轻 易被亲核试剂取代。
含氮有机化合物

溶于水
(2) 用于鉴定
所有的铵盐都具有一定的熔点或分解点。
季铵碱: 碱性与氢氧化钠相当,具有很强的吸湿性
- + HCl R4N OH
季铵盐:是强酸强碱盐。
- + NaOH R4N Cl
+
+ R4N Cl- + AgOH
+
-+ HO R4N Cl 2
+
R4N +
+
Na+ +
OH + Cl
-
-
+ R4N OH + AgCl↓
第十四章
有机含氮化合物
在有机化合物中,除C、H、O三种元素外,N是第四 种常见元素。有机含氮化合物的种类很多,范围也很广,
它们的结构特征是含有碳氮键(C—N、C=N、C≡N),有
的还含有N—N、N=N、N≡N、 N—O、N=O 及N—H键
等。
本章主要讨论硝基化合物、胺类和偶氮化合物。
无机化合物 名 称 氨 结构式 胺
O O
由于键长的平均化,硝基中的两个氧原子是等同的,
:
异构现象
Ar(R)—NO2 硝基化合物 N和C相连
Ar(R)—ONO 亚硝酸酯 C和O相连 水解生成醇 和亚硝酸
化学性质不同
不水解
命名 以硝基作为取代基,烃为母体。
CH3CHCH 3
NO 2
NO 2 NO 2
H3C
NO 2
2-硝基丙烷
对硝基甲苯
8.28
7.16
4.00
0.38
(2) 对芳卤的影响
Cl
+
NaOH
H2O 200 ℃
含氮有机化合物

(一)酰胺的结构和命名
其结构通式如下:
酰胺的命名是根据酰基和氨(或胺)基的名称而称为“某酰 某胺”,并在酸胺名称前指明氮上所连的烃基。例如:
酰胺的性质: (二)酰胺的性质: 1、酸碱性: 酰胺的碱性很弱,接近于中性。(因氮原子 上的未共用电子对与碳氧双键形成P-π共轭)。
酰亚胺(酰胺氮上的另一个氢原子也被酰基取 代)显弱酸性(例如,邻苯二甲酰亚胺,能与强碱 的水溶液生成盐)。
2-甲基-4-氨基己烷
CH3 CH3 CH3-CH-CH2-CH-N-CH2-CH3 CH2-CH3
2-甲基-4-(二乙氨基)戊烷
二、 胺的性质
(一)胺的物理性质 低级胺有氨味或鱼腥味,高级胺无味。 芳胺有毒! 溶解度:低级胺可溶于水,高级胺不溶于水。 溶解度 (氢键、R在分子中所占比重) 沸点:伯、仲胺沸点较高(氢键),叔胺沸点 沸点 较低。
+ H2O
N-甲基-N-亚硝基苯胺
。 3 胺 (CH3)2N
+ HNO2
(CH3)2N
N=O
对亚硝基-N,N-二甲苯胺
脂肪族胺与HNO2的反应可用来区别伯、仲、叔胺。
酰胺
酰胺可看作羧酸分子中羧基上的羟基被 氨基取代后所生成的化合物,其官能团为酰 胺基( ),是羧酸的重要衍生物,也
是氨或胺的酰基衍生物。
尿素在农业上又是一种很好的肥料。
尿素晶体缓慢加热,则两分子尿素脱去一分子氨 而缩合成二缩脲。
二缩脲反应:二缩脲在碱性溶液中与稀硫酸铜溶 液反应,能产生紫色或紫红色的配合物。
季铵盐和季铵碱
季铵盐:是氨彻底烃基化的产物。具有无机盐的性 质,在水中完全电离,不溶于有机溶剂。
R3N + RX R4N X季铵盐
有机含氮化合物

有机含氮化合物有机含氮化合物是指分子中氮原子和碳原子直接相连的有机物,也可看成是烃分子的一个或几个氢原子被含氮的官能团所取代的衍生物,前面学过的包括氨基酸、腈、酰胺,亚胺、肟、腙。
一、硝基化合物硝基化合物是指烃分子中的氢原子被硝基取代后得到的化合物,常用RNO2或ArNO2表示。
根据硝基所连接烃基的不同可以分为脂肪族和芳香族硝基化合物,根据分子中所连硝基的多少又可以分为一硝基化合物和多硝基化合物。
共振论的观点认为硝基化合物是两种极限式的共振杂化体。
大部分芳香族硝基化合物为淡黄色固体,大多数具有苦杏仁气味。
硝基对苯环有亲电取代又有亲核取代。
(一)芳核上的亲核取代反应(1)硝基对苯环上取代基特别是邻、对位取代基的性质有很大影响卤苯型化合物中的卤素卤素很不活泼。
,难以发生亲核取代.,但当卤素的邻、对位有硝基存在时,卤原子活泼型增加,硝基越多,亲核取代反应越容易进行。
有证据表明该反应是分两步进行的,第一步是亲核加成,形成带负电荷的活性中间体买森海默尔配合物,第二步是离去基团卤素的离去。
在这个反应中,决定反应速率的步骤中有两种分子参与,所以是双分子历程。
原因。
由于邻、对位硝基对卤素的强吸电子作用,使得与卤素相连的碳原子密度降低。
容易受到亲核试剂的进攻。
硝基在邻位的情况与之在对位的情况相似,如果邻对位均有硝基,芳香亲核取代反应则更容易。
(二)硝基的还原反应硝基化合物易被还原,反应条件对还原产物有较大影响,在酸性介质中,以zn,Fe,或Sn 为还原剂,硝基将被还原成氨基,该反应的中间产物是亚硝基苯及羟基苯胺,但它们比硝基苯更容易还原,不容易分离出来。
,进一步还原为氨基,若以二氯化锡为还原剂,还可选择还原硝基,避免醛基得还原。
在中性或弱酸性下,主要得芳基羟胺。
在碱性介质中,主要发生双分子还原,还原剂不同,还原产物有很大差异。
,但产物经酸性条件进一步还原最终形成苯胺。
若用硫化钠,硫氢化钠,可以选择性地还原一个。
(三)缩合反应有a氢的硝基化合物在碱性条件下生成负碳离子,缩合反应。
含氮有机化合物和杂环汇总

CH3NHCH2CH3 甲乙胺 (仲胺) 甲基-乙基-环丙基 H 3C N CH2CH3 胺(叔胺)
6
NHCH 3
N-甲基苯胺
邻-甲基苯胺 N-甲基-N-乙基 苯胺
7
NH 2 CH3
N CH3 CH2CH3
CH2NH 2
+ NH 3 Cl
苯甲胺(苄胺) 氯化苯铵 溴化四甲铵
-
(CH3)4N Br
31
第二节 重氮化合物 和偶氮化合物
重氮化合物 R-N=N(Ar)
偶氮化合物
R-N=N-R’ (Ar)
32
重氮化合物的化学性质 1.重氮基取代反应(放氮反应)
33
OH
+
N2
H
+
3 PO 2+ H 2O
O H2
/ △
N2
N2
N) 2 C ( u 2 C N KC
+
Cu
2X 2
+H
X
CN N2
X
+
27
(3) 叔胺和亚硝酸反应
N(CH3)2
N(CH3)2
+ HNO2
N O
28
鉴别:
伯胺 脂 肪 族 仲胺
HNO2
N2 黄色油 状物
叔胺
溶解
29
五.与医学有关的胺类
苯胺
NH 2 + 3Br2(水)
Br Br NH 2 Br + HBr
白
30
ห้องสมุดไป่ตู้
拓展
“新洁尔灭”
溴化二甲基十二烷基苄基铵,又称苯扎溴 铵(C6H5CH2N+(CH3)2C12H25Br-),商品名为 “新洁尔灭”。它为季铵盐型阳离子表面活性 广谱杀菌剂,杀菌力和去垢效力强,对皮肤和 组织无刺激性,对金属、橡胶制品无腐蚀作用, 不污染衣服,性质稳定,易于保存,属消毒防 腐类药物。1:1000~2000的新洁尔灭溶液广泛 用于手、皮肤、粘膜、器械等的消毒。
有机化学含氮有机化合物 (1)

4-甲基-2-戊胺 4-methyl-2-pentanamine
CH3 CH3CH2CHCHCH3 N(C2 H5)2
N,N-二乙基-3-甲基-2-戊胺 N,N-diethyl-3-methyl-2-pentanamine
C2H5NHCH2CH2NH2
N-乙基乙二胺
N-ethyl-1,2-ethanediamine
HCHO
HOCH2 CH2NO2
HCHO CH2OH HOCH2 C CH2OH CH2OH
HOCH2 CHNO2 CH2OH
⑷ 与亚硝酸反应
1° RCH2NO2 HONO 2° R2CHNO2 3° R3CNO2
NOH RC NO2 NaOH 红 色 液体
R2C
NO NO2
NaOH
蓝 色 液体
(
3
H+ O 3
NH2
Br NH2 Br
+
H2SO4
NH3 HSO4 Br 2
NH3 HSO4
NH2 NaOH Br
Br
(3)磺化
NH2
+ + H2SO4
NH2
NH3 HSO4
NHSO3 H ]
180-200℃ [
+
NH3
内盐,熔点高
SO3 H
SO3-
(4)硝化
NHCOCH3
HNO3
H+ O 3 NO2 NHCOCH3 NO2 H+O 3
当氮连接四个不同基团时,两对映体不能 转换:
CH3 C 6 H5CH2 CH2=CHCH2 N CH3
+
C 6 H5 C 6 H5
+N
CH2C 6 H5 CH2CH=CH2
有机-12-12-含氮化合物

O NHCCH3
=
Br2
O NHCCH3
=
H2O/H+
NH2
Br
Br
硝化: 芳香胺硝化,氨基应加以保护 磺化:苯胺用浓硫酸磺化时,首先生成盐,在加热下失 水生成对氨基苯磺酸(重排)
NH2
c H2SO4
NH3
+H
SO4
-
NH3+
Δ -H2O
内盐 SO3-
四. 个别化合物
H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
Байду номын сангаас
CH3 N CH2CH3 H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
N-甲基-N-乙基环戊胺
芳香胺:把芳香胺作为母体,其它烃基作为取代基
NHCH3 CH2CH3 Cl N-甲基苯胺 N CH2CH3 N,N-二乙基-4-氯苯胺 邻乙基苯胺 NH2 CH2CH3
复杂胺:以烃为母体,以氨基为取代基
R–C≡N R–N=C=O
Ar–N2+Cl-
异氰酸酯
亚胺 R–CH=NH
§12.1 胺
一. 分类、命名
胺可以看作是氨的烃基衍生物 伯胺(一级胺) 仲胺(二级胺) 叔胺(三级胺) 季铵盐(四级铵盐)
RNH2 R2NH R3N R4N+XArNH2 Ar2NH Ar3N
注意:伯/仲/ 叔胺与伯/仲/ 叔卤代烃及 伯/仲/叔醇分 类方法的区 别
脂肪胺亲核性比氨强,氨与卤代烃反应得混合物
季铵盐是强酸强碱盐,不能与碱作用生成季铵碱 季铵盐与AgOH作用因生成卤化银沉淀,可得到季 铵碱
R4N+X- + AgOH R4N+OH- + AgX↓
含氮化合物-化工

NH2
应用:制联苯胺及衍生物 例:
Zn-NaOH-CH3OH-H2O NO2 ? H2N CH3
NH2 CH3
H
+
H3 C
D.部分还原
还原剂:(NH4)2S, NH4SH, Na2S, NaHS
NO2 NaHS CH3OH NO2
NO2 CH3 NaHS CH3OH NH2 NO2
NH2
NO2
CH3
+
NH3
Ni / H2
CH2NH2
O CH
+
CH2NH2 Ni / H2
CH2NHCH2
应用:合成伯胺、仲胺 机理:先生成亚胺,再还原—C=N—
3、酰基化: 伯、仲胺与酰氯、酸酐作用,生成酰胺:
O R C Cl O
+
NH2R' R'NHR'
R C NHR' O R C N-R'
R' 工业上制备酰胺采用羧酸与胺的反应
叔醇
(CH3 )3C-Cl
叔卤代烃
(CH3 )3C-NH2
伯胺
CH3CHCH3 NH2
伯胺
CH3CHCH3 Cl
仲卤代烃
NH4+上的4个氢都被取代,生成季铵盐(碱):
(CH3)4N Cl
+
_
(CH3)4N OH
+
_
根据氨基的数目分:一元胺、二元胺、多元胺。
CH3CH2 NH2
乙胺
CH3CH2 NHCH2CH3
生成的负碳离子能够被硝基的强吸电子作用所 稳定:
_ _
RCH-N O_
+
O
RCH=N
有机化学含氮有机化合物

10.3 重氮和偶氮化合物 N N
重氮化合物 R N N B (Cl,H,N…) 偶氮化合物 R N N R
NN 偶氮苯 N N NH
苯重氮氨基苯
+
N
N Cl-
NN
NHCH3
对甲氨基偶氮苯
N N NH
CH3
苯重氮氨基对甲苯
氯化重氮苯
10 含氮有机化合物
一、 重氮盐的反应及在合成中的应用
重氮盐的化学性质很活泼,能发生许多反应,一 般可分为两类:失去氮的反应和保留氮的反应。
NH2 HNO2
OH + N2
芳香族伯胺低温下与HNO2作用生成重氮盐,称为重氮化反应。
NH2 NaNO2 HCl
0~ 5 0C
N2+Cl-
OH + N2
芳香族重氮盐比脂肪族重氮盐稳定,在合成上有许多用途。
10 含氮有机化合物
仲胺
NHCH3
NaNO2 HCl 10 0C
NO NCH3
N-亚硝基-N-甲苯胺 黄色油状或固体
N2+Cl- +
OH
NN
OH
N2+Cl- + CH3
OH
OH NN
偶合反应的重要用途是合成偶氮染料。
CH3
10 含氮有机化合物
二、偶氮化合物
R、R′为脂肪族烃基的偶氮化合物,光照或加热时易分
解,放N2并产生自由基。可作自由基引发剂。 芳香族偶氮化合物都有颜色,许多芳香族偶氮化合物的衍
生物,是重要的合成染料。称为偶氮染料。
叔胺 R3N
季铵 R4N+
烃基的不同 脂肪胺、芳香胺 氨基的数目 一元胺、二元胺等
CH3CH2NH2 CH3CH2NHCH2CH2CH3 (CH3CH2)2NCH2CH2CH3
含氮化合物

1°使卤苯易水解、氨解、烷基化 卤素直接连接在苯环上很难被氨基、烷氧基取代,当苯环上有 硝基存在时,则卤代苯的氨化、烷基化在没有催化剂条件下即可 发生。 2°使酚的酸性增强
OH OH OH NO 2 NO 2 pKa 9.89 7.15 NO 2 4.09 O2N NO 2 0.38 OH NO 2
R NH3Cl + NaOH
RNH2 + Cl + H2O
胺的碱性强弱,可用Kb或pKb表示:
R NH 2 + H2O Kb = R NH 3 RNH2 Kb OH R NH 3 + OH pKb = logKb
碱性: 脂肪胺 > 氨 > 芳香胺 pKb < 4.70 4.75 >8.40
脂肪胺 在气态时碱性为: (CH3)3N > (CH3)2NH > CH3NH2 > NH3 在水溶液中碱性为: (CH3)2NH > CH3NH2 > (CH3)3N > NH3 原因:气态时,仅有烷基的供电子效应,烷基越多,供电子效应 越大,故碱性次序如上。
第十章
含氮有机化合物 (Nitrogen)
第一节 硝基化合物
一、分类、命名、结构
1. 硝基(NO2-)取代烃分子中的氢原子所成的化合物称为硝基 化合物。硝基是它的官能团。 按烃基的不同,硝基化合物可分为:脂肪族硝基化合物 (RNO2),例如:CH3NO2 硝基甲烷、CH3CH2NO2 硝基乙烷。芳香族 硝基化合物(Ar-NO2). 例如:
1、物理性质 脂肪族硝基化合物多数是油状液体,芳香族硝基化合物除了硝基苯 是高沸点液体外,其余多是淡黄色固体,有苦仁气味,味苦。不溶 于水,溶于有机溶剂和浓硫酸(形成 盐)。 2.脂肪族硝基化合物的化学性质 (1)还原 硝基化合物可在酸性还原系统中(Fe、Zn、Sn和盐酸) 或催化氢化为胺。
13 有机含氮化合物

NaNO2/HCl
R3NHX-
+
(H3C)2N
ON
NO 绿色结晶
(H3C)2N
CH3
NaNO2 /HCl
(H3C)2N
CH3
应用:芳香叔胺的鉴别
5、芳环上的取代反应 氨基与羟基一样,对芳环上的亲电取代 反应具有较强的致活作用,芳胺的芳环上很 易发生亲电取代反应。 (1)卤代反应
NH2
-H2O
NR"R"' R
R'
CH
R'
R' R CH NHR"
R C NR"
[H]
4、 Hofmann降解
5 、 Gabriel合成法(制备纯净伯胺)
O NH O
N aOH H2O KOH CH3CH2OH
O NK O
ONa ONa + RNH2
- +
O
RX DMF
N R O
O
O
N R O
O
NH2NH2 回流
2 、烃基化(多烃基化)
N上的未共用电子对可作为亲核试剂,发生 亲核取代反应。
3、酰化(单酰基化)和磺酰化(单磺酰基化)
常用的碱:氢氧化钠、三乙胺和吡啶 ---缚酸剂 R1COCl R3N or (R CO) O 不反应 1 2 运用:(1)药物合成;(2)保护氨基
NH2
+
CH3
SO2Cl
CH3
N
10 7 °
H
CH3
N H
11 3° 1 0 6°
H
CH3
N CH3
10 8 °
CH3
(三)胺的化学性质
有机含氮化合物

(三)化学反应
1、芳核上的亲核取代反应(SN2Ar)
硝基是强吸电子基,当其与苯环直接相连时, 不仅使芳环上的亲电取代反应活性下降,而且通 过吸电子效应,对其邻、对位的取代基产生显著 的影响。
(1)增强卤素的活泼性
Cl
卤
烃
10%NaOH H+
反
360℃,P
应 活
Cl
性 增
NaOH,H2O H+
强
135 ℃
二甲(基)乙(基)胺
H3C N CH2CH3
1 2 3
4
Cl
N-甲基-N-乙基对氯苯胺
结构复杂的胺的命名 命名时,将氨基看作取代基,以烃为母体。
CH3 NH2
C1 H3
CH
2
CH
3
C4 H 2
C5 H3
2-甲基-3-氨基戊烷
铵盐的命名,则由相应的胺与酸参考无机铵的 命名方法进行。
(CH3)4N+ Cl–
90%
烯胺
仲胺:多采用环状胺 共振式:
(四)制备
1、氨或胺的烃基化
CH3CHCOOH + NH3 Br
1mol
70mol
CH3CHCOO-NH4+ NH2
65~70%
Cl
NO2
EtOH
+ CH3NH2 160℃
NHCH3 NO2
2、硝基化合物的还原
O2N
H2/Ni
COOH
3atm
H2N
NO2
NH3+Cl-
NHCOCH3
HNO3 H2SO4
NHCOCH3 NO2
SO3H
OHH2O
NH2
SO3H
有机化学~10含氮化合物

R2NH + H2O R2N+H2 + OH-
从电子效应考虑:烷基越多碱性越强; 从溶剂化效应考虑:烷基越多碱性越弱。
铵盐溶于水,不溶于有机溶剂
分离、提纯 胺
比较下列化合物碱性大小
>
>
>
供电子基团
吸电子基团
2.烃基化
胺作亲核试剂与R―X R―OH Ar―OH 反应在N原子上引入烃基。 季铵盐
3、氨基对芳环的致活作用
N原子上的孤对电子:
1、碱性
+ H X
2、亲核性
+
反应部位:
1. 碱性 结论: 所有的胺呈弱碱性 H2O < RNH2 < < OH – > RCONH2 (1)
胺
pKb
NH3 CH3NH2 (CH3)2NH (CH3)3N
4.7 3.4 3.3 4.3 9.4 13 8.7
2.卤化——速度快,溴化和氯化得2,4,6-三卤苯胺:
白色沉淀
思考: 如何鉴别苯酚与苯胺?
如何制备一溴苯胺?
制备一溴苯胺
乙酰化
溴化
水解
使苯胺活性降低!
——主要产物对溴乙酰苯胺:
例1——间位取代反应 例2——对位取代反应 硝化——注意硝酸的氧化作用和氨基的保护 氨基的保护 间位取代反应,注意条件
pH < 3.1, 红色
10.2.3 偶氮染料和酸碱指示剂
霍夫曼规则——季铵盐在消除反应中,得到的主要产物为双键上烷基最少的烯烃。
取代较少的烯烃为主要产物
反应机理: E2反应
过渡态 Hofmann 消除规律: 生成取代较少的烯烃
含氮有机化合物
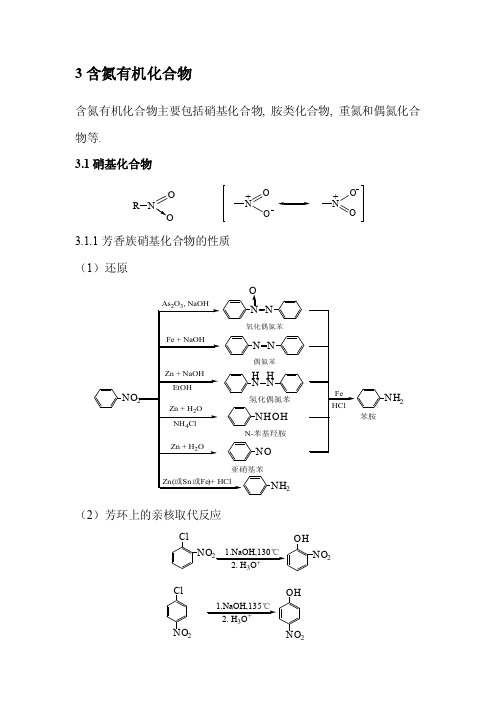
3含氮有机化合物含氮有机化合物主要包括硝基化合物, 胺类化合物, 重氮和偶氮化合物等.3.1硝基化合物R ONO ONO O++3.1.1芳香族硝基化合物的性质 (1)还原2NH 2苯胺(2)芳环上的亲核取代反应NO ClNO 2OHClNO 2OHNO 21.NaOH,130℃3+1.NaOH,135℃3+ClNO 2NO 2OCH 2CH 3NO 2NO 2Et 3NFNO 2OCH 3NO 2CH 3OHClNO 2NH 2NO 2ClNO 2NO 2NHCH 3NO 2NO 2+ CH 3CH 2OH + CH 3OK + NH 3+ CH 3NH3.1.2脂肪族硝基化合物的性质R CH 2NOR CH OH (1) α-氢的酸性 CH 3NO 2 CH 3CH 2NO 2(CH 3)2CHNO 2p K a10.28.57.8(2) 与羰基化合物的反应CHO CH CH NO 2+ CH 3NO 225℃β-硝基苯乙烯3.2胺氨分子中一个,两个或三个氢原子被烃基取代所生成的化合物分别称为伯胺(一级胺)、仲胺(二级胺)和叔胺(三级胺)。
胺和氨一样,氮原子为sp 3杂化,三个sp 3杂化轨道分别与氢或碳原子形成三个σ键,剩下一个sp 3杂化轨道被一对电子占据。
例如甲胺、三甲胺均为棱锥形结构, 苯胺中的氮原子则接近平面构型.其杂化状态在sp 3与sp 2之间.3.2.1胺的命名CH 3NH 2 (CH 3)2NH (CH 3CH 2)3N 甲胺 二甲胺 三乙胺NH 2苯胺 NH 2CH 3邻甲基苯胺NHCH 3N-甲基苯胺 N(CH 3)2N ,N-二甲基苯胺2-氨基-3,4-二甲基戊烷 3-(N ,N-二乙氨基)-4-甲基己烷 3.2.2胺的化学性质 (1) 胺的碱性各类胺的碱性次序和影响因素。
气相: NH 3<C 2H 5NH 2<(C 2H 5)2NH <(C 2H 5)3N 溶液中:[RNH 3+][OH -][RNH 2]K b =H 3C H 112.9o0.147nmH 3CCH 2CH CH CH 3CH 3CH 3CH 3CH 2CHCHCH 3N(C 2H 5)2CH 2CH 3RNH 2 + H 2ORNH 3 + OH NH 3C3CH 31080.147nmoRNH 3+ + H 2 2 + H 3O +[RNH 2][H 3O +] [RNH 3+]K a =NH 3 < C 2H 5 NH 2 <(C 2H 5)3N < (C 2H 5)2NHp K a 9.25 10.80 10.85 11.09 p K b 4.76 3.36 3.25 3.06烷基供电子的诱导效应与水的溶剂化效应二者综合作用的结果,造成了胺在水中的碱性强度次序。
