配合物中的化学键理论
经典课程-_配合物中的化学键理论资料

3.1 价键理论(VB理论)
共价键的本质是由于原子相互接近时轨道重叠( 即波函数叠加),原子间通过共用自旋相反的电 子对使能量降低而成键。
共价键的主要特点是具有饱和性和方向性。
共价键的形成: 键(头碰头) HF的生成
键:p轨道(肩并肩)
价键理论
要点:配合物是通过给予体和接受体的反应而生成的, 给予体原子具有孤对电子, 它给出孤对电子进入作为配合物 中心原子或离子的空轨道, 为了接受这些电子对, 中心原子 的原子轨道首先要进行杂化形成一组新的具有一定方向性和 对称性的等价杂化轨道, 再与配体的给予体轨道重叠形成 配键。
配合物中的化学键理论
本章学习内容
3.1 配位化合物化学键理论概述 3.2 价健理论; 3.3 晶体场理论; 3.4 分子轨道理论
学习目标
总体:理解并掌握配位化合物的化学键理论(包括价键 理论、晶体场理论和分子轨道理论),并利用这些化学键 理论解释配位化合物的结构及性质(应用)。
掌握配合物的价键理论的主要要点及其应用。 重点掌握晶体场理论的基本原理及其具体应用。 理解配合物的分子轨道理论的基本要点及其应用。 了解这些化学键理论的优缺点。
价键理论
晶体场理论 分子轨道理论
价键理论
Sidgwick(1923)和Pauling(1928)提出配位共价模型,考虑了中心原 子和配体的结构,能较好地说明许多配合物的配位数、几何构型、 磁性质和一些反应活性等问题。
这个理论统治了配合物结构这一领域达二十多年,但这个价键理论 只能说明配合物在基态时的性质,而不能说明与激发态有关的性质 (如配合物的各种颜色和光谱),也不能说明同一过渡金属系列中 不同配合物的相对稳定性等等
构型) 4、价键理论优缺点
第三章配合物的化学键理论

• 计算分裂能的经验公式
Jø rgensen公式: = f· g
f:配体因子 g:中心金属离子因子
2-4 电子成对能(P)与配合物自旋状态
问题:正八面体场Fe3+ (d5)中的电子如何排布呢?
Paulli原理 需要满足三个条件: 能量最低原理
Hund规则
eg
o
eg
o
t2g
低自旋 高自旋
低自旋配合物的晶体场稳定化能
•配合物的热力学性质 离子的水合热(-H):
Mn+(g) + xH2O = [M(H2O)6]n+ (aq) + (-H)
水 合 能
Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
100
离子半径
由于随核电荷增 加,d电子也增加, 但d电子不能将增加 的核电荷完全屏蔽, 单从这个因素考虑应 单调下降。
dyz , dxz dxy, dyz , dxz
dxy
2
dxy dyz , dxz
Z轴缩短的 正八面体场 Oh 八面体(D4h)
Z轴拉长的 八面体(D4h)
dx2-y2 dz2, dx2-y2
d
dz2 dxy dxy , dyz , dxz
dyz , dxz 拉长八面体场中Cu2+ (d9)的电子排布
如[Fe(H2O)6]2+/3+,[FeX6]3-等
③ P: 自旋交叉
㈡ 晶体场理论对配合物高低自旋状态的预测
•[Fe(CN)6]4-: = 33000 cm-1, P = 17600 cm-1
>P,t2g6,低自旋 ( = 0)
•[Fe(H2O)6]2+: = 10400 cm-1, P = 17600 cm-1 <P,t2g4eg2,高自旋 ( = 4.9 B.M.)
第二章 配合物的化学键理论

第二章配合物的化学键理论配合物的化学键理论:中心离子与配位体之间的化学键。
第一节配合物的静电理论静电理论的基本观点:认为中心离子是带正电荷的粒子,而配位体是带负电荷的粒子,配合物中的配位键是由单纯的静电相互吸引而形成的,形成配合物的结合能有两项:1 配体与中心离子的吸引能2 配体与配体之间的排斥能U结合=U吸引+U排斥有一些现象不能很好解释:配体一定时,半径相近的金属离子与之形成的配合物的稳定性应相近。
如Na b半径为0.95, Cu+半径为0.96形成的配合物的稳定性却相差很大改进的静电理论:静电极化理论,即中心离子和配位体在静电的作用下,相互会产生变形,中心离子的正电荷可吸引配体的电子,而配体的负电荷则排斥中心离子的电子。
1 自己变形两方面的作用2 使对方变形Na b , K+ , Mg2+ , Ca2+等离子,具有8电子结构,极化弱,因而与配体配位时,变形小Cu2+,Ag+ , Zn2+ , Cd2+等离子,具有18电子结构,极化强,与配体配位时,变形大规则:中心离子具有较强的极化作用或变形性强,与变形性强的配位体配位时,形成的配合物稳定静电理论的评价:提出较早,对早期的配合物的化学键理论有贡献。
不足之处:1 不能解释象Ni(CO)4这样的配合物2 不能解释配合物的磁性和光谱第二节价键理论Sidywich 的配键理论主要的价键理论 Pauling 的电价和共价配位理论 Taube 的内轨和外轨理论主要介绍的价键理论的内容:1 Pauling 提出的杂化轨道理论 2 Taube 提出的内轨和外轨理论 IIIB IVB VB VIB VIIB VB IB IIB Sc Ti V Cr Mn Fe Co Ni Cu Zn 3d 1 4S 2 3d 2 4S 2 3d 3 4S 2 3d 5 4S 1 3d 5 4S 2 3d 6 4S 2 3d 7 4S 2 3d 8 4S 2 3d 94S 13d 10 4S 2Pauling 杂化轨道理论,用于处理配合物的形成其基本假设:中心离子,主要指过渡金属离子的价电子层中能量相近的(n-1)d, ns, np 或nd 轨道杂化后,形成能量等同的杂化轨道,接受配体的孤对电子而形成配合物,Pauling 称这种成键方式形成的为共价配合物。
第9章 9.7配合物的化学键理论
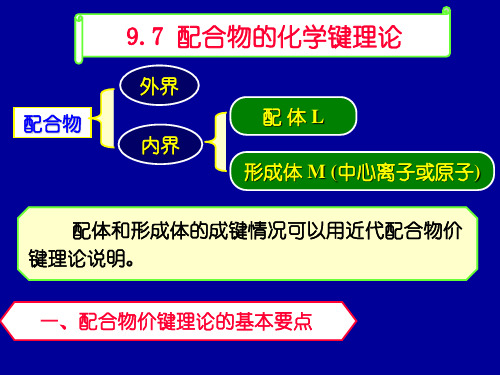
F-, H2O, OH-
常形成外轨型配离子 ( 因配位原子F, O电负性高)
配 CN-, CO
常形成内轨型配离子
体
(C的电负性较低,易给出孤对电子)
NH3, Cl-
内, 外轨型配离子均可形成 ( 由中心离子决定)
4、内轨型和外轨型配合物的稳定性和磁性
1)稳定性(解离程度)
一般来说 , 内轨型配 离子比外轨型配离子稳 定,解离程度小。
常见的轨道杂化类型与配合物几何构型的对应关系
杂化类型 配位数 几何构型
实例
spp ssp2 spp33 dspp22 dspp33 sp33dd22 d22sp33
2
直线型
[Ag(NH3)2]+,[Cu(NH3)2]+
3 平面正三角形
[ CuCl3]-
4
正四面体
[Ni(NH3)4]2+,[Zn(NH3)4]2+
4
正方形
[Cu(NH3)4]2+,[Ni(CN)4]2-
5
三角双锥
[Fe(CO)5]
6
正八面体
[FeF6]3-,[Co(NH3)6]2+
6
正八面体
[Fe(CN)6]3-,[Co(NH3)6]3+
sp, sp2, sp3, sp3d2杂化 形成外轨型配合物
dsp2,dsp3,d2sp3杂化 形成内轨型配合物
正八面体
配体 中心离子
三角双锥
[Zn(NH3)4]2+是正四面体
Zn2+
Fe3+
[FeF6]3-是正八面体
Ni2+
[Ni(CN)4]2-是正方形
Ni2+
F e
配合物的化学键理论

dxy
dyz
2/5Δt
dxz
t2
3/5Δt
Δt=(4/9)Δ0 e
dx2-y2
dz2
由于正四面体场中的e轨道和t轨道都 不象正八面体场中那样直接指向配体,所 以它们受到配体的排斥作用没有在正八面 体场中受到的排斥作用大。 根据计算,在配体及中心离子都相同,并 且配体与中心离子的距离和八面体相等的 条件下:
e 0.58e e - 3 3 1.26 r r r
2
2
2
当n=6, q=2时, 配离子的生成能为:
2e 1.66e e - 6 6 2.04 r r r
2
2
2
表2-1 配离子生成能(-e2/r) q n 1 2 3 4(四面体) 4(平面正方形) 5 6 7 8 1 1.00 1.50 1.25 0.32 0.16 2 2.00 3.50 4.26 4.32 4.16 3.10 2.04 3 3.00 5.50 7.26 8.32 8.16 8.10 8.04 6.02 4.24 4 4.00 7.50 10.26 12.32 12.Байду номын сангаас6 13.10 14.04 13.02 12.24
eg t2g eg
t2g
1. 成对能(P)
定义:当一个轨道中已有一个电子时,它对第二个 电子的引入有其排斥作用。因此需要一定的能量克 服这种排斥才能引入第二个电子与之成对,所需要 的能量称为成对能。 2.高自旋配合物和低自旋配合物
当Δ<P时,Δ较小为 弱场配体,形成高 自旋配合物。 当Δ>P时,Δ较大为 强场配体,形成低 自旋配合物。
dxy轨道其 极大值方 向与x轴和 y轴成45°, 故其能量 低于dx2-y2 轨道
配位化学-配合物的化学键理论
3d
4s
4p
xx xx xx
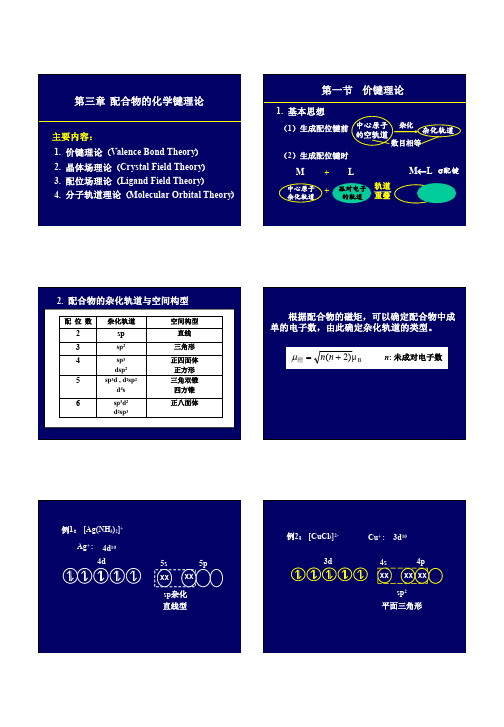
sp2 平面三角形
1
2017-9-12
例3: [Co(NCS)4]23d
Co2+ 3d7
4s
4p
xx xx xx xx
sp3 四面体
例4:[Ni(CN)4]2- Ni2+: 3d8
3d
4s
4p
电子归并, 杂化
xx xx xx xx dsp2
平面正方形
问题:什么情况下,内层d电子归并?
d. 价键理论不能解释配合物的颜色及吸收光谱。
e. 对非经典配合物无法解释。
3
2017-9-12
第二节 晶体场理论 1929年由Bethe提出
基本思想:
50年代以后得到发展
中心原子 静电作用
配体
①
具有电子结构
无电子结构 静电场
的离子
② 在配体静电场作用下,中心原子原来简并的5个d轨道能
级发生分裂,分裂能量的大小与空间构型及配体、中心原子 的性质有关。
2017-9-12
第三章 配合物的化学键理论
主要内容: 1. 价键理论(Valence Bond Theory) 2. 晶体场理论(Crystal Field Theory) 3. 配位场理论(Ligand Field Theory) 4. 分子轨道理论(Molecular Orbital Theory)
的排斥作用相对较小,能量降低。 dxz
eg (dx2—y2、dz2)
o
d
自由金属离子 球形场
t2g (dxy、dyz、dxz)
八面体场
d轨道在八面体场中的分裂
o:(1)由电子光谱得到;(2)由量子力学微扰理
配合物的化学键理论

12
根据这个结构, 可以推测 Cu2+的配合物应当很容易地失去未配对的4p电子而迅速氧化为Cu3+, 但事实并非如 此。
因此, 价键理论有其局限性。它被配位场理论或分子轨道理论取代是必然的。
13
4.2 晶体场理论 1929年由Bethe提出, 30年代中期为Van Vleck等所发展, 及Puling的价键理论处于同一时代, 但当时并未引起
17
由于电子的总能量, 亦即各轨道总能量保持不变, eg能量的升高总值必然等于t2g轨道能量下降的总值, 这就是所谓的重 心守恒原理(原来简并的轨道在外电场作用下如果发生分裂, 则分裂后所有轨道的能量改变值的代数和为零)。
将eg和t2g这两组轨道间的能量差用△o或10Dq来表示, △o或10 Dq称为分裂能, 根据重心守恒原理, 则
的伸展较3d轨道远, 5d轨道在空间的伸展又比4d轨道远, 因而易受到配体场的强烈作用。
27
(4) 配体的本性 将一些常见配体按光谱实验测得的分裂能从小到大次序排列起来, 便得光谱化学序:
这个化学序代表了配位场的强度顺序。由此顺序可见:对同一金属离子, 造成△值最大的是CN-离子, 最小的是I -离子, 通常把CN-、NO2-等离子称作强场配体, I-、Br-、F-离子称为弱场配体。
优点:能够说明一些配合物的配位数、几何构型和稳定性。 缺点:将中心原子和配体都看作是没有内部结构的点电荷——离子键,不能说明配合物的磁学性质和光学性质。
3
➢价键理论 Sidgwick(1923)和Pauling(1928)提出了配位共价键模型,考虑了中心原子和配体的结构,能较好地说明许多配
合物的配位数、几何构型、磁性质和一些反应活性等问题。
显然, 配合物的配位数就是中心原子在成键时动用的空轨道数。
第4章 配合物中的化学键理论

(3)配合物中心离子能级分裂的结果,使配合物 得到稳定化能。晶体场稳定化能(CFSE)的大小 与分裂能及中心离子的电子构型有关。
配体场理论(LFT):(1)配体不是无 结构的点电荷,而是具有一定的电荷分布 (轨道);
(3)Jahn-Teller效应 在d电子云分布不对称的非线性分子中,如果在基态时有 几个简并的状态,体系则不稳定,分子的几何构型必然会 发生畸变以降低简并度,从而稳定其中的某种状态。
例如:Cu2+(d9) t2g6eg3(dz2)2(dx2-y2)1; (dz2)1(dx2-y2)2
3 分子轨道理论
*配合物中的化学键理论 1 价键理论 Valence Bond Theory, VBT
理论要点:[1]中心原子提供能够可利用的空轨道 (价电子轨道)进行杂化形成能量相同的杂化轨道后 同配体作用形成配位键。 所形成配离子的空间结构、配位数以及稳定性主要取 决于杂化轨道的数目和类型;
[2]中心原子利用哪些空轨道进行杂化,既和中心原 子的电子层结构有关,还和配体中配位原子的电负 性有关。
[3]磁性 配合物磁矩=[n*(n+2)]1/2 单位:玻尔磁子(B.M)
局限性:[1]定性理论, 只能说明基态的性质; [2]不能解释配合物的光谱、颜色等; [3]不能很好解释有些配合物的形成、稳定性等
2 晶体场理论(CFT)及配体场理论(LFT)
晶体场理论(CFT):(1)中心离子具有电子结构,配体 可看作是无电子结构的离子或偶极子的点电荷,中心离 子与配体之间的作用完全是静电作用;
中心原子和配位原子的原子轨道按照一定的原则进 行有效地线性组合。
配合物的化学键理论

杂化
轨道 sp3d2 d2sp3
sp3
dsp2
配键 类型 外轨型 内轨型
外轨型
内轨型
Kf 1014
稳定性
<
1042
107. 96
1031. 3
<
磁性
Ni2+的d电子构型 杂化轨道 配键类型
未成对电子数 磁性
[Ni(NH3)4]2+ [Ni(CN)4]2 d8
sp3 外轨型
dsp2 内轨型
2 顺磁性
弱场配体
强场配体
——以上称为光谱化学序列
4. 电子成对能和配合物高、低自旋
电子在分裂后轨道上的分布遵循: 能量最低原理和洪特规则
如 Cr3+ d3
eg
E t2g
八面体场
d4d7构型的离子, d电子分布有高、低自旋两种方式。
如 Cr2+ d4
[Cr(H2O)6]2+
eg
△o t2g
[Cr(CN)6]4-
中心离子和配体之间以静电引力相互作用而形 成化学键。
中心离子的5个能量相同的d轨道受配体负电场 的排斥作用,发生能级分裂(有的轨道能量升 高,有的能量降低)。
2. 正八面体场中d轨道的能级分裂
无外电场作用下的d轨道 Edxy= Edxz= Edyz= Edx2-y2= Edz2
在带负电荷均匀球形场的作用下,d轨道能量 均升高相同值,能级不发生分裂。
请问: [Zn(NH3)4]2+、 [Ag(NH3)2]+呈现什么颜色?
中心离子d 轨道全空(d0)或全满(d10), 不能发生 d-d跃迁,其水合离子为无色。
解释配合物的稳定性
Eeg=+0.
配合物的化学键理论ppt课件
[Co(NH3)6]Cl2在水溶液中离解
[Co(NH3)6]2++6H2O [Co(H2O)6]2++6NH3
[Co(NH3)6]Cl2容易被空气氧化; 受热易分解:
150C
[Co(NH3)6]Cl2
• 负电荷集中在球的内接正八面体的六个顶点 ,每个顶点的电量为q,球壳上的总电量仍 为6q,不会改变对d电子的总排斥力和d轨道 的总能量。
但单电子处在不同d轨道上 时所受到的排斥作用不再 完全相同。
八面体晶体场下d轨道的分裂
eg轨道
t2g轨道
重心守恒原理——原来简并的轨道在外电 场作用下如果发生分裂,则分裂后所有轨道能 量改变值的代数和为零。
Ni—CONi+CO
金属原子的d轨道与CO的碳原子的p轨道发生
重叠,金属的d电子部分移向碳原子,即中心 原子向配体反馈电子,形成了反馈键。
CO同金属生成羰基配合物的原因
• 有部分双键存在,过渡金属离子的外层或次 外层有d电子,CO的碳原子有空的p轨道,碳 的p轨道可与金属的d轨道重叠,接受金属的d 电子而形成d—p反馈键。
四面体场和八面体场中中心原子d轨道能级分裂图
3、平面正方形场
• 是八面体配合物的特殊情况,即八面体z轴方向 上处于相反位置的两个配体移到无限远处时就成 为平面正方形。
中心原子dx2-y2轨道极大值处于与配体迎头相撞的
位置,受到配体排斥力最大,能级升高最多;
dxy的电子云夹在两个配体之间所受到的排斥力要
二、晶体场稳定化能 (CFSE)
1.晶体场稳定化能(CFSE)的定义
配合物化学键理论

强场:o > P 弱场:o < P
d5 型
强场o > P
弱场o < P
(4) 影响CFSE的因素 ① d电子数目; ② 配位体的强弱; ③ 晶体场的类型
表1 过渡金属络离子的稳定化能(CFSE)
弱场CFSE/Dq
dn d0 离子 Ca2+,Sc3+ 正方型 0 正八面体 0 正四面 体 0 正方型 0
中心离子用外层(n-1)d,ns,np杂化轨道与电负性 较小的配位原子,如CN-、NO2-等形成内轨型配合 物。例如[Fe(CN)6]3-配离子,Fe采用d2sp3内轨型 杂化轨道,配合物的键能大,稳定,在水中不易 离解。
(3)内、外轨型配合物的测定---磁矩
由磁矩可判断内轨或外轨型配合物
s n—分子中未成对电子数
z
y
x
x
dz2
y z
dx2-y2
z
x
x
y
dxy
dxz
dyz
1.分裂能 (1)分裂能与配合物几何构型的关系
八面体型的配合物
在八面体型的配合物中,6个配位体分别占据八 面体的6个顶点,由此产生的静电场叫做八面体场。
(1)八面体场
八面体场中d轨道能级分裂
dz2 dx2-y2 eg 3 5 Δo =6Dq Δ o =10Dq 2 5 Δ o = 4Dq t2g dxy dxz dyz
[CrCl6]313600
[MoCl6]319200
分裂能与配位体的关系:光谱化学序列
[CoF6]3- [Co(H2O)6]3+ [Co(NH3)6]3+ o/cm-1 13000 18600 22900 [Co(CN)6]334000
配合物中的化学键理论.
例:(见例4、例6、)
8
②、内轨型配合物: A、定义: 指形成配合物时,中心离子提供外层 ( ns,np ) 和 次 外 层 空 轨 道 (n - 1)d 进 行 杂 化而与配体结合所形成的配合物。 B、特点: a、提供外层(ns, np)和次外层空轨道 (n-1)d进行杂化成键。 b、杂化类型为:dsp2和d2sp3杂化。 c、配合物有较少(或没有)未成对电子数。
10
例 : [Co(NH3)6]2+ 为 外 轨 型 , 则 [Co(NH3)6]3+为内轨型。 D、内轨型配离子的稳定性大于外轨型配离 子。
原因:由于次外层轨道能级比最外层的 低。
11
内容小结:
①:杂化——构型——类型
n M用以杂 杂化 空间构型 类型 化的轨道 轨道
示例
2 ns、np sp 直线型
外层轨道
成键类型: 外轨配键
内轨配键
配合物的类型: 外轨型
内轨型
成单电子状态: 高自旋
低自旋
空间构型
正四面体
平面正方形
5
规律:中心离子dsp2 杂化,配离子的空间构 型为平面正方形。
类似有:[Cu(NH3)4]2+、[Pt(NH3)4]2+等。
③、配位数为6的配离子 也有两种成键方式
A、以 SP3d2 杂化轨道成键: 例:
Ag(NH3)2+
4 ns、np sp3 正四面体 外轨型 Ni(NH3)42+
(n-1)d、 dsp2 平面四方 内轨型 Ni(CN)42ns、np
6 ns、np、 sp3d 正八面体 外轨型
nd
2
配合物的化学键理论

配体场理论
配位场理论是晶体场理论的发展,分别 取其晶体场理论和分子轨道理论的优点 结合而成。对中心离子与配体静电作用 部分用晶体场理论来处理,而共价作用 部分用分子轨道理论来处理。
遵循成键三原则:能量近似、最大重叠 和对称性匹配原则。
在理论上比晶体场理论等方法更为严谨, 所得的结果常用来补充晶体场理论的不 足。
一.判断配合物的空间构型 二.判断配合物的成键类型 三.判断配合物的磁性 四.价键理论的特殊应用
(一) 判断配合物的空间构型
杂化类型决定配离子的空间构型;杂化轨道数 等于中心原子的配位数。
价键理论顺利地解释了配合物的分子构型:
配位数
2
3
4
杂化轨道
sp
sp2
sp3
4 dsp2
分子构型 直线 三角形 正四面体 正方形
配位数
5
杂化轨道 sp3d d2sp2,
分子构型 三角双锥
5 d4s 四方锥
6 sp3d2, d2 正八面体
➢ 2配位的配合物 [Ag(NH3)2]+
Ag+(d10)的电子结构:
4d
5s
5p
[Ag(NH3)2]+的结构 4d :
sp杂化 5p
H3N NH3
结果: [Ag(NH3)2]+形成前后, 中心原子的d电子
单击此处添加标题
第4讲 配合物的化学键理论
单击此处添加标题
配合物的化学键理论,主要研究中心原子和 配体之间结合力的本性;
并用来说明配合物的物理和化学性质:如配 位数、几何构型、磁学性质、光学性质、热 力学稳定性、动力学反应性等。
单击此处添加标题
静电理论 体场理论
分子轨道理论
第3章 配合物的化学键理论

Mn2+ < Co2+ Ni2+ < V2+ < Fe3+ < Cr3+ < Co3+ < Mo3+ < Rh3+ < Ir3+ < Pt4+
3. 晶体场理论
3. 晶体场理论
(3)配体的性质和光谱化学序
(A)同一金属、不同配位原子对的影响 I < Br < Cl < S < F < O < N < C
MXL5:拉长 / 缩短八面体
3. 晶体场理论
3. 晶体场理论
3.2 晶体场分裂能( )及其影响因素
晶体场分裂能( ):d轨道能量分裂后,最高能量d轨道与最低能量 d轨道之间的能量差。相当于1个电子从能量最低d轨道跃迁至能量最高d 轨道所需吸收的能量。
影响因素:
(1)晶体场类型
八面体场、四面体场、平面正方形场· · · · · ·
[Co(NH3)6]3+
o = 23000 cm-1
(C)中心金属离子半径:半径越大, 越大。 中心离子半径越大,d轨道离核越远,易在配体场作用下改变能量, 增加。 同族元素, 随中心离子轨道主量子数的增加而增加: 3d4d, 增加约40%50%; [Co(NH3)6]3+ [Rh(NH3)6]3+ 4d5d, 增加约20%25%
原子半径减小 电负性减小
(B)光谱化学序列 (spectrochemical series) 弱场 I-<Br-<S2-<SCN-<Cl-<NO3-<F-<(NH2)2CO<OH- ~
CH3COO- ~ HCOO-<C2O42-<H2O<NCS-<gly-<CH3CN<edta4<py < NH3<en<NH2OH<bpy<Phen<NO2-<PPh3<CN-<CO 强场
第三章 配合物化学键理论

1 d 轨道在晶体场中的分裂
d 轨道在八面体场中的能级分裂
•dxy、dxz 、 dyz 、 dx2-y2 、 dz2在球形 对称场中,受到的作用相等,为简 并轨道;
•若有一个配合物ML6,M处于八面 体场oh中,由于L沿着x、y、z轴方向 接近中心离子, dxy、dxz 、 dyz 正好 插入配位体L的空隙中间,受静电排 斥相对较小,能量较低、而dx2-y2 、 dz2正好正对着配位体L,受静电排 斥相对较大,能量较高。
(σ-π的协同效应)
当配位体给出电子对与中心元素形成 键时,如果中心元素的
某些d 轨道(如dxy、dyz、dxz)有孤电子对,而配位体有空的p分子轨
道(如CO中有空的 p*轨道) 或空的 p或 d 轨道,而两者的对称性又匹 配时,则中心元素的孤对 d 电子也可以反过来给予配位体形成所谓
的“反馈 p 键”,它可用下式简示:
⑴ 正八面体配离子中d轨道的能级分裂 在过渡金属的自由离子中,五个d轨道的空间取向虽 然不同,但他们的能量却是相同的,是五个简并轨道,设 其能量为E。如果中心离子处在球形对称的电场中,由于 负电场在各个方向的斥力相同,五个d轨道能量升高的程 度也相同,因此,五个d轨道的能量虽都有升高,但并不 发生分裂,设其能量E=0 Dq。
d 轨道在四面体场中的能级分裂
在球型场中 在四面体场中
组轨道的能量与八面体场中正好相反。其能量差用 符号△T表示: △T = E(t2g) - E(eg)
d 轨道在平面正方形场中的能级分裂
在球型场中 在平面四边形场中
dx2–y2
dx2–y2
dz2
Δ
0
eg
dxy dxy dxz dyz dxz
2/3Δ dz20 dyz1/12Δ 0
配合物的化学键理论

配合物的化学键理论The Chemical Bond Theories of Complexes配合物的化学键理论处理中心原子(或离子)与配体之间的键合本质问题,用以阐明中心原子的配位数、配位化合物的立体结构以及配合物的热力学性质、动力学性质、光谱性质和磁性质等。
几十年来,提出来的化学键理论有: 静电理论(EST) Electrostatic Theory 价键理论(VBT) Valence Bond Theory 晶体场理论(CFT) Crystal Field Theory分子轨道理论(MOT) Molecular Orbital Theory 角重叠模型(AOM) Angular Overlap Model在这一节中,我们讲授配合物的价键理论和晶体场理论。
分子轨道理论和角重叠模型在后续课程中学习。
一、价键理论(Valence Bond Theory )L .Pauling 等人在二十世纪30年代初提出了杂化轨道理论,首先用此理论来处理配合物的形成、配合物的几何构型、配合物的磁性等问题,建立了配合物的价键理论,在配合物的化学键理论的领域内占统治地位达二十多年之久。
1.价键理论的基本内容:(1) 配合物的中心体M 与配体L 之间的结合,一般是靠配体单方面提供孤对电子对与M 共用,形成配键M ←∶L ,这种键的本质是共价性质的,称为σ配键。
(2) 形成配位键的必要条件是:配体L 至少含有一对孤对电子对,而中心体M必须有空的价轨道。
(3) 在形成配合物(或配离子)时,中心体所提供的空轨道(s 、p ,d 、s 、p 或s 、p 、d)必须首先进行杂化,形成能量相同的与配位原子数目相等的新的杂化轨道。
2.实例:(1) 主族元素配合物 Be 4O(CH 3COO)6:每个Be 原子都采取sp 3杂化-4BF :B 原子为sp 3杂化,正四面体构型 -36AlF :-3][ Al 3+周围共有12个价电子 Al 3+采取sp 3d 2杂化 (2) 过渡元素配合物a .(n - 1)d 10电子构型中心体+243)Zn(NH sp 3杂化 正四面体-3HgI sp 2杂化 平面三角形b .(n - 1)d 8电子构型中心体F Al F F F FF+243])[Ni(NH sp 3杂化 正四面体 -24]Ni(CN)[ dsp 2杂化 平面四方-24PtCl dsp 2杂化 平面四方c .(n - 1)d x (x <8)电子构型中心体-36Fe(CN) d 2sp 3杂化 正八面体+363])[Co(NH d 2sp 3杂化 正八面体 +263])[Co(NH sp 3d 2杂化 正八面体-36FeF sp 3d 2杂化 正八面体3.讨论:(1) 配合物中的中心体可以使用两种杂化形式来形成共价键:一种杂化形式为(n - 1)d 、n s 、n p 杂化,称为内轨型杂化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
④、成键过程:
17
[Ag(NH3)2]+的形成过程 解:Ag+的价电子构型为 4d10 5s0
5p 5s 4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
SP杂化 5p
4d
↑↓ ↑↓ ↑↓ ↑↓ ↑↓
sp
:NH3 :NH3
↑↓ ↑↓ ↑↓
5p
2NH3
4d
↑↓ ↑↓ ↑↓ ↑↓
重叠
返回3
18
例:
[Ni(NH3)4]2+的形成 。
↑ ↑
3d
↑ ↑ ↑
4d
SP 3d2 杂化
3d
↑ ↑ ↑ ↑ ↑
sp3d2
23
6F重叠
4d
:F- :F- :F- :F- :F- ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
↑ ↑
3d
↑ ↑ ↑
:F- ↑↓
sp3d2
返回5
24
例: [Fe(CN)6]3-的形成。 解:Fe3+ 的价电子构型为
4S 3d
↑ ↑ ↑ ↑ ↑
③规律:中心离子 SP3d2 与d2SP 3 杂化, 配离子的空间构型均为正八面体形。
7
3-
3-
3、 外轨型配合物和内轨型配合物 ①、外轨型配合物:
A、定义:指形成配合物时,中心离子全部采用 外层空轨道(ns, np, nd)进行杂化,并与配体结 合而形成的配合物。
B、特点:
a、中心离子仅采用外层空轨道(ns, np, nd) 进行杂化成键。 b、杂化类型为:sp3和sp3d2杂化。 c、配合物有较多的未成对电子。
4
B、以dsp2杂化轨道成键:
例:
成键结果分析比较: 2+ 2①Ni(NH3)4 ②Ni(CN)4 M 用以杂 4s 4p (4-1)d 4s 4s 化的轨道: ns np (n-1)d ns np 杂化特点:全部用外层轨道 使用内层轨道和 外层轨道 成键类型: 外轨配键 内轨配键 配合物的类型: 外轨型 内轨型 成单电子状态: 高自旋 低自旋 空间构型 正四面体 平面正方形
2
FeF63Fe(CN)6312
d2sp 正八面体 内轨型
3
②:内轨型和外轨型配合物特性比较
键型 杂化类型
内轨型配合物 内轨配键
(n-1)d、ns、np
外轨型配合物 外轨配键
ns、np、nd
轨道能级 稳定性 离解性
低 大 小
高 小 大
思考:在FeF63-和Fe(CN)6-溶液中,哪一溶液 中的自由Fe3+浓度大? 问题:如何知道配合物的键型和类型? 13
例:(见例4、例6、)
8
②、内轨型配合物: A、定义: 指形成配合物时,中心离子提供外层 (ns,np)和次外层空轨道(n-1)d进行杂 化而与配体结合所形成的配合物。 B、特点: a、提供外层(ns, np)和次外层空轨道 (n-1)d进行杂化成键。 b、杂化类型为:dsp2和d2sp3杂化。 c、配合物有较少(或没有)未成对电子数。
4、配合物的磁性
磁性:指配合物在外磁场作用下,表现出: ①、排斥外磁场,表现抗磁性(反磁性)---指在外磁 场感应下,物质内部的磁力线与 外磁场的方向相反的 现象。当物质中没有 未成对电子时表现出抗磁性。 ②、顺着外磁场,表现顺磁性----当物质中有未 成对电子时,表现出顺磁性。 磁性量度:
μ nn 2 --- n为未成对电子数
以磁矩μ量度,μ的单位:波尔磁子(B•M)14
当测出:μ = 0 ,无成单电子,抗磁性。 μ ≠ 0,有成单电子,顺磁性。 μ ∝ 成单电子数n
μ与n取值关系: n : 1 2 3 4 5 μ(B•M): 1.73 2.83 3.87 4.90 5.92 问题:根据μ与n的对应关系,设计推理配合物 杂化类型,键型和类型的思维程序。
例:(见例5、例7、)
9
③、说明: A、当配体为F - 、H2O、OH - 时较易形成 外轨型配合物。 原因:配位原子电负性较大,不易给出 孤对电子,为弱场配体。 B、当配体为CN-、NO2-时容易形成内轨 配合物。 原因:配位原子电负性较小,容易给出 孤对电子,为强场配体。 C、而当配体为Cl - 、NH3 时,则可内可外。 此时中心离子正电荷愈多,对配体的吸引力 愈大,愈容易形成内轨型配离子。
4p
4s 3d
↑↓ ↑↓ ↑↓ ↑ ↑
dSP2杂化
4p
3d
↑↓ ↑↓ ↑↓ ↑↓
dsp2
21
4CN重叠 3d
↑↓ ↑↓ ↑↓ ↑↓
:CN- :CN :CN- :CN
4p
↑↓Βιβλιοθήκη -↑↓↑↓
-
↑↓
dsp2
22
返回4
例:
[FeF6]3-的形成 。
解:Fe3+的价电子构型为 3d54s0 。
4d 4p 4s
3d54s0
。
d 2sp 3杂化
4d
4P d2SP 3
3d
↑↓ ↑↓ ↑
d2SP3
25
6CN重叠 3d
↑↓ ↑↓ ↑ :CN- :CN- :CN- :CN- :CN- :CN- ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
4d
d2sp3
返回6
26
10-4
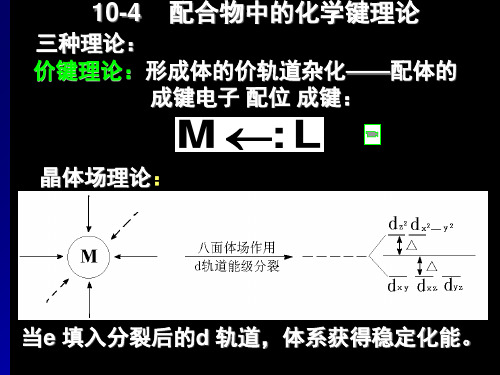
配合物中的化学键理论
三种理论: 价键理论:形成体的价轨道杂化——配体的 成键电子 配位 成键:
M : L
晶体场理论:
当e 填入分裂后的d 轨道,体系获得稳定化能。 1
配位场理论:在晶体场理论基础上,考虑M与L 在成键 时原子轨道的重叠。
2
一、价键理论 1、理论要点 (1)、 配离子的中心离子和配位体是以配位键 结合的。其中心离子M必须有空轨道,而配 位体L要有未成键的孤对电子。 即
5
规律:中心离子dsp2 杂化,配离子的空间构 型为平面正方形。 类似有:[Cu(NH3)4]2+、[Pt(NH3)4]2+等。
③、配位数为6的配离子 也有两种成键方式 A、以 例: B、 以 例:
SP3d2 杂化轨道成键:
d2SP3 杂化轨道成键:
6
问题:[FeF6] 和[Fe(CN)6] 的成键特征是什么? 答案: ①、成键状态特征:M全部使用外层轨道ns、 np、nd杂化,形成外轨道配键,配合物属外 轨型,高自旋态。 ②、成键特征:(n-1)d 轨道参与杂化,形成内 轨配键,配合物属内轨型,低自旋态。
10
例 : [Co(NH3)6]2+ 为 外 轨 型 , 则 [Co(NH3)6]3+为内轨型。 D、内轨型配离子的稳定性大于外轨型配离 子。 原因:由于次外层轨道能级比最外层的 低。
11
内容小结: ①:杂化——构型——类型
n M用以杂 化的轨道 2 ns、np 4 ns、np (n-1)d、 ns、np 6 ns、np、 nd (n-1)d、 ns、np 示例 杂化 空间构型 类型 轨道 sp Ag(NH3)2+ 直线型 sp3 正四面体 外轨型 Ni(NH3)42+ dsp2 平面四方 内轨型 Ni(CN)42sp3d 正八面体 外轨型
15
推理程序: 推 结合M的d电子组态 推 据测μ n 推M的杂化类型 键型 推 配合物类型 22+ 实例:经测定MnCl 4 的μ= 5.88 B•M,Mn 的d 5,请推定MnCl 2-的键和类型。 电子组态 d 4 推出 解答:据μ= 5.88 n= 5,得结论: ①、d5 电子未重排。 2+ 3 ②、Mn 采取ns、np 杂化得sp 杂化轨道。 2③、MnCl 4 的键型为外轨配键属外轨型,高 自旋态。
解:Ni2+的价电子构型为 3d84s0 。
4p
4s
3d
↑↓ ↑↓ ↑↓ ↑
↑
SP3杂化
3d ↑↓ ↑↓ ↑↓
↑
↑
sp3
19
4NH3 重叠
3d
↑↓ ↑↓ ↑↓ ↑ ↑
:NH3 :NH :NH3:NH3
↑↓
3 ↑↓
↑↓
↑↓
sp3
返回4
20
例: [Ni(CN)4]2-的形成 。
解:Ni2+的价电子构型为 3d84s0 。
M : L
(2)、成键时,中心离子提供的空轨道先化, 形成的杂化轨道再与配原子中有孤电子对的 价轨道进行重叠,形成配位共价键。
3
2、 配离子的空间构型 ①、配位数为2的配离子 中心离子sp杂化,空间构型为直线型。 如 [Ag(CN)2]-等。 例: ②、配位数为4的配离子 有两种成键方式 A、以sp3杂化轨道成键 : 中心离子sp3杂化,配离子的空间构型为 正 四面体。 如: [Zn(NH3)4]2+、[HgI4]2-等。 例:
