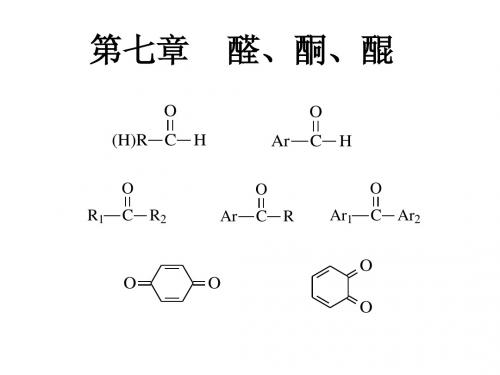
醛酮醌
有机化学 第9章 醛、酮、醌

O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
第八章醛酮醌

CH3CH2CH2CHO
BrCH2CH2CHO + HOCH2CH2OH
H+
O
BrCH2CH2
H3O
O
CH3CH2CCLi
O
+
CH3CH2CCCH2CH
2
O
CH3CH2CCCH2CH2CHO + HOCH2CH2OH
O
Br
HOCH2CH2OH C6H6
O
O Br
O NaOH C2H5OH
O
+ H3O
方法b:
CH3I
Mg µµ
CH3 CH3-CH-CHO
H2O/H
+
CH3 CH3-CH-CH-CH3 OH
由于乙醛及2-溴丙烷都很容易得到,故方法a较为合理。
(5) 加炔钠
(1) CH C Na ,液NH 3,-33 C (2) H 2O,H+,65%-75%
+
。
O
OH C CH
炔醇
R-CC-Na+ NaNH2 (-NH3) R-CCH
第九章 醛、酮、醌
在醛和酮分子中,都含有一个共同的官能 团—羰基,故统称为羰基化合物。
C
O
官能团:
C O 醛
(羰 基) O R-C-H (-CHO为醛基) O
' (两个R可以相同,也可不同) 酮 R-C-R °
• • • • • • • •
分类: ① 根据烃基的不同,可将醛、酮分为: 脂肪族醛、酮,芳香族醛、酮; 饱和醛、酮,不饱和醛、酮; ② 根据醛、酮分子中羰基的个数,可分为: 一元醛、酮,二元醛、酮等; ③ 根据酮羰基所连的两个烃基是否相同,分为: 单酮,混酮。
醛、酮、醌
无水HCl
R C
OH OR'
R'OH
无水HCl
R C H
OR' OR'
半缩醛
缩醛
醛与醇生成半缩醛、缩醛的反应是按下列历程进行的:
R H C O H
+
R H
R C O H
Ⅰ
+ +
H
C OH
+
.. R'OH
R C H
OH
+ .OR' .
H
Ⅱ
-H
+
R C H
OH OR'
H O C CHOH CHOH CHOH .. CH2 OH
分子内的六员环状半缩醛
H
OH C CHOH CHOH O CHOH CH2
4. 与格氏试剂的加成反应
格氏试剂是较强的亲核试剂,非常容易与醛、酮 进行加成反应,加成的产物不必分离便可直接水解生 成相应的醇,是制备醇的最重要的方法之一。
无水 乙 醚 R C O MgX H2O H
+
C O + RMgX
R C
OH
+ Mg(OH)X
甲醛与格氏试剂加成产物水解后可以得到比格氏试剂 分子中的烃基多一个碳原子的伯醇;其它醛与格氏试剂 加成后,水解的最终产物是仲醇;酮与格氏试剂加成后, 水解的最终产物是叔醇。
H C O + R MgX H
无水乙醚
H R C OMgX H H2O H
+
HCl OH R C SO3Na R Na2CO3 (CH3)H C O + Na2SO3 + NaHCO3 H(CH3) R C O (CH3)H + NaCl + SO2 + H2O
第9章 醛酮醌
说明:
Ⅰ用途:鉴别醛类 制不饱和酸
Ⅱ只氧化醛基,不影响双键。
幻灯片48
练习:
步骤:
羟醛缩合,加热脱水,本尼迪特试剂作用.
幻灯片49
5.还原反应 (适应 醛酮)
1)羰基还原为羟基
Ⅰ催化氢化
幻灯片50
幻灯片51
Ⅱ金属氢化物NaBH4 (硼氢化钠)
优点:选择性强,只还原醛、酮、酰卤中的羰基,不还原其它基团。
异丁醛
丙烯醛
幻灯片6
B.酮酮的命名与醚相似,按照羰基所连烃基来命名。
二甲(基)酮
苯乙酮
幻灯片7
系统命名法
选主链:含羰基和重键,Ar–取代基
编 号:近羰基端,指明羰基位置和数目
3-甲基丁醛
βα
β-甲基丁醛
3-苯基-2-丙烯醛
幻灯片8
4-苯基-2-丁酮
4-羰基戊醛
或:4-ቤተ መጻሕፍቲ ባይዱ酮醛
幻灯片9
练习
Z-13-二十碳烯-10-酮
幻灯片52
幻灯片53
2)羰基还原为亚甲基的反应
Ⅰ沃尔夫—凯惜纳—黄鸣龙反应
幻灯片54
练习:
步骤: 酰基化, 黄鸣龙反应.
幻灯片55
Ⅱ克莱门森还原法Zn—Hg / HCl
对碱敏感时可用克莱门森还原法(锌汞齐)
幻灯片56
幻灯片57
6.歧化反应——坎尼扎罗(Cannizzaro)反应
条件: 无α-H 的醛
反应活性
亲核试剂一定,不同类型醛酮反应活性大小
结论:醛>酮,R小的> R大的
幻灯片20
④分析
相同点:都有双键,都能加成.
不同点:
亲核加成
8.1醛酮醌

强调:分子式相同的醛和酮互为同分异构体。 举例:
O CH3 CH2 C H
O CH3 C CH3
含有共轭环已二烯二酮结构的一类化合物称为醌
O O 对苯醌 O O H3C O CH3 O O 1,4-萘醌
邻苯醌
O 2,5-二甲基对苯醌
醌的结构、 第一节 醛、酮、醌的结构、分类和命名
一、醛、酮的结构
ch甲基乙基甲酮甲乙酮chchch甲基乙烯基甲酮ch乙基环己基甲酮醛的命名与醇的习惯命名法相似称某醛脂肪酮则按酮基羰基所连接的两个烃基而称为某某酮简单的烃基或芳基写在前
第八章 醛、酮、醌
8.1醛、酮、醌的 醛 结构、分类、命名及物理性质 结构、分类、
醛和酮是含氧有机化合物。他们的分子中都含有羰基 所以醛和酮又称为羰基化合物。 醛:在羰基上至少连有一个氢原子的化合物。 举例: 官能团:
5、醌的颜色 、 醌类一般都有颜色,对位醌多呈黄色,邻位醌 类一般都有颜色,对位醌多呈黄色, 呈红色或橙色。所以它是许多染料和指示剂的母 多呈红色或橙色。所以它是许多染料和指示剂的母 体。 O O O O = = O
对苯醌
黄色) (黄色)
=
=
1, 2-萘醌 萘醌 红色) (红色)
=
邻苯醌
(红色) 红色)
π 键 C
2
O C O
σ 键
H 116.5。
121.8 。 C O
sp 杂化
π
H 近平面三角形结构
δ C δ O
C
O
C
O
电负性 C < O
π 电子云偏向氧原子
极性双键
醛和酮的官能团是羰基,在羰基中碳原子以双键与氧原子相连,与碳 碳双键相似,碳氧双键也是由一个σ键和一个π 键组成的。 C=O双键中氧原子的电负性比碳原子大,所以π电子云的分布偏向氧原 子,故羰基是极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。
有机化学——醛、酮、醌

? OH
OH CH3CHCHCHO CH3 OH CH3CH2CHCHCHO CH3 OH CH3CH2CHCH2CHO
(4)交叉醇醛缩合反应 (Claisen-Schmidt reaction)
OH CHO + CH3CHO CH-CH2CH=O
延长碳链!
CH=CH-CH=O
肉桂醛
(5). 分子内的醇醛反应
1) Et2O 2) H+
OH CH2CH3
O HC NH3 C Na
ONa C CH
H2O
OH C CH
(二)α-H 的反应
1、烯醇 化 H C H
H
C O C C H OH
+ C H 酮式 C O H
+
C
..
C
O (1)
碳 负离 子 H + C C O (2) 烯醇 阴 离 子
(α- H)
O Na2CO3,H2O OH -H2O O O
O
1,6-环葵二酮
(三)、歧化反应(Cannizaro’s reaction)
NaOH HCOONa + CH3OH 2 HCHO △
CHO + HCHO
(氧化剂)
(还原剂)
Na OH △
CH2OH + HCOONa
1、歧化化反应机理
CHO CHO COOH CH2OH
H
+ R
OCH3 C H OH2 +
-H2O R
OCH3 C + + O H H
OCH3 R-CH
+ H OCH
3
R
缩醛
OCH3 CH3OH + C OCH3 R-C H H
第八章 醛、酮、醌

3,4-二甲基戊醛
CH3 H 2C C H C H C H 2C H O
4-甲基-3-己酮
O C H 3C H C H C H 2C C H 3
3-甲基-4-戊烯醛
CH3 CH3 CH2 CH
4-己烯-2-酮
CHO
三、醛和酮的物理性质
除甲醛是气体外,低级饱和醛、酮是液 体,高级醛、酮为固体。 2.沸点 沸点比分子量相当的烃及醚高。 3.溶解性 低级的醛酮可溶于水。 四、羰基的结构 1.状态
+
C H I3
氧化性
C H 3C H 2 O H I2 Na OH C H 3C H O
I2 Na OH C H I3
+
HC O ONa
C H3C H C H2C H3 OH
N a OI
C H3C C H2C H3 O
Na OI
C H I3
+ C H 3C H 2C O O N a
2.由甲基酮---→羧酸(少1C)
92%
2.羟醛(酮)缩合反应
O 2 CH3 C H 稀 OH
α,β -不饱和醛
C H 3C H CHCHO
反应机理:
O
O CH2 C H
1) O H
O
+
H CH2 C H
+
H 2O
O
碳负离子
C H3 C H C H2C H O O
2) C H 3 C H 3)
H 2O
+
CH2 C H
氧负离子
CH3 CH CHCH O OH H
H 2O
H
+
C H 2OH C H 2OH
在有机合成中利用这一性质来保护醛基
醛、酮和醌

比较下列化合物亲核加成的活性次序
NO2
> CHO
> CHO
H3C
CHO
Cl O
> Cl C C H Cl
HO HC C H
H
六、 醛酮的化学性质
2. 羰基的亲核加成 (1) 与亚硫酸氢钠加成
R C
H
(CH3)
O + NaHSO3 ( 饱和)
R
C H (CH3)
ONa SO3H
R
OH
C
H
SO3Na
(CH3)
H
H
OH
H
OH
质子化的羰基
半缩醛
R
OR'
C
H+
R
OR'
C
H2O
R
+
C OR'
H
OH
H
O+ H2
H
R'
R'OH
R +OH
C
H
OR'
H+ R
OR'
C
H
OR'
为了使平衡向生成缩醛的方向移动,必须使用过量的醇或从反应 体系中把水蒸出。
六、 醛酮的化学性质
(b) 缩酮的生成 酮也可以在干HCl气或无水强酸催化下与醇反应形成缩酮 但反应速度要慢得多,且平衡大大偏向左方:
按含羰基的饱和性分
饱和醛酮 不饱和醛酮
CH3CHO
O CH2=CH C H
按烃基的类别分
脂肪醛酮 芳香醛酮
R CHO
Ar CHO
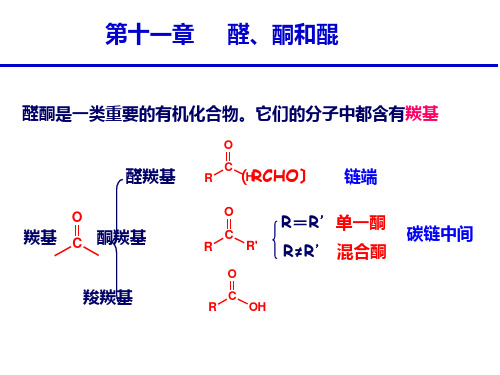
第十一章 醛、酮和醌
醛酮的命名 醛酮的制法 醛酮的物理性质 醛酮的波谱性质 醛酮的结构 醛酮的化学性质 不饱和醛酮的性质 卡宾 醌
醛、酮和醌
CH3 +
CH3 CHO
二、 醛酮的制法
(4) 醇的氧化 R ' CHOH R
[O]
R ' C=O R
OH
[O]
=O
氧化剂:KMnO4、K2Cr2O7 / H+、HNO3等
RCH2OH [H]
[O]
RCHO
CHO
+ O2
V2O5
铬酰氯
CH2CH3 + O2 硬脂酸钴 COCH3
芳烃侧链的氧化发生在α-H
二、 醛酮的制法
2. 醛和酮的实验室合成 (1) 烯烃
RCH
臭氧化--还原水解
CHR' O3 Zn / H2O RCHO + R'CHO O C CHR'' O3 Zn / H2O R C R' + R''CHO
O
H2 Pd-BaSO4
硫-喹啉
CH3CH2CH2C H
二、 醛酮的制法
O CH CH
NaNH2, NH3(l) CH3CH2CH2CH2Br
CH
CH3CCH2CH2CH2CH3
H2O HgSO4, H2SO4 CCH2CH2CH2CH3
二、 醛酮的制法
CH3 Cl CHO Cl
H2SO4,high,T
CH3 1) Fe,Cl2 2) H3O+ SO3H
CrO2Cl2 CH3 Cl Cl
第十一章 醛、酮和醌
醛酮的命名 醛酮的制法 醛酮的物理性质 醛酮的波谱性质 醛酮的结构 醛酮的化学性质 不饱和醛酮的性质 卡宾 醌
有机化学-第九章醛酮醌

3、低级醛酮的沸点比相对分子量相近的醇低。 (分子间无氢键)。
4、低级醛酮易溶于水,醛酮都能溶于水。丙酮能 溶解很多有机化合物,是很好的有机溶剂。
二、 醛酮的化学性质
1、 加成反应
• 烯烃的加成一般为亲电加成; • 醛酮的加成为亲核加成,易于HCN、NaHSO3、ROH、 RMgX等发生亲核加成反应。
(1)一般过酸 + 无机强酸(H2SO4) (2)强酸的过酸 :CF3COOOH (3)一般酸 + 一定浓度的过氧化氢(产生的过酸立即反应)。
反应机理
O
H+ +OH
R-C-R'
R-C-R'
OH
R-C-R'
+
-H+ O R"COO-H
OH R-C-R'
O-OCR" O
R
O
R' C
O O
H
O
C R"
R’重排 O-O键断裂 -R”COO- , -H+
(1)碳碳双键加成
2,3,5,6-四溴环己二酮
注意:两种方法的适用范围
• 克莱门森还原——适用对酸不敏感的化合物; 如:NH2-CH2-CH2-CO-CH3,就不能用此方法,
含有-NO2也被同时还原。 • 武尔夫-克日聂尔-黄鸣龙反应——适用对碱不敏感的
化合物; 如:含有羧基等就不行。
补充:
-CO,-NO2均 还原!
用HCl,可使 之变为酚!
• 由于醛基直接连在芳环上的芳醛都没有氢原子, 所以可以用坎尼扎罗反应来制备芳香族醇:
二、烃基的反应
1、α-氢原子的卤代反应
第八章醛、酮、醌.ppt.Convertor

第八章醛、酮、醌.ppt.Convertor第八章醛、酮、醌主要内容醛、酮、醌的结构、分类和命名醛、酮、醌的物理性质醛、酮、醌的化学性质重点:醛酮的结构及化学性质醛、酮、醌的特点醛的两个游离基至少连一个氢,-CH=O是醛基。
如:CH3CHO 。
醌具有环己烯酮的结构特点。
如都含有官能团,叫羰基。
区别:酮的两个游离基都连烃基。
如CH3COCH3;§1、醛和酮一元醛酮:CH2O、CH3CHO、CH3COCH3饱和醛酮脂肪醛酮多元醛酮:乙二醛、2,4-戊二酮一、不饱和醛酮CH2=CHCHO、CH3COCH=CHCH3芳香醛酮C6H5COCH2CH3、C6H5COC6H5、C6H5CHO酮分为单酮和混酮。
混酮CH3COCH2CH3、C6H5COCH3单酮C6H5COC6H5、CH3CH2COCH2CH3饱和一元醛酮的通式为:CnH2nO。
㈠、分类醛酮概述㈡、醛酮的命名1、普通命名法醛的命名与醇相似;酮的命名与醚相似。
CH3CH2CH2CHO乙基异丙基酮异戊醛(β-甲基丁醛)甲基乙基酮丁醛2、系统命名法系统命名法与醇相似,母体是醛或酮。
CH3CHOCH3COCH3CH3COCH2CH3乙醛丙酮2-丁酮CH2=CHCHO丙烯醛2-甲基-4-溴3-2-甲基丙醛2-甲基-3-戊3-戊烯-2-苯甲醛苯乙醛苯乙酮2-苯基丙醛环戊基丙酮3-甲基环己酮二、物理性质常温下,甲醛:气体;C12以下醛、酮:液体;高级:固体。
沸点:醇、酚>醛、酮>醚、烃(分子量相近)因醛、酮为极性分子,但不能形成分子间氢键。
低级醛、酮易溶于水。
因能与水形成氢键。
高级醛、酮不溶于水,易溶于有机溶剂。
低级醛具有刺激气味, C8~13醛、酮和一些芳香醛具有花果香味。
C9、C10的醛可三、醛酮的结构C:sp2杂化;三个σ键,一个π键;键角:120°,C=O键长:122pm羰基具有极性。
四、醛酮的化学性质Nu-:CN-、RO-、R结构决定性质。
醛、酮、醌

醛拼音:quán醛([Chemistry] aldehyde):有机化合物的一类,是醛基(-CHO)和烃基(或氢原子)连接而成的化合物。
醛-结构醛的通式为R-CHO,-CHO为醛基。
醛基是羰基(-CO-)和一个氢连接而成的基团。
醛-分类按照烃基的不同,醛可分为脂肪醛和芳香醛。
芳香醛的羰基直接连在芳香环上。
按照醛基的数目,醛可以分为一元醛(二元醛和多元醛。
按烃基是否饱和可以分为,饱和醛,不饱和醛。
醛-命名简单的醛常用普通命名法。
芳香醛中芳基可作为取代基来命名。
多元醛命名时,应选取含醛基尽可能多的碳链作主链,并标明醛基的位置和醛基[1]的数目。
不饱和醛的命名除醛基的编号应尽可能小以外,还要表示出不饱和键所在的位置。
许多天然醛都有俗名,例如,肉桂醛(cinnamaldehyde),茴香醛(anisaldehyde),视黄醛等(retinal)。
(注:饱和一元脂肪醛的通式为Cn H2n O,分子式相同的醛、酮、烯醇互为异构体)醛-重要反应银镜反应:R-CHO + 2Ag(NH3)2OH —(条件:水浴60℃加热)→ R-COONH4 + 2 Ag↓ + 3NH3↑ + H2O与新制氢氧化铜(斐林试剂、班氏试剂)反应:R-CHO + 2Cu(OH)2 —(条件:加热)→R-COOH + Cu2O↓ + 2H2O与溴水反应:R-CHO + Br2 + H2O —→ R-COOH + 2HBr加成反应:R-CHO + H2 —(条件:镍做催化剂,加热)→ R-CH2-OH2R-CHO+O2—(条件:铜或者银做催化剂,加热)→ 2R-COOH注:醛类也可通过和高锰酸钾反应(条件:加热)得到羧酸,方程式高中不需掌握甲醛与苯酚反应生成酚醛树脂反应规律在氧化还原反应中,醛类被氧化则生成酸,被还原则生成醇。
酮定义:酮是羰基与两个烃基相连的化合物(正式学名为“某基·某基甲酮”)。
根据分子中烃基的不同,酮可分为脂肪酮、脂环酮、芳香酮、饱和酮和不饱和酮。
大学有机化学------醛酮醌

鉴别反应:鉴别醛的存在。
注意:选择性氧化醛基(-CHO),不影响-OH, >C=C<键,酮基等,但是α-羟基酮可被上述试剂 氧化。 芳香醛只能还原吐伦(Tollens)试剂,甲醛 不能还原本尼地(Benedict)试剂。
(2)KMnO4/H+或K2Cr2O7/H+强氧化:
工业合成尼龙-66的原料 酮只能被强氧化剂氧化,断裂碳链。
4、氧化反应
醛易被氧化,而酮则难氧化 。
(1)弱氧化剂氧化: 吐伦(Tollens)试剂: 硝酸银的氨溶液 [Ag(NH3)2]+NO3-
斐林(Fehling)试剂: 由I和II组成。I是硫酸铜溶液;II是酒石酸钾 钠 和氢氧化钠的混合溶液。
本尼地(Benedict)试剂: 硫酸铜、碳酸钠和柠檬酸钠的混合液。
3-硝基-4-甲 基-苯 乙 酮
§1.2 醛、酮的结构
羰基 >C=O: 一个键、 一个键 , 与 CC 相似。
C=O双键中氧原子的电负性比碳原子大, 所以π电子云的分布偏向氧原子,故羰基是极 化的,氧原子上带部分负电荷,碳原子上带 部分正电荷。
δ C δ O
极性双键
所以羰基易与亲核试剂进行加成反应 ——亲核加成反应
缩醛或缩酮性质与醚相似,可视为同碳二元醇 的双醚在碱性溶液中稳定,对氧化剂、还原剂也 很稳定,遇酸分解为原来的醛、酮。 有机合成中常用来保护醛基或酮基。 缩醛(酮)对碱、氧化剂稳定。在稀酸溶液中 易水解成醛和醇:
在有机合成中,保护羰基。如:
HOCH 2
CHO
O
HOOC
CHO
HOCH 2
CHO OCH 3
CH3CH=CHCH2CHO
+ 2H2
大学有机化学-醛、酮、醌

第八章 醛、酮、醌Ⅰ 学习要求1. 掌握醛、酮的结构特征和分类。
2. 熟练掌握醛、酮的系统命名及其化学性质,了解醛、酮的物理性质。
3. 掌握亲核加成反应历程及影响因素,并能比较不同醛、酮加成反应活性顺序。
4. 了解醌的结构特点、命名和化学性质。
Ⅱ 内容提要一. 醛、酮的结构特点羰基是醛、酮的特征官能团,羰基中的碳原子及氧原子均为sp 2杂化,碳氧双键上的电子云偏向氧原子,使羰基碳原子的电子云密度显著减少,容易受亲核试剂进攻而发生亲核加成反应;受羰基的﹣I 效应的作用,羰基化合物的α﹣H 有一定的活性;羰基上连有氢原子而发生醛的氧化反应。
其反应主要发生在下列部位:二. 醛、酮的化学性质1. 亲核加成反应(π键断裂):醛、酮发生亲核加成反应的活性与羰基碳的缺电子程度及烃基对羰基的空间位阻程度有关: 综合影响的结果,其活性顺序为:RCH Hα—H 的反应醛的氧化反应羰基的亲核加成反应及还原反应(R')RCO C CNR'OHH 2O +C COOHR'OHC SO 3NaR'OHH+C R'OC OR"R'OHR"OH 干RC OR"R'OR"C R"R'OMgXH 2O +RC R"R'OHC NR'OHH Y 2C R"NY 与氢氰酸的反应,醛、脂肪族甲基酮及少于8个碳的脂环酮能发生该反应。
生成2-羟基酸,多用于增加1个碳原子的合成。
与饱和亚硫酸钠的反应,醛、脂肪族甲基酮及少于8个碳的脂环酮能发生该反应。
生成2-羟基磺酸钠,可用于分离或鉴别。
与醇的反应,生成半缩醛,不稳定,与过量的醇反应可生成缩醛,缩醛在碱性条件下稳定,在酸性条件下不稳定。
常利用该反应来保护羰基。
与格氏试剂的反应,经水解得到醇。
可用于制备结构较为复杂的醇。
与氨的衍生物的反应,该反应可用于鉴别或分离醛、酮。
9.醛、酮、醌

24
第一节、 第一节、醛和酮的分类和命名
1.2、醛和酮的命名 、 2. 系统命名法
回顾
a. 选择含羰基最多的最长的碳链为主链。 选择含羰基最多的最长的碳链为主链。 含羰基最多的最长的碳链为主链 b. 羰基编号尽可能小 羰基编号尽可能小——醛因醛基在碳链末端, 醛因醛基在碳链末端, 醛因醛基在碳链末端 因此编号总为 总为1,可以省略; 需注明羰基位置。 因此编号总为 ,可以省略;酮需注明羰基位置。 c. 若羰基在环外,可将环做为取代基。 若羰基在环外 环外, 将环做为取代基。
O O O Cl
O
二乙酮
甲乙酮
甲基-α-氯乙基酮 甲基环己基酮 甲基 氯乙基酮
5
第一节、 第一节、醛酮的分类和命名
2. 系统命名法
a. 选择含羰基最多的最长的碳链为主链。 选择含羰基最多的最长的碳链为主链。 含羰基最多的最长的碳链为主链
O
6 5 4 3 2 1
3-丙基 2, 5-己二酮 丙基丙基 己二酮
9
第二节、 第二节、醛和酮的结构和物理性质
2.2、醛和酮的物理性质 、
沸点: 比相应分子量的烷烃和醚类要高。 沸点:(1) 比相应分子量的烷烃和醚类要高。 (2) 比相应分子量的醇要低。这是由于醛 比相应分子量的醇要低。 酮分子间不能形成氢键,偶极-偶极的静电吸 酮分子间不能形成氢键,偶极 偶极的静电吸 引力没有氢键强。 引力没有氢键强。
第 九 章
醛、 酮、 醌
1
醛和酮
醛、酮都是含有羰基的化合物。 酮都是含有羰基的化合物。 羰基的化合物
O RCHO R O RCOR' R R' H
醛 酮
2
第一节、 第一节、醛和酮的分类和命名
第七章 醛、酮、醌

多元醛或酮:选含羰基最多的碳链做主碳链
分子中同时存在醛基和酮基时,醛为母体。酮羰基称羰基或氧代
O O C H 3C C H 2 C C H 3
2,4-戊二酮 O 5 4 3 2 1 CH 3C CH 2CH 2CHO 4-羰基戊醛(γ-羰基戊醛) 或,4-氧代戊醛
课堂练习
用系统命名法命名下列化合物:
(一)醛酮相似的反应
亲核加成反应
C=O与C=C双键都能发生加成反应,但是烯烃的加成属 于亲电加成,羰基的加成属于亲核加成
羰基的特征
δ C
δ O
极性双键,羰基碳原子缺电子,氧原子负电子,有两个反应中心
C
O +: Nu
慢
Nu C O
E
Nu
C OE
快
负氧离子中间体
1、与氢氰酸加成
醛、酮与氢氰酸发生加成反应,生成α-羟基氰
2、与氨的衍生物(羰基试剂)的加成
C O 通式:
R
R ( H)
C N
R
C=O + H-HN-G
R ( H)
C—N
OH H
G
-H2O
R R ( H)
C=N
G
一般用乙酸做催化剂,太强的酸会降低亲核试剂的亲核能力
羟胺
R
H 2N OH (R')H R C N OH
肟
肼 苯肼
H 2N
NH 2
(R')H
R (R')H
CH3CH2OH 氧化
I2/OH -
OH CH3CH R(H)
I2 /OH卤化
O CH3C R(H)
OH-
CH3CHO
CI3CHO
CH I3 + HCOO-
第七章 醛、酮、醌

4、 与H2O加成:
多数醛、酮的反应平衡偏向左边。 特殊结构的醛、酮水合物:
O
5、与醇加成:
无水酸(干燥氯化氢)
反应机理:
第一步:亲核加成 第二步:亲核取代:不断将水蒸出,有利于反应进行
缩醛在酸性条件下水解,重新得到醛、酮。 缩醛对氧化剂、还原剂、碱稳定。 ——官能团保护,保护羰基。
例4:合成题:
CHO CH CHCHO CHO
OH
苯甲醛
β-苯基丙烯醛
(肉桂醛)
邻羟基苯甲醛 (水杨醛)
C H O O
C H O
C C H 3
O
C C H 3
C H C H C H O
C H C H C H O
(二)、酮 1、脂肪酮或脂环酮 (1)、系统命名法: ①、原则与相应醇的命名相同:
1CH32C3CH24CH25CH2 6CH3
反应的历程为:
C δ+ δ-O+-CN [ C O- ] H+ C OH
CN
CN
影响反应的因素:
①、碱和酸 由于:HCN
H++CN-
因此在反应体系中加入碱,能大大加速反密度越低,反应越 容易进行。
亲核加成的活性顺序:
H
H
H
CO>CO>CO
4、加成方式:1,2-或1,4-加成
H CH3 4CH 3CH 2C 1O+RMgX
1,2-加成
CH3 CH CH CH OMgX R
H+,H2O
CH3 CH CH CH OH R
H CH3 4CH 3CH 2C 1O+RMgX
1,4-加成
CH3 CH CH CH OMgX R H+,H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5-乙基-6-羟基- 3-庚酮
O CH3CH2CCH2CHO
3-戊酮醛 书176、154页
7.2 醛、酮的结构
O
羰基 >C=O: 一个键、 一个键 羰基碳:sp2杂化;羰基为平面型。 121.7o
121pm
C
116.6o
羰基是极性基团。
(D) CH3
C
CH2C6H5
(E) C6H5COCH3
(A)、 (B) 、(C) 、(D) 均可
再来回顾反应历程: (—)
Nu:
slow d+ dNu
H+
fast Nu
H
O
其中关键一步: δ-
O
R
C
δ+
(H)R + Nu
-
R
C
Nu
(H)R
正电性越大, 羰基越活泼 (电子效应)
烃基的体积越小, 羰基越活泼 (空间效应)
δ +
δ
-
C
O
+ R
δ
-
MgX
δ
+
无水乙醚
OM gX C R
H2O
OH C R
书182
6)与氨的衍生物的反应
以通式
H2N—G
表示
氨衍生物的氮原子上都具有孤对电子,是含N的亲核试剂。
加成-消除历程
R’ R—C=O + H2N—G
H+
R’ R-C — N—G OH H
H+
-H2O
R’ R—C=O
R’ R-C=N—G (N-取代亚胺)
5-甲基-4-己烯醛
CH3 CCH2 CH O CH2
CH
CCHO
丙炔醛
4-戊烯-2-酮
芳香族或脂环族醛、酮的命名原则
把芳基看作取代基来命名;
CHO
CH3
CH
CHO
CH
CH CHO
苯甲醛
2-苯丙醛
3-苯丙烯醛
O C-- CH 3
O C-- CH 2 CH 3
苯乙酮
1-苯基-1-丙酮
脂环族醛、酮的命名原则
1)与氢氰酸加成
2) 与亚硫酸氢钠加成
3) 与水加成 4)与醇加成 5)与格氏试剂反应 6)与氨的衍生物的反应
1)与氢氰酸加成
O R C R'(H)
OH
+
HCN
R
C CN
R'(H)
a-氰醇(a-羟腈)
实验现象:
1.氢氰酸与丙酮反应,无碱存在时,3~4小时内只有一半 原料起反应。
2.加一滴氢氧化钾溶液,两分钟反应可以完成。
+ H-OH
缩醛(同碳二元醇的醚)
缩醛对碱、氧化剂稳定。在稀酸溶液中易水解成醛和醇。
R H
R C H OR'
C
OR' OR'
OR'
+ H2O
OH-
no reaction
R C H O + 2R'OH
+
H2O
H+
注意
1 1 2
条件:干燥HCl
常用于:保护醛基
想一想
?
CH3CH
CHCHO
CH3CH CHCHO OH OH
+ 3 NaI + 3 H2O
常用碘仿反应来鉴定甲基酮结构:
O CH3 C 、CH3
OH CH
反应物要求:
a-C上有三个活泼氢的醛、酮 醛:乙醛 酮: 甲基酮 NaOI CH3 C 醇:CH3 CH R(H)
OH
R(H)
O
实验 碘仿反应
④ ④ ③ ② ① ③ ② ①
试管①—乙醛 试管②—丙酮
各加入碘试液
CHO
加入氢氧化钠后 ①、②、④—黄
试管③—苯甲醛
试管④—异丙醇
CH3—CH—CH3 OH
卤仿反应小节:
含甲基酮结构的醛、酮或醇与X2/碱反应,生成羧酸盐和 三卤甲烷(卤仿)。因此,该反应又称为卤仿反应。
C CH3 O Cl2 NaOH H+ C OH + CHCl3 O
O (CH3)3CCH2C CH3
O CX3 C R(H)
+
NaOH
CHX3
+
(H)R
COONa
由于三个卤原子的强烈吸电子诱导效应,使得羰 基碳原子的正电性加强,三卤代产物在碱溶液中 很不稳定,易分解成羧酸盐和三卤甲烷(俗称卤仿)
碘仿反应
α
O C R(H)
CH3
+ 3 I2 +
4 NaOH
CHI 3 + (H)RCOONa 淡黄色晶体
第 七章
醛、酮、醌
7.1 醛、酮的分类和命名 7.2 醛、酮的结构 7.3 醛、酮的物理性质 7.4 醛、酮的化学性质 7.5 醌
7.1 醛、酮的分类和命名
7.1.1 醛酮的分类:
• ① 根据烃基的不同 • ② 根据醛、酮分子中羰基的个数 • ③ 根据酮羰基所连的两个烃基是否相同,
1. 根据烃基的不同分: O
H3 O+
R
C
H
醛
O R C R'
无水乙醚
R
CH OH R''
仲醇
R''
MgX
R'' R C R' OM gX
H3 O+
R'' R C OH R' 叔醇
酮
无水乙醚
回忆:
无水乙醚
R-X + Mg
d
+
R-MgX
d
+
格氏试剂
H2O/H+
Od
+ R-MgX
d
-
¸¸
RCH2CH2OMgX
RCH2CH2OH
à ö Ä ® ¼ ¶ 2· Cµ ² ´
1) 醛酮的a-H卤代
H O H+ or OH—C—C— + X2 ————>
X O —C—C— + HX
当羰基上连有甲基时,三个 a-H全部被取代。
卤仿反应
X2
α
(用碱催化)
+
2 NaOH
NaOX
+ NaX +
O
H2 O
O C R(H)
CH3
+
3 NaOX
CX3 C R(H) + 3 NaOH
的一端开始将主链碳原子编号。醛基不需标明
位次;酮的羰基要标明位次;不饱和醛、酮还
需标明不饱和键的位次。
CH 3CH 2CCH 3 O
CH3 CH2 CHCHO CH3
丁酮
2-甲基丁醛
CH3 CH2 CHCH2 CCH2 CH3 CH3 O
5-甲基-3-庚酮
不饱和脂肪族醛、酮的命名
CH 3C CH 3 CHCH 2CH 2CHO
Br2 NaOH
H
+
O (CH3)3CCH2COH + CHBr3
减碳反应!
卤仿反应
常用于:
合成少一个C的羧酸
鉴别乙醛、甲基酮及 CH3 CH R(H)
OH
H2N NH O2 N NO2
2-戊醇
CHI3 (黄)
I2 + NaOH
(-)
黄
2-戊酮
3-戊酮
CHI3 (黄)
(-)
2) 羟醛缩合反应——(增长碳链的反应) H O
Na2CO3
+
SO2
+
H2O
H(CH3 )
Na2SO3
+ CO2 +
H2 O
在此水溶液中加酸或加碱,由于能从平衡中除去NaHSO3,而使加成物又变回 到原来的醛、酮.
31
用于醛、酮的分离提纯
3) 与水加成
R (R')H C O
R
OH C OH
+ HOH
(R')H
注意
偕二醇 (不稳定)
11
反应物:主要是甲醛、乙醛,丙酮等小 分子羰基化合物
CH3-CH2-CH2-CHO
CH3-CH-CHO
正丁醛
异丁醛
CH3
酮类命名与醚类相似,按羰基所连的两个烃基称为某烃(基甲)酮
O CH 3 C CH 2 CH 3
甲基乙基(甲)酮(甲乙酮)
O H3 C CH2 C CH2 CH3
二乙基(甲)酮(二乙酮)
2. 系统命名法 :
脂肪族醛、酮的命名原则
选择含有基的最长碳链为主链,从电子效
应、空间效应 和亲核试剂的亲核能力 羰基的活泼性顺序
4
α-羟基腈是一类活泼化合物,容易转变成其它化合物。
2) 与亚硫酸氢钠加成
R H C O
HO
O Na S
-
+
R C H
ONa SO3H
R C H
OH SO3Na
+
O (饱和)
(白色结晶)
a-羟基磺酸钠
注意
H2N—NH-C-NH2
R’ R-C=N-NH-CO-NH2 缩氨脲
见书184
反应生成的产物一般都是具有一定熔点、 不溶于水的晶体,它们在稀酸水溶液中能水 解生成原来的醛、酮,因此,这类反应可用 于醛、酮的鉴别、分离和精制。
实验 醛、酮与2,4-二硝基苯肼的反应
均加入2,4-二硝基苯肼
试管①—乙醛
OC2 H 5
