12有机金属化合物
金属有机化学-2

_ X W C NR2
X W C NR2 _
配体RC不仅可与一个金属形成三重键,也可与三个金属原 子形成三个单键,以此在过渡金属原子簇中形成三重桥基 基团,μ3-alkylidyne。 12.5 金属羰基配合物 过渡金属羰基配合物属所知最早的有机金属化合物 中的一类。它们是合成其它低价金属配合物,特别是原子 簇的常用原料。羰基配体不仅可被许许多多其它配体所取 代,而且未被取代的羰基还能稳定化合物分子
M M
O C M
μ3
M
二重桥联 doubly bridging
三重桥联 triply bridging
CO作为双桥基配体十分常见,特别是在多核原子簇化合物 中;它们几乎总伴随着金属-金属键而出现:
O C M C O C O M O C M M
CO桥常成对出现,并能与非桥联模式处于动态平衡之中。 例如,Co2(CO)8的溶液至少含有两种异构体:
1. DMPE Ta Br Br C H 2. 2Na/Hg P P Ta C H CMe3
CMe3
3. Hexa(t−butoxy)ditungsten在温和的反应条件下,与炔烃 发生金属化反应,也可得到过渡金属炔基配合物:
(t−BuO)3W≡W(t−BuO)3 + RC≡CR
⎯→ ⎯
2 (t−BuO)W≡C−R R = 烷基
12.5.1 1.
制备,结构和性质 金属+CO Ni + 4CO Fe + 5CO
⎯1bar, 25° C→ ⎯⎯ ⎯
Ni(CO)4 ⎯100bar, 150⎯→ Fe(CO)5 ⎯⎯⎯C °
2.
金属盐+还原剂+CO
3 4
H PO VCl3 + 3Na + 6CO ⎯diglyme→[Na(diglyme)2]+[V(CO)6] − ⎯⎯→ ⎯⎯ ⎯
重金属有机化合物

重金属有机化合物
重金属有机化合物是由一个或多个重金属与有机分子结合而形成的化合物。
这些化合物常见的有机配体包括有机酸、有机醇、有机胺等。
重金属有机化合物具有特殊的化学、物理性质,广泛应用于催化剂、药物、染料、助剂等领域。
一些常见的重金属有机化合物包括:
1. 有机汞化合物:如甲基汞、乙基汞等。
它们在环境中具有高毒性,对环境和人体健康造成严重危害。
2. 有机铅化合物:如四乙基铅、三乙基铅等。
它们曾广泛应用于汽油中,但因其对环境和人体健康的危害而被逐渐淘汰。
3. 有机锡化合物:如四丁基锡、二苄基锡等。
它们在某些领域具有重要的应用,如催化剂、稳定剂等。
4. 有机铜化合物:如四丁基铜、二苄基铜等。
它们常作为催化剂或电子材料的前体。
这些重金属有机化合物的合成方法和性质研究是重要的化学领域,也是环境保护领域的重要课题,探索并开发更环保、高效的方法和材料对于可持续发展具有重要意义。
十二羰基三钌用途

十二羰基三钌用途摘要:I.前言II.十二羰基三钌的性质和结构III.十二羰基三钌的用途1.催化反应2.材料科学3.生物医学IV.十二羰基三钌的制备方法V.总结正文:【前言】十二羰基三钌是一种有机金属化合物,具有独特的化学性质和广泛的应用前景。
本文将介绍十二羰基三钌的基本性质、结构特点,以及其在催化反应、材料科学和生物医学等领域的应用。
【II.十二羰基三钌的性质和结构】十二羰基三钌(Ru(CO)12)是一种金属羰基配合物,钌原子与十二个羰基配体通过共价键结合。
钌原子的电子构型为[Ru]4f14 5d7 6s2,具有不饱和的5d轨道,能与羰基形成稳定的化学键。
羰基配体为中性分子,具有稳定的碳氧双键结构。
【III.十二羰基三钌的用途】【1.催化反应】十二羰基三钌在催化反应中具有很高的活性。
它可以用作催化剂,促进羰基化反应、氢化反应、氧化反应等多种化学反应。
由于其高度的活性和选择性,十二羰基三钌被广泛应用于有机合成、石油化工和材料科学等领域。
【2.材料科学】十二羰基三钌具有独特的物理和化学性质,可用作催化剂、磁性材料、超导体等。
例如,十二羰基三钌可以通过化学气相沉积法(CVD)制备具有特殊性能的薄膜。
这些薄膜在电子器件、光学器件和能源器件等领域具有广泛的应用前景。
【3.生物医学】十二羰基三钌在生物医学领域也有潜在的应用。
例如,它可以用于制备钌-药物偶联物,这些偶联物具有高选择性的抗肿瘤活性。
此外,十二羰基三钌还可用于生物成像,如磁共振成像(MRI)和正电子发射断层扫描(PET)等。
【IV.十二羰基三钌的制备方法】十二羰基三钌可以通过多种方法制备,如羰基化反应、热解法、还原法等。
其中,羰基化反应是最常用的方法。
该方法以钌金属或钌化合物为原料,与羰基化合物反应生成十二羰基三钌。
【V.总结】十二羰基三钌是一种具有广泛应用前景的有机金属化合物,具有独特的化学性质和结构特点。
在催化反应、材料科学和生物医学等领域,十二羰基三钌表现出很高的活性和选择性。
有机金属化学

(四)金属有机化学和无机化学
(Ph3P)2PdMe2与 (Ph3P)4Pd性质类似 RSi(OR)3与Si(OR)4性质类似
金属有机化学与不含碳-金属键的络合物化 学重叠,与无机化学重叠
金属有机化学是介于无机化学和有机化 学之间的边缘学科。
(五)有些含M-C键的化合物不属于 金属有机化合物
1983年,K. G.Bergman和
W.A.G.Graham在金属络合物和烷烃的 分子间反应中观察到了C—H键活化,再次掀 起金属有机化学的热潮
三、金属有机化合物分类
(一)按中心金属元素在周期表中的位置: 主族金属有机化合物
包括IA,IIA,IIIA,IVA,VA族及IIB族的金属与准金属
随后,很多化学家对砷、锑、锡、汞的 元素有机化合物进行过不少研究工作。
我国的化学家于20世纪五六十年代,制备了 许多锑化合物,用于治疗血吸虫病和黑热病。 为了减低锑化合物的毒性,还合成了一些新 的有机锑化合物。
其他,如锡有机物作为杀菌剂,汞有机物作 为消毒剂,“顺铂”做为抗癌药物等
(二)金属有机化合物的工业直接应用
四乙基铅:汽油的抗震剂,有机锡化合物:高分子
聚合物的稳定剂和聚烯烃、橡胶等的防老剂等
硅酮聚合物:橡胶、塑料、涂料、粘合剂、润滑剂等, 可用作火箭、高速飞机等领域中耐油、耐高温或低温 的特种材料。
其他元素有机聚合物,包括高分子金属络合物,可用 作胶粘剂、阻燃剂、催化剂等。
金属有机聚合物在粘流态拉丝或制成其他形状,然后 高温裂解,可制得特定形状的陶瓷材料。用这种方法 已合成出有机碳硅烷--碳化硅纤维。
1917年,W.Schlenk从有机汞试剂出发,合成了烷
基锂试剂,并发展了金属有机化学实验中常用的 Schlenk 系列玻璃仪器及其相关操作
金属有机化学

1954年维蒂希(G.Wittig)发现磷叶立德 与羰基化合物反应生成结构确定的烯烃。
1956年布朗(H.C.Brown)发现了烯烃的 硼氢化反应。 1979年布朗与维蒂希分享诺贝尔化学奖。
1958年齐格勒的学生维尔克(Wilke)发 现镍配合物催化丁二烯的环齐聚反应并第 一次通过分离鉴定反应活性物种来确定反 应机理。他还发现了[CpMo(CO)3]2金属之 间存在共价键,为过渡金属原子簇合物奠 定了基础。
➢Ni-CO是π配位 ➢金属羰基配合物及其衍生物在过渡金属有机化合物
的合成和很多催化反应中都有重要的意义
C Ni O
=
5)金属有机化学是研究金属有机化合物和 类金属有机化合物的化学。 无机化学(欧美)
金属有机化学 有机化学(中国)
实际上处于有机化学与无机化学之间的 一门边缘学科。
二、金属有机化学的发展历史
宝库。现在人们称镁nt)。镁有机化合物同有机 化合物的反应称为格林雅反应(Grignard Reaction)。为此,1912年他获得诺贝尔化学 奖。这是第一个获诺贝尔奖的金属有机化学 家。
1922年:T.Midgley T.A. Boyd Pd(C2H5)4作为汽 油中的抗震剂。
RCH 2CH2CHO+RCH 3CCHO
• 这一反应应称之为氢甲酰化反应,但在工业 界常称作Oxo反应,这是起初误以为是氧化 反应,故称为“Oxonation”或Oxo反应。由这 一过程产生的醇,已习惯地称作Oxo醇。这 个反应是第一个均相催化工业应用的例子。
1951年鲍森(Pauson)和米勒(Miller)分别发现了二茂 铁Fe(C5H5)2。 次年威金森(Wilkinson)等确定了它具有夹 心面包式分子结构及新的化学键理论,激起了化 学家对过渡金属有机化合物研究的热情,大大推动 了过渡金属有机化合物的发展。
有机金属化合物——

有机金属化合物
由于这两种成键作用的相互配合,相互促进的协同作 用,增强了σ-π配键的成键效应,增强了羰基化合物的 稳定性。
有机金属化合物
有效原子序数规则(EAN规则) 最早提出是用以预言金属羰基化合物稳定性的经验规则, 称为有效原子序数规则(EAN规则) 该规则用以预言稳定存在的有机金属化合物应该符合 过渡金属全部电子总数+所有配体提供成键的电子数=该金属 所在周期中稀有气体的原子序数要求的化合物。
有机金属化合物
6σ LUMO _ C + 2π C _ _ C 2pz 1π 2s 4σ 2s _ C + O _ 4σ 2py 2px C _ + O 1π (二重简并) O O + 5σ + _ O _ 2π (二重简并) + 6σ
HOMO + 2px 2py 2pz 5σ
3σ C C CO O
如果化合物中的碳原子是通过其他原子如:O、S及N等 与金属键合的化合物,如二乙硫基汞(C2H5S)2Hg和四丙 氧基钛(C3H7O)4Ti,不含有M—C键,应该不属于有机 金属化合物。
但是广义上讲,只要是配合物中含有有机配体,包括通 过O、S、N、及P等原子键合的,通常也被列为有机金属 化合物。 广义:金属与有机基团直接键合的一类化合物。
有机金属化合物
Organometallic Compounds
有机金属化合物 1.1827年:Zeise 制得了第一个有机金属化合物 蔡斯盐K[PtCl3(C2H4)]· 2O; H 2.1842年:R.W.Bunsen 合成了第一个纯有机砷 化物R3As; 3.1901年:格林尼亚发现了格氏试剂,有机镁化 合物RMgX ,因此,他获得了诺贝尔奖; 4.1951年: Fe(C5H5)2 的合成 ---- 有机金属化学 迅速 发展。
金属有机化学复习题
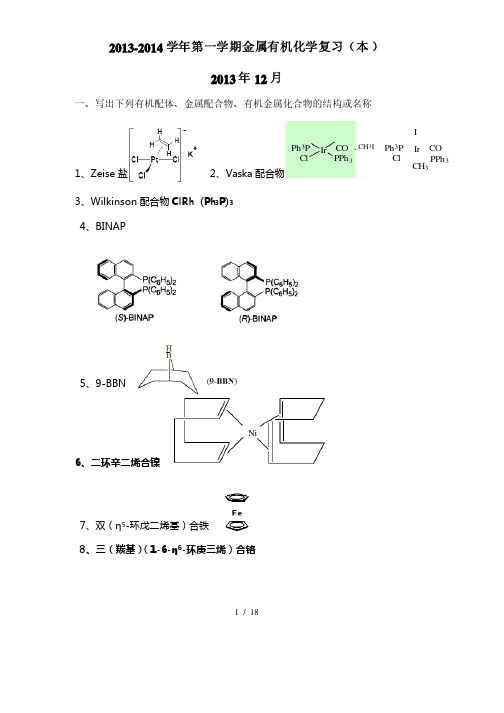
2013-2014学年第一学期金属有机化学复习(本)2013年12月一、写出下列有机配体、金属配合物、有机金属化合物的结构或名称1、Zeise盐2、Vaska配合物Ph3P IrClCOPPh3Ph3P IrClCOPPh3CH3ICH3I3、Wilkinson配合物ClRh (Ph3P)34、BINAP5、9-BBN6、二环辛二烯合镍Ni7、双(η5-环戊二烯基)合铁8、三(羰基)(1-6-1-6-ηη6-环庚三烯)合铬1 / 18HHCrCOCOCO9、Ni(COD)21010、、RhCl(PPh3)3 Wilkinson配合物、η5- CpMn(CO)31111、ηCO))51212、、Fe Fe((CO13、MoH4(PPh3)4、η5- Cp2Zr(CH3)21414、η1515、、Et2AlCl 二乙基氯化铝二、解释下列各名词二、解释下列各名词1、金属有机化合物、金属有机化合物 含有金属-碳键(含有金属-碳键(M-C M-C M-C)的化合物定义为金属有机化合物)的化合物定义为金属有机化合物2、过渡金属有机化合物、过渡金属有机化合物 含有过渡金属-碳键(M-C )的化合物, 过渡金属含有d 电子,在(n-1)d, ns, np 原子构型中原子构型中,,(n-1)d 轨道能级与ns 接近,它们皆可参与成键。
符合18电子规则。
3、18电子规则电子规则对于稳定的单核反磁过渡金属络合物,其金属外层的电子数与配体配键的电子数的总和等于18。
只有当金属具有稳定的惰性气体结构时才能形成热力学稳定的过渡金属有机化合物。
4、EAN 电子规则电子规则过渡金属配合物的中心(形成体)倾向于与一定数目的配体结合,以使自身周围的电子数等于同周期稀有气体元素的电子数5、环状多烯π-金属配合物6、高自旋配合物成对能(P )大于分裂能(△)的配合物, 当P >△时>△时, , 因电子成对需要的能量高能量高, , 电子将尽量以单电子排布分占不同的轨道电子将尽量以单电子排布分占不同的轨道, , 取高自旋状态。
有机金属化合物

Phosphine complexes
PPh 3 Ph3P Rh Cl PPh 3 Ph3P PPh 3 Cl Ru Cl PPh 3
Organosilicon and organoboron compounds
Ph Si Ph
• Metal main group transition metal f-block metal
[PtCl3(C2H4)]-
[Ni(CO)4]
Metal hydride complexes
H Et3P Pt Cl PEt 3 Ph3P H2 PPh 3 H Ru H PPh 3
N2-complexes,
H3N H3N NH3 NH3 Ru N N NH3 2+ Ph2P Ph2P PPh 2 Mo PPh 2 N N N N
交界碱
Hard ligands: N, O, F,
Soft ligands: a) 第三周期及以下的原子 b) 可接受p电子的原子 c) 含有p电子的,如
C C
C
C
HSAB原则—— 硬亲硬、软亲软、软硬交界就不管 硬的配体易于和硬的金属形成稳定的配合物 (金属通常处于高的 氧化态) 如 Al3+, Fe3+, Cu 2+, Ti4+, Pt4+. AlF63-, Ti(OR)4 very stable complexes Pt(0)-F, Pt(0)-OR, W(0) very rare. 软的配体易于和软的金属形成稳定的配合物 (金属通常处于低的 氧化态) 如Mn(I), Co(I), Fe(II), Pt(II), Pt(0)…) Pt(II) is soft but Pt(IV) is hard Cl Pt Cl Cl Pt(IV)
有机过渡金属化合物

有机过渡金属化合物具有较高的反应性,能够参与多种化 学反应,如氧化还原反应、配位反应、聚合反应等。
多样性
有机过渡金属化合物具有多样性,可以根据不同的配体和 金属中心进行设计和合成,从而获得具有特定结构和性质 的化合物。
常见类型
金属碳化物
如铁(II)氰化物、钴(II)氰化物等 。
金属烃化物
如二茂铁、二环戊二烯铁等。
固相合成法
固相合成法是一种通过固体状态 下的反应来合成有机过渡金属化
合物的方法。
固相合成法的优点是反应条件温 和,操作简便,适用于制备结构
复杂的有机过渡金属化合物。
固相合成法的缺点是反应速度较 慢,产率较低,需要进一步优化
反应条件。
04 有机过渡金属化合物在新能源领域的应用
CHAPTER
在燃料电池中的应用
有机过渡金属化合物
目录
CONTENTS
• 有机过渡金属化合物的定义和特性 • 有机过渡金属化合物在化学反应中的应用 • 有机过渡金属化合物的合成方法 • 有机过渡金属化合物在新能源领域的应用 • 有机过渡金属化合物的毒性和环境影响 • 有机过渡金属化合物的未来发展前景
01 有机过渡金属化合物的定义和特性
新应用领域的探索
生物医学应用
研究有机过渡金属化合物在生物医学领域的应用,如药物开 发、生物成像和癌症治疗等,以拓展其在生命科学领域的应 用范围。
能源领域
探索有机过渡金属化合物在可再生能源转换和存储方面的应 用,如太阳能电池、燃料电池和锂电池等,以提高能源利用 效率和降低环境污染。
绿色合成技术的发展
有机过渡金属化合物可以作为染料敏化剂,用于染料敏化太阳能电池中, 提高染料的光吸收和电子传输性能。
金属有机化合物 概念

金属有机化合物概念金属有机化合物是一类具有金属原子与有机配体结合而成的化合物。
金属有机化合物的研究领域涵盖了金属有机化学和配位化学等多个学科,而其广泛的应用领域包括催化剂、药物、材料科学等。
金属有机化合物的合成方法多种多样,常见的方法包括金属与有机配体的直接配位、金属的还原、金属的插入、还原格氏试剂的羰基化反应等。
这些合成方法的共同点是在合成过程中使金属原子与有机配体相结合,形成金属离子和配体之间的配位键。
金属有机化合物的结构特点有两个方面。
一方面,金属原子与有机配体之间存在配位键,金属原子常以配位数较低的方式与配体结合,形成配合物的核心结构。
另一方面,金属离子与配体之间常存在键之外的相互作用,如氢键、范德华力等,这些相互作用可以影响金属有机化合物的物理化学性质。
金属有机化合物具有丰富的物理化学性质和应用价值。
首先,金属有机化合物在光学、电子学和磁学等物理学领域具有重要应用。
例如,一些金属有机化合物可作为发光材料,可用于LED器件和荧光探针等。
其次,金属有机化合物常常用作催化剂,可用于有机合成反应、燃料电池等。
此外,金属有机化合物还可以作为药物分子的前体,广泛应用于药物研究领域。
金属有机化合物也存在一些挑战和问题。
首先,金属有机化合物的合成方法较为复杂,并且合成过程中的金属有机化合物容易受到空气和湿气的影响,从而降低了其合成产率。
此外,金属有机化合物的毒性和稳定性问题也需要进一步研究和解决。
综上所述,金属有机化合物是一类具有金属原子与有机配体结合而成的化合物,具有丰富的物理化学性质和广泛的应用领域。
金属有机化合物的研究和应用在化学领域中具有重要的地位,并为科学家和研究工作者提供了大量的研究内容和发展方向。
金属有机化学1金属有机化合物的定义

RCH 2CH2CHO+RCH 3CCHO
• 这一反应应称之为氢甲酰化反应,但在工业 界常称作Oxo反应,这是起初误以为是氧化 反应,故称为“Oxonation”或Oxo反应。由这 一过程产生的醇,已习惯地称作Oxo醇。这 个反应是第一个均相催化工业应用的例子。
1951年鲍森(Pauson)和米勒(Miller)分别发现了二茂 铁Fe(C5H5)2。 次年威金森(Wilkinson)等确定了它具有夹 心面包式分子结构及新的化学键理论,激起了化 学家对过渡金属有机化合物研究的热情,大大推动 了过渡金属有机化合物的发展。
• 有机锂与格氏试剂的最大不同之处在于溶剂。 有机锂可以在惰性溶剂,如戊烷,石油醚等 烷烃中制备,而格氏试剂不溶于烃类溶剂, 只有少数能在这类溶剂中制备。
1931年:W Hieber制备了第一个过渡金属 氢化物H2Fe(CO)4
1938年:德国鲁尔化学公司Rolen发现Oxo 法:
Co or Rh RCH=CH2+CO+H2
金属有机化学
金属有机化合物的定义
一.金属有机化合物的定义与基本概念
中文:金属有机化合物 (常用) 有机金属化合物 : 台、港、日用此名称
英文:Organometallic compounds Organometallics
定义:分子中含有一个或多个金属-碳键(δ键或
π键)的化合物。
1)含M-C -金属有机化合物
1963年他们分享了诺贝尔化学奖。
1954年维蒂希(G.Wittig)发现磷叶立德 与羰基化合物反应生成结构确定的烯烃。
1956年布朗(H.C.Brown)发现了烯烃的 硼氢化反应。 1979年布朗与维蒂希分享诺贝尔化学奖。
1958年齐格勒的学生维尔克(Wilke)发 现镍配合物催化丁二烯的环齐聚反应并第 一次通过分离鉴定反应活性物种来确定反 应机理。他还发现了[CpMo(CO)3]2金属之 间存在共价键,为过渡金属原子簇合物奠 定了基础。
金属有机化合物的定义

金属有机化合物的定义
金属有机金属化合物是指烷基(包括甲基、乙基、丙基、丁基等)和芳香基(苯基等)的烃基与金属原子结合形成的化合物,以及碳元素与金属原子直接结合的物质之总称。
与锂、钠、镁、钙、锌、镉、汞、铍、铝、锡、铅等金属能形成较稳定的有机金属化合物。
大体上可分为烷基金属化合物(alkylmetalic compounds)和芳香基金属化合物(arymetalic compounds)两类。
对环境有影响的,前者为甲基汞化合物、四乙基铅、三丁锡;后者为苯基汞盐、三苯基锡等;还有作汽油抗爆剂的有机锰化合物如三羰基环戊二烯锰等。
这些物质大部分为人工合成,但铅、汞、镉、锡等在自然界会甲基化(或烷基化),如由无机汞转化为甲基汞。
其中大多数是由于水体底质中微生物的作用,在鱼体内则是通过各种生物转化而成。
一般有机金属化合物有脂溶性,比无机金属容易通过生物膜,经肠壁吸收,进入脑血管、胎盘的量也较多;因此有更强的生物毒性。
烷基金属化合物容易引起中枢神经的障碍。
在体内以肝等器官为主的微粒体药物代谢酶系统使有机金属化合物脱去烷基、芳香基,最终成为无机金属。
通过生物体膜引起的毒性,以鸟类最为敏感。
金属有机化合物课件

金属有机化合物的键合性质
01
02
03
金属-碳键
金属与碳原子之间形成的 化学键,具有独特的成键 性质和反应活性。
金属-氢键
金属与氢原子之间形成的 化学键,在催化加氢等反 应中具有重要作用。
金属-金属键
部分金属有机化合物中存 在金属与金属之间的直接 成键,具有特殊的电子结 构和磁性。
金属有机化合物的反应性质
金属还原消除
高价态的金属有机化合物可以被还原剂还原为低价态,同时消除一些小分子(如氢 气、卤化氢等),生成新的金属有机化合物。
其他合成方法
自由基反应
通过自由基引发剂引发自 由基反应,可以合成一些 具有特殊结构的金属有机 化合物。
缩合反应
通过缩合反应可以合成一 些大环或多环的金属有机 化合物。
重排反应
生物成像剂
某些金属有机化合物具有良好的光学 性质,可以作为生物成像剂用于荧光 显微镜、MRI等医学影像技术。
在催化领域中的应用
均相催化
金属有机化合物可以作为均相催化剂,催化有机反应、氧化还原反应等。
非均相催化
通过将金属有机化合物负载在固体载体上,可以制备出非均相催化剂,用于多相催化反应。
06
结论与展望
在某些条件下,金属有机 化合物可以发生重排反应, 生成结构更复杂的金属有 机化合物。
04
金属有机化合物的表征技术
红外光谱
原理
红外光谱是通过检测化合物分子 振动能级跃迁时吸收或发射的红 外光来获取分子结构信息的技术。
应用
用于鉴定金属有机化合物中的官能 团、确定分子结构以及研究反应机 理等。
特点
红外光谱具有高度特征性和指纹性, 对于含有不同官能团的金属有机化 合物具有很好的区分度。
有机化学中的有机金属化合物

有机化学中的有机金属化合物有机金属化合物是有机化学领域中的一个重要分支,它们在化学反应、催化剂和材料科学等方面具有广泛的应用。
本文将介绍有机金属化合物的概念、合成方法、理论基础以及一些重要的应用领域。
一、有机金属化合物的概念及分类有机金属化合物是含有一个或多个碳-金属化合键的化合物,其中金属通常是过渡金属或主族金属。
根据金属原子与有机配体的配位方式和配体的性质,有机金属化合物可分为有机配合物和金属有机化合物两类。
有机配合物是指金属原子与一个或多个有机配体通过配位键相连的化合物。
配体通常是含有氮、氧、硫等原子的有机化合物,它们通过静电作用、配位键或共价键与金属原子相连。
金属有机化合物是指金属与一个或多个碳原子直接形成化学键的化合物。
这类化合物通常由一个有机配体直接与金属发生键合,形成金属-碳化学键。
二、有机金属化合物的合成方法1. 配位反应法:通过配位反应将有机配体与金属原子结合,合成有机配合物。
2. 金属加成反应法:通过碳-碳双键或碳-碳三键的加成反应,将金属原子直接与有机分子中的π键形成键合。
3. 氧化加成反应法:将醇、酮、醛等有机化合物与金属原子进行反应,生成金属有机化合物。
4. 烷基化反应法:将卤代烃或烯烃与金属锂、镁等金属化合物反应,生成金属有机化合物。
三、有机金属化合物的理论基础研究有机金属化合物的理论基础主要包括配位化学、有机化学和无机化学的知识。
其中,配位化学研究金属原子与有机配体之间的配位键和配位结构;有机化学研究有机分子的结构和反应性质;无机化学研究金属的性质和反应规律。
四、有机金属化合物的应用领域1. 催化剂:有机金属化合物在催化剂领域应用广泛,可以用于有机合成反应、杂环合成、聚合反应等。
2. 有机光电材料:一些含有金属有机化合物的有机材料,具有发光、导电等特性,被广泛应用于有机光电器件的制备。
3. 药物合成:有机金属化合物在药物合成中扮演着重要角色,可以用于有机合成的催化反应、活化底物等。
高考化学 真题模拟题专项汇编12 有机化合物试题

冠夺市安全阳光实验学校专题12 有机化合物1.(新课标Ⅰ)国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。
对于上述化学药品,下列说法错误的是A.CH3CH2OH能与水互溶B.NaClO通过氧化灭活病毒C.过氧乙酸相对分子质量为76D.氯仿的化学名称是四氯化碳【答案】D【解析】A.乙醇分子中有羟基,其与水分子间可以形成氢键,因此乙醇能与水互溶,A说法正确;B.次氯酸钠具有强氧化性,其能使蛋白质变性,故其能通过氧化灭活病毒,B 说法正确;C.过氧乙酸的分子式为C2H4O3,故其相对分子质量为76,C说法正确;D.氯仿的化学名称为三氯甲烷,D说法不正确。
综上所述,故选D。
2.(新课标Ⅰ)紫花前胡醇可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是A.分子式为C14H14O4B.不能使酸性重铬酸钾溶液变色C.能够发生水解反应D.能够发生消去反应生成双键【答案】B【解析】A.根据该有机物的分子结构可以确定其分子式为C14H14O4,A叙述正确;B.该有机物的分子在有羟基,且与羟基相连的碳原子上有氢原子,故其可以被酸性重铬酸钾溶液氧化,能使酸性重铬酸钾溶液变色,B叙述不正确;C.该有机物的分子中有酯基,故其能够发生水解反应,C叙述正确;D.该有机物分子中与羟基相连的碳原子的邻位碳原子上有氢原子,故其可以在一定的条件下发生消去反应生成碳碳双键,D叙述正确。
综上所述,故选B。
3.(新课标Ⅱ)吡啶()是类似于苯的芳香化合物,2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。
下列叙述正确的是A.Mpy只有两种芳香同分异构体B.Epy中所有原子共平面C.Vpy是乙烯的同系物D.反应②的反应类型是消去反应【答案】D【解析】A.MPy有3种芳香同分异构体,分别为:甲基在N原子的间位C上、甲基在N原子的对位C上、氨基苯,A错误;B.EPy中有两个饱和C,以饱和C为中心的5个原子最多有3个原子共面,所以EPy中所有原子不可能都共面,B错误;C.VPy 含有杂环,和乙烯结构不相似,故VPy不是乙烯的同系物,C错误;高考真题D.反应②为醇的消去反应,D正确。
金属有机化学总结要点

见到。
精选课件
9
缺电子型化合物中的多中心键
Li,Be,Mg,A1等几种元素的烷基化合物和氢化物, 其单分子体不稳定,多数情况下以多聚体存在。
二硼烷B2H6能稳定存在,而其单分子体BH3却只有极 少量能以游离的分子存在,其原因是长期未得到解 决的问题。
用Ziegler催化剂的烯烃聚合机理
精选课件
23
Ziegler催化剂是由TiCl4或TiCl3与A1Et3或A1Et2Cl 等有机铝化合物混合来制备,烷基铝化合物是作为过 渡金属化合物的烷基化试剂而起作用的,钛上所带卤 素原子与铝上所带的烷基发生交换即生成乙基钛化合 物:
精选课件
24
认为确实是生成了某种乙基钛化合物,并成为活性物 种。这样生成的催化剂与乙烯反应后,乙烯П配位于 钛,发生Et—Ti 键间的插入反应,反应机理可最简单 地表示如下:
精选课件
6
IUPAC命名规则:
n-Bu3GeEt MeBeH
三丁基乙基锗 氢甲基铍
精选课件
7
-配合物命名
含-键配位的金属有机化合物,命名时要指出配位的配位体中有多少碳原子与金属原子成键,用 n表示。
Mn
CO
CO
CO
5-CpMn(CO)3 三羰基 - 5 - 环戊二烯基合锰
精选课件
8
金属与碳之间存在共价键时,成键形式可以有三种情 况:
氢原子进入桥的位置,它的1S轨道与SP3轨道重叠后, 就形成了1个扩展到整个B—H—B原子组的一个轨道 [图2.6(c)]。由各硼原子和桥联的H原子分别提供1个 电子,所以用4个电子形成了2组B—H—B键,1对电 子用于3个原子组,这样的键叫三中心二电子键(3— center,2—electronbond);简称3c - 2e键。
12有机金属化合物
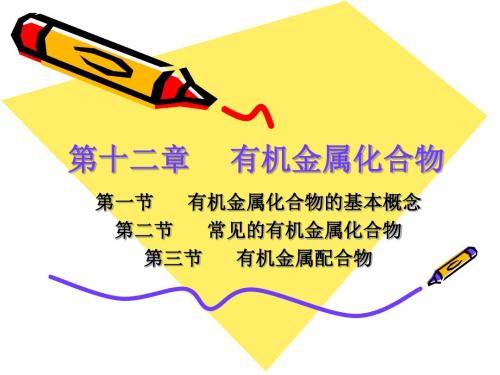
应用最广的是烷基铝及其卤化物: 三乙基铝 [(C2H5)3Al] 三异丁基铝 [(i-C4H9)3Al] 二乙基氯化铝 [(C2H5)2AlCl]
(一)烷基铝的制法 1、卤代烃与金属铝作用:
是制备烷基铝最常用的方法
2Al + 3RX I2 RAlX2 + R2AlX (R=CH3,C2H5) R3Al2X3 (倍半卤代烷基铝)
3、当金属原子除了与有机基团相连外,还连有 无机原子,可将其看作是带有有机基团的无机 盐加以命名.
CH3CH2MgI 碘化乙基镁
CH3ZnCl 氯化甲基锌
三、有机金属化合物的制备
1、金属和卤代烃直接反应: 用于活泼金属衍生物的制备
RBr + 2Li
Et2O
RLi + LiBr
RBr + Mg Et2O
n-C4H9Li + H Li + n-C4H10
Li
+
N
CH3
N
CH2Li
+
上述反应代表从简单的有机锂化合物制备较复杂 的有机锂化合物的一种方法,称为烃的金属化。 烷基锂容易将pKa值小于35的烃金属化。
2、对不饱和键的加成反应
(1)与二氧化碳作用
RLi + CO2
RCOOLi RLi
H2O
R LiO R C O
OH
3、活泼中间体的生成
有机锂化物作为强碱容易形成碳负离子, 是制备苯炔、碳烯等高度活泼的中间体。
F + C6H5Li F Li -LiF F + Li 苯炔
CBr4 + CH3Li LiCBr3
十二羰基三钌分解温度

十二羰基三钌分解温度
十二羰基三钌是一种无机化合物,化学式为Re2(CO)12。
它是
一种重要的过渡金属有机化合物,通常用作催化剂或合成中间体。
关于它的分解温度,需要考虑到其化学性质和热稳定性。
首先,十二羰基三钌的分解温度受到环境条件的影响,如气压、氧气浓度等。
在标准大气压下,据文献报道,十二羰基三钌的分解
温度约为180-200摄氏度。
但是,这个数值可能会因实验条件的不
同而有所变化。
其次,分解温度还与分解产物有关。
十二羰基三钌在分解时会
释放出一氧化碳和金属钌,而这些分解产物的稳定性和反应性也会
影响到分解温度。
此外,分解温度还可能受到催化剂或其他反应条
件的影响。
另外,分解温度还可能受到分解动力学的影响。
在实际应用中,通过热分析等方法可以更准确地测定十二羰基三钌的分解温度和分
解动力学参数。
总的来说,十二羰基三钌的分解温度是一个复杂的问题,受到
多种因素的影响。
要准确测定其分解温度,需要进行系统的实验研究,并综合考虑其化学性质、环境条件和分解产物等因素。
金属有机化学12 催化的交叉偶联反应及相关聚合反应

Br
ROH
O
R
Substrates Limitation:
R
Br
R
Alkenyl and aryl halide were considered as “inactive” substrates
Cross Coupling Reaction
- 2010 Chemistry Nobel Prize Awarded for Carbon-Bonding Technique
交叉偶联反应及共轭聚 合物的合成
胡爱国
教学大纲
背景知识
金属有机化合物的定义及金属有机化学发展历史
金属有机化合物中的结构和化学键
化合价、 氧化态、 d 电子数、 饱和度、有机配体、配位数和18电子规则 空间点群(Point Group)、立体构型 价键理论(Valence bond Theory)、晶体场理论(Crystal Field Theory) 分子轨道理论(Molecular Orbital Theory)
交叉偶联反应及共轭聚合物的合成胡爱国背景知识金属有机化合物的定义及金属有机化学发展历史金属有机化合物中的结构和化学键化合价氧化态d电子数饱和度有机配体配位数和18电子规则空间点群pointgroup立体构型价键理论valencebondtheory晶体场理论crystalfieldtheory分子轨道理论molecularorbitaltheory金属有机化合物的反应配合反应氧化加成反应和还原消除反应oxidativeadditionreductiveelimination迁移插入和消除反应migrationinsertionelimination配体上的反应金属有机化
Cross Coupling Reaction
有机化学英文命名大全

buta-1,3-diene
H3C
CH 3
but-2-yne
9
hexa-2,4-diyne
脂环烃(alicyclic hydrocarbons)命名: 烃类名称前 + cyclo-
例: 环己烷: cyclohexane; 环己二烯: cyclohexadiene 环辛四烯: cyclooctatetraene
苯胺
21
当苯环上有两个或多个取代基时,苯环上的编号应符合最低原则。而当应
用最低系列原则无法确定那一种编号优先时,与烷烃的情况一样,中文命名时 应让顺序规则中较小的基团位次尽可能小,英文命名时,应按英文字母顺序, 让字母排在前面的基团位次尽可能小。例如:
6 5
4
H3C
CH2CH2CH3
1
2 CH2CH3
14
CH2 CH: CH CH2 1,3-丁二烯 butadiene 或 1,3-butadiene 或 buta-1,3- diene
CH2 C CH CH2
CH3
2-甲基-1,3 -丁二烯 2-methyl-1,3 –butadiene/ 2-methylbuta-1,3-diene
15
* 同时含有双键和三键时,用-enyne结尾。 如:
3
4甲基2乙基1丙基苯 2ethyl4methyl1propylbenzene
CH3CH2
CH3 CH2CH3
1甲基3,5二乙基苯 1,3diethyl5methylbenzene
22
常见官能团的词头、词尾名称
23
important substituents
CN
OH
NH2
OR
R X(X=F,Cl,Br,I)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2, 2,与卤化物反应
使金属卤化物烷基化: 使金属卤化物烷基化:
2R3Al + AlX3
2R3Al + ZnCl2
3R2AlX
R2Zn + 2R2AlCl
3,与烯烃的反应 ,
与α-烯烃发生加成 烯烃发生加成
C2H5 Al C2H5 CH2=CH2 CH2CH2C2H5 CH2=CH2 C2H5 ....... C2H5 H2O 水解 (CH2CH2)mC2H5 + Al(OH)3
Al
Al
C2H5 (CH2CH2)mC2H5 (CH2CH2)mC2H5 (CH2CH2)mC2H5
�
A lH 3 + 3R C H =C H 2 A l(C H 2 C H 2 R ) 3
6(CH3)2C=CH2 + 3H2 + 2Al
I2 160oC ,3000kPa
2Al[CH2CH(CH3)2]3 三 异丁 基 铝
(二)性质
低级烷基铝通常以缔合形式存在
H3C Al H3C CH3 三甲 基铝 的二 聚体 CH3 Al CH3 CH3
-LiBr
LiCBr3 + CH3Br CBr2 二 溴碳 烯
4,烯烃聚合反应的催化剂 ,
催化烯烃的定向聚合: 催化烯烃的定向聚合: 使异戊二烯定向聚合(合成天然橡胶) 使异戊二烯定向聚合(合成天然橡胶)
C 4H 9Li + nCH 2=CH 2
35000KPa 37 C
o
C 4H 9 CH 2
CH 2 n Li
2,有机金属化合物的性质有三种情况: ,有机金属化合物的性质有三种情况:
①共价化合物的性质:Hg Si Ge Sn Pb Tl 共价化合物的性质:
二甲基汞 [(CH3)2Hg] 四甲基硅 [(CH3)4Si]
②离子化合物的性质:K Na Rb Cs
甲基钾(CH3K) 甲基钾
③路易斯酸性:Mg B Al Ga
1) 有机锌卤化物的形成: 有机锌卤化物的形成:
X-CH2-CO2R + Zn α -卤代酸酯 卤 X-Zn-CH2-CO2R X=Cl Br I
2) 有机锌卤化物和醛酮的羰基加成: 有机锌卤化物和醛酮的羰基加成:
C=O + X-Zn-CH2-CO2R XZnO C CH2 CO2R
3) 用稀酸水解: 用稀酸水解:
有机锌化合物的碳负离子特性及活泼 性均比有机锂化物或有机镁化物低. 性均比有机锂化物或有机镁化物低. 1. 质子化反应 R2N与质子给予体反应分两步: 与质子给予体反应分两步: 与质子给予体反应分两步
R2Zn + HX RZnX +HX R2Zn + H2O R2Zn + R' OH RZnX + RH ZnX2 + RH RZnOH + RH RZnOR' + R'H
2,对不饱和键的加成反应 ,
(1)与二氧化碳作用 )
RLi + CO 2
RCOOLi RLi
H 2O
R LiO R C O
C
R OLi R + 2LiOH
水解
(2)与C=C的加成 ) 的加成
CH2=CH2 + (CH3)3CLi
CH=CH2
(CH3)3C CH2CH2Li
CH CH2R
+ RLi
Li
(2)NH4Cl,H2O
OH
3,活泼中间体的生成 ,
有机锂化物作为强碱容易形成碳负离子, 有机锂化物作为强碱容易形成碳负离子, 是制备苯炔,碳烯等高度活泼的中间体. 是制备苯炔,碳烯等高度活泼的中间体.
F + C 6 H 5 Li F Li -LiF F + Li 苯炔
CBr4 + CH3Li LiCBr3
3 3
R
-M+ ) R (CH ) GaN(CH
R
NR3' 3 3
二,有机金属化合物的命名
1,在金属名称之前加上相应的有机基团的名称. ,在金属名称之前加上相应的有机基团的名称.
CH 3K 甲基钾 (CH 3)2Hg 二甲基汞 (CH 3CH 2)3Al 三乙基铝 n-C 4H 9Li 正丁基锂
2,以硅烷或锡烷等衍生物命名. ,以硅烷或锡烷等衍生物命名.
倍半卤代烷基铝被碱金属还原可获得三烷基铝: 倍半卤代烷基铝被碱金属还原可获得三烷基铝:
2 C2H5AlCl2 + 3Na 3(C2H5)2AlCl + 3Na (C2H5)2AlCl + Al + 3NaCl 120-130oC 2(C2H5)3Al + Al + 3NaCl
2, α-烯烃与氢化铝作用 , 烯烃与氢化铝作用
烷基锂与α, 不饱和酮发生 不饱和酮发生1, 加成 加成, 烷基锂与 ,β-不饱和酮发生 ,2-加成,而 格氏试剂则进行1, 加成 加成. 格氏试剂则进行 ,4-加成.
α β CH2=CH C CH3 O CH3
(1)CH3Li (2)NH4Cl,H2O
CH2=CH C CH3 OH
β α (1)CH3MgBr CH2=CH C CH3 CH3 CH2CH C CH3 O
第十二章
有机金属化合物
第一节 有机金属化合物的基本概念 第二节 常见的有机金属化合物 第三节 有机金属配合物
第一节 有机金属化合物的基本概念
一,有机金属化合物的定义及分类 1,有机金属化合物的定义: ,有机金属化合物的定义:
指金属与碳原子直接相连成键的有机化合物. 指金属与碳原子直接相连成键的有机化合物 可用R-M表示. 表示. 可用 表示 决定有机金属化合物的性质的关键是碳-金属 决定有机金属化合物的性质的关键是碳 金属 键的性质. 键的性质.
XZnO C CH 2 CO 2R + HX HO C CH 2 CO 2R + ZnX 2 β -羟 基 酸 酯 羟
三,有机铝化合物
按照铝原子所连的烃基数目不同可分为三类: 按照铝原子所连的烃基数目不同可分为三类: R3Al R2AlZ RAlZ2
R=烃基 烃基 Z=H,F,Cl,Br,I,OR,SR,NH2,NHR,PR3 , , , , , , , , 2,
n-C 4 H 9 Li + H Li + n-C 4 H 10
Li
+
N
CH 3
N
CH 2Li
+
上述反应代表从简单的有机锂化合物制备较复杂 的有机锂化合物的一种方法,称为烃的金属化. 的有机锂化合物的一种方法,称为烃的金属化. 烷基锂容易将pKa值小于 的烃金属化. 值小于35的烃金属化 烷基锂容易将 值小于 的烃金属化.
Br
+ n-C 4 H 9 Li
Li
+ n-C 4 H 9 Br
(二)性质
有机锂化物均可溶于苯或环己烷中 性质与格氏试剂相似,但比格氏试剂更为活泼, 性质与格氏试剂相似,但比格氏试剂更为活泼, 可发生一些格氏试剂所不能发生的反应. 可发生一些格氏试剂所不能发生的反应.
1, 1,锂化反应
有机锂化物与烃作用,烃中较活泼的氢原子可被 锂取代
CH2=C CH=CH2 CH3
C4H9Li
CH2 C=CHCH2 CH3
n
二,有机锌化合物 (一)制法
1. 金属锌和卤代烃反应
2RX + 2Zn 2RZnX R 2 Zn + ZnX 2
2. 卤化锌和有机锂化物或有机镁化物反应
2RM + RZnX
M=Li,MgX
R 2 Zn + MX
(二)性质
R4Ge + 4MgClX R3Ga + 3LiCl R4Pb + Pb + 4MgClX
3,用二烷基汞与活泼金属反应: 用二烷基汞与活泼金属反应: 制备较纯的有机金属化合物
3R 2 H g + 2A l 2R 3 A l + 3H g
第二节 常见的有机金属化合物
一,有机锂化合物
在有机合成中起很重要的作用. 在有机合成中起很重要的作用. 较容易制备,能溶于惰性溶剂,使用范围不断 较容易制备,能溶于惰性溶剂, 扩大. 扩大. 常用有机锂化合物:正丁基锂 n-C4H9Li 常用有机锂化合物:
三甲基铝 [(CH3)3Al] 三甲基镓 [(CH3 )3Ga]
In
R
CH3 M Al (路易斯酸) Al R CH3 基衍生物 CH3 H 3C 三烷 第三主族 元素 3个价电子 6个价电子 个 个 三甲基铝的二聚体 H 3C M + 3R CH3 R
R R 3)3Ga + (CH3)3N' (CHM + N R3 R
(CH 3)4Si (CH 3CH 2)2SnCH 3 四甲基硅烷 三乙基甲基锡烷
3,当金属原子除了与有机基团相连外,还连有 ,当金属原子除了与有机基团相连外, 无机原子, 无机原子,可将其看作是带有有机基团的无机 盐加以命名. 盐加以命名
CH 3CH 2 MgI 碘化乙基镁
CH 3ZnCl 氯化甲基锌
应用最广的是烷基铝及其卤化物: 应用最广的是烷基铝及其卤化物: 三乙基铝 [(C2H5)3Al] 三异丁基铝 [(i-C4H9)3Al] 二乙基氯化铝 [(C2H5)2AlCl]
(一)烷基铝的制法 1,卤代烃与金属铝作用: ,卤代烃与金属铝作用:
是制备烷基铝最常用的方法
2Al + 3RX I2 RAlX2 + R2AlX (R=CH3,C2H5) R3Al2X3 (倍半卤代烷基铝) 倍
2,与碳碳重键的反应 , 环丙烷的制备: 环丙烷的制备:
