第五单元《定量研究化学反应》复习课
中考化学一轮复习 第五单元 定量研究化学反应 第07课时 定量研究化学反应课件

第十五页,共三十页。
NaCl和H2。
高频考向探究
2.[2013·宿迁] 图 7-1 为某化学反应的微观示意图,“ ”和“ ”分别代表不同元素的原子,该反
应可能是 (
A
)
图 7-1
A.2CO+O2
B.2H2+O2
2CO2
2H2O
C.CH4+2O2
#43;O2
2MgO
第十六页,共三十页。
1.计算步骤
(1)设:设
未知量。
(2)写:正确写出反应的
(一定要配平)。
化学(huàxué)方
(3)找:找出已知量和未知量的相对质量(
程式
(4)列:列比例式(根据已知量和待求量的相对质量
)与实际质量的关系。
相对分子质量和化学计量数的乘积
)。
(5)解:解比例式求出待求量(要有单位)。
(6)答:检查无误后简明地写出答案。
2Mg+O2
2MgO (2)正确写出反应的化学方程式
2×24
2×(24+16)
3g
x
2×24
2×(24+16)
=
3g
(3)写出相关物质的相对分子质量与化学计量数的乘积
(4)对应列出相关物质的已知量、未知量
x=5 g
答:生成氧化镁的质量为 5 g。
(5)列比例式,求解
(6)简明地写出答案
第十一页,共三十页。
之比等于实际质量之比
[口诀] 化学反应中有关计算的步骤可记忆如下:
化学方程要配平,需将纯量代方程(fāngchéng);关系式对关系量,单位统一不能忘;
关系量间成比例,解题步骤要完整。
第十页,共三十页。
第5单元定量研究化学反应复习与巩固---2024--2025学年九年级化学鲁教版(2024)上册

2NaHCO3
Na2CO3+H2O +CO2↑ 。
现取Na2CO3和NaHCO3的混合物10g,加热到
质量不再改变,剩余固体质量为6.9g。下列说
法正确的是( B )
A.反应后生成CO2的质量为3.1g
B.反应后生成CO2和H2O的质量比为22:9
C.原混合物中NaHCO3的质量为4.2g
D.原混合物中Na2CO3的质量分数为58%
中也只有氢、氧两种元素,反应前后元素种类没有改变。
从微观看:化学反应的过程,就是参加反应的各物质(反应物)分裂成原
子,原子又重新组合而生成其他物质(生成物)的过程。在这个过程中,
组成反应物的原子的大小和质量都没有变化。
综上所述:化学反应的实质是分子分裂为原子,原子重新组合成新分子。
反应前后,原子的种类和数目都不发生变化,因此反应物与生成物的质量
教学过程
当
堂
检
测
(多选)7.下列说法中正确的是( BC)
A.质量相等的氧化铁和四氧化三铁中,氧元素的质
量比为80:87
B.碳酸钠和氯化钠的固体混合物22.3g,其中含氧
元素4.8g,则该混合物中氯元素的质量为7.1g
C.某碳酸钙和氧化钙组成的混合物中钙元素的质量
分数为60%,将50g该混合物高温煅烧至固体质量不
。
(5)若将上述的固液混合物过滤后,向滤液中再加入4.4g水,如图,则需
要
g氢气完全燃烧,才能生成最终烧杯中水的质量。
教学过程
解: (1)
典
例
解
析
2H2O2
MnO2
2H2O +O2↑
解: (2)根据质量守恒定律,生成氧气的质量为:
九年级化学下册《第五单元 定量研究化学反应》复习课件

(填字母序号),A的
第十三页,共十八页。
2.某脱氧保鲜剂主要成分为活性铁粉。 利用(lìyòng)铁与氧气、水反应生成氢氧 化铁的原理,吸收包装袋中的氧气 和水分,从而延长食品的保质期。 已知该脱氧保鲜剂中活性铁粉的质 量为5.6 g。
计算该脱氧保鲜剂最多能够吸收氧 气的质量?(Fe:56 O:16)
【提出问题】水煤气是什么?
【猜想假设】根据资料和反应物判断,水煤气可 能是:①一氧化碳和氢气;②二氧化碳和氢气。
提出以上猜想的依据是
。
第九页,共十八页。
考点 二:化学方程式 (kǎo diǎn)
以客观 事实为基础(jīchǔ);遵循质量守恒定律
1.书写化学(huàxué)方程式的原则:
a、表示反应 物、生成物及反应条件。b、表示反
第五单元 定量 研究化学反应 (dìngliàng)
第一页,共十八页。
复习 目标 (fùxí)
1、掌握质量守恒定律的意义和应用(yìngyòng)。
2、掌握化学方程式的配平并能熟练写出学过 的化学方程式。
3 、理解化学方程式的含义,会根据化学 方程式进行简单计算。
第二页,共十八页。
考点一:质量 守恒定律 (zhìliàng)
(zhǒnglèi)
第四页,共十八页。
1.加热(jiā rè)ag氯酸钾和bg二氧化 锰的混合物制取氧气,到固体 的质量不再减少为止,得到cg 固体剩余物。根据质量守恒定 律可知,生成氧气的质量为
( )B
A (a+b)g B (a+b-c)g
C (a-c)g D (b-c)g
第五页,共十八页。
2、已知反应3A+2B=3C+2D,生 成物C和D的质量比为9:8,若 A和B两种物质共51克,充分 混合,恰好完全反应,则 (chōngfèn)
第五单元定量研究化学反应复习课
定律
解 的 种类 、 数目 、 质量 没有变化,因此化学反应
释
前后物质的总质量守恒。
2.化学反应前后各种量的关系
宏观
六
不
变
微观
两改变 宏观 微观
两个可能变 分子 的数目可能改变
元素种类 不变 元素质量 不变 物质的质量总和 不变 原子的种类 不变 原子的数目 不变 原子的质量 不变 物质 的种类一定改变 分子 的种类一定改变
例 2 (2019·四川达州)下图为某化学反应的微观示意图,图中“ ”表示硫原
C 子,“ ”表示氧原子。下列说法错误的是 ( )
A.甲是 SO2 B.该反应属于化合反应 C.参加反应的甲、乙两种物质的分子个数比为 1∶1 D.化学反应前后,原子种类、数目均不变
常考点突破
3.表格数据分析
例 3 (2019·云南)在一定条件下,一密闭容器内发生某反应,测得反应前后各物
请回答: (1) 二 氧 化 锰 作 为 催 化 剂 , 在 化 学 反 应 前 后 本 身 的 ______________都没有发生变化。 (2)反应生成氧气的质量为_______g。 (3)计算过氧化氢溶液中溶质的质量分数。(此问必须要有计算过程)
核心实验突破 实验:探究化学反应前后物质的质量有无变化 例6 某兴趣小组设计如下实验探究质量守恒定律。
考点梳理
知识点一 质量守恒定律 知识点二 化学方程式 知识点三 利用化学方程式的简单计算
知识点一 质量守恒定律
1.质量守恒定律的理解
质量
内 参加化学反应 的各物质的质量总和等于 反应后生 容 成 的各物质的质量总和
微 在化学变化中,旧的分子 分裂 成 原子 , 原
守恒 观 子 重新组合成新的分子。即在化学反应前后,原子
第五单元_定量研究化学反应复习课件haha2

②量的方面:表明了化学反应中各物质的 质量 关系。
表明了化学反应中各微粒的 数量 关系。 如:2H2 + O2 2H2O表示参加反应的氢气、氧气和生成的水的 质量比为: 1 : 8 : 9 。分子的个数比为: 2 : 1 : 2 。 (3)书写原则:① 遵守客观事实 ② 遵守质量守恒定律 。 (4)书写步骤:① 写 ② 配 ③ 注 。
2C2 H5SH 9O2 点燃4CO2 2X 6H2 O
则X的化学式为( )
A.H 2SO 4 B.SO3
C.SO2 D.CO2
【例3】为防止煤气逸散使人中毒,常在煤气中
加入少量的有特殊刺激性气味的乙硫(C2H5SH)。 乙硫醇在煤气燃烧过程中也可以充分燃烧,其化 学方程式为:,则X的化学式为( ) A. B.SO3 C.SO2 D.CO2
2、A、B、C三种物质各15g,当它们相互 反应完成时生成30g新物质D,若再增加 10gC,它们又继续反应完成时,A与C恰好 消耗完毕。则参加反应的A与B的质量比 ( ) A 、 2: 3 B、 2 : 1 C 、 3: 2 D 、 1: I
总结收获:
设 答 写
根据化学 方程式的 计算 列
化 学 方 程 式
一、质量守恒定律及其应用
判断下列说法是否正确,并说明理由:
1、2g氢气与8g氧气完全反应,生成的水的质量 为10g。(×) 2、镁条燃烧后,生成的氧化镁的质量增加,这一 变化不遵守质量守恒定律( × )
3、物质反应前后总质量不变,所以反应前后的分 子个数也不变。( × )
自我小结:
在运用质量守恒定律时要注意哪些方面?
(Na:23 C:12 O:16 H:1 Cl:35.5 )
学以致用,提高能力
定量研究化学反应复习课(1)

参加化学反应的各物质
内容 的质量总和等于反应后
质
生成的各物质的质量总和
量
守
恒
定
律
判断下列说法是否正确: (1)100克干冰升华变成100克二氧化碳气体符合质量守恒定律。 (2)根据质量守恒定律,2L氢气与1L氧气恰好完全反应,生成3L水。 (3)根据质量守恒定律, 3gC在10gO2中充分燃烧,生成13gC02 。 (4)根据质量守恒定律,燃烧的镁带和生成的白色粉末质量相等。
参加化学反应的各物质
内容 的质量总和等于反应后
质
生成的各物质的质量总和
量 守
原因
原子种类没有改变 原子数目没有增减
恒
原子质量没有变化
定
律
解释一些实验事实
应用
推测一些物质的组成或化学式, 书写化学方程式
例:生物的呼吸作用表示为: 有机物 + 氧气→二氧化碳 + 水 以下关于有机物组成元素推断正确的( )
1、复习质量守恒定律,能从微观角度分析质量守恒定律的原因。 2、加强对质量守恒定律的理解,通过实验分析提高学生探究能力。 3、通过分析物质的组成以及化学方程式的书写和计算,提高学生对质量
守恒定律的应用能力。
成语“点石成金”,本意为古代术士的 一
种法术,即能使石头变成黄金;现比喻能 化腐朽为神奇。有人说他能把石灰石变成黄 金,你认为可能吗?依据是什么?
A.2m = a
B.3n = 2a
C . m=2a
D.a = n – m
例1:已知反应3A+2B=2C+D,A、B两物质恰好 完全反应时质量为3:4,若生成C和D的质 量和为140g,则反应中消耗B的质量是( )g
分析:
中考化学复习方案 第五单元 定量研究化学反应课件

第7课时(kèshí)┃ 归类示例
变式题 [2012·龙岩] 图7-2为探究化学反应前后物质总质 量关系的实验装置图。请根据要求回答。
第十六页,共三十二页。
第7课时(kèshí)┃ 归类示例
(1)将图7-2甲所示滴管中的盐酸滴入盛有大理石的小试管中,有气泡产生,
该反应的化学方程式为_________________
3.应用:(1)解释有关化学反应中物质的质量变化现象;
(2)确定某物质的组成或化学式; (3)求算化学反应中某种物质或元素的质量;
(4)判断(pànduàn)化学反应的类型。
第六页,共三十二页。
第7课时┃ 考点(kǎo diǎn)聚焦 考点(kǎo diǎn)2 化学方程式
1.概念:用______化__学__式__表示化学反应的式子。 2.书写原则:必须以______客__观__事__为实依据,绝不能凭空臆 造;遵循(zūn xún)____质__量__守_恒__定__律___,即化学方程式两边各种原 子的总数要相等。
第十四页,共三十二页。
第7课时(kèshí)┃ 归类示例
归类示例
► 类型(lèixíng)一 质量守恒定律的探究 命题角度:通过设计实验探究质量守恒定律,分析实验中产生
误差的原因,评价(píngjià)实验方案的严密性、可行性。
例1 [2011·泸州] 在如图7-1 所示的装置中,当两种溶液发生反 应后,天平不再保持平衡,指针向 右偏转。天平不平衡的原因是 __反__应__生__成_的__二__氧_化__碳__气_体__放__出_____, 反 ___应__的__化__学__方__程__式__为_______N__a__2__C__O____3+__。 2H2SO4===Na2SO4+CO2↑+H2O 若反应物不变,要使天平在反应后仍然保持平衡,你认为对装置 的改进措施是___把__烧__杯__换__成__锥__形__瓶__,__在__锥__形_瓶__口__系__一__个__气__球_。
第五单元《定量研究化学反应》复习课

Zn + H2SO4 = ZnSO4 + H2↑
65
161
2
x
y
0.4g
65:x=2:0.4g
x=13 g
161:y=2:0.4g y= 32.2 g
黄铜屑中铜的质量为:32.5g-13g=19.5g
设蒸发的水的质量为m g
32.2g / (180g+13g-0.4g-m)×100%=20%
m=31.6g
答:生成氧化镁80g。
练一练
1.已知每瓶氧气的质量大约是0.16g,根据前面的探究你
试着求一下:要制两瓶氧气需要多少克过氧化氢?
解:设需要过氧化氢的质量为x
2H2O2 催剂==化== 2H2O↑+O2↑
2×34
32
x
0.16g×2
2×34
32
x = 0.16g×2
x=0.68g
答:需要过氧化氢0.68g。
物质组成
2、有一种可燃物在空气中燃烧生成了二氧化碳和 水,则对此化合物组成的说法正确的是()
A. 一定含有碳、氢、氧三种元素 B. 一定含有碳、氢两种元素,不含有氧元素 C. 一定含有碳、氢两种元素,可能含有氧元素 D. 可能含有碳、氢、氧三种元素
推断化学式
3、某种气态化合物R在空气中充分燃烧
R
+
点燃
5O2 ==
3CO2 +
4H2O,根据质量守恒定
律,判断R的化学式为()
A. CH4 B. C3H8 C.C2H6O D. C3H8O
化学方程式的意义
1.从宏观角度: 表示了反应物、生成物及反应条件。
2.从微观角度: 表示了各物质的微粒的个数比
初中化学_第五单元《定量研究化学反应》单元复习课教学设计学情分析教材分析课后反思
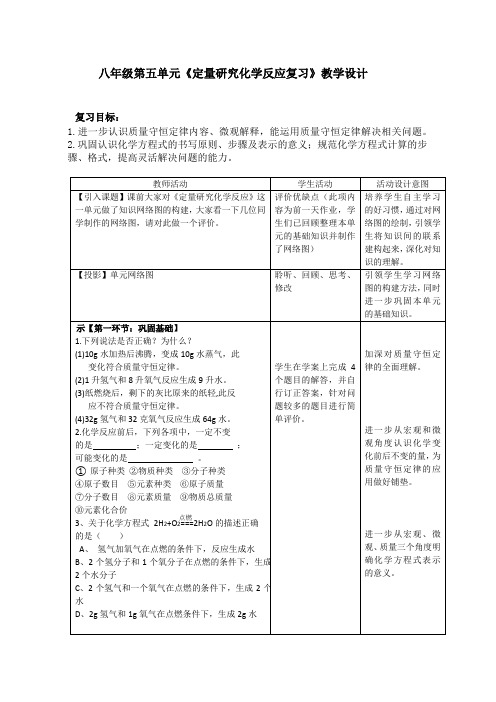
八年级第五单元《定量研究化学反应复习》教学设计复习目标:1.进一步认识质量守恒定律内容、微观解释,能运用质量守恒定律解决相关问题。
2.巩固认识化学方程式的书写原则、步骤及表示的意义;规范化学方程式计算的步骤、格式,提高灵活解决问题的能力。
4、下列化学方程式是否正确?为什么?点燃 (1) 4P +5O 2 ===2P 2O 5点燃 (2)4Fe+3O 2===2Fe 2O 3 (3) H 2+O 2===H 2O点燃 (4)CH 4+2O 2===CO 2 +2H 2O通过该题组练习,强化化学方程式书写的注意事项,为正确书写做好铺垫。
【第二环节:强化重点】一、质量守恒定律的探究和应用1:在课堂教学中,老师们引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,同学们都进行了规范的操作、准确的称量和细致的观察。
实验装置和选用药品分别以ABC 表示如下:(1)上述三个实验探究反应前后天平仍平衡的是 ,天平不平衡的是 。
(2)B 实验天平不平衡的原因是 。
若要得到正确结论,请帮助改进实验装置。
【小结】探究设计质量守恒定律时,若有气体参加或生成的反应要在 装置中进行 。
2:甲乙丙丁四种物质在密闭容器内混合后,在一定的条件下充分反应,测得反应前后各物质的质量分数如下表所示,说法正确的是( )A.丁一定是这个反应的催化剂B.参加反应的甲和乙的质量之和一定等于生成的丙的质量C.甲一定是化合物,乙一定是单质甲 乙 丙 丁 反应前质量分数/% 70 15 6.25 8.75 反应后质量分数/% 35 7.5 48.75 x学生口答,针对气球反应完后是否胀大产生浮力展开实验创新,观看微视频,充分理解实验改进方法和原理。
学生讲解解题的思路和方法。
通过该问题解答,使学生明确探究设计质量守恒定律时的注意事项:若有气体参加或生成的反应要在密闭装置中进行 ,并学习灵活进行实验的创新性改进通过该表格题的解答,使学生明确用质量守恒定律进行未知质量的求算是解决问题的关键。
定量研究化学反应(单元复习课件)

考点三:化学方程式的书写
【迁移训练3】在化学反应 aC2H6+bO2═mCO2+nH2O中,各化学式系数之 间的关系正确的是( B )
A.a=3m B.m=2a C.3n=a D.2b=m+n
考点四:根据化学方程式进行计算
1.解题步骤:
(1)设未知量 (2)写方程式 (3)找相关量,即列 出跟计算 (4)列比例式,求未知量 (5)回答问题
反应物 生成物
3.化学方程式中需要注意的问题: 在化学方程式中,通常用“△”表示反应需要_加__热__,用“↑” 或“↓”注明生成物是_气__体___或是_沉__淀___. 4.化学方程式的意义 定性方面:①表示反应物、生成物和反应条件。 定量方面:②表示反应物、生成物之间微粒个数比。
(化学计量数之比、系数比)
6.质量守恒定律中的规律总结
六个“不变” 两个“一定变” 三个“可能变”
宏观 微观
①元素的种类 ②元素的质量 ③物质的总质量 ①原子的种类 ②原子的数目 ③原子的质量
物质的种类
①元素的化合 价
②物质的状态
分子的种类 分子的数目
7.质量守恒定律的应用
(1)进行有关的计算; (2)推测物质的组成,确定物质中所含元素的种类; (3)确定化学反应中某种物质的化学式; (4)判断化学方程式是否正确; (5)解释化学反应中的一些简单的现象和问题。
4.化学反应的实质:物质发生化学反应时,只是反应物的 原子__重__新__组__合____,生成新物质。 5.质量守恒定律的微观解释:在化学反应前后,原子的 ______种__类___没有改变,原子的___数__目___没有增减,原子的 _____质__量_____也没有变化。因此,化学反应前后物质的总 质量不变
定量研究化学反应复习

东平街道中学
展长国
复习目标
1、能熟练复述质量守恒定律的内容和守恒的本 质,并会利用质量守恒定律推断物质的组成 及化学式等。 2、能根据书写化学方程式的步骤判断化学方程 式的正误及正确书写化学方程式。 3、会根据化学方程式进行相关化学计算。
本单元知识结构
化学反应
质量守恒定律
中考真题:2016 泰安 26题 试写出Fe(OH)2和O2、水发生反应生成Fe(OH)3的化学 方程式: 。
考点五:推断化学式
典例.“长征火箭”燃料燃烧的化学方程式为
C2H8N2 + 2N2O4 =2CO2+ 4H2O + 3X ,则X的化学式是 。
跟踪训练: 1、宇航服可采用氢氧化锂(LiOH)去除二氧化碳气体。该反应 的化学方程式为:2LiOH + CO2 == Li2CO3 + X , 则X的化学式 为 。
考点二:质量守恒定律的微观本质 典例:2016 泰安 第8题科学家最新发现,通过简单的化学反
应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观 示意图。下列说法错误的是 B
A.参加反应的X、Y两物质的粒子个数比为3:4 B.该反应不属于置换反应 C.W物质中碳元素的质量分数为75% D.化学反应前后原子的种类、个数、质量均保持不变 解题方法指导:紧密结合质量守恒的微观本质——原子 种类、原子数目、元素种类不变解答。
考点四:根据信息书写化学方程式
解题方法指导:细读信息,找出反应物、生成物和反应条件 典例:镁是一种比较活泼的金属,点燃后它既能在氮气中、也能 在二氧化碳中继续燃烧.已知镁在氮气中燃烧化合成一种物质, 其中氮元素的化合价是-3价;镁在二氧化碳中燃烧生成一种金属 氧化物和一种非金属单质,试写出镁在空气中燃烧时可能发生的 反应的化学方程式:(1)_________________________ (2)_________________________ (3)________________________方程式书写正确的是( D ) A.2Fe+6HCl = 2FeCl3+3H2↑ 高温 B.CO+Fe2O3 2Fe+CO2 C.2NaOH+CuSO4=Na2SO4+Cu(OH)2 D.NaHCO3+ HCl=NaCl+CO2↑+H2O
第五单元《定量研究化学反应》复习课件

2.(绥化中考)下列对应的化学方程式书写完全正确的 是 ( ) A.用澄清的石灰水检验二氧化碳气体 CO2 +Ca(OH)2 ==CaCO3↓+ H2O B.用水的电解实验测定水的组成 2H2O 通电 2H2+ O2 点燃 C.在密闭的容器中燃烧镁条验证质量守恒定律
点 Mg+O2==2MgO2
4、(2013济南中考)6g某物质在氧气 中燃烧,生成4.4gCO2和2.7gH2O,则该 化合物中一定含有 元素。
5、(2013邵阳中考)将A、B、C各10g 的混合物加热后,A全部参加反应,C 增加了8g,同时生成了4gD,则在反应 中A和 B的质量比是( A ) A.5:1 B.1:5 C.1:4 D.4:1
元素的质量
物质的总质量
物质的种类
一定改变:
分子的种类
元素的化合价
可能改变:
分子的数目
质量守恒定律的应用
1、镁带在氧气中燃烧
解释现象:生成白色的固体收集后称 量,发现比燃烧的镁条质量大。
镁 + 氧气 → 氧化镁
注意:
点燃
m1
m2
有气体参加或有气体生成的反应必须在密 闭容器中进行才能用于验证质量守恒定律
中考链接:1、 (2013青岛中考) 在化学反应2XY2+Y2=2Z中Z的化 学式为(B )
A、X2Y3
C、X2Y6
B、XY3
D、 X2Y4
2、 (2013兰州中考)反应A+B=C+D中,
已知2 g A和5 gB参加了反应,生成了4 g C, 3 则有____ g D生成。
3、(2012淄博中考)某物质在氧气中燃 烧,生成CO2和H2O,则该化合物中一定 含有 元素,可能含有 元素。
中考化学教材化总复习 第五单元 定量研究化学反应课件

物质
甲烷 氧气 水 二氧化碳 X
反应前质量/g 3.2 11.2 0
0
0
反应后质量/g 0
0 7.2 4.4 a
下列判断正确的是 A.表中a的值为2.6 C.X可能含有氢元素
2021/12/9
( D) B.X一定是该反应的催化剂 D.X一定含有氧元素
第二十一页,共三十二页。
第7课时┃ 归类(ɡuī lèi)示例
[方法点拨] 进行质量守恒定律探究实验时,一要注意所选物
质(wùzhì)要能发生化学变化;二要注意是否有空气中的物质(wùzhì)参 与进去或是否有产物逸散到空气中去,如果有此情况,必须在密闭 容器内进行;如果没有此情况,可以在敞口容器内进行。
2021/12/9
第二十页,共三十二页。
第7课时(kèshí)┃ 归类示例
第十七页,共三十二页。
第7课时┃ 归类(ɡuī lèi)示例
(5)小明认为:实验时,即使锥形瓶中未盛装石灰水,实验前后天平
(tiānpíng)也将会保持平衡。老师在赞许小明观点的同时,指明了如果不使用石
灰水可能会存在一定问题。该问压__增__大___,__橡__皮__塞___弹__出__,_影__响___实__验__测。定
五单元(dānyuán) 定量研究化学反应
第7课时(kèshí) 定量研究化学反应___
2021/12/9
第一页,共三十二页。
第五 单元 (dìwǔ) 定量研究化学反应
2021/12/9
第二页,共三十二页。
第7课时┃定量(dìngliàng)研究化学 反应
第第7课7课时时 定定量量研研究究化化学学反反应应
第7课时┃ 考点(kǎo diǎn)聚焦
[说明] 配平化学方式程式的方法较多,但总体应注意两个
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
X= 3.25g 答:参加反应的锌的质量为3.25g。 这种锌粒中锌的质量分数为72%
3、 将含3克氯酸钾和1克二氧化锰的混合物加热片刻,冷却,称 得残余固体的质量为3.04克,根据质量守恒定律可知,生成氧气 的质量为多少克?固体残余物中含有什么物质?质量各为多少?
思路:反应中固体物质质量减轻了,原来3克+1克=4克, 加热片刻后剩余固体3.04克,固体质量为什么会减轻?减 轻了多少?此减轻的是什么物质的质量?
(5) 简明地写出答案
….………… 答
3.根据化学方程式计算的注意事项: (1)所有代入化学方程计算的量必须是纯净物的质量,如果 是不纯物,则需要转换。 纯物质的质量=不纯物质质量×纯度=不纯物质质量×(1-杂 质的质量分数) (2)气体、液体的体积,要换算成气体、液体的质量。 气体质量(g)=气体体积(L)×密度(g/L) 液体质量(g)=液体体积(mL)×密度(g/mL) (3)若题目中只给出一种物质的质量,则另一种物质的用量 往往用“足量”、“适量”、“过量”或“完全反应”、“恰 好完全反应”等来描述。如果同时知道两种反应物的质量,需 要考虑过量问题。 (4)注意已知质量的单位;设未知数的时候要设×××的质 量为X,而不能设××× X克;整个化学计算过程要带单位, 最后求出的X的值后写上单位。(无说明则保留到小数点后一位)
3.加热15.8g高锰酸钾,当产生1.6g氧气时,固体剩余物的成分 是 ( A )
A.K2MnO4和MnO2 B.KMnO4、K2MnO4和MnO2
C.KMnO4和MnO2
D.KMnO4和K2MnO4
思路:根据氧气的质量来求生成这么多氧气需要分解多少 克高锰酸钾。要注意到15.8克高锰酸钾有可能没有全部分解。 所以15.8克这个数据在此不能直接用于计算。 解:设生成1.6克氧气需要分解高锰酸钾的质量为x △ 2KMnO4 ==== K2MnO4 + MnO2 + O2↑ 316 32
A.氢气
B.红磷
C.硫
D.铁
思路:写出反应方程式,作适当的变形,使氧气化学式前 的计量数相等(都为1),然后观察比较,一般不必算出最 后结果。 2.相等质量的铁和锌分别与足量的稀盐酸反应,已知反应的化学 方程式为:Fe+2HCl=FeCl2+H2↑, Zn+2HCl=ZnCl2+H2↑。则生成 氢气的质量是 (B ) A.相等 B.铁大于锌 C.铁小于锌 D.无法比较 思路: Fe+2HCl = FeCl2+H2↑ 56 2 m x Zn+2HCl = ZnCl2+H2↑ 2 65 m y
例:某纯净物X在空气中完全燃烧,反应的化学方程式为:
X + 3O2 = 2CO2 + 2H2O,试推断X的化学式 C2H4 。 思路: X + 3O2 = 2CO2 + 2H2O 反应前 X中: C: 2个 H: 4个 反应后 C: 2个 H: O: 4个 6个
O: 6个 注意:X前的计量数
若2X + 3O2 = 2CO2 + 4H2O,试推断X的化学式
。
若2X + 3O2 = 2CO2 + 4H2O,试推断X的化学式 2X + 3O2 = 2CO2 + 4H2O 反应前 C: 2个 2X中: H: 8个 O: 2个 O:6个 反应后 C: 2个
。
H:
O:
8个 8个
∴X的化学式为CH4O(或CH3OH)
练习
1.相等质量的下列物质,在氧气中完全燃烧,消耗氧气最多的 是 ( A )
练习: 简单计算
1、已知40克硫磺恰好与40克氧气完全发 生反应,生成 80 克二氧化硫。现将50克 硫磺放在 40 克氧气中,使其充分燃烧, 实际上只有 40 克硫磺参与反应,则反应 80 后剩余硫磺 10 克,生成二氧化硫______ 克。
物质组成
2、有一种可燃物在空气中燃烧生成了二氧化碳和 水,则对此化合物组成的说法正确的是() A. 一定含有碳、氢、氧三种元素
课堂小结:
1.根据化学方程式计算的一般方法是:
掌握根据化学方程式计算各反应物和生成物之间的质量比是这 类计算的关键。因此必须注意以下几点:
(1)认真审题,分析题目涉及到什么反应,已知物是什么,待 求物是什么。 (2)正确书写出反应的化学方程式(这是正确解题的前提), 因此在计算之前必须检查化学方程式是否正确(重点查:①各 物质的化学式是否正确;②化学方程式是否符合质量守恒定律 即是否配平。)。 (3)正确计算出反应中已知物质和待求物质的质量比。 (这是正确解题的关键)
③相对分子(或原子) 质量之和计算错误 ④未注明单位, 未带单位计算 ⑤计算结果错误且无单位
×
142×15.5 X = -------------31 = 71 答:可生成五氧化二磷71克.
练习
1、把23克乙醇(俗称酒精)在空气中充分燃烧 后,只生成27克水和44克二氧化碳,由此推断 乙醇由几种元素组成?
·山东教育版
·山东教育版
·山东教育版
练习:
4、根据已学知识判断下列反应方程式是否正 确。如有错误,请指出错误之处。 (1)3Fe + 2O2
加热
Fe3O4
(2)Mg + O2
(4)H2O (5)H2O2
通电
点燃
MgO2
点燃
不符合客观事实
(3)CH4 + 2O2↑
MnO2
CO2 + 2H2O
不符合客观事实
2、把4.5克含杂质(杂质不与盐酸反应)的锌粒和足量的稀盐酸 反应,待反应停止后,烧杯中物质的质量减少了0.1g。求: (Zn+2HCl===ZnCl2 + H2↑) ①参加反应的锌的质量。 ②这种锌粒中含锌的质量分数。 解:设参加反应的Zn的质量为X 根据题意:反应生成氢气的质量为0.1g Zn+2HCl===ZnCl2 + H2↑ 65 2 X 0.1g 65 2 = X 0.1g ∴该锌粒中 3.25g Zn%= ×100% = 72% 4.5g
(4)进行准确、熟练的数学运算(这是解题正确的保证)。
(5)要有完整的解题步骤和规范的书写格式。 (这是解题规范的必需)
2、根据化学方程式进行计算的步骤
Hale Waihona Puke (1)设未知数 ……………....…………设 (2)写出化学方程式 …...…… 写 (3) 写出有关物质的相对分子质量 (不忘乘以前面的化学计量数) 列 已知量和未知量 比 列比例式 (4) 求解 …...….…..………………… 解
练习一:15.5克红磷在氧气中充分燃烧,可 生成五氧化二磷多少克?
(找出下列所解答案中的错误) × 解:设可生成X克五氧化二磷 ①设未知数不正确 点燃 × P + O 2 ====== P 2 O 5 ②未配平 × 31 × 15.5
×
31 = --------15.5 ------142 X
142 X
第五单元
《定量研究化学反应》
-------复习课
考点全息整合
各物质的质量 生成的各物质的质量 分子 种类 质量 数目
·山东教育版
理解和应用质量守恒定律时应注意:
1.必须是真正参加反应的物质 2.各物质的质量总和相等, 不是其他物理量,如体积 3.只能用于解释化学变化
质量守恒定律守恒分析归纳:
宏观
[例题]:3克镁在氧气中充分燃烧,可以生成多少克氧化镁? 解:设可生成氧化镁的质量为X 点燃 2 Mg + O 2 ====== 2 Mg O 48 80 3克 X 48 克 ------ = 3 -----80 X (1)设未知数 ….... …….….设
(2)写出化学方程式…...…..写
(3)列出相关数据 …...…..列
2KClO3 ── 2 KCl +
△
MnO2
O 32
↑
3 奇数配偶数法:找出出现次数最多且是奇数 个的原子,在其前面配2,然后依次配平。 如: C2H4 + 3 O2 —— —— 2 CO2 + 2 H2O 4.定一法:首先从一种化学式较复杂的物质着 手,并把计量数看为1,以此作为配平的起点 根据原子个数守恒,由已经确定的化学计量数 来确定其他化学式的计量数(可为分数)若配 平后出现分数,则在方程式两边各乘以某数, 使计量数变为最简整数比
(4) 写比例式,求解.….……..比
80×3克 X = ------------ ….. …... …………………………….解 48 = 5 克 答:3克镁在氧气中充分燃烧可生成氧化镁 5 克。 (5) 简明地写出答案…..…...答
根据化学方程式计算的注意事项:
(1). 根据物质的组成及化学方程式 求各化学式的相对分子质量(或相对 原子质量)与化学式前边计量数的乘 积,计算时必须准确无误。 (2). 解题格式的书写要规范化。 (3). 注意单位的书写要求。
《化学方程式》知识归纳:
1、理论依据:质量守恒定律
化 学 方 程 式
1、以客观事实为依据
2、书写原则
2、遵守质量守恒定律
1、宏观:
3、涵义
2、质量 3、微观:
4、书写步骤:写、配、注、等
5、应用
1、表示化学反应
2、根据化学方程式进行计算(解题步骤)
化学式
客观事实 质量守恒定律
·山东教育版
·山东教育版
B. 一定含有碳、氢两种元素,不含有氧元素
C. 一定含有碳、氢两种元素,可能含有氧元素
D. 可能含有碳、氢、氧三种元素
推断化学式
3、某种气态化合物R在空气中充分燃烧
R + 5O2 == 3CO2 + 4H2O,根据质量守恒定
律,判断R的化学式为()
