SHU-2011-6气固相反应动力学
气固相催化反应的动力学步骤

气固相催化反应的动力学步骤以气固相催化反应的动力学步骤为标题,本文将从理论和实践两方面介绍气固相催化反应的动力学步骤。
一、理论部分1.催化剂的吸附在气固相催化反应中,催化剂的吸附是反应的第一步。
催化剂表面存在各种吸附位,其中最常见的是吸附位和活性位。
吸附位是催化剂表面的一个缺陷,其表面结构与晶体结构不同,因此吸附能力较强。
活性位则是吸附位上的一些具有活性的物种,如氢原子、羟基、氧原子等。
催化剂表面的吸附位和活性位对反应物的吸附和反应至关重要。
2.反应物的吸附反应物吸附在催化剂表面的吸附位和活性位上,通过化学键形成催化剂-反应物复合物,这是反应的第二步。
3.反应反应物在复合物的作用下发生反应,形成产物。
反应速率取决于反应物的浓度、催化剂的活性、反应温度等因素。
4.产物的脱附产物脱附是反应的最后一步,当产物与催化剂之间的键断裂时,产物会从催化剂表面脱离。
二、实践部分以催化裂化反应为例,介绍气固相催化反应的动力学步骤。
1.催化剂的选择在催化裂化反应中,催化剂的选择非常重要。
催化剂应具有较高的活性和选择性,同时还应具有较高的稳定性和寿命。
2.反应条件的控制催化裂化反应需要适宜的反应温度、反应压力、反应时间等条件。
反应温度一般在450-550℃之间,反应压力一般为1-2MPa。
3.反应物的选择催化裂化反应的反应物为长链烷烃,反应物的选择对反应的效果有很大影响。
一般来说,碳数较多的长链烷烃反应活性较低,而碳数较少的烷烃反应活性较高。
4.反应机理的研究通过对反应物和产物的分析,可以确定反应的机理和动力学参数,如反应速率常数、反应级数等。
这对于优化反应条件、提高反应效率具有重要意义。
气固相催化反应的动力学步骤包括催化剂的吸附、反应物的吸附、反应和产物的脱附。
在实践中,催化剂的选择、反应条件的控制、反应物的选择和反应机理的研究是保证反应效率和催化剂寿命的关键。
气固相反应动力学
例如是,可天逆然吸气热的反蒸应汽,转提化高反温应度有C利H于4提高H反2O应速率C并O提高H甲2烷的平衡转化率,
但考虑到设备材质等条件限制,一般转化炉内温度小于800-850℃。
第五节 温度对反应速率的影响及最佳温度
3)可逆放热反应
rA
k1
f1 (
y)
k2
f2
(
y)
k1
f1 (
y ) 1
f1 (
y ) 1
k2 k1
f2 ( y) f1( y)
k1
f1 (
y ) 1
f2 ( y)
K
y
f1( y)
1)不可逆反应:只有正反应,上式中中括号部分为1。由于反应速率常数随温度 的升高而升高,因此,无论是放热反应还是吸热反应,都应该在尽可能高的 温度下进行,以获得较大的反应速率,但在实际生产中,要考虑以下问题:
Ea Ea0 A
Ed
Ed0
A
Ea0,Ed0,,为常数
第四节 气固相催化反应本征动力学方程
将吸附和脱附活化能代入净吸附速率的表达式中:
r
ra
rd
A pA
f
A
exp
Ea0 RgT
A
RgT
k
'
f
'
A
exp
E2 RgT
由条件
rA T
y
0,对上式求导,使其等于零,并以Top代替T
f1( y)k10
E1 RgTo2p
《气固相反应动力学》课件

目录
• 气固相反应动力学概述 • 气固相反应动力学的基本原理 • 气固相反应的动力学实验研究 • 气固相反应的动力学模拟研究 • 气固相反应动力学的应用研究 • 总结与展望
01
气固相反应动力学概述
定义与特点
定义
气固相反应动力学是研究气体与固体 物质之间反应速率和反应机制的学科 。
科学研究
气固相反应动力学是化学反应工 程和物理化学等领域的重要分支 ,对于深入理解反应机制和探索 新反应路径具有重要意义。
气固相反应动力学的发展历程
早期研究
早在19世纪,科学家就开始研究气固相反应,初期主要关注燃烧和氧 化等简单反应。
理论模型建立
随着实验技术的发展,20世纪初开始建立气固相反应的动力学模型, 如扩散控制模型和化学反应控制模型等。
工业粉尘治理
通过气固相反应技术对工业生产过程中产生的粉尘进行控制和处理 ,减少空气污染。
土壤修复
利用气固相反应技术对受污染的土壤进行修复,如通过化学氧化还原 反应降低土壤中的重金属含量。
在新材料研发中的应用
纳米材料制备
气固相反应技术可用于制备纳米材料,如纳米碳管、纳米氧化物 等,具有广泛的应用前景。
实验技术进步
20世纪中叶以后,实验技术的进步为气固相反应动力学研究提供了更 多手段,如激光诱导荧光、质谱仪等技术的应用。
当前研究热点
目前,气固相反应动力学的研究重点包括新型催化剂的设计与制备、 反应机理的深入研究以及计算机模拟在动力学研究中的应用等。
02
气固相反应动力学的基本 原理
化学反应动力学基础
跨学科合作
气固相反应动力学涉及多个学科领域,需要加强跨学科合 作,促进多学科交叉融合,共同推动气固相反应动力学的 发展。
第五章 气-固相催化反应动力学

* K A p* K R pR A i * 1 K A p* K R pR A
或(1 i )
1
* 1 K A p* K R pR A
对于化学反应: A+ B
L+M
(双组分反应)
(1)反应物吸附: A X AX ;
B X BX ;
(2)表面反应: AX BX LX MX ; (3)产物脱附: LX L X ; MX M X ;
C14-SL型二段转化 催化剂
QDB-04型CO耐 硫变换催化剂
(1)固体催化剂的组成及基本制备方法 活性组分——原子——活性中心 (1)组成 助催化剂——分子——协同作用 载 体——骨架——支撑作用
浸渍法——贵金属催化剂 (2)方法
沉淀法——氧化物催化剂 共混法——氧化物催化剂 熔融法——金属催化剂
1 d ni 1 d ni ri 或ri S dt W dt
(3)反应速率与固体颗粒催化剂内的扩散速率有关。
5.1.2 固体催化剂的表面积、外表面积和内表面积
S108型二氧化硫氧 化制硫酸催化剂
A202型氨合成催 化剂
C307型中低压合 成甲醇催化剂
T-504型常温COS 水解催化剂
多组分
j i
rd ,i kd ,ii
——脱附速率方程
其中:
i — 覆盖率; (1 j ) — 空位率;
j i
k a A exp( Ea / RgT )
பைடு நூலகம்
——吸附速率常数
kd k exp( Ed / RgT ) ——脱附速率常数
列如某一表面反应为:A B C 若三个组分都被吸附, 则各对应组分的吸附和脱附速率方程有:
第五章 气-固相催化反应动力学

5.2.2 吸附等温方程 思考1:吸附等温方程?
第五章 气-固相催化反应动力学 5.1 气-固相催化反应 5.2 气-固相催化反应本征动力学 5.3 气-固相催化反应宏观动力学
5.1 气-固相催化反应
5.1.1 气-固相催化反应概述 1、气-固相催化反应——非均相反应——发生在气-固界面。
2、气-固相催化反应的特征
(1)在操作条件下反应物和产物都为气体;
图例 外层气膜 内孔结构 向内传递 向外传递
气 流 主 体
反应物 生成物
气 膜 界 面
反应物 生成物
颗 粒 外 表 面
孔 反应物 道
内 生成物 表
面
气-固相催化反应过程基本概念
● 气流主体——对流过固体催化剂颗粒的气体物料的统称。 ● 气 膜——气流主体流过固体颗粒催化剂外表面所形成的
层流边界层。 ● 外扩散过程——反应组分在气膜中的扩散过程。
(2)反应主要在固体颗粒催化剂内表面上进行;
ri
1 S
dni dt
或ri
1 W
dni dt
(3)反应速率与固体颗粒催化剂内的扩散速率有关。
5.1.2 固体催化剂的表面积、外表面积和内表面积
S108型二氧化硫氧 A202型氨合成催 化制硫酸催化剂 化剂
C307型中低压合 成甲醇催化剂
T-504型常温COS 水解催化剂
① ②
Hale Waihona Puke B① ②③ M
① A A B B
② A B L M
A+B
L+M
气-固相催化反应本证动力学 过程示意图
③ L L M M
5.2.1 本证动力学过程速率方程
第二次课、气固相反应动力学

化学吸附受以下三个因素的影响: (1)单位表面积上气体分子的碰撞数
碰撞频率越大,吸附速率越大。在单位时间内气体 分子和表面的碰撞次数越多,被吸附的可能性越大。由 气体分子运动论知:气体中组分在单位时间内对单位表 面的碰撞数与气体中组分A的分压PA成正比。
即:吸附速率与分压成正比。
(2)吸附活化能 化学吸附需要一定的活化能Ea,只有能量超过Ea的分子 才有可能被吸附,这部分分子在总分子中只占一部分,在 E exp ( 总分子数上应乘上一个因子 RT )
式中 K为催化剂,[AK]、[BK]、[CK]为活化络合物。
(2)对可逆反应,催化剂只能改变达到平衡的时间,不能 改变最终的平衡状态。 化学平衡常数与反应的标准自由焓差之间有如下关系:
G 0 RT ln K P
因催化剂的始终态相同,对状态函数G 0 无影响,故平衡 常数不会因催化剂的存在而改变。催化剂会同等程度的加快正 逆反应的速率。
若吸附组分多于两个,裸露活性点所占的分率为θv=1∑θi 如为非解离性吸附,则不难相应地导出:
i
K i Pi 1 K i Pi
i
V 1 i 1
K i Pi 1 1 K i Pi 1 K i Pi
i i
pM A B L
总结:理想吸附等温式
代入吸附速率的一般式:
0 0 Ea Ed A A ' r ra rd ka0 exp( )PA f ( A ) kd 0 exp( ) f (A ) RT RT RT RT
在中等覆盖度范围内,式中f(θA)的变化对ra的影响比 exp( A ) 小得多, 可将其近似归并到常数项中去。
(2-78)
气固界面反应动力学研究

气固界面反应动力学研究气固界面反应动力学是一门十分重要的学科,它涉及到气体分子与固体物质的相互作用,研究其反应过程和机理,对于工业化生产流程优化、环境保护等方面都有着重要的意义。
气滴反应气滴反应是一种典型的气固界面反应,其研究逐渐受到了越来越多的关注。
在气滴反应过程中,气体中的粒子通过碰撞与固体表面上的原子或分子相互作用,从而引发了反应。
气滴反应的研究可以为解释肺部疾病、氧化燃料电池、超疏水表面制备等领域提供理论基础。
气固界面反应动力学气固界面反应动力学主要涉及到反应速率、反应物吸附、反应机理等方面的研究。
其中,反应速率是一个重要的指标,它决定了反应的进行程度和速度。
反应速率的研究涉及到气体分子与固体表面的相互作用、气体分子的扩散等方面。
同时,反应速率还与反应条件、环境温度等因素密切相关。
反应物吸附也是气固界面反应动力学研究的重要方面。
反应物在气固界面上的吸附过程被认为是反应的第一步。
一些实验结果表明,反应物与固体表面之间的物理吸附和化学吸附会直接影响到反应的进行。
对反应物的有效吸附与化学键形成的研究有助于进一步了解气固界面反应机理。
最近,越来越多的研究集中在气固界面反应的机理和反应路径方面。
这些研究探讨了分子对于不同表面结构的反应性差异,以及反应过程中可能会出现的中间体。
为了更好地理解这些机理和反应路径的研究,可采用计算机模拟的方法与实验相结合,从而获得更为准确和可靠的数据。
总结气固界面反应动力学研究对于理解气体分子与固体表面的相互作用以及气滴反应机理具有重要作用。
反应速率、反应物吸附和反应机理是该研究领域的关键方面,并且计算机模拟与实验相结合可以获得更为准确和可靠的数据。
随着研究的深入,我们相信气固界面反应动力学将为工业化生产以及环境保护等方面提供更为有效的解决方案。
气固反应动力学

气固反应动力学
气固反应动力学是研究气体与固体之间的化学反应速率和反应机理的学科。
在气固反应中,气体分子与固体表面上的活性位点发生反应,产生新的化学物质。
气固反应动力学的研究可以帮助我们了解反应速率与反应条件之间的关系,以及反应机理的细节。
气固反应动力学的研究方法包括实验和理论模拟。
实验可以通过测量反应速率和反应物浓度的变化来研究反应动力学。
理论模拟则可以使用计算化学方法,如密度泛函理论和分子动力学模拟,来模拟反应机理和反应速率。
气固反应动力学在许多领域都有应用,如催化剂设计、环境保护和材料科学等。
例如,在催化剂设计中,研究气固反应动力学可以帮助我们设计更高效的催化剂,提高化学反应的产率和选择性。
在环境保护中,研究气固反应动力学可以帮助我们了解大气污染物的生成和转化机理,从而制定更有效的减排措施。
在材料科学中,研究气固反应动力学可以帮助我们合成新型材料,并控制其结构和性能。
气固相催化反应宏观动力学

第四章气-固相催化反应宏观动力学在多孔催化剂进行的气-固相催化反应由下列几个步骤所组成:①反应物从气相主体扩散到催化剂颗粒的外表面。
②反应物从外表面向催化剂的孔道内部扩散。
③在催化剂内部孔道所组成的那表面上进行催化反应。
④产物从那表面扩散到外表面。
⑤产物从外表面扩散到气流主体。
①、⑤称为外扩散;②、④称为内扩散;③为本征动力学所描述,存在传质、传热现象(传质系数、传热系数),描述以上五个步骤的模型称为宏观动力学模型。
§ 4.1 气-固相催化反应的宏观过程一、气-固相催化反应过程中反应组分的浓度分布以催化活性组分均匀分布的球形催化剂为例,说明催化反应过程中反应物的浓度分布R 0 R死区:可逆反应,催化剂颗粒中反应物可能的最小浓度是颗粒温度夏的平衡浓度 在距中心半径R 处反应物的浓度接近平衡浓度,此时,在半径 R 颗粒内催化反应速率接近 于零,这部分区域称为“死区”。
、内扩散有效固子与总体速率上的催化反应}同时进行,使催化剂内各部分的反映速率并不一致,越接近于外表面,反应物浓 度/,产物浓度\,颗粒处于等温时,越接近于外表面,单位内表面上催化反应速率/, 内扩散有效因子(或内表面利用率):等温催化剂单位时间颗粒中实际反应量与按外表面组分浓度及颗粒内表面积计算的反 应量之比K S 为按单位内表面积计算的催化反应速率常数S 为单位体积催化床中催化剂的内表面积。
定态下,单位时间内催化剂颗粒外表面由扩散作用进入催化剂内部的反应组分量与单位时 间内整个催化剂颗粒中实际反应的组分量相等,所以 即单位时间内从气流主体扩散到催化剂外表面的反应组分量也必等于颗粒内实际反应量, 即:(A )g kG Se (CAg CAS )k S Sif (CAS )C *A ,如果S e-单位体积催化床中颗粒得外表面积K G-外扩散传质系数(A)g-将内、外传递过程影响考虑在内的催化反应总体速率, 若催化反应式一级可逆反应,则f(c A)C A C A§ 4.2催化剂颗粒内气体的扩散一、多孔介质中气体扩散的形式分子扩散: 10纽特逊扩散(Knudsen)10构型扩散a 0.5 ~ 1.0nm与分子大小相当,扩散系数与分子构型有关表面扩散(重点了解分子扩散与纽特逊扩散,简要提及构型扩散与表面扩散)、分子扩散Fick 定律J A D AB d C A d x三、纽特逊扩散直圆孔中Knudsen扩散系数D K可按下式估算:D k a V cm l/s式中a 为孔半径cm V 为平均分子运动速度cm/sR g =8.314KJ/kmol • K , M 为扩散组分的相对分子量 Kg/kmol气体分子的平均自由程 可用下式估算—119.87 X 10 /Pcm式中压力P 的单位为P a一、 催化剂孔内组分的综合扩散系数一般工业催化剂只考虑分子扩散和 Knudsen 扩散,Ni (D)由两者串联而成,Ni (V)为滞流流动 通量,是由催化剂两端存在着相当大的压力差而引起的组分通过多孔粗话机的滞流流动所 形成,一般工业催化剂不予考虑可忽略。
气固相催化反应宏观动力学

气固相催化反应宏观动力学化学反应工程主要研究化学反应器的原理,研究物理因素对化学反应的影响,以研究反应动力学为主要内容,并据此进行工业反应器的设计及放大。
工业中,气固相催化反应十分常见,如SO 2催化氧化、H 2和CO 低压合成甲醇、由乙炔合成醋酸乙烯等,所以气固相催化反应的宏观动力学是教学重点。
但气固相催化反应宏观动力学这部分的知识较难理解,公式复杂,反应速率表达形式多,我们在教学过程中很难理解和掌握。
以下就这部分知识进行说明和分析。
反应动力学有本征动力学和宏观动力学之分。
在气固相催化反应中,反应发生在固体催化剂的内表面,完整的反应步骤有:反应物从气相主体扩散,穿过颗粒外气膜滞流层,达到颗粒外表面;反应物从颗粒外表面沿微孔向颗粒内表面扩散;反应物被催化剂颗粒内表面的活性中心吸附;被吸附的反应物在内表面上发生化学反应;产物由内表面上脱附;产物由微孔内向颗粒外表面扩散;产物由外表面穿过气膜层向气流主体扩散。
因此,完整的反应包含了颗粒外的气相扩散、颗粒内的气相扩散和表面催化反应过程。
而扩散现象的存在必然会对反应速率造成影响。
外扩散是纯传质的物理过程,内扩散与表面催化反应是同时进行的,所有又称“内扩散-反应过程”。
如仅研究表面反应过程,即排除内、外扩散影响下的催化剂表面与所接触的气体间的反应情况的动力学,则为本征动力学。
而将所有扩散影响考虑在内的情况,则为宏观动力学。
宏观反应速率不仅和化学反应本征反应速率有关,而且与过程的扩散速率有关。
如当外扩散为控制步骤时,反应的宏观速率就仅取决于传质扩散速率。
1、反应速率的表达及反应速率常数间的相互关系对气固相催化反应,反应速率的表达可以用体积反应速率、表面积反应速率或质量反应速率,即反应区可以用不同的基准,相应地化学反应速率常数的基准也有很多。
体积反应速率的表达为:dVdF r ii v±= (1)式中反应区体积可以指催化剂颗粒床层的堆体积,或者是床层中催化剂颗粒的体积。
气-固相反应动力学

ra A pA f (A )exp(Ea / RT ), ( A 为A的吸附常数)
ra pA f (A )exp(Ea / RT )
影响化学脱附速率大小的因素有以下两个。
① 化学脱附需要脱附活化能 Ed,只有能量高于Ed的吸附态 分子才能脱附,它们所占百分数为exp(-Ed/RT )。 ② 化学脱附速率与表面覆盖率θA有关,用f ′ (θA )表示, θA 越大,脱附速率越大。
大孔: ra > 25 nm 催化剂内孔径大小不等,而且有一定的分布,用平均孔半径。 平均孔半径的测定:
mg、 S g、 ra、L、 n
内表面积: 孔总容积: 两者相除,得
mg Sg (2 ra L)n
mgVg ( ra 2 L)n
ra 2Vg Sg
(间接可测的量)
2.固体催化剂的活化 (略,自学)
第二章
气-固相催化反应本征及宏观动力学
第一节 催化及固体催化剂
一、催化反应
1.均相催化反应,反应所在场所是反应空间。 催化反应 2.非均相催化反应,反应场所在催化剂表面。
二、固体催化剂
固体催化剂主要是多孔材料,或由多孔材料为载体与担 载在载体表面的活性物质所组成。 工业固体催化剂是由反应和反应器所决定的具有一定形 状的规则颗粒(直径约2 ~ 10 mm) 。催化剂颗粒内有许多孔 径大小不同、分布曲折的孔道,催化剂的活性位置绝对地分 布在催化剂颗粒内的孔道侧壁上(内表面上)。
* bA pA A 覆盖率 A , B 覆盖率 * * 1+bA pA +bB pB
* bB pB B , * * 1+bA pA +bB pB
1 bi pi* , 总空白率 1 i 第i 组分覆盖率 i * 1+ b j p* i 1 1+ b j p j j
化学反应工程气固相催化反应本征动力学

33
同理,对于脱附速率:
rd kd0 exp
Ed0 ln
RT
f '
近似认为f ' 为常数,同时令:
kd
kd0
exp
Ed0 RT
f
'
可得:
rd
kd
exp
RT
ln
34
对于表观吸附速率:
r
ra
rd
ka
exp
RT
ln
pA
kd
exp
RT
ln
吸附达到平衡时,
4
非均相催化反应速率表达
• 对于均相反应,已经定义:
r 1 d
V dt
及 rA
1 V
dnA dt
• 由于气固相催化反应发生在催化剂表面,
而且催化剂的量对于反应的速率起着关键
的作用,因此,反应速率不再由反应体积
来定义,而改由催化剂体积来定义。
5
• 1、以催化剂体积定义反应速率
r
1 VS
d
dt
kmol
如果有多种组分被吸附,则有
B,C,
,等等
D
空位率:
未被覆盖的活性中心数
V
总活性中心数
自然有 n i V 1 i1
20
• 既然吸附过程可以视为化学反应(基元 反应),吸附速率式就可以写成:
ra
ka0
exp
Ea RT
p
AV
作为吸附的逆过程,脱附可以写为:
rd
kd0
exp
Ed RT
Aσσ+σ+ ks Rσ Sσ ks '
• 将被催化剂活性中心吸附的反应物之间 进行的化学反应通常被认为是基元反应, 其速率表达符合质量作用定律。
气固相催化反应动力学

表面反应: A B R S
R的脱附: R R
S的脱附: S S
反应速率即等于A的净吸附速率,而A的吸附速率是与A的分压 及裸露的活性点数成正比例的,脱附速率则与A的覆盖率成正 比,故净吸附速率为
r ra rd k1 p AV k2 A
由于其余各步都达到了平衡状态,故有
i
Ki Pi
1 Ki Pi
i
r
kr KA pAKB pB
kpA pB
1 K A pA K B pB K R pR KS pS 2 1 K A pA K B pB K R pR KS pS 2
式中, k k AK AKB 对于表面覆盖率极低的情况,则
A的吸附: A A
B的吸附: B B
表面反应: A B R S
R的脱附: R R S的脱附: S S
因表面反应速率是与吸附的A与B的量成正比的,故
r rA kr AB
式中kr是表面反应速率常数,将 代入得
(K A pA KB pB KR pR KS pS ) 1 于是反应速率式便简化成于一般均相反应速率式相同的形式了,
r kpA pB
(2)吸附控制
以反应 A B R S 为例,如A的吸附是控制步骤,可设想 其机理步骤如下:
A的吸附: A k1,k2 A B的吸附: B B
1 KRS
pR pS pB
KB pB KR pR KS pS
式中
K k1K A K B k2 K R K S
(3)脱附控制 A R 反应为例,其机理为
A A A R
气固反应动力学

气固反应动力学
在气固反应中,气体和固体通常是非均相的。
因此,反应速率不仅受到化学反应速率的影响,还受到气体和固体之间的传质过程的影响。
这种传质过程包括气体分子的扩散、对流和固体表面的吸附。
气固反应的动力学描述可以使用基于传质控制理论的模型。
该模型假设反应速率受到反应物分子在固体表面的吸附速率和从固体表
面反应出的物质分子的脱附速率的限制。
气固反应动力学也可以通过实验来研究。
通常使用适当的实验装置,如反应器和色谱仪等,来测量反应速率和反应产物的组成。
通过比较实验数据和理论模型预测的数据,可以验证气固反应动力学理论的准确性。
总的来说,气固反应动力学是一个重要的研究领域,其研究结果可以应用于许多实际问题,如催化剂设计、环境保护和能源开发等。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
气 体 边 界 层
生 成 物 层
反 应 界 面
2M+O2=2MO
MCO3=MO+CO2
MO+CO=M+CO2
19
气-固相反应的特征
化学反应
Ⅰ
反应气体传质 生成气体传质
反应气体扩散
Ⅱ
Ⅲ Ⅴ
气体边界层
生成气体扩散
Ⅳ
生成物层 反应界面
金属氧化过程: I - II - III 碳酸盐分解过程: III - IV – V 碳的燃烧过程: I - III – V 氧化物还原过程: I - II - III - IV - V
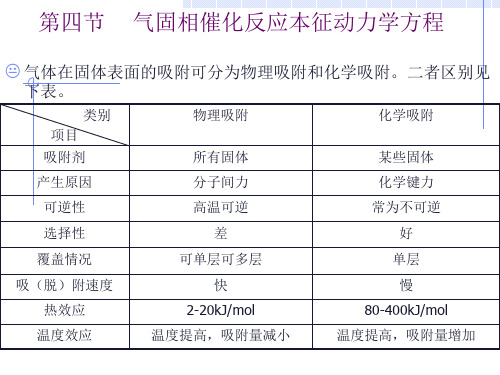
2. 化学吸附特点
A.
B. C.
D.
由固体表面与吸附分子间的化学键力所致,形成吸附化学 键,产生表面活化络合物 多为单分子层吸附,吸附满后不再吸附(即吸附量有上限) 吸附热与化学反应热相当(同一数量级)40-400kJ/mol 温度升高,吸附量增加
注意:1)物理吸附不改变活化能,不是构成化学反应的 主要原因 2)化学吸附因化学键的作用,使被吸附分子发生 变化,更具活性,为反应创造有利条件
A
K A pA 1 K A p A K B pB
raA ka p A (1 A B )
B
i
K B pA 1 K A p A K B pB
K i pi
n
多分子吸附:
1 K i pi
i 1Leabharlann , (i 1,2,..., n)
铁矿石还原反应速度
区别于均相反应和界面反应(吸附和催化反应)
气-固相反应过程
金属氧化反应 碳酸盐分解反应 碳的燃烧反应 反应气体
氧化物还原 反应
O2
CO2
O2
CO2
反 气 生应 体 成界 边 物面 界 层 层
反 应 界 面
气 体 边 界 层 C+O2=CO2
产物气体
CO CO2
反 气 生应 体 成界 边 物面 界 层 层
限制性环节和局部平衡
反应速度的限制性环节
限制性环节的阻力近似等于化学反应
的总阻力,反应过程推动力和限制性环节阻
力之比可近似得出化学反应的速度。
局部平衡
阻力较小的步骤,可以近似认为达到
平衡,相对于真正的热力学平衡这一平衡是 局部平衡。随着化学反应的进行,局部平衡 要发生移动。
准稳态处理方法
一个串联反应进行了一段时间之后,各个步骤的反应 速度经过相互调整,从而达到各个步骤的速度相等。 这时反应中间产物的浓度和各点的浓度均相对稳定, 这一状态称为稳态。
同理,对于第三步有:
r3 k3 pCO2 (1 ) r3 k3 CO2
k 3 pCO2 (1 ) k3
CO
2
1
1 k 3 k1 1 pCO pCO2 k 1 k3
整个还原过程的速度取决于限制性环节即第二步骤的速度。
r2 k2CO k2CO2
先分析界面化学反应的速度规律
用 CO(or H2) 还原铁矿石,界面化学反应可以分为以下步骤:
1. 2.
CO首先在反应界面吸附; 吸附的 CO和铁矿石中的氧发生反应,生成低价氧化铁(或金属
铁)和吸附态的 CO2;
3.
吸附的 CO2脱附。
上面这些步骤都是可逆反应。
实验表明,吸附和脱附的速度比较快,界面化学反应比较慢, 是整个反应的限制性环节。这一机理常称为 LangmuirHinshewood机理。
t
02
k r r0 2D
2 [1 (1 X B )1/ 3 ] 0 [1 (1 X B ) 2 / 3 ]
控制步骤讨论
02 表示气相边界层传质阻力与化 学反应阻力之比
k r r0 2D
2 0
(1)化学动力学控制区:
2 0 0.1
t
B r0
20
碳燃烧反应: A(g) + bB(s) = cC(g)
动力学步骤: (1)气体反应物通过气体 边界层(外传质); (2)界面化学反应; (3) 气体产物通过气体 边界层(外传质)。
21
(1)反应物的外传质
A(g)通过气相边界层速率:
A,i 4ri 2 kdA (c Ab c As ) n
反应速率与r20成反比;扩散活化能为4-20kJ/mol;增加温度对反应 速率的影响不明显,但增加气流速度能显著提高反应速率
如果中间产物浓度和各点浓度的变化所消耗的物质量 比发生反应的物质量小得多时,各个反应步骤的速度 仍近似相等,这样的处理方法又称为准稳态法。
用稳态方法处理时,可以建立一系列方程,联立 方程并消去不能测量的界面浓度项,求出反应速 度的计算公式。
J l kl (C Cs ) 液相边界层的传质流: 1 J g kg ( Ps P) 气相边界层的传质流: RT 界面化学反应为一级可逆反应: r k1Cs k1Ps 达到准稳态时, J l J g r p 反应速度表达式 C k1 K r K 1 1 RT k 1 kl k1 k g K p 表示和气相分压p相平衡的液相浓度 K
整理得
k 1k 2 k 3 k1k 2 p p CO CO2 k k1k 2 k3 r 1 k k 1 1 pCO 3 pCO2 k 1 k3
上式就是还原反应得速度公式。
pCO2 k 2 A pCO K r 1 ApCO BpCO2
分子是实际浓度与平衡浓度之差,推动力 分母是液相、气相边界层的传质阻力和化学反应 的阻力之和,总阻力
固体表面的吸附与表面反应速率
吸附类别:物理吸附和化学吸附 1. 物理吸附特点: A 依靠范德华力(分子间引力),无明显选择性; B 多层吸附 C 吸附热大致与被吸附组分的冷凝潜热相当2-20kJ/mol D 吸附与脱附能快速达到平衡(可逆),吸附量随温度 升高而降低
pCO2 r k 2 A p CO K
在高炉冶炼条件下,还原反应是一级可逆反应。
区域化学反应
由于传质阻力的限制,还原剂的浓度从矿石表面到中心逐渐减少, 从而导致矿石的逐层还原。 Fe(最外层)—FeO—Fe3O4— Fe2O 3(核心未反应部分) 各层之间有明显的界线。还原反应在层与层之间一个很窄的区域 中进行。这样的反应常叫做“区域化学反应”。
设全部能进行吸附的活性中心数为 1,其中吸附 CO的部分数用θCO 表示,吸附 CO2的部分数用θCO2表示。设θ= θ CO+ θ CO2。
第一步的速度为
r1 k1 pCO (1 ) r1 k 1 CO
反应速度快,可以认为达到局部平衡,则
CO
k1 pCO (1 ) k 1
1
冶金反应动力学的处理方法及特点
1.
冶金动力学研究的复杂性
高温多相反应 流体流动状况不了解
2.
1.
化学反应的推动力和阻力
反应体系的实际状态和平衡状态的差距产生了化学反应的 推动力。
2.
过程总阻力与各步骤阻力相关,计算方法与电路中总电阻 的方法相同。
铁矿石还原反应由以下步骤组成:
1.气相中的气体还原剂通过气相扩散边界层,扩散到铁矿石表
dn A 1 1 dnB A B n n dt b b dt 3 2 4ri 4ri dri 1 d (B ) B b dt 3 bdt
B : 摩尔密度(mol / cm 3)
25
整理
4ri dri A B n bdt
2
A n
4r 2c A,b 1 / kdA 1 / k r
A
Kp 1 Kp
ra ka p A (1 A ) 2
ra rd
rd k
2 d A
1 在低压时, A p ;在高压时, (1 A ) p
双分子吸附
ka A A
B B
ka
A的吸附速率: A r k d A A的脱附速率: d A K A p A (1 A B ) A吸附平衡时, ra rd B K B pB (1 A B ) B吸附平衡时,
朗格缪尔吸附模型 ——理想吸附模型/均匀表面吸附模型
1.
2. 3.
4.
基本假定: 固体表面均匀,即整个表面具有均匀的吸 附能力 吸附和脱附活化能与表面吸附的程度无关 单分子层吸附(每个活性中心仅能吸附一 个气体分子) 被吸附分子间没有相互作用
单分子吸附
ka A A
代表活性中心
23
反应过程处于稳态时:
A,r n A,i n A n
k dA c As c A,b k dA k r
A n 4r c A,b
2
kr cAs kdA (cAb cAs )
A,r 4ri kr c As n
2
24
1 / kdA 1 / k r
球形粒子的反应速率
面。这一步骤称为外扩散。
2.气体还原剂通过多孔的还原产物层,扩散到还原反应界面。这 一步骤称为内扩散。在气体还原剂向内扩散的同时,铁离子 也通过固态产物层向内进行扩散。 3.气体还原剂在反应界面进行还原反应。这一步骤又可以分为吸 附过程、吸附的还原剂和晶格中的氧化合、气体还原产物脱 附等步骤。 4.气体还原产物通过多孔的产物层扩散到矿石表面。 5.气体还原产物通过气相边界层扩散到气相内部。
[(1 (1 X B )1/ 3 )
