乙醛的结构与性质学案
初中乙醛的性质教案

初中乙醛的性质教案教学目标:1. 了解乙醛的分子结构和官能团;2. 掌握乙醛的物理性质和化学性质;3. 理解乙醛在有机合成中的应用;4. 培养学生的实验操作能力和观察能力。
教学重点:1. 乙醛的分子结构和官能团;2. 乙醛的物理性质和化学性质;3. 乙醛在有机合成中的应用。
教学难点:1. 乙醛的化学反应机理;2. 乙醛的安全操作注意事项。
教学准备:1. 实验室用具:试管、酒精灯、加热器、导管等;2. 实验试剂:乙醛、乙醇、氯仿、水等;3. 课件和教学素材。
教学过程:一、导入(5分钟)1. 引导学生回顾有机化学的基本概念,如有机化合物、碳氢化合物等;2. 提问:你们知道什么是醛吗?醛有什么特点?二、新课内容(15分钟)1. 介绍乙醛的分子结构和官能团,解释醛基的化学性质;2. 讲解乙醛的物理性质,如无色、具有刺激性气味、低沸点等;3. 讲解乙醛的化学性质,如加成反应、氧化反应等;4. 介绍乙醛在有机合成中的应用,如制取乙酸、丁醇、乙酸乙酯等。
三、实验操作(15分钟)1. 分组进行实验,每组配备相应的实验试剂和用具;2. 引导学生按照实验步骤进行操作,注意安全事项;3. 观察实验现象,记录实验结果。
四、总结与拓展(10分钟)1. 总结乙醛的性质和实验结果;2. 提问:乙醛的化学性质与其他有机化合物有什么不同?为什么?3. 引导学生思考乙醛在现实生活中的应用,如食品添加剂、药物合成等。
五、作业布置(5分钟)1. 请学生根据实验结果,写出乙醛的化学反应方程式;2. 请学生查阅资料,了解乙醛在其他领域的应用。
教学反思:本节课通过讲解和实验操作,使学生了解了乙醛的性质,掌握了乙醛的物理性质和化学性质,以及其在有机合成中的应用。
在实验操作环节,学生能够按照实验步骤进行操作,注意安全事项,培养了学生的实验操作能力和观察能力。
通过本节课的学习,学生对乙醛有了更深入的了解,为后续有机化学的学习打下了基础。
高中化学选修五乙醛教案

高中化学选修五乙醛教案课题:乙醛教学目标:1. 理解乙醛的结构和性质;2. 掌握乙醛的制备方法;3. 了解乙醛的性质及在工业上的应用。
教学重点和难点:1. 乙醛的结构和性质;2. 乙醛的制备方法;3. 乙醛在工业上的应用。
教学准备:1. 乙醛的结构式、制备方法和性质资料;2. 实验室设备和乙烯、高锰酸钾等实验物质;3. 多媒体教学设备。
教学过程:一、引入(5分钟)通过展示乙醛的瓶子和结构式,引导学生思考乙醛的结构特点和应用领域。
二、乙醛的结构和性质(15分钟)1. 介绍乙醛的结构式和命名;2. 讲解乙醛的物理性质和化学性质,如氧化性和还原性。
三、乙醛的制备方法(15分钟)1. 介绍乙醛的几种制备方法,如乙烯氧化和高锰酸钾氧化;2. 解释每种方法的反应机理和条件。
四、乙醛的工业应用(10分钟)1. 简要介绍乙醛在工业上的应用,如合成橡胶、药品、香料等领域;2. 引导学生思考乙醛在工业生产中的重要性。
五、实验操作(20分钟)1. 对乙烯氧化制备乙醛的实验操作;2. 观察实验现象,记录数据并分析结果。
六、总结与讨论(10分钟)1. 总结乙醛的特点及在工业上的应用;2. 讨论乙醛的环境影响和安全注意事项。
七、提高拓展(5分钟)提出拓展问题,引导学生深入学习乙醛的相关知识。
教学反思:通过本节课的教学,学生能够全面了解乙醛的结构、性质、制备方法及工业应用,培养学生的实验操作能力和综合素养。
同时,教师应根据学生的实际情况,灵活调整教学内容和方法,提高教学效果。
第二节 醛 学案

第二节醛学案【自主梳理】一、乙醛1.组成与结构乙醛的分子式结构简式官能团。
2.物理性质乙醛是色、具有气味的液体,密度小于水,沸点为20.8℃。
乙醛易挥发,能与水、乙醇、氯仿等互溶。
3.化学性质(1)加成反应(醛基中的能够发生加成反应)还原反应:在有机化学反应中,常把有机物分子中得或失的反应。
(2)氧化反应:①可燃性:②催化氧化(在醛基中的碳氢之间插入)氧化反应:在有机化学反应中,通常把有机物分子中得或失的反应。
③被弱氧化剂氧化银镜反应方程式:。
与新制氢氧化铜的反应方程式:。
二、醛类1.概念:分子里由烃基与基相连构成的化合物。
2.饱和一元醛的通式3.醛类的化学通性:(1)催化加氢:RCHO十H2(还原反应)也属于加成反应(主要表现在与氢气的催化加成上,亦称为还原反应)(催化剂常用金属镍)【思考】若已知含羰基(—C—)类的有机物也能发生类似的加成反应,试写出:2—甲基丁醛与氢气:(2)氧化反应①催化氧化:RCHO+O2②银镜反应:RCHO+③新制氢氧化铜悬浊液的反应:RCHO++NaOH4.甲醛 (1)结构特点:甲醛的分子式 ,结构简式 ,结构式 。
(2)物理性质:甲醛又叫蚁醛是一种无色具有强烈刺激性气味的 体,易溶于水。
含35%~40%的甲醛水溶液叫 。
甲醛 毒,装饰材料释放出的气体中含有甲醛,要注意安全及环境保护。
5【课堂探究】思考:1、该有机物的分子式为C 2H 4O ,你能写出它所有可能的结构式吗?2、该分子的1H-NMR 谱图如下,你所写的结构式有与它相符合的吗?实验探究1观察乙醛样品、闻味,将其溶解于水等,总结性质。
回忆:请同学们回忆一下,我们以前接触过这种物质吗?写出该反应的化学方程式。
根据乙醛分子结构,推测乙醛可能具有的化学性质。
归纳:乙醛的化学性质1. ,方程式: 思考:有机反应中的氧化反应和还原反应,我们应该怎样判断? 并推测乙醛还可能具有那些化学性质?还原反应 ; 氧化反应 。
(完整版)第二节乙醛学案
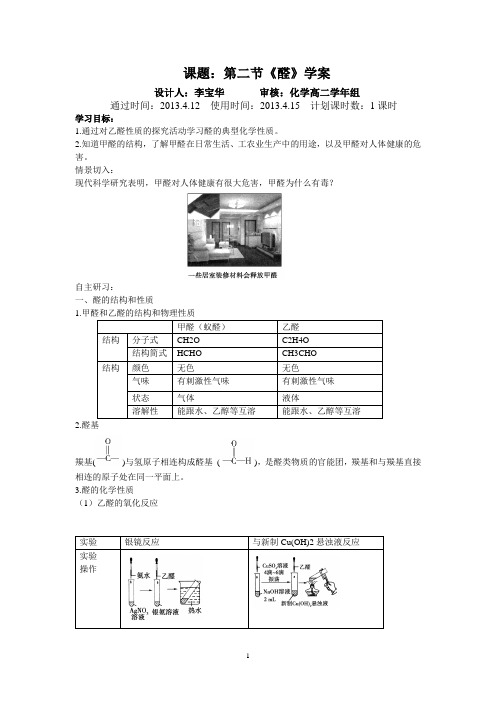
课题:第二节《醛》学案设计人:李宝华审核:化学高二学年组通过时间:2013.4.12 使用时间:2013.4.15 计划课时数:1课时学习目标:1.通过对乙醛性质的探究活动学习醛的典型化学性质。
2.知道甲醛的结构,了解甲醛在日常生活、工农业生产中的用途,以及甲醛对人体健康的危害。
情景切入:现代科学研究表明,甲醛对人体健康有很大危害,甲醛为什么有毒?自主研习:一、醛的结构和性质1.甲醛和乙醛的结构和物理性质甲醛(蚁醛)乙醛结构分子式CH2O C2H4O结构简式HCHO CH3CHO结构颜色无色无色气味有刺激性气味有刺激性气味状态气体液体溶解性能跟水、乙醇等互溶能跟水、乙醇等互溶2.醛基羰基()与氢原子相连构成醛基(),是醛类物质的官能团,羰基和与羰基直接相连的原子处在同一平面上。
3.醛的化学性质(1)乙醛的氧化反应实验银镜反应与新制Cu(OH)2悬浊液反应实验操作实验现象红色沉淀产生方程式CH3CHO+2Ag(NH3)2OH−−−→−水浴加热CH3COONH4+2Ag↓+3NH3+H2O(2)乙醛的还原反应醛基中的碳氧双键可以与氢气发生加成反应,其反应方程式为:RCHO+H2 RCH2OH二、醛的用途1.甲醛俗称蚁醛,35%~40%的甲醛水溶液俗称福尔马林,具有杀菌、消毒、防腐能力。
2.甲醛常用于制造酚醛树脂、脲醛树脂等。
(1)反应物条件催化剂苯酚甲醛沸水浴加热①浓盐酸作催化剂生成线型酚醛树脂。
②氨水作催化剂生成体型酚醛树脂。
(2)思考讨论1.醛基的结构式为,书写结构简式时应注意什么?提示:醛基是羰基与氢原子相连,在写其结构简式时要突出羰基与氢原子的关系,可以写成—CHO,但不能写成—COH或CHO—。
2.乙醛能使溴水或KMnO4酸性溶液褪色吗?为什么?课堂师生互动知识点1醛基与醛的关系以及醛基的性质与检验1.醛基与醛的关系(1)醛基为醛类有机物的官能团,因此醛中一定含醛基,而含醛基的物质不一定是醛。
高中化学 第三章 第二节 醛教案 新人教版选修5

山东省菏泽一中高中化学 第三章 第二节 醛教案 新人教版选修5【教学目标】1.使学生掌握乙醛的结构式,主要性质和用途2.使学生掌握醛基和醛类的概念【教学重点】乙醛的性质和用途【教学过程】一、乙醛1.乙醛的分子组成与结构乙醛的分子式是O H C 42,结构式是,简写为CHO CH 3。
注意 对乙醛的结构简式,醛基要写为—CHO 而不能写成—COH 。
2.乙醛的物理性质乙醛是无色、具有刺激性气味的液体,密度小于水,沸点为C8.20。
乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。
注意 因为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.乙醛的化学性质从结构上乙醛可以看成是甲基与醛基()相连而构成的化合物。
由于醛基比较活泼,乙醛的化学性质主要由醛基决定。
例如,乙醛的加成反应和氧化反应,都发生在醛基上。
(1)乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。
例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气发生加成反应:说明:①在有机化学反应中,常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
乙醛与氢气的加成反应就属于还原反应。
②从乙醛与氢气的加成反应也属于还原反应的实例可知,还原反应的概念的外延应当扩大了。
注:此处可借助flash 帮助学生理解乙醛的加成反应(2)乙醛的氧化反应在有机化学反应中,通常把有机物分子中加入氧原子或失去氢原子的反应叫氧化反应。
乙醛易被氧化,如在一定温度和催化剂存在的条件下,乙醛能被空气中 的氧气氧化成乙酸:注意 ①工业上就是利用这个反应制取乙酸。
②在点燃的条件下,乙醛能在空气或氧气中燃烧。
乙醛完全燃烧的化学方程式为: O H CO O CHO CH 22234452 点燃乙醛不仅能被2O 氧化,还能被弱氧化剂氧化。
【实验3-5】在洁净的试管里加入1 mL 2%的3AgNO 溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(此时得到的溶液叫做银氨溶液)。
高中化学《乙醛的结构与性质》优质课教学设计、教案

第二章官能团与有机化学反应烃的衍生物第三节醛和酮糖类(第一课时)壱、教材分析醛是有机化合物中一类重要的衍生物,由于醛基很活泼,醛可以发生多种化学反应,在有机合成中起着重要作用,是各种含氧衍生物相互转化的中心环节。
《新课标》要求认识醛的代表物的组成和结构特点,醛基的检验,知道烃衍生物之间的转化关系。
乙醛是醛类的代表物。
教材在简单介绍了乙醛的分子结构和物理性质之后,从结构引出乙醛的两个重要化学反应:乙醛的加成反应和乙醛的氧化反应,把乙醛与乙醇联系起来,并结合乙醛的加氢还原,从有机化学的反应特点出发,定义还原反应;通过乙醛的氧化反应,又把乙醛和乙酸联系起来,同时结合乙醛的氧化,给出有机化学中的氧化反应定义。
让学生明确有机与无机中关于氧化还原反应概念的区别。
学好乙醛的性质,明确乙醛和乙醇、乙酸之间的相互转化关系,能更好地掌握醛类及其与醇类、羧酸的关系,建立有机知识网络。
因此本节课在这一章中起着承上启下的作用。
二、学情分析学生对有机物已有了一定的掌握,并且知道了学习有机物该从哪些方面着手,以前对烃的学习已为学习烃的衍生物打下了基础。
在《化学与生活》中已经学习过含醛基的物质—葡萄糖的性质,为乙醛的学习奠定了基础。
在前一课题中对乙醇进行了学习,学生已对烃的衍生物的学习方法已经比较熟悉。
通过对乙醇氧化反应,消去反应的学习,了解了有机物反应中断键的规律。
学生在以前的学习中已经掌握了类比学习的方法。
这些都为乙醛的学习打下了基础。
三、教学目标1、知识与技能(1)了解乙醛的物理性质、组成和结构特点。
(2)根据醛的组成和结构特点,进一步认识加成反应、有机物的氧化反应;(3)能通过实验加深对醛基的检验,并能更好地理解醛的化学性质。
2、过程与方法:学生通过自主学习、探究实验、问题思考等过程,进一步学会学习有机物的方法,建立“结构决定性质,性质决定用途“的学科思想。
3、情感态度价值观:(1)进一步认识结构决定性质的规律,加强实验在化学学习中作用的认识。
乙醛学案教学文档

第三章第二节醛(第1课时)
导学案
——乙醛的性质
一、学习目标
1、掌握乙醛的分子结构
2、通过实验探究,把握乙醛的化学性质,并理解乙醛的结构对其性质的影响
3、知道有机反应中氧化反应和还原反应的判断方法
二、温故知新
1、研究有机化合物的一般步骤和方法
步骤:
方法:
2、取44g某有机物与充足的氧气反应,将生成的气体依次通入无水CaCl2,KOH浓溶液的,两装置分别增重36g、88g,质谱图测得其相对分子质量为44,计算其分子式
2、乙醇的催化氧化:
三、基础梳理
分子式结构式结构简式官能团
颜色状态气味密度沸点溶解性
比水
3、乙醛的化学性质
结构决定性质,你能否根据乙醛的组成和结构猜测乙醛可能
具有哪些性质?
四、实验探究
3、小结:有机反应中氧化反应和还原反应的判断氧化反应:或;
还原反应:或
()
CH
3CH
2
OH CH
3
CHO CH3COOH
( )
()。
新人教版化学选修5高中《醛》学案

新人教版化学选修5高中《醛》学案第二节醛【学习目标】:1.了解乙醛的结构特点2.掌握乙醛的主要化学性质3.了解醛类物质的通性【高效预习】一,乙醛1.组成与结构:分子式为①,结构式为②,结构简式为③或④,乙醛的核磁共振氢谱中,氢原子的种类和数目之比为⑤2.物理性质:乙醛是⑥色,具有⑦的液体,密度比水⑧易⑨,易⑩,能跟⑾、⑿等互溶。
3.化学性质:氧化反应:燃烧:⒀银镜反应:⒁和新制Cu(OH)2反应:⒂加成反应:⒃二.醛类物质1.最简单的一元醛:⒄2.饱和一元醛通式:⒅ t氧化反应⒆,⒇3.化学通性还原反应(21)【典型例题】例1.某学生做乙醛还原性的实验,取l mol/L的硫酸铜溶液2 mL和0.4mol/L的氢氧化钠溶液4 mL,在一支试管里混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无红色沉淀,实验失败的原因是( )A.氧氧化钠的量不够 B.硫酸铜不够量C.乙醛溶液太少 D.加热时间不够例 2.丙烯醛的结构简式为CH2=CH—CH0。
下列关于它的性质叙述错误的是()A.能使溴水褪色,也能使高锰酸钾酸性溶液褪色B.在一定条件下与H2充分反应,生成l一丙醇C.能发生银镜反应表现出氧化性D.一定条件下能被空气氧化【能力提升】1.某种饱和一元醇和某种饱和一元醛的混合物共3 g,跟银氨溶液完全反应后,可还原出16.2 g银,下列说法中正确的是 ( )A.混合物中一定含有甲醛B.混合物中可能含有乙醛C.混合物中醇与醛的质量比为1∶3D.3 g混合物不可能还原出16.2 g银2.香料茉莉酮是一种人工合成的有机化合物,其结构简式如图下列关于茉莉酮的说法正确的是()A.该有机物的化学式为C11H16OB.1 mol该有机物与H2充分反应,消耗H2 4 molC.该有机物属于不饱和酮类物质,不能发生银镜反应D.该有机物能发生加成反应,但不能发生氧化反应【衔接高考】(2002年全国理综)昆虫能分泌信息素,下列是一种信息素的结构简式CH3(CH2)5CH=CH(CH2)9CHO指出该物质中的任意一种官能团,为该官能团提供一种简单的鉴别方法并简述实验现象,写出与鉴别方法有关反应的化学方程式并指出反应类别完成下表(2004年)室内装潢和家具挥发出来的甲醛是室内空气的主要污染物。
乙醛学案

§6—5乙醛醛类(一)一、乙醛的结构与用途
乙醛的分子式:结构式:
结构简式:官能团:
用途:
二、乙醛的物理性质
色:态:味:
溶解性:
其它物理性质:
三、化学性质
1、加成反应
化学方程式:
判断有机物被还原(发生还原反应)的方法:
判断有机物被氧化(发生氧化反应)的方法:
2、氧化反应
(1)燃烧:
(2)催化氧化:
(
课堂练习:
某醛的结构简式为(CH3)2C=CHCH2CH2CHO,检验分子中醛基的方法是
,检验分子中的碳碳双键的方法是,实验操作中应先检验,原因是。
课后思考:
1、常见的能发生连续两步氧化的物质有那些?
2、我们可以通过银镜反应和与新制的氢氧化铜反应来检验醛基的存在,还可以通过这两个反应中醛基与沉淀的物质的量比例关系来测定醛基的数目,醛基与沉淀的物质的量之比为多少?
3、先归纳乙烯、溴乙烷、乙醇、乙醛、乙酸这五种常见有机物的相互转化关系,再完成练习。
有两种有机化合物A和B,分子式分别为C2H6O和C2H4O,已知:①B氧化得C,还原得A;②A能氧化得B,脱水生成烯烃F;③F能跟溴水反应生成D;④D与氢氧化钠的水溶液反应,得到溶于水的产物E。
⑴写出A和B的结构简式;⑵写出上述各反应的化学方程式,并对E命名。
作业:
A层:教材P149页课后习题:二(1、4),四
B层:教材P149页课后习题:二(1、4),四;《三维设计》P52页闯关题组一。
C层:教材P149页课后习题:二(1、4),四;《三维设计》P52页闯关题组一和T6。
高中化学_乙醛的结构与性质教学设计学情分析教材分析课后反思

第二章官能团与有机化学反应烃的衍生物第三节醛和酮糖类(第一课时)一、教材分析醛是有机化合物中一类重要的衍生物,由于醛基很活泼,醛可以发生多种化学反应,在有机合成中起着重要作用,是各种含氧衍生物相互转化的中心环节。
《新课标》要求认识醛的代表物的组成和结构特点,醛基的检验,知道烃衍生物之间的转化关系。
乙醛是醛类的代表物。
教材在简单介绍了乙醛的分子结构和物理性质之后,从结构引出乙醛的两个重要化学反应:乙醛的加成反应和乙醛的氧化反应,把乙醛与乙醇联系起来,并结合乙醛的加氢还原,从有机化学的反应特点出发,定义还原反应;通过乙醛的氧化反应,又把乙醛和乙酸联系起来,同时结合乙醛的氧化,给出有机化学中的氧化反应定义。
让学生明确有机与无机中关于氧化还原反应概念的区别。
学好乙醛的性质,明确乙醛和乙醇、乙酸之间的相互转化关系,能更好地掌握醛类及其与醇类、羧酸的关系,建立有机知识网络。
因此本节课在这一章中起着承上启下的作用。
二、学情分析学生对有机物已有了一定的掌握,并且知道了学习有机物该从哪些方面着手,以前对烃的学习已为学习烃的衍生物打下了基础。
在《化学与生活》中已经学习过含醛基的物质—葡萄糖的性质,为乙醛的学习奠定了基础。
在前一课题中对乙醇进行了学习,学生已对烃的衍生物的学习方法已经比较熟悉。
通过对乙醇氧化反应,消去反应的学习,了解了有机物反应中断键的规律。
学生在以前的学习中已经掌握了类比学习的方法。
这些都为乙醛的学习打下了基础。
三、教学目标1、知识与技能(1)了解乙醛的物理性质、组成和结构特点。
(2)根据醛的组成和结构特点,进一步认识加成反应、有机物的氧化反应;(3)能通过实验加深对醛基的检验,并能更好地理解醛的化学性质。
2、过程与方法:学生通过自主学习、探究实验、问题思考等过程,进一步学会学习有机物的方法,建立“结构决定性质,性质决定用途“的学科思想。
3、情感态度价值观:(1)进一步认识结构决定性质的规律,加强实验在化学学习中作用的认识。
第五节--乙醛(导学案)

课题: 第五节乙醛班级________________ 姓名________________【学习目标】1. 通过观察乙醛样品, 闻乙醛的气味, 阅读教材, 认识乙醛的主要物理性质。
2. 通过观察乙醛的球棍模型, 比例模型, 认识乙醛的结构特点。
3.分析乙醛的结构, 类比烯烃与氢气的反应, 正确书写乙醛与氢气的反应方程式。
通过分析乙醇与乙醛的相互转化, 认识有机反应中的氧化反应和还原反应。
4.通过实验探究, 进一步认识乙醛的氧化反应, 并能正确书写乙醛的催化氧化反应方程式、乙醛的银镜反应方程式、乙醛与新制氢氧化铜悬浊液的反应方程式以及配制银氨溶液的反应方程式。
进一步学习实验操作技能与实验观察方法, 形成团队合作意识及对待科学的严谨态度。
【学习重点】1. 乙醛的氧化反应。
2.实验操作技能, 分析实验现象能力。
【学习难点】乙醛的银镜反应和乙醛与新制Cu(OH)2悬浊液反应的实验探究。
【学习过程】自主学习回忆相关知识, 并填写下列空格。
1._______________________________________________叫加成反应, 乙烯使溴的四氯化碳溶液褪色的化学方程式为_______________________________。
2.乙醇转化为乙醛的化学方程式为_____________________________________, 反应类型为_______________, 从分子组成上分析, 乙醇转化为乙醛, 相当于乙醇失去_______原子转化为乙醛。
3. 向氢氧化钠溶液中滴加硫酸铜溶液的反应方程式为______________________。
4. (查资料完成)向硝酸银溶液中滴加稀氨水所涉及反应的化学方程式为:__________________________________________________________________。
同步学习活动1: 观察乙醛样品, 闻乙醛气味, 阅读教材, 填写下列空格。
教资面试初中化学乙醛教案

教资面试初中化学乙醛教案
教学内容:乙醛
教学对象:初中生
教学目标:学习乙醛的结构、性质和用途,了解乙醛在生活中的应用和意义。
教学重点:乙醛的结构、性质和用途
教学难点:乙醛在生活中的应用和意义
教学准备:乙醛样品、实验器材、教学PPT、教学板书
教学过程:
一、导入(5分钟)
老师向学生介绍乙醛的概念,并展示乙醛的分子结构。
通过提问引导学生思考乙醛在生活中的应用。
二、讲解与示范(15分钟)
1. 讲解乙醛的性质、结构和化学反应。
2. 通过实验演示乙醛的制备方法和性质变化。
3. 引导学生分析乙醛在生活中的应用和意义。
三、实验操作(20分钟)
学生根据老师的指导进行乙醛的实验操作,观察其性质变化并记录实验结果。
四、讨论与总结(10分钟)
学生就实验结果进行讨论,总结乙醛的性质和用途。
老师进一步解释乙醛在实际应用中的重要性,引导学生思考并提出问题。
五、作业布置(5分钟)
布置乙醛相关的练习题,让学生巩固所学知识。
要求学生写一篇小结,总结乙醛的结构、性质和用途,并谈谈乙醛的应用领域。
教学反思:通过本节课的教学,学生能够掌握乙醛的基本知识,理解其在生活中的应用和意义。
教师要注重引导学生思考,培养学生的实验能力和创新思维。
同时,要注重实际应用,让学生认识化学知识的实用性和重要性。
化学选修五第章第二节醛—乙醛学案

化学选修五第三章第二节《醛—乙醛》学案【学习目标】1.把握乙醛的结构和重要性质2.把握有机化学中判定氧化和还原反映的方式3.把握醛基的查验方式【学法指导】注意从官能团的转变分析物质间的转化关系【学习进程】探讨一:取22g该样品在足量氧气中燃烧,将生成的气体依次通过浓硫酸和氢氧化钠的洗气瓶,两装置别离增重18g和44g。
该物质在相同条件下对氢气的相对密度为22。
请求出其分子式,并推测它可能的结构。
未知液体的核磁共振氢谱自主整理:一、乙醛的结构分子式:结构式:结构简式:官能团:二、物理性质知识建构:探讨二:请同窗们从醛基的结构来预测一下乙醛分子中化学键可能的断裂方式,从而可能发生哪些反映?三、化学性质1、加成反映探讨三:乙醛能使KMnO4/H+褪色吗?2、a 、探讨四:P57实验3-6b 、探讨五:P57实验3-5c 、想一想:用葡萄糖代替乙醛做斐林反映的实验也显现了砖红色沉淀,该实验结果可说明什么?小结升华:有机氧化还原反映的特点氧化反映还原反映反馈训练:1、下列混合溶液能够用分液漏斗分离的一组是( )A、乙醛和水B、乙醛和乙醇C、乙醇和水D、苯和水2、下列四种转变有一种与其他三种反映类型不同的是()3、关于丙烯醛(CH2=CHCHO)的化学性质说法中正确的有()A、能使酸性KMnO4褪色B、能发生氧化反映生成酸C、能发生消去反映D、不能发生还原反映继续试探:如何查验其中的醛基和碳碳双键?4、配平下列化学方程式:CH3CHO + KMnO4+ H2SO4==CH3COOH + MnSO4+ K2SO4+ H2O5、以乙烯为原料制取乙酸,写出反映的化学方程式,并注明反映类型。
高中化学《乙醛的结构与性质》优质教学课件设计共26页文档

1、纪律是管理关系的形式。——阿法 纳语言影响 ,而是 让儿童 练习良 好道德 行为, 克服懒 惰、轻 率、不 守纪律 、颓废 等不良 行为。 4、学校没有纪律便如磨房里没有水。 ——夸 美纽斯
5、教导儿童服从真理、服从集体,养 成儿童 自觉的 纪律性 ,这是 儿童道 德教育 最重要 的部分 。—— 陈鹤琴
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
乙醛的结构和性质(教学设计)-2016-2017学年高二化学上册
学习目标。
自主学习【引导学生阅读教材P56~58,完成自主学习内容】一、乙醛的物理性质及其结构1.乙醛的物理性质乙醛是________、具有________气味的液体,密度比水________,沸点低(20.8°C),易挥发,易燃烧,能跟________________等互溶。
2.乙醛的分子结构分子式:________________结构式:________________电子式:________________结构简式:______________官能团的结构简式:________二、乙醛的化学性质1.氧化反应(1)银镜反应【点击观看乙醛的银镜反应】【实验操作】思考,按照老师引导的思路进行阅读,小组内讨论,代表回答。
通过阅读,培养学生的自主学习能力和团队合作精神。
(2)与新制Cu(OH)2的反应【点击观看乙醛与新制氢氧化铜的反应】(3)催化氧化乙醛在有催化剂并加热的条件下,能被氧气氧化为乙酸,反应的化学方程式为:___________________(4)燃烧:反应方程式:____________________2.加成反应乙醛蒸气和H2的混合气体通过热的镍催化剂,发生加成反应的化学方程式为:_______________________________________拓展延伸一、醛基的检验及性质1.醛基的性质醛基可被氧化剂氧化为羧基,也可被H2还原为醇烃基,因此既有还原性,也具有氧化性,可用图示表示如下:根据课堂内容进行知识的提升。
通过对醛基的结构及性质、氧化或还原反应原理的拓展,把2.醛基的检验(1)能和银氨溶液发生银镜反应实验中注意事项:①试管内壁(玻璃)要光滑洁净;②银氨溶液要现用现配;③银氨溶液的制备、乙醛的用量要符合实验说明中的规定;④混合溶液的温度不能太高,受热要均匀,以温水浴加热为宜;⑤在加热过程中,试管不能振荡。
(2)与新制Cu(OH)2反应产生红色沉淀实验中注意事项:①Cu(OH)2要新制;②制备Cu(OH)2是在NaOH溶液中滴加少量CuSO4溶液,应保持碱过量;③反应条件必须是加热煮沸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《乙醛的结构与性质》学案
一、乙醛的组成和结构
1、用结构式写出乙醇在铜存在下催化氧化的方程式:
2、写出乙醛的分子式、结构式、结构简式、电子式。
3、从结构上分析乙醛可能有哪些化学性质。
二、乙醛的物理性质
三、乙醛的化学性质
1、加成反应:(与H
2、HCN加成)
2、氧化反应:
(1)与银氨溶液反应:
A、银氨溶液的配制:
B、银镜反应方程式,:
C、除去银镜的方法:
D、银镜反应的用途:
(2)与新制的氢氧化铜反应:
A:新制氢氧化铜的配制:
B:反应方程式:
C、反应的用途:
四、乙醛的用途
五、有机物中的氧化反应与还原反应
1、氧化反应概念:
2、还原反应概念:
Ex:指出下列反应的反应类型
(1)CH≡CH + H2 →CH2==CH2
(2)2CH3CHOH + O2→CH3CHO + 2H2O
(3)CH3CHO + H2→CH3CH2OH
(4)CH2==CH2+ H2O →CH3CH2OH
(5)C6H5—NO2+ 3 Fe + 6HCl →C6H5—NH2+ 3FeCl2+ 2H2O
六、问题讨论
1、根据乙醛的性质分析,乙醛能否使酸性的高锰酸钾溶液褪色?
2、以丙醛(CH3CH2CHO)为例,写出下列化学方程式。
(1)与氢气加成:
(2)与银氨溶液:
(3)与新制的氢氧化铜:
(4)与HCN加成:
(5)。
