无菌生产概念及非最终灭菌制剂生产和质量控制
无菌生产概念及非最终灭菌制剂生产和质量控制

配制区域的洁净度级别
应单独设置,注意称量区的空气流向,防 止粉尘扩散 应根据产品的特性设定相应的洁净度级别
欧盟无菌药品的GMP附录规定: 原辅料和大多数产品的准备/配制应至少在D 级区进行,以降低尘粒和微生物污染的风险, 适于过滤及灭菌操作 微生物污染风险比较高时,如容易长菌的产品、 配制后要等相当长时间方可灭菌的产品或因故 主要不在密闭容器内进行配制操作的产品,配 制必须在C级环境中进行
5 6
3,520 35,200
10,000
100,000
7
8
352,000
3,520,000
10
100
5
50
• 所有级别均依据生产活动时在邻近暴露物料/物品处测试的数据 • 浮游菌、沉降菌纠偏限度表示建议的环境质量水平。企业也可根据作业或 分析方法的类型确定微生物纠偏措施标准 • 引自Guidance for Industry Sterile Drug Products Produced by Aseptic Processing — Current Good Manufacturing Practice, FDA
原辅料和大多数产品的准备配制应至少在d级区进行以降低尘粒和微生物污染的风险适于过滤及灭菌操作微生物污染风险比较高时如容易长菌的产品配制后要等相当长时间方可灭菌的产品或因故主要不在密闭容器内进行配制操作的产品配制必须在c级环境中进行采用无菌制造工艺时除菌过滤的有菌操作区与无菌操作区未分隔除菌过滤用过滤器通常使用2只串联方式确保过滤的可靠性可能情况下应在紧挨灌装点的位置用除菌过滤器将所有药液特别是大容量注射剂进行除菌过滤采用无菌制造工艺时除菌过滤操作区域不得设在无菌操作区内可通过管道传送滤液完整性试验的合格标准应参照供应商的说明书设定微生物挑战性试验由供应商做以避免污染产品压缩空气或氮气压力表阀门压力表滤芯外壳排污阀阀门亲水滤器起泡点试验水剂产品以产品或水湿润滤膜02参考压力031mpa045参考压力023mpa详见供货商说明书疏水性滤器起泡点60vv异丙醇水溶液6070vv乙醇水溶液压缩空气或氮气阀门压力表滤芯外壳阀门前进流测试仪排污阀前进流试验80起泡点压力下进行详见供货商说明书确定实际生产中如开机前的调试加入无菌原辅材料无菌连接灌装和密封产品污染的概率应综合考虑生产线可能造成污染的各种因素并能对工艺受控的状态做出准确的评估应尽可能模拟实际生产的无菌操作可能时应包括最差条件的相关活动以挑战无菌操作无菌灌装用各类物料器具的准备或灭菌处理未对不同装量不同批量的产品分别进行冻干工艺验证冷冻干燥室的灭菌应使蒸汽在搁板间自由流通欣弗事件的发生2006年7月安徽华源克林霉素磷酸酯葡萄糖注射液不良事件报告81例涉及10个省灭菌条件1007分钟贮存条件阴凉稳定性考察有一批留样的有关物质为79有关物质总杂不得过80灭菌条件100310分钟贮存条件遮光密闭保存有关物质总杂不得过602004年底改为80单杂不得过40贮存条件遮光密闭在阴凉处保存有关物质总杂不得过40单杂不得过25有关物质lvp100mlsvp2ml粉针剂原料药8080404050402525江苏省的一家药厂经试验发现克林霉素磷酸酯水溶液加热到60含量下降86因无法采用灭菌工艺生产该企业最终申报了克林霉素磷酸酯的冻干粉针剂产品研发未考虑灭菌工艺的可行性忽视工艺的可行性盲目跟风报批注射剂用原料药的杂质控制不严忽视产品的安全性中国医药报2007年1月4日a6版辐射灭菌法类别fo值微生物存活概率要点说明过度杀灭法fo12106热稳定性产品以杀灭微生物作为实现无菌的手段残存概率
深度解析《非最终灭菌无菌制剂生产质量技术指导原则》

深度解析《非最终灭菌无菌制剂生产质量技术指导原则》原文为《冻干粉针剂(化学制剂)生产质量技术指导原则》,本人认为对于非最终灭菌的无菌制剂均有指导意义,所以更名如下:红色部分为本人的解读部分,供大家讨论、批评、指正!——————————————————————————————————————————————————————————————————————————————————————————————————非最终灭菌无菌制剂(冻干及粉针等)生产质量技术指导原则为提高冻干粉针剂(化学制剂)风险排查的有效性和针对性,在严格执行GMP的基础上,指导企业排查生产质量风险和开展生产质量研究,建立完善企业内部质量管理制度,制定本指导原则。
冻干粉针剂(化学制剂)的生产必须严格按精心设计并经验证的方案及规程进行,产品的无菌或其它质量特性绝不能只依赖与任何形式的最终处理或成品检验。
本指导原则适合非最终灭菌的无菌制剂。
1.人员培训管理1.1称量、配制、洗灌封、过滤、冻干、无菌和内毒素检验等关键岗位新进人员经GMP知识、岗位操作(特别是进、出无菌区的更衣、无菌操作技术、无菌操作行为规范)等专业培训,并经考核合格和质量管理部门确认后才能上岗。
(入厂安全知识培训、入厂GMP知识培训、微生物知识培训、车间安全操作培训、各种岗位操作SOP培训、洁净区(无菌区)行为规范、无菌更衣、无菌操作等培训、考核、资质确认、上岗证……)1.2企业应定期对上述关键岗位操作人员,组织岗位操作SOP及相关管理制度再培训、再考核。
(资质再确认管理,每年定期进行再培训、再考核和上岗资质确认)1.3冻干粉针剂灌装生产线的员工,应定期参加培养基模拟灌装试验。
灌装生产线的新员工经岗位培训后正式生产第一年,至少有一次参加成功的培养基模拟灌装试验。
(灌装分装生产线每半年一次培养基灌装试验,每个员工至少应参加其中的一次)2. 厂房、设备与设施2.1厂房、设备与设施管理2.1.1厂房和设备设施应在采用经过验证的工艺和规程进行生产操作时,保持持续的验证状态。
无菌药品生产与质量控制

(3)、灭菌方法的选择: 1)灭菌条件121℃,15min湿热灭菌。 2)灭菌F0值≥8min,SAL ≤10-6的湿热灭菌。 3)采用微生物截留过滤器的除菌过滤工艺。 4)采用无菌原料和预先灭菌的包装材料进行无菌配制和 灌装工艺。
无菌药品生产与质量控制
灭菌工艺决策树
无菌药品生产与质量控制
所以,无菌保证水平必须有足够的F0值,控制产品灭菌前的 微生物。 例:假定灭菌开始时产品中的污染微生物总数(N0)为 100cfu/瓶,耐热参数(D)为1min,要达到无菌保证水 平不小于6的标准,灭菌 F0=SAL+lgNO*D=(6+lg100)*1=8min.
同 样 的 产 品 , 在 110℃ 下 灭 菌 , 则 灭 菌 时 间 为 : t=F0/L110=8/0.08=100min。
N 产品内微生物的残留数 N0 灭菌开始时产品内的微生物数 t 累计灭菌时间 k 常数,与微生物的耐热性、灭菌温度有关
无菌药品生产与质量控制
4、微生物的耐热参数 微生物的耐热参数,简称D值,是指在特定灭菌 条件下,使微生物数量下降一个对数单位或杀灭 90%所用的时间(分钟)。
5、灭菌率:表示不同灭菌温度所对应的灭菌效果 的重要函数。 灭菌温度为T℃时的灭菌效果,与121℃下同样灭 菌时间的灭菌效果用下面公式表示 灭菌率L=10(T-121)/Z;
t 灭菌时间
例:110℃灭菌30minF0值计算:110℃的灭菌率为0.08, F0=0.08*30=2.4min,即110℃灭菌30min相当于121℃灭 菌2.4min。
F0值是衡量、区分无菌保证工艺属于最终灭菌工艺还是非 最终灭菌工艺。
无菌药品生产与质量控制
7、无菌保证水平:公式SAL=F0/D-lgN0 药典规定,最终灭菌工艺生产的药品SAL<=10-6,残存 微生物的概率越低,无菌保证的风险越低。
无菌药品生产管理与质量控制

溶剂(注射用水)。
从原辅料中带入(胰岛素,葡萄糖等)。
从容器、用具、管道和装置带入。
制备过程中的污染(操作时间长,装备不密封,人员操作 不当)。
(3)内毒素控制的方法:
来源控制,控制物料、器具存放过程中的条件,减少微生 物滋生。
通过清洗、灭菌降低微生物负荷,减少内毒素生成。
微生物的概率越低,无菌保证的风险越低。
所以,无菌保证水平必须有足够的F0值,控制产品灭菌前的 微生物。
例:假定灭菌开始时产品中的污染微生物总数(N0)为 100cfu/瓶,耐热参数(D)为1min,要达到无菌保证水 平不小于6的标准,灭菌 F0=SAL+lgNO*D=(6+lg100)*1=8min.
4、除菌过滤器的设置
两只串联过滤器第一只为截留药液中的细菌的负载,第 二只接近灌装点,满足无菌保证要求。因分险高的原因, 第二只过滤器完整性测试合格,产品及可放行。看下面
两个图:
5、除菌过滤的法规要求:
《药品生产质量管理规范》2010 修订版:
附录 1:无菌药品
第十章 生产管理
无菌药品生产管理与质量控制
目录
无菌保证与无菌生产 湿热灭菌工艺的管理 除菌过滤工艺 制药用水的管理 GMP检查中存在的问题
无菌保证与无菌生产
一、自然界常见的微生物
种类
基本特点
细菌 真菌 病毒
0.5~5μm , 生 长 态 时 不 耐 热 , 部 分 能 形成耐热芽孢。
5 μm ~50μm,形成芽孢随空气扩散, 不耐热。
灭菌程序由计算机控制完成, 腔体内冷空气排除比较彻 底; 具有灭菌周期短、 效率高等特点。
无菌药品生产过程中的污染与控制

无菌药品生产过程中的污染与控制提纲132一、无菌药品生产简述◆无菌的定义:无菌指没有活的微生物。
◆无菌技术的定义:保持无菌物品、无菌区域不被污染、防止病原微生物侵入人体的一系列操作技术。
◆无菌物品的定义:经过物理或化学方法灭菌后,未被污染的物品的物品。
一、无菌药品生产简述◆无菌药品定义:无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
(2010版GMP无菌药品附录)◆常用的无菌药品一、无菌药品生产简述◆无菌生产工艺的基本特点无菌产品的质量不能完全依赖于对成品的无菌度测试。
◆取样检查不能保证支支的合格◆概率上的“无菌”理论上:无菌=没有任何活的微生物实际上:我们无法证明产品中没有活微生物存在实际我们无法明产品中没有活微物存在◆无法对整批产品进行100%检验一、无菌药品生产简述◆无菌制剂的生产工艺:-采用最终灭菌工艺的为最终灭菌产品;-部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
一、无菌药品生产简述◆最终灭菌与非最终灭菌有着本质的区别◆最终灭菌:◆通常是在高质量的环境条件下进行灌装和密封产品容器。
产品在这类环境下灌装和封口是要最大一、无菌药品生产简述◆非最终灭菌的产品:◆在无菌生产工艺中,药品,容器及密封件首先要分别灭菌,然后把其组装起来。
由于在最终容器的产品不再经过灭菌处理,所以容器灌装及封口要在非常高质量的环境下进行。
无菌生产加工较最终灭菌方法有更多的变数。
◆在无菌组装成最终产品前,保证最终产品的各构成部分一一、无菌药品生产简述◆无菌产品生产涉及的内容示意图最终灭菌硬件厂房设施空调净化系统设备、仪器生产管理制约用水系统工艺用气系统物料无菌转运一、无菌药品生产简述◆控制生产过程中质量风险的目标:◆最终灭菌制剂:-灭菌前控制和最大程度减少产品的生物负荷-无菌保证水平为残存微生物污染概率≤10-6非最终灭菌制剂◆非最终灭菌制剂:一、无菌药品生产简述◆实施GMP管理是无菌药品质量保证的基础◆确保持续稳定地生产出合格的药品–适用于预定用途–符合注册要求–不仅限于质量标准最大限度减少药品生产过程中的风险交叉污染!二、无菌药品生产的污染源◆无菌药品GMP管理的基本原则◆2010版GMP无菌药品附录基本要求:◆第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
最终灭菌无菌药品生产管理与质量控制

微生物知识
微生物按其结构、化学组成及生活习性等分为三大 类:
原核细胞型:细菌、放线菌、支原体、衣原体、立 克次氏体、螺旋体等
真核细胞型:真菌 非细胞型:病毒 噬菌体
真菌和细菌
大小 主要成员 细胞组成
细胞质 成份
繁殖方式
孢子
真菌 5 μm ~ 50 μm
酵母、霉菌
酵母是单细胞,其它为多细胞
105℃灭菌40分钟时,Fo 约为 1分钟,能使D值为1 分钟的芽孢数量下降1个对 数单位
无菌检查的局限性
历史的教训: 1962年,美国FDA颁布第一部GMP 1970-1975年,美国输液污染至败血症400多起 --有问题的产品全部通过了无菌检查
1973年的英国药典和1980年USP增补版提到了无菌 的量化标准
芽孢的特点
耐热 80 ℃下长期存活 100 ℃下有相当高的存活率 100 ℃以上死亡过程符合一级动力学方程
影响芽孢耐热性的因素 芽孢存在的介质 受热时的湿度
无菌的基本概念----什么是无菌
最终灭菌方法生产的无菌药品概述
什么是无菌? “无菌”的理论定义 ������ 完全无生物存在 ������ 绝对条件 “无菌”的实际定义 ������ 经生长和繁殖证明无生物 ������ 普遍接受的标准是,灭菌后,最终灭菌注射剂或其它关
最终灭菌无菌药品生 产管理与质量控制
蚌埠市食品药品监督管理局 宫文武
一、微生物知识----什么是微生物 二、无菌的基本概念----什么是无菌 三、无菌保证要素----如何实现产品无菌
微生物知识----什么是细菌
微生物知识
什么是微生物 微生物(microorganism, microbe)是一些肉眼看
最终灭菌与非最终灭菌的区别

无菌药品的普遍定义是要求没有活体微生物的存在,为了达到产品中没有活体微生物,无菌药品在制造过程中需要采取各种方法来去除制品中原有的微生物和防止制品受到微生物的污染[1]。
有许多方法可以用来控制微生物的生长、杀灭或去除微生物,通常在药品制造工艺过程中把这些方法分成化学和物理两大类。
其中,化学方法有化学消毒剂、气化双氧水、臭氧和环氧乙烷等;物理方法有湿热或干热灭菌、辐射灭菌和过滤除菌等。
在无菌药品的生产中,灭菌温度、灭菌时间、灭菌设施等诸多环节与药品质量和用药安全息息相关。
“欣弗”事件的主要原因是该公司在药品生产过程中的违规操作,即该公司未按批准的工艺参数灭菌,降低灭菌温度,缩短灭菌时间,增加灭菌柜装载量,影响了灭菌效果。
本文就如何合理选择灭菌方法,如何保证灭菌稳定、可靠,同时又不危害自然环境进行了阐述。
1 最终及非最终灭菌制剂产品的生产要求无菌药品的生产分为最终灭菌和非最终灭菌两种类型。
如无菌冻干粉针剂等制剂就属于非最终灭菌类型,在生产过程中需采用无菌作业以确保成品的无菌状态。
1.1 最终灭菌产品在最终灭菌注射剂(如大输液等)的生产过程中,配液、灌装可在非无菌环境中生产,而产品灌装后最终需通过灭菌措施达到灭菌要求。
比如,最终灭菌的容量为5OⅡlL以上的大容量注射剂由于直接输入血液,因此在其生产的全过程中应采取各种技术措施防止微粒、微生物、内毒素污染,以保证人体用药安全。
在药液配制过程中,应根据具体产品的要求,设臵0.22~O.45 Il m的微孔滤膜过滤器对药液进行过滤,以降低药液中微生物、微粒的污染。
大输液所用包装容器,即玻璃瓶和胶塞应按规定进行清洗,包括粗洗、精洗等。
大输液的灭菌是在灌装后进行的,玻璃瓶经灌装、扎盖后,由专用小车运至双扉式灭菌柜。
灭菌设施一般可用水浴式灭菌器,以过热水为灭菌介质,采用水喷淋方式对灌装后药品加热升温和灭菌,灭菌后以循环水冷却。
大输液的灭菌一般应按配液批号进行安排,同一批号需要多个灭菌柜时,应编制亚批号。
非最终灭菌无菌药品(化学制剂)生产质量技术指导原则
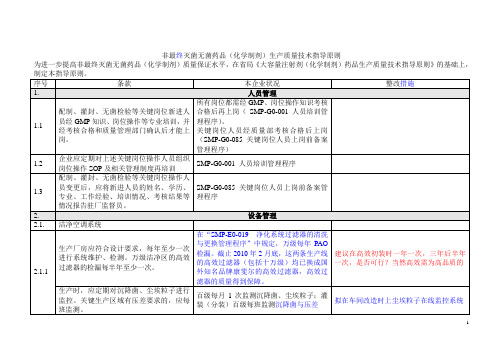
3.1.2
原辅料的内控质量标准中应包括微生物限度、热原或细菌内毒性指标。
有相关规定
3.1.3
应对原辅料质量进行质量回顾分析,以评估其质量稳定性、可控性,制定合理的内控质量标准。稳定性差的产品,内控质量标准的相关项目应高于国家标准,并设定相应的警戒值。
每年回顾分析,均有内控标准。
制剂生产部水系统采用蒸气消毒,对压力温度等有相关规定,消毒前对管路排空有确认。
2.2.5
应定期对注射用水管路进行检漏试验。
安装完毕时做过,以后未进行
修订《注射用水系统标准操作及维护保养程序》规定大修期间每年检漏一次
2.2.6
工艺用水系统应按规定定期维护,保养即处理,呼吸器的材质应为疏水性材质,定期进行完整性检查;注射用水储罐上的呼吸器应采取必要措施,如对呼吸器加热或将冷凝水排空,防止温差产生的冷凝水的蓄积,造成微生物滋生。
培养基模拟试验应模拟最差条件,如装量最大、灌装速度最慢、人员最多、时间长于正常生产的时间等等,同时应模拟药品生产的全过程,如冻干粉针剂应包括冻干工序的上料、下料以及轧盖过程等。
实际操作按产品最大装量、灌装速度最慢、人员最多、时间长于正常生产的时间,冻干粉针剂已包括冻干工序的上料、下料以及轧盖过程。
4.4
修改“SMP-D0-006质量内控标准和检验操作程序的制订与执行”,加入稳定性差的产品,除内控质量标准高于国家标准,还应设定相应的警戒值。
3.1.4
辅料必要时应进行精制(精制工艺应经验证),并制定相应精制方法、内控质量标准。
无需要精制的辅料
3.1.5
无菌粉针用原料药经取样后,应采取有效措施,避免污染。
按规定执行
2.5.2
无菌药品生产与质量控制

(1)、细菌内毒素和热原的概念:热原的污染是注射用 原料及制剂生产普遍存在的问题,污染可能来源于原料、 水、试剂、车间环境、设备等。含有热原的药品进入人体 后,会使人体发冷、寒战、体温升高、出汗、恶心呕吐等 不良反应。严重着出现昏迷、虚脱甚至生命危险。引起热 原反应的主要是革兰氏阴性菌细胞壁中降解的脂多糖,也 称细菌内毒素。
无菌药品生产管理与质量控制
2014年10月20
目录
无菌保证与无菌生产 湿热灭菌工艺的管理 除菌过滤工艺 制药用水的管理 GMP检查中存在的问题
无菌保证与无菌生产
一、自然界常见的微生物
二、微生物分布特点
1、微生物无处不在。
2、气源性微生物革兰氏阳性菌较多:它们可形成芽孢, 难以杀灭。因此,需要洁净的环境。可以通过氧化(消毒 )方法除去。
4、湿热灭菌的特点:
蒸汽有利于蛋白质的变性和酶的失活,从而杀死细胞。
蒸汽热穿透性强。
灭菌效率高:温度相对较低,灭菌时间相对较短。
灭菌过程不产生任何化学物理污染:释放热量,凝结成水 。
灭菌过程控制参数少(时间、温度及压力),运行稳定, 方便管理。
5、湿热灭菌过程需注意的事项
(1)、应当定期对灭菌柜腔室做检漏测试(灭菌过程 需抽真空)。
通过干热去除或者其他手段对已存在的内毒素进行破坏和 去除。
(4)、内毒素的去除方法: 加热法。 酸碱法(玻璃容器)。 蒸馏法(注射用水)。 活性炭吸附。 超滤(中药注射剂)。 离子交换法(缓冲液)。
4、芽孢:当目些细菌遇到不良生存环境时,为保护自身 ,在细胞内形成一个壁厚而坚硬的休眠体,该休眠体及称 芽孢或者孢子。
最终灭菌与非最终灭菌的区别

无菌药品的普遍定义是要求没有活体微生物的存在,为了达到产品中没有活体微生物,无菌药品在制造过程中需要采取各种方法来去除制品中原有的微生物和防止制品受到微生物的污染[1]。
有许多方法可以用来控制微生物的生长、杀灭或去除微生物,通常在药品制造工艺过程中把这些方法分成化学和物理两大类。
其中,化学方法有化学消毒剂、气化双氧水、臭氧和环氧乙烷等;物理方法有湿热或干热灭菌、辐射灭菌和过滤除菌等。
在无菌药品的生产中,灭菌温度、灭菌时间、灭菌设施等诸多环节与药品质量和用药安全息息相关。
“欣弗”事件的主要原因是该公司在药品生产过程中的违规操作,即该公司未按批准的工艺参数灭菌,降低灭菌温度,缩短灭菌时间,增加灭菌柜装载量,影响了灭菌效果。
本文就如何合理选择灭菌方法,如何保证灭菌稳定、可靠,同时又不危害自然环境进行了阐述。
1 最终及非最终灭菌制剂产品的生产要求无菌药品的生产分为最终灭菌和非最终灭菌两种类型。
如无菌冻干粉针剂等制剂就属于非最终灭菌类型,在生产过程中需采用无菌作业以确保成品的无菌状态。
1.1 最终灭菌产品在最终灭菌注射剂(如大输液等)的生产过程中,配液、灌装可在非无菌环境中生产,而产品灌装后最终需通过灭菌措施达到灭菌要求。
比如,最终灭菌的容量为5OⅡlL以上的大容量注射剂由于直接输入血液,因此在其生产的全过程中应采取各种技术措施防止微粒、微生物、内毒素污染,以保证人体用药安全。
在药液配制过程中,应根据具体产品的要求,设置0.22~O.45 Il m的微孔滤膜过滤器对药液进行过滤,以降低药液中微生物、微粒的污染。
大输液所用包装容器,即玻璃瓶和胶塞应按规定进行清洗,包括粗洗、精洗等。
大输液的灭菌是在灌装后进行的,玻璃瓶经灌装、扎盖后,由专用小车运至双扉式灭菌柜。
灭菌设施一般可用水浴式灭菌器,以过热水为灭菌介质,采用水喷淋方式对灌装后药品加热升温和灭菌,灭菌后以循环水冷却。
大输液的灭菌一般应按配液批号进行安排,同一批号需要多个灭菌柜时,应编制亚批号。
最终灭菌与非最终灭菌的区别

无菌药品的普遍定义是要求没有活体微生物的存在,为了达到产品中没有活体微生物,无菌药品在制造过程中需要采取各种方法来去除制品中原有的微生物和防止制品受到微生物的污染[1]。
有许多方法可以用来控制微生物的生长、杀灭或去除微生物,通常在药品制造工艺过程中把这些方法分成化学和物理两大类。
其中,化学方法有化学消毒剂、气化双氧水、臭氧和环氧乙烷等;物理方法有湿热或干热灭菌、辐射灭菌和过滤除菌等。
在无菌药品的生产中,灭菌温度、灭菌时间、灭菌设施等诸多环节与药品质量和用药安全息息相关。
“欣弗”事件的主要原因是该公司在药品生产过程中的违规操作,即该公司未按批准的工艺参数灭菌,降低灭菌温度,缩短灭菌时间,增加灭菌柜装载量,影响了灭菌效果。
本文就如何合理选择灭菌方法,如何保证灭菌稳定、可靠,同时又不危害自然环境进行了阐述。
1 最终及非最终灭菌制剂产品的生产要求无菌药品的生产分为最终灭菌和非最终灭菌两种类型。
如无菌冻干粉针剂等制剂就属于非最终灭菌类型,在生产过程中需采用无菌作业以确保成品的无菌状态。
1.1 最终灭菌产品在最终灭菌注射剂(如大输液等)的生产过程中,配液、灌装可在非无菌环境中生产,而产品灌装后最终需通过灭菌措施达到灭菌要求。
比如,最终灭菌的容量为5OⅡlL以上的大容量注射剂由于直接输入血液,因此在其生产的全过程中应采取各种技术措施防止微粒、微生物、内毒素污染,以保证人体用药安全。
在药液配制过程中,应根据具体产品的要求,设置0.22~O.45 Il m的微孔滤膜过滤器对药液进行过滤,以降低药液中微生物、微粒的污染。
大输液所用包装容器,即玻璃瓶和胶塞应按规定进行清洗,包括粗洗、精洗等。
大输液的灭菌是在灌装后进行的,玻璃瓶经灌装、扎盖后,由专用小车运至双扉式灭菌柜。
灭菌设施一般可用水浴式灭菌器,以过热水为灭菌介质,采用水喷淋方式对灌装后药品加热升温和灭菌,灭菌后以循环水冷却。
大输液的灭菌一般应按配液批号进行安排,同一批号需要多个灭菌柜时,应编制亚批号。
无菌生产概念及非最终灭菌制剂生产和质量控制133页PPT

ห้องสมุดไป่ตู้ 1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、有勇气承担命运这才是英雄好汉。——黑塞 4、与肝胆人共事,无字句处读书。——周恩来 5、阅读使人充实,会谈使人敏捷,写作使人精确。——培根
无菌生产概念及非最终灭菌 制剂生产和质量控制
26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国 GMP(1998 修订)
洁净 级别 尘粒数 / 立方米
≥ 0.5μm ≥ 5μm
微生物最大允许数
浮游菌 CFU /立方米
沉降菌 CFU/皿 (Ф 90 mm 半 小 时 )
100
10 000
3 500
350 000
0
2 000 20 000 60 000
5
100 500 1000
1
3 10 15
无菌生产概念及非最终灭菌注射剂 生产和质量控制
上海市食品药品监督管理局认证审评中心 张 华 2007年9月
无菌生产概念及非最终灭菌注射剂 生产和质量控制
无菌药品的高风险分析 厂房设计、洁净度级别和环境控制 设备 生产工艺
配制 过滤 无菌灌装
冻干 从“欣弗”事件谈灭菌工 艺
配制区域的洁净度级别
应单独设置,注意称量区的空气流向,防 止粉尘扩散 应根据产品的特性设定相应的洁净度级别
欧盟无菌药品的GMP附录规定: 原辅料和大多数产品的准备/配制应至少在D 级区进行,以降低尘粒和微生物污染的风险, 适于过滤及灭菌操作 微生物污染风险比较高时,如容易长菌的产品、 配制后要等相当长时间方可灭菌的产品或因故 主要不在密闭容器内进行配制操作的产品,配 制必须在C级环境中进行
防止微生物污染 防止热原或细菌内毒素的污染 防止产品中有异物 装量准确
厂房设计、洁净度级别 和环境监控
国内企业常见缺陷
采用无菌工艺制造的洁净区内,无菌的操 作区与有菌的操作区未完全分开 冻干灌装区所用工器具灭菌后,经事实上 的非无菌区进入无菌区,带来微生物污染 风险 无菌区设水池及洁具间,或设地漏 无菌区设单独的废物区 洁净区压差监控不到位
生产工艺
生产工艺
配制 过滤 无菌灌装
冻干
从“欣弗”事件谈灭菌工艺
无菌药品生产管理的要点
生产加工的每 个阶段(包括 灭菌前的各阶 段)都必须采 取预防措施, 以尽可业常见缺陷
提高称量配制区域的洁净度级别,使其与灌装 区域一致,共用同一洁净区的更衣设施、走廊 和HVAC系统 称量操作位置的正上方安装高效空气层流 不注意物料称量的先后顺序 整包装的物料不称量即投料 不按照规定的处方配制 称量记录不完整 操作区域受到活性炭污染
无要求
洁净区压差控制要求比较
WHO
不同级别 相邻房间 的压差 10-15Pa
美国
10-15Pa
欧盟
10-15Pa
中国
> 5Pa
洁净区过滤 空气的送风 应能确保在 任何运行状 态下对周围 其它压差 低级别区保 持正压及气 流方向,并 有足够的自 净能力
无菌操作间 对相邻非洁 净区操作间 应始终保持 正压(如至 少12.5Pa)
应设送风故障报警系 统; 关键操作区 压差十分重要的毗邻 的压差 级别区之间应安装压 差表并定期记录压差
无要求
关键操作区气流方向示例一
10000级 100级
SCIP
M
直接包材 接触部
灭菌
M
关键操作区气流方向示例二
关键点
Grade”B”
0.45±20% m/s
SCIP
Grade”A”
M 直接包材 接触部 灭菌
过滤
国内企业常见缺陷
过滤器的安装位置远离灌装点 采用无菌制造工艺时,除菌过滤的有菌操作区 与无菌操作区未分隔 未记录所用过滤器的型号、来源、批号 不做过滤器的完整性试验 过滤器完整性试验的合格标准设定不正确 过滤后的溶液存放在开口的容器中
5 6
3,520 35,200
10,000
100,000
7
8
352,000
3,520,000
10
100
5
50
• 所有级别均依据生产活动时在邻近暴露物料/物品处测试的数据 • 浮游菌、沉降菌纠偏限度表示建议的环境质量水平。企业也可根据作业或 分析方法的类型确定微生物纠偏措施标准 • 引自Guidance for Industry Sterile Drug Products Produced by Aseptic Processing — Current Good Manufacturing Practice, FDA
洁净区过滤 空气的送风 应能确保在 任何运行状 洁净区与室 态下对周围 外大气的静 低级别区保 压差> 10Pa 持正压及气 流方向,并 有足够的自 净能力
洁净区环境监控要求比较
WHO
关键操作区 为控制各级别的洁净 区操作时的尘粒数, 的尘粒 应对尘粒进行监测
无菌操作时,应频繁 对微生物进行动态监 测; 关键操作结束后,应 关键操作区 对表面和人员的微生 的微生物 物进行监测; 应制定微生物监控的 警戒和纠偏标准,以 监控空气质量的趋势
目检与包装
洁净度级别比较
WHO A B C D 美国 M3.5 M3.5 M4.5 M6.5 美国 100 100 10 000 100 000 ISO/TC
(209)
EEC
(GMP)
(GMP) (209E) (习惯分类)
ISO 5 ISO 5 ISO 7 ISO 8
A B C D
WHO GMP 2002 标准
穿无 菌服 缓冲
缓冲
胶塞存放
穿洁 净衣
缓冲
铝盖 存放
缓冲
穿洁 穿洁 净衣 净衣 脱衣 脱衣
前室 电 控 不合 格品
洗瓶间
无菌分装
传递窗
扎盖间
灯检
缓冲 洗瓶机 隧道式干热灭菌器 缓冲 走廊 缓冲 缓冲
缓冲
无菌操作区布局示例图二
图例 10 000 LAF 层流 人流 100 物流 配制
预留部分 技术夹层、CIP、SIP管
M
操作者不能进 入Grade”A”区 域。
厂房的检查要点
厂房布局和建造 洁净度级别的标准 关键操作区的空气流向 洁净区的压差 洁净区的清洁和消毒 环境监控 HVAC系统的维护和监控
设 备
国内企业常见缺陷
储存除菌过滤后药液的高位槽呼吸口未安装呼吸器 与药品直接接触的压缩空气、惰性气体未确认是否 符合生产要求 灭菌和冻干设备管理不到位
采用最终灭菌工艺生产的灌装间倒压差
厂房有重大变更,不做确认和验证
无菌操作区布局示例图一
走廊 废物间 脱包 冻干机房 工长室 暂存 配 液 间 小机修 零备件 缓冲 车间化验 药液灌装间 滤过间 粉针容器消毒 冻干物料进口 原料 暂存 废物 暂存 洁具间 清洁灭菌 缓冲 胶塞 清洁 灭菌 二更 脱外衣 女穿衣 器具存放间 原料 拆包 洁具间 更鞋 缓冲间 铝盖 灭菌 女更外 铝盖 拆包
<3 5 50 100
<3 5 25 50
<3 5 - -
注:沉降碟的暴露时间,一般4小时,我国为0.5小时 引自WHO技术报告902,2002
浮游菌采样仪
MERCK MAS-100
Millipore
FDA对洁净区划分的标准-2004
洁净区级别 (0.5μm 尘粒数/立 方英尺) 100 1000 ISO 名称 0.5 μm 尘粒数/立方米 浮游菌 纠偏限度 (cfu/m3 ) 1 7 沉降菌 纠偏限度 (φ90mm; cfu/4h) 1 3
要求与血液相等或接近(血液pH7.4)
必要的物理和化学稳定性,以确保产品在 储存期内安全有效 降压物质
有些注射液,如复方氨基酸注射液,其降压物质 必须符合规定,确保安全
注射剂生产的风险分析
内源性的影响因素
系统 设备 工艺过程 物料和中间体的质量 人员
外源性的影响因素
无菌药品生产的管理要点
称量
必须按照注册批准的处方配料 称量中应特别注意防止交叉污染
一次称量一种物料 通常先称量辅料,后称量原料药 活性炭应在单独区域中称量,称量后放在水溶 液中
衡器
使用前应检查校准
最好采用客观的记录 如实记录衡器的读数 复核
称量记录
配制工序的检查要点
操作区的设置和洁净度级别 配料处方 称量操作 称量记录 防止污染和交叉污染的措施
共用设备应有防止交叉污染的措施
设备应在确认的范围内使用
密闭系统示例
生产用隔离器示例一
生产用隔离器示例二
生产用隔离器示例三
国内企业常见缺陷
注射用水和纯化水标准不符合药典标准
工艺用水未做微生物限度的检测
注射用水和纯化水的微生物限度检查未采 用薄膜过滤法 注射用水循环系统温度检测点安装位置不 合理,不能反映系统保持65℃以上循环 未监测注射用水关键使用点的细菌内毒素
无菌检查 从“齐二药”事件谈物料和中间体质量控 制 人员监控
无菌药品的高风险分析
注射剂的特点
药效迅速、作用可靠 可用于不宜口服给药的患者 可用于不宜口服的药物 发挥局部定位作用 注射给药不方便且注射时疼痛
直接入血制剂,质量要求比其他剂型更严格,使 用不当更易发生危险
制造过程复杂,生产费用较大,价格较高
注:新标准分为动态及静态,差一个级别;A级没有要求连续微粒测试 引自WHO技术报告902,2002
WHO GMP 2002 微生物指标
级别 空气样 CFU/m3 沉降碟 (90mm) CFU/4小时 接触碟 (55mm) CFU/碟 5指手套 CFU/手套
