物质的量课件
合集下载
必修一物质的量PPT课件
1.992643×10-26千克
阿伏加德罗常数:符号为NA ≈6.02×1023
此数据亦称为阿伏加德罗常数
.
5
【课堂练习】
1、判断正误,并说明理由。
A、1mol氢 错误。没有指出是分子、原子或离子
B、1mol CO2 正确。
C、 1mol大米
错误。大米不是微观粒子
注 意
必须指明粒子的种类,如原子、分子、离子等。
(4)1mol H2O约含有 6.02×1023 个 H2O,其中 含有 1.204×10个24 氢原子和 6.02×1023 个 氧原子。
(5)0.5mol CuCl2 含有 3.01×1023 个Cu2+离
子和 6.02×1023 . 个Cl-离子。
9
摩尔质量
(符号: M )
1.定义: 每摩尔物质的质量 相对原子质量:H:1 C:12 O:16
② 水的式量是___1,8摩尔质量是______;
18g/mol
2mol的水是36克;90.g水是_91_08__=_5mol
14
物质的量(n)与物质的质量(m) 之间的 关系:
物质的量 (n)
×M ÷M
物质的质量 (m)
m = n × M(克)
n = m ÷ M(mol)
.
15
议一议
相对原子质量:H:1 C:12 O:16 S:32
坎德拉
cd
.
3
物质的量
1、表示一定数目粒子的集合体。(分子、原子、离子、质子、中子、电子等)
符号:__n__ 2、单位名称:_摩__尔____ 符号:_m__o_l_
(来源于拉丁文“moles”,表示大量和堆量的意思,是含有
课件《物质的量》PPT_完美课件_人教版1

溶液体积
nB: mol V: L
CB: mol/L
第4 页
溶质不是1mol
× 例 判断下列说法是否正确:
1、将1gNaCl溶于水制不成是11LL溶溶液液,则c=1mol/L
2、将1molNaCl溶于1L水中,则c=1mol/L
×
3 、 若从1L 1 mol/L的NaOH溶液中取出20mL,则取出的NaOH溶液
课堂感悟
课堂巩固 1 、 300mL 某 浓 度 的 NaOH 溶 液 中 含 有 60g 溶 质 。 现 要 配 制 1 mol/L
NaOH溶液,应取原溶液与蒸馏水的体积比约为( A ) A. 1∶4 B. 1∶5 C. 2∶1 D. 2∶3 c(NaOH) = (60g÷40g·mol-1)÷0.3 = 5mol·L-1
个数 5mol·L-1×300mL = 1mol·L-1×(300mL+V水)
若由液体配制溶液所需主要仪器
第6 页
二、溶液中微粒的物质的量浓度
第7 页
[练习] 下列各溶液中 1、0.8L 0.4mol/L的NaOH溶液中C(Na+) 2、2L 0.15mol/L的Na3PO4溶液中C(Na+) 3、0.1mol/L Al2(SO4)3中Al3+的物质的量浓度为 4、已知2LAl2(SO4)3溶液中,Al3+为9.03x1023个,则SO42-的物质 的量浓度为
④读数时 ,应平视,使溶液的凹液面正好与刻度相切;不能 作反应容器,不能长期存放溶液,只能用作配制的量具。移 动容量瓶,应手握刻度线以上部分。
三、物质的量在化学实验中的应用
[随堂练习]
容量瓶需标有:
(1)温度
(2)浓度
(3)容积
物质的量ppt课件

1.定义:表示含有一定数目粒子的集合体,是国际单位制七个 基本物理量之一。 2.符号:n
3.单位: 摩尔( mol),简称摩
4.描述对象:微观粒子或结构
01
物质的量
一、物质的量
01
物质的量
一、物质的量
注意:
①物质的量是一个基本物理量,是专有名词,四个字不可拆分、 省略。
②物质的量只能用来描述微观粒子或结构,不能用来描述宏观物 质。
32
2.991×10-23g 18.006g
18
02
摩尔质量
一、摩尔质量
1.定义:单位物质的量的物质所具有的质量叫做摩尔质量。
2.符号:M
3.单位:g/mol(或g·mol-1)
4.数值:数值上等于相应物质的相对化学式量(相对原子质量、 相对分子质量等)
02
摩尔质量
一、摩尔质量
4.换算关系:
例6:36g葡萄糖(C6H12O6)的物质的量为_0_._2_mol,其中含C_1_.2_mol, 含H_2_._4_mol,含O_1_.2_mol。
PART 02
02
摩尔质量
我们已经学习了物质的量和阿伏伽德罗常数,那么1mol粒子所 具有的质量是多少呢?
粒子 Fe原子 O2分子 H2O分子
物质的量 1mol 1mol 1mol
粒子数 NA NA NA
单个粒子质量 物质的质量 相对化学式量
9.288×10-23g 55.91g
56
5.314×10-23g 31.99g
01
物质的量
一、物质的量
生活中:
一双筷子═2根筷子 一打鸡蛋═12个鸡蛋
那么1mol粒子到底是多少个粒子呢?
01
3.单位: 摩尔( mol),简称摩
4.描述对象:微观粒子或结构
01
物质的量
一、物质的量
01
物质的量
一、物质的量
注意:
①物质的量是一个基本物理量,是专有名词,四个字不可拆分、 省略。
②物质的量只能用来描述微观粒子或结构,不能用来描述宏观物 质。
32
2.991×10-23g 18.006g
18
02
摩尔质量
一、摩尔质量
1.定义:单位物质的量的物质所具有的质量叫做摩尔质量。
2.符号:M
3.单位:g/mol(或g·mol-1)
4.数值:数值上等于相应物质的相对化学式量(相对原子质量、 相对分子质量等)
02
摩尔质量
一、摩尔质量
4.换算关系:
例6:36g葡萄糖(C6H12O6)的物质的量为_0_._2_mol,其中含C_1_.2_mol, 含H_2_._4_mol,含O_1_.2_mol。
PART 02
02
摩尔质量
我们已经学习了物质的量和阿伏伽德罗常数,那么1mol粒子所 具有的质量是多少呢?
粒子 Fe原子 O2分子 H2O分子
物质的量 1mol 1mol 1mol
粒子数 NA NA NA
单个粒子质量 物质的质量 相对化学式量
9.288×10-23g 55.91g
56
5.314×10-23g 31.99g
01
物质的量
一、物质的量
生活中:
一双筷子═2根筷子 一打鸡蛋═12个鸡蛋
那么1mol粒子到底是多少个粒子呢?
01
2.3物质的量 课件(共28张ppt)高中化学人教版2019高中化学必修一

④集体化 物质的量可以表示多个微粒的特定组合或集合体,如 1 mol NaCl, 0.5 mol H2SO4
判断:
1mol大米 × 1 摩尔氧 × 1 摩尔氧原子 √ 3 摩尔 H2O √ 0.5 摩尔二氧化碳分子 √ 物质的量即是物质的质量,也是物质的数量 × 摩尔是7个基本物理量之一 ×
注意事项:
①专有化 “物质的量”四个字是一个整体,不能拆开,也不能添字。 如不能说成“物质量”或“物质的数量”等
②微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、 电子等,不能表示宏观的物质,如米
③具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
注意事项:
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数。 (2)不能认为1 mol粒子等于6.02×1023个,也不能认为 6.02×1023就是阿伏加德罗常数 (3)在计算时采用近似值6.02×1023mol-1
一个惊人的数字
这些物质中粒子数目非常庞大,不可能一个一个去数
生活中的计生量活中物品以什么方式计量?
大件物品以单个方式计量
情境引入 生活中物品以什么方式计量?
小件物品按一定的标准打包为一个集合体
微观粒子
物质的量
是国际单位制七个基本物理 量之一。
X个
物理量 长度 时间
物质的量 热力学温度
电流 发光强度
质量
......
8g
C: 12g/mol
2 molC
24g
H2O: 18g/mol 10 molH2O
180g
判断:
1mol大米 × 1 摩尔氧 × 1 摩尔氧原子 √ 3 摩尔 H2O √ 0.5 摩尔二氧化碳分子 √ 物质的量即是物质的质量,也是物质的数量 × 摩尔是7个基本物理量之一 ×
注意事项:
①专有化 “物质的量”四个字是一个整体,不能拆开,也不能添字。 如不能说成“物质量”或“物质的数量”等
②微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、 电子等,不能表示宏观的物质,如米
③具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
注意事项:
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数。 (2)不能认为1 mol粒子等于6.02×1023个,也不能认为 6.02×1023就是阿伏加德罗常数 (3)在计算时采用近似值6.02×1023mol-1
一个惊人的数字
这些物质中粒子数目非常庞大,不可能一个一个去数
生活中的计生量活中物品以什么方式计量?
大件物品以单个方式计量
情境引入 生活中物品以什么方式计量?
小件物品按一定的标准打包为一个集合体
微观粒子
物质的量
是国际单位制七个基本物理 量之一。
X个
物理量 长度 时间
物质的量 热力学温度
电流 发光强度
质量
......
8g
C: 12g/mol
2 molC
24g
H2O: 18g/mol 10 molH2O
180g
高一化学《化学中常用的物理量——物质的量》 PPT课件 图文

6.02×1023个12C的物质的量为 1 mol;
6.02×1023个CO的物质的量为 1 mol;
6.02×1023个OH-的物质的量为 1 mol。
0.5mol的O2中有多少个氧分子? 1.204 × 1024个H原子的物质的量是多少?
物质的量(n)、阿伏加德罗常数(NA) 与微粒数(N)之间的关系为:
【迁移·应用】
1.204×1024 个H原子
6.02×1023 个O原子
6.02×1023个H2O
1mol H2O
2 mol H
1 mol O
笑傲江湖
⑴0.5molNa2SO4含有 1mol molNa+, 0.5mol molSO42-,含 1.204×1024个O。
⑵3.01×1023个氢分子含 1 mol H、 含有 6.02×1023 个质子、 1 mol e-。
6.02X1023粒米供全球60亿人每人每天吃一斤, 需要3万多年
10亿人数一滴水里的水分子数,每人每分钟数100个,
可见:阿伏加德罗常数适用于微观粒子,不能用 于宏观物体。
谢谢! 学妹给我打电话,说她又换工作了,这次是销售。电话里,她絮絮叨叨说着一年多来工作上的不如意,她说工作一点都不开心,找不到半点成就感。 末了,她问我:学姐,为什么想 找一份 自己热 爱的工 作这么 难呢? 我问她上一份工作干了多久,她 说不到 三个月 ,做的 还是行 政助理 的工作 ,工作 内容枯 燥乏味 不说, 还特别 容易得 罪人, 实在不 是自己 的理想 型。 我又问了她前几份工作辞职的原 因,结 果都是 大同小 异,不 是因为 工作乏 味,就 是同事 不好相 处,再 者就是 薪水太 低,发 展前景 堪忧。 粗略估计,这姑娘毕业不到一年 ,工作 却已经 换了四 五份, 还跨了 三个行
物质的量完整课件(共39张PPT)

0.2
0.2
0.1
二、摩尔质量
1. 1mol物质的质量 2. 1mol 任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质 量或相对分
子质量相等。
3. 2. 摩尔质量 4. 〔1〕定义:单位物质的量的物质所具有的质量叫做摩尔质量,符号为M。 5. 〔2〕单位:g/mol 6. 〔3〕数值:数值等于该粒子的相对分子〔原子〕质量。
;分子数是
1.204 ×1024
。
〔6〕SO4- 摩尔质量是
,物质的量是
。
96 g/mol
9.6g
3. 物质的质量〔m),物质的量(n),摩尔质量(M)三者之间的关系
n m M
m n N
M
NA
【例题6】24.5gH2SO4 的物质的量是多少?
n (H 2 S4 O )M m ( (H H 2 2 S S4 4 O ) O ) 92 g 8 ./5 4 m g o 0 .2 lm 5ol
〔2〕标准状况下〔0℃,101kPa), 1mol 任何 气体的体积都约占22.4 L/mol。
25℃,101kPa时,气体摩尔体积约为24.5L/mol。
〔3〕计算公式:
V V 注意:
m
n ①22.4L/mol 使用条件:适用气体,且一般指标准状况,即0℃、101kPa。
②
适用对象:必须是气态物质,单一或混合气体均可用。
溶质的单位 溶液的单位
单位
公式
物质的量浓度
溶质的质量分数
mol
g
L
g
mol·L-1
CB
溶质的物质的(n量B) 溶液的体(积 V)
-
wB溶 溶质 液的 的((m m 质 质 B))量 1量 0% 0
高中化学必修一物质的量课件.ppt

) )
28 56
=0.5__mol铁原子。
② 水的式量是_1_8_,摩尔质量是_1_8_g_/_m_o;l 2mol的水是36克;90g水是_91_08__=_5mol
“非典”肆虐时期,过氧乙酸(C2H4O3) 是被人们广泛使用的消毒剂。
相对原子质量:C:12 H:1 O:16
①过氧乙酸的式量是_7_6_ ; 摩尔质量是 76g/mol__;
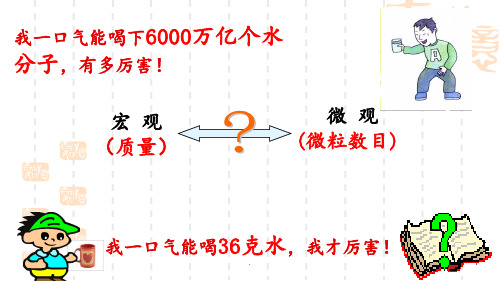
害!
我一口气能喝36克水,
我才厉害!
小结 :
1.物质的量是一种基本物理量,它实际上表示含有一定 数目粒子的集体,符号为n。 2.摩尔是物质的量的单位,含有6.02×1023 个粒子的任 何粒子集体计量为1摩尔。摩尔简称摩,符号为mol。 3.6.02×1023 mol-1叫做阿伏加德罗常数,是个物理量, 符号为NA。 4.单位物质的量的物质所具有的质量叫做摩尔质量,符 号为M。任何物质的摩尔质量以g/mol为单位时,在数值 上与该粒子的相对原子质量或相对分子质量相等。 5.粒子数(N)、物质的量(n)和质量(m)之间的关系:
2 NA,为 1.204×1024 个。
1. 下列说法正确的是
(
A. Na的摩尔质量为23g
B. Na的摩尔质量为23
C. Na的摩尔质量为23g/mol
D. Na的摩尔质量为23g×10-2kg/mol
2.下列气体中所含分子数目最多的是(
A.1gH2 C.30gCl2
B.10gCO2 D.17g NH3
(来源于拉丁文“moles”,表示大量和堆量的意思,是含
有相同个数的分子、原子等微粒的巨大集合体)
1打铅笔:12只 1双袜子:2只 1世纪: 100年
1mol某种微粒是多 少个呢?
高中化学人教版必修一课件:1.2.1物质的量 (共21张PPT)

小结:
物质的量的意义:是联系宏观和微观的纽 带或桥梁。表达式:
M
m
M
NA
n NA
宏观物体 质量
桥梁
N
微观粒子 个数
6.02×1023×1.993×10-23g =12g
很好称
6.02×1023是个很神奇的数据!!!
国 际 上 规 定 : 1mol 任 何 粒 子 所 含 的 粒 子 数 与 0.012kg 12C中所含的碳原子数相同。
0.012kg 12C
碳原子
已知:一个碳原子的质量为 1.993×10-23g
求: 0.012kg12C中所含的碳原子数?
12g 解: 碳原子数=
1.993 × 10-23g
≈ 6.02×1023
二、阿伏加德罗常数
符号:NA
意大利科学家
1:等于0.012kg 12C所含的原子数。
2:定义:1mol任何粒子的粒子数,叫阿伏加德 罗常数,即NA。
3:约为6.02×1023mol-1
= 6.02 × 1023 答:O2的氧原子数为6.02 × 1023个。
1mol物质的质量到底有多大?
实践体验
粒子符号 物质的式 每个粒子的质 1摩物质含有的 1摩物质质
量
量(g/个) 粒子数(个) 量(g)
C
12
1.993X10-23 6.02 × 1023 12
Fe
56
9.032X10-23 6.02 × 1023 56
m(H2SO4)
24.5克
n(H2SO4)==
==
M(H2SO4)
98克/摩
== 0.25mol
n(o)=4n(H2SO4)=1.0mol
人教版高一化学必修1:1.2物质的量 课件(共41张PPT)

课件PPT部编版课件统编版部编版人 教版高 一化学 必修1:1 .2物质 的量 课件(共41张PPT)课件优质课课件免 费课件PPT
练习:
含1.204*1025氧原子的氧气有 ()mol。
课件PPT部编版课件统编版部编版人 教版高 一化学 必修1:1 .2物质 的量 课件(共41张PPT)课件优质课课件免 费课件PPT
当物质所包含的微粒数与12克碳(12C)的 原子数相同时,这些物质就是1 mol。
1 mol物质所含的微粒数称为阿伏伽德罗常数, 具体数值约为6.02*1023个(用NA 表示)
1 mol碳中含碳原子()个, 2 mol碳中含碳原子()个,
1 mol碳中含碳原子(NA)个, 2 mol碳中含碳原子(2 NA )个,
课件PPT部编版课件统编版部编版人 教版高 一化学 必修1:1 .2物质 的量 课件(共41张PPT)课件优质课课件免 费课件PPT
1 mol碳是()克 2 mol碳是()克
课件PPT部编版课件统编版部编版人 教版高 一化学 必修1:1 .2物质 的量 课件(共41张PPT)课件优质课课件免 费课件PPT
含1.204 *1024个碳原子的碳相当 于(2) mol。
课件PPT部编版课件统编版部编版人 教版高 一化学 必修1:1 .2物质 的量 课件(共41张PPT)课件优质课课件免 费课件PPT
已知微粒数 N 已知阿伏伽德罗常数 NA 求物质的量 n
课件PPT部编版课件统编版部编版人 教版高 一化学 必修1:1 .2物质 的量 课件(共41张PPT)课件优质课课件免 费课件PPT
课件PPT部编版课件统编版部编版人 教版高 一化学 必修1:1 .2物质 的量 课件(共41张PPT)课件优质课课件免 费课件PPT
高一化学《物质的量》课件

(2)1.204×1024个H2O,其物质的量是多少?
解:H2O的物质的量为
N
1.204×1024
Байду номын сангаас
n=
=
NA
6.02 ×1023mol-1
= 2 mol
答:1.204×1024个H2O,其物质的量是2mol。
[例题二]
(1)1mol H2O中多少mol H,多少mol O?
分析: H2O-----2H-----O
阿伏加德罗常数:12克12c中含有的碳原子数,符号为NA 。
意
摩尔的标准
0.012 Kg 12C所含的碳原子数与1mol某种微粒集合 体含有的微粒数相同。
[思考] 0.012kg 12C
?个
已知:一个碳原子的质量为 1.993 × 10-26kg
求: 0.012kg 碳-12 中所含的碳原子数? 解:
碳原子数= 0.012kg
≈ 6.02×1023
1.993 × 10-26kg
1mol大米 2 摩尔分子氢 1 摩尔氧 1mol钠元素
【注意事项】
使用摩尔时,必须指明微粒的种类,微粒可以 是分子、原子、离子、质子、中子、电子等。
说出下列符号的意义: 1H 2mol H 2mol H+ 1mol H2 1mol H2O
判断正误: 1mol 氢
1mol H 1mol 粉笔
2mol CO2 0.3mol 大米 0.5mol SO24-
常见物质的量的描述方法
(能用化学式表示的用化学式,不能用化学式的用中文名称)
如:1mol C 表示1mol碳原子
(1)2molH
2 摩尔氢原子
(2)2molH+
高中化学《物质的量》完整完整PPT课件

例题2 1.5molH2SO4 的质量是多少? 解: 由m=n×M
m n (H2SO4)= (H2SO4)×M(H2SO4)
=1.5mol ×98g/mol =147.0g 答:1.5molH2SO4 的质量是147.0g。
.
例题3 0.01mol某物质的质量为1.08g,
此物质的摩尔质量是多少?
Na2SO4 —————Na+————— SO42- ————— O
1
2
1
4
NA
2NA
NA
4NA
1mol 2mol
1mol
.
4 mol
练习2、计算并填空:
⑴ 3.01×1024个硫酸分子的物质的量为5 mol; ⑵2 mol H2O中含 4 mol H和 2 mol O,
含有 1. 204×1024 个H2O。
质量为 0.85 g
.
练习
2.求下列物质的质量: ⑴1摩碳酸钙100克 ;⑵2molH2 4克 ; ⑶0.5摩硫酸49克 ; ⑷2molCO2 88克 . 3.求下列物质的物质的量:
⑴10g碳酸钙 0.1mol; ⑵1.2g氢气 0.6mo;l
⑶9.8gH2SO4 0.1mol ; ⑷66gCO21.5mol; ⑸含NA个氢原子的水:. 0.5mol .
① NA个微观粒子所形成的微粒集体的质量在几 克 到几百克之间,质量大小适宜,可以称量,便
于换算。
② 有利于借助相对原子质量,确定不同种类粒
子集体 的质量。
.
物质所含微粒数
物质的质量
阿佛加德罗常数 = 阿佛加德罗常数个微的粒质量
= 物质的量(mol)
当物质的量等于1mol时: 物质所含微粒数=阿佛加德常数 物质的质量=阿佛加德罗常数个微粒的质量
3第三章 物质的量(课件)

第三章 物质的量
第一节 物质的量及其单位
课堂练习2
9.03×1023个NaOH的物质的量是多少? 解:N=9. 03×1023, NA=6.02×1023 mol-1
N 9.03× 1023 = n(NaOH)= 23 -1 =1.5 mol 10 mol NA 6.02×
答: 9. 03×1024个NaOH是1.5 mol。
答:90 g H2O的物质的量是5 mol。
第三章 物质的量
第二节 摩尔质量
课堂练习2
2 molHCl的质量是多少? 解: M(HCl)=36.5 g/mol,n(HCl)=2 mol
m(HCl)=n(HCl)×M(HCl)
=2 mol×36.5 g/mol=73 g
答:2 mol HCl的质量是73 g。
第三章 物质的量
第三节 气体摩尔体积
学习要求
1.掌握气体摩尔体积的概念 2.理解摩尔体积的概念 3.掌握有关气体摩尔体积的计算
第三章 物质的量
第三节 气体摩尔体积
一、摩尔体积
摩尔体积就是物质的体积除以物质的量。 摩尔体积的符号是Vm。
摩尔体积的计算公式为:
V Vm= n
摩尔体积的SI单位是m3/mol,在化学上用 L/mol来表示。
O2 H2 N2 CO2
32.00 2.016 28.02 44.01
1.429 0.0899 1.2506 1.977
22.39 22.42 22.41 22.26
第三章 物质的量
第三节 气体摩尔体积
二、气体摩尔体积
3.气体的体积与物质的量之间的关系 在标准状况下,气体所占的体积V与物质的量n之间 的关系为:
第三章 物质的量
2.3物质的量 课件(共26张PPT) 化学人教版(2019)必修第一册

2、配制一定物质的量浓度的溶液
2、配制一定物质的量浓度的溶液
在溶液稀释前后,溶液中溶质的物质的量相等
巩固练习6
D
A不知道溶液的体积, 浓度不能计算 B标准状况下,葡萄糖 不是气体,不能用气体 摩尔体积进行计算 C溶液的体积未知,不 能计算一摩尔每升葡萄 糖水溶液所含碳原子物 质的量
巩固练习7
溶液的稀释
1、物质的量浓度C
物质的量浓度:单位体积的溶液里所含溶质B的物质的 量,也称为B的物质的量浓度 符号:CB 单位:mol/L(或mol·L-1)
2、配制一定物质的量浓度的溶液
①计算 ②选用适的容量瓶(常用规 格有50mL,100mL,250mL, 500mL和1000mL) ③称量 ④溶解 ⑤转移润洗 ⑥定容摇匀 ⑦贴标签
巩固练习5
A标准状况下水不是 气体,不能使用气
B 体摩尔体积进行有
关计算
C在同温同压下两种
气体的体积之比等
于气体的物质的量
之比
D常温下气体摩尔体积大于22.4升每摩尔
,则该条件下22.4升氧气的物质的量小
于一摩尔,其中所含分子数小于NA
3、物质的量浓度
物质的量浓度C:
配制一定物质的 溶液的配制 量浓度的溶液:
国际上规定1mol粒子集合体所含的粒子数约为6.02×1023 阿伏伽德罗常数:1mol任何粒子的粒子数 符号:NA 通常用6.02×1023mol-1表示
1.物质的量n
2.摩尔质量M
摩尔质量:单位物质的量的物质所具有的质量 符号:M 单位:g/mol(或g·mol-1)
2.摩尔质量M
巩固练习1
g,则1mol12C16O2 的质量是(a+2b)
NA,12C16O2摩尔质 量是(a+2b)
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)3 mol大米 错误,摩尔不能用来描述宏观物质
(4)0.5 摩尔 CO2 正确
思考:
1 mol H2O 中含有多少摩尔氢原子? 多少摩尔氧原子?共有多少摩尔的 原子?
[巩固练习]
5 mol SO2分子中含有多少摩尔的 原子?
(1)1molO2中约含有多少个氧气分子?
6.02 × 1023
(2)2molO2中约含有多少个氧气分子?
2 × 6.02 × 1023
(3)n molO2中约含有多少个氧气分子? (已知阿伏加德罗常数为NA)
n × 6.02 × 1023(n × NA)
问题探究
阿伏加德罗常数
N = NA × n
微粒个数
物质的量
填空题:
1 6.02 ×1023个CO2 分子的物质的量为 —1——mol 2、1.806×1024个Fe原子的物质的量为 ——3 —mol
电子个数约是_6_._0_2_×___1_0_2_4 __
链接
阿伏加德罗
生平简介
意大利物理学家。1776 年8月9日生于都灵市一个 律师家庭,1856年7月9日 卒于都灵市。1792年进都 灵大学法律系学习,取得 法学博士学位后,曾开业 当律师。1800年弃法从理, 十分勤奋,1820年被聘任 都灵大学理科教授。自 18 年被选为都灵科学院院士 后,还担任过意大利教育 委员和度量衡学会会长.
(2)1mol任何 粒子的粒子数叫阿伏加德
罗常数(链接)
[思考]
问题1:阿伏加德罗常数约为 6.02 × 1023 ,这到底有多大?
非常庞大,如果6.02 × 1023粒稻谷,平均分给全球 60亿人,每人每天吃一斤,则需要吃14万年。
问题2:6.02 × 1023 等于阿伏加德罗常数吗?
不等
问题3:能否说1 mol小麦约含有6.02 × 1023个麦粒? 为什么?
原子核内有6个质子和6个中子
0.012kg 12C
12C原子
[思考]
已知:一个碳原子的质量为 1.993 × 10-23kg
求: 0.012kg 碳-12 中所含的碳原子数?
ቤተ መጻሕፍቲ ባይዱ
解:
0.012kg
碳原子数=
≈ 6.02×1023
1.993 × 10-23kg
(1)1mol 粒子的数目是0.012 kg12C所 含的碳原子数,约为6.02 × 1023
人人类社会进步的关键:化学
类 社 会
想想看:
你如何用托盘天平称出一粒米的质 量(假设每粒大米的质量一样大)
取一些大米称其质量,并数出大米粒数,再计算每一粒 大米的质量。
你熟悉的知识
点燃
C + O2 = CO2
微粒数: 1
1
1
质量:
12g
32g
44g
宏 观 物质的量 微 观
(质量)
(微粒数)
国际单位制(SI)的7个基本物理量
答: 0.5molO2的电子数为4.816 × 1024个。
物质的量 :表示含有一定数目粒子集体的物理量
摩尔
:是物质的量的单位,符号为mol
阿伏加德罗 :是0.012 千克12c 所含的碳原子数
常数
约为6.02 × 1023
换算公式 物质的量(n)
×NA
÷ NA
微粒数(N)
链接
反馈练习
(1) 摩尔是_物__质__的__量_单位,1摩尔物质约含___6_._0_2_×__1_0_2_3_____ 个微粒。
Amedeo Avogadro 1776~1856
不能,因为物质的量及其单位的使用对象只能是微观粒 子,不能用来描述宏观物质。
==
归纳:
1mol任何粒子的粒子数 0.012 kg12C所含的碳原子数
阿伏加德罗常数
约为 6.02ㄨ1023
[巩固练习]
判断下列说法是否正确
(1)1 mol氧 错误,必须指明微粒的种类,是氧原子、氧分子
还是氧离子,可改为1 mol O 或1 mol O2 (2)0.5 mol H2 O 正确
3、0.5molO2中含有的氧气分子数目是3_._0_1_×_1_023个 4、0.5molO2中含有的氧原子数目是6_._0_2_×_1_023 个
[计算题]
在0.5molO2中含有的电子数目是多少? 解:O2的电子数为
N = n ×16 × NA
=0.5 mol×16× 6.02 ×1023mol-1 = 4.816 × 1024
物体的 长短
物体所 含物质 的多少
物理量 长度 质量 时间 电流 热力学温 度 物质的量
发光强度
单位名称 米 千克 秒 安[培] 开[尔文]
摩[尔] 坎[德拉]
单位符号 m Kg S A K
mol cd
1mol的标准是什么?(既1mol表示 的粒子数目的依据是什么?)
用0.012 kg 12C所含的碳原子数作为1mol的 标准。
(2)下列说法正确的是( A)
A 6.02 × 1023是阿伏加德罗常数的近似值。 B 1mol 12C中的原子个数为6.02 × 1023 C含有阿伏加德罗常数个微粒的质量是1mol D1mol H 2约含有6.02 × 1023 个氢原子
链接
(有4)C. O1m3 2o- l_N_1_a_2_C_O_m3中ol有, 约Na_6_.+0__2___×__2___1__0__2m3 o个l,。约_1_.2_0_4__×__1_024个, (5). 3.01 × 1023个H2SO4分子的物质的量是__0_.5_m__o_l_ (6). 1mol NH4 +原子含有电子物质的量是__1_0_m__o_l_,
(4)0.5 摩尔 CO2 正确
思考:
1 mol H2O 中含有多少摩尔氢原子? 多少摩尔氧原子?共有多少摩尔的 原子?
[巩固练习]
5 mol SO2分子中含有多少摩尔的 原子?
(1)1molO2中约含有多少个氧气分子?
6.02 × 1023
(2)2molO2中约含有多少个氧气分子?
2 × 6.02 × 1023
(3)n molO2中约含有多少个氧气分子? (已知阿伏加德罗常数为NA)
n × 6.02 × 1023(n × NA)
问题探究
阿伏加德罗常数
N = NA × n
微粒个数
物质的量
填空题:
1 6.02 ×1023个CO2 分子的物质的量为 —1——mol 2、1.806×1024个Fe原子的物质的量为 ——3 —mol
电子个数约是_6_._0_2_×___1_0_2_4 __
链接
阿伏加德罗
生平简介
意大利物理学家。1776 年8月9日生于都灵市一个 律师家庭,1856年7月9日 卒于都灵市。1792年进都 灵大学法律系学习,取得 法学博士学位后,曾开业 当律师。1800年弃法从理, 十分勤奋,1820年被聘任 都灵大学理科教授。自 18 年被选为都灵科学院院士 后,还担任过意大利教育 委员和度量衡学会会长.
(2)1mol任何 粒子的粒子数叫阿伏加德
罗常数(链接)
[思考]
问题1:阿伏加德罗常数约为 6.02 × 1023 ,这到底有多大?
非常庞大,如果6.02 × 1023粒稻谷,平均分给全球 60亿人,每人每天吃一斤,则需要吃14万年。
问题2:6.02 × 1023 等于阿伏加德罗常数吗?
不等
问题3:能否说1 mol小麦约含有6.02 × 1023个麦粒? 为什么?
原子核内有6个质子和6个中子
0.012kg 12C
12C原子
[思考]
已知:一个碳原子的质量为 1.993 × 10-23kg
求: 0.012kg 碳-12 中所含的碳原子数?
ቤተ መጻሕፍቲ ባይዱ
解:
0.012kg
碳原子数=
≈ 6.02×1023
1.993 × 10-23kg
(1)1mol 粒子的数目是0.012 kg12C所 含的碳原子数,约为6.02 × 1023
人人类社会进步的关键:化学
类 社 会
想想看:
你如何用托盘天平称出一粒米的质 量(假设每粒大米的质量一样大)
取一些大米称其质量,并数出大米粒数,再计算每一粒 大米的质量。
你熟悉的知识
点燃
C + O2 = CO2
微粒数: 1
1
1
质量:
12g
32g
44g
宏 观 物质的量 微 观
(质量)
(微粒数)
国际单位制(SI)的7个基本物理量
答: 0.5molO2的电子数为4.816 × 1024个。
物质的量 :表示含有一定数目粒子集体的物理量
摩尔
:是物质的量的单位,符号为mol
阿伏加德罗 :是0.012 千克12c 所含的碳原子数
常数
约为6.02 × 1023
换算公式 物质的量(n)
×NA
÷ NA
微粒数(N)
链接
反馈练习
(1) 摩尔是_物__质__的__量_单位,1摩尔物质约含___6_._0_2_×__1_0_2_3_____ 个微粒。
Amedeo Avogadro 1776~1856
不能,因为物质的量及其单位的使用对象只能是微观粒 子,不能用来描述宏观物质。
==
归纳:
1mol任何粒子的粒子数 0.012 kg12C所含的碳原子数
阿伏加德罗常数
约为 6.02ㄨ1023
[巩固练习]
判断下列说法是否正确
(1)1 mol氧 错误,必须指明微粒的种类,是氧原子、氧分子
还是氧离子,可改为1 mol O 或1 mol O2 (2)0.5 mol H2 O 正确
3、0.5molO2中含有的氧气分子数目是3_._0_1_×_1_023个 4、0.5molO2中含有的氧原子数目是6_._0_2_×_1_023 个
[计算题]
在0.5molO2中含有的电子数目是多少? 解:O2的电子数为
N = n ×16 × NA
=0.5 mol×16× 6.02 ×1023mol-1 = 4.816 × 1024
物体的 长短
物体所 含物质 的多少
物理量 长度 质量 时间 电流 热力学温 度 物质的量
发光强度
单位名称 米 千克 秒 安[培] 开[尔文]
摩[尔] 坎[德拉]
单位符号 m Kg S A K
mol cd
1mol的标准是什么?(既1mol表示 的粒子数目的依据是什么?)
用0.012 kg 12C所含的碳原子数作为1mol的 标准。
(2)下列说法正确的是( A)
A 6.02 × 1023是阿伏加德罗常数的近似值。 B 1mol 12C中的原子个数为6.02 × 1023 C含有阿伏加德罗常数个微粒的质量是1mol D1mol H 2约含有6.02 × 1023 个氢原子
链接
(有4)C. O1m3 2o- l_N_1_a_2_C_O_m3中ol有, 约Na_6_.+0__2___×__2___1__0__2m3 o个l,。约_1_.2_0_4__×__1_024个, (5). 3.01 × 1023个H2SO4分子的物质的量是__0_.5_m__o_l_ (6). 1mol NH4 +原子含有电子物质的量是__1_0_m__o_l_,
