材料科学基础---二元相图
合集下载
二元相图

T L
L
冷却结晶曲线
t
L
Pb
+
合金on
β + (α + β )
m
o
n
Sn
二元共晶相图
二元系各类恒温转变图型
恒温转变类型
共晶转变 共析转变
反应式
图形特征
L →α +β
γ →α +β
共晶式
偏晶转变 熔晶转变
L1 → L2 + α
δ→L+γ
L+β →α
β+γ →α
包晶转变
包晶式
包析转变 合晶转变
C溶于 Fe 中形成的间隙固溶体, 金相显微镜下为规则的多边形晶粒
A的强度和硬度不高,塑性好, 容易压力加工,A没有磁性
1.3、高温铁素体 C溶于 Fe 中形成的间隙固溶体,用 表示,它只存在于13950C—15380C 2、铁碳化合物—渗碳体(Fe3C)
渗碳体是Fe3C相,含碳量为6.69%,其硬度很高 强度极低,脆性非常大,常作为强化相。 3、液相——铁和碳的液相熔体,用L表示
1227 1148
4.3
6.69 2.11
共晶转变点
渗碳体Fe3C的熔点
C在A中的最大溶解度
特性点 及线 F G
温度 0C 1148 912
含碳量 % 6.69 0
意
义
渗碳体Fe3C的成分
Fe 与
Fe
转变点
H
J K N P S Q
1495
1495 727 1394 727 727 600
广东石油化工学院
第一节 相图的基本知识
3、相平衡的条件 材 料 科 学 基 础 在指定的温度和压力下,若多相体系 的各相中每一组元的浓度均不随时间 而变,则体系达到相平衡。 3.1 相律 在平衡条件下,系统的自由度数f、 组元数c和平衡相数p之间的关系
L
冷却结晶曲线
t
L
Pb
+
合金on
β + (α + β )
m
o
n
Sn
二元共晶相图
二元系各类恒温转变图型
恒温转变类型
共晶转变 共析转变
反应式
图形特征
L →α +β
γ →α +β
共晶式
偏晶转变 熔晶转变
L1 → L2 + α
δ→L+γ
L+β →α
β+γ →α
包晶转变
包晶式
包析转变 合晶转变
C溶于 Fe 中形成的间隙固溶体, 金相显微镜下为规则的多边形晶粒
A的强度和硬度不高,塑性好, 容易压力加工,A没有磁性
1.3、高温铁素体 C溶于 Fe 中形成的间隙固溶体,用 表示,它只存在于13950C—15380C 2、铁碳化合物—渗碳体(Fe3C)
渗碳体是Fe3C相,含碳量为6.69%,其硬度很高 强度极低,脆性非常大,常作为强化相。 3、液相——铁和碳的液相熔体,用L表示
1227 1148
4.3
6.69 2.11
共晶转变点
渗碳体Fe3C的熔点
C在A中的最大溶解度
特性点 及线 F G
温度 0C 1148 912
含碳量 % 6.69 0
意
义
渗碳体Fe3C的成分
Fe 与
Fe
转变点
H
J K N P S Q
1495
1495 727 1394 727 727 600
广东石油化工学院
第一节 相图的基本知识
3、相平衡的条件 材 料 科 学 基 础 在指定的温度和压力下,若多相体系 的各相中每一组元的浓度均不随时间 而变,则体系达到相平衡。 3.1 相律 在平衡条件下,系统的自由度数f、 组元数c和平衡相数p之间的关系
材料科学基础-6二元相图

2
Ω=0,>0,G-x曲线也有一最小值;
Ω>0, G-x曲线也有2个最小值,拐点内<0。
6.3.2 多相平衡的公切线原理
6.3.3 混合物的自由能和杠杆法则
6.3.4 从自由能—成分曲线推测相图
6.3.5 二元相图的几何规律
★相图中所有的相界线代表相变的温度和平衡相 成分,即平衡相成分沿着相界线随温度变化而变 化; ★两单相区之间必定有这两相的两相区-相区接 触法则; ★二元相图的三相平衡区为一水平线,其与三个 单相区的交点确定平衡相的浓度; ★两相区与单相区的分界线与三相等温线相交, 分界线的延长线进入另一两相区。
(1)单相区:3个, L、 α 、β (2)两相区: 3个, L+α 、L+β 、α +β 相区:1个, L+α+β (3)三
5.与匀晶和共晶相图的区别
(1)相同处
PDC线以上区域; PDC线以下、DF以右区域的
分析方法以及结晶过程与匀晶相同;
BPDF以内区域,与共晶线MEN线以下区域相同,
按照固ห้องสมุดไป่ตู้度线分析。 (2)不同处 包晶线PDC及包晶反应:L+α→β
6.10 铁碳合金相图 6.11 二元合金的凝固理论
第6章 二元合金相图及合金凝固
由一种元素或化合物构成的晶体称为单组元晶体或纯晶体,
该体系称为单元系。两个组元的为二元系,n个组元都是独立
的体系称为n元系。对于纯晶体材料而言,随着温度和压力的 变化,材料的组成相会发生变化。
从一种相到另一种相的转变称为相变。由不同固相之间的
2.非平衡共晶组织
a
非平衡共晶组织(成分位于a点稍左)一般分布在初晶α 的相界上,或者在枝晶间。可以通过扩散退火来消除,最终得
材料科学基础 -二元合金相图

1、相图分析
(1)相区 单相区:L, a, b 两相区: L+a, L+ b,a+b
(2)相变线
TAP及TBP:L→a, L→b。
TAC及TBD:初生a及b结晶终了线。
CE及DF:
a
→bII,b→
a
。
II
CDP: L+ a →b。
液相线:TAPTB
固相线:TACDTB
(3)相变点 P:包晶转变点,发生包晶反应的液相成分点。
相区
单相区:L, a, b 两相区: L+a, L+ b,a+b
相变线
TAE及TBE:初生(初晶)a及b析出线 即L→a, L→b
TAM及TBN:初生a及b结晶终了线 MF及NG: a及b溶解度变化线
即a→bII,b→aII MEN: 共晶线,即L→a+b
相变点
TA及TB:纯组元A、B的熔点 M及N:a及b的最大溶解度点 F及G:a及b室温溶解度点 E:共晶点,发生共晶反应的液相成分点
问题:假定合金分别冷却到1,2,3,4温度开始结晶,获得的组织特点有何不同?
(2)晶内偏析共晶
晶内偏析共晶: 端部固溶体合金非平衡结晶时出现共晶组织
的现象。 由于晶内偏析共晶数量较少,往往以离异
共晶形式存在。 两种情况促使离异共晶形成: ►靠近极限溶解度的端部固溶体的非平衡冷却。 ►靠近极限溶解度的亚共晶合金的平衡冷却。
(3)x2合金
组织组成物:a0+ b包+aII +bII
Wa II
DF EF
Cx2 CD
100%
相 对 量
Wb II
CE Dx2 EF CD
100%
计 算
Wa0
814材料科学基础-第七章 二元相图知识点讲解

共晶线:水平线CED叫做共晶线。
共晶反应:在共晶线对应的温度下,E点成分的合金同时结晶出C点成分的 α固溶体个D点成分的β,形成这两个相的机械混合物:
LE C D
共晶体:共晶反应的产物,即两相的机械混合物 共晶温度:发生共晶反应的温度。即共晶线CED对应的温度 共晶点:代表共晶温度和共晶成分的点,也就是共晶图中的E点。
过烧:当钢加热到接近熔化温度,并在此温度长时间停留,,不仅奥氏体 晶粒长大,同时由于氧化性气体渗入到晶界,使晶间物质Fe、C、S发生氧 化,形成易熔共晶体氧化物。这种现象称为过烧。
非平衡凝固总结
非平衡凝固对合金的影响:
(1)组织影响:晶内偏析、枝晶偏析(冷却速度越大,凝固相间距越大,那么枝晶偏析越 严重)
两相的相对量随体系的成分x变化而变化。
知识点5 自由能-成分曲线推测相图
根据公切线原理,可以求出某一温度下平衡相的成分。因此,可以根据二 元系的不同温度下的自由能-成分曲线画出二元系相图。
二元相图的几何规律
(1)相图中所有的线条都代表发生相转变的温度和平衡相的成分,所以相界线是相平衡的 体现,平衡相成分必须沿着相界线随着温度而变化;
的化学势相等。
dGa B A B A
dx
AB
dG B A B A
dx
AB
1.多相平衡公切线法则:多相 平衡必能作出公切线,切点对 应着各相平衡时的成分; 2.两相平衡时,混合物的自由 能位于切点之间的直线上。
知识点4 杠杆法则
(1)当二元系的成分x≤x1时,α固溶体的摩尔 吉布斯自由能低于β固溶体,故α相为稳定相, 即体系处于单相α状态; (2)当x≥x2时,β相的摩尔吉布斯自由能低于α 相,则体系处于单相β状态; (3)当x1<x<x2时,公切线上表示混合物的摩 尔吉布斯自由能低于α相或者β相的摩尔吉布斯 自由能,故α和β两相混合时,体系能量最低。
共晶反应:在共晶线对应的温度下,E点成分的合金同时结晶出C点成分的 α固溶体个D点成分的β,形成这两个相的机械混合物:
LE C D
共晶体:共晶反应的产物,即两相的机械混合物 共晶温度:发生共晶反应的温度。即共晶线CED对应的温度 共晶点:代表共晶温度和共晶成分的点,也就是共晶图中的E点。
过烧:当钢加热到接近熔化温度,并在此温度长时间停留,,不仅奥氏体 晶粒长大,同时由于氧化性气体渗入到晶界,使晶间物质Fe、C、S发生氧 化,形成易熔共晶体氧化物。这种现象称为过烧。
非平衡凝固总结
非平衡凝固对合金的影响:
(1)组织影响:晶内偏析、枝晶偏析(冷却速度越大,凝固相间距越大,那么枝晶偏析越 严重)
两相的相对量随体系的成分x变化而变化。
知识点5 自由能-成分曲线推测相图
根据公切线原理,可以求出某一温度下平衡相的成分。因此,可以根据二 元系的不同温度下的自由能-成分曲线画出二元系相图。
二元相图的几何规律
(1)相图中所有的线条都代表发生相转变的温度和平衡相的成分,所以相界线是相平衡的 体现,平衡相成分必须沿着相界线随着温度而变化;
的化学势相等。
dGa B A B A
dx
AB
dG B A B A
dx
AB
1.多相平衡公切线法则:多相 平衡必能作出公切线,切点对 应着各相平衡时的成分; 2.两相平衡时,混合物的自由 能位于切点之间的直线上。
知识点4 杠杆法则
(1)当二元系的成分x≤x1时,α固溶体的摩尔 吉布斯自由能低于β固溶体,故α相为稳定相, 即体系处于单相α状态; (2)当x≥x2时,β相的摩尔吉布斯自由能低于α 相,则体系处于单相β状态; (3)当x1<x<x2时,公切线上表示混合物的摩 尔吉布斯自由能低于α相或者β相的摩尔吉布斯 自由能,故α和β两相混合时,体系能量最低。
二元相图【材料科学基础】

相区: 液相区(L)、固相区 (α)、固液两相共存 区(L+α)。
13
¾ α相: Cu-Ni合金形成的置换固溶体。 ¾ 在两相区中: 9 f =C-P+1=2-2+1= 1,两个相的成分和温度
变量中只有一个可以独立变化,其中一个固定后, 另一个也随之固定。 9 例如,温度一定,在此温度下两个平衡相成分固 定,由该温度水平线与该两相区边界线相交的两点 决定(杠杆定律)。
33
• 共晶反应:在一定的温度下,由一定成分的液相同 时结晶出成分一定且不相同的两个固相的转变过 程,也称共晶转变。其反应式为:
共晶温度
• 发生共晶反应时,根据相律 f = C – P + 1 = 2-3+1=0,所以三个相的成分不能变化,温度也 不能变化,因此共晶线为水平线,三个相在此线上 有确定的成分点。
以Cu-40%Ni合金为例
16
t0
●
t1
●
t2
●
t3
●
● ●
●
●
17
平衡结晶过程
形核和核长大
¾ 形核:过冷、结构起伏、能量起伏、成分起伏(微 小区域内成分偏离平均成分的现象)。
¾ 长大:建立平衡 界面前沿液相中溶质原子扩散 破坏平衡 晶体长大 恢复平衡 重
新建立平衡。
18
19
20
结晶特点: ¾ 结晶在一个温度范围内进行,f =1,平衡结晶过
共晶区如此。 • 组成共晶体的两相均为金属
型液固界面,两个相的长大 速度与过冷度关系的差别不 大,伪共晶区对称地扩大。
53
9 (2)伪共晶区偏向一边扩大
• 两个组元熔点差别大,共晶点偏向低熔点组元,伪共晶 区偏向高熔点组元。
13
¾ α相: Cu-Ni合金形成的置换固溶体。 ¾ 在两相区中: 9 f =C-P+1=2-2+1= 1,两个相的成分和温度
变量中只有一个可以独立变化,其中一个固定后, 另一个也随之固定。 9 例如,温度一定,在此温度下两个平衡相成分固 定,由该温度水平线与该两相区边界线相交的两点 决定(杠杆定律)。
33
• 共晶反应:在一定的温度下,由一定成分的液相同 时结晶出成分一定且不相同的两个固相的转变过 程,也称共晶转变。其反应式为:
共晶温度
• 发生共晶反应时,根据相律 f = C – P + 1 = 2-3+1=0,所以三个相的成分不能变化,温度也 不能变化,因此共晶线为水平线,三个相在此线上 有确定的成分点。
以Cu-40%Ni合金为例
16
t0
●
t1
●
t2
●
t3
●
● ●
●
●
17
平衡结晶过程
形核和核长大
¾ 形核:过冷、结构起伏、能量起伏、成分起伏(微 小区域内成分偏离平均成分的现象)。
¾ 长大:建立平衡 界面前沿液相中溶质原子扩散 破坏平衡 晶体长大 恢复平衡 重
新建立平衡。
18
19
20
结晶特点: ¾ 结晶在一个温度范围内进行,f =1,平衡结晶过
共晶区如此。 • 组成共晶体的两相均为金属
型液固界面,两个相的长大 速度与过冷度关系的差别不 大,伪共晶区对称地扩大。
53
9 (2)伪共晶区偏向一边扩大
• 两个组元熔点差别大,共晶点偏向低熔点组元,伪共晶 区偏向高熔点组元。
材料科学基础 4-2二元相图及其类型_OK

后退 下页
nf 的溶解度变化线
●凝固过程:
合金1:L L 合金2 :L L
21
●不平衡凝固
◆伪共晶
在非共晶成分处获得100%的共晶组 织,只能在非平衡条件下得到。
后退
下页
22
后退
下页
23
◆不平衡共晶
m点以左,n点以右合金不平衡凝固时出现的 共晶组织 。
后退 下24页
◆离异共晶
当初相较多,当发生 共晶反应时,与当初相相 同的一相优先形核,将另 一相推到最后处形成,失 去了共晶形貌,即组织为 离异组织。
上页 下页
25
●包晶相图
后退
下页26
后退
下页27
后退
下页28
1.包晶型反应有何特点?与 共晶反应相比,你能否总结 其规律?
2.分析其冷凝过程,比较平 衡与非平 衡凝固的异同?
下页 30
(4)共析反应:在某一恒温下,一定成分 的固相同时分解成两个成分与结构不同的固 相反应。 (5)包析反应:两个不同成分的固相,在 某一恒温下相互作用生成另一固相的反应。
表5-6是对以上反应类型的总结
上页
下页
31
后退 下页
32
二元相图的分析方法
后退 下页
一、二元相图的一些基本规律
(1)相接触法则:在二元相图中,相邻相区 的相数差为1,点接触除外。 (2)在二元相图中,三相平衡一定是一条水 平线,该向上一定与3个单相区有点接触,其
系中一切具有相同的物理性能与化学性
能的均匀部分,与其它有明显界面分开,
超越界面会有性质突变,否则仍为同一
相。
3
后退 下页
对于合金系统来说,要保持物理性能、 化学性能相同则要满足:成分相同和结 构相同。
材料科学基础-二元相图

LE→( αC + βD)
相图的构成:
LE→( αC + βD)
相图的构成:线
AE和BE为两液相线; AC和BD为两固相线; CG和DH:(固溶度曲线) 固溶体α、β的溶解度线; CED:水平共晶线。
三个单相区: L、α、β; 三个双相区:L+α、L+β、
α+β 一个三相区:L+α+β,
CED共晶线。 29
连接转变开始点 和终了点
冷却过程中,不同相的热容量不同,冷却曲线上的斜率 不同, 曲线的转折点对应温度就是相变温度。
相图的测定: 二元相图:4000个(81%)(4950); 三元相图:8000(5%)(161700)。工作量巨大。 四元相图:1000(0.1%)(3921225) 问题:成分难控制,高熔点,难以达到相平衡
室温组织:α+βII +(α+β)
(α+β)%=L%=c2/ce, (α+βII)%=e2/ce
α%=c’g/fg× e2/ce,
βII%=fc’/fg × e2/ce
41
相: α+β
α初 :暗黑色粗大树枝状, βII :白色颗粒。
(α+β)
亚共晶组织:
α+βII +(α+β)
④合金Ⅳ:过共晶合金 L→L+β→β+(α+β)→β+αII+ (α+β)
4. 偏晶转变相图 fdc Ld→αf +Lc
偏晶转变:
L36→Cu +L87
72
5、具有合晶转变的相图
Lc+Ld→f
6、熔晶转变相图
→ +L
♣ 6.3.5 二元相图的几何规律
相图的构成:
LE→( αC + βD)
相图的构成:线
AE和BE为两液相线; AC和BD为两固相线; CG和DH:(固溶度曲线) 固溶体α、β的溶解度线; CED:水平共晶线。
三个单相区: L、α、β; 三个双相区:L+α、L+β、
α+β 一个三相区:L+α+β,
CED共晶线。 29
连接转变开始点 和终了点
冷却过程中,不同相的热容量不同,冷却曲线上的斜率 不同, 曲线的转折点对应温度就是相变温度。
相图的测定: 二元相图:4000个(81%)(4950); 三元相图:8000(5%)(161700)。工作量巨大。 四元相图:1000(0.1%)(3921225) 问题:成分难控制,高熔点,难以达到相平衡
室温组织:α+βII +(α+β)
(α+β)%=L%=c2/ce, (α+βII)%=e2/ce
α%=c’g/fg× e2/ce,
βII%=fc’/fg × e2/ce
41
相: α+β
α初 :暗黑色粗大树枝状, βII :白色颗粒。
(α+β)
亚共晶组织:
α+βII +(α+β)
④合金Ⅳ:过共晶合金 L→L+β→β+(α+β)→β+αII+ (α+β)
4. 偏晶转变相图 fdc Ld→αf +Lc
偏晶转变:
L36→Cu +L87
72
5、具有合晶转变的相图
Lc+Ld→f
6、熔晶转变相图
→ +L
♣ 6.3.5 二元相图的几何规律
材料科学基础第七章1.1

2、相图的类型和结构
(1)二组元在液态无限溶解,在固态无限固溶,并形成连 续固溶体的匀晶相图。 (2)二组元在液态无限溶解,在固态有限固溶,并有共晶 反应的共晶相图。 (3)二组元在液态无限溶解,在固态有限固溶,有包晶反 应的包晶相图。 (4)二组元在液态无限溶解,在固态形成化合物的相图。 (5)二组元在液态无限溶解,在固态有共析或包析转变的 相图。 (6)二组元在液态有限溶解,并有偏晶或合晶反应的相图。 (7)其他相图。
5、二元相图的几何规律
(1) 相图中所有的线条都代表发生相转变 的温度和平衡相的成分,所以相界线是相平 衡的体现,平衡相的成分必须沿着相界线随 温度而变化。 (2) 两个单相区之间必定有一个由该两相 组成的两相区分开,而不能以一条线接界(即 两个单相区只能交于一点而不能交于一条线)。 两个两相区必须以单相区或三相水平线分开。 即:在二元相图中,相邻相区的相数差为1, 这个规则为相区接触法则。
具有匀晶转变的二元合金系主要有:Cu-Ni,FeCr,Ag-Au,W-Mo,Nb-Ti,Cr-Mo,Cd-Mg, Pt-Rh等。 属于二元匀晶相图的二元陶瓷有NiO-CoO、CoO -MgO、NiO-MgO等.
一、平衡凝固 平衡凝固(equilibrium solidification) 是指凝固过程是在无限缓慢地冷却,原 子(组元)扩散能够充分进行以达到相平 衡的成分。这种凝固方式所得到的组织 称为平衡组织。
两个单相区只能交于一点而不能交于一条线
5、二元相图的几何规律
(3) 二元相图中的三相平衡必为一条水平线, 表示恒温反应。在这条水平线上存在3个表示 平衡相的成分点,其中两点在水平线两端, 另一点在端点之间,水平线的上下方分别与3 个两相区相接。 (4) 当两相区与单相区的分界线与三相等温 线相交则分界线的延长线应进入另一两相区 内,而不会进入单相区。
材料科学基础_第5章_二元相图

不大时,它们不仅可以在液态或熔融状态完全互溶,而且 在固态也完全互溶,形成成分可变的连续固溶体,称为无 限固溶体或连续固溶体,它们形成的相图即为匀晶相图或 互溶相图。 ➢ 由液相结晶出单相固溶体的过程称为匀晶转变。液固态完 全互溶的体系不多,但是包含匀晶转变部分的相图却不少 ,几乎所有的二元系统都含有匀晶转变部分。
Cu
18 20
30 40
66 60 80
Ni 相对质量为1/4。溶体合金的平衡凝固及组织
➢ 平衡凝固是指凝固过程中每个阶段都能达到平衡,因此 平衡凝固是在极其缓慢的冷速下实现的。现以30%Ni和 70%Cu的铜镍合金为例来说明固溶体的平衡冷却过程及其 组织的。
11
冷却曲线 t Ⅱ
23
X2合金结晶过程分析
L
(共晶合金)
T,C
183
L
L+
L+
c
d
e
+
T,C
(+ )
围内凝固,具有变温凝固的特征 ②还需要成分起伏
15
5.3.2 二元共晶相图 两组元在液态无限互溶,固态有限溶解,通过共晶反
应形成两相机械混合物的二元合金称为二元共晶相图。共 晶反应是液相在冷却过程中同时结晶出两个结构不同的固
相的过程。 L
16
Ta,tb分别是Pb,Sn的熔点 M:锡在铅中的最大溶解度。N:铅在锡中的最大溶解度 E:为共晶点,具有该点成分的合金在恒温183℃发生共 晶转变LE→aM+ΒN,共晶转变是具有一定成分的液相在恒 温下同时转变为两个具有一定成分和结构的固相的过程。 F:室温时锡在铅中的溶解度;G:室温时铅在锡中的溶 解度
之间一定是由这两个相组成的两相区。如铁区(线)区(
Cu
18 20
30 40
66 60 80
Ni 相对质量为1/4。溶体合金的平衡凝固及组织
➢ 平衡凝固是指凝固过程中每个阶段都能达到平衡,因此 平衡凝固是在极其缓慢的冷速下实现的。现以30%Ni和 70%Cu的铜镍合金为例来说明固溶体的平衡冷却过程及其 组织的。
11
冷却曲线 t Ⅱ
23
X2合金结晶过程分析
L
(共晶合金)
T,C
183
L
L+
L+
c
d
e
+
T,C
(+ )
围内凝固,具有变温凝固的特征 ②还需要成分起伏
15
5.3.2 二元共晶相图 两组元在液态无限互溶,固态有限溶解,通过共晶反
应形成两相机械混合物的二元合金称为二元共晶相图。共 晶反应是液相在冷却过程中同时结晶出两个结构不同的固
相的过程。 L
16
Ta,tb分别是Pb,Sn的熔点 M:锡在铅中的最大溶解度。N:铅在锡中的最大溶解度 E:为共晶点,具有该点成分的合金在恒温183℃发生共 晶转变LE→aM+ΒN,共晶转变是具有一定成分的液相在恒 温下同时转变为两个具有一定成分和结构的固相的过程。 F:室温时锡在铅中的溶解度;G:室温时铅在锡中的溶 解度
之间一定是由这两个相组成的两相区。如铁区(线)区(
材料科学基础.第四章
向凝固问题。合金K0 <1, 凝固自左向右进行。
(1)平衡凝固溶质分布 冷却时固相的溶质分布
这种情况下,冷速极其缓慢, 固体、液体中溶质原子充
分扩散。凝固结束时,各部分成分都为Co,无偏析产生,如图
中的Co水平线。
(2)实际凝固(正常凝固)溶质分布 溶质分布及表达式见图。 ①液体中溶质完全混合--偏析严重,左端纯化; ②液体中溶质完全不混合—比较符合实际凝固; ③液体中溶质部分混合。
f=c-p+1(←f=c-p+2,温度、压力) 自由度数是指在木改变系统平衡相的数目的条件厂,可独立改变
的,不影响(影响/决定体系状态)合金状态的因素(如温度、压 力、平衡相成分)的数目。
自由度数的最小值为零,f =0时发生恒温转变,例如纯金属结 晶、二元合金的三相平衡转变、三元合金的四相平衡转变等。
1
4( 3
h2 hk k 2 a2
)(
l c
)2
六方系
对复杂点阵(体心立方,面心立方等),要考虑晶面层数的增加。 体心立方(001)面之间还有一同类的晶面(002),因此间距减半。
1.2.4 晶体的极射赤面投影
通过投影图可将立体图表现于平面上。晶体投影方法很多, 包括球面投影和极射赤面投影。
不平衡凝固的冷速越快,平均成分线的偏离越大。合金内部成分
不均匀现象称为偏析,晶粒内部成分不均匀称为“晶内偏析”, 树
枝晶内的偏析称为“枝晶偏析”。生产中用扩散退火(均匀化退 火)
4.固溶体合金凝固时的溶质量分布 合金凝固时的溶质重新分布,导致宏观偏析和微观偏析并对 晶体的生长形态产生很大影响。 匀晶合金冷却时,固相浓度CS与液相浓度CL的比值K0= CS/CL, 称为平衡分配系数,如图示。 讨论图4.7水平放置的圆 棒容器中,合金液体的定
(1)平衡凝固溶质分布 冷却时固相的溶质分布
这种情况下,冷速极其缓慢, 固体、液体中溶质原子充
分扩散。凝固结束时,各部分成分都为Co,无偏析产生,如图
中的Co水平线。
(2)实际凝固(正常凝固)溶质分布 溶质分布及表达式见图。 ①液体中溶质完全混合--偏析严重,左端纯化; ②液体中溶质完全不混合—比较符合实际凝固; ③液体中溶质部分混合。
f=c-p+1(←f=c-p+2,温度、压力) 自由度数是指在木改变系统平衡相的数目的条件厂,可独立改变
的,不影响(影响/决定体系状态)合金状态的因素(如温度、压 力、平衡相成分)的数目。
自由度数的最小值为零,f =0时发生恒温转变,例如纯金属结 晶、二元合金的三相平衡转变、三元合金的四相平衡转变等。
1
4( 3
h2 hk k 2 a2
)(
l c
)2
六方系
对复杂点阵(体心立方,面心立方等),要考虑晶面层数的增加。 体心立方(001)面之间还有一同类的晶面(002),因此间距减半。
1.2.4 晶体的极射赤面投影
通过投影图可将立体图表现于平面上。晶体投影方法很多, 包括球面投影和极射赤面投影。
不平衡凝固的冷速越快,平均成分线的偏离越大。合金内部成分
不均匀现象称为偏析,晶粒内部成分不均匀称为“晶内偏析”, 树
枝晶内的偏析称为“枝晶偏析”。生产中用扩散退火(均匀化退 火)
4.固溶体合金凝固时的溶质量分布 合金凝固时的溶质重新分布,导致宏观偏析和微观偏析并对 晶体的生长形态产生很大影响。 匀晶合金冷却时,固相浓度CS与液相浓度CL的比值K0= CS/CL, 称为平衡分配系数,如图示。 讨论图4.7水平放置的圆 棒容器中,合金液体的定
材料科学基础 第7章 其他类型的二元相图

其他类型的二元相图
1. 具有化合物的二元相图 2. 具有偏晶转变的相图 3. 具有合晶转变的相图 4. 具有熔晶转变的相图 5. 具有固态转变的二元相图
1. 具有化合物的二元相图
在某些二元系中,可形成一个或多个化合 物,化合物一般处于相图的中间位置,又称 为中间相(intermediate phase)。根据两 组元间形成化合物的稳定性,可分为:
复杂二元相图的分析方法
分析复杂二元相图的步骤和方法如下:
(1) 首先看相图中是否存在化合物,如有稳定化合物,则以这 些稳定化合物为界(把化合物视为组元),把相图分成几个区域 (基本相图)进行分析。(2)Biblioteka 根据相区接触法则,认清各相区的组成相。
组成二元相图的基本单元有单相区、两相区和三相水平线。这 些单元根据相区接触法则组合在一起。
(4) 应用相图分析典型合金的组晶过程和组织变化规 律。
单相区;相成分、质量与原合金相同。
双相区;在不同温度下两相成分沿相界线变化,各相 的相对量可由杠杆法则求得。
三相共存(平衡)时,三个相的成分固定不变,可用杠 杆法则求出恒温转变前、后相组成的相对量。
二元相图恒温转变类型
恒温转变类型
反应式
转变特征:是在一定温度下从一 个液相中同时分解出一个固相和 另一成分的液相的过程,且固相 的相对量总是偏多。 即:
L1→A+L2
3.具有合晶转变的相图
合晶转变(syntectic reaction)相图(图7.41)特点:二元 组在液态下有限溶解,存在不熔合线,不熔合线以下的两液相 L1和L2。
Mg-Si合金, 就能形成稳定化合物Mg2Si。Mg-Si合金相图 属于含有稳定化合物的相图。
在分析将整个Mg-Si相图可分为Mg-Mg2Si和Mg2Si-Si两个相图来进行分析
1. 具有化合物的二元相图 2. 具有偏晶转变的相图 3. 具有合晶转变的相图 4. 具有熔晶转变的相图 5. 具有固态转变的二元相图
1. 具有化合物的二元相图
在某些二元系中,可形成一个或多个化合 物,化合物一般处于相图的中间位置,又称 为中间相(intermediate phase)。根据两 组元间形成化合物的稳定性,可分为:
复杂二元相图的分析方法
分析复杂二元相图的步骤和方法如下:
(1) 首先看相图中是否存在化合物,如有稳定化合物,则以这 些稳定化合物为界(把化合物视为组元),把相图分成几个区域 (基本相图)进行分析。(2)Biblioteka 根据相区接触法则,认清各相区的组成相。
组成二元相图的基本单元有单相区、两相区和三相水平线。这 些单元根据相区接触法则组合在一起。
(4) 应用相图分析典型合金的组晶过程和组织变化规 律。
单相区;相成分、质量与原合金相同。
双相区;在不同温度下两相成分沿相界线变化,各相 的相对量可由杠杆法则求得。
三相共存(平衡)时,三个相的成分固定不变,可用杠 杆法则求出恒温转变前、后相组成的相对量。
二元相图恒温转变类型
恒温转变类型
反应式
转变特征:是在一定温度下从一 个液相中同时分解出一个固相和 另一成分的液相的过程,且固相 的相对量总是偏多。 即:
L1→A+L2
3.具有合晶转变的相图
合晶转变(syntectic reaction)相图(图7.41)特点:二元 组在液态下有限溶解,存在不熔合线,不熔合线以下的两液相 L1和L2。
Mg-Si合金, 就能形成稳定化合物Mg2Si。Mg-Si合金相图 属于含有稳定化合物的相图。
在分析将整个Mg-Si相图可分为Mg-Mg2Si和Mg2Si-Si两个相图来进行分析
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微分整理,得: 微分整理,
dG = −SdT +VdP + ∑µidni
µi =
∂G ∂ni T,P,r
(代表体系内物质传输的驱动力; 代表体系内物质传输的驱动力; 等温、 等温、等压及其它组元数量不变 的情况下,每增加单位摩尔i 的情况下,每增加单位摩尔 组 体系自由能的变化) 元,体系自由能的变化)
组织结构 相图 加工处理 特性 性能
相图热力学的基本要点
— 相平衡条件
设有一多元系,含组元 为 摩尔,组元2为 摩尔, 设有一多元系,含组元1为n1 摩尔,组元 为n2 摩尔 ……,则体系 , 吉布斯自由能 :
G = G(T, P, n1, n2,...)
(温度T、压力 、各组元物质量 i 的函数) 温度 、压力P、各组元物质量n 的函数)
相图提供的信息
某一成分的合金, 一定温度下 所处的状态、 某一成分的合金,在一定温度下,所处的状态、相组成 状态 合金在冷却过程中 发生了哪些反应或转变, 合金在冷却过程中,发生了哪些反应或转变,以及其开始与终了温度 冷却过程 一定成分的合金,在室温下具有什么样的平衡组织, 一定成分的合金,在室温下具有什么样的平衡组织,可以根据组织与 平衡组织 性能的关系,预测材料的性能 性能的关系,预测材料的性能 相图与材料的加工工艺性能 如流动性) 相图与材料的加工工艺性能(如流动性)存在一定的对应关系 新材料研发、材料加工过程中 过程中, 在新材料研发、材料加工过程中,都起着十分重要的作用
相图热力学的基本要点
— 吉布斯相律 Gibbs phase rule
相律:在平衡条件下,一个系统的组元数、相数、 相律:在平衡条件下,一个系统的组元数、相数、自由度数之
间的关系规律,相律的数学表达式: 间的关系规律,相律的数学表达式:
f =C–P+2
f — 系统的自由度数 Degrees of freedom, 即不影响系统状态的条件下,能 即不影响系统状态的条件下, 够独立可变参数的数目, 温度、压力、 够独立可变参数的数目,如:温度、压力、成分参数的数目 C — 组成物的组元数,即系统组成物质的个数。例如:纯水系统,C = 1; 组成物的组元数,即系统组成物质的个数。例如:纯水系统, ;
第六章 二元相图
Binary phase diagrams
基本概念
组元 Component:指组成合金的最简单、最基本、能够独立存在的物质, 指组成合金的最简单、最基本、能够独立存在的物质,
是组成一个系统的基本单元 例如,单质(元素)、 基本单元, )、化合物 是组成一个系统的基本单元,例如,单质(元素)、化合物 两个或 元素或化合物( ),按不同比例配 合金 Alloy:指由两个或两个以上元素或化合物(组元),按不同比例配 :指由两个 两个以上元素或化合物 组元), 制的一系列不同成分的材料体系
质量分数(重量百分数) 质量分数(重量百分数)wt. % 摩尔分数(原子百分数) 摩尔分数(原子百分数)at. %
二元相图的建立
一种,是利用已有的热力学参数,通过热力学计算和分析建立相图 一种,是利用已有的热力学参数,通过热力学计算和分析建立相图 热力学计算和分析 另一种,是依靠实验的方法建立相图, 另一种,是依靠实验的方法建立相图,几乎所有的相图都是通过实 实验的方法建立相图 验得到的,最常用的是热分析法、还有热膨胀法、 验得到的,最常用的是热分析法、还有热膨胀法、电阻法 热分析法 热膨胀法
单元系统(C = 1) )
相律分析: 自由度数f 相律分析:(自由度数 最小值 = 0,意味着保持系统平衡状态不变的条件下,没 ,意味着保持系统平衡状态不变的条件下,
有可以独立变化的变量,即任何变量的变化都会造成系统平衡状态的变化) 有可以独立变化的变量,即任何变量的变化都会造成系统平衡状态的变化) — 压力不变条件下,f = C – P + 1 = 2 – P,当f = 0 时,则P = 2,表明: 压力不变条件下, ,表明: 单元系统最多只能有二相同时存在 — 压力变化条件下, f = C – P + 2 = 3 – P,当f = 0时,则P = 3,表明: 压力变化条件下, 时 ,表明: 单元系统最多可以有三相共存
材料组成的层次
组元
加一点盐 完全溶解
相
加盐过量 过饱和
材料体系
纯水 相:1个 个 组元: 组元:H2O
NaCl水溶液 水溶液 相:1个 个 组元: 组元:H2O、NaCl 、
NaCl过饱和溶液 过饱和溶液 相:2个 个 组元: 组元:H2O、NaCl 、
组元、 组元、相的关系
相图
Phase diagram
— 单元、二元、三元相图 单元、二元、
是一个材料系统在不同的化学成分 温度、压力条件下所处 成分、 相图 :是一个材料系统在不同的化学成分、温度、压力条件下所处 状态的图形表示,也称为状态图。由于相图都是在平衡条件( 状态的图形表示,也称为状态图。由于相图都是在平衡条件(极缓 状态图 慢冷却)下测得的,相图也称为平衡 状态) 平衡( 慢冷却)下测得的,相图也称为平衡(状态)相图
a、b 之间(0˚C~100 oC): = 1,故f = 1,即 、 之间( ):P ): , ,
只能以单相(液相)的形式存在,说明在此范围 只能以单相(液相)的形式存在, 内温度的变化不会引起状态的改变
二元系统(C = 2) )
— 压力不变 相律分析: 相律分析:
如果P 如果 = 3,则 f = 0。说明,当二元合金系统同时出现三个相时, , 。说明,当二元合金系统同时出现三个相时, 就没有可以变化的因素了,即只有确定温度 成分条件下 确定温度、 条件下, 就没有可以变化的因素了,即只有确定温度、成分条件下,才会出 相同时存在的状态 现3 相同时存在的状态 二元合金系统3 相共存状态时 温度不能变化, 状态时, 二元合金系统 相共存状态时,温度不能变化,发生的平衡反应都 等温过程,并且反应中的三个相(无论是反应相,还是生成相) 是等温过程,并且反应中的三个相(无论是反应相,还是生成相) 化学成分都是固定的
α α β β dG = dGα + dGβ = µ2 dn2 + µ2 dn2
由于 故
α β − dn2 = dn2
β α β dG = µ2 − µ2 dn2
(
)
因此,组元 从 的条件是: 因此,组元2从α 相自发转到β 相的条件是:
β α β dG = µ2 − µ2 dn2 < 0 α 即, 2 − µ2 < 0 µβ
例如:纯水的 相图( 大气压下 大气压下) 例如:纯水的PT 相图(1大气压下)
a点(0 oC): = 2, 故f = 0,即恒温下,可以 点 ):P ): , ,即恒温下,
保持液(水 二相共存, 保持液 水) – 固(冰)二相共存,液 – 固平衡点 冰 二相共存 b点(100 oC): P = 2,故f = 0,气 – 液二相平 点 ): , , 衡点,意义与a 衡点,意义与 点相似
L L
β γ α µC = µC = µC = L = µC L P
相平衡条件:处于平衡状态下的多相( 个相 体系, 个相) 相平衡条件:处于平衡状态下的多相(P个相)体系,每个组
共有C个组元 在各相中的化学势都必须彼此相等。 个组元) 元(共有 个组元)在各相中的化学势都必须彼此相等。这就决定 了平衡状态下的多元系,其中可能存在的相数将有一定的限制。 了平衡状态下的多元系,其中可能存在的相数将有一定的限制。
对于盐水来说,由于水中含有NaCl,所以 = 2 对于盐水来说,由于水中含有 ,所以C
P — 系统中能够同时存在的相(如:固相、液相、α相等)数 系统中能够同时存在的相( 固相、 液相、 相等 2 — 表示温度、压力两个变量 表示温度、
对于绝大多数常规材料系统,压力的影响极小,可不当作变量,当 对于绝大多数常规材料系统,压力的影响极小,可不当作变量, 作常量( ),因此 作常量(1 atm),因此,自由度数减少一个,相律表达式变为: ),因此,自由度数减少一个,相律表达式变为: f =C–P+1
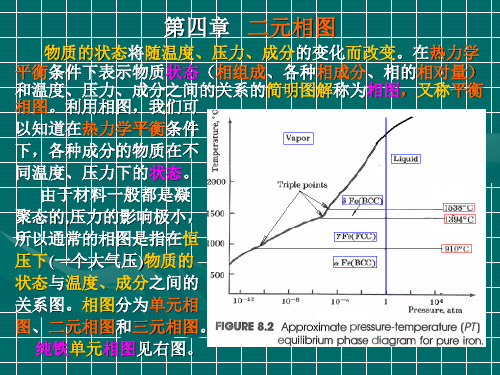
相图( 纯Fe相图(温度-压力) 相图 温度-压力)
Cu-Ag相图(温度 成分) 相图(温度-成分 成分) 相图
三元相图(温度-成分) 三元相图(温度-成分)
单组元相图:成分单一的纯物质,由于没有成分的变化,一般采用温 单组元相图:成分单一的纯物质,由于没有成分的变化,一般采用温 度-压力相图 压力相图 合金相图:对于常用的合金相图,因为压力的影响很小(常规定1 合金相图:对于常用的合金相图,因为压力的影响很小(常规定1个 大气压),不再把压力当作变量考虑,而采用温度 ),不再把压力当作变量考虑 温度大气压),不再把压力当作变量考虑,而采用温度-成分相图
(
)
当dG = 0,即 , 有物质传输。 有物质传输。
β α µ2 = µ2
相处于平衡状态, ,α 相和β 相处于平衡状态,此时体系内没
同理,其它组元也应有同样的属性 同理, 对于多元系的多相平衡条件可普遍写成: 对于多元系的多相平衡条件可普遍写成:
β γ α L P µ1 = µ1 = µ1 =L = µ1 β γ α L P µ2 = µ2 = µ2 =L = µ2
组元i 的化学势: 组元 的化学势: 偏摩尔自由能) (偏摩尔自由能)
j ≠i
如果某组元在各相中的化学势相同,就没有物质的传输, 如果某组元在各相中的化学势相同,就没有物质的传输,体系处于平衡状态
若体系包含有α,β,……相,对每个相自由能的微分式可写成: 相 对每个相自由能的微分式可写成:
α α α α dGα = −SαdT +VαdP + µ1 dn1 + µ2 dn2 +L L
β β dGβ = −Sβ dT +V β dP + µ1 dnβ + µ2 dnβ +L L 1 2
