2013届高三化学一轮复习课件:第一章热点专题整合(人教版)
合集下载
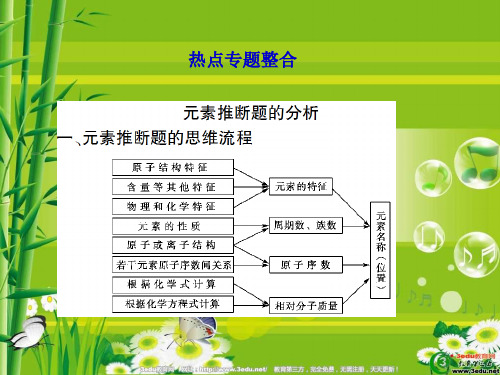
2013届高考化学第一轮考点总复习课件28

mL×溶液的密度(g·cm-3)×溶质的质量分数
溶质摩尔质量( g·mol-1)×1 L
(2)析出无机盐溶质的计算方法通常使用 差量法
①在某温度下的饱和溶液,蒸发溶剂后 析出晶体(无结晶水)
析 溶②出 剂饱晶 减和体 少质 质溶量 量液升 1高0S0温度后重新达到饱和需
要增加溶质(无结晶水)
4.胶体
(1)胶体的主要性质
丁达尔现象:光束通过胶体时,形成光亮 的“通路”的现象。这是由于胶粒对光的 散射而形成的,可用于鉴别胶体与溶液。
(2)胶体的应用
胶体凝聚沉降是解释制豆腐、江河入海口 处形成的三角洲、明矾净水、除尘器等的 原理。
(考查胶体的知识)
下列关于胶体和溶液的说法中,正确的是
Mg2+(aq)+2OH-(aq)
(3)溶解能力:易溶、可溶、微溶、难溶。
(4) 溶质的质量分数= 溶
溶质的质量(g) 溶液的质量(g)
×100%
液 浓
溶质的物质的量(mol) 物质的量浓度(mol·L-1)= 溶液的体积(L)
度 物质的量浓度与溶质质量分数的换算关系
物质的量浓度
c1=000
象
象
沉淀 层
分离方法 蒸发、结晶 渗析、盐析 过滤 分液
2.溶液
溶质:被溶解的物质,可以是
气体、液体或固体 (1)溶液的组成 溶剂:能溶解物质的物质,常
用的溶剂是水
动态平衡:在一定温度下固体
物质在液态溶剂里当溶解速率
(2)溶解过程
和结晶速率相等形成饱和溶液 的状态(动态平衡)
表示方法:Mg(OH)2(s噲垐) ??
增加溶质质量 新饱和溶液的质量
S高温 100 S低ຫໍສະໝຸດ S高温3.关于溶液的计算方法
【走向高考】2013高考化学一轮总复习 2-1物质的分类课件 新人教版(必修部分)

答案:A
8.(1)根据交叉分类法,请用斜线将下面框图的盐与盐的 分类连接起来。 KHS 钠盐 NaCl 酸式盐 NaHSO4 无氧酸盐 Na2CO3 含氧酸盐
(2)现有下列物质:A.豆浆 酸 碳 E.氢氧化钠固体 I.水 J.H2SO4
B 食盐水
C.铁
D.稀硫 H.二氧化
F.纯碱固体
G.泥水
请将它们的序号填充到下列横线上。 溶液 混合物胶体 浊液 单质 物质 酸 碱 纯净物 化合物盐 氧化物
走向高考· 化学
人教版 ·高考一轮总复习
路漫漫其修远兮 吾将上下而求索
第一部分 必修部分
第二章
化学物质及其变化
第二章
第一节 物质的分类
核心知识图
课堂师生互动 方法警示探究
自主复习
备选习题
自主评估
课后强化作业
核心知识图
命题预测
本节重点知识为物质的分类方法,胶棒的性质及应用。 主要考查常见物质的所属类别,单质、氧化物、酸、碱、盐 的相互转化关系,胶体的性质、制备及应用,2014 年高考对 胶体的考查可能在与生产、生活实际相联系的试题中,对物 质分类的考查会分散在其他试题中,单独考查的可能性很小。
A.
B.
C.
D.
解析:本题考查物质的分类。B 选项错误,置换反应一定 是氧化还原反应;C 选项错误,分解反应也可能是氧化还原 反应;D 选项错误,置换反应一定是氧化还原反应,离子反 应也可能是非氧化还原反应。
答案:A
2.下表中对相关物质的分类全部正确的一组是( 编号 A B C D 纯净物 明矾 混合物 弱电解质 蔗糖 NaHCO3 SO2 H2SiO3 H2CO3 非电解质 CO2 CH3CH2OH Cl2 CH4
2013届高考化学热点专题整合复习课件5
(填元素符号);
(2)A与B形成的化合物中,含非极性键的化合物的结构式为 ________;
(3)D 、 E 所 形 成 氢 化 物 的 稳 定 性 由 强 到 弱 的 顺 序 是 ______________(填具体的化学式);
(4)写出工业上制E单质的化学方程式_____________________
【精讲精析】 Z原子最外层电子数是X原子内层电子数的3倍, X原子内层应为2个电子,Z原子最外层电子数为6个,根据题 意,Z应在第3周期,所以Z为S。Z原子最外层电子数为Y原子 最外层电子数的3倍,且Y、Z同周期,Y为Mg。根据最外层电 子数之和为13,X为N。逐项分析,不难得知答案。 【答案】 A
题型二 利用特殊分子的电子数和结构推断 1.核外电子数相等的微粒
10 电子微粒
①分子:CH4、NH3、H2O、HF、Ne ②阴离子:N3-、O2-、F-、OH-、NH- 2 ③阳离子:Na+、Mg2+、Al3+、H3O+、NH+ 4
18 电子微粒
①分子:SiH4、PH3、H2S、HCl、Ar、F2、
【精讲精析】 10 电子含氢化合物或离子有 CH4、NH3、H2O、 HF、NH+ 4 、OH-、H3O+,他们之间可发生的反应有 OH-+NH+ 4
==△===NH3↑+H2O,OH-+H3O+
2O,NH3+H3O+ ===NH+ 4
+H2O,再根据 3 个反应可推知 A 为 OH-,B 为 NH+ 4 ,C 为 H2O, D 为 NH3,E 为 H3O+。
组成中均有氢,且电子总数均为 10 个,A 是双原子的阴离子。根据
下列变化,写出微粒的化学式及 B 微粒的空间构型。
①A+B==△===C+D↑,②C+
A+E,③D+E===B+C
(2)A与B形成的化合物中,含非极性键的化合物的结构式为 ________;
(3)D 、 E 所 形 成 氢 化 物 的 稳 定 性 由 强 到 弱 的 顺 序 是 ______________(填具体的化学式);
(4)写出工业上制E单质的化学方程式_____________________
【精讲精析】 Z原子最外层电子数是X原子内层电子数的3倍, X原子内层应为2个电子,Z原子最外层电子数为6个,根据题 意,Z应在第3周期,所以Z为S。Z原子最外层电子数为Y原子 最外层电子数的3倍,且Y、Z同周期,Y为Mg。根据最外层电 子数之和为13,X为N。逐项分析,不难得知答案。 【答案】 A
题型二 利用特殊分子的电子数和结构推断 1.核外电子数相等的微粒
10 电子微粒
①分子:CH4、NH3、H2O、HF、Ne ②阴离子:N3-、O2-、F-、OH-、NH- 2 ③阳离子:Na+、Mg2+、Al3+、H3O+、NH+ 4
18 电子微粒
①分子:SiH4、PH3、H2S、HCl、Ar、F2、
【精讲精析】 10 电子含氢化合物或离子有 CH4、NH3、H2O、 HF、NH+ 4 、OH-、H3O+,他们之间可发生的反应有 OH-+NH+ 4
==△===NH3↑+H2O,OH-+H3O+
2O,NH3+H3O+ ===NH+ 4
+H2O,再根据 3 个反应可推知 A 为 OH-,B 为 NH+ 4 ,C 为 H2O, D 为 NH3,E 为 H3O+。
组成中均有氢,且电子总数均为 10 个,A 是双原子的阴离子。根据
下列变化,写出微粒的化学式及 B 微粒的空间构型。
①A+B==△===C+D↑,②C+
A+E,③D+E===B+C
高考化学一轮总复习第一章高考热点课1课件

答案 √
Байду номын сангаас
12/11/2021
第二十八页,共三十三页。
解析 答案
判断正误,正确的画“√”,错误的画“×”,并指明错因。 (1)5.6 g 铁粉与硝酸反应失去的电子数一定为 0.3NA。( × ) 错因:当铁粉过量时生成 Fe2+。 (2)0.1 mol Zn 与含 0.1 mol HCl 的盐酸充分反应,转移的电子数目为 0.2NA。( × ) 错因:盐酸不足,Zn 不能完全反应。
12/11/2021
第十六页,共三十三页。
(4)1 L 1.0 mol·L-1 的 NaAlO2 水溶液中含有的氧原子数为 2NA。( × ) 错因:水溶液中溶剂 H2O 中也含有氧原子。
12/11/2021
第十七页,共三十三页。
记“隐含”,突破陷阱
(1)隐含“可逆反应”
2SO2+
催化剂 O2 △ 2SO3,2NO2
解析 答案
(2)(2015·全国卷Ⅰ)过氧化钠与 H2O 反应,生成 0.1 mol 氧气转移电子数 为 0.2NA。( )
解析 2Na2O2+2H2O===4NaOH+O2↑,Na2-O12―→Na-O2H+O0 2,Na2O2 中氧元素化合价-1→-2,化合价降低 1,化合价-1→0,化合价升高 1,故 生成 0.1 mol O2 转移 0.2NA 电子,故正确。
12/11/2021
第七页,共三十三页。
判断下列说法是否正确 (1)(2018·全国卷Ⅰ)92.0 g 甘油(丙三醇)中含有羟基数为 1.0NA。( )
解析 1 分子丙三醇含有 3 个羟基,92.0 g 丙三醇的物质的量是 1 mol, 其中含有羟基数是 3NA,错误。
答案 ×
Байду номын сангаас
12/11/2021
第二十八页,共三十三页。
解析 答案
判断正误,正确的画“√”,错误的画“×”,并指明错因。 (1)5.6 g 铁粉与硝酸反应失去的电子数一定为 0.3NA。( × ) 错因:当铁粉过量时生成 Fe2+。 (2)0.1 mol Zn 与含 0.1 mol HCl 的盐酸充分反应,转移的电子数目为 0.2NA。( × ) 错因:盐酸不足,Zn 不能完全反应。
12/11/2021
第十六页,共三十三页。
(4)1 L 1.0 mol·L-1 的 NaAlO2 水溶液中含有的氧原子数为 2NA。( × ) 错因:水溶液中溶剂 H2O 中也含有氧原子。
12/11/2021
第十七页,共三十三页。
记“隐含”,突破陷阱
(1)隐含“可逆反应”
2SO2+
催化剂 O2 △ 2SO3,2NO2
解析 答案
(2)(2015·全国卷Ⅰ)过氧化钠与 H2O 反应,生成 0.1 mol 氧气转移电子数 为 0.2NA。( )
解析 2Na2O2+2H2O===4NaOH+O2↑,Na2-O12―→Na-O2H+O0 2,Na2O2 中氧元素化合价-1→-2,化合价降低 1,化合价-1→0,化合价升高 1,故 生成 0.1 mol O2 转移 0.2NA 电子,故正确。
12/11/2021
第七页,共三十三页。
判断下列说法是否正确 (1)(2018·全国卷Ⅰ)92.0 g 甘油(丙三醇)中含有羟基数为 1.0NA。( )
解析 1 分子丙三醇含有 3 个羟基,92.0 g 丙三醇的物质的量是 1 mol, 其中含有羟基数是 3NA,错误。
答案 ×
2013届高考化学第一轮配套复习(1)

89
整理课件90整理课件 Nhomakorabea91
整理课件
92
整理课件
93
整理课件
94
整理课件
95
45
整理课件
46
整理课件
47
整理课件
48
整理课件
49
整理课件
50
整理课件
51
整理课件
52
整理课件
53
整理课件
54
整理课件
55
整理课件
56
整理课件
57
整理课件
58
整理课件
59
整理课件
60
整理课件
61
整理课件
62
整理课件
63
整理课件
64
整理课件
65
整理课件
66
整理课件
67
整理课件
68
整理课件
69
整理课件
70
整理课件
71
整理课件
72
整理课件
73
整理课件
74
整理课件
75
整理课件
76
整理课件
77
整理课件
78
整理课件
79
整理课件
80
整理课件
81
整理课件
82
整理课件
83
整理课件
84
整理课件
85
整理课件
86
整理课件
87
整理课件
88
整理课件
整理课件
24
整理课件
25
整理课件
26
整理课件
27
整理课件
28
整理课件
2013届高三化学一轮复习课件:12.1化学实验的常用仪器和基本操作(人教版)

使用 仪器
药匙 (或纸槽)
镊子
托盘 天平
用试剂 瓶倾倒
3.物质的溶解 (1)固体的溶解 搅拌 一般在烧杯中进行,为了加速溶解,常采用研细、_____、振 荡或_____等措施。 加热
(2)液体的溶解
量筒 一般先用_____分别量取一定量的溶质和溶剂,然后先后倒入 烧 杯 里 搅 拌 而 溶 解 , 但 对 于 浓 H2SO4 的 溶 解 , 一 定 要 将 浓H2SO4 水 搅拌 __________缓缓倒入___中,并且边倒边______。
一、常见化学仪器及使用方法
1.可加热的仪器
(1)直接加热仪器 试管 向下倾斜
玻璃棒
圆底烧瓶
锥形瓶
烧杯
量筒
0.1
容量瓶
引流
酸式滴定管
酸
强氧化 碱
0.01
碱式滴定管
0.01
小烧杯
物品 砝码 0.1 温度计 支管口
3.分离提纯仪器 仪器图形与名称 主要用途 使用方法和注意事项
①可用于试剂注入; 贴 ①漏斗加滤纸后, 过滤时注意“一___、 低 靠 二___、三___” 可过滤液体 ②长颈漏斗用于 ②装配气体发生装置 装配气体发生装 时,应将长颈漏斗颈 插入液面下 口____________,防止 置 气体逸出
③量筒、滴定管、分液漏斗、长颈漏斗、容量瓶等仪器在使用 前必须检验是否漏水 ④烧瓶、坩埚、烧杯等仪器均可直接在酒精灯上灼烧 ⑤用温度计测量出酒精的沸点为78.5 ℃ 【答案】 (1)②⑤⑥ (2)⑤
二、化学基本操作 1.玻璃仪器的洗涤 (1)洗净标准 成股流下 玻璃内壁附着均匀的水膜,不聚滴,也不__________。 (2)常见附着物的洗涤 不易用水清洗的物质,根据其性质选不同的洗涤剂将其溶解, 然后再用水洗。例如:
2013届高考化学第一轮考点总复习课件64

递减
递增 逐渐变难 逐渐减弱
12
•
•
2.元素的金属性与非金属性比较
从结构上理解元素的金属性与非金属性 递变规律:同主族元素的原子从上到下原子 半径依次递增,核对电子的吸引能力依次递 减,失电子能力增强,得电子能力减弱,即 金属性逐渐增强,非金属性逐渐减弱;同周 期元素(稀有气体除外)的原子从左到右原 子半径依次递减,核对电子的吸引能力依次 递增,得电子能力增强,失电子能力减弱, 即非金属性逐渐增强,金属性逐渐减弱。 13
3
• • •
基础知识回顾 一、元素周期律 1.定义:元素的 性质 随 核电荷数(或原 。 •子序数) 的递增而呈 周期性 变化的规律称元 素周期律。 • 2.元素周期律的实质:元素原子 。 核外电 • 的周期性变化。 子排布 4
3.元素周期律的具体内容: (1)原子核外电子排布的变化规律: 除H、He元素外,最外电子层上的电子数 重复出现 递增到 的变化。 8 1 • (2)原子半径变化规律:同周期,随 核电荷数(或原子序数)的 ,原子 递增 半径 递减 • ,同主族,随核电荷数(或原子序 递增 递增 数)的 ,原子半径 。(稀有气 体元素原子的半径由于测定方法不同除 外。) 5
Байду номын сангаас
• • •
二、元素周期表及其应用 1.元素周期表的编排
电子层数 • ②将 相同的元素从左到右排成 一横行; 最外层电子数 • ③把 相同的元素按电子层 数递增的顺序从上到下排成纵行。 8
;
①按 原子序数 递增的顺序从左到右排列
• •
2.周期表的结构(横七竖“十八”) (1)周期:在元素周期表中每一横行称为 一个 周期 ,7个横行为 7 个周期。短周 期指 三个周期;长周期指 1、 2、 3 4、 5、 6 三个周期;第 周期未排满,称作不完全周 7 期。 16 7 • (2)族:18个纵行,共 个族: 个主族 7 个副族、 1 个第Ⅷ族, 1 个零族,第 18 。 、 8、9、10 三个纵行为第Ⅷ族 • 纵行为零族;第 。 9
2013届高考化学第一轮配套复习课件26

②加成反应 与H2反应的化学方程式为: ________________________________。 ③氧化反应 a . 可 燃 性 : ________________________________( 火 焰 明 亮 , 有浓烟)。 b.苯不能被酸性 KMnO4溶液氧化,所以将苯加 入酸性KMnO4溶液中,溶液不褪色。
乙炔与H2反应的化学方程式为:__________________, 乙炔与HCl反应的化学方程式为:__________________。 (4)实验室制法 CaC2+2H2O―→Ca(OH)2+CH≡CH↑(CaC2又叫电石)。
2.炔烃 (1) 概念:分子里含有 ________ 的一类脂肪烃, 称为炔烃。 (2)通式:________________(n≥2,n∈N)。 (3) 物理性质:炔烃的物理性质一般随着分子里 碳原子数的增多而呈现规律性的变化,如沸点 随分子里碳原子数的增加而 ________ ,相对密 度逐渐________。 (4) 化学性质:与乙炔相似,容易发生 ________ 反应、________反应等,能使溴水及酸性KMnO4 溶液褪色。
四、芳香烃 1.苯 (1) 组成和结构:苯的分子式为 ________ ,结构 简式为 ________ ,分子构型是 ________ , 12 个 原子 ________ ,其中六个碳原子构成 ________ , 所以苯分子中键角是 ________ ,碳原子为 sp2 杂 化,苯分子中的碳碳键是介于单键、双键之间 的一种独特的键。 (2) 物理性质:通常情况下,苯是 ________ 态, 有特殊气味,有毒,不溶于水,密度比水 ________,挥发性:________。
基础回扣 一、烷烃 1.概念:分子里碳原子之间都以 ________连接 成链状,碳原子其余的价键全部跟 ________ 结 合而得到的烃,叫做烷烃。 2.结构特点:①单键,②饱和,③链状。 3.通式:________(n≥1,n∈N)。
2013届高考化学第一轮配套复习课件13

(2)离子晶体:由________和________通过 ________结合而成的晶体。
2.决定离子晶体结构的因素
(1)几何因素:________________。
(2)电荷因素:即正负离子________。
(3)键性因素:离子键的________。
3.一般物理性质
一般地说,离子晶体具有较高的________点和 ________点,较大的________。这些性质都是 因为离子晶体中存在着________。若要破坏这 种作用需要________________。
对称性
有
熔点
________
非晶体
内部原子或分子的排 列________
________
________ 无
不固定
2.晶胞
(1)定义:在晶体微观空间里取出一个 ________________,这个描述晶体________ 的基本单元叫做晶胞。
(2)结构:一般来说,晶胞都是________,晶胞 只是晶体微观空间里的一个基本单元,在它的 上下左右前后无隙并置地排列着无数个晶胞, 而且所有晶胞的形状及其内部的________、 ________及________________是完全相同的 。
六、晶格能 1. 定 义 ________ 形 成 1 摩 离 子 晶 体 _______ 的 能 量 , 单 位 _______, 通 常 取 ________。 2. 大 小 及 其 他 量 的 关 系 (1)晶 格 能 是 最 能 反 映 离 子 晶 体 ________的 数 据 。 (2)在 离 子 晶 体 中 , 离 子 半 径 越 ________, 离 子 所 带 的 电 荷 数 越 ________, 则 晶 格 能 越 大 。 (3)晶 格 能 越 大 , 阴 、 阳 离 子 间 的 离 子 键 就 越 _______, 形 成 的 离 子 晶 体 就 越 ____, 而 且 熔 点 越 _____, 硬 度 越 _____。
2.决定离子晶体结构的因素
(1)几何因素:________________。
(2)电荷因素:即正负离子________。
(3)键性因素:离子键的________。
3.一般物理性质
一般地说,离子晶体具有较高的________点和 ________点,较大的________。这些性质都是 因为离子晶体中存在着________。若要破坏这 种作用需要________________。
对称性
有
熔点
________
非晶体
内部原子或分子的排 列________
________
________ 无
不固定
2.晶胞
(1)定义:在晶体微观空间里取出一个 ________________,这个描述晶体________ 的基本单元叫做晶胞。
(2)结构:一般来说,晶胞都是________,晶胞 只是晶体微观空间里的一个基本单元,在它的 上下左右前后无隙并置地排列着无数个晶胞, 而且所有晶胞的形状及其内部的________、 ________及________________是完全相同的 。
六、晶格能 1. 定 义 ________ 形 成 1 摩 离 子 晶 体 _______ 的 能 量 , 单 位 _______, 通 常 取 ________。 2. 大 小 及 其 他 量 的 关 系 (1)晶 格 能 是 最 能 反 映 离 子 晶 体 ________的 数 据 。 (2)在 离 子 晶 体 中 , 离 子 半 径 越 ________, 离 子 所 带 的 电 荷 数 越 ________, 则 晶 格 能 越 大 。 (3)晶 格 能 越 大 , 阴 、 阳 离 子 间 的 离 子 键 就 越 _______, 形 成 的 离 子 晶 体 就 越 ____, 而 且 熔 点 越 _____, 硬 度 越 _____。
高三化学一轮复习 第一章热点专题整合课件 新人教

X3Ny,~,y2N2,1,,y2,3x+21.45ygg/mol,,220.4.5L6/Lmol) 1∶y2=3x+214.5ygg/mol∶220.4.5L6/Lmol 讨论:y 只能取正整数,若 y=1,x=12,无解。 若 y=2,x=24,符合,则化合物 A 为 Mg3N2。
【答案】 Mg3N2
1.(2011·全国新课标高考)0.80 g CuSO4·5H2O样品受热脱水过 程的热重曲线(样品质量随温度变化的曲线)如图所示。
请回答下列问题: (1)试确定200 ℃时固体物质的化学式________(要求写出推断 过程); (2)பைடு நூலகம்270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉 末和一种氧化性气体,该反应的化学方程式为_______。
把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,
该晶体的化学式为________,其存在的最高温度是________。
【解析】 (1)根据差量大小可确定 200 ℃时,样品失去部分水 n(CuSO4·5H2O)=3.2×10-3mol
CuSO4·5H2O, =20=0==℃= CuSO4·(5 - n)H2O + ,nH2O,1 mol,,18n g,3.2×10-3 mol,,(0.80-0.57)g)
此法的关键是正确找出方程式中的差量(理论差)和发生反应的 差量(实际差),然后列比例求解。
(2011·重庆高考改编)2.5 g氮的金属化合物A,通过系列反应理 论上可得0.56 L(标准状况)N2,则A的化学式为________。
【精讲精析】 设该化合物的化学式为 X3Ny,X 的相对原子质 量为 x,则:
B.处理废水中 Cr2O27-的物质的量为n2xmol
C.反应中发生转移的电子数为 3nx mol
【答案】 Mg3N2
1.(2011·全国新课标高考)0.80 g CuSO4·5H2O样品受热脱水过 程的热重曲线(样品质量随温度变化的曲线)如图所示。
请回答下列问题: (1)试确定200 ℃时固体物质的化学式________(要求写出推断 过程); (2)பைடு நூலகம்270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉 末和一种氧化性气体,该反应的化学方程式为_______。
把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,
该晶体的化学式为________,其存在的最高温度是________。
【解析】 (1)根据差量大小可确定 200 ℃时,样品失去部分水 n(CuSO4·5H2O)=3.2×10-3mol
CuSO4·5H2O, =20=0==℃= CuSO4·(5 - n)H2O + ,nH2O,1 mol,,18n g,3.2×10-3 mol,,(0.80-0.57)g)
此法的关键是正确找出方程式中的差量(理论差)和发生反应的 差量(实际差),然后列比例求解。
(2011·重庆高考改编)2.5 g氮的金属化合物A,通过系列反应理 论上可得0.56 L(标准状况)N2,则A的化学式为________。
【精讲精析】 设该化合物的化学式为 X3Ny,X 的相对原子质 量为 x,则:
B.处理废水中 Cr2O27-的物质的量为n2xmol
C.反应中发生转移的电子数为 3nx mol
2013届新课标高考化学一讲义轮总复习课件:第1单元第2讲氧化还原反应

(1)常见氧化剂
①活泼的非金属,如Cl2、Br2、O2等。
②元素(如Mn、Fe等)处于高化合价的氧化物,
如MnO2、Fe2O3等。
③元素(如S、N等)处于高化合价时的含氧酸,
如浓H2SO4、HNO3等。
④元素(如Mn、Cl、Fe等)处于高化合价时的盐
,如KMnO4、KClO3、FeCl3等。
⑤过氧化物,如Na2O2、H2O2等。
19
(考查氧化还原反应规律的运用) G、Q、X、Y、Z均为氯的含氧化合物, 不了解它们的化学式,但知道它们在一定 条件下具有如下转换关系(未配平)(四个 反应中氯元素化合价均有变化):
(1)GQ+NaCl
(2)Q+H2OX+H2 (3)Y+NaOHG+Q+H2O (4)Z+NaOHQ+X+H2O
20
5
3.在氧化还原反应中,除了遵 循质量守恒定律,在反应前后原 子的种类与个数不发生变化以外 ,反应过程中电子得失的总数或 化合价升降的总数也守恒。
6
重点知识归纳 1.氧化还原反应的基本概念 氧化还原反应的本质是有电子转移(电 子得失或共用电子对偏移),表现的特征 是化合价的升降。相互关系如下:
7
9
注意:箭头不是表明电子的直接转移关系 ,而是表明同一元素在反应前后得失电 子情况,氧化剂箭头所指向的产物为还 原产物,还原剂箭头所指向的产物为氧 化产物。在2e-前一定要注明“得”“失”字 样。
10
失电子,化合价升高,被氧化
还原剂 + 氧化剂
氧化产物 + 还原产物
得电子,化合价降低,被还原
得2e-
2CO2↑+2H2O
2013届高考化学第一轮配套复习课件34

2.下列离子方程式中,属于水解反应的是( A.HCOOH+H2O B.CO2+H2O
2- C.CO3 +H2O
)
HCOO +H3O
-
+
+ HCO- 3 +H - HCO- + OH 3
D.HS-+H2O
[答案]C
S2-+H3O+
3.在 0.5 mol/L 的 NaHSO3 溶液中滴入石蕊,溶液变红, 试回答有关问题: (1)该溶液中 HSO3 的电离程度________(填“大于”、 “小 于”或“等于” )HSO- 3 的水解程度。
2
基础回扣 一、盐类水解的基本概念 1.定义 在溶液中盐电离出来的离子跟水电离出的 H +或 OH-结合生成弱电解质的反应。 2.实质 水解反应破坏了水的电离平衡, ________ 了水 的电离,使溶液显示不同程度的酸、碱性。
3.特点 (1)水解反应通常很微弱,存在水解平衡。 (2) 水 解 反 应 是 ________ 反 应 的 逆 反 应 , 是 ________反应。
课堂探究
考点突破
课堂反馈
课时作业
课 堂 探 究
条 分 缕 析· · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · 各 个 击 破
解读考纲 考点
考纲解读
1
1.了解盐类水解的原理是促进了 水的电离,会书写水解的离子方 盐类水解原 程式。 理及其应用 2.能够分析影响盐类水解程度的 外界因素。 3.了解盐类水解的主要应用。 离子浓度大 能够应用电离、水解等知识,比 小比较 较水溶液中离子浓度的大小。
2 (2)溶液中 Na 、HSO3 、 H 、OH 、 H2SO3、SO3 等粒子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【答案】
Mg3N2
பைடு நூலகம்
1.(2011·全国新课标高考)0.80 g CuSO4·5H2O样品受热脱水 过程的热重曲线(样品质量随温度变化的曲线)如图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式________(要求写出推断
过程); (2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉
3.电子守恒 电子守恒法解题的步骤是:首先找出氧化剂、还原剂及其物质
的量以及每摩尔氧化剂、还原剂得失电子的物质的量,然后根
据电子守恒列出等式:氧化剂的物质的量×每摩尔氧化剂得电 子数=还原剂的物质的量×每摩尔还原剂失电子数,利用这一 等式,解氧化还原反应计算题,可化难为易,化繁为简。
4.电荷守恒法 电荷守恒法主要指阴离子带的负电荷总数等于阳离子带的正电 荷总数。常见的电荷守恒有以下几种情况: (1)化合物化学式中存在的电中性原则(正负化合价代数和为零)。
(2)离子反应中的电荷守恒(反应前后电荷数相等)。
(3)电解质溶液中存在的电荷守恒(阴、阳离子电荷守恒)。
(2011· 纲 高 考 ) 某 含 铬 (Cr2O 2- ) 废 水 用 硫 酸 亚 铁 铵 大 7 [FeSO4· 4)2SO4· 2O]处理,反应中铁元素和铬元素完全转化为沉 (NH 6H 淀。该沉淀经干燥后得到 n mol FeO· yCrxO3。不考虑处理过程中的 Fe 实际损耗,下列叙述错误的是( ) A.消耗硫酸亚铁铵的物质的量为 n(2-x)mol nx B.处理废水中 Cr2O2-的物质的量为 mol 7 2 C.反应中发生转移的电子数为 3nx mol D.在 FeO· yCrxO3 中,3x=y Fe
【答案】 (1)CuSO4· 2O(推断过程见解析) H (2)CuSO4570 ℃CuO+SO3↑ CuSO4· 2O 102 ℃ ===== 5H
二、守恒法 1.质量守恒法 质量守恒法是依据化学反应前后反应物参加反应的总质量与生 成的生成物总质量相等的原理,进行有关计算。
2.原子或离子守恒法
化学反应是原子或离子间重新组合的过程,化学反应前后原子 或离子的物质的量不会改变即原子或离子守恒。
热点专题整合
方法思想——化学计算中的几种方法技巧 一、关系式法和差量法 1.关系式法:此法常用于多步连续反应的计算。确定关系式 可利用各步反应的计量关系或某元素原子守恒关系找出已知物 质和未知物质的关系式,然后根据已知量和未知量列比例求解。 2.差量法:所谓“差量”是指一个反应过程中某始态量与终 态量的差值,常用的有①质量差;②气体体积差;③物质的量 差等。此方法是利用差量与反应中各物质之间存在一定的正比 例关系进行解题的方法。 此法的关键是正确找出方程式中的差量(理论差)和发生反应的 差量(实际差),然后列比例求解。
【解析】 根据溶液中的电荷守恒可得:2c(Mg2+ )+3c(Al3+ )= 2c(SO2- ),故 c(Al3+ )=(2×6.5 mol/L-2×2 mol/L)/3=3 mol/L,当加 4 入的 NaOH 溶液恰好将 Mg2+ 与 Al3+分离时,NaOH 转化为 Na2SO4 和 NaAlO2,则由 Na+守恒得: 2nSO2- +nAl3+ 4 V(NaOH)= cNaOH 2 ×6.5 mol/L×0.2 L+3 mol/L×0.2 L = =2 L。 1.6 mol/L
【答案】 A
(2)由 258 ℃时的固体质量可得 270 ℃所得样品为 CuSO4, ℃ 570 下灼烧硫酸铜生成黑色粉末和一种氧化性气体,其反应的方程式为: CuSO4 570 ℃ CuO + SO3↑ , 氧 化 铜 溶 于 稀 硫 酸 , 结 晶 得 到 ===== CuSO4· 2O, 5H 其存在的最高温度为 102 ℃, 由图可知: 温度高于 102 ℃,CuSO4· 2O 就会分解。 5H
末和一种氧化性气体,该反应的化学方程式为_______。
把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出, 该晶体的化学式为________,其存在的最高温度是________。
【解析】 (1)根据差量大小可确定 200 ℃时,样品失去部分水 n(CuSO4· 2O)=3.2×10- 3mol 5H CuSO4· 2O, 200 ℃ CuSO4· - n)H2O + ,nH2O,1 mol,,18n 5H ===== (5 g,3.2×10- 3 mol,,(0.80-0.57)g) 1 18n = 3.2×10- 3 0.80-0.57 n=4 故 200 ℃时固体物质的化学式为 CuSO4· 2O H
【精讲精析】 Cr2O2- 具有强氧化性,FeSO4· 4)2SO4· 2O (NH 6H 7 具有强还原性,二者发生氧化还原反应,Fe2+被氧化成 Fe3+,Cr2O2- 7 中+6 价 Cr 被还原成+3 价 Cr。该反应中,Fe 失电子的物质的量等 于 Cr 得电子的物质的量, 则有 ny mol=3nx mol, 3x=y,D 正确; 即 nx 据 Cr、Fe 原子守恒可知,生成 n mol FeO· yCrxO3 时,消耗 mol Fe 2 Cr2O2- ,消耗 n(y+1)mol=n(3x+1)mol 硫酸亚铁铵,A 错误,B 正 7 nx 确;反应中转移的电子为 mol×2(6-3)=3nx mol,C 正确。 2
(2011·重庆高考改编)2.5 g氮的金属化合物A,通过系列反应理 论上可得0.56 L(标准状况)N2,则A的化学式为________。
【精讲精析】 设该化合物的化学式为 X3Ny,X 的相对原子质 量为 x,则: y y 2.5 g 0.56 L X3Ny,~, N2,1,, , ,, ) 2 2 3x+14yg/mol 22.4 L/mol y 2.5 g 0.56 L 1∶ = ∶ 2 3x+14y g/mol 22.4 L/mol 讨论:y 只能取正整数,若 y=1,x=12,无解。 若 y=2,x=24,符合,则化合物 A 为 Mg3N2。
【答案】 D
3.在反应A+2B===C+2D中,已知C和D的相对分子质量之
比为22∶9,当1.6 g A与B完全反应后,生成4.4 g C,则在此
反应中参与反应的B和生成的D的质量之比为( A.16∶9 B.23∶9 )
C.32∶9
D.46∶9
【解析】 根据 A+2B===C+2D 知生成 4.4 g C 时生成 D 的质 2×9 量为 ×4.4 g=3.6 g,由质量守恒定律知参加反应的 B 的质量为 22 3.6 g+4.4 g-1.6 g =6.4 g 故参加反应的 B 与生成的 D 的质量比为 6.4 g∶3.6 g=16∶9。
【答案】
A
2. 某硫酸镁和硫酸铝的混合溶液中, c(Mg2+)=2 mol/L, c(SO2-) 4 2+ 3+ =6.5 mol/L, 若将 200 mL 此混合液中的 Mg 和 Al 分离,至少应 加入 1.6 mol/L 的苛性钠溶液( ) A.0.5 L B.1.625 L C.1.8 L D.2 L
Mg3N2
பைடு நூலகம்
1.(2011·全国新课标高考)0.80 g CuSO4·5H2O样品受热脱水 过程的热重曲线(样品质量随温度变化的曲线)如图所示。
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式________(要求写出推断
过程); (2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉
3.电子守恒 电子守恒法解题的步骤是:首先找出氧化剂、还原剂及其物质
的量以及每摩尔氧化剂、还原剂得失电子的物质的量,然后根
据电子守恒列出等式:氧化剂的物质的量×每摩尔氧化剂得电 子数=还原剂的物质的量×每摩尔还原剂失电子数,利用这一 等式,解氧化还原反应计算题,可化难为易,化繁为简。
4.电荷守恒法 电荷守恒法主要指阴离子带的负电荷总数等于阳离子带的正电 荷总数。常见的电荷守恒有以下几种情况: (1)化合物化学式中存在的电中性原则(正负化合价代数和为零)。
(2)离子反应中的电荷守恒(反应前后电荷数相等)。
(3)电解质溶液中存在的电荷守恒(阴、阳离子电荷守恒)。
(2011· 纲 高 考 ) 某 含 铬 (Cr2O 2- ) 废 水 用 硫 酸 亚 铁 铵 大 7 [FeSO4· 4)2SO4· 2O]处理,反应中铁元素和铬元素完全转化为沉 (NH 6H 淀。该沉淀经干燥后得到 n mol FeO· yCrxO3。不考虑处理过程中的 Fe 实际损耗,下列叙述错误的是( ) A.消耗硫酸亚铁铵的物质的量为 n(2-x)mol nx B.处理废水中 Cr2O2-的物质的量为 mol 7 2 C.反应中发生转移的电子数为 3nx mol D.在 FeO· yCrxO3 中,3x=y Fe
【答案】 (1)CuSO4· 2O(推断过程见解析) H (2)CuSO4570 ℃CuO+SO3↑ CuSO4· 2O 102 ℃ ===== 5H
二、守恒法 1.质量守恒法 质量守恒法是依据化学反应前后反应物参加反应的总质量与生 成的生成物总质量相等的原理,进行有关计算。
2.原子或离子守恒法
化学反应是原子或离子间重新组合的过程,化学反应前后原子 或离子的物质的量不会改变即原子或离子守恒。
热点专题整合
方法思想——化学计算中的几种方法技巧 一、关系式法和差量法 1.关系式法:此法常用于多步连续反应的计算。确定关系式 可利用各步反应的计量关系或某元素原子守恒关系找出已知物 质和未知物质的关系式,然后根据已知量和未知量列比例求解。 2.差量法:所谓“差量”是指一个反应过程中某始态量与终 态量的差值,常用的有①质量差;②气体体积差;③物质的量 差等。此方法是利用差量与反应中各物质之间存在一定的正比 例关系进行解题的方法。 此法的关键是正确找出方程式中的差量(理论差)和发生反应的 差量(实际差),然后列比例求解。
【解析】 根据溶液中的电荷守恒可得:2c(Mg2+ )+3c(Al3+ )= 2c(SO2- ),故 c(Al3+ )=(2×6.5 mol/L-2×2 mol/L)/3=3 mol/L,当加 4 入的 NaOH 溶液恰好将 Mg2+ 与 Al3+分离时,NaOH 转化为 Na2SO4 和 NaAlO2,则由 Na+守恒得: 2nSO2- +nAl3+ 4 V(NaOH)= cNaOH 2 ×6.5 mol/L×0.2 L+3 mol/L×0.2 L = =2 L。 1.6 mol/L
【答案】 A
(2)由 258 ℃时的固体质量可得 270 ℃所得样品为 CuSO4, ℃ 570 下灼烧硫酸铜生成黑色粉末和一种氧化性气体,其反应的方程式为: CuSO4 570 ℃ CuO + SO3↑ , 氧 化 铜 溶 于 稀 硫 酸 , 结 晶 得 到 ===== CuSO4· 2O, 5H 其存在的最高温度为 102 ℃, 由图可知: 温度高于 102 ℃,CuSO4· 2O 就会分解。 5H
末和一种氧化性气体,该反应的化学方程式为_______。
把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出, 该晶体的化学式为________,其存在的最高温度是________。
【解析】 (1)根据差量大小可确定 200 ℃时,样品失去部分水 n(CuSO4· 2O)=3.2×10- 3mol 5H CuSO4· 2O, 200 ℃ CuSO4· - n)H2O + ,nH2O,1 mol,,18n 5H ===== (5 g,3.2×10- 3 mol,,(0.80-0.57)g) 1 18n = 3.2×10- 3 0.80-0.57 n=4 故 200 ℃时固体物质的化学式为 CuSO4· 2O H
【精讲精析】 Cr2O2- 具有强氧化性,FeSO4· 4)2SO4· 2O (NH 6H 7 具有强还原性,二者发生氧化还原反应,Fe2+被氧化成 Fe3+,Cr2O2- 7 中+6 价 Cr 被还原成+3 价 Cr。该反应中,Fe 失电子的物质的量等 于 Cr 得电子的物质的量, 则有 ny mol=3nx mol, 3x=y,D 正确; 即 nx 据 Cr、Fe 原子守恒可知,生成 n mol FeO· yCrxO3 时,消耗 mol Fe 2 Cr2O2- ,消耗 n(y+1)mol=n(3x+1)mol 硫酸亚铁铵,A 错误,B 正 7 nx 确;反应中转移的电子为 mol×2(6-3)=3nx mol,C 正确。 2
(2011·重庆高考改编)2.5 g氮的金属化合物A,通过系列反应理 论上可得0.56 L(标准状况)N2,则A的化学式为________。
【精讲精析】 设该化合物的化学式为 X3Ny,X 的相对原子质 量为 x,则: y y 2.5 g 0.56 L X3Ny,~, N2,1,, , ,, ) 2 2 3x+14yg/mol 22.4 L/mol y 2.5 g 0.56 L 1∶ = ∶ 2 3x+14y g/mol 22.4 L/mol 讨论:y 只能取正整数,若 y=1,x=12,无解。 若 y=2,x=24,符合,则化合物 A 为 Mg3N2。
【答案】 D
3.在反应A+2B===C+2D中,已知C和D的相对分子质量之
比为22∶9,当1.6 g A与B完全反应后,生成4.4 g C,则在此
反应中参与反应的B和生成的D的质量之比为( A.16∶9 B.23∶9 )
C.32∶9
D.46∶9
【解析】 根据 A+2B===C+2D 知生成 4.4 g C 时生成 D 的质 2×9 量为 ×4.4 g=3.6 g,由质量守恒定律知参加反应的 B 的质量为 22 3.6 g+4.4 g-1.6 g =6.4 g 故参加反应的 B 与生成的 D 的质量比为 6.4 g∶3.6 g=16∶9。
【答案】
A
2. 某硫酸镁和硫酸铝的混合溶液中, c(Mg2+)=2 mol/L, c(SO2-) 4 2+ 3+ =6.5 mol/L, 若将 200 mL 此混合液中的 Mg 和 Al 分离,至少应 加入 1.6 mol/L 的苛性钠溶液( ) A.0.5 L B.1.625 L C.1.8 L D.2 L
