元素周期律---学案.pdf
高中化学第一单元元素周期律导学案
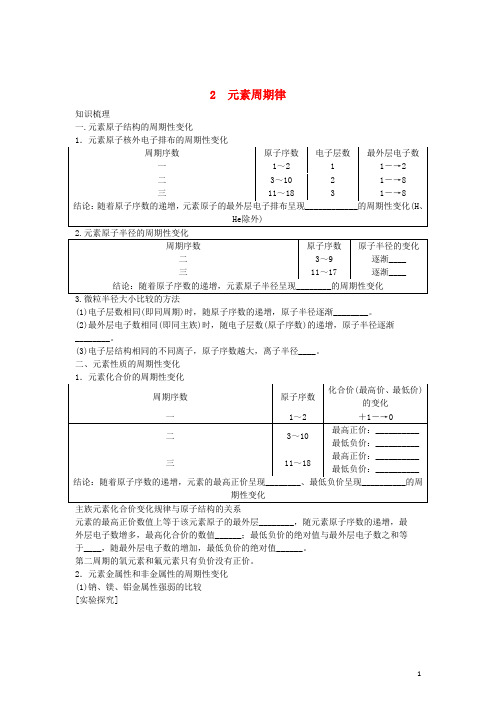
2 元素周期律知识梳理一.元素原子结构的周期性变化(1)电子层数相同(即同周期)时,随原子序数的递增,原子半径逐渐________。
(2)最外层电子数相同(即同主族)时,随电子层数(原子序数)的递增,原子半径逐渐________。
(3)电子层结构相同的不同离子,原子序数越大,离子半径____。
二、元素性质的周期性变化元素的最高正价数值上等于该元素原子的最外层________,随元素原子序数的递增,最外层电子数增多,最高化合价的数值______;最低负价的绝对值与最外层电子数之和等于____,随最外层电子数的增加,最低负价的绝对值______。
第二周期的氧元素和氟元素只有负价没有正价。
2.元素金属性和非金属性的周期性变化(1)钠、镁、铝金属性强弱的比较[实验探究]高价氧化物对应水化物的碱性逐渐________,因此元素的金属性逐渐________。
物对应水化物的酸性逐渐______,因此元素的非金属性逐渐________。
(3)同周期元素金属性、非金属性强弱的变化规律同周期元素从左到右,元素的金属性逐渐________,非金属性逐渐________。
对其他周期元素的性质进行研究,也可以得到类似结论,所以元素的金属性和非金属性随着原子序数的递增呈现__________________。
(4)元素的金属性、非金属性与元素在周期表中位置的关系①同一周期,从左向右,原子半径逐渐________,最外层电子数逐渐________,元素的原子失电子能力逐渐________,得电子能力逐渐________;元素金属性逐渐________,非金属性逐渐________;②同一主族,从上到下,原子半径逐渐________,元素的原子失电子能力逐渐________,得电子能力逐渐________;元素金属性逐渐________,非金属性逐渐________。
三、元素周期律1.内容:元素的__________随着元素__________________而呈________的变化。
1.2.1元素周期律学案
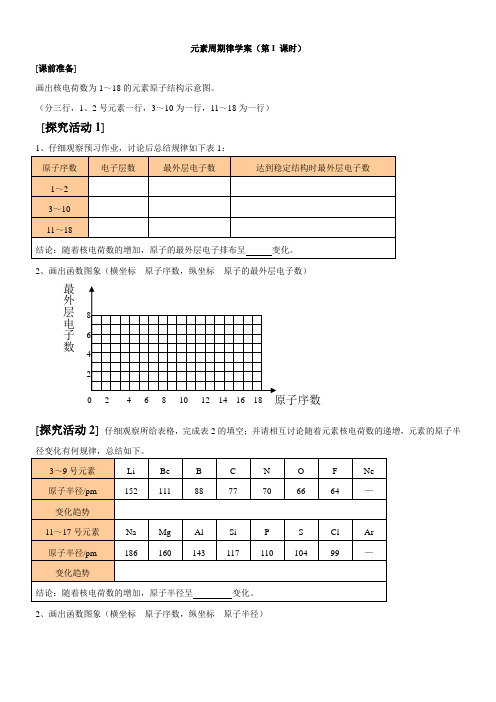
元素周期律学案(第I 课时)[课前准备]画出核电荷数为1~18的元素原子结构示意图。
(分三行,1、2号元素一行,3~10为一行,11~18为一行)[探究活动1]2、画出函数图象(横坐标---原子序数,纵坐标---原子的最外层电子数)[探究活动2] 仔细观察所给表格,完成表2的填空;并请相互讨论随着元素核电荷数的递增,元素的原子半径变化有何规律,总结如下。
2、画出函数图象(横坐标---原子序数,纵坐标---原子半径)0 2 4 6 8 10 12 14 16 18最外层电子数[深入探究1]1、电子层数相同的元素(除稀有气体元素)的原子半径:2、当原子的电子层数不同而最外层电子数相同时,元素的原子半径: [探究活动3]2、画出函数图象(横坐标---原子序数,纵坐标---元素的主要化合价)[深入探究2](1)、原子序数为11~17的元素的最高化合价和最低化合价的变化规律是 。
原子半径 40 80 元素的主要化合价(2)、序数为11~17的元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系是。
[反馈练习]例题1、元素的微粒半径大小比较有何规律?Li____Na____K,Li+____Na+____K+,F____Cl____Br___I, F-____Cl-____Br-___I-,Na____Mg____Al,P____S____Cl,Na____Na+,Cl____ Cl-,Fe____ Fe2+____ Fe3+,N3-____O2-____F-____Na+____Mg2+____Al3+,P3-____S2-____Cl-____K+____Ca2+,例2、同周期的X、Y、Z三种元素,已知其氢化物分别为XH3、H2Y、HZ,则下列判断正确的是A.原字半径Z > Y > X B.Z的非金属性最强C.氢化物还原性XH3 > H2Y > HZ,稳定性XH3 > H2Y > HZD.最高氧化物对应水化物H3XO4酸性最强例3、有a、b、c、d四种元素,a、b为同一周期元素,c、d为同一主族元素。
元素周期律学案

元素周期律学案2(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--第一章第二节元素周期律(2)【学习目标】1、掌握元素的金属性和非金属性随原子序数递增而呈现周期性变化规2、通过实验操作,培养学生实验技能。
【学习重点】1、元素的金属性和非金属性随原子序数的递增而呈现周期性变化的规律2、元素周期律的本质【复习巩固】1、核外电子的排布的规律有哪些?①.电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布;②每层最多容纳的电子数为2n2(n代表电子层数);③电子一般总是尽先排在能量最低的电子层④最外层电子数不超过8个(第一层为最外层时,电子数不超过2个)2.写出下列离子的离子结构示意图:Mg2+ F- Br- Ca2+【基础知识】性质强弱判断依据金属性非金属性二、第三周期元素性质变化规律[实验一] Mg、Al和水的反应:分别取一小段镁带、铝条,用砂纸去掉表面的氧化膜,放入两支小试管中,加入2~3 ml水,并滴入两滴酚酞溶液。
观察现象。
过一会儿,Na Mg Al与冷水反应现象化学方程式与沸水反应现象化学方程式结论最高价氧化物对应的水化物碱性强弱NaOH Mg(OH)2中强碱Al(OH)3 Mg Al现象[总结]Na、Mg、Al与水反应越来越,对应氧化物水化物的碱性越来越,金属性逐渐。
[小结]第三周期元素Na Mg Al Si P S Cl,金属性逐渐,非金属性逐渐【总结】同一周期从左到右,元素原子失去电子能力逐渐______,得电子能力逐渐______。
三、同周期元素性质递变规律同周期从左到右,金属性逐渐,非金属性逐渐。
四、元素周期律(1)定义:。
(2)实质:。
【自主探究】根据1—18号元素的原子结构示意图,体会元素性质和原子结构的关系。
______________________________________________________________________【反馈练习】1、下列各组元素中按微粒半径递增顺序排列的是A、Li Na KB、Ba2+ Ca2+ Mg2+C、Ca2+ K+ Cl-D、N O F2、下列说法正确的是()A.SiH4比CH4稳定 C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强B.O2-半径比F-的小 D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱3、同一周期中,X、Y、Z三种元素,其气态氢化物稳定性按X、Y、Z的顺序不断增强,下列说法正确的是()A.非金属性X>Y>Z C.它们氧化物水化物的酸性按X、Y、Z顺序增强B.原子半径X>Y>Z D.气态氢化物的还原性按X、Y、Z顺序增强4、A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8。
§1.2元素周期律导学案(1)

1
(3)原子核外电子排布的变化规律 请写出 1-20 号原子结构示意图。例如: 。
原 子 序数 元 素 符号 原 子 结 构 示 意 图 原 子 序数 元 素 符号 原 子 结 构 示 意 图
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
归纳:随着原子序数的递增,原子的核外电子排布呈现以下规律性变化: 原子序数 1~2 ~ ~ 结论 电子层数 1 最外电子层数 → → → 随着原子序数的递增, 元素原子的最外层电子排布呈现从 (第一周期除外) ,即达到稳定结构的周期性变化。 递增到 的周期性变化 达到稳定结构时的最外层电子数
2
【练习】某元素 X 的最高价氧化物对应水化物的化学式为 HXO4,则其气态氢化物的化学式为: 若其水溶液呈现酸性,且能与 AgNO3 溶液反应生成白色沉淀,则它在元素周期表中的位置是: 三、原子半径的变化规律 元素符号 原子半径 nm 元素符号 原子半径 nm 元素符号 原子半径 nm H 0.037 Li 0.152 Na 0.186 Be 0.089 Mg 0.160 B 0.082 Al 0.143 C 0.077 Si 0.117 N 0.075 P 0.110 O 0.074 S 0.102 F 0.071 Cl 0.099 Ar Ne He
; 。
结论:同一周期,随着原子序数的递增,元素原子半径逐渐 ,呈现周期性变化。 归纳:微粒半径大小的比较 1、原子半径大小的比较 同主族,从上到下,原子半径逐渐 。 同周期,从左到右,原子半径逐渐 。 2、离子半径大小的比较 (1)具有相同电子层结构的离子半径大小的比较 “序大径小” 规律: 电子层数相同, 随着核电荷数的增加, 原子核对核外电子的吸引能力 32+ 2+ 3+ 例如:r(N )>r(O )>r(F )>r(Na )>r(Mg )>r(Al ) (2)同主族离子半径大小的比较 元素周期表中从上到下,电子层数逐渐 ,离子半径逐渐 。 (3)同一元素的不同离子的半径大小比较 “价高径小”规律:同种元素的各种微粒,核外电子数越多,半径 , + 高价阳离子半径 低价离子半径。如:r(H )>r(H)>r(H ) 练习:根据下列原子结构示意图回答(用编号回答): ① ② ③ ④
刘培侦学案——元素周期律.pdf

元素周期律(第二课时)学案【学习目标】知识和技能:1.初步掌握元素周期律的内容,理解元素周期律的本质。
2.掌握同周期元素性质的变化规律;巩固元素金属性、非金属性的判断依据。
过程与方法:1.掌握元素性质规律的分析方法。
2.利用各种图表分析处理数据,培养透过现象看本质的科学素养。
3.初步学会实验探究的基本步骤和方法。
情感、态度、价值观:1、在知识的归纳过程中,重视发现意识、感受在发现中寻找结论的乐趣2、加强合作意识,在合作中享受学习的成功3、结合元素周期律的学习,树立“有量变到质变以及客观事物本来是相互联系和具有内部规律的”辨证唯物主义观点。
【学习过程一】:课前自主学习(一)旧知识复习(完成后,你可以尝试做后面的“每课一题”)1.在元素周期表中,同主族元素原子在核外电子排布上具有相同的,从上到下,电子层数。
同周期元素原子具有相同的,从左到右,最外层电子数。
2.在元素周期表中,以碱金属和卤素为例:同主族元素从上到下,原子半径逐渐;元素的金属性逐渐,非金属性逐渐。
(二)课前预习1.完成教材第15页最上表格填空内容,然后填空。
2.以第三周期11——18号元素为例,可以发现,同周期元素,从左到右,随着原子序数的增加,原子最外层电子数从增加到,呈现依次的变化;除(填元素符号)外,其它元素原子半径逐渐;金属元素只有化合价,非金属有两种化合价,并且,从左到右,元素最高正化合价依次,最低负化合价的绝对值依次。
【学习过程二】:课堂学习每课一题下列说法正确的是()A.在元素周期表中,同一主族元素从上到下原子半径依次增大。
B.F-、 Cl-、 I-等离子的还原性依次减弱。
C.由于同主族元素从上到下非金属性减弱,所以HCl 、HBr、 HI 的酸性依次减弱。
D. 已知Be与Mg同主族,根据同主族元素性质的递变性推测,金属Ca与水反应比Be与水反应容易反思与整理:学习环节学习内容方法归纳知识总结展示自主学习成果把自学成果在全班展示师生进行评价,形成结论总结:同周期元素从左往右原子核外电子排布原子半径元素化合价小试牛刀下列说法不正确的是()A.离子半径:Na+<F-B.原子半径:Na>BeC.硫元素所呈现的正化合价只有+6价D.只有非金属元素存在负化合价,金属元素没有负化合价问题思考同周期元素的金属性、非金属性会呈现怎样的变化规律呢?实验探究1、明确探究课题,2、回忆所学知识3、提出猜想与假设4、制定研究计划设计实验提供下列实验仪器、药品仪器:试管酒精灯试管夹砂纸小刀镊子烧杯锥形瓶玻璃片药品:钠镁条铝片蒸馏水稀盐酸酚酞 MgCl2溶液、AlCl3溶液 NaOH溶液5、记录现象搜集证据6、分析实验得出结论7、反思与评价实验探究报告探究课题:提出假设:(注意提出假设的依据)________________________________________________________________________实验方案(提醒:要注意实验原理和步骤)实验现象记录:________________________________________________________________________实验结论:________________________________________________________________________【课堂小结】知识规律小结:探究方法小结:推理阐述根据以上实验探究得出的结论,进行推理,为什么同周期元素的金属性会呈现这种递变规律?进行阐述。
§1.元素周期律导学案(3)

近的元素符号。
(镭)是原子序数最大
族中最大的
.
( )
所代表的元素的最高价氧化物对应水化物酸性最强
、c.d、h所代表的元素形成的单质可能都是电的良导体
14种元素中n元素失去核外第1个电子需要的能量最多
14种元素中m元素失去核外第1个电子需要的能量最少
B的原子序数都小于18,已知A元素原子的最外层电子数为
层电子数为(a一b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有.能与水反应 B.能与硫酸反应 C.能与NaOH反应 D.能与碳酸钠反应
我的难点与疑惑。
第一章物质结构元素周期律学案

第一章物质结构元素周期表第一节元素周期表第一课时教学内容:元素周期表教学目标1、知识与技能初步掌握元素周期表的结构2、过程与方法引导学生自主学习,认识元素周期表的结构3、情感态度与价值观通过化学史的学习,培养学生勇于创新的品质教学重点:元素周期表的结构教学难点:原子结构与元素周期表的位置相互推断教学策略:谈话讨论,自主建构教学进程【课前研读】(提示:请同学课前务必完成!)一、请同学们阅读课本的文字,回答下列问题:(1)哪一位科学家首先制得了第一张元素周期表?(2)编排第一张元素周期表时,是以什么为编排顺序的?现在的周期表又以什么为编排顺序?(3)什么叫原子序数?它和核电核数、质子数、核外电子数间有什么关系?二、元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数1、周期表的结构短周期(第1、2、3周期)周期:7个(共七个横行)长周期(第4、5、6周期)周期表不完全周期(第7周期)主族7个:ⅠA-ⅦA族:16个(共18个纵行)副族7个:IB-ⅦB第Ⅷ族1个(3个纵行)零族(1个)稀有气体元素口诀:三长、三短、一不完全;七主七副一零一Ⅷ2、周期表的编排原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行;再把不同横行中最外层的电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。
这样,就可以得到一个表,这个表就叫元素周期表,元素周期表有多种形式(望同学们上网搜索了解)。
【课堂讨论】(带你发现元素周期表,争做课堂主人!)(一)、预习演说(3分钟)(二)、你能否将1—18号元素编成一个小小的周期表,然后和同学间交流。
(7分钟)要求:1.将性质相似的元素归类。
2.体现元素性质的周期性递变规律。
编制原则:1.将最外层电子数相同的元素归为一列。
2.将相同电子层数的元素排在一行。
3.按原子序数的递增编排。
(三)、收集具代表性的由学生所编制的周期表,请大家讨论交流周期表的编排,哪一种更为合理呢?(3分钟)(四)、周期表具有哪些编排原则?(师生合作讨论,2分钟)(五)周期表的结构(教师引导,集体讨论)(7分钟)元素周期表有7个横行,每一个横行叫做一个周期。
(完整版)第二节元素周期律导学案

第二节元素周期律【学习目标】1 、了解原子核外电子的排布;能划出1〜20号原子结构示意图。
2 、掌握元素化合价、原子半径随原子序数的递增而呈现出的周期性变化规律。
【相关知识点回顾】2、下列微粒结构示意图表示的各是什么微粒1、化合价的递变规律分析元素主要化合价的变化,你能得到什么结论? 结论:随着原子序数的递增, ____________ 在1~20号元素中,同一元素化合价有以下量的关系: ① _________________________________ 最高正价=;最低负价与最高正价的关系为:丨最高正价丨+ I 负价丨= _______________ 。
1、原子核外电子是 排布的。
现在发现元素原子核外电子最少的有层,最多的有层。
最外层电子数最多不超过电子的排布,特别是个(只有1层的不超过 _个)。
元素的性质与原子核外 上的电子数目有密切关系。
2、右图是某元素的原子结构示意图,该原子的核电荷数为_核外有_个电子层,最外层有 _个电子,化学反应中这种 原子容厂 (填“得”或“失”r 电子。
【学习过程】、原子核外电子的排布1、原子核外的电子由于能量不同,它们运动的区域也不同。
通常能量低的电子在离核电子层(n)1234567对应符号⑵ 第2层最多排 ________ 个电子⑶ 除K 层外,不论原子有几个电子层,其最外层中的电子数最多只能有____ 个(K 层最多有 ______ 个)[练习]1、下列微粒结构示意图是否正确?如有错误,指出错误的原因。
__________ 的区域运动,能量高的电子在离核 _______________ 的区域运动。
2、表示方法:3、排布规律:按能量由 ____________ 到 _______ ,即由内到外,分层排布。
⑴ 第1层最多只能排个电子、元素周期律填写教材P14〜15表格,然后思考与交流如下问题:② 金属元素无 __________ 价(除零价外,);既有正价又有负价的元素一定是 _____________________ 元素; ③ O F 无正价。
元素周期律(第1课时)教学案

课题:第四章第二节元素周期律(第1课时)教学案课标要求1.通过对“同周期元素性质”的学习,培养科学探究和创新意识。
2.通过对“元素周期律内容和实质”的学习,建构微观原子结构特点决定宏观性质的探究思路和模式。
学习目标认识同周期元素的核外电子排布、主要化合价、原子半径等性质的周期性变化规律。
教学重难点同周期、同主族元素性质【情景导入】【问题探究1】原子结构的周期性变化决定反映元素性质的周期性变化归纳出反映元素周期律1.根据P、S、Cl在周期表中位置进行比较(1)H3PO4、H2SO4、HClO4酸性强弱。
(2)P3-、S2-、Cl-还原性强弱。
2.试根据同周期元素非金属性的变化规律,比较SiH4、PH3、H2S和HCl的稳定性。
探究提示:1.(1)非金属性:Cl>S>P,酸性:HClO4>H2SO4>H3PO4。
(2)非金属性:Cl>S>P,还原性:P3->S2->Cl-。
2.元素的非金属性越强,气态氢化物越稳定。
同周期元素,随着原子序数的递增,非金属性逐渐增强,故非金属性:Si<P<S<Cl,所以它们的氢化物的稳定性顺序为SiH4<PH3<H2S<HCl。
【问题探究2】1.第三周期元素的阳离子半径从左到右逐渐减小,对吗?提示:对。
第三周期元素的阳离子从左到右分别是钠离子、镁离子和铝离学习过程设计核外电子是处在一定的轨道上绕核运行的,正如太阳系的行星绕太阳运行一样;核外运行的电子分层排布,按能量高低而距核远近不同。
这个模型被称为“玻尔原子模型”。
现代物质结构理论在新的实验基础上保留了“玻尔原子模型”合理的部分,并赋予其新的内容。
你想知道核外电子是如何排布的吗?请让我们一起走进教材学习元素性质的周期性变化规律。
氢化物稳定性增强减弱还原性减弱增强最高价氧化物的水化物酸性增强减弱碱性减弱增强【归纳总结】(1)主族元素的最高正价=最外层电子数(O、F除外)。
(2)只有非金属才有负价,且|最低负价数值|+|最高正价数值|=8。
马泉周期律学案

高中化学《元素周期律》学案
[教学目标]
知识技能:1、使学生了解元素原子核外电子排布、原子半径、主要化合价与元素金属性、非金属性的周期性变化。
2、了解两性氧化物和两性氢氧化物的概念。
3、认识元素性质的周期性变化是元素原子核外电子排布周期性变化的结果,从而理解
元素周期律的实质。
能力方法:培养学生进行自主学习、探究学习和合作学习的能力并进行科学研究方法的教育。
情感态度:树立由量变到质变、尊重客观事实的辨证唯物主义观点,培养自身学习自然科学的兴趣和探求知识、不断进取的品质。
[重点]1、核外电子排布2、金属性、非金属性的周期性变化;元素周期律的实质
[难点]金属性、非金属性的周期性变化。
第二节 元素周期律(第3课时)教案.pdf

必修Ⅱ第一章物质结构元素周期律第二节元素周期律(第3课时)一、教材分析:本节在物质结构的基础上,将元素周期表的学习和元素周期律的学习结合起来,将学生所学习的知识连汇贯通,体现了由感性认识上升到理性认识的科学认知规律。
周期表和元素周期律为发展物质结构理论提供了客观依据。
原子的电子层结构与元素周期表有密切关系,周期表为发展过度元素结构、镧系和锕系结构理论,甚至为指导新元素的合成,预测新元素的结构和性质都提供了线索。
元素周期律和周期表在自然科学的许多部门,都是重要工具。
二、教学目标:1、知识与技能:(1)掌握元素周期表和元素周期律。
(2)掌握元素化合价与元素在周期表中位置的关系。
2、过程与方法:(1)归纳、比较。
通过对前面所学知识的归纳比较,掌握“位、构、性”的关系。
(2)自主学习。
引导自主探究,分析化合价与元素在周期表中位置的关系。
3、情感、态度与价值观:培养学生科学创新品质,培养学生理论联系实际的能力。
三、教学重点难点:重点:周期表、周期律的应用难点:“位、构、性”的推导四、学情分析:本节课在学生已经了解元素周期律的基础上进行教学,主要是让学生认识周期表特别是元素周期律的应用,整体上难度不大,学生能够掌握。
所以须让学生动手、动脑、参与归纳,并在学习的过程中帮助学生查漏补缺,从而使学生达到对旧知识的复习,实现由未知向已知、由浅入深的转化。
进而学生会了解并掌握元素在周期表中的位置(简称“位”)反映了元素的原子结构(简称“构”),而元素的原子结构,则决定、影响元素的性质(简称“性”)。
因此,我们只要知道三种量(“位、构、性”)中的一种,即可推出另外2种量。
五、教学方法:启发——归纳——应用六、课前准备:多媒体、实物投影仪七、课时安排:1课时八、教学过程(一)检查预习,了解学生对已有知识的掌握程度及存在的困惑。
(二)情景导入,展示目标[新课导入]元素周期律、元素周期表是一种重要的结构理论,它的重要性体现在什么地方呢?这就是我们这节课要学习的内容。
元素周期律学案
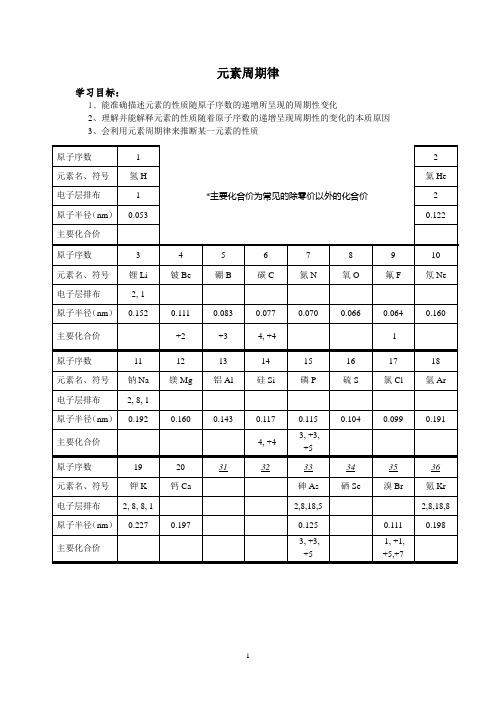
元素周期律学习目标:1、能准确描述元素的性质随原子序数的递增所呈现的周期性变化2、理解并能解释元素的性质随着原子序数的递增呈现周期性的变化的本质原因3、会利用元素周期律来推断某一元素的性质原子序数 1*主要化合价为常见的除零价以外的化合价2元素名、符号氢H 氦He 电子层排布 1 2 原子半径(nm)0.053 0.122 主要化合价------- 原子序数 3 4 5 6 7 8 9 10 元素名、符号锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne 电子层排布2, 1原子半径(nm)0.152 0.111 0.083 0.077 0.070 0.066 0.064 0.160 主要化合价+2 +3 -4, +4 -1 -------- 原子序数11 12 13 14 15 16 17 18 元素名、符号钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 电子层排布2, 8, 1原子半径(nm)0.192 0.160 0.143 0.117 0.115 0.104 0.099 0.191主要化合价-4, +4 -3, +3,+5--------原子序数19 20 31 32 33 34 35 36 元素名、符号钾K 钙Ca 砷As 硒Se 溴Br 氪Kr 电子层排布2, 8, 8, 1 2,8,18,5 2,8,18,8 原子半径(nm)0.227 0.197 0.125 0.111 0.198主要化合价-3, +3,+5-1, +1,+5,+7--------一、原子核外电子的排布规律1.各电子层最多容纳_____个电子(n为电子层数)。
2. (1)最外层电子数_________,K层________。
(2)次外层电子数__________。
(3)倒数第三层电子数________。
3. 最外层达到_______个电子为稳定结构。
电子由能量______的电子层向能量______的电子层填充,满足_________原则。
元素周期律学案

学案:第一节 元素周期表(第一课时)【重点】元素周期表的结构【阅读】教科书4—5页,完成下面的空。
一、元素周期表的发展史1、1869年,俄国化学家 制出第一张元素周期表。
(最早是以______________由小到大排列的,后来排序依据改为______________)2、原子序数:按照元素在周期表中的 给元素编号,得到原子序数。
原子序数= = = 【探究】将下面元素的结构示意图,补充完整,回答下面问题。
1周期2周期3周期【思考】根据书写的核外电子排布,分析:1、为什么将氢和氦放在第1周期?同样,第2周期的元素有何共同点(第3周期呢)?2、为什么将氢锂钠放在一个纵行?可知周期表中同一个纵行的元素有何共同点?二、元素周期表1.编排规则(阅读至5页上半部分,一边阅读一边观察周期表) 把 相同的元素,按 递增的顺序从左到右排成横行, 把 相同的元素,按 递增的顺序从上而下排成纵行。
(纵行叫族)将上面结构示意图的每个纵行上方,标上它们的族号(查找周期表)2.元素周期表的结构【总结】填写:(仔细看周期表)(2)周期表中从ⅢB 到ⅡB 之间的元素(共 个纵行),它们的偏旁均为“金”,说明它们均为 元素,通称为过渡元素。
(3)族的别称:ⅠA 称为 元素(除____) ⅦA 称为 元素 0族称为 元素 (4)根据原子结构确定元素在周期表中的位置①、周期的序数=______________ ②、主族序数=____________________ 只要根据核外电子排布规律,画出原子结构示意图就知道它在周期表中的位置。
【练习】不看周期表,你知道么:16号元素,在元素周期表中位于 周期第 族; 9号元素在元素周期表中 周期第 族。
位于第三周期IV A 族的元素为 号元素。
短周期:第 周期长周期:第 周期不完全周期:第 周期 主族 个(用 表示)副族 个(用 表示) 第Ⅷ族 个(包括 个纵行)_____族 个(稀有气体)周期: 个,(共 个横行) 族: 个,(共 个纵行) 周期表 ⎪⎪⎩⎪⎪⎨⎧⎩⎨⎧⎪⎪⎩⎪⎪⎨⎧【提高】1、离子X n+、Y m- 核外电子排布均为 2、8,则X 元素应在___周期,属于_____元素,Y 元素应在______周期,属于_____元素。
《元素周期律》 导学案

《元素周期律》导学案一、学习目标1、理解元素周期律的实质,掌握元素性质随原子序数递增的规律。
2、熟悉元素周期表的结构,能准确说出周期和族的划分。
3、学会运用元素周期律和周期表,预测元素的性质。
二、学习重点1、元素周期律的内容和实质。
2、元素性质在周期表中的递变规律。
三、学习难点1、元素周期律的理解和应用。
2、原子结构与元素性质的关系。
四、知识梳理(一)元素周期律1、定义:元素的性质随着原子序数的递增而呈周期性变化的规律。
2、具体表现(1)原子半径同一周期,从左到右,原子半径逐渐减小(稀有气体元素除外)。
同一主族,从上到下,原子半径逐渐增大。
(2)化合价同一周期,从左到右,最高正化合价由+1 递增到+7(O、F 除外),最低负化合价由-4 递增到-1。
同一主族,最高正化合价相同,最低负化合价相同。
(3)金属性和非金属性同一周期,从左到右,金属性逐渐减弱,非金属性逐渐增强。
同一主族,从上到下,金属性逐渐增强,非金属性逐渐减弱。
(二)元素周期表1、编排原则(1)按原子序数递增的顺序从左到右排列。
(2)将电子层数相同的元素排成一个横行,称为周期。
(3)把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行,称为族。
2、结构(1)周期短周期:第 1、2、3 周期,分别包含 2、8、8 种元素。
长周期:第 4、5、6、7 周期,分别包含 18、18、32、32 种元素。
(2)族主族:由短周期元素和长周期元素共同构成,共 7 个主族,分别用ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA 表示。
副族:完全由长周期元素构成,共 7 个副族,分别用ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB 表示。
第Ⅷ族:包括 8、9、10 三个纵行。
0 族:稀有气体元素。
(三)原子结构与元素周期表、元素性质的关系1、原子结构与元素周期表的关系(1)原子序数=核电荷数=质子数=核外电子数(2)周期序数=电子层数(3)主族序数=最外层电子数2、原子结构与元素性质的关系(1)最外层电子数越少,电子层数越多,越易失电子,金属性越强。
12元素周期律学案

1.2元素周期律学案一、元素周期律及其实质1.定义:元素的性质随着元素原子序数的递增而呈周期性变化的规律叫做元素周期律。
2.实质:是元素原子的核外电子排布的周期性变化的必然结果。
核外电子排布的周期性变化,决定了元素原子半径、最外层电子数出现周期性变化,进而影响元素的性质出现周期性变化。
注意:元素各项性质的周期性变化不是简单的重复,而是在新的发展的基础上重复。
随着原子序数的增大,元素间性质的差异也在逐渐增大,并且由量变引起质变。
二、元素周期表及其结构1.元素周期表:电子层数相同的元素按原子序数递增的顺序从左到右排成横行;最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行,得到的表叫元素周期表。
元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
2.元素周期表的结构⑴周期:具有相同的电子层数的元素按原子序数递增的顺序排列成的横行叫周期。
周期表有7 个周期:1、2、3 周期为短周期;4、5、6周期为长周期;7为不完全周期。
目前1~7周期元素数目分别为2、8、8、18、18、32、26。
周期序数= 电子层数。
⑵族:最外层电子数相同的元素按电子层数递增的顺序排成的纵行叫族(除8、9、10列)。
长式元素周期表有18 纵行,分为16 个族。
主族:由短周期元素和长周期元素共同构成的族。
用族序数后加字母A表示。
7个。
副族:完全由长周期元素构成的族。
用族序数(罗马数字)后加字母B表示。
7个。
第Ⅷ族:第8、9、10 纵行。
0族:第18 列稀有气体元素。
⑶镧系元素:周期表中[行6,列3]的位置,共15种元素。
第IIIB族的钪(Sc)、钇(Y)和镧系一起统称为稀土元素。
⑷锕系元素:周期表中[行7,列3]的位置,共15种元素。
均为放射性元素⑸过渡元素:第Ⅷ族加全部副族共六十多种元素的通称,因都是金属,又叫过渡金属。
(6)超铀元素: 铀之后的元素。
三、原子结构、元素的性质、元素在周期表中的位置间的相互关系1.元素在周期表中位置与元素性质的关系⑴分区线附近元素,既表现出一定的金属性,又表现出一定的非金属性。
《元素周期律》教案1

元素周期律—— 第1课时知识与技能:1、以1-20号元素为例,了解元素原子核外电子排布规律。
2、掌握元素化合价随原子序数的递增而呈现出的周期变化规律。
过程与方法:1.归纳法、比较法。
2.培养学生抽象思维能力。
情感、态度与价值观:培养学生勤于思考、勇于探究的科学品质。
教学重点:元素化合价随原子序数的递增的变化规律。
教学难点:原子核外电子排布。
教学过程:一、原子核外电子的排布 :三条原则一图式1.原子核外电子的分层排布:在多个电子的原子里,核外电子是分层运动的,又叫电子分层排布2.核外电子排布的三条原则:① 电子一般总是尽先排在能量最 低 的电子层里,当能量低的电子层排满后依次进入能量较高的电子层。
②各电子层最多容纳的电子数为 2n 2 个③最外层电子数不超过 8 个(K 层不超过 2 个),次外层电子数不超过 18 个, 倒数第三层电子数不超过 32 。
3.原子结构(或离子结构)示意图:1——20号元素【例如】原子结构示意图O 2- Al 3+ Na +-离子结构示意图1. 电子数相同的粒子:2.元素原子结构的特殊性的粒子(1——18号)(1)最外层电子数为 1 的原子有: H Li Na ; (2)最外层电子数为 2 的原子有: He Be Mg ;(3)最外层电子数跟次外层电子数相等的原子有: Be Ar ; 最外层电子数是次外层电子数2倍的原子是: C ; 最外层电子数是次外层电子数3倍的原子是: O ;最外层电子数是次外层电子数4倍的原子是: Ne ; (4)次外层电子数是最外层电子数2倍的原子有: Li Si ; (5)内层电子总数是最外层电子数2倍的原子有: Li P ; (6)电子层数与最外层电子数相等的原子有: H Be Al ; (7)电子层数是最外层电子数2倍的原子有: Li ;(8)最外层电子数是电子层数2倍的原子有: He C S ;(9)最外层电子数是电子层数3倍的原子是: O ;(10)原子核内无中子的原子 1H ;3.等质子数的粒子:离子:9个质子的离子:F-、OH-、NH2-11个质子的离子:Na+、H3O+、NH4+17个质子的离子:HS-、Cl-分子:14个质子:N2、CO、C2H2 16个质子:S、O24.等式量粒子:式量28:式量78:式量98:式量32:元素周期律第2课时知识与技能:1、掌握元素的金属性和非金属性随原子序数的增递而呈现周期性变化的规律。
元素周期律学案

一.复习回顾⑴碱金属元素:Li→Na→K→Rb→Cs①电子层数依次,②原子半径依次,③熔沸点依次,④与氧气反应,与水反应越来越,⑤金属性逐渐,单质的还原性逐渐,⑥离子的氧化性逐渐。
⑵卤族元素:F→Cl→Br→I→At①电子层数依次,②原子半径依次,③熔沸点依次,④密度依次。
⑤非金属性逐渐,单质的氧化性逐渐,⑥卤素阴离子的还原性逐渐,⑦跟H2化合越来越,⑧卤化氢的热稳定性逐渐,⑨氢卤酸的酸性逐渐。
二.填表练习综上所述,我们可以从11~18号元素性质的变化中得出如下结论:Na Mg Al Si P S Cl Ar金属性逐渐减弱,非金属性逐渐增强稀有气体元素三.规律总结1.同周期元素性质的递变:同一周期元素从左到右(除稀有气体外),随核电荷数依次,原子半径逐渐,核对最外层电子的吸引力逐渐,得电子的能力逐渐,因此,元素的金属性逐渐,非金属性逐渐。
(金属与非金属的分界线是)表现在:元素的最高价氧化物对应水化物的碱性逐渐,酸性逐渐;元素与氢化合的能力逐渐,形成气态氢化物的稳定性逐渐。
2.同主族元素性质的递变:同一主族的元素从上到下,随着核电荷数的,电子层数依次,原子半径逐渐,原子失电子能力逐渐,得电子能力逐渐,所以,元素的金属性逐渐,非金属性逐渐。
表现在:最高价氧化物对应水化物的酸性逐渐,碱性逐渐;非金属与氢气化合的能力逐渐,气态氢化物的稳定性逐渐;金属与水或酸反应的剧烈程度越来越。
3.金属性、非金属性的判断依据金属性的判断依据:①单质与水反应置换出氢的难易程度;②单质与酸反应置换出氢的难易程度;③最高价氧化物对应的水化物(氢氧化物)的碱性强弱。
非金属性的判断依据:①与氢气反应生成氢化物的难易程度;②氢化物的稳定性;③最高价氧化物对的水化物的酸性强弱。
4.微粒半径大小的比较规律(1)层数相同,核大半径小。
即电子层数相同时,结构相似的微粒中核电荷数大的微粒半径小。
例如:。
(2)层异,层大半径大。
即当微粒的电子层数不同时,结构相似的微粒中,电子层数大的微粒半径大。
《元素周期律》学案

《第二节元素周期律》学案学习目标:1、知识与技能目标:(1)了解元素原子核外电子排布、原子半径、主要化合价和元素金属性、非金属性的周期性变化。
(2)认识元素性质的周期性变化是原子核外电子排布周期性变化的结果,从而理解元素周期律的实质。
2、过程和方法目标:(1)自主学习,自主归纳比较元素周期律。
(2)自主探究,通过实验探究,培养探究能力。
3、情感态度与价值观目标:培养辨证唯物主义观点:量变到质变规律学习过程:1、预习必会(1)碱金属元素在原子结构上有哪些相似性和递变性?(2)同族元素金属性和非金属性如何变化?(3)元素周期表的结构怎样?第三周期有哪些元素呢?(4)元素金属性强弱的判断依据是什么?(5)元素非金属性强弱的判断依据是什么?(6)设计什么实验来验证元素的金属性强弱?2、进入新课二、元素周期律思考:同周期元素原子结构和性质存在怎样的关系?又作怎样的变化呢?【科学探究1】1.在下表中写出元素周期表前三周期元素(1~18号)的符号及原子的核外电子排布(用原子结构2.观察上面的表格,思考并讨论:随着原子序数的递增,元素原子的核外电子排布、元素【科学探究2】1.实验(1)(2)2.讨论:⑴结合钠与水反应的现象,比较钠和镁与水反应的难易程度。
⑵比较镁和铝与盐酸反应的难易程度。
⑶比较钠、镁、铝的最高价氧化物对应的水化物(氢氧化物)碱性强弱。
⑷通过以上实验和讨论,你能推断出钠、镁、铝的金属性强弱吗?Na Mg Al金属性逐渐:4.通过以上对第三周期元素性质的比较,我们可以得出的结论:Na Mg Al Si P S Cl金属性逐渐:,非金属性逐渐:。
对其它周期元素进行研究,也可以得出类似的结论。
元素周期律:元素周期律的实质:3、课堂小结:4、布置作业:【课堂检测】1、下列递变情况不正确的是:A.Na、Mg、Al最外层电子数依次增多,其单质的还原性依次减弱B.P、S、Cl最高正价依次升高,对应气态氢化物稳定性增强C.C、N、O原子半径依次增大D.Na、K、Rb氧化物的水化物碱性依次增强2、同一周期X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是HXO4 > H2YO4 > H3ZO4,则下列说法判断错误的是A.原子序数X <Y <ZB.气态氢化物稳定性HX > H2Y > H3ZC.元素的非金属性X > Y > ZD.单质的氧化性X > Y > Z3、用“>”、”<”回答下列问题:⑴酸性:H2CO3H2SiO3H2SiO3H3PO4⑵碱性:Ca(OH)2Mg(OH)2Mg(OH)2Al(OH)3⑶气态氢化物的稳定性:H2O H2S H2S HCl【每日一练】1、下列各组元素中,按最高正价递增顺序排列的是()A、C、N、O、FB、K、Mg、C、S C、F、Cl、Br、ID、Li、Na、K、Rb2、元素的性质随着原子序数的递增,呈现周期性变化的根本原因是:A、原子半径从大到小的周期性变化B、化合价呈周期性变化C、单质熔沸点呈周期性变化D、原子核外电的排布呈周期性变化3、从Na到CI,原子半径最大的金属元素是,原子半径最小的非金属元素是。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《元素周期律》学案授课人:孙燕红学习目标:
1、了解原子结构与元素性质之间的关系,认识元素周期律。
2、学习透过现象看本质的科学抽象的方法。
3、初步形成世界是有规律的,并且规律是可以认识的。
学习方法:归纳推理、自主探究、合作学习
教学过程:
二、元素周期律
学与问:
(1)随着原子序数的递增,元素原子的电子层排布的周期性与原子半径的周期性之间是什么关系呢?
(2)随着原子序数的递增,元素原子的电子层排布的周期性与元素化合价的周期性之间是什么关系呢?
小结:
4、元素的金属性和非金属性的规律性变化(以第三周期元素为例)
(Ⅰ)实验探究元素的金属性(Na、Mg、Al)强弱
学生自主探究:设计实验验证Na、Mg、Al的金属性强弱
小结:金属性强弱的判断依据:
(1)
(2)
(3)
实验探究一:
自主探究
知识迁移:碱性强弱介于KOH和Mg(OH)2之间的氢氧化物是()A.NaOH B.Al(OH)3C.Fe(OH)3D.RbOH
(Ⅱ)元素的非金属性(Si、P、S、Cl)强弱
请阅读课本16页表三,总结:
同周期从左到右,非金属性逐渐;同主族从下到上,非金属性逐渐。
小结:非金属性强弱的判断依据:
(1)
(2)
(3)
知识迁移:
PH3、H2S、HCl的氢化物的稳定性逐渐;HClO4、H2SO4、H3PO4的酸性逐渐。
归纳:
通过以上对第三周期元素性质的比较,我们可以得出的结论:
Na 、Mg 、Al 、Si 、P 、S 、Cl的金属性逐渐,非金属性逐渐
归纳总结:元素周期律:。
元素周期律的实质:。
知识线
能力提升:
方法线
创新应用:
1、原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是():
A.电子层数
B.原子半径
C.最外层电子数
D.化合价
2、下列有关物质性质的比较正确的是()
A、同主族元素的单质从上到下,非金属性减弱,熔点增高
B、元素的最高正化合价在数值上等于它所在的族序数
C、同周期主族元素的原子半径越小,越难失去电子
D、元素的非金属性越强,它的气态氢化物越不稳定
3、下列有关原子结构和元素周期律的表述正确的是()
A、原子序数为15的元素的最高化合价为+3
B、ⅦA族元素是同周期中非金属性最弱的元素
C、第二周期ⅣA族元素的原子核电荷数和中子数一定为6
D、原子序数为12的元素位于元素周期表的第三周期ⅡA族
4、下列关于元素周期表和元素周期律的说法错误的是( )
A、Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B、第二周期元素从Li到F,非金属性逐渐增强
C、因为Na比K容易失去电子,所以Na比K的金属性强
D、O与S为同主族元素,且O比S的非金属性强
5、下列排列顺序正确的是()
A、热稳定性:H2O>HF>NH3
B、原子半径:Na>Al>S
C、酸性:H3PO4>H2SO4>HClO4
D、金属性:Al>Mg>Na
6、同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:H3XO4、H2YO4、HZO4,则:
(1)X、Y、Z的非金属性强弱顺序为_____________。
(2)气态氢化物的化学式分别为________________,
它们稳定性强弱为_____________________________。
(3)最高价氧化物对应水化物的酸性强弱为_______________________________________。
