鲁教版九年级全册 第二单元 第三节 原子的构成 说课稿-精选教学文档
鲁教版原子的构成说课稿鲁教版高中地理说课稿

鲁教版原子的构成说课稿鲁教版高中地理说课稿标题:鲁教版高中地理说课稿-原子的构成一、教学目标1. 知识与技能:了解原子的概念及其构成,掌握原子核、电子云、质子、中子的性质和相互关系。
2. 过程与方法:通过图示、实验、讨论和解构等方式,培养学生观察、实验、思考和解决问题的能力。
3. 情感、态度和价值观:培养学生对科学的兴趣和探究精神,提高对科学知识的欣赏和理解能力。
二、教学重点1. 原子的构成与组成结构。
2. 原子核、电子云、质子和中子的性质和相互关系。
三、教学内容1. 原子的概念与历史背景介绍。
2. 原子的组成结构及其性质。
四、教学过程1. 导入(5分钟)通过带入学生的生活实际,引发学生对原子的好奇和思考:我们平时接触到的物质都是由什么构成的?有没有发现它们可以不断地被分割,最终得到一种不能再被分割的最小粒子?2. 概念讲解(10分钟)介绍原子的概念及原子的历史背景,让学生了解到原子是物质的最小单位,并引导学生思考原子的构成。
3. 实验观察(15分钟)通过实验展示原子的构成:利用静电手势带电棒使金叶片散开,观察到这种现象后,引导学生思考金叶片散开的原因,并讲解静电作用和电子的概念。
4. 图示讲解(10分钟)通过图示展示原子的构成结构:引导学生观察质子、中子和电子的相互关系,讲解原子核、电子云和电子轨道等概念。
5. 概念解读(10分钟)进一步讲解原子核、电子云、质子、中子的性质和相互关系,让学生对原子的构成有更深入的理解。
6. 总结与讨论(5分钟)总结原子的构成及其性质,并引导学生讨论原子的重要性和应用。
五、教学手段1. 实物、图示和模型等以直观方式展示原子的构成。
2. 实验操作和观察,培养学生实验能力和观察力。
3. 問答互動,激发学生思考和表达能力。
六、教学资源1. 电子白板或投影仪等多媒体设备。
2. 实物展示材料:带电棒、金叶片等。
3. 图片、图表和模型等辅助教学材料。
七、教学评价1. 教师通过学生的回答、实验操作和讨论情况来进行评价,了解学生对原子构成概念的掌握程度。
鲁教版九年级上册化学教案:第二单元第三节原子的构成第1课时

鲁教版九年级上册化学教案:第二单元第三节原子的构成第1课时【教学目的】1.知识与技艺〔1〕经过学习原子结构的开展史,学会用历史唯心主义的观念来评价迷信家在迷信上的贡献,学会迷信研讨的普通方法。
〔2〕知道原子是由原子核和核外电子构成的,明白构成原子的这些粒子是如何构成原子的,以及在原子中微粒之间存在的规律。
2.进程与方法〔1〕充沛应用教材提供的图、表等资料,借助模型、多媒体等教学手腕,化笼统为直观,初步学会运用类比、想像、归结、概括等方法对获取的信息停止加工;〔2〕了解假说与模型是迷信研讨的重要方法;经过对图片图表的剖析讨论,增强对信息的搜集处置才干和交流才干3.情感态度和价值观〔1〕激起先生对微观世界的探求欲和学习化学的兴味;〔2〕对先生停止世界的物质性、物质的可分性的辩证唯心主义观念的教育。
〔3〕体会迷信开展的迂回性,感受迷信的神奇魅力,培育迷信素养【教学重点】〔1〕原子的外部结构【教学难点】〔1〕对〝原子不显电性〞的了解。
【课前预备】多媒体、原子结构的发现史的资料、原子结构的缩小模型、原子外部运动的动画片【课时布置】1 课时【教学进程】一、导入新课水分子很小,它的直径只要千万分之一毫米。
构成水分子的氢原子和氧原子岂不更小?这么小的原子还能不能再分呢?在历史上,人们曾经一度以为原子是最庞大的粒子了,不能再分红更小的粒子。
在化学变化中,原子是不能再分的,那么分开了化学变化,原子还能再分吗?二、新课学习英国化学家道尔顿提出过近代迷信原子论,他以为原子不可分。
他以为原子是庞大的不可联系的实心球体。
并以此为依据提出了原子实心球模型。
1897 年,英国物理学家汤姆森等人仔细剖析了高压放电管的阴极射线,发现它是由一种带负电荷的粒子构成的粒子流,这种粒子就是电子。
汤姆森停止了一系列实验后发现,不论阴极资料是什么,都会发射出电子。
这让他看法到,电子是一切物质的原子中共有的粒子!既然原子中存在更小的粒子,那么原子就是可分的。
鲁教版九年级化学教案-原子的构成
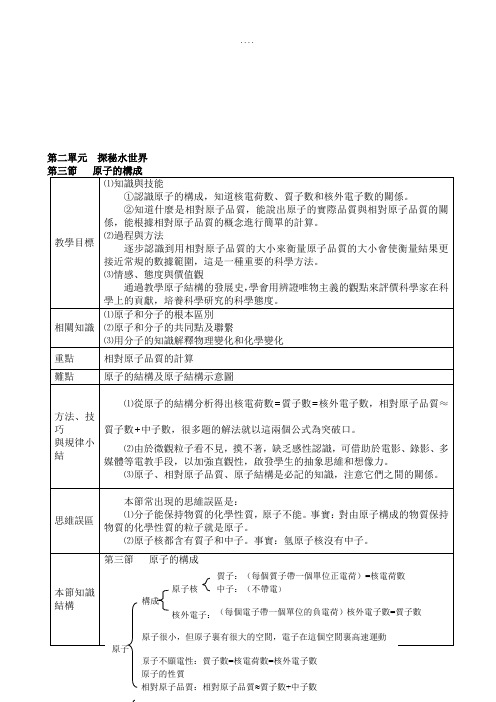
第二單元探秘水世界第三節 原子的構成一、原子的結構二、原子中的電子 1.核外的電子是分層排布的 (排布規律)2.原子結構示意圖3.原子的分類 ⑴金屬原子 ⑵非金屬原子 ⑶稀有氣體原子4.離子 書寫 分類5.元素週期表6.原子序數7.電子雲教 學 過 程 知 識 點 教 師 活 動學 生 活 動原子 (不顯電性) 原子核核外電子質子 中子二、原子中的電子1.核外的電子是分層排布的(排布規律)2.原子結構示意圖⑴在多電子的原子中,核外電子的能量不同,能量高的離核遠,能量低的離核近;⑵電子盡可能在離原子核近的電子層上運動;⑶每層最多容納2n2個電子(n為電子層);⑷最外層電子數不超過8個電子(離原子核最近的為第一層,第一層為最外層時電子數不超過2個)。
圖中小圓圈表示原子核,圈內數字表示核內質子數,“+”表示原子核帶正電,弧線表示電子層,弧線上的數字表示該層上的電子數。
瞭解排布規律記憶1~18號(即H~Ar)元素的順序、名稱和符號分析P41氧原子的結構示意圖3.原子的分類4.離子書寫分類陽離子陰離子⑴金屬原子,最外層電子一般少於4個,不穩定,易失去電子,帶正電荷。
⑵非金屬原子,最外層電子一般多於4個,不穩定,易得到電子,帶負電荷。
⑶稀有氣體原子,最外層電子一般為8個,(氦是2個),穩定,既不易失去、也不易得到電子。
在化學反應中,原子核是不變的,發生改變的是核外電子(最外層電子數)。
也是構成物質的一種微粒。
(帶電荷的原子或原子團)在元素符號的右上方,標出帶幾個單位的什麼電荷。
如:Mg2+,Al3+,F-,O2-帶正電荷的離子叫陽離子,如Na+,Mg2+,Al3+,H+等。
帶負電荷的離子叫陰離子,如:F-,O2-,Cl-,S2-等。
決定原子化學性質的是原子的最外層上的電子數。
小結:1.原子的結構2.原子結構示意圖3.離子的分類及符號表示並分析在結構上的特點。
結論分析P42NaCl的形成過程分析:離子所帶的電荷數與原子結構的關係?觀察離子符號的書寫,交流共用:構成物質的基本微粒——分子、原子、離子有何異同?它們之間有什麼關係?你能看出原子的性質與原子的核外電子排布有什麼關係?觀察附錄元素週期表能力提高:某微粒的結構示意圖為下圖所示,你能確定X的值嗎?它可以表示哪些微粒,試一一寫出。
鲁教版九年级全册(新) 第二单元第三节《原子的构成》教案

《原子的构成》学案教学目标:一、知识与技能:1、通过学习原子结构的发展史,学会用历史唯物主义的观点来评价科学家在科学上的贡献,学会科学研究的一般方法。
2、知道原子是由原子核和核外电子构成的,明白构成原子的这些粒子是如何构成原子的,以及在原子中微粒之间存在的规律。
二、过程与方法:了解假说与模型是科学研究的重要方法;通过对图片图表的分析讨论,增强对信息的收集处理能力和交流能力三、情感态度:体会科学发展的曲折性,感受科学的神奇魅力,培养科学素养教学方法:探究学习法类比法讨论法分析归纳法教材分析:学生通过学习人类对原子结构的认识过程,感受人类认识自然的客观规律,更深刻的领悟原子结构的知识是自然科学的重要基础知识之一,原子是构成物质的一种基本粒子,物质的组成,性质和变化都与原子结构密切相关。
教学过程:展示:温故而知新(2013.百色市)有关分子、原子的说法正确的是()A.分子是保持物质性质的最小粒子B.化学变化中分子、原子都可分C.花香四溢说明分子间有间隔D.原子是化学变化中的最小粒子引入:通过前面的学习我们知道在化学变化中分子可分,原子不可分即原子是化学变化中的最小粒子。
那么抛开化学变化这一前提,原子是否可以再分呢?对于原子的结构的问题,科学家们进行了整整一个世纪的研究和探讨。
我们这节课就通过重温科学家们的原子结构假说及实验推论,一起来揭示原子结构的奥秘。
板书:课题一:原子的构成讲解:我们先看一下在原子论中所描述的原子,展示:道尔顿的原子设想设问:你能否在生活中找到道尔顿的原子模型呢?学生:讨论回答铅球钢珠等过渡:我们看到道尔顿认为的原子是坚实的不可分割的实心球,然而英国的另外一位科学家汤姆森在1897年发现了电子,并通过实验进一步发现电子是所有原子的组成部分。
向人们证明了原子是可以再分的。
在此基础上提出了他的原子模型。
展示:了解汤姆森的原子设想设问:你能否在生活中找到汤姆森的原子模型呢?过渡:那么原子的内部结构究竟是怎样的,因为原子很小,我们无法把它打开来看,我们今天就请来神通广大,能大能小的一个人物----孙悟空,让他把自己缩小数亿亿倍,钻进原子的内部来一探原子的结构。
鲁教版九年级全册化学2.3原子的构成 说课稿

鲁教版九年级全册化学2.3原子的构成说课稿值观,(1)在了解原子结构模型发展的过程中,知道科学发展是循序渐进的。
(2)通过阅读张青莲教授的相关资料,了解中国人在科学发展中作出的贡献,进而增强学生的爱国情感。
三维一体的教学目标,以知识为主体,借助于掌握知识学习的过程,学习分析,归纳,对比的科学方法,同时发展学生的科学思想和爱国情感。
(三)教学的重、难点结合教材内容、学生情况,确定本节课的重点:认识原子的构成难点:认识原子的构成;了解相对原子质量的概念(四)课时安排一课时二、学情分析美国著名教育心理学家奥苏贝尔说,影响学习的唯一最重要的因素是学生已经知道了什么,要探明这一点,并应据此进行教学.”因此,教师必须重视对学生情况的掌握与分析。
(一)学生情况初中化学面对的是九年级学生,他们好奇心强,求知欲旺盛,乐于探究感兴趣的问题,对事物的认识正由感性向理性转变,但感性认识仍然占主导地位。
能力水平:学生初步具备了分析、归纳信息的能力,以及与人合作交流的能力,但有待于进一步发展。
知识水平:学生已经学习了分子、原子的概念,可以为本节课的学习起到铺垫作用(二)教法与学法结合本节课的教学目标和学生情况。
教法本节课将采用引导探究法,这种方法不仅重视知识的获得,同时关注学生获取知识的过程。
演示法,通过演示原子的图片及动画,提高学生的学习兴趣,同时发展学生的观察能力和抽象思维能力。
学法本节课将采用分析归纳法(通过分析图4-2中的有关数据,得出质子数=核外电子数,在此过程中提高学生归纳信息的能力),合作学习法(让学生在讨论交流中取长补短,培养学生的合作竞争意识),从而学生由“学会”变为“会学”。
三教学过程本着以学生发展为主的思想,结合本节课的教学目标和教学条件,设计以下教学过程:(一)创设情景激发兴趣上课前先请同学们观看:我国第一颗原子弹爆炸的相关图片,接着描述它的强大威力,并解释原子弹之所以具有如此强大的威力与原子的内部结构有着密切的关系,那原子的内部到底隐藏着什么奥秘?这样的导课方式开阔了学生的视野,同时激发了学生的探究欲望,从而顺利进入教学过程阶段二(二)活动探究得出新知活动探究一:原子的构成先向学生简单介绍原子结构模型建立的发展历史,19世纪初英国科学家道尔顿提出原子是一个“坚硬的实心小球”。
鲁教版九年级上册化学教案:第二单元 第三节 原子的构成

第三节原子的构成[教学目的]知识与技能:1、知道原子的构成、原子核外电子是分层排布以及原子质量的计算。
2、理解原子构造的表示方法,知道原子构造示意图的含义。
3、理解原子最外层电子数与元素化学性质的关系。
过程与方法:1、通过想像、猜测—探究、证明—归纳和学生间互相讨论、交流,增强学生归纳知识、获取知识的才能。
情感态度与价值观:1.培养学生对微观世界学习的乐趣,初步体会物质构成的奥秘,培养抽象思维才能、想象力和分析推理才能。
2.树立“构造决定性质〞、“物质的微粒性〞等辩证唯物主义观。
[教学重点、难点]1、教学重点:原子的构造、离子的形成、原子质量计算。
2、教学难点:核外电子的排布。
3、[教学过程]一、原子的构成1.提问:〔1〕什么是分子、原子?分子是保持物质化学性质的最小粒子。
原子是化学变化中的最小粒子。
〔2〕分子和原子的最大区别是什么?在化学变化中,分子可以再分成原子,而原子不能再分。
2. 发挥想象,说说你对原子的最初认识,原子的外形可能是什么样的?〔1〕猜测:原子不能分。
1)、原子可能是一个实心球体。
2)、原子可能像一个乒乓球。
3)、原子可能像一个樱桃。
19世纪末前的科学家,如道尔顿。
当时人们都认为原子不可分其实,原子不是一个个简单的、实心的球体,而是一个空心球,几个小粒子围绕着一个大粒子运动。
但这些粒子是什么呢?其中居于原子中心的大粒子就是原子核,原子核带正电;小粒子就是电子,电子带负电,它们在原子核外的一定范围内作高速的运动。
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
原子的构成示意图原子构造模型图〔2〕原子核还能不能再分呢?想一想原子弹的爆炸?原子弹爆炸正是利用原子核裂变时产生的宏大能量,这说明原子核还能再分。
科学研究说明:原子核也不是简单的、不可分割的,它由质子和中子两种粒子构成。
科学研究还发现,质子带正电,中子不带电。
构成原子的粒子的电性和质量〔表1〕〔3〕请你找出不同种类原子的区别。
鲁教版九年级化学上册第二单元第三节原子的构成说课讲稿

第三节原子的组成讲课稿三各位领导,老师:大家好!第一感谢学校给了我此次学习和锻炼的时机。
今日,我讲课的内容是《原子的组成》,不足之处敬请大家提出责备与建议。
本课题,我将从教材剖析、教法剖析、学法指导、教课过程、板书设计、教后反省六个方面说说我的教课方案。
一、教材剖析:1、教材的地位和作用:本课题包含原子的组成和相对原子质量两部分内容,第一部分要点介绍原子的组成,同时介绍了原子不显电性的原由,而后又形象的介绍了原子的大小,以及原子中各部分的大小和运动状况。
第二部分介绍相对原子质量,因为原子的质量太小,书写和使用都很不方便,于是采纳相对原子质量来表示原子的质量。
教材还经过介绍张青莲教授的事迹对学生进行爱国主义教育。
2、教课目的(1)知识与技术目标:①认识原子是由质子、中子和电子组成的。
②初步认识相对原子质量的看法,并会查相对原子质量表。
(2)过程与方法目标:充足利用教材供给的图、表等资料,初步学会运用类比、想象、归纳、归纳等方法获守信息并进行加工。
(3)感情态度与价值观目标:①对学生进行物质可分性的辩证唯心主义看法教育。
②联合张青莲教授的优秀贡献资料,对学生进行爱国主义教育。
3、教课重、难点要点是原子的组成和相对原子质量。
难点是原子不显电性的原由和相对原子量看法的形成。
二,学生剖析我们学校地处偏僻地域,学生课外知识有限的,而本课题内容又较抽象,远离学生的生活经验,所以讲堂上需要老师尽可能的多供给一些信息,激发学生的学习兴趣,帮助学生打破难点。
幸亏在此以前,学生已经学习了分子原子的看法,初步研究了物质组成的神秘。
可是,他们其实不知道原子能否就是组成物质的最小粒子,它的质量究竟有多大,本课题就是要解决学生的这些问题。
三、教法剖析:基于本单元知识比较抽象,理论性较强,波及的实验较少,所以在教课中采纳研究议论法、情形教课法、剖析比较法与指导学生阅读、组织学生议论相联合来进行教课。
四、学法指导:初中学生以经验型的逻辑思想为主,理解抽象的看法和结论存在必定困难,在教师指引和帮助下,学生能睁开想象,经过形象的比喻来理解。
鲁教版化学九年级上册 第二单元 第三节 原子的构成-教案

原子的构成【教学目标】1.认识原子的组成及核电荷数、质子数和核外电子数的关系。
2.了解原子、分子和离子的异同点和相互关系,会用原子和分子的观点说明化学反应的发生过程。
3.了解原子的实际质量和相对原子质量的意义,理解相对原子质量的概念。
4.学会计算原子的相对原子质量。
【教学重难点】1.相对原子质量的意义。
2.原子、分子和离子的异同点和相互关系。
【教学过程】一、原子的结构1.讨论交流分子和原子有什么区别?2.近代化学之父道尔顿在200年前提出:“没有人能将原子再分”的论断。
你认为道尔顿的论断科学吗?你的依据有哪些?3.阅读课本认识原子的结构,思考交流:为什么绝大多数的α粒子能够顺利穿过金箔,而只有极少数被反弹回来?材料阅读:最早发现电子的科学家——英国科学家汤姆森。
粒子轰击金箔实验结论:(1)原子是由原子核和核外电子构成的,电子在原子核外“很大”的空间里运动。
(2)原子核是由带正电荷的质子和不带电的中子构成。
(3)质子和中子的质量差不多,都约为电子质量的1836倍。
(4)原子核所带的正电荷数简称核电荷数。
(5)质子数=核电荷数=核外电子数(6)原子的质量主要集中在原子核上。
4.原子很小,是不是不能再分了?若能分你的证据是什么?二、认识原子中的电子1.阅读教材,明确原子结构示意图表示的意义,并对电子的得失形成初步印象。
尝试画出钠原子、氯原子(17个质子)的原子结构示意图。
2.电子对原子的性质的影响,分析钠原子、氯原子得失电子的可能情况。
(1)在多电子的原子中,核外电子的能量不同,能量高的离核远,能量低的离核近;(2)电子尽可能在离原子核近的电子层上运动;(3)每层最多容纳2n2个电子(n为电子层);(4)最外层电子数不超过8个电子(离原子核最近的为第一层,第一层为最外层时电子数不超过2个)。
(课件展示氧原子结构图)图中小圆圈表示原子核,圈内数字表示核内质子数,“+”表示原子核带正电,弧线表示电子层,弧线上的数字表示该层上的电子数。
九年级化学全套教案鲁教版第二单元第三节原子的结构

课题:第三节认识原子(第一课时)•教学目标1、认识原子的组成及核电荷数、质子数和核外电子数的关系。
2、了解原子、分子和离子的异同点和相互关系,会用原子和分子的观点说明化学反应的发生过程。
3、进一步认识事物的可分性,逐步培养学生树立物质的变度能引起质变的辨证唯物主义观点,培养学生的观察能力、分析综合能力和抽象综合能力。
•重点和难点重点:原子的组成难点:原子、分子和离子的异同点和相互关系。
•教学方法自学研究法、讲述法、谈话法、讨论法。
•教学媒体选择多媒体系统•教学内容分析“认识原子”这一节的主要内容是认识原子的结构和相对原子质量,第一课时主要是原子的结构和电子的知识。
小结时重点应放在原子、分子的主要区别上,也就是看两种微粒在化学反应里能否再分,可以采取总结、对比、讨论的方法促进理解。
在上一节的学习中,学生已经掌握了有关化合反应、分解反应的概念,这是引导学生从分子认识原子的十分有效的基础知识。
通过物质的分解反应可以从宏观上观察到一种物质分解成两种或两种以上的其他物质,再从“分子是保持物质化学性质的微粒”来分析,能推断出分子是可分的,从而引出原子能否可分的问题。
•教学对象分析在“原子能不能再分”教学中,就目前的实验手段来说,还难以让人们直接看到原子的内部结构,在此化学启蒙阶段,学生乂缺乏分析推断原子结构的知识基础,比较理想的方法是用描述原子结构的动画片,使学生对原子结构有一个比较形象的了解。
在节课教学之前,学生头脑中已形成了一系列有关分子的形象,而且原子概念乂是通过分析反应导出的,所以有必要让学生活楚的对原子和分子加以对比,了解二者的相似、相异和相关之处。
在教学中,对丁电子的运动,既不能套用宏观物体的运动规律去体会微观粒子的运动状态, 乂不能不以宏观物体的运动状态为例来描述原子核和电子的行为,否则学生将无法建立起有关的形象,应该向学生指出电子在核外作高速运动,与汽车在公路上奔驰、人造卫星按一定轨道绕地旋转是不同的,它没有固定的线性轨道。
原子的结构说课稿鲁教版

原子的结构说课稿鲁教版尊敬的评委老师们,我是化学组8号考生,我将为大家讲解《原子的构成》这一课题。
从教材分析、学情分析、教学方法、教学过程、板书设计等几个方面,我将详细介绍我的教学内容。
首先,我想谈一下我的教材认识。
本节课是选自鲁教版九年级化学上册第二单元第三小节。
它是在学生研究分子、原子的基础上,深入探究原子内部构成的一节课,是学生今后研究化学的重要理论基础,同时也为学生研究元素打下基础,起到了承上启下的作用。
为了符合新课程标准和学生的认知特点,我制定了以下教学目标:知识与技能方面:了解原子是由质子、中子和电子构成的,以及原子中各粒子之间的数量关系。
过程与方法方面:学会运用观察、分析、归纳的方法获取信息,并对信息进行加工处理,提高自主探究的能力。
情感态度与价值观方面:体会到人们对物质世界的认识是不断深入、艰难曲折的,感受到科学实验在科学发展中的重要作用,养成科学探究的研究精神。
基于对教材内容的分析和教学目标,我确立了本节课的重点:理解原子的构成。
难点在于理清各粒子之间的数量关系。
接下来,我将进行学情分析。
在研究本课题之前,学生已经初步了解了微观世界,但空间想象能力较差,对原子的构成认识起来将十分困难。
因此,我采用了“自主研究、探究展示、感悟提升”及“自学、展示、点拨、练、小结”的三环五步式导学案课堂模式,以问题引出、小组交流、讲解点拨的教学方法,使学生在自学探究、合作交流中获得知识、增长能力。
接下来是具体的教学过程:我设计了四个环节:创设情境、导入新知;逐层深入、获得新知;点拨探究、扩展新知;课堂练、迁移新知。
第一个环节:创设情境、导入新知。
我会让学生回忆分子的特征,接着提出分子已经很小了,构成分子的原子岂不是更小,那么它能不能再分呢?它是否是构成物质的最小粒子呢?今天,我们将有效地解答这个问题。
通过设置问题情境,既激发了学生的研究兴趣,又自然而然地进入了第二个环节:逐层深入、获得新知。
首先,我会用多媒体展示教学目标,让学生从整体上感知,从而明确努力方向。
鲁教版九年级上册化学教案:第二单元 第三节 原子的构成-精选学习文档

第三节原子的构成[教学目标]知识与技能:1、知道原子的构成、原子核外电子是分层排布以及原子质量的计算。
2、了解原子结构的表示方法,知道原子结构示意图的含义。
3、了解原子最外层电子数与元素化学性质的关系。
过程与方法:1、通过想像、猜想—探索、证明—归纳和学生间相互讨论、交流,增强学生归纳知识、获取知识的能力。
情感态度与价值观:1.培养学生对微观世界学习的乐趣,初步体会物质构成的奥秘,培养抽象思维能力、想象力和分析推理能力。
2.树立“结构决定性质”、“物质的微粒性”等辩证唯物主义观。
[教学重点、难点]1、教学重点:原子的结构、离子的形成、原子质量计算。
2、教学难点:核外电子的排布。
3、[教学过程]一、原子的构成1.提问:(1)什么是分子、原子?分子是保持物质化学性质的最小粒子。
原子是化学变化中的最小粒子。
(2)分子和原子的最大区别是什么?在化学变化中,分子可以再分成原子,而原子不能再分。
2. 发挥想象,说说你对原子的最初认识,原子的外形可能是什么样的?(1)猜想:原子不能分。
1)、原子可能是一个实心球体。
2)、原子可能像一个乒乓球。
3)、原子可能像一个樱桃。
19世纪末前的科学家,如道尔顿。
当时人们都认为原子不可分其实,原子不是一个个简单的、实心的球体,而是一个空心球,几个小粒子围绕着一个大粒子运动。
但这些粒子是什么呢?其中居于原子中心的大粒子就是原子核,原子核带正电;小粒子就是电子,电子带负电,它们在原子核外的一定范围内作高速的运动。
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。
原子的构成示意图原子结构模型图(2)原子核还能不能再分呢?想一想原子弹的爆炸?原子弹爆炸正是利用原子核裂变时产生的巨大能量,这说明原子核还能再分。
科学研究表明:原子核也不是简单的、不可分割的,它由质子和中子两种粒子构成。
科学研究还发现,质子带正电,中子不带电。
构成原子的粒子的电性和质量(表1)(3)请你找出不同种类原子的区别。
鲁教版化学九年级上册 第二单元 第三节 原子的构成-教案

第三节原子的构成原子中的电子广西贵港市覃塘区覃塘镇第一初级中学【教学设计思路分析】根据新课标的要求,让学生以轻松愉快的心情去认识微观的化学世界。
积极探究化学奥秘,形成持续学习化学的兴趣。
从学生已有的知识出发,让他们在熟悉的生活情景中感受化学的重要性。
为了突出重点,突破难点,本设计将结合教材图表,以人类已认识原子中的电子为主线,引导学生展开探究性学习活动,创设条件,引导学生通过阅读教材,观察图表、讨论交流等方式自主学习,探究,让学生体验科学探究过程,把微观知识宏观化,理性知识感性化,结合科学推理与史料佐证认识原子中的电子。
让学生积极主动地体验探究过程,逐步形成终身学习的意识和能力。
【教材内容分析】原子中的电子是本单元乃至整个初中化学学习的重点,在上节课学习原子结构的基础上,本节课着重学习核外电子的有关知识。
而原子中的电子内容抽象、远离学生的生活经验,并且教材语言以结论性的叙述性语言为主,这成为本节教学的难点。
了解核外电子是分层排布的,电子层离核的远近与电子的能量有关,知道原子结构示意图各部分的含义,了解原子的化学性质主要由原子的最外层电子数决定,强调化学反应中原子不可分,是指原子核不变,发生改变的是原子核外的电子。
知道离子的表示方法。
对原子、分子、离子进行比较。
本节课充分体现了现代寓教于乐的教学方式,同时也成为学生学习解释微观世界实际问题的过程。
【教学目标】1.知识与技能:(1)知道核外电子的排布规律。
(2)理解原子结构示意图各部分表示的意义。
(3)了解离子的形成及离子符号的书写。
2.过程与方法:( 1 )通过阅读分析、比较归纳的方法来学习有关的知识,培养学生观察能力、分析综合能力和抽象思维能力,通过情景的创设来激发学生学习微观知识的兴趣。
(2)运用形象恰当的比喻减少学生对微观世界的神秘感。
3.情感、态度、价值观:(1)通过原子中电子的学习,进行世界是物质的,物质是可分的辩证唯物主义观点教育。
(2)激发学生对微观世界的探究欲和学习化学的兴趣。
鲁教版九年级全册第二单元第三节原子的构成说课稿

下面我将从4个环节谈谈我的教学进程。
环节一,情境创设
经过动画模拟电解水的微观进程,提出效果:在化学变化中,原子不可分,是不是在任何状况下,原子都不可分呢?这样在惹起先生猎奇心的同时,激起学习的兴味,进而导入课题。
鲁教版九年级全册第二单元第三节原子的构成说课稿
首先谈谈我对教材的了解,本节课是在先生学习了水分子的变化基础上的进一步延伸,也为之后学习原子中的电子奠定基础,在教材中起着承上启下的作用。
为了做到因材施教我将对先生状况停止预测,8年级的先生笼统逻辑思想才干和归结概括才干曾经初步构成,喜欢自主的学习环境,有较强的求知欲和表现欲。
播放描画原子结构的视频,引导先生发现原子的外部结构:原子是由原子核与核外电子构成的,原子核是由质子和中子构成的,一个质子带一个单位正电荷,中子不带电,一个电子带一个单位负电荷。从而了解原子不带电的缘由:在同一原子中,质子数=电子数。提高先生的微观思想才干。
在这儿先生能够会发生疑惑:原子核与电子电性相反,为什么没有吸引到一同呢?鉴于先生知识水平,可以复杂说明:由于电子在核外高速运动,靠向心力使电子不被吸引到原子核上,而正是由于正负电荷的相互吸引,电子也不至于脱离原子核的约束。
展现〝几种原子的构成〞。引导先生发现:在原子中,质子数=核电荷数=核外电子数,不同原子质子数不同。并提示先生:质子数不一定等于中子数,并不是一切的原子中都有中子。让先生了解与微观对比图片,让先生了解,原子也是构成物质的一种基本粒子,金、金刚石都是由原子构成的。并经过以下三个事例:1,报纸上的一个墨点含有的原子数。2,长时间一同放置的铁块与铅块会融合在一同。3,水银温度计中的水银在受热时体积会增大,遇冷时体积会增加。让先生交流讨论,总结出原子的性质,原子的质量体积都很小、原子之间存在距离和相互作用、总在不时运动。让先生体会微观与微观之间的联络,逐渐树立微粒观。
鲁教版九年级上册化学教案:第二单元第三节原子的构成第2课时

鲁教版九年级上册化学教案:第二单元第三节原子的构成第2课时【教学目的】1.知识与技艺〔1〕知道什么是相对原子质量,能说出原子的实践质量与相对原子质量的关系,能依据相对原子质量的概念停止复杂的计算。
〔2〕知道原子核外的电子是分层排布的。
〔3〕原子得失电子后会构成离子〔4〕知道离子的表示方法2.进程与方法〔1〕逐渐看法到用相对原子质量的大小来权衡原子质量的大小会使权衡结果更接近惯例的数据范围,这是一种重要的迷信方法。
〔2〕经过多媒体教学手腕及直观的言语,诱发先生的想像力,添加先生对微观粒子的理性看法3.情感态度和价值观〔1〕停止世界是物质的、物质是运动的等辨证唯心主义观念教育。
【教学重点】〔1〕相对原子质量的计算〔2〕对原子结构表示图的剖析【教学难点】〔1〕原子结构表示图〔2〕相对原子质量的意义【课前预备】多媒体素材【课时布置】1 课时【教学进程】一、导入新课虽然一切原子都十分庞大,但是它们的质量仍存在差异。
例如,1个氧原子的质量为2.657×10-26kg,1个铁原子的质量为9.288×10-26kg。
这么小的数字,书写、记忆和运算都很不方便,为此,国际上一致采用相对原子质量来计量原子的质量。
二、新课学习二、原子质量的计量以碳12 原子质量的1/12 作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量。
视频:相对原子质量在这里值得我们留意的是:相对原子质量不是原子的真实质量,是个比值原子实践质量越大,它的相对原子质量数值越大相对原子质量的单位是 1我们读表格:一些常用的相对原子质量表中的相对原子质量数值全部采用〝四舍五入〞法取整数值〔氯由上表可知:计量原子的质量时,采用〝碳 12 原子质量的1/12〞作为基准,所得的相对原子质量数值要比采用〝千克〞作为基准所得的实践原子质量数值更繁复,更便于比拟和运算。
例:1个碳原子的质量是1.993×10-26Kg,一个硫原子的质量是5.3152×10-25Kg,求硫原子的相对原子质量?[解:规范=1.993×10-26Kg×1/12=1.66×10-27Kg硫原子的相对原子质量=5.3152×10-25Kg/1.66×10-27Kg=32答:硫原子的相对原子质量是 32]读表格,找出相对原子质量与粒子个数的关系[相对原子质量≈质子数+中子数]多识一点:计量中的迷信一要迷信选择计量单位,以使得计量结果易于比拟和运算。
鲁教版化学九年级上册第二单元第三节 原子的构成学案资料

第三节原子的构成(第一课时)一、学习目标1、认识原子的组成及核电荷数、质子数和核外电子数的关系。
2、了解原子、分子和离子的异同点和相互关系,会用原子和分子的观点说明化学反应的发生过程。
二、学习重难点重点:原子的组成难点:原子、分子和离子的异同点和相互关系。
三、自主学习提纲:(一)复习探讨你所知道的分子和原子有什么区别?(二)、阅读课本P36—— P37相关内容,认真观察图片,思考所标示的意义,先对以下问题独立思考解答,然后再组内交流,找出最佳解决方案。
1、有分子构成的物质在发生物理变化时分子本身,发生化学变化时分子,但原子。
2、发现电子的是。
汤姆森与卢瑟福推断出的原子结构有哪些异同点。
谁的更准确些?3、观察α粒子轰击金箔实验图片,思考为什么绝大多数的α粒子能够顺利穿过金箔,而只有极少数被反弹回来?结论:原子是由居于原子中心的和构成的,原子核是由和构成。
每个质子带一个单位的,而中子。
每个电子带一个单位的。
(三)阅读课本P38相关内容,仔细识记、分析活动天地中的各原子的数据。
完成下列问题:1、核电荷数= =2、根据氢原子、碳原子的数据你可以得到那些结论?3、讨论原子与分子有哪些区别与联系?(四)认识原子中的电子:阅读P39—— P40内容,小组内合作交流,解决下列问题。
1、原子的核外电子是怎样排布的?依据是什么?2、认真观察分析氧原子的结构示意图,尝试画出碳原子、镁原子的结构示意图,并分别指出质子数、电子层数、最外层电子书。
3、在化学变化中原子是否容易得失电子,与其密切相关。
也就是说决定原子的化学性质。
4、在化学变化中,原子核是的,发生改变的是。
原子失去电子后变成,得到电子后变成。
构成食盐的微粒。
5、认真分析氯化钠的形成过程,分析得失电子与离子的电性的关系。
6、构成物质的基本微粒有、、。
四、课堂反思:学到了什么?本节课你有哪些收获?还有什么疑问?五、当堂作业:1.一般原子的原子核()A 由电子和质子构成 B由质子和中子构成C 由电子和中子构成 D不能再分2.原子里的质子数等于()A 中子数 B电子数 C中子数和电子数之和 D核电荷数3.发现电子的科学家为()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环节一,情境创设
通过动画模拟电解水的微观过程,提出问题:在化学变化中,原子不可分,是不是在任何情况下,原子都不可分呢?这样在引起学生好奇心的同时,激发学习的兴趣,进而导入课题。
环节二,新课讲授
首先播放有关原子结构发现史的视频,让学生了解汤姆森发现电子的过程。展示卢瑟福做的а粒子轰击金箔实验的模拟图。让学生了解实验原理,并思考:如果原子像汤姆森原子模型那样,这一束а粒子射到原子上,会出现怎样的情形?可类比多发子弹射到一只西瓜上,再展示卢瑟福实验的结果。引导学生由实验现象推导出原子的内部结构。学习科学家严谨认真、敢于质疑的科学精神。
展示“几种原子的构成”。引导学生发现:在原子中,质子数=核电荷数=核外电子数,不同原子质子数不同。并提醒学生:质子数不一定等于中子数,并不是所有的原子中都有中子。让学生了解原子内部各微粒的之间的数量关系。ቤተ መጻሕፍቲ ባይዱ
展示金、金刚石的宏观与微观对比图片,让学生了解,原子也是构成物质的一种基本粒子,金、金刚石都是由原子构成的。并通过以下三个事例:1,报纸上的一个墨点含有的原子数。2,长时间一起放置的铁块与铅块会融合在一起。3,水银温度计中的水银在受热时体积会增大,遇冷时体积会减少。让学生交流讨论,总结出原子的性质,原子的质量体积都很小、原子之间存在间隔和相互作用、总在不断运动。让学生体会宏观与微观之间的联系,逐步建立微粒观。
情感态度与价值观目标:通过对原子结构的学习,让学生体会宏观与微观之间的联系,逐步建立微粒观。
研读教材,本节课教学重难点是:了解原子的特征及内部结构。
为了更好地讲解重难点,我将把讨论交流法、启发引导法以及多媒体教学法等相结合进行教学,充分调动学生的积极性,让学生成为学习的主人。
下面我将从4个环节谈谈我的教学过程。
宋以后,京师所设小学馆和武学堂中的教师称谓皆称之为“教谕”。至元明清之县学一律循之不变。明朝入选翰林院的进士之师称“教习”。到清末,学堂兴起,各科教师仍沿用“教习”一称。其实“教谕”在明清时还有学官一意,即主管县一级的教育生员。而相应府和州掌管教育生员者则谓“教授”和“学正”。“教授”“学正”和“教谕”的副手一律称“训导”。于民间,特别是汉代以后,对于在“校”或“学”中传授经学者也称为“经师”。在一些特定的讲学场合,比如书院、皇室,也称教师为“院长、西席、讲席”等。知识与技能目标:了解原子的特征及内部结构。
我说课的题目是《原子的结构》。我将从教材,学情、教学目标、教法学法、教学过程、板书设计等几个方面进行我的说课。
教师范读的是阅读教学中不可缺少的部分,我常采用范读,让幼儿学习、模仿。如领读,我读一句,让幼儿读一句,边读边记;第二通读,我大声读,我大声读,幼儿小声读,边学边仿;第三赏读,我借用录好配朗读磁带,一边放录音,一边幼儿反复倾听,在反复倾听中体验、品味。首先谈谈我对教材的理解,本节课是在学生学习了水分子的变化基础上的进一步延伸,也为之后学习原子中的电子奠定基础,在教材中起着承上启下的作用。
播放描述原子结构的视频,引导学生发现原子的内部结构:原子是由原子核与核外电子构成的,原子核是由质子和中子构成的,一个质子带一个单位正电荷,中子不带电,一个电子带一个单位负电荷。从而理解原子不带电的原因:在同一原子中,质子数=电子数。提高学生的微观思维能力。
在这儿学生可能会产生疑惑:原子核与电子电性相反,为什么没有吸引到一起呢?鉴于学生知识水平,可以简单说明:由于电子在核外高速运动,靠离心力使电子不被吸引到原子核上,而正是由于正负电荷的相互吸引,电子也不至于脱离原子核的束缚。
要练说,先练胆。说话胆小是幼儿语言发展的障碍。不少幼儿当众说话时显得胆怯:有的结巴重复,面红耳赤;有的声音极低,自讲自听;有的低头不语,扯衣服,扭身子。总之,说话时外部表现不自然。我抓住练胆这个关键,面向全体,偏向差生。一是和幼儿建立和谐的语言交流关系。每当和幼儿讲话时,我总是笑脸相迎,声音亲切,动作亲昵,消除幼儿畏惧心理,让他能主动的、无拘无束地和我交谈。二是注重培养幼儿敢于当众说话的习惯。或在课堂教学中,改变过去老师讲学生听的传统的教学模式,取消了先举手后发言的约束,多采取自由讨论和谈话的形式,给每个幼儿较多的当众说话的机会,培养幼儿爱说话敢说话的兴趣,对一些说话有困难的幼儿,我总是认真地耐心地听,热情地帮助和鼓励他把话说完、说好,增强其说话的勇气和把话说好的信心。三是要提明确的说话要求,在说话训练中不断提高,我要求每个幼儿在说话时要仪态大方,口齿清楚,声音响亮,学会用眼神。对说得好的幼儿,即使是某一方面,我都抓住教育,提出表扬,并要其他幼儿模仿。长期坚持,不断训练,幼儿说话胆量也在不断提高。综合以上分析,结合新课改要求,我制定以下三维教学目标:
“教书先生”恐怕是市井百姓最为熟悉的一种称呼,从最初的门馆、私塾到晚清的学堂,“教书先生”那一行当怎么说也算是让国人景仰甚或敬畏的一种社会职业。只是更早的“先生”概念并非源于教书,最初出现的“先生”一词也并非有传授知识那般的含义。《孟子》中的“先生何为出此言也?”;《论语》中的“有酒食,先生馔”;《国策》中的“先生坐,何至于此?”等等,均指“先生”为父兄或有学问、有德行的长辈。其实《国策》中本身就有“先生长者,有德之称”的说法。可见“先生”之原意非真正的“教师”之意,倒是与当今“先生”的称呼更接近。看来,“先生”之本源含义在于礼貌和尊称,并非具学问者的专称。称“老师”为“先生”的记载,首见于《礼记?曲礼》,有“从于先生,不越礼而与人言”,其中之“先生”意为“年长、资深之传授知识者”,与教师、老师之意基本一致。过程与方法目标:鼓励学生相互交流讨论,形成良好的学习习惯和学习方法。
