氧化还原反应方程式的书写幻灯片课件
合集下载
《氧化还原反应》PPT课件优秀课件

公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
【情境·思考】 《中国诗词大会》是央视首档全民参与的诗词节目,节 目以“赏中华诗词、寻文化基因、品生活之美”为基 本宗旨,力求通过对诗词知识的比拼及赏析,带动全民 重温那些曾经学过的古诗词,分享诗词之美,感受诗词 之趣,从古人的智慧和情怀中汲取营养,涵养心灵。
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
提示:②不涉及。“粉身碎骨浑不怕,要留清白在人间” 实质是碳酸钙的分解和氧化钙与水的反应,都没有元素 化合价的变化,不属于氧化还原反应。
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
失氧 物质
结论
Fe2O3
CuO
发生_还__原__反应
氧化反应与还原反应__同__时_发生
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
3.从电子转移的角度认识氧化还原反应
分析
氧化 反应
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
【情境·思考】 《中国诗词大会》是央视首档全民参与的诗词节目,节 目以“赏中华诗词、寻文化基因、品生活之美”为基 本宗旨,力求通过对诗词知识的比拼及赏析,带动全民 重温那些曾经学过的古诗词,分享诗词之美,感受诗词 之趣,从古人的智慧和情怀中汲取营养,涵养心灵。
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
提示:②不涉及。“粉身碎骨浑不怕,要留清白在人间” 实质是碳酸钙的分解和氧化钙与水的反应,都没有元素 化合价的变化,不属于氧化还原反应。
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
失氧 物质
结论
Fe2O3
CuO
发生_还__原__反应
氧化反应与还原反应__同__时_发生
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
3.从电子转移的角度认识氧化还原反应
分析
氧化 反应
公 开 课 课 件 优质课 课件PP T优秀课 件PPT 免费下 载《氧 化还原 反应》 PPT课件
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应PPT精品教学人教版

练一练:
• 根据化合价升降判断下列化学反 应是否为氧化还原反应:
① Na20+ H2O = 2NaOH
否
② Zn+2HCl = ZnCl2+H2↑ 是
③ H2+Cl2 = 2HCl
是
④ 2KClO 3 △ 2KCl +3O 2↑ 是
氧化还原反应PPT精品教学人教版(优 秀课件 )
氧化还原反应PPT精品教学人教版(优 秀课件 )
氧化剂:在反应中含元素化合价降低的物质 还原剂:在反应中含元素化合价升高的物质 被氧化:一般指化合价升高的那种元素被氧化 被还原:一般指化合价降低的那种元素被还原 氧化产物:被氧化得到的产物 还原产物:被还原得到的产物
氧化还原反应PPT精品教学人教版(优 秀课件 )
氧化还原反应PPT精品教学人教版(优 秀课件 )
氧化还原反应PPT精品教学人教版(优 秀课件 )
从得失氧的角度定义氧化还原反应: __物__质_得__到_氧__的__反_应____叫氧化反应. __物__质_失__去_氧__的__反_应____叫还原反应. __有__氧_得__失_的__反__应____叫氧化还原反应.
氧化反应和还原反应是兼于一体的,两者 同时存在,同时发生,不可截然分开。
+1
H2
-2
O
+
0
C
高温
==
0
H2
+
+2 -2
CO
化合价升高 得到氧,被氧化(发生氧化反应)
[定义]有元素化合价升降的化学反应称为氧化还原反应
氧化还原反应PPT精品教学人教版(优 秀课件 )
氧化还原反应PPT精品教学人教版(优 秀课件 )
00
+4 -2
氧化还原反应- ppt完整版79页PPT

❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
氧化还原反应- ppt完整版
•
46、寓形宇内复几时,曷不委心任去 留。
•
47、采菊东篱下,悠然见南山。
•
48、啸傲东轩下,聊复得此生。日 有所长 。
•
50、环堵萧然,不蔽风日;短褐穿结 ,箪瓢 屡空, 晏如也 。
谢谢你的阅读
氧化还原反应 课件(共38张PPT)

高温
H2 O + C == H2 + CO
得到氧,被氧化〔发生氧化反响〕
氧化反响和复原反响是分别独立进行的吗?
思考与交流
仔细从整个反响分析下面反响的反响类型:
失去氧, 被复原
CuO + H2 = Cu + H2O 得到氧,被氧化
CuO失去氧变成单质铜的同时, 还原反应
H2得到氧变成H2O。
氧化反应
〔一〕从得氧失氧角度来分析:
△
CuO + H2 == Cu + H2O
H
Cu
O
H
Cu
O
H
H
氧化反响:物质得到氧的反响,如H2得到氧的反响。 复原反响:物质失去氧的反响,如CuO失去氧的反响。
失去氧,被复原〔发生复原反响〕
△
CuO + H2 == Cu + H2O
得到氧,被氧化〔发生氧化反响〕 失去氧,被复原〔发生复原反响〕
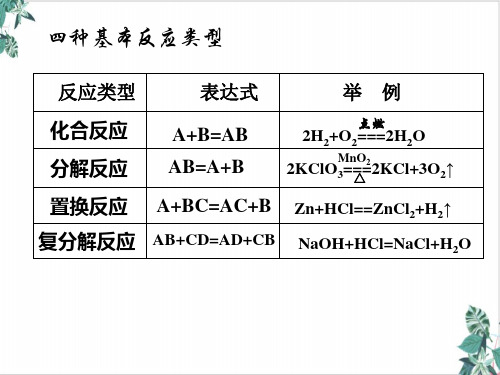
分解反响 化合反响 置换反响 复分解反响
一、氧化复原反响
〖练习〗判断以下哪些是氧化复原反
响?属于哪种根本反响类型?
√ Cu+Cl2 =△== CuCl2
化合 反响
× CaO + H2O === Ca(OH) 2
× CaCO3=高=温=CaO+CO2 ↑
分解反应
√ 2KClO3==△=2KCl+3O2 ↑
A.一定被氧化
B.一定被复原
C.可能被氧化,也可能被复原
D.以上都不是
2、以下变化属于氧化反响的是〔 〕BD
A. Fe2O3
Fe B. Zn ZnCl2
C. Na2CO3 CO2 D. Al Al2O3
一、氧化复原反响
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三届全国优秀微课程展示作品
氧化还原反应方程式的书写
化学 高三
蒙城县化学名师工作室 安徽省蒙城县第八中学 安徽省蒙城县第二中学
魏香三 魏 喆
氧化还原反应是高考的重点, 也是高考的难点。
例1(2009安徽27)某厂废水中含5.00×10-3mol·L-1 的Cr2O72- ,其毒性较大。某研究性学习小组为了变 废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe 的化合价依次为+3、+2),设计了如下实验流程:
0
4 Fe +
= +5
NO3-
+ 10 H+
—4
F+2e 2+
+
-3
NH4+ + 3 H2O
得8e-
6 Fe2+ +
H+—
2C+3r3+ +
6F+3e3+
得3e- ×2
3.根据反应体系的酸碱性,在方程式左边 或右边补充H+、OH-或H2O等。
Cr2O72- + 6 Fe2+ + H+— 2Cr3+ + 6 Fe3+ + H2O
4.根据电荷守恒及质量守恒配平方程式并 注明反应条件和气体、沉淀符号等。
= Cr2O72- + 6 Fe2+ +14 H+— 2Cr3+ + 6 Fe3+ + 7H2O
例2(2011安徽28)
分析:
从图中分析主要反应物Fe、NO3- 、H+ ; 主要生成物Fe 2+ 、NH4+ 、H2O Fe + NO3- + H+ — Fe 2+ + NH4+ + H2O
失2e-×4
⑴第①步反应的离子方程式是
分析:主要反应物有Cr2O72-、Fe2+、H+ 主要生成物有Cr3+、Fe3+ Cr2O72- + Fe2+ + H+—Cr3+ + Fe3+
。
4
2、在情境下,标出元素化合价的升降
,根据化合价的升降或得失电子守恒配 平上述四种物质。
失e- ×6
C+6r2O72- +
+2
氧化还原反应方程式的书写
化学 高三
蒙城县化学名师工作室 安徽省蒙城县第八中学 安徽省蒙城县第二中学
魏香三 魏 喆
氧化还原反应是高考的重点, 也是高考的难点。
例1(2009安徽27)某厂废水中含5.00×10-3mol·L-1 的Cr2O72- ,其毒性较大。某研究性学习小组为了变 废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe 的化合价依次为+3、+2),设计了如下实验流程:
0
4 Fe +
= +5
NO3-
+ 10 H+
—4
F+2e 2+
+
-3
NH4+ + 3 H2O
得8e-
6 Fe2+ +
H+—
2C+3r3+ +
6F+3e3+
得3e- ×2
3.根据反应体系的酸碱性,在方程式左边 或右边补充H+、OH-或H2O等。
Cr2O72- + 6 Fe2+ + H+— 2Cr3+ + 6 Fe3+ + H2O
4.根据电荷守恒及质量守恒配平方程式并 注明反应条件和气体、沉淀符号等。
= Cr2O72- + 6 Fe2+ +14 H+— 2Cr3+ + 6 Fe3+ + 7H2O
例2(2011安徽28)
分析:
从图中分析主要反应物Fe、NO3- 、H+ ; 主要生成物Fe 2+ 、NH4+ 、H2O Fe + NO3- + H+ — Fe 2+ + NH4+ + H2O
失2e-×4
⑴第①步反应的离子方程式是
分析:主要反应物有Cr2O72-、Fe2+、H+ 主要生成物有Cr3+、Fe3+ Cr2O72- + Fe2+ + H+—Cr3+ + Fe3+
。
4
2、在情境下,标出元素化合价的升降
,根据化合价的升降或得失电子守恒配 平上述四种物质。
失e- ×6
C+6r2O72- +
+2
