04 第四章 酰化反应2015-2016-2
酰化反应-碳原子上的酰化反应

溶剂和添加剂对酰化反应的影响也很 大。选择合适的溶剂和添加剂可以促 进反应的进行,提高产物的纯度和收 率。
04
碳原子酰化反应的合成 策略
选择性碳酰化反应
选择性碳酰化反应是指在特定条件下,优先在目标分子中的特定碳原子上进行酰化反应,以获得所需 产物。这种反应通常需要使用特异的催化剂或试剂,控制反应条件,如温度、压力、溶剂等,以确保 选择性。
环境影响
传统的碳酰化反应通常需要使 用有害的有机溶剂和大量的能 源,对环境造成压力。
反应条件苛刻
许多碳酰化反应需要在高温或 高压下进行,增加了操作的难
度和成本。
前景展望
新反应路径探索
随着绿色化学的发展,研究者正在寻找 更环保、更温和的碳酰化反应条件和路
径。
模块化反应
通过模块化反应策略,将不同的官能 团组合在一起,实现一锅多步反应,
提高合成效率。
高选择性催化剂
开发高选择性催化剂是解决选择性难 题的重要方向,有助于在复杂体系中 实现单一组分的酰化。
计算机辅助设计
利用计算机辅助设计技术,预测和优 化反应条件,提高碳酰化反应的效率 和选择性。
THANKS FOR WATCHING
感谢您的观看
碳原子酰化反应的定义
01
碳原子酰化反应是指有机化合物 中的碳原子与酰基(如羧基)结 合,生成新的有机化合物的化学 反应。
02
在碳原子酰化反应中,酰基通常 来自羧酸或其他酰化试剂,如酸 酐、酰氯等。
碳原子酰化反应的机理
碳原子酰化反应通常通过亲核取代机理进行,其中碳原子上的氢原子被酰基取代。
反应过程中,酰化试剂首先与强酸(如硫酸、磷酸等)反应,生成亲电的酰基正离子,然后与碳原子上的电子云密度较高的 区域结合,形成新的碳-酰基键。
化学反应中的酰化反应

化学反应中的酰化反应化学反应是我们日常生活中不可缺少的一部分,它不仅应用于我们周围的生活和工作中,也是科研领域中不可或缺的一个技术支撑。
而酰化反应则是其中的一个十分重要的反应类型。
本篇文章将介绍酰化反应的定义、机理、应用等方面的内容。
1. 酰化反应的定义酰化反应是一种有机合成反应,指的是酸酐(anhydrides)或酸卤(acyl halides)与醇(alcohol)或酚(phenol)等亲核试剂发生酰化反应。
其中,酸酐和酸卤均具有电子丰富的羰基(carbonyl)结构,容易被亲核试剂进行攻击,产生新的酯(ester)化合物。
2. 酰化反应的机理酰化反应的机理可分为两步:亲核试剂攻击和质子转移。
在第一步中,亲核试剂(如醇或酚)的亲核性中心(如羟基)攻击羰基碳原子,形成一个稳定的中间体:酸酐或酸卤与亲核试剂的加合物。
接着,在第二步中,质子转移将中间体中的酰基(acyl)基团从原来的酸酐或酸卤转移到了亲核试剂中,同时释放出质子(H+),生成酯化合物。
3. 酰化反应的应用酰化反应在有机合成领域中具有广泛的应用,尤其是在制备大分子化合物和药物研发中更是不可或缺。
例如,酰化反应被用于制备各种功能酯和酰胺(amides)等有机化合物,这些化合物在多种领域都有广泛的应用。
同时,酰化反应还可以被用作催化反应的催化剂。
除了有机合成领域外,酰化反应还在食品、香料、染料等领域中有应用。
例如,在香水制造过程中,酰化反应可以用于制备各种具有特殊香味的酯化合物。
4. 酰化反应的影响因素酰化反应的影响因素有很多,其中最为重要的因素是反应物的浓度和反应温度。
反应物浓度的影响是非常明显的。
当反应物浓度越高时,相同的酰化反应所需要的时间和反应温度就相对较低。
这是因为反应物浓度高,反应速度快,反应所需要的时间和温度就自然而然地降低了。
反应温度也是影响酰化反应的重要因素。
当反应温度较低时,由于分子运动较慢,分子之间的相对位置不稳定,酰化反应的过程会较为缓慢。
酰化反应方程式

酰化反应方程式酰化反应方程式就像是化学舞台上的一场奇妙魔术表演。
你看那反应物,就像是一群等待变身的小演员。
比如说,我们有个醇类分子,这家伙就像个有点憨态可掬的小胖子,带着自己的羟基( -OH),在化学的舞台上晃悠着。
这时候,酰化试剂登场啦,它就像个神秘的魔法师,带着酰基(R - CO -)这个魔法棒。
当酰化试剂靠近醇类小胖子的时候,就像是魔法师选中了自己的变身对象。
然后,神奇的事情发生了,羟基( -OH)就像个听话的小跟班,心甘情愿地把自己的氢原子交了出去。
这个过程就像是一场交易,氢原子像个小金币一样被拿走了。
而醇类分子剩下的部分呢,就和酰基紧紧地结合在一起,就像两块磁铁吸住了一样。
原本单纯的醇类小胖子,一下子就变成了一个有着全新身份的酯类分子。
这酯类分子就像是穿了一身华丽新衣的模特,有着独特的香气和性质。
如果把整个反应过程比作一场足球比赛,反应物们就是球员。
酰化试剂就像是那个拥有超级传球技能的中场核心,把酰基这个关键的“球”传给了醇类分子这个前锋。
前锋接到球后,立刻就完成了一次精彩的射门,也就是成功地变成了新的分子。
酰化反应方程式还像是一场精心编排的舞蹈。
每个原子、每个基团都有自己的舞步和走位。
它们按照一定的节奏和规律,在反应的舞台上翩翩起舞,最后组合成了新的舞蹈队形,也就是新的化合物。
而且,酰化反应可不是一场孤独的表演。
它在很多领域都有着重要的戏份。
在制药行业,它就像个关键的工匠,能够把简单的原料变成有着神奇药效的药物分子。
就好比把普通的石头变成了闪闪发光的钻石。
在香料制造中,酰化反应方程式也是个重要的魔法咒语。
它能把一些平淡无奇的化学物质变成迷人的香料,就像把一只丑小鸭变成了美丽的白天鹅。
从宏观上看,酰化反应方程式虽然只是一些符号和线条的组合,但在微观的化学世界里,它却是一场场精彩绝伦、充满惊喜的大事件。
就像一个小小的舞台上,不断地上演着麻雀变凤凰的传奇故事,让我们这些化学的观众们总是忍不住惊叹和鼓掌。
第四章酰化反应

RCOCl N
SH
Et3N
N
该活性酯(21)常用于合成大环内酯及β-内酰胺类化合 物,收率较高。
OH CH3 COOH HO O O O O
(21)/Ph3P/AcOH/THF
OH O
CH3 (75%)
O
O
O
4.活性酯及其应用 .
羧酸三硝基苯酯
COONa H3C ROH H3C CH3 H3C COOR Cl TNB H3C CH3 R=CH3 (96%) R= i Pr (22%) R= t Bu (7%)
羧酸吡啶酯
Et3N/RCOOH
I
N CH3
Cl
OH ( CH2 )n
Hale Waihona Puke IN CH3OCOR
I
N CH3
HO(CH2)nCOOH Cl
Et3N ,7.5~8h
I
N CH3
C O O
(CH2 )n C O O N CH3 O
三、酸酐酰化剂
(RCO)2O R'OH( ArOH )
酸或碱
RCOOR'( RCOOAr )
Ac2O DMAP 95
(CH3CH2CO)2O DMAP/Et3N 94
Ac2O PPY/Et3N 92
Ac2O PPY/Et3N 86
1、主要影响因素
催化剂
当醇、酚羟基共存时,采用三氟化硼为催化剂可对醇羟基进行选择性酰化
BF3 Et2O
HO
CH2OAc
(68%)
HO
CH2OH
Ac2O Py
AcO
NO2
COOC2H5
NH2 HOOCCH2CH2CHCOOH
ROH/HBF4/Na2SO4 25~60
第四章 酰化反应 答案
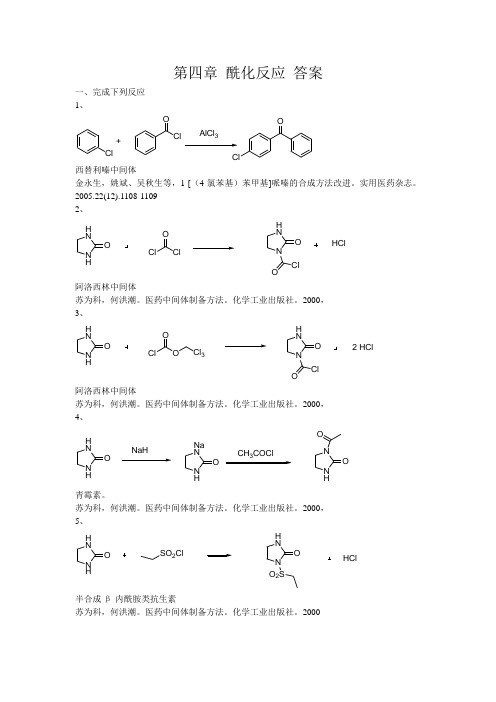
第四章 酰化反应 答案一、完成下列反应 1、ClClClOO+AlCl 3西替利嗪中间体金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。
实用医药杂志。
2005.22(12).1108-1109 2、 N HH NO ClO ClN H NO ClOHCl阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 3、 N HH NO ClO ON H NO ClO2 HClCl 3阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 4、 N HH NO NaHN HNa NO CH COClN HNO O青霉素。
苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 5、 N HH NO SO 2ClN H NO O 2SHCl半合成β-内酰胺类抗生素苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
20006、OOO3C OCH 2CH 2COOH芬不芬章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,1340 7N HS CH3C O O CCH O NS COCH 3乙酰丙嗪8NH 2COOHNHCOCH 3COOH安眠酮章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,13 9N N SH 2NSHCH3C O CCH 3O N N S HN SHCOCH 3乙酰唑胺章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,14 10 NH 2OHCH3C O O CCH O NHCOCH 3OH嘧啶苯芥章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,15 11 NH 23NHCOCH 3磺胺类药物章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,17 12NH2 F3CCl2NHCOClF3CClCH3CN卤卡班章思规。
实用精细化学品手册(有机卷)下。
04 第四章 酰化反应2015-2016-2

1.3 底物结构对反应的影响 醇 CH3OH C2H5OH n-C3H7OH CH2=CHCH2OH PhCH2OH i-PrOH t-BuOH v 1 0.84 0.84 0.64 0.68 0.47 0.026
醇的结构对酰化反应的影响(立体因素和碳正离子稳定性): 伯醇>仲醇>叔醇
C
OH +
+ H 2O
COOH
COOCH3
+
HO OH OH
C12H25OH
TsOH Xylene
HO OH OH
OH n-C11H23
OH CO2 H C3H7-n TsOH CH2Cl2 24 h
n-C11H23
O
O n-C3H7
OH
1.5 Lewis酸催化法: (AlCl3、SnCl4、FeCl3、BF3等)
+R''X O R C H M O R C M +R''COX O R C R'' O R C COR''
O OH +R'' C CH2 O H R C CH2-CH-R''
直接自由基酰化:
O O O H3C CHO Bz2O2 90-95 8 h
o
O O R C CH2-CH2-R'
H3C C O
OH O R R'OH H OR' R C OH OH OR' R C OH OH2
R
OH OH
-H2O R
OH OR'
H R
O OR'
羧酸与醇形成酯的反应为AAc2, 反应为可逆反应(reversible reaction),需打破平 衡以提高收率。
酰化反应

4. 酰氯为酰化剂
(1)反应通式 (2)反应机理
55
(3)影响因素
A 酰氯结构的影响
■ 脂肪族酰氯 > 芳酰氯 ■ 羰基的α位连有吸电子基团时,活性增强 ■ 芳酰氯邻位有取代基时,活性降低
B 催化剂的影响
■ 有机碱:吡啶、三乙胺、N,N-二甲基苯胺、N,N-二甲基吡啶 ■ 无机碱:NaOH、KOH、Na2CO3、K2CO3 ■ 采用吡啶类碱不仅可以中和反应生成的HCl,还有催化作用,增强活性
S
R CH S
n-C4H9Li
S RC Li S
H2O/HgCl22
第二节 氧原子上的酰化反应
• 醇的O-酰化反应 • 酚的O-酰化反应 • 醇、酚羟基的保护
13
一、醇的O-酰化反应
1. 羧酸为酰化剂
(1)反应通式
(2)反应机理
提高收率:
■ 增加反应物浓度
19
(iii) Vesley法 采用强酸型离子交换树脂加硫酸钙 催化能力强、收率高、条件温和
Vesley法
CH3COOH + CH3OH 10min
CH3COOCH3 (94%)
20
(iv) DCC法( dicyclohexylcarbodiimide,二环己基碳二亚胺)
21
DCC类似物:
CH3-N=C=N-C(CH3)3
N
r.t., 12 min
(96%)
H3C
CH3 COOC(CH3)3
金属离子Hg2+、Ag+、Cu+、Cu2+等对反应有催化作用
35
(ii) 羧酸吡啶酯
36
(iii) 羧酸三硝基苯酯( 一锅煮合成法 )
精细有机合成第四章酰化

O CH3 C
O
CH3 C O
R1 + ቤተ መጻሕፍቲ ባይዱH
R2
O R1 CH3C N R2 +
O CH3C OH
式中R1可以是氢、烷基或芳基,R2可以是氢或烷 基。这个反应不生成水,因此是不可逆的。
Company Logo
4.1.2 酸酐的N-酰化
❖ 如果被酰化的胺和酰化产物熔点不太高,在乙酰 化时可不另加溶剂。
Company Logo
4.1.1用酰氯的N-酰化
用酰氯进行N-酰化的反应通式如下:
R NH2 + Ac Cl
R NHAc + HCl
式中R表示烷基或芳基,AC表示各种酰基,这类反应 是不可逆的。酰氯是比相应的酸酐更活泼的酰化剂。 许多酰氯比相应的酸酐容易制备,因此常常用酰氯作 酰化剂。最常用的酰氯有长碳链脂肪酸的酰氯,芳羧 酰氯、芳磺酰氯、光气和三聚氰酰氯等。
用羧酸的N-酰化是一个可逆的过程,首先生成铵 盐,然后脱水生成酰胺:
O R C OH + H2N R'
成盐
O R C O H3NR'
-H2O 加热
OH R C N R'
Company Logo
4.1.3 羧酸的N-酰化
为了使酰化反应尽可能完全并使用过量不太多的 羧酸,必须除去反应生成的水,脱水的方法主要 有下述几种。 ❖ 1.高温熔融脱水酰化法 ❖ 2.反应精馏脱水酰化法 ❖ 3.溶剂共沸蒸馏脱水酰化法 此3种方法的用法见书P253页。
❖ 如果被酰化的胺和酰化产物熔点较高,就需要另 外加苯,甲苯或氯苯等非水溶性惰性有机溶剂。
❖ 如果被酰化的胺和酰化产物易溶于水,而乙酰化 的速度比乙酐的水解速度快的多,乙酰化反应也 可以在水介质中进行。
酰化反应原理与实例解析

精心整理第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2.围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标●掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用;●掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
●掌握生产中操作及注意事项●了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章酰化技术第一节概述一、酰化反应1.概念酰化反应是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2.反应通式代表RR基反应精馏脱水法主要用于乙酸与芳胺的N-酰化,例如,将乙酸和苯胺加热至沸腾,用蒸馏法先蒸出含水乙酸,然后减压蒸出多余的乙酸,即可得N-乙酰苯胺。
溶剂共沸脱水法主要用于甲酸(沸点100.8℃)与芳胺的N-酰化反应。
(以上方法大多在较高温度下进行,因此,不适合热敏性酸或胺)(2)催化剂强酸作催化剂适用于活性较强的胺类的酰化缩合剂作催化剂适用于活性弱的胺类、热敏性的酸或胺类常用的此类缩合剂有★DCC(Dicyclohexylcarbodiimide,二环己基碳二亚胺)DIC(DiisopropylCarbodiimide,二异丙基碳二亚胺)等。
DCC是一个良好的脱水剂,以DCC作脱水剂用羧酸直接酰化,条件温和,收率高,在复杂结构的酰胺、半合成抗生素及多肽的合成中有较多的应用。
二、羧酸酯酰化剂反应过程1.反应物活性(1)对于羧酸酯(RCOORˊ)的合成)将7—ACA、水、丙酮加入反应体系中,降温,加入三乙胺、活性酯,反应至7-ACA 基本消失后,加有机酸酸,有头孢噻肟酸沉淀生成。
酰化反应

4、酰化剂和被酰化物的反应活性
酰化反应的难易,与酰化试剂的亲电性、被酰化 物的亲核能力及空间效应有密切关系。 在酰化反应中,酰化剂(正离子或带正电部分) 以亲电质点参与反应,故酰化反应可称之为亲电 取代反应。
酰化剂的反应活性——取决于羰基碳上部分正电 荷的大小。正电荷越大,其反应活性越强。 对R相同的羧酸衍生物,离去基团Z的吸电子能力 越强,酰基上部分正电荷越大。
但进攻苯环的中间体可能是(b)和(c),它们与苯环 作用生成芳酮与AlCl3的络合物。
(b) 与苯环作用方式
(c) 与苯环作用方式
注意:
碳酰化时,1mol酰氯理论上需1molAlCl3,但实际上要过 量10%~15%AlCl3。 若酰化剂是酸酐,它首先与AlCl3作用会生成酰氯,然后 按上述历程参加反应。
(3)用异氰酸酯进行N-酰化
异氰酸酯很活泼,胺可为脂肪胺、芳胺等
(4)用尿素进行N-酰化
(5)用羧酸酯进行N-酰化
N-酰化常用的羧酸酯: 碳酸二甲酯,氯甲酸三氯甲酯,双(三氯甲基) 碳酸酯
5、N-酰化反应终点
在芳胺的酰化产物中,未反应的芳胺可发生重氮 化反应,而酰化产物则不能。 利用这一特性可在滤纸上作试验,定性检查酰化 终点。
2CH2=C=O
CH2
C O O C CH2
用乙烯酮进行N-酰化的条件
室温(0-200℃),介质: 水、甲苯、乙醇、丙酮等 常用的芳胺:phNH2、邻甲苯胺等 乙烯酮用量为芳胺的1.05倍
CH2 C O O C CH2 + H2N CH3 CH3COCH2CO HN CH3
(2) 用三聚氯氰(或三聚氰酰氯)进行N-酰化
第十一章
酰化反应
酰化反应

n-C18H37 C COO n-C7H15
HO
Zn2+ 175℃
C18H37-n
CH3 CH2
C CH3
n-C18H37
O + H3C C
O
H3C C
产物稳定
n-C4H9 CH2
C COO C
n-C7H15
CH3
CH3
CH3
25
第一节 氧原子的酰化反应
一 醇的氧酰化
3)酸酐为酰化剂
RCOOCOR
催化剂
(1)质子酸催化法: 浓硫酸, 氯化氢气体, 磺酸等
O
H+
OH
R C OH
R C OH
H
CH2COOH OH
H
TsOH/PhH △,
OH R C OH
H
O O
H
9
第一节 氧原子的酰化反应 一 醇的氧酰化1) 羧酸为酰化剂
(2)Lewis酸催化法: (AlCl3, SnCl4,FeCl3,等)
H2C H2C
O
C + CH3OH CH3ONa
O
O
H2C C OCH3 CH2OH
O H3CO C
O OC
O
CH3
+
CH3ONa
CH3OH 回流 H3CO
C
-酯交换完成某些特殊的合成
O
OH + H3C C OCH3
17
第一节 氧原子的酰化反应
一 醇的氧酰化
2)羧酸酯为酰化剂
例:局麻药丁卡因
CH3(CH2)3 HN
CH3
CH3Br
C COO OH
·Br
N ch3 CH3
2015酰化反应

反应机理:
RCOOH + C6H11N C NC6H11 C6H11 N C N C6H11 H RCOO NHC6H11 O RCOOH R C O C NC6H11 O C NHC6H11 O + RCOO R C O C NHC6H11 A O C6H11NHCNHC6H11
A
R'OH
R
O R' + H
酰化反应
酰化反应
定义:有机化合物分子中引入酰基的反应称为酰化 反应。主要发生在碳、氧、氮、硫等原子上。 用途:活性化合物的必要官能团 结构修饰和前体药物 羟基、胺基等基团的保护 类型:直接酰化 间接酰化
Page 2
直接酰化反应类型
亲电酰化反应 亲核酰化反应 自由基酰化反应
-H RCO2R'
Page 9
氨基的酰化:
O R' + H N R C OH R''
RCOO NH2R'R'' O R C OH NH R' R'' O R C N R' R''
羧酸与胺 需高温脱水 催化剂:可用DCC、DIC等缩水剂(活化羧酸)
Page 10
COOH NH2 N H CH3OH SOCl2 N H COOMe DCC/Et3N/CH2Cl2 COOH N H HN O
用量:至少是底物的一倍以上(?)
Page 32
催化剂的选择:
以酰氯、乙酸酐为酰化剂时,多用Lewis酸为催化剂如AlCl3、 FeCl3、TiCl4、ZnCl2
O C Cl F + AlCl3 NH2 O C F
NH2
酰化反应原理与实例解析

第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2.围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;3.围绕典型药物的生产过程,完成用羧酸法、酯交换法、酸酐法、酰氯法生产酯类产品。
项目三:草酸二乙酯的制备学习目标●掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用;●掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
●掌握生产中操作及注意事项●了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章酰化技术第一节概述一、酰化反应1.概念酰化反应是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2.反应通式(式中RCOZ为酰化剂,Z代表X,OCOR,OH,ORˊ,NHR″等;SH为被酰化物,S代表RˊO、R″、Ar 等。
)二、常用酰化剂及其活性★1.常用酰化剂:羧酸、羧酸酯、酸酐、酰氯等酰化剂的活性规律:当酰化剂(RCOZ)中R基相同时,其酰缩合剂作催化剂适用于活性弱的胺类、热敏性的酸或胺类常用的此类缩合剂有★DCC(Dicyclohexylcarbodiimide,二环己基碳二亚胺)DIC(DiisopropylCarbodiimide,二异丙基碳二亚胺)等。
DCC是一个良好的脱水剂,以DCC作脱水剂用羧酸直接酰化,条件温和,收率高,在复杂结构的酰胺、半合成抗生素及多肽的合成中有较多的应用。
二、羧酸酯酰化剂反应过程1.反应物活性(1)对于羧酸酯(RCOORˊ)位阻若酰基中R空间位阻大,则活性小电性有吸电子取代基则活性高,易酰化。
离去基团的稳定性离去基团越稳定,则活性越高(2)对于胺类胺的碱性碱性越强,活性越高,空间位阻空间位阻越小,活性越高(32(1(2(3(43—(1)(2)(3)(4)(5)(6)●三、酸酐酰化剂1.反应过程★2.注:TLC检测终点酸酐用量一般略高于理论量的5~10%(不可逆),最常用的酸酐是乙酸酐,通常在20~90℃可顺利进行反应(活性高)溶剂不另加溶剂被酰化的胺和酰化产物熔点不太高时非水惰性有机溶剂被酰化的胺和酰化产物熔点较高时水被酰化的胺和酰化产物易溶于水(乙酰化速度比乙酸酐的水解速度快)★3.应用向乙酰化反应罐中加入母液加入乙酸酐,搅拌均匀后,先慢后快地加入38%~40%的乙酸钠溶液。
酰化反应PPT

化学工业出版社 Chemical Industry Press
② 被酰化物的结构影响 A.酰基定位和电子效应
化学工业出版社 化学工业出版社 Chemical Industry Press Chemical Industry Press 芳烃有间位对位基取代,一般不发生反应。
普通高等教育“十一五”国家级规划教材 化学工业出版社 “十二五”普通高等教育本科国家级规划教材 Chemical Industry Press
化学工业出版社 Chemical Industry Press
药物合成反应 (第三版)
化学工业出版社 Chemical Industry Press
化学工业出版社 Chemical Industry Press
PhNO2 : 溶解性好,反应呈均相,但可与AlCl3形成复合物 A.对反应收率的影响 B.对定位的影响 C.杂环的酰化反应
化学工业出版社 Chemical Industry Press
化学工业出版社 Chemical Industry Press
化学工业出版社 Chemical Industry Press
第三章
酰化反应 (Acylation) 化学工业出版社
Chemical Industry Press 化学工业出版社 Chemical Industry Press
化学工业出版社 Chemical Industry Press
化学工业出版社 Chemical1 Industry Press C.用量:一般较多(酰氯 :1;酸酐 1:2) 化学工业出版社 Chemical Industry Press
B.催化剂的活性:Lewis酸 > 质子酸
第四节 碳原子上的酰化反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.4
混合酸酐的应用
3.4.1 羧酸-三氟乙酸混合酸酐法
RCOOH
O R O F3C O
+
(CF3CO)2O
O R O F3C OH
RCOOCOCF3 RCO
+ +
CF3COOH CF3COOH
+H
R'OH RCOOR'
+H
适用于立体位阻较大的羧酸的酯化
+R''X O R C H M O R C M +R''COX O R C R'' O R C COR''
O OH +R'' C CH2 O H R C CH2-CH-R''
直接自由基酰化:
O O O H3C CHO Bz2O2 90-95 8 h
o
O O R C CH2-CH2-R'
H3C C O
酰基的引入方式:直接酰化法和间接酰化法
2、直接酰化法:直接将酰基与有机化合物相结合
亲电酰化剂
O R R O
O
酰化剂
亲核酰化剂
R
自由基酰化剂
R
O
R
O
直接亲电酰化:
O Z O Y
R
+
Y H
R
H
Z
Z = Hal, OCOR', OH, OR', NHR'等
Y = R''NH-, R''O-, Ar-
直接亲核酰化:
+
N N
+
C H3C O O R'OH C H3C O O R' +
COCH3
N H
OH CH3 OH OH O Ph2 CH3 OH OCH3 OH OCH 3
酰化剂 催化剂 收率%
(PhCO)2O
(CH3CH2CO)2O
Ac2O DMAP 95
Ac2O PPY/Et3N 92
Ac2O PPY/Et3N 86
-HOPOCl2
N(CH3)2 CH NR2 Cl
+ HNR2 + HCl (Vilsmeier 反应)
间接亲核酰化:
HS R CHO S CH S O R C R'
+
HS S
R
n-C4H9Li
R C
S
R'X LiX
Li
S
R R' C
H2O/HgCl2
S
碳原子上引入酰基的反应有的属于亲电酰化反应(如Friedel-Crafts反应, Vilsmeier反应),有的属于亲核酰化反应(如上述制备醛、酮的反应)
DMAP/Et3N DMAP/Et3N 87 94
CH3 C3H7 C CH3 OH +
O C C O O Et3N TEA
O C O
CH3 C C 3H 7
CH3 C O OH
例:镇痛药阿法罗定(安那度尔)的合成
OH CH3 N CH3 ①(C2 H5CO)2O/Py/△ ②HCl(gas)
OCOC2H5 CH3 · HCl N CH3
第一节 氧原子上的酰化反应
一、氧原子上的酰化反应------醇的O-酰化
二、氧原子上的酰化反应------酚的O-酰化
一、氧原子上的酰化反应------醇的O-酰化
1. 羧酸作为酰化剂:
R-OH + R'COOH
R'COOR + H2O
primary alcohol > secondary alcohol > tertiary alcohol
G O G' R-OH G' O R X G O OH G' G O R-X G' O M 无水条件 G O O R
位阻大的羧酸也可能由于位阻而酯化困难!
1.4 质子酸催化
如:浓硫酸 ,氯化氢(气体), HBF4磺酸等,一些内酯 的合成常用有机酸如苯磺酸、对甲苯磺酸作催化
H R C OH O R C OH OH
R'OH
H OR' R C OH OH
OR' R C OH OH2
¨
-H 2O H 2O
OH R C OR'
H
O R C OR'
H3C N COOH
CH3OH/C6H6/△ HCl(gas) H3C N COOC2H5 ·HCl 镇痛药盐酸呱替啶 fast-acting opioid analgesic drug
配位键(增加C的正电性)
O R OH
AlCl3 -HCl R
O AlCl3 R O AlCl2
O AlCl3 O AlCl2
对于不稳定的酸和醇(如含双键)不能用质子酸催化,而 这类催化剂尤其是BF3可避免双键的分解或重排。
CO2H + CH3OH BF3 CO2CH3
1.6 酸性树脂(Vesley)催化法:
CO2Bu-t CH3
1.8 偶氮二羧酸二乙酯法(Diethyl azodicarboxylate)
N N
COOC2H5 COOC2H5
O
+ Ph3P
C2H5O
C
N
N
COOC2H5
RCOOH
P Ph3 O C2H5O C
H N
N
COOC2H5
RCOO
R' HO C R'' R'''
R' Ph3P O C R'' R'''
CH3 O O O H
CH3
酰化能力弱,因为可形成分子内氢键
O CH2OH O O COOH
+
I
DCC/DMAP 25℃ O O
CH2 O C I 96%
HO
N
Ph Ph
+ NC
CO2H
DCC/THF 55 oC, 10 h
O NC O N Ph Ph
H3CO N H
CO2H CH3
t-BuOH H3CO DCC/ZnCl2 N H
2. 酰氯作为酰化剂
RCOCl
+
R'OH
RCOOR'
AlCl3
R
+
HCl
2.1 Lewis酸催化
O R O R O C
C Cl + AlCl3
C Cl
AlCl4
O R C Cl AlCl3 配位键,增大碳的正电性
2.2 碱催化
①无 机 碱 :去 酸 剂 ②有机碱 :Py, Et3N, DMAP PPY:CH2CH2N(C2H5)2 二甲苯
HCl(gas)
O2N
COOCH2CH2N(C2H5)2
Fe/HCl 45℃,2h
H2N
COOCH2CH2N(C2H5)2· HCl
局部麻醉药普鲁卡因
O OH O CH3(CH2)3 COOH 100℃, 分水 HO HO C(CH2 )3CH3
OH
O O
8 C, 2 h
o
PhCOONa + POCl3 Et 3N
PhCOO-POCl2
t-BuOH
o
PhCOOBu-t 0 C, 3 h 68%
COCl Me Me Me
+
AgCN/HMPT
OH Me
COO Me
3 min
Me
92%
3. 酸酐作为酰化剂
酸酐是一个强酰化剂,反应具有不可逆性,但由于大分子的酸 酐难以制备,导致其应用方面的局限性 3.1 质子酸催化
RCOO
R' R'' C R''' O C O R
P Ph3
DEAD是活化醇的试剂但必须有供质子的来源,这儿羧酸本身 就可供质子。这个方法是Mitsunobu反应。
OH O O
1) DEAD/PPh3/PhCO2H 2) K2CO3/CH3OH O
OCOPh O
O OH + O2N O OH DEAD/Ph3P THF rt, 14h O O2N
O R C O R C O R C O O O OH R C OH + R O C
H
R
C
3.2 Lewis酸催化
O R C O
O
R C O
AlCl3
O
R
C
+ R C OAlCl3
BF3.Et2O HO CH2OH Ac 2O Py
HO
CH2OAc
[25] (68%)
AcO
CH2OAc (62%)
当醇、酚羟基共存时,采用三氟化硼为催化剂可对醇羟基进行选择性酰化
+ H 2O
COOH
COOCH3
+
HO OH OH
C12H25OH
TsOH Xylene
HO OH OH
OH n-C11H23
OH CO2 H C3H7-n TsOH CH2Cl2 24 h
n-C11H23
O
O n-C3H7
OH
1.5 Lewis酸催化法: (AlCl3、SnCl4、FeCl3、BF3等)
H
C
OH2 O
C
+ H2O
C
+
RCOOH
C
O
C R
+ H
叔醇由于其立体位阻大且在酸性介质中易脱去羟基形成正碳离子,同 时形成的酯也易发生脱酯氧基而形成正碳离子,正碳离子的稳定性使得 反应不易生成酯。 与叔醇一样,苄醇、烯丙醇由于脱羟基形成稳定的碳正离子,碳正离 子与水作用而恢复成醇的趋向大于形成酯的趋向,故同样酰化较为困难。
