腐蚀学原理-第二章 腐蚀热力学
合集下载
第2章腐蚀电化学原理简介PPT课件

形成腐蚀电池并不是造成腐蚀的根本原因,只要材料与环境 介质接触,形成热力学不稳定的体系,就会在释放化学能的 推动下,使金属转变为离子溶解(即发生腐蚀)。
腐蚀反应中释放的化学能又是从何而来的?
形成腐蚀电池确实对腐蚀有加速作用。在腐蚀控制工作中仍 然要注意防止形成腐蚀电池,或减小腐蚀电池的推动力。
Zn+2H+→Zn2++H2↑
电流的流动
金属中:电子从阳极流向阴极。
形 溶液中:离子迁移。阳离子从阳极区向阴极区迁移,阴离子从
成
阴极区向阳极区迁移。
回 路
阳极:发生氧化反应
阴极:发生还原反应
中国民航大学 理学院 2010/8/14
5
A
k
e
-
+
化学 Zn
Cu
势能2H+
Zn2+
SO42-
电池工作的推动力是电池反应的化学势能,即反应物和反应 产物之间的化学势差。
化学势能与构成电池的两个电极的电位差成正比。
ΔrGm=-nFE
中国民航大学 理学院 2010/8/14
6
2.1 腐蚀电池
-+
Zn Cu e
Zn2+
2H+ SO42-
◦ 把Zn-Cu原电池短路,电池仍可以持续工作。
电池工作的结果仅造成Zn被溶解(腐蚀),不能输出有用的 电功
形成了腐蚀原电池(可简称腐蚀电池)。电化学腐蚀是以腐 蚀电池工作的方式完成的
中国民航大学 理学院 2010/8/14
10
2.1 腐蚀电池
2.1.2 腐蚀电池的类型
◦ 按组成腐蚀电池的阴极、阳极的大小:
宏观腐蚀电池:阳极区和阴极区尺寸较大,区分明显,多数 情况下肉眼可辨。
腐蚀反应中释放的化学能又是从何而来的?
形成腐蚀电池确实对腐蚀有加速作用。在腐蚀控制工作中仍 然要注意防止形成腐蚀电池,或减小腐蚀电池的推动力。
Zn+2H+→Zn2++H2↑
电流的流动
金属中:电子从阳极流向阴极。
形 溶液中:离子迁移。阳离子从阳极区向阴极区迁移,阴离子从
成
阴极区向阳极区迁移。
回 路
阳极:发生氧化反应
阴极:发生还原反应
中国民航大学 理学院 2010/8/14
5
A
k
e
-
+
化学 Zn
Cu
势能2H+
Zn2+
SO42-
电池工作的推动力是电池反应的化学势能,即反应物和反应 产物之间的化学势差。
化学势能与构成电池的两个电极的电位差成正比。
ΔrGm=-nFE
中国民航大学 理学院 2010/8/14
6
2.1 腐蚀电池
-+
Zn Cu e
Zn2+
2H+ SO42-
◦ 把Zn-Cu原电池短路,电池仍可以持续工作。
电池工作的结果仅造成Zn被溶解(腐蚀),不能输出有用的 电功
形成了腐蚀原电池(可简称腐蚀电池)。电化学腐蚀是以腐 蚀电池工作的方式完成的
中国民航大学 理学院 2010/8/14
10
2.1 腐蚀电池
2.1.2 腐蚀电池的类型
◦ 按组成腐蚀电池的阴极、阳极的大小:
宏观腐蚀电池:阳极区和阴极区尺寸较大,区分明显,多数 情况下肉眼可辨。
第二章 金属腐蚀电化学理论基础

(E=0.00V)
(Pt (镀铂黑)H2(1atm), H+(aH+=1)) 标准氢电极的电极反应为 (Pt) H2 = 2H+ + 2e 规定标准氢电极的电位为零。以 标准氢电极为参考电极测出的电位值 称为氢标电位,记为E(vs SHE) 。 SHE是最基准的参考电极,但使用 不方便,实验室中常用的参考电极有:
1.宏观腐蚀电池
铜铆钉
1. 异种金属相接触 如 电偶腐蚀。 2. 浓差电池 (1)金属离子浓度不同, 浓度低电位低,容易腐蚀。 (2)氧浓度不同 氧浓度低电位低,更容易腐蚀。 3. 温差电池 如金属所处环境温度不同, 高温电位低,更容易腐蚀。
铝板
粘 土
沙 土
2. 微观腐蚀电池 (1)材料本身的不均匀性
也可以简单地说,绝对电极电位是电子导体和离子导体接 触时的界面电位差。
双电层:
由于金属和溶液的内电位不同,在电极系统的金属相和
溶液相之间存在电位差,因此,两相之间有一个相界区,叫做
双电层。 电极系统中发生电极反应,两相之间有电荷转移,是形成 双电层的一个重要原因。 例如:Zn/Zn2+,Cu/Cu2+ 。
腐蚀原电池产生的电流是由于它的两个电极在电解质中的 电位不同产生的电位差引起的,该电位差是电池反应的推动力。 构成腐蚀原电池的基本要素(*) • • • • 阳极 阴极 电解质溶液(*) 电池反应的推动力-电池两个电极的电位差
电流流动:在金属中靠电子从阳极流向阴极;在溶液中靠离 子迁移;在阳、阴极区界面上分别发生氧化还原反应,实现电子 的传递。 从金属腐蚀历程也可看出化学腐蚀与电化学腐蚀的区别。
盐水滴实验
3%NaCl+铁氰化钾+酚酞
(Pt (镀铂黑)H2(1atm), H+(aH+=1)) 标准氢电极的电极反应为 (Pt) H2 = 2H+ + 2e 规定标准氢电极的电位为零。以 标准氢电极为参考电极测出的电位值 称为氢标电位,记为E(vs SHE) 。 SHE是最基准的参考电极,但使用 不方便,实验室中常用的参考电极有:
1.宏观腐蚀电池
铜铆钉
1. 异种金属相接触 如 电偶腐蚀。 2. 浓差电池 (1)金属离子浓度不同, 浓度低电位低,容易腐蚀。 (2)氧浓度不同 氧浓度低电位低,更容易腐蚀。 3. 温差电池 如金属所处环境温度不同, 高温电位低,更容易腐蚀。
铝板
粘 土
沙 土
2. 微观腐蚀电池 (1)材料本身的不均匀性
也可以简单地说,绝对电极电位是电子导体和离子导体接 触时的界面电位差。
双电层:
由于金属和溶液的内电位不同,在电极系统的金属相和
溶液相之间存在电位差,因此,两相之间有一个相界区,叫做
双电层。 电极系统中发生电极反应,两相之间有电荷转移,是形成 双电层的一个重要原因。 例如:Zn/Zn2+,Cu/Cu2+ 。
腐蚀原电池产生的电流是由于它的两个电极在电解质中的 电位不同产生的电位差引起的,该电位差是电池反应的推动力。 构成腐蚀原电池的基本要素(*) • • • • 阳极 阴极 电解质溶液(*) 电池反应的推动力-电池两个电极的电位差
电流流动:在金属中靠电子从阳极流向阴极;在溶液中靠离 子迁移;在阳、阴极区界面上分别发生氧化还原反应,实现电子 的传递。 从金属腐蚀历程也可看出化学腐蚀与电化学腐蚀的区别。
盐水滴实验
3%NaCl+铁氰化钾+酚酞
腐蚀热力学

方向进行时,阴极反应。
第二章 腐蚀热力学
(3)电极电位
➢ 双电层
电子导体相(金属)和离子导体相(溶液)都存在一个内电位(即, , ),由
于两相内电位的不同,在电极系统的离子导体相和金属导体相之间就存在电位差
( − ),导致在两相之间存在一个相界区,称为双电层
假设双电层为一个均匀电场,其电场强度可以表示为
腐蚀原电池示意图
➢ 腐蚀电池的定义是:只导致金属材料腐蚀破坏而不能对外做有用功的短路原电池
• 导致金属的腐蚀破坏
腐蚀原电池的特点
• 释放的能量不能对外做有用功
• 电极反应最大程度不可逆
第二章 腐蚀热力学
腐蚀原电池的构成及其工作过程
阳极
构成
阴极
电解质溶液
电路
➢ 工作过程
阳极过程: ⟶ + +
第二章 腐蚀热力学
2.1 原电池和腐蚀原电池
2.2 电极系统与电极反应
2.3 电化学位与电极电位
2.4 电化学腐蚀倾向的判断
2.5 Ee–pH图
第二章 腐蚀热力学
2.1 原电池和腐蚀原电池
原电池
干电池(左)以及原电池工作原理(右)示意图
➢ 阳极反应:负极上发生的反应,金属失去
负极(锌皮): → 2+ + 2
从右至左自发进行:
∆ = + + − − = >
反应平衡时:
∆ = + + − − = =
对任意含有j种物质的化学反应,化学反应达到平衡的条件
∆ = σ =
第二章 腐蚀热力学
(2)电化学位及可逆电极反应的平衡条件
第二章 腐蚀热力学
(3)电极电位
➢ 双电层
电子导体相(金属)和离子导体相(溶液)都存在一个内电位(即, , ),由
于两相内电位的不同,在电极系统的离子导体相和金属导体相之间就存在电位差
( − ),导致在两相之间存在一个相界区,称为双电层
假设双电层为一个均匀电场,其电场强度可以表示为
腐蚀原电池示意图
➢ 腐蚀电池的定义是:只导致金属材料腐蚀破坏而不能对外做有用功的短路原电池
• 导致金属的腐蚀破坏
腐蚀原电池的特点
• 释放的能量不能对外做有用功
• 电极反应最大程度不可逆
第二章 腐蚀热力学
腐蚀原电池的构成及其工作过程
阳极
构成
阴极
电解质溶液
电路
➢ 工作过程
阳极过程: ⟶ + +
第二章 腐蚀热力学
2.1 原电池和腐蚀原电池
2.2 电极系统与电极反应
2.3 电化学位与电极电位
2.4 电化学腐蚀倾向的判断
2.5 Ee–pH图
第二章 腐蚀热力学
2.1 原电池和腐蚀原电池
原电池
干电池(左)以及原电池工作原理(右)示意图
➢ 阳极反应:负极上发生的反应,金属失去
负极(锌皮): → 2+ + 2
从右至左自发进行:
∆ = + + − − = >
反应平衡时:
∆ = + + − − = =
对任意含有j种物质的化学反应,化学反应达到平衡的条件
∆ = σ =
第二章 腐蚀热力学
(2)电化学位及可逆电极反应的平衡条件
腐蚀学原理-第二章腐蚀热力学
问题:
电偶的概念, 危害、用途?
2.3 电位—pH图
金属的电化学腐蚀:金属同水溶液相互作 用。水溶液:H+和OH-离子。
电位—pH图 金属在水溶液中的稳定性不但与它的电极电位有 关,还与水溶液的pH值有关。若将金属腐蚀体系 的电极电位与溶液pH值的关系绘成图,就能直接 从图上判断给定条件下发生腐蚀反应的可能性。
极化图与腐蚀极化图?
金属在25℃的标准电极电位E°
Mg=Mg2++2e:-2.363 Al=A13++3e:-1.662 Ti=Ti3++3e:-1.210 Fe =Fe2++2e:-0.440V Cu=Cu2++2e:+0.337 Pd=Pd2++2e:+0.987 Au=Au++e:+1.691 注:均相对于SHE
2.4 腐蚀电池及其工作历程
(1)阳极过程 金属溶解,以离子形式进入溶液,并把当量的电子留在 金属上
(2)阴极过程 从阳极流过来的电子被阴极表面溶液中能够接受电子的 物质所吸收,即发生阴极还原反应。 阴极还原反应中能够吸收电子的氧化性物质D,在腐蚀学中通常称为 去极化剂。因为如果没有去极化剂,阴极区将由于电子的积累而发生 阴极极化而阻碍腐蚀的进行。最常见的阴极去极化剂是溶液中的O2和 H+离子。
比利时学者M.Pourbaix在1938年首先提出,又称 Pourbaix图。
Fe-H2O电位-pH图
a线为析氢电极反应:
E
E
2.3RT
lg
a2 H
2F
pH2
b线为O2与H2O间的 电化学反应:
2H2O
第二章电化学腐蚀热力学要点

• 上面介绍的是常见的三种宏观腐蚀电池。实际上 腐蚀现象往往是几种(包括下面将介绍的微电池) 类型的腐蚀电池共同作用的结果。
2.3.2微观腐蚀电池
• 在金属外表上由于存在许多极微小的电极 而形成的电池称为微电池。微电池是因金 属外表的电化学的不均匀性所引起的,不 均匀性的原因是多方面的。
图2.4 腐蚀电池
图2.5铜锌接触形成腐蚀电池示意图
图2.6铸铁形成腐蚀电池示意图
• 单个金属与溶液接触时所发生的金属溶解 现象称为金属的自动溶解。这种自溶解过 程可按化学机理进展,也可按电化学机理 进展。金属在电解质溶液中的自动溶解属 于电化学机理。
图2.7金属锌在稀酸溶液中的腐蚀
2.2.4金属腐蚀的电化学历程
• 金属腐蚀反响体系是一个开放体系。在反响过程 中,体系与环境既有能量的交换又有物质的交换。
金属腐蚀反响一般都是在恒温和恒压的条件下进 展的,用体系的热力学状态函数吉布斯(Gibbs)自
由能判据来判断反响的方向和限度较为方便。吉 布斯自由能用G表示,对于等温等压并且没有非
体积功的过程,腐蚀体系的平衡态或稳定态对应
• Zn2++ 2OH- → Zn(OH)2 ↓ • 这种反响产物称为腐蚀次生产物,也称腐蚀产物。某些情
况下腐蚀产物会发生进一步的变化。例如铁在中性的水中 腐蚀时Fe2+离子转入溶液遇到OH-离子就生成Fe(OH)2, Fe(OH)2又可以被溶液中的溶解氧所氧化而形成Fe(OH)3。
• 4 Fe(OH)2+O2+H2O→ 4Fe(OH)3: • 随着条件的不同(如温度、介质的pH及溶解的氧含量等)也
• 从上面讨论的腐蚀电池的形成可以看 出,—个腐蚀电池必须包括阴极、阳极、 电解质溶液和连接阴极与阳极的电子导体 等几个组成局部,缺一不可。这几个组成 局部构成了腐蚀电池工作历程的下三个根 本过程。
2.3.2微观腐蚀电池
• 在金属外表上由于存在许多极微小的电极 而形成的电池称为微电池。微电池是因金 属外表的电化学的不均匀性所引起的,不 均匀性的原因是多方面的。
图2.4 腐蚀电池
图2.5铜锌接触形成腐蚀电池示意图
图2.6铸铁形成腐蚀电池示意图
• 单个金属与溶液接触时所发生的金属溶解 现象称为金属的自动溶解。这种自溶解过 程可按化学机理进展,也可按电化学机理 进展。金属在电解质溶液中的自动溶解属 于电化学机理。
图2.7金属锌在稀酸溶液中的腐蚀
2.2.4金属腐蚀的电化学历程
• 金属腐蚀反响体系是一个开放体系。在反响过程 中,体系与环境既有能量的交换又有物质的交换。
金属腐蚀反响一般都是在恒温和恒压的条件下进 展的,用体系的热力学状态函数吉布斯(Gibbs)自
由能判据来判断反响的方向和限度较为方便。吉 布斯自由能用G表示,对于等温等压并且没有非
体积功的过程,腐蚀体系的平衡态或稳定态对应
• Zn2++ 2OH- → Zn(OH)2 ↓ • 这种反响产物称为腐蚀次生产物,也称腐蚀产物。某些情
况下腐蚀产物会发生进一步的变化。例如铁在中性的水中 腐蚀时Fe2+离子转入溶液遇到OH-离子就生成Fe(OH)2, Fe(OH)2又可以被溶液中的溶解氧所氧化而形成Fe(OH)3。
• 4 Fe(OH)2+O2+H2O→ 4Fe(OH)3: • 随着条件的不同(如温度、介质的pH及溶解的氧含量等)也
• 从上面讨论的腐蚀电池的形成可以看 出,—个腐蚀电池必须包括阴极、阳极、 电解质溶液和连接阴极与阳极的电子导体 等几个组成局部,缺一不可。这几个组成 局部构成了腐蚀电池工作历程的下三个根 本过程。
材料腐蚀与防护-金属的电化学腐蚀原理(2)

已测知Zn和Cu在质量分数为0.03的NaCl水 溶液中的开路电位分别为EZn= -0.83V和 ECu=0.05V,回路电阻R=250。
此时,两电极的稳定电位差0.05+0.83=0.88V,
铜-锌腐蚀原电池示意图
电池刚接通时,毫安表指示的起始瞬间电流 值
电流变化
瞬间电流很快下降,经过一段时间 后,达到一个比较稳定的电流值, I2=0.15mA ???
腐蚀极化图
+E EeC
β
假定任何电流下,阴极阳极的极 化率为常数,称为Evans图(U. R. Evans)。 S所对应的电位Emix,称为混合电 位。由于Emix电位下的金属处于 腐蚀状态,故混合电位就是金属 的自腐蚀电位Ecorr,对应的电流 称为腐蚀电流,用Icorr表示。 I 腐蚀电位是一种不可逆非平 衡电位,需由实验测得,腐蚀 电流表示金属腐蚀的速率,对 于均匀腐蚀和局部腐蚀都适用。
CA
PA E A E A 100% 100% 100% e e PC PA PR EC E A ER EC E A
PR ER ER 100% 100% 100% e e PC PA PR EC E A ER EC E A
S2O62 +2e 2SO42
3.溶液中中性分子的还原反应 吸氧反应 氯的还原反应
如:
O2 +H2O+4e 4OH Cl2 2e 2Cl
4.不溶性化合物的还原反应
如:
Fe(OH)3 +e Fe(OH)2 OH
电路接通
腐蚀电池接通前后电位变化
过电位
电极电位的偏离值称为极化值。 通常引入一新术语--过电位或超电位(取正值)来表征电 极极化的程度。
此时,两电极的稳定电位差0.05+0.83=0.88V,
铜-锌腐蚀原电池示意图
电池刚接通时,毫安表指示的起始瞬间电流 值
电流变化
瞬间电流很快下降,经过一段时间 后,达到一个比较稳定的电流值, I2=0.15mA ???
腐蚀极化图
+E EeC
β
假定任何电流下,阴极阳极的极 化率为常数,称为Evans图(U. R. Evans)。 S所对应的电位Emix,称为混合电 位。由于Emix电位下的金属处于 腐蚀状态,故混合电位就是金属 的自腐蚀电位Ecorr,对应的电流 称为腐蚀电流,用Icorr表示。 I 腐蚀电位是一种不可逆非平 衡电位,需由实验测得,腐蚀 电流表示金属腐蚀的速率,对 于均匀腐蚀和局部腐蚀都适用。
CA
PA E A E A 100% 100% 100% e e PC PA PR EC E A ER EC E A
PR ER ER 100% 100% 100% e e PC PA PR EC E A ER EC E A
S2O62 +2e 2SO42
3.溶液中中性分子的还原反应 吸氧反应 氯的还原反应
如:
O2 +H2O+4e 4OH Cl2 2e 2Cl
4.不溶性化合物的还原反应
如:
Fe(OH)3 +e Fe(OH)2 OH
电路接通
腐蚀电池接通前后电位变化
过电位
电极电位的偏离值称为极化值。 通常引入一新术语--过电位或超电位(取正值)来表征电 极极化的程度。
第 2 章 腐蚀电化学原理简介

腐蚀反应中释放的化学能又是从何而来的?
形成腐蚀电池确实对腐蚀有加速作用。在腐蚀控制工作中仍 然要注意防止形成腐蚀电池,或减小腐蚀电池的推动力。
中国民航大学 理学院
2010/8/14
10
2.1.2 腐蚀电池的类型
◦ 按组成腐蚀电池的阴极、阳极的大小:
宏观腐蚀电池:阳极区和阴极区尺寸较大,区分明显,多数
什么是正极和负极,什么是阴极和阳极? 什么情况下正极是阳极,什么情况下正 极是阴极?
A
e
k
+
Cu 2H+
Zn
Zn2+
SO42-
中国民航大学 理学院
2010/8/14
4
总反应(电池反应) = 阳极反应 + 阴极反应 Zn+2H+→Zn2++H2↑
形 成 回 路
电流的流动 金属中:电子从阳极流向阴极。 溶液中:离子迁移。阳离子从阳极区向阴极区迁移,阴离子从 阴极区向阳极区迁移。 阳极:发生氧化反应 阴极:发生还原反应
腐蚀电池不做有用功,只造成金属的腐蚀。
腐蚀电池的电极反应、电池反应和推动力与一般原电池相同。
两个电极反应,阳极反应造成金属溶解(或腐蚀),阴极反 应是环境中的氧化剂(习惯上称去极化剂)的还原反应。
两个电极反应是共轭关系,即阳极失去的电子等量地被阴极 反应消耗。
金属的腐蚀速度、阴极去极化剂的还原速度和通过的电流之 间符合法拉第定律。
情况下肉眼可辨。
1. 电偶电池:两种不同的金属短路接触,浸入连续的电解质溶液中。 如钢铁部件用铜铆钉连接,连接区存有积水的情况。
中国民航大学 理学院
2010/8/14
形成腐蚀电池确实对腐蚀有加速作用。在腐蚀控制工作中仍 然要注意防止形成腐蚀电池,或减小腐蚀电池的推动力。
中国民航大学 理学院
2010/8/14
10
2.1.2 腐蚀电池的类型
◦ 按组成腐蚀电池的阴极、阳极的大小:
宏观腐蚀电池:阳极区和阴极区尺寸较大,区分明显,多数
什么是正极和负极,什么是阴极和阳极? 什么情况下正极是阳极,什么情况下正 极是阴极?
A
e
k
+
Cu 2H+
Zn
Zn2+
SO42-
中国民航大学 理学院
2010/8/14
4
总反应(电池反应) = 阳极反应 + 阴极反应 Zn+2H+→Zn2++H2↑
形 成 回 路
电流的流动 金属中:电子从阳极流向阴极。 溶液中:离子迁移。阳离子从阳极区向阴极区迁移,阴离子从 阴极区向阳极区迁移。 阳极:发生氧化反应 阴极:发生还原反应
腐蚀电池不做有用功,只造成金属的腐蚀。
腐蚀电池的电极反应、电池反应和推动力与一般原电池相同。
两个电极反应,阳极反应造成金属溶解(或腐蚀),阴极反 应是环境中的氧化剂(习惯上称去极化剂)的还原反应。
两个电极反应是共轭关系,即阳极失去的电子等量地被阴极 反应消耗。
金属的腐蚀速度、阴极去极化剂的还原速度和通过的电流之 间符合法拉第定律。
情况下肉眼可辨。
1. 电偶电池:两种不同的金属短路接触,浸入连续的电解质溶液中。 如钢铁部件用铜铆钉连接,连接区存有积水的情况。
中国民航大学 理学院
2010/8/14
第2章—电化学腐蚀原理(二)

2.8.1 析氢腐蚀的阴极过程步骤 在酸性溶液中,析氢过程步骤: (1)水合氢离子向阴极表面扩散并脱水: H3O+ → H+ + H2O (2)H+与电极表面的电子结合放电,形成吸附氢原子: H+ + e→Hads (3)吸附态氢原子通过复合脱附,形成H2分子: Hads + Hads → H2 或发生电化学脱附,形成H2分子: Hads + H+ + e → H2 (4)H2分子形成氢气泡,从电极表面析出。 各过程连续进行,最慢的过程控制整个反应过程。 通常(2)过程为控制过程。
电流通过腐蚀电池时,阳极的电极电位向正方向移动(升 高)的现象,称为阳极极化。 电流流过腐蚀电池时,阴极的电极电位向负方向移动(降 低)的现象,称为阴极极化。 (1)电化学极化或活化极化 在金属阳极溶解过程中,由于电子从阳极流向阴极的速度 大于金属离子放电离开晶格进入溶液的速度,因此阳极的正 电荷将随着时间发生积累,使电极电位向正方向移动,发生 电化学阳极极化。 由于电子进入阴极的速度大于阴极电化学反应放电的速度, 因此电子在阴极发生积累,结果使阴极的电极电位降低,发 生电化学阴极极化。
(1)构成腐蚀电池,即阴、阳极区之间存在电位差;
(2)存在着维持阴极过程进行的物质,即阴极去极化剂。
2.6 腐蚀电池的电极过程
2.6.1 阳极过程
(1)金属原子离开晶格转变为表面吸附原子:
M晶格 → M吸附 (2)表面吸附原子越过双电层进行放电转变为水化阳离子: M吸附+mH2O → Mn+•mH2O + ne (3)水化金属离子Mn+•mH2O从双电层溶液侧向溶液深处迁移。
2.8.2 析氢腐蚀发生的条件与特征
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
比利时学者M.Pourbaix在1938年首先提出,又称 Pourbaix图。
Fe-H2O电位-pH图
a线为析氢电极反应:
2 a 2 . 3 RT E E lg H 2F pH2
b线为O2与H2O间的 电化学反应:
2H2O O2(g)+4H++4e
会发生腐蚀。 B点处于腐蚀区,且在氢线以下,即处于Fe2+ 离子和H2的稳定区。 C点条件下,即在腐蚀区,又在氢线以上,对 于Fe2+和H2O是稳定的。铁仍会腐蚀,但不是 析氢腐蚀,而是吸氧腐蚀。
2.4 腐蚀电池及其工作历程
(1)阳极过程 金属溶解,以离子形式进入溶液,并把当量的电子留在 金属上 (2)阴极过程 从阳极流过来的电子被阴极表面溶液中能够接受电子的 物质所吸收,即发生阴极还原反应。 阴极还原反应中能够吸收电子的氧化性物质 D,在腐蚀学中通常称为 去极化剂。因为如果没有去极化剂,阴极区将由于电子的积累而发生 阴极极化而阻碍腐蚀的进行。最常见的阴极去极化剂是溶液中的 O2和 H+离子。 (3)电流的流动 电流的流动在金属中是依靠电子从阳极流向阴极,在 溶液中则是依靠离子的迁移,即阳离子从阳极区移向阴极区,阴离子 从阴极区移向阳极区。在阳极和阴极区界面上则分别发生上述的氧化 和还原反应,实现电子的传递。这样,整个电池体系便形成了一个回 路。
阴极反应:2H++1/2O2+2e H2O
铁免于腐蚀的方法
(1)把铁的电极电位降低至免蚀区,即对铁施行阴极保护。 可用牺牲阳极法,即用电位负的锌或铝合金与铁连接,构 成腐蚀电偶,或用外加直流电源的负端与铁相连,而正端 与辅助阳极连接,构成回路,都可保护铁免遭腐蚀。 (2)把铁的电位升高,使之进入钝化区。这可通过阳极保护 法或在溶液中添加阳极型缓蚀剂或钝化剂来实现。应指出 ,这种方法只适用于可钝化的金属。有时由于钝化剂加入 量不足,或者阳极保护参数控制不当,金属表面保护膜不 完整,反而会引起严重的局部腐蚀。溶液中有Cl-离子存在 时还需注意防止点蚀的出现。 (3)调整溶液的pH值至9~13之间,也可使铁进入钝化区。 应注意,如果由于某种原因(如溶液中含有一定量的Cl-)不 能生成氧化膜,铁将不钝化而继续腐蚀。
电偶序
金属或合金在某一特定介质中(如3%NaCl溶 液中)的腐蚀电位次序。
在3%NaCl中的电偶序 金 属 电位/V(SHE) Mg -1.45 Zn -0.80 Al -0.53 Cd -0.52 Fe -0.50 Pb -0.30 Sn -0.25 Ni -0.30 Cu +0.05 Cr +0.23 As +0.30 Ti +0.37 Pt +0.47
铜在不含氧酸中:
Cu Cu2++2e
EC = +0.337V u
铜在含氧酸中:
1/2O2+2H++2e
H2 O E O =1.229V
Nernst公式
2.3RT aO EE lg nF aR
0
含义: 单一电极反应,处于平衡状态下的电极电位。
极化图与腐蚀极化图?
金属在25℃的标准电极电位E°
Mg=Mg2++2e:-2.363 Al=A13++3e:-1.662 Ti=Ti3++3e:-1.210 Fe =Fe2++2e:-0.440V Cu=Cu2++2e:+0.337 Pd=Pd2++2e:+0.987 Au=Au++e:+1.691 注:均相对于SHE
问题: 为什么Mg、Al、Ti在空 气中不发生剧烈腐蚀?
问题:
电偶的概念, 危害、用途?
2.3 电位—pH图 金属的电化学腐蚀:金属同水溶液相互作用。 水溶液:H+和OH-离子。
电位—pH图
金属在水溶液中的稳定性不但与它的电极电位有 关,还与水溶液的pH值有关。若将金属腐蚀体系 的电极电位与溶液pH值的关系绘成图,就能直接 从图上判断给定条件下发生腐蚀反应的可能性。
亚微观腐蚀电池
每个电极表面十分微小(<10nm),遍布整个 金属表面,其中阴、阳极无规则地、统计 地分布着,且随时间不断地发生变化,结 果导致金属的均匀腐蚀。
作业
思考题: 1、5、6、7 计算题: 2、11、
二、按腐蚀机理分类
金属腐蚀倾向的电化学判据: EA﹤EC 则电位为EA的金属自发进行腐蚀 EA=EC 平衡状态 EA﹥EC 电位为EA的金属不发生腐蚀
问题1 问题2
Fe│H+ 阴阳极反应? Fe │O2
电位E属于热力学概念or动 力学概念?
举例(金属在不同环境中的腐蚀情况) 铁在酸中:
Fe
= -0.440V EF Fe2++2e e (△G°)T,p =-84920 J/mol
2.5腐蚀电池的类型
宏观腐蚀电池
异金属接触电池(电偶) 浓差电池(水线腐蚀、缝隙腐蚀、沉积物腐蚀、 盐滴腐蚀和丝状腐蚀、金属管道) 温差腐蚀电池 电解池阳极腐蚀(电镀阳极、杂散电流腐蚀)
微观腐蚀电池
由于金属表面化学成分的不均匀性而产生 的微电池(含杂质金属) 由于金属组织不均匀性而产生的微电池( 晶体缺陷)--晶间腐蚀、应力腐蚀断裂 由于金属物理状态的不均匀性而产生的微 电池 由于金属表面膜不完整而产生的微电池
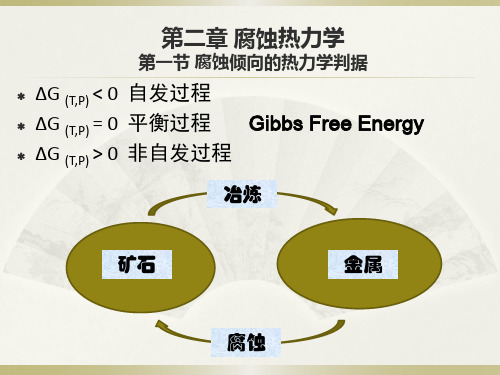
第一节 腐蚀倾向的热力学判据
第二章 腐蚀热力学
ΔG (T,P) < 0 自发过程 ΔG (T,P) = 0 平衡过程 Gibbs Free Energy ΔG (T,P) > 0 非自发过程
冶炼
矿石
金属
腐蚀
第二节 电化学腐蚀倾向的判断和电动序
E:电极电位(electrode potential,E) E0:标准电极电位(standard electrode potential)。 电位的基准E0H:标准氢电极(standard hydrogen electrode, SHE) E0H =0(pH=0) E0O=+0.815V(pH=7) EA(anode) 阳极:氧化反应,失电子 阴极:还原反应,得电子 EC(cathode)
Fe-H2O电位-pH图
a线为析氢电极反应:
2 a 2 . 3 RT E E lg H 2F pH2
b线为O2与H2O间的 电化学反应:
2H2O O2(g)+4H++4e
会发生腐蚀。 B点处于腐蚀区,且在氢线以下,即处于Fe2+ 离子和H2的稳定区。 C点条件下,即在腐蚀区,又在氢线以上,对 于Fe2+和H2O是稳定的。铁仍会腐蚀,但不是 析氢腐蚀,而是吸氧腐蚀。
2.4 腐蚀电池及其工作历程
(1)阳极过程 金属溶解,以离子形式进入溶液,并把当量的电子留在 金属上 (2)阴极过程 从阳极流过来的电子被阴极表面溶液中能够接受电子的 物质所吸收,即发生阴极还原反应。 阴极还原反应中能够吸收电子的氧化性物质 D,在腐蚀学中通常称为 去极化剂。因为如果没有去极化剂,阴极区将由于电子的积累而发生 阴极极化而阻碍腐蚀的进行。最常见的阴极去极化剂是溶液中的 O2和 H+离子。 (3)电流的流动 电流的流动在金属中是依靠电子从阳极流向阴极,在 溶液中则是依靠离子的迁移,即阳离子从阳极区移向阴极区,阴离子 从阴极区移向阳极区。在阳极和阴极区界面上则分别发生上述的氧化 和还原反应,实现电子的传递。这样,整个电池体系便形成了一个回 路。
阴极反应:2H++1/2O2+2e H2O
铁免于腐蚀的方法
(1)把铁的电极电位降低至免蚀区,即对铁施行阴极保护。 可用牺牲阳极法,即用电位负的锌或铝合金与铁连接,构 成腐蚀电偶,或用外加直流电源的负端与铁相连,而正端 与辅助阳极连接,构成回路,都可保护铁免遭腐蚀。 (2)把铁的电位升高,使之进入钝化区。这可通过阳极保护 法或在溶液中添加阳极型缓蚀剂或钝化剂来实现。应指出 ,这种方法只适用于可钝化的金属。有时由于钝化剂加入 量不足,或者阳极保护参数控制不当,金属表面保护膜不 完整,反而会引起严重的局部腐蚀。溶液中有Cl-离子存在 时还需注意防止点蚀的出现。 (3)调整溶液的pH值至9~13之间,也可使铁进入钝化区。 应注意,如果由于某种原因(如溶液中含有一定量的Cl-)不 能生成氧化膜,铁将不钝化而继续腐蚀。
电偶序
金属或合金在某一特定介质中(如3%NaCl溶 液中)的腐蚀电位次序。
在3%NaCl中的电偶序 金 属 电位/V(SHE) Mg -1.45 Zn -0.80 Al -0.53 Cd -0.52 Fe -0.50 Pb -0.30 Sn -0.25 Ni -0.30 Cu +0.05 Cr +0.23 As +0.30 Ti +0.37 Pt +0.47
铜在不含氧酸中:
Cu Cu2++2e
EC = +0.337V u
铜在含氧酸中:
1/2O2+2H++2e
H2 O E O =1.229V
Nernst公式
2.3RT aO EE lg nF aR
0
含义: 单一电极反应,处于平衡状态下的电极电位。
极化图与腐蚀极化图?
金属在25℃的标准电极电位E°
Mg=Mg2++2e:-2.363 Al=A13++3e:-1.662 Ti=Ti3++3e:-1.210 Fe =Fe2++2e:-0.440V Cu=Cu2++2e:+0.337 Pd=Pd2++2e:+0.987 Au=Au++e:+1.691 注:均相对于SHE
问题: 为什么Mg、Al、Ti在空 气中不发生剧烈腐蚀?
问题:
电偶的概念, 危害、用途?
2.3 电位—pH图 金属的电化学腐蚀:金属同水溶液相互作用。 水溶液:H+和OH-离子。
电位—pH图
金属在水溶液中的稳定性不但与它的电极电位有 关,还与水溶液的pH值有关。若将金属腐蚀体系 的电极电位与溶液pH值的关系绘成图,就能直接 从图上判断给定条件下发生腐蚀反应的可能性。
亚微观腐蚀电池
每个电极表面十分微小(<10nm),遍布整个 金属表面,其中阴、阳极无规则地、统计 地分布着,且随时间不断地发生变化,结 果导致金属的均匀腐蚀。
作业
思考题: 1、5、6、7 计算题: 2、11、
二、按腐蚀机理分类
金属腐蚀倾向的电化学判据: EA﹤EC 则电位为EA的金属自发进行腐蚀 EA=EC 平衡状态 EA﹥EC 电位为EA的金属不发生腐蚀
问题1 问题2
Fe│H+ 阴阳极反应? Fe │O2
电位E属于热力学概念or动 力学概念?
举例(金属在不同环境中的腐蚀情况) 铁在酸中:
Fe
= -0.440V EF Fe2++2e e (△G°)T,p =-84920 J/mol
2.5腐蚀电池的类型
宏观腐蚀电池
异金属接触电池(电偶) 浓差电池(水线腐蚀、缝隙腐蚀、沉积物腐蚀、 盐滴腐蚀和丝状腐蚀、金属管道) 温差腐蚀电池 电解池阳极腐蚀(电镀阳极、杂散电流腐蚀)
微观腐蚀电池
由于金属表面化学成分的不均匀性而产生 的微电池(含杂质金属) 由于金属组织不均匀性而产生的微电池( 晶体缺陷)--晶间腐蚀、应力腐蚀断裂 由于金属物理状态的不均匀性而产生的微 电池 由于金属表面膜不完整而产生的微电池
第一节 腐蚀倾向的热力学判据
第二章 腐蚀热力学
ΔG (T,P) < 0 自发过程 ΔG (T,P) = 0 平衡过程 Gibbs Free Energy ΔG (T,P) > 0 非自发过程
冶炼
矿石
金属
腐蚀
第二节 电化学腐蚀倾向的判断和电动序
E:电极电位(electrode potential,E) E0:标准电极电位(standard electrode potential)。 电位的基准E0H:标准氢电极(standard hydrogen electrode, SHE) E0H =0(pH=0) E0O=+0.815V(pH=7) EA(anode) 阳极:氧化反应,失电子 阴极:还原反应,得电子 EC(cathode)
