抗癌药Imatinib Mesylate的多晶型结构与稳定性
莫博赛替尼化学结构

莫博赛替尼化学结构
莫博赛替尼是一种抗癌药物,其化学名称为N-(4-((3-(2-amino-4-pyrimidinyl)-2-pyridinyl)oxy)phenyl)-4-(4-methyl-2-thiazolyl)-2-pyrimidinamine。
其化学结构可以描述为一种含有嘧啶和吡啶环的有机化合物。
具体来说,它包括一个苯基环和两个嘧啶环,其中一个嘧啶环连接着一个吡啶环。
此外,它还含有一个氨基和一个硫代咪唑基团。
这些结构特征赋予了莫博赛替尼其特定的生物活性和抗癌作用。
从结构角度来看,莫博赛替尼的苯基环和嘧啶环可能与靶标蛋白发生相互作用,从而影响癌细胞的生长和增殖。
其嘧啶环的存在也表明了其可能与DNA或RNA发生相互作用,从而影响癌细胞的遗传物质合成和复制。
此外,硫代咪唑基团的存在可能赋予了莫博赛替尼一些特殊的化学性质,使其在生物体内表现出特定的药理学效应。
总的来说,莫博赛替尼的化学结构为其在抗癌治疗中的作用提供了重要的基础,对于研究其药理学效应和与靶标蛋白的相互作用具有重要意义。
通过深入了解其化学结构,可以更好地理解莫博赛替尼在抗癌治疗中的作用机制,为其临床应用提供理论支持。
莫博赛替尼化学结构

莫博赛替尼化学结构全文共四篇示例,供读者参考第一篇示例:莫博赛替尼(Imatinib,商品名格列卫)是一种靶向治疗白血病的药物,也被用于治疗一些其他类型的癌症。
它是通过靶向特定的蛋白质,从而阻断癌细胞的生长和扩散。
莫博赛替尼的化学结构是一种非常复杂的有机分子,其分子式为C29H31N7O,分子量为493.604克/摩尔。
莫博赛替尼的化学结构包含一个核心环结构,由苯环和嘧啶环连接而成。
苯环是由六个碳原子和六个氢原子组成的环状结构,而嘧啶环是由一个氮原子和四个碳原子组成的环状结构。
这两个环通过一个氮原子相连,形成了一种特殊的结构,这种结构对于莫博赛替尼的药效非常重要。
莫博赛替尼在体内主要靶向作用于一种叫做BCR-ABL融合蛋白的蛋白质。
这种融合蛋白质是一种异常的蛋白质,由Bcr(一种信号传导蛋白)和Abl(一种酪氨酸激酶)两种蛋白质的部分结构融合而成。
这种异常蛋白质的产生是由于某些白血病细胞的染色体发生了特定的基因突变,导致Bcr和Abl两种基因相互融合。
而莫博赛替尼正是针对这种异常的蛋白质进行靶向治疗的。
莫博赛替尼的化学结构设计和药效机制是经过长期的研究和开发的。
科学家们通过不断的实验和研究,逐渐了解了白血病细胞的基因突变以及融合蛋白质的结构和功能特点。
通过对这些信息的深入研究,他们最终设计出了莫博赛替尼这种能够精准干预癌细胞生长的药物。
莫博赛替尼在临床应用中被证实具有显著的疗效,尤其是对于慢性髓细胞白血病(CML)和胃肠间质瘤(GIST)等罕见白血病和恶性肿瘤的治疗效果非常显著。
通过连续服用莫博赛替尼,患者的白血细胞数量可以得到控制,进而延缓疾病的进展并提高生存率。
莫博赛替尼的治疗效果和安全性已经得到了许多临床试验和长期随访的验证,被广泛应用于临床治疗。
莫博赛替尼是一种非常重要的抗癌药物,通过靶向作用于异常蛋白质来抑制癌细胞的生长和扩散。
其化学结构复杂且精确,对于白血病和其他类型的癌症具有显著的治疗效果。
omacetaxine mepesuccinate 结构式 -回复

omacetaxine mepesuccinate 结构式-回复Omacetaxine mepesuccinate是一种抗白血病药物,常用于治疗慢性髓细胞白血病(CML)。
它的结构式如下所示:[Omacetaxine mepesuccinate]在本文中,我们将一步一步解析omacetaxine mepesuccinate的结构和作用机制,以及它在治疗慢性髓细胞白血病中的应用。
第一步:结构解析Omacetaxine mepesuccinate的结构式反映了该药物的分子组成和化学特性。
其结构式中的Mepesuccinate表示该药物是以甲基琥珀酸酯的形式给药。
Omacetaxine是其活性成分,它是一种天然产物,通过分离和纯化工艺获得。
第二步:作用机制Omacetaxine mepesuccinate是一种蛋白质合成抑制剂。
它通过阻断CML细胞中的蛋白质合成来发挥作用。
具体来说,Omacetaxine抑制了细胞内的特定蛋白质合成酶,称为蛋白质合成酶1(eEF1A),这导致CML 细胞无法合成新的蛋白质。
这种针对特定蛋白质合成酶的作用使得CML 细胞不能进行正常的细胞周期和增殖过程,导致细胞死亡。
第三步:应用于慢性髓细胞白血病治疗由于它的作用机制,Omacetaxine mepesuccinate被用作一线治疗或二线治疗慢性髓细胞白血病。
它可以作为单药使用,也可以与其他药物联合使用。
在一线治疗中,Omacetaxine mepesuccinate通常被用作早期慢性髓细胞白血病患者的初始治疗。
它可以帮助减少白血病细胞的数量,并提高患者的生存率。
在二线治疗中,Omacetaxine mepesuccinate被用于那些已经使用了其他药物但未能有效控制疾病的患者。
它可以用于那些耐药或无法耐受其他治疗方法的患者。
需要注意的是,Omacetaxine mepesuccinate通常由专业医生在医院或诊所中给予静脉注射。
eribulin mesylate中文

eribulin mesylate中文Eribulin Mesylate(依立必能甲酸盐)是一种用于治疗乳腺癌的药物。
它属于一种叫做微管动力抑制剂的药物类别。
微管动力抑制剂通过干扰癌细胞内的微管结构,阻止了癌细胞的分裂和生长,从而抑制了肿瘤的发展。
乳腺癌是一种常见的恶性肿瘤,特别是在女性中更为普遍。
乳腺癌的发生与多种因素有关,包括遗传因素、生活方式和激素水平等。
乳腺癌的治疗方法包括手术切除、放疗、化疗和靶向治疗等。
Eribulin Mesylate就是一种化疗药物,它可以通过干扰肿瘤细胞的生长和分裂来抑制肿瘤的发展。
Eribulin Mesylate的使用是根据乳腺癌患者的具体情况来决定的。
一般来说,它适用于那些已经接受过至少两种化疗方案但疗效不佳的晚期乳腺癌患者。
它可以作为单药使用,也可以与其他抗癌药物联合使用。
Eribulin Mesylate的使用需要经过专业医生的评估和指导,因为它可能会引起一些副作用,如恶心、呕吐、乏力和白细胞减少等。
Eribulin Mesylate的治疗方案一般是每21天一次,每次静脉注射。
治疗的具体剂量和周期会根据患者的具体情况而定。
在使用Eribulin Mesylate期间,患者需要定期进行血液检查和身体检查,以监测治疗效果和副作用的发生。
Eribulin Mesylate的疗效已经在多个临床试验中得到证实。
其中一项研究显示,与其他化疗药物相比,Eribulin Mesylate可以显著延长晚期乳腺癌患者的总生存期。
另一项研究还发现,Eribulin Mesylate可以减少肿瘤的体积,并提高患者的生活质量。
然而,Eribulin Mesylate并不适用于所有的乳腺癌患者。
在使用之前,医生需要评估患者的全身情况、病情严重程度和其他治疗选择等因素。
患者也需要向医生提供详细的病史和用药情况,以确保安全和有效的治疗。
Eribulin Mesylate是一种用于治疗乳腺癌的化疗药物。
艾玛昔替尼化学结构

艾玛昔替尼化学结构艾玛昔替尼(Imatinib Mesylate),是一种口服的小分子靶向抗癌药物,属于酪氨酸激酶抑制剂。
它被广泛应用于慢性骨髓性白血病(CML)和胃肠道间质瘤(GIST)等肿瘤的治疗。
艾玛昔替尼的化学结构是一种咪唑基取代的苯甲酰胺类化合物。
它的分子式为C29H31N7O,相对分子质量为493.61。
艾玛昔替尼的结构中含有苯环、咪唑环和胺基等功能基团。
艾玛昔替尼通过抑制酪氨酸激酶(tyrosine kinase)的活性,从而干扰了癌细胞的信号传导通路,抑制了癌细胞的增殖和存活。
具体来说,艾玛昔替尼通过与BCR-ABL融合蛋白结合,阻断了BCR-ABL激酶的活性,从而抑制了CML细胞的增殖和存活。
此外,艾玛昔替尼还可以抑制肿瘤细胞中的KIT受体激酶,从而发挥对GIST 的治疗作用。
艾玛昔替尼的药物代谢途径主要是通过肝脏的细胞色素P450酶系统进行。
它主要经过CYP3A4酶代谢,形成活性代谢产物N-甲基艾玛昔替尼。
这些代谢产物具有较强的抗肿瘤活性,对于药物的治疗效果起到了重要的作用。
在临床应用中,艾玛昔替尼一般口服给药,每日一次。
由于其强烈的作用靶点选择性,艾玛昔替尼在治疗CML和GIST方面取得了显著的疗效。
然而,艾玛昔替尼也存在一定的副作用,如恶心、呕吐、腹泻等消化系统反应,以及水肿、皮疹、疲乏等全身反应。
此外,由于艾玛昔替尼的药物代谢途径主要经过肝脏,因此在用药过程中需要注意肝功能的监测。
尽管艾玛昔替尼在治疗白血病和肿瘤方面取得了巨大的成功,但也有部分患者出现耐药现象。
这主要是由于药物靶点的突变导致药物失效。
为了克服耐药问题,科学家们进行了大量的研究工作,开发了多种新型的靶向抗癌药物,如二代和三代BCR-ABL抑制剂。
这些药物在治疗耐药患者方面显示出了很大的潜力。
艾玛昔替尼作为一种重要的靶向抗癌药物,通过抑制酪氨酸激酶的活性,抑制了癌细胞的增殖和存活,取得了显著的疗效。
然而,其副作用和耐药问题仍然需要我们进一步研究和解决。
介孔二氧化硅纳米粒作为抗癌药物递送载体研究进展

㊀收稿日期:2022-11-06基金项目:辽宁省民生科技计划项目(2021JH2/10300067)ꎻ辽宁省教育厅2021年度科学研究经费项目(LJKZ0099)作者简介:陈立江(1969-)ꎬ女ꎬ湖南永州人ꎬ教授ꎬ博士生导师ꎬ研究方向:药物新剂型及其机理.㊀∗通信作者:陈立江ꎬE ̄mail:chlj16@163.com.㊀㊀辽宁大学学报㊀㊀㊀自然科学版第51卷㊀第1期㊀2024年JOURNALOFLIAONINGUNIVERSITYNaturalSciencesEditionVol.51㊀No.1㊀2024介孔二氧化硅纳米粒作为抗癌药物递送载体研究进展陈立江∗ꎬ马㊀艳ꎬ潘㊀昊(辽宁大学药学院ꎬ辽宁沈阳110036)摘㊀要:介孔二氧化硅纳米粒在抗癌药物递送系统中被广泛应用ꎬ因其具有孔径可调控㊁表面易被修饰㊁亲水性较好㊁生物兼容性良好等优势被制备成纳米药物递送载体.本文将从介孔二氧化硅纳米粒的合成方法㊁机理㊁生物降解及其在抗癌药物递送系统中的应用等方面对其进行总结ꎬ希望能为其作为纳米药物递送载体的研究提供帮助.关键词:介孔二氧化硅ꎻ制备ꎻ应用ꎻ降解中图分类号:R944㊀㊀㊀文献标志码:A㊀㊀㊀文章编号:1000-5846(2024)01-0001-07ReviewsofMesoporousSilicaNanoparticlesastheApplicationofAnticancerDrugDeliveryCarriersCHENLi ̄jiang∗ꎬMAYanꎬPANHao(SchoolofPharmaceuticalSciencesꎬLiaoningUniversityꎬShenyang110036ꎬChina)Abstract:㊀Mesoporoussilicananoparticlesarewidelyusedinanticancerdrugdeliverysystemsandarepreparedasnanodrugdeliverycarriersbecauseoftheiradvantagesofadjustableporesizeꎬeasysurfacemodificationꎬgoodhydrophilicityꎬandhighbiocompatibility.Thisarticlewillsummarizethesynthesismethodꎬmechanismꎬbiodegradationandapplicationofmesoporoussilicananoparticlesinanticancerdrugdeliverysystemsꎬhopingtoprovidehelpfortheirresearchasnanodrugdeliverycarriers.Keywords:㊀mesoporoussilicananoparticlesꎻpreparationꎻapplicationꎻdegradation0㊀引言癌症是一类常见的恶性肿瘤ꎬ死亡率极高ꎬ已经困扰了人类几个世纪.到目前为止ꎬ人类与癌症㊀㊀之间的拉锯战仍在焦灼地进行ꎬ2020年全球新发癌症患者19292789人ꎬ死亡9958133人ꎬ死亡率高达51.6%ꎬ其中乳腺癌㊁肺癌㊁结直肠癌㊁前列腺癌㊁胃癌及肝癌等为主要病症[1].癌症的治疗一直都是全球关注的热点ꎬ目前较为常见的是以手术为 主 ㊁药物为 辅 的治疗手段ꎬ阿霉素㊁顺铂㊁紫杉醇等广谱抗癌药被广泛用于癌症的治疗ꎬ但其常规制剂多具有全身毒性较大㊁水溶性较差以及多药耐药等弊端[2-4].近年来ꎬ研究人员将抗癌药物制备成脂质体㊁纳米粒以及载药胶束等新型纳米制剂ꎬ可以改善药物的水溶性㊁降低药物毒副作用㊁增强药物作用效果[5-7].介孔二氧化硅纳米粒(MesoporoussilicananoparticlesꎬMSNs)是一种介孔型无机纳米材料ꎬ因其具有较高的药物负载能力㊁较大的比表面积㊁孔径均匀可调㊁表面易被修饰且生物兼容性良好等特点被广泛用作抗癌药物的递送载体[8-9].1㊀MSNs的制备1.1㊀MSNs的合成机理MSNs的合成机理尚未完全明确ꎬ目前比较受大众认可的包括液晶模板机理㊁协同作用机理和膨胀收缩机理.液晶模板机理(见图1)指先将表面活性剂分子分散在水中形成胶束ꎬ等待胶束自组装形成液晶模板再加入硅源(二氧化硅前驱体化合物)ꎬ使其水解形成二氧化硅(SiO2)附着在其表面并缩合ꎬ最后通过酸刻蚀或煅烧等手段除去表面活性剂分子ꎬ该机理适用于解释直径大于100nm的MSNs的形成过程[10].协同作用机理建立在液晶模板机理基础之上ꎬ该机理认为液晶相是在硅源加入后才开始形成的ꎬ硅源的水解产物促使液晶模板形成ꎬ液晶模板的前驱体促进硅源水解ꎬ二者是相互促进㊁互助共生的关系ꎬ该机理适用于解释表面活性剂浓度较低时MSNs的形成过程[11].膨胀收缩机理(见图2)是指表面活性剂分子先在水中形成椭圆体胶束ꎬ硅源在胶束的疏水核心中溶解ꎬ使胶束从椭圆体转变为球体ꎬ硅源水解将亲水单体释放到水环境中ꎬ带负电荷的单体通过静电吸引力将带正电的表面活性剂分子吸附到胶束表面ꎬ胶束收缩变小ꎬ邻近的胶束聚集ꎬ生长形成具有介孔结构的颗粒ꎬ该机理适用于解释直径小于20nm的MSNs的形成过程[12].图1㊀液晶模板机理示意图[10]图2㊀膨胀收缩机理示意图[12]1.2㊀MSNs的合成方法溶胶-凝胶㊁微波辅助合成以及水热合成法是药物递送系统中MSNs较为常见的制备方法.溶胶-凝胶法的合成过程是让硅源在含有表面活性剂的体系中水解缩合形成溶胶后再形成凝胶ꎬ反应条件温和ꎬ操作简便ꎬ且对实验器材要求较低ꎬ但反应时间稍长ꎬ是最为常用的合成方法[13].微波辅助合成法建立在溶胶-凝胶法基础之上ꎬ在形成前驱体凝胶后利用微波辐射进行加热ꎬ使之迅速结2㊀㊀㊀辽宁大学学报㊀㊀自然科学版2024年㊀㊀㊀㊀晶化ꎬ大量成核ꎬ具有反应迅速㊁产率更高等优点ꎬ但该法制备MSNs的孔径大小和结构的可调节性较小[14-15].水热合成法是指在酸性或碱性条件下ꎬ将表面活性剂与硅源混合后装入高压釜ꎬ经水热处理得到结晶ꎬ反应速度介于溶胶-凝胶法与微波辅助合成法之间ꎬ但该法制备的MSNs纯度较高ꎬ粒度易被控制ꎬ且分散性较好[16].依据MSNs的介孔结构特征可分为多个系列ꎬ其中MCM系列(包括MCM-41㊁MCM-48等)和SBA系列(包括SBA-15㊁SBA-16等)是药物递送系统中的常见应用类型[17].MCM系列等常以阳离子表面活性剂如十六烷基三甲基氯化铵等为模板剂ꎬSBA系列多数以非离子三嵌段共聚物如聚环氧乙烷-聚环氧丙烷-聚环氧乙烷等为模板剂ꎬ两个系列的MSNs在合成过程中均需加入适量的酸性或者碱性物质来调控反应条件ꎬ然后加入正硅酸乙酯或硅酸钠等硅源ꎬ待反应完成后进行后处理ꎬ最后通过煅烧或选择性刻蚀等方法除去模板剂ꎬ得到纯净的MSNs[18-19].1.3㊀MSNs的结构改造MSNs作为药物递送载体一直是比较热门的研究对象ꎬ根据不同的需求ꎬ可对MSNs的结构进行升级和改造.中空介孔二氧化硅纳米粒(HollowmesoporoussilicananoparticlesꎬHMSNs)内部的空腔结构使其具有更大的比表面积和更高的载药量ꎬ适用于封装各种客体分子[20].HMSNs的合成方法包括两种ꎬ可选用单模板自组装法ꎬ即将已合成的MSNs放入热水中孵化ꎬ使其内部的介孔硅层自动溶解ꎬ形成中空空腔.也可选用双模板法ꎬ先制备出一个内核模板ꎬ例如金纳米粒㊁SiO2纳米粒和聚乙烯微球等硬质模板或囊泡㊁乳液㊁胶束等软质模板ꎬ之后利用溶胶-凝胶法在其表面合成MSNsꎬ最后再除去内核模板和介孔壳中的模板剂以此获得HMSNs[21-22].MSNs的孔径介于2~50nm之间ꎬ可容纳小分子药物ꎬ但对于蛋白质㊁酶㊁核酸㊁抗体等生物大分子药物ꎬ传统孔径的MSNs就无法满足载药需求ꎬ可对其进行扩孔ꎬ提升其药物负载能力.在MSNs的合成过程中ꎬ可通过改变pH㊁温度或反应物配比等条件来调节MSNs的孔径大小ꎬ也可以通过直接模板法对MSNs进行扩孔ꎬ即以疏水链较长的表面活性剂为模板剂或添加孔隙膨胀剂ꎬ使其进入胶束中心的疏水部分ꎬ进而扩大孔径[23-24].此外ꎬ还可在MSNs合成后对其进行后处理ꎬ用复盐浸渍法或硫酸辅助水热法对MSNs进行扩孔[25-26].虽然大孔径的MSNs在载药能力上有所提高ꎬ但孔径提升的同时可能会影响其被细胞摄取的能力ꎬ且结构可能会出现坍塌.此外ꎬMSNs还被制备成棒状㊁褶皱状及树突状等多种形态ꎬ用于改善其药物装载㊁递送或释放等性能[27-29].图3㊀HMSNs的合成及载药示意图[30]2㊀MSNs的表面功能化及其在抗癌药物递送系统中的应用如图3所示ꎬMSNs的介孔结构有利于其负载药物ꎬ将药物包覆在其内部后一般会选择适当的材料对MSNs的介孔结构进行修饰ꎬ即对MSNs进行 堵孔 ꎬ防止药物在递送途中发生泄漏ꎬ无法到达治疗部位.由于MSNs的表面具有亲水性和电负性ꎬ通过对其表面的硅烷醇基团进行官能化ꎬ可使其成为具有功能性的药物递送载体ꎬ实现缓㊁控释放药物或者靶向病变部位释放药物等目的[30].目前ꎬ关于功能型MSNs的研究ꎬ较为常见的可大致分为3类ꎬ包括主动靶向型MSNs㊁刺激响应型MSNs以及膜包覆型MSNs.2.1㊀主动靶向型MSNsMSNs的粒径一般小于200nmꎬ因此载药的MSNs可借助高通透性和滞留(Enhanced3㊀第1期㊀㊀㊀陈立江ꎬ等:介孔二氧化硅纳米粒作为抗癌药物递送载体研究进展㊀㊀permeabilityandretentionꎬEPR)效应实现药物在病变部位的蓄积ꎬ但这并不能促进肿瘤细胞对MSNs的选择性摄取.某些多糖㊁肽类及小分子受体等在肿瘤细胞表面会过度表达ꎬ通过物理吸附㊁静电结合或共价键偶联等方法将其配体修饰在MSNs表面ꎬ可将药物靶向递送至肿瘤部位ꎬ促进肿瘤细胞对载药MSNs的选择性吸收ꎬ降低药物对正常组织和细胞的毒副作用.Xu等[31]以聚多巴胺(PDA)改性的透明质酸(HA)修饰HMSNsꎬ成功制备了一种具有靶向和光热双重治疗作用的阿霉素(DOX)纳米制剂ꎬ在降低DOX全身毒性的同时ꎬ实现药物在肿瘤酸性微环境下的响应释放.Ghosh等[32]用3-羧基苯基硼酸和聚丙烯酸修饰MSNsꎬ用于递送4-异丙基苯甲醛ꎬ在小鼠乳腺癌模型中ꎬ表现出良好的体内抗肿瘤活性.Xu等[33]用叶酸(FA)和聚乙二醇(PEG)的共轭体修饰MSNsꎬ用于负载紫杉醇(PTX)ꎬ细胞实验结果表明ꎬFA修饰的MSNs能增强肝癌细胞对载药MSNs的摄取ꎬPEG的包覆可提高MSNs的生物兼容性ꎬ可显著改善紫杉醇的抗肿瘤效果.2.2㊀刺激响应型MSNs在肿瘤部位ꎬ肿瘤细胞的恶性增殖会导致肿瘤组织内部氧气供给不足ꎬ细胞进行无氧代谢ꎬ造成乳酸等酸性物质大量蓄积ꎬ导致肿瘤微环境整体呈现弱酸性[34].另外ꎬ相比于正常组织ꎬ肿瘤部位的谷胱甘肽(GSH)及某些生物酶的浓度较高ꎬ可根据该类特性设计刺激响应型药物递送载体ꎬ让修饰材料在特定的环境中降解ꎬ使药物尽可能地到达靶部位ꎬ防止药物在递送途中被提前释放[35-36].Wang等[37]以碳酸钙和脂质体双层膜包覆MSNsꎬ其中碳酸钙可在溶酶体内的酸性环境中分解ꎬ使溶酶体内部渗透压升高ꎬ破坏溶酶体结构ꎬ触发MSNs的溶酶体逃逸机制ꎬ同时以脂质体膜的包覆来增强纳米粒子的生物兼容性.Shin等[38]用HA修饰HMSNsꎬ引入二硫键形成HMSN SS HAꎬ用于负载DOXꎬ成功制备了一种可在高GSH浓度环境下响应释放药物的靶向制剂.除此之外ꎬ还可在MSNs中掺杂磁性氧化铁等纳米粒子ꎬ使其具有磁性响应功能[39]ꎬGao等[40]将四氧化三铁(Fe3O4)纳米粒杂交到MSNs中ꎬ以FA为堵孔剂ꎬ成功制备了一种具有主动靶向和磁性响应效果的阿霉素纳米制剂ꎬ可用于磁共振成像(MagneticresonanceimagingꎬMRI)引导的放射治疗.2.3㊀膜包覆型MSNs外源性纳米粒子一般会具有免疫原性或毒性ꎬ进入人体后会被免疫系统识别并清除ꎬ使得大部分粒子都聚集在肝㊁脾等器官ꎬ无法到达肿瘤部位[41].为增强MSNs的生物兼容性ꎬ延长药物作用时间ꎬ可选择亲水性高分子材料PEG或聚(乙二醇)甲基丙烯酸酯(Poly(ethyleneglycol)methacrylateꎬPPEGMA)对MSNs的表面进行修饰ꎬ也可用磷脂双层膜对其进行包覆[42].脂质体的化学成分和双层结构与生物膜相似ꎬ可与生物环境高度相容ꎬ提高药物的递送效率ꎬ但脂质体难以完全模仿生物膜的复杂机制[43].近年来ꎬ 复合类药物载体 成了研究人员的关注热点ꎬ以生物膜包覆合成类药物载体ꎬ利用细胞间相互作用的特点ꎬ可增强肿瘤细胞对载药纳米粒子的摄入ꎬ降低免疫系统的抑制外排作用ꎬ提高药物的生物利用度[44].Zhang等[45]构建了一种多层纳米药物载体ꎬ以PDA包覆MSNs使其具有光热刺激响应性ꎬ以生物素包覆使其具有肿瘤细胞靶向性ꎬ最后以红细胞膜包覆增强其逃避免疫系统清除的能力ꎬ结果表明约21.39%的纳米粒在注射24h后仍可存在于血液循环系统.除红细胞膜外ꎬ细菌外膜及癌细胞膜等也被广泛用于 复合类药物载体 的制备.Wang等[46]以大肠杆菌的外膜囊泡包覆PDA修饰MSNsꎬ其中大肠杆菌的外膜囊泡可诱导免疫应答ꎬ借助中性粒细胞的吞噬作用和趋化作用来增强对肿瘤细胞的靶向性.此外ꎬXie等[47]以癌细胞膜包覆MSNsꎬ合成了一种可以逃避宿主免疫系统攻击且同时具有同源靶向能力的纳米颗粒ꎬ增强纳米粒子的细胞内化能力ꎬ提高药物的生物利用度.3㊀MSNs的降解MSNs的降解是一个水解过程ꎬ水性介质中的羟基与其表面的非桥联氧( Si O Si )发生4㊀㊀㊀辽宁大学学报㊀㊀自然科学版2024年㊀㊀㊀㊀亲核反应ꎬ使可溶性硅酸浸出.传统的MSNs需要几天时间才能完成体内降解ꎬ排出体外也需要几周的时间ꎬ这可能导致MSNs在人体内蓄积ꎬ从而暴露生物安全问题ꎬ因此ꎬ以MSNs为药物递送载体时需考虑其在人体内的降解能力[48].扩大孔径㊁增加MSNs的比表面积可以提升水分子与MSNs之间的接触概率ꎬ为水解反应提供更多的反应位点[49].有研究表明ꎬ将Mn2+㊁Ca2+㊁Zn2+㊁Fe3+及Sr2+等金属离子杂化到MSNs的骨架中ꎬ以M Si O(M为金属离子)结构替代MSNs中的Si O Si结构ꎬ利用M Si键在酸性或氧化还原条件下比Si O键更易断裂的性质ꎬ提高MSNs在生物体内的降解能力[50-53].此外ꎬ在MSNs表面引入硫基等有机基团ꎬ也能使MSNs在特定的内环境中依靠氧化还原反应或酶解反应发生降解[54].4㊀结论与展望MSNs作为抗癌药物的递送载体对药物具有较大的包容性ꎬ无论是亲水性药物还是疏水性药物ꎬ都可被包覆在MSNs的内部.此外ꎬMSNs允许多药负载ꎬ对于具有p糖蛋白外排作用或需要联合治疗的抗癌药物ꎬMSNs可允许其与p糖蛋白外排抑制剂或其他抗癌药物联合负载ꎬ增强药物的作用效果ꎬ提高其生物利用度.MSNs的合成对环境和条件的要求并不苛刻ꎬ合成原料较为常见且操作简便ꎬ在抗癌药物递送载体中占据重要席位.目前MSNs已经被广泛用于生物医学成像㊁癌症治疗㊁基因治疗以及疫苗开发等多个重点领域.需要注意的是ꎬ用于药物递送载体的MSNs需保持高度分散和稳定ꎬ若MSNs发生聚集ꎬ则会影响肿瘤细胞的摄取效率ꎬ因此除流体动力学尺寸外ꎬ分散系数和稳定性也可以作为其在合成过程中的考察指标.此外ꎬ关于MSNs的体内降解问题也尚未得到完全解决ꎬ虽然金属离子接枝可增强MSNs的降解性能ꎬ但人体只能控制微量的金属元素代谢ꎬ过量摄入会产生生物毒性.另外ꎬ对于 复合类药物载体 ꎬ生物膜的包覆则会涉及体内的免疫应答ꎬ与该类机制相关的研究相对来说还比较少见ꎬ若能将其研究透彻ꎬ那么以MSNs作为抗癌药物递送载体的制剂就会有更大的希望进入临床转化.参考文献:[1]㊀WorldCancerResearchFundInternational.Worldwidecancerdata[EB/OL].(2022-03-23)[2022-11-05].https://www.wcrf.org/cancer ̄trends/worldwide ̄cancer ̄data/.[2]㊀HaftcheshmehSMꎬJaafariMRꎬMashreghiMꎬetal.Liposomaldoxorubicintargetingmitochondria:Anovelformulationtoenhanceanti ̄tumoreffectsofDoxil?invitroandinvivo[J].JournalofDrugDeliveryScienceandTechnologyꎬ2021ꎬ62:102351.[3]㊀PavanSRꎬPrabhuA.Advancedcisplatinnanoformulationsastargeteddrugdeliveryplatformsforlungcarcinomatreatment:Areview[J].JournalofMaterialsScienceꎬ2022ꎬ57(34):16192-16227.[4]㊀翟瑞东ꎬ刘哲鹏ꎬ赵守进.口服紫杉醇制剂的研究进展[J].实用药物与临床ꎬ2022ꎬ25(1):92-96.[5]㊀OlusanyaTOBꎬHajAhmadRRꎬIbegbuDMꎬetal.Liposomaldrugdeliverysystemsandanticancerdrugs[J].Moleculesꎬ2018ꎬ23(4):907.[6]㊀JoMJꎬJinISꎬParkCWꎬetal.Revolutionizingtechnologiesofnanomicellesforcombinatorialanticancerdrugdelivery[J].ArchivesofPharmacalResearchꎬ2020ꎬ43(1):100-109.[7]㊀QiSSꎬSunJHꎬYuHHꎬetal.Co ̄deliverynanoparticlesofanti ̄cancerdrugsforimprovingchemotherapyefficacy[J].DrugDeliveryꎬ2017ꎬ24(1):1909-1926.[8]㊀刘梦瑶.紫杉醇和槲皮素共载功能性介孔二氧化硅纳米粒的构建及逆转乳腺癌多药耐药研究[D].济南:山东大学ꎬ2020.[9]㊀史巧ꎬ黄星月ꎬ吴凯ꎬ等.载姜黄素的介孔二氧化硅及中空介孔二氧化硅的制备及释药性能研究[J].中国药师ꎬ2021ꎬ24(7):209-214.[10]㊀NarayanRꎬNayakUYꎬRaichurAMꎬetal.Mesoporoussilicananoparticles:Acomprehensivereviewonsynthesis5㊀第1期㊀㊀㊀陈立江ꎬ等:介孔二氧化硅纳米粒作为抗癌药物递送载体研究进展㊀㊀andrecentadvances[J].Pharmaceuticsꎬ2018ꎬ10(3):118.[11]㊀江悦.介孔氧化硅基药物缓释载体制备及性能研究[D].唐山:华北理工大学ꎬ2021.[12]㊀YiZFꎬDuméeLFꎬGarveyCJꎬetal.AnewinsightintogrowthmechanismandkineticsofmesoporoussilicananoparticlesbyinsitusmallangleX ̄rayscattering[J].Langmuirꎬ2015ꎬ31(30):8478-8487.[13]㊀KrishnanVꎬVenkatasubbuGDꎬKalaivaniT.Investigationofhemolysisandantibacterialanalysisofcurcumin ̄loadedmesoporousSiO2nanoparticles[J].AppliedNanoscienceꎬ2023ꎬ13(1):811-818.[14]㊀GolezaniASꎬFatehASꎬMehrabiHA.SynthesisandcharacterizationofsilicamesoporousmaterialproducedbyhydrothermalcontinuespHadjustingpathway[J].ProgressinNaturalScience:MaterialsInternationalꎬ2016ꎬ26(4):411-414.[15]㊀DeyRꎬSamantaA.Microwave ̄synthesizedhigh ̄performancemesoporousSBA-15silicamaterialsforCO2capture[J].KoreanJournalofChemicalEngineeringꎬ2020ꎬ37(11):1951-1962.[16]㊀KamarudinNHNꎬJalilAAꎬTriwahyonoSꎬetal.Variationofthecrystalgrowthofmesoporoussilicananoparticlesandtheevaluationtoibuprofenloadingandrelease[J].JournalofColloidandInterfaceScienceꎬ2014ꎬ421:6-13.[17]㊀李艳梅ꎬ张宇佳ꎬ陈明曦ꎬ等.介孔二氧化硅纳米粒作为药物载体研究进展[J].中国药剂学杂志ꎬ2021ꎬ19(2):52-60.[18]㊀TrendafilovaIꎬLazarovaHꎬChimshirovaRꎬetal.NovelkaempferoldeliverysystemsbasedonMg ̄containingMCM ̄41mesoporoussilicas[J].JournalofSolidStateChemistryꎬ2021ꎬ301:122323.[19]㊀HuYCꎬZhiZZꎬZhaoQFꎬetal.3Dcubicmesoporoussilicamicrosphereasacarrierforpoorlysolubledrugcarvedilol[J].MicroporousandMesoporousMaterialsꎬ2012ꎬ147(1):94-101.[20]㊀RahmanZUꎬWeiNꎬLiZXꎬetal.Preparationofhollowmesoporoussilicananospheres:Controllabletemplatesynthesisandtheirapplicationindrugdelivery[J].NewJournalofChemistryꎬ2017ꎬ41(23):14122-14129.[21]㊀LiYHꎬLiNꎬPanWꎬetal.Hollowmesoporoussilicananoparticleswithtunablestructuresforcontrolleddrugdelivery[J].ACSAppliedMaterials&Interfacesꎬ2017ꎬ9(3):2123-2129.[22]㊀SunSQꎬZhaoXYꎬChengMꎬetal.Facilepreparationofredox ̄responsivehollowmesoporoussilicaspheresfortheencapsulationandcontrolledreleaseofcorrosioninhibitors[J].ProgressinOrganicCoatingsꎬ2019ꎬ136:105302.[23]㊀曹渊ꎬ魏红娟ꎬ王晓.介孔材料的调孔方法及机理[J].材料导报ꎬ2010ꎬ24(11):27-31.[24]㊀孙蕊.介孔二氧化硅纳米粒子的制备及介孔结构调控的研究[D].沈阳:东北大学ꎬ2019.[25]㊀SunRꎬQiaoPCꎬWangZꎬetal.Monodispersedlarge ̄mesoporemesoporoussilicananoparticlesenabledbysulfuricacidassistedhydrothermalprocess[J].MicroporousandMesoporousMaterialsꎬ2021ꎬ317:111023.[26]㊀王平ꎬ朱以华ꎬ杨晓玲ꎬ等.介孔二氧化硅微球的扩孔及组装磁性纳米铁粒子[J].过程工程学报ꎬ2008ꎬ8(1):162-166.[27]㊀RahmaniSꎬDurandJOꎬCharnayCꎬetal.Synthesisofmesoporoussilicananoparticlesandnanorods:Applicationtodoxorubicindelivery[J].SolidStateSciencesꎬ2017ꎬ68:25-31.[28]㊀SoltaniRꎬMarjaniAꎬShirazianS.Novelmesoporouscrumpledpaper ̄likesilicaballs[J].MaterialsLettersꎬ2020ꎬ281:128230.[29]㊀AnWTꎬDefausSꎬAndreuDꎬetal.Invivosustainedreleaseofpeptidevaccinemediatedbydendriticmesoporoussilicananocarriers[J].FrontiersinImmunologyꎬ2021ꎬ12:684612.[30]㊀YanHJꎬYouYꎬLiXJꎬetal.PreparationofRGDpeptide/folateaciddouble ̄targetedmesoporoussilicananoparticlesanditsapplicationinhumanbreastcancerMCF ̄7cells[J].FrontiersinPharmacologyꎬ2020ꎬ11:898.[31]㊀XuQNꎬChangCꎬWangXLꎬetal.Aself ̄coatedhollowmesoporoussilicananoparticlefortumortargetingandchemo ̄photothermaltherapy[J].JournalofMaterialsScienceꎬ2022ꎬ57(10):6013-6025.[32]㊀GhoshSꎬKunduMꎬDuttaSꎬetal.Enhancementofanti ̄neoplasticeffectsofcuminaldehydeagainstbreastcancerviamesoporoussilicananoparticlebasedtargeteddrugdeliverysystem[J].LifeSciencesꎬ2022ꎬ298:120525.[33]㊀XuXYꎬWuCꎬBaiADꎬetal.Folate ̄functionalizedmesoporoussilicananoparticlesasalivertumor ̄targeteddrug6㊀㊀㊀辽宁大学学报㊀㊀自然科学版2024年㊀㊀㊀㊀deliverysystemtoimprovetheantitumoreffectofpaclitaxel[J].JournalofNanomaterialsꎬ2017ꎬ2017:2069685.[34]㊀WorsleyCMꎬVealeRBꎬMayneES.Theacidictumourmicroenvironment:Manipulatingtheimmuneresponsetoelicitescape[J].HumanImmunologyꎬ2022ꎬ83(5):399-408.[35]㊀TangHXꎬChenDFꎬLiCQꎬetal.DualGSH ̄exhaustingsorafenibloadedmanganese ̄silicananodrugsforinducingtheferroptosisofhepatocellularcarcinomacells[J].InternationalJournalofPharmaceuticsꎬ2019ꎬ572:118782.[36]㊀Molinier ̄FrenkelVꎬCastellanoF.Immunosuppressiveenzymesinthetumormicroenvironment[J].FEBSLettersꎬ2017ꎬ591(19):3135-3157.[37]㊀WangYWꎬZhaoKꎬXieLYꎬetal.Constructionofcalciumcarbonate ̄liposomedual ̄filmcoatedmesoporoussilicaasadelayeddrugreleasesystemforantitumortherapy[J].ColloidsandSurfacesBꎬ2022ꎬ212:112357.[38]㊀ShinDꎬLeeSꎬJangHSꎬetal.Redox/pH ̄dualresponsivefunctionalhollowsilicananoparticlesforhyaluronicacid ̄guideddrugdelivery[J].JournalofIndustrialandEngineeringChemistryꎬ2022ꎬ108:72-80.[39]㊀PopovaMꎬKosevaNꎬTrendafilovaIꎬetal.DesignofPEG ̄modifiedmagneticnanoporoussilicabasedmiltefosinedeliverysystem:Experimentalandtheoreticalapproaches[J].MicroporousandMesoporousMaterialsꎬ2021ꎬ310:110664.[40]㊀GaoQꎬXieWSꎬWangYꎬetal.AtheranosticnanocompositesystembasedonradialmesoporoussilicahybridizedwithFe3O4nanoparticlesfortargetedmagneticfieldresponsivechemotherapyofbreastcancer[J].RSCAdvancesꎬ2018ꎬ8(8):4321-4328.[41]㊀马徵薇.生物膜包载的纳米药物传递系统在结肠癌治疗的研究[D].沈阳:辽宁大学ꎬ2019.[42]㊀ZhouZHꎬZhangRQꎬJiaGFꎬetal.ControlledreleaseofDOXmediatedbyglutathioneandpHdual ̄responsivehollowmesoporoussiliconcoatedwithpolydopaminegraftpoly(poly(ethyleneglycol)methacrylate)nanoparticlesforcancertherapy[J].JournaloftheTaiwanInstituteofChemicalEngineersꎬ2020ꎬ115:60-70.[43]㊀TanSWꎬWuTTꎬZhangDꎬetal.Cellorcellmembrane ̄baseddrugdeliverysystems[J].Theranosticsꎬ2015ꎬ5(8):863-881.[44]㊀石金燕.基于生物膜包裹的介孔二氧化硅载药纳米粒的构建与抗肿瘤活性研究[D].沈阳:辽宁大学ꎬ2021.[45]㊀ZhangYFꎬYueXYꎬYangSCꎬetal.Longcirculationandtumor ̄targetingbiomimeticnanoparticlesforefficientchemo/photothermalsynergistictherapy[J].JournalofMaterialsChemistry.Bꎬ2022ꎬ10(26):5035-5044.[46]㊀WangZYꎬShiJYꎬPanHꎬetal.Membrane ̄cloakedpolydopaminemodifiedmesoporoussilicananoparticlesforcancertherapy[J].Nanotechnologyꎬ2022ꎬ33(34):345101.[47]㊀XieWꎬDengWWꎬZanMHꎬetal.Cancercellmembranecamouflagednanoparticlestorealizestarvationtherapytogetherwithcheckpointblockadesforenhancingcancertherapy[J].ACSNanoꎬ2019ꎬ13(3):2849-2857.[48]㊀HuYꎬBaiSꎬWuXZꎬetal.Biodegradabilityofmesoporoussilicananoparticles[J].CeramicsInternationalꎬ2021ꎬ47(22):31031-31041.[49]㊀ParisJLꎬBaezaAꎬVallet ̄RegíM.Overcomingthestabilityꎬtoxicityꎬandbiodegradationchallengesoftumorstimuli ̄responsiveinorganicnanoparticlesfordeliveryofcancertherapeutics[J].ExpertOpiniononDrugDeliveryꎬ2019ꎬ16(10):1095-1112.[50]㊀WangXPꎬLiXꎬItoAꎬetal.Biodegradablemetalion ̄dopedmesoporoussilicananospheresstimulateanticancerTh1immuneresponseinvivo[J].ACSAppliedMaterials&Interfacesꎬ2017ꎬ9(50):43538-43544.[51]㊀WangLYꎬHuoMFꎬChenYꎬetal.Coordination ̄accelerated ironextraction enablesfastbiodegradationofmesoporoussilica ̄basedhollownanoparticles[J].AdvancedHealthcareMaterialsꎬ2017ꎬ6(22):1700720.[52]㊀LiXLꎬZhangXꎬZhaoYBꎬetal.FabricationofbiodegradableMn ̄dopedmesoporoussilicananoparticlesforpH/redoxdualresponsedrugdelivery[J].JournalofInorganicBiochemistryꎬ2020ꎬ202:110887.[53]㊀GuoXꎬShiHSꎬZhongWBꎬetal.Tuningbiodegradabilityandbiocompatibilityofmesoporoussilicananoparticlesbydopingstrontium[J].CeramicsInternationalꎬ2020ꎬ46(8):11762-11769.[54]㊀何芳.仿生空心介孔有机硅纳米载药系统的构建与抗肿瘤评价[D].沈阳:辽宁大学ꎬ2022.(责任编辑㊀郭兴华)7㊀第1期㊀㊀㊀陈立江ꎬ等:介孔二氧化硅纳米粒作为抗癌药物递送载体研究进展。
伊布替尼 平面结构 溶解度

伊布替尼平面结构溶解度
【原创实用版】
目录
1.伊布替尼的简介
2.伊布替尼的平面结构
3.伊布替尼的溶解度
4.伊布替尼的应用领域
正文
伊布替尼是一种用于治疗慢性髓系白血病和费城染色体阳性急性淋巴细胞性白血病的药物,其化学名为“4-[(4-甲基 -1-哌嗪) 甲
基]-N-[4-[(3-甲基 -2-氧代 -5-咪唑啉 -4-基) 甲基]-2-甲基苯胺]-3-甲基 -2-氧代 -5-咪唑啉 -4-羧酸”。
它的平面结构由一个哌嗪环、一个咪唑啉环和一个苯胺环组成,这三个环通过共价键连接在一起,构成了伊布替尼的基本骨架。
伊布替尼的溶解度是指其在水中的溶解程度。
一般来说,伊布替尼在水中的溶解度较低,但在某些有机溶剂中的溶解度较高。
这一特性决定了伊布替尼在制备和应用过程中需要特别注意溶解度的问题,以保证药物的有效成分能够被充分吸收和利用。
伊布替尼的应用领域非常广泛,除了上述提到的治疗慢性髓系白血病和费城染色体阳性急性淋巴细胞性白血病外,还用于治疗多种实体瘤,如肺癌、胃癌等。
第1页共1页。
抗癌药物作用机理及作用靶点
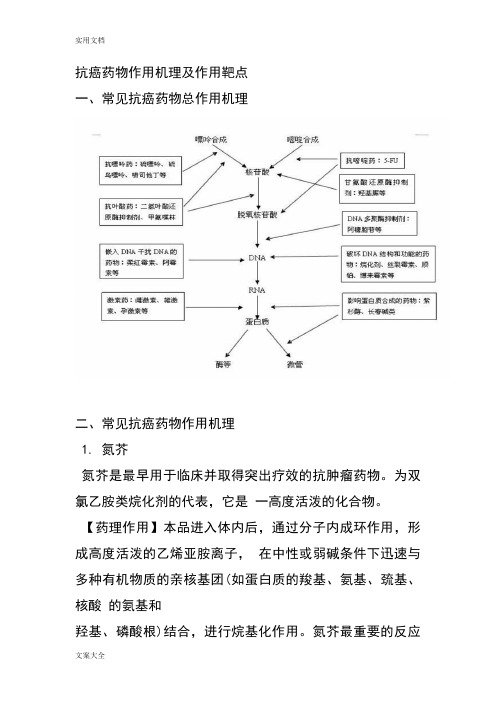
抗癌药物作用机理及作用靶点一、常见抗癌药物总作用机理二、常见抗癌药物作用机理1. 氮芥氮芥是最早用于临床并取得突出疗效的抗肿瘤药物。
为双氯乙胺类烷化剂的代表,它是一高度活泼的化合物。
【药理作用】本品进入体内后,通过分子内成环作用,形成高度活泼的乙烯亚胺离子,在中性或弱碱条件下迅速与多种有机物质的亲核基团(如蛋白质的羧基、氨基、巯基、核酸的氨基和羟基、磷酸根)结合,进行烷基化作用。
氮芥最重要的反应是与鸟嘌呤第7位氮共价结合,产生DNA 的双链内的交叉联结或DNA 的同链内不同碱基的交叉联结。
G1期及M 期细胞对氮芥的细胞毒作用最为敏感,由G1期进入S 期延迟。
【适应症】主要用于恶性淋巴瘤及癌性胸膜、心包及腹腔积液。
目前已很少用于其他肿瘤,对急性白血病无效。
与长春新碱(VCR)、甲基卡肼(PCZ)及泼尼松(PDN)合用治疗霍奇金病有较高的疗效,对卵巢癌、乳腺癌、绒癌、前列腺癌、精原细胞瘤、鼻咽癌(半身化疗法)等也有一定疗效;腔内注射用以控制癌性胸腹水有较好疗效;对由于恶性淋巴瘤等压迫呼吸道和上腔静脉压迫综合征引起的严重症状,可使之迅速缓解。
2.环磷酰胺环磷酰胺为氮芥与磷酰胺基结合而成的化合物,是临床常用的烷化剂类免疫剂。
【药理作用】该品在体外无抗肿瘤活性,进入体内后先在肝脏中经微粒体功能氧化酶转化成醛磷酰胺,而醛酰胺不稳定,在肿瘤细胞内分解成酰胺氮芥及丙烯醛,酰胺氮芥对肿瘤细胞有细胞毒作用。
环磷酰胺是双功能烷化剂及细胞周期非特异性药物,可干扰 DNA 及 RNA 功能,尤以对前者的影响更大,它与DNA 发生交叉联结,抑制DNA 合成,对S 期作用最明显。
【适应症】该品为最常用的烷化剂类抗肿瘤药,进入体内后,在肝微粒体酶催化下分解释出烷化作用很强的氯乙基磷酰胺(或称磷酰胺氮芥),而对肿瘤细胞产生细胞毒作用,此外本品还具有显著免疫作用。
临床用于恶性淋巴瘤,多发性骨髓瘤,白血病、乳腺癌、卵巢癌、宫颈癌、前列腺癌、结肠癌、支气管癌、肺癌等,有一定疗效。
阿可拉定长循环脂质体的制备与药效学评价

阿可拉定长循环脂质体的制备与药效学评价付淑凤;马丽霞【期刊名称】《西北药学杂志》【年(卷),期】2023(38)1【摘要】目的制备阿可拉定长循环脂质体(icaritin PEGylated liposomes,Ica-Lips),并评价其对人源肝癌细胞(hepaloblasloma G2,HepG2)的体内抗肿瘤效果。
方法采用冷冻干燥-水化法制备Ica-Lips,并在透射电镜下观察Ica-Lips的微观形态,测定Ica-Lips的包封率、粒径分布、Zeta电位,以及在pH7.4磷酸盐缓冲液(PBS)以及大鼠血浆中的药物释放特性;并考察了Ica-Lips的稳定性;比较了Ica-Lips与Ica原料药在大鼠体内的药动学行为,评价Ica-Lips对小鼠接种人源肝癌细胞(HepG2)的抑瘤效果。
结果制备的Ica-Lips呈类球状分布,其包封率为96.4%±0.3%,平均粒径为(108.4±3.6)nm,Zeta电位为(-12.9±0.2)mV;与Ica-Lips 在pH7.4 PBS中的释药速率相比,其在大鼠血浆中的释药速率明显加快;Ica-Lips在低温条件下保存3个月,稳定性良好;药动学研究表明,Ica-Lips可显著延长药物在大鼠体内的滞留时间,增加药物的生物利用度;药效学研究表明,Ica-Lips对小鼠接种人源肝癌细胞(HepG2)的抑瘤效果显著高于Ica溶液(P<0.05)。
结论将阿可拉定制备成长循环脂质体,提高了抗肿瘤效果,具有潜在的临床应用价值。
【总页数】5页(P113-117)【作者】付淑凤;马丽霞【作者单位】咸阳职业技术学院;西安交通大学医学部【正文语种】中文【中图分类】R94【相关文献】1.槲皮素长循环纳米脂质体的制备与质量评价2.乳铁蛋白修饰的去氢骆驼蓬碱长循环磁纳米脂质体的制备和体外性质评价3.柚皮素脂质体冻干粉的制备及其药效学评价4.鸦胆子油脂质体冻干粉的制备及其药效学评价5.奥沙利铂长循环脂质体的制备及其在小鼠体内的药效学研究因版权原因,仅展示原文概要,查看原文内容请购买。
甲磺酸伊马替尼的合成

甲磺酸伊马替尼的合成甲磺酸伊马替尼(ImatinibMesylate)是一种强效的抗癌药物,其具有良好的抗肿瘤活性。
目前,甲磺酸伊马替尼已被用于治疗慢性骨髓瘤、各种类型的白血病、肾细胞癌等多种肿瘤。
甲磺酸伊马替尼的合成是一篇极其重要的课题,它不仅有助于充分理解它的合成机理,而且也为临床研究带来重要的参考。
甲磺酸伊马替尼的合成可以概括为一个三步反应:第一步,N-乙酰氨基苯基乙酸苄基酯与苯基氨甲酰基甲苯相反应,形成Tyrphostin;第二步,Tyrphostin酰胺与亚甲基甲胺碘酸酯反应,形成imatainib;第三步,imatinib经甲磺酸缩合,形成甲磺酸伊马替尼。
第一步的反应首先将N-乙酰氨基苯基乙酸苄基酯溶解在室温醇中,同时加入苯基氨甲酰基甲苯及碘乙醇。
然后在室温下搅拌2~3小时,反应液变淡色,停止搅拌,放置一段时间,采用常压蒸馏进行分离,蒸馏残留物为Tyrphostin。
第二步的反应将Tyrphostin酰胺溶解在甲苯介质中,加入亚甲基甲胺碘酸酯,室温下搅拌3~4小时,反应液变白色,采用冷却干燥法分离,得到imatinib一种黄褐色的熔点82~84度的固体。
第三步的反应将imatinib放入甲磺酸溶液中,加热至80~90度,搅拌2~3小时,冷却至室温,采用常压蒸馏进行分离,得到甲磺酸伊马替尼一种白色固体,熔点233~238度。
甲磺酸伊马替尼的合成不仅能有效满足我们对药物的需求,而且也能帮助我们更好地理解它的药理作用机制,为临床研究提供重要的参考。
深入了解甲磺酸伊马替尼的合成及其药理机制,将有助于为肿瘤患者更加有效地提供抗癌疗法。
总之,甲磺酸伊马替尼的合成是一个重要的话题,其三步反应被各方研究人员证明是可行可用的。
经过进一步的研究,将为合成高品质甲磺酸伊马替尼提供新的研究结果,从而为肿瘤患者带来更有效的治疗方法和更好的抗癌效果。
甲磺酸伊马替尼晶体结构

甲磺酸伊马替尼晶体结构
甲磺酸伊马替尼(Imatinib mesylate)是一种抗癌药物,它是伊马替尼的甲磺酸盐形式。
由于没有特定提及晶体结构的相关文献,我无法提供其精确的晶体结构信息。
然而,伊马替尼(Imatinib)本身是一种分子化合物,其晶体结构已被研究和报道。
根据现有研究,伊马替尼的晶体结构是由各个分子间的相互作用建立起来的。
它主要由碳、氢、氧、氮和硫等元素组成。
伊马替尼的分子式为C29H31N7O,其分子量为493.6克/摩尔。
伊马替尼的晶体结构可能涉及分子之间的氢键和范德华力等相互作用。
这些相互作用对于固体中各个分子的排列和结晶态的稳定性至关重要。
总的来说,虽然无法提供具体的甲磺酸伊马替尼晶体结构信息,但伊马替尼本身是一种已被研究的化合物,其晶体结构可能由分子间的氢键和范德华力等相互作用决定。
总之,多孔纳米晶超晶格是一种具有特殊结构和性质的材料,其制备方法和控制孔隙结构的能力使其在各个领域都具有重要的应用潜力。
希美替尼结构式-概述说明以及解释

希美替尼结构式-概述说明以及解释1.引言1.1 概述希美替尼(Imatinib)是一种广泛应用于白血病和其他恶性肿瘤治疗的靶向治疗药物。
它是第一代酪氨酸激酶抑制剂,通过抑制异常的酪氨酸激酶活性,阻止了癌细胞的生长和扩散。
希美替尼已被证明在治疗慢性髓性白血病(CML)、急性淋巴性白血病(ALL)和一些消化道肿瘤等疾病中具有显著的疗效。
随着对希美替尼的深入研究,人们对其治疗机制和潜在的临床应用也有了更深入的了解。
本文将着重介绍希美替尼的化学结构、药理作用以及临床应用,以期为读者提供更全面的了解和认识。
1.2 文章结构文章结构部分主要是说明整篇文章的结构安排,帮助读者更好地理解文章的内容组织。
本文的结构分为引言、正文和结论三个部分。
引言部分主要包括概述、文章结构和目的三个方面。
在概述部分,会简要介绍希美替尼这种药物的背景和重要性。
文章结构部分即是本段,将会介绍整篇文章的结构安排。
目的部分则明确了本文撰写的目的和意义。
正文部分包括了希美替尼的化学结构、药理作用以及临床应用三个方面,分别介绍了这种药物的化学成分、作用机制以及临床使用的情况。
结论部分则对全文的内容进行总结,强调希美替尼的重要性和未来发展的展望。
同时,通过结论部分可以让读者更清晰地理解全文的核心意义和价值。
最后,结尾的结束语也是文章的收尾部分,可以对全文进行一个简短的总结或思考。
整个文章结构分明,逻辑清晰,能够很好地引导读者了解希美替尼这一药物的相关知识和重要性。
1.3 目的:本文的主要目的是详细介绍希美替尼这一药物的化学结构、药理作用以及临床应用,以便读者能够更全面地了解这一重要药物。
通过对希美替尼的研究和分析,可以帮助读者更好地认识并理解希美替尼在临床上的作用机制和应用领域,为医学研究和医疗实践提供参考和指导。
希美替尼作为一种重要的药物,对于肿瘤治疗以及其他相关疾病的治疗具有重要的意义,因此深入了解和研究希美替尼,可以为临床医生和研究人员提供更多选择和参考,有助于促进医疗领域的发展和进步。
吡妥布替尼结构式-概述说明以及解释

吡妥布替尼结构式-概述说明以及解释1.引言1.1 概述概述:吡妥布替尼(英文名称为Imatinib)是一种靶向治疗白血病和其他恶性肿瘤的药物,是一种酪氨酸激酶抑制剂。
吡妥布替尼可以有效抑制癌细胞的生长和扩散,并且对特定基因突变导致的异常细胞增殖起到显著的抑制作用。
由于其独特的分子结构和药理作用,吡妥布替尼在临床上被广泛应用,并取得了显著的治疗效果。
本文将从吡妥布替尼的化学结构、药理作用和临床应用等方面进行详细介绍,旨在帮助读者更全面地了解和认识这一重要的抗癌药物。
1.2 文章结构文章结构部分将主要包括以下内容:1. 引言部分:对吡妥布替尼进行简要的介绍,引发读者对该化合物的兴趣和好奇心。
2. 正文部分:分为三个子部分,分别介绍吡妥布替尼的化学结构、药理作用和临床应用,以便深入了解吡妥布替尼在医药领域的重要性和价值。
3. 结论部分:总结吡妥布替尼在医学领域的重要性,并展望其未来的发展前景,最终得出结论。
通过这样的文章结构,读者可以系统地了解吡妥布替尼的相关信息,从而更好地理解和掌握这一重要化合物的知识。
1.3 目的本文的主要目的是通过对吡妥布替尼的化学结构、药理作用和临床应用进行深入探讨,全面了解这一药物的特性和作用机制。
同时,结合吡妥布替尼在临床上的重要性,探讨其未来发展的潜力和前景。
通过对吡妥布替尼的研究和分析,可以为其在临床应用和新药开发中提供更多的参考和指导,促进药物研究领域的发展和进步。
希望本文能够为读者对吡妥布替尼有更深入的了解,并对其在医学和药物领域的应用产生更大的兴趣。
2.正文2.1 吡妥布替尼的化学结构:吡妥布替尼是一种常用的抗癌药物,化学名称为N-[3-(3-甲氧基-4-甲基苯基)-8-(3-胺基丙基)[1,3]噁二唑-2-基]-N'-甲基胍,分子式为C23H31N7O2,分子量为437.54。
吡妥布替尼的化学结构包括一个[1,3]噁二唑环和一个甲基胍基团。
[1,3]噁二唑环是一种含氮的杂环化合物,具有环状结构和芳香性质。
甲磺酸伊马替尼的合成

甲磺酸伊马替尼的合成甲磺酸伊马替尼是英文名字为ImatinibMesylate,是一种广泛应用于抗癌治疗的药物。
它是一种黏液体,无色至浅黄色,有较强的稳定性。
它是由6-氨基-2-甲基-3-碘咪唑衍生物的水杨酸乙酰胺(也称为Imatinib Mesylate)合成而成。
甲磺酸伊马替尼的合成是一个既复杂又具有挑战性的过程。
在一系列反应中,由一开始的原料2-甲基-3-碘咪唑到最终的甲磺酸伊马替尼,每一步都有可能遇到难题,影响最终成果。
首先,将原料2-甲基-3-碘咪唑与甲氨基氯化钠反应,产生2-甲基-3-碘咪唑甲氨基氯化物缩合物。
然后,将此缩合物水解,生成6-氨基-2-甲基-3-碘咪唑。
接下来,将6-氨基-2-甲基-3-碘咪唑与水杨酸脂肪酰胺反应,产生6-氨基-2-甲基-3-碘咪唑乙酰胺。
最后,将6-氨基-2-甲基-3-碘咪唑乙酰胺与甲磺酸氢钠反应,产生甲磺酸伊马替尼,这一步也叫做“甲磺酸化”。
甲磺酸伊马替尼的合成并不是一步到位,它是一个复杂而又费时费力的过程。
每一步都是关键,都有可能影响最终的成果。
因此,必须对各步骤的条件、温度、比例等都细致入微的控制,以确保最终获得甲磺酸伊马替尼的质量。
甲磺酸伊马替尼是一种广泛应用于抗癌治疗的有效药物,它的发明为抗癌治疗的发展做出了重要贡献。
由于其优越的生物学性质,甲磺酸伊马替尼更是受到了社会的广泛关注,已经成为科研领域的一项新兴研究项目。
甲磺酸伊马替尼的合成是一个复杂而具有挑战性的过程,要求从采购原料到最终成品的每一步都仔细控制,以确保甲磺酸伊马替尼的质量达到最佳要求。
虽然这一过程是复杂的,但是理论和实践的发展,给了生产者们充满信心,使他们能够更好地合成出高品质的甲磺酸伊马替尼。
伊利替康 结构式

伊利替康结构式伊利替康,也称为依西美坦,是一种利用于治疗乳腺癌和睾丸癌的化学药物。
它是一种抗肿瘤药物,通过抑制肿瘤细胞的生长和有丝分裂来起到治疗作用。
伊利替康具有独特的结构式和分子特性,下面将详细介绍它的结构式、作用机制、药代动力学和临床应用。
一、伊利替康的结构式伊利替康的化学分子式为C28H22F2N4O4,分子量为502.5克/摩尔。
其结构式如下所示:```H H| |F - C - C=C - C=C - C O| | | || || | | C N| | O // ||H - C=C-C - C=C - C-N H H/ || /C C - C//\\ / \\O O O O```图 1 伊利替康的分子结构式二、伊利替康的作用机制伊利替康的作用机制主要涉及其对肿瘤细胞的生长和分裂的抑制作用。
它是一种激酶抑制剂,通过阻断细胞周期蛋白依赖激酶(CDK)的活化而抑制细胞有丝分裂。
具体来说,伊利替康主要抑制CDK4和CDK6的活性,从而阻止细胞周期的进行,使肿瘤细胞无法继续增殖和扩散。
伊利替康也可以通过抑制转录因子E2F的活性,阻止其介导的基因转录而干扰肿瘤细胞的增殖。
这些作用机制使得伊利替康成为一种有效的抗肿瘤药物。
三、伊利替康的药代动力学1. 吸收:伊利替康口服后在胃肠道吸收迅速,生物利用度高达70%~90%。
饭后服药会延缓吸收而不影响总吸收量。
2. 分布:伊利替康主要分布在体内的肝脏、肾脏、肺和睾丸等组织中,而不会穿透血脑屏障。
3. 代谢:伊利替康主要在肝脏中代谢,由肝脏中的细胞色素P450酶系统催化酶代谢。
4. 排泄:伊利替康主要通过肝脏代谢后,以尿液和粪便的形式排泄。
伊利替康的药代动力学特点表明它在体内的吸收、分布、代谢和排泄都比较稳定,为临床应用提供了保障。
四、伊利替康的临床应用伊利替康主要用于治疗激素受体阳性的、早期和晚期乳腺癌,以及激素受体阳性的、晚期或转移性的睾丸癌。
临床研究表明,伊利替康在这些肿瘤治疗中具有显著的疗效,并且与其他治疗手段联合应用时可以进一步提高治疗效果。
依奇珠单抗结构 -回复

依奇珠单抗结构-回复关于依奇珠单抗(Ipilimumab)的结构,我们先来了解一下该药物的背景和作用机制。
依奇珠单抗是一种免疫疗法药物,主要用于治疗晚期黑色素瘤(melanoma)和转移性结直肠癌(metastatic colorectal cancer)。
它被称为抗CTLA-4抗体,因为它通过抑制CTLA-4(细胞因子T淋巴细胞相关蛋白-4)的活性,增强机体的免疫应答,从而达到抗肿瘤的目的。
CTLA-4是一种抑制性共刺激分子,它与T细胞的CD28受体竞争结合到抗原递呈细胞上的B7分子,从而阻碍了T细胞的激活。
而依奇珠单抗作为CTLA-4的抗体,则能够阻断CTLA-4与B7的结合,解除T细胞的免疫抑制状态,让T细胞可以更好地与肿瘤细胞发生互动,增强免疫系统对肿瘤的攻击力。
接下来,我们来详细了解依奇珠单抗的结构。
依奇珠单抗是一种全人源的IgG1类单克隆抗体,是由基因工程技术制造的。
它由两个重链和两个轻链组成,结构上呈现出典型的“Y”字形。
每个重链上都有一个恒定区(constant region)和一个可变区(variable region)。
恒定区负责与免疫系统的其他细胞进行互动,而可变区则决定了抗体对特定抗原(在这里是CTLA-4)的特异性。
重链和轻链的恒定区结合形成了抗体的Fc区域(Fragment, crystallizable region),它可以与免疫系统的其他细胞和分子发生相互作用,如激活补体系统、结合Fc受体等。
Fc区域的特性也决定了抗体的药理学特性,如药代动力学、免疫反应等。
在依奇珠单抗的Fc区域,还可以发现一种名为“髅浆酸”(L-fucose)的糖基。
研究发现,当依奇珠单抗上的髅浆酸被移除时,其免疫刺激效应将明显增强,对肿瘤的抑制效果也更好。
这一发现促使科学家进行了改良,用于生产更具活性的依奇珠单抗。
此外,在依奇珠单抗上的恒定区域还经过了一系列的修饰。
通过添加多肽链(polyethylene glycol,简称PEG),可以延长抗体的血浆半衰期,并且减少免疫系统对抗体的排斥反应。
格列卫构效关系

格列卫构效关系格列卫(Gleevec,Imatinib)是一种针对特定癌症的靶向治疗药物,主要用于治疗慢性髓性白血病(CML)和某些类型的急性淋巴细胞白血病(ALL)。
它是第一个被批准用于治疗CML的靶向药物,通过抑制肿瘤细胞中的异常激酶活性来发挥作用。
格列卫的构效关系研究主要集中在以下方面。
1.分子结构:格列卫的分子式为C29H31N7O,它是一种小分子化合物,能够通过口服进入体内。
其分子结构中含有多个芳香环和氮原子,这些结构特征对于其生物活性和药理作用至关重要。
2.生物活性:格列卫的主要生物活性是抑制Bcr-Abl激酶,这是一种在CML和某些ALL肿瘤细胞中异常表达的激酶。
通过抑制Bcr-Abl激酶,格列卫能够阻断肿瘤细胞的增殖和生存信号通路。
3.选择性:格列卫具有较高的选择性,它主要抑制Bcr-Abl激酶,而对其他激酶的影响较小。
这种选择性有助于减少对正常细胞的影响,从而降低药物的副作用。
4.药代动力学:格列卫的药代动力学特性,包括吸收、分布、代谢和排泄,对其治疗效果和安全性有重要影响。
研究表明,格列卫口服后能够迅速吸收,并在体内达到较高的浓度。
5.疗效和安全性:格列卫的临床试验和长期使用表明,它对于某些类型的白血病具有显著的疗效,能够显著延长患者的生存期。
同时,与其他治疗方法相比,格列卫具有较好的安全性。
6.耐药性:尽管格列卫对于某些患者非常有效,但部分患者可能会出现耐药性,这可能与Bcr-Abl基因的突变或其他机制有关。
因此,对耐药机制的研究对于改进治疗方法具有重要意义。
格列卫的构效关系研究为其临床应用提供了重要的理论基础,有助于更好地理解其在治疗癌症中的作用机制,并为未来药物的设计和改进提供了方向。
利特昔替尼 有关物质 流动相 含量

利特昔替尼有关物质流动相含量以利特昔替尼是一种抗癌药物,也被称为ALK抑制剂。
它被广泛应用于非小细胞肺癌(NSCLC)的治疗中,特别是那些携带ALK基因突变的患者。
利特昔替尼的物质流动相及其含量对于药物的有效性和安全性具有重要影响。
物质的流动相是指物质的物理状态,包括固态、液态和气态。
利特昔替尼是一种固态药物,在常温下呈现为白色结晶粉末状。
在制药过程中,利特昔替尼的流动相需要通过精细的工艺控制,以确保药物的稳定性和一致性。
此外,利特昔替尼的流动相还对于药物的溶解性和生物利用度等性质具有影响。
利特昔替尼的含量指的是药物中所含的有效成分的量。
药物的含量决定了其治疗效果和副作用的严重程度。
利特昔替尼的含量需要在制药过程中进行严格的控制和检测,以确保每个药片中的有效成分符合规定的标准。
过高或过低的含量都可能导致药效不佳或药物毒性增加。
为了保证利特昔替尼的物质流动相和含量的一致性,制药过程中需要进行严格的质量控制。
首先,原材料的质量必须符合相关标准,以确保制药过程中的物质流动相和含量的稳定性。
其次,制药过程中需要严格控制温度、湿度和压力等参数,以保证利特昔替尼的物质流动相稳定。
还需要进行定期的质量检测,确保利特昔替尼的含量符合规定的范围。
除了制药过程中的控制,患者在使用利特昔替尼时也需要注意药物的物质流动相和含量。
患者应按照医生的指导正确使用药物,遵循药物的用法和用量。
在用药过程中,患者应注意观察药物的外观,并及时联系医生或药师,如果发现药物的物质流动相或含量异常。
利特昔替尼的物质流动相和含量对于药物的疗效和安全性至关重要。
制药过程中需要严格控制和检测药物的物质流动相和含量,以确保药物的质量稳定。
患者在使用药物时也需要注意药物的外观和使用方法,及时与医生或药师沟通,以确保药物的有效性和安全性。
蛋白酪氨酸激酶抑制剂——慢性髓样白血病治疗药 imatinib mesylate

蛋白酪氨酸激酶抑制剂——慢性髓样白血病治疗药 imatinib
mesylate
王宇皎
【期刊名称】《国外医药:合成药.生化药.制剂分册》
【年(卷),期】2001(22)6
【总页数】2页(P374-375)
【关键词】蛋白酪氨酸激酶抑制剂;慢性髓样白血病;作用机理;不良反应
【作者】王宇皎
【作者单位】
【正文语种】中文
【中图分类】R733.72;R979.1
【相关文献】
1.酪氨酸激酶抑制剂(Imatinib mesylate)与现有治疗对照 [J], 宋韶芳
2.酪氨酸激酶抑制剂治疗未达最佳疗效慢性髓系白血病患者联合自噬抑制剂羟氯喹的临床研究 [J], 黄佳瑜;李砚如;连芸;谢月;赵慧慧;朱雨;李骥;李建勇;钱思轩
3.慢性髓性白血病患者酪氨酸激酶抑制剂治疗中发生的Ph阴性髓系肿瘤 [J], 袁婷;王晓燕;赖悦云;秦亚溱;石红霞;黄晓军;江倩
4.慢性髓性白血病酪氨酸激酶抑制剂治疗过程中继发Ph染色体阴性急性早幼粒细胞白血病一例 [J], 张风红;吴倩;尹佳;张静人;杨小飞;陈苏宁
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗癌药Imatinib Mesylate的多晶型结构与稳定性盛玥;李钢【摘要】本文对抗癌药物甲磺酸伊马替尼的多晶型与稳定性进行了分析与研究.通过X射线粉末衍射仪( XRD)测定了伊马替尼的晶型,并测定了在不同湿度下的稳定性,用X射线衍射原位高温附件( in situ high temperature)测定了伊马替尼的热稳定性.结果表明,该批次伊马替尼为α晶型,在从室温至200℃的加热过程中晶体结构稳定,在RH 75%的湿度条件下,结构也比较稳定,但在RH 92.5%的高湿度时,晶体结构逐渐向无定形转化.%This article studies the stability and the crystal structure of an anticancer drug imatinib mesylate. The crystal form of the imatinib mesylate was determined by means of X-ray powder diffraction. The stability under different humidity was determined and the thermostability of imatinib mesylate was analyzed by X-raydiffraction( XRD) with in situ high temperature accessories. The results showed that the sample is the α crystalline form and its crystal form was stable during the heat ing process from room temperature to 200℃. The crystal form was stable under low humidity,but unstable under high humidity and finally turned to amorphous.【期刊名称】《南京师大学报(自然科学版)》【年(卷),期】2014(000)001【总页数】4页(P137-140)【关键词】甲磺酸伊马替尼;X射线粉末衍射;多晶型【作者】盛玥;李钢【作者单位】南京师范大学分析测试中心,江苏南京210023;南京师范大学分析测试中心,江苏南京210023【正文语种】中文【中图分类】R917甲磺酸伊马替尼(Imatinib Mesilate),商品名为格列卫(gleevec,glivec),化学名为4-(4-甲基哌嗪基-1-甲基)-N-[4-甲基-3-[4-(3-吡啶基)嘧啶-2-氨基]-苯甲酰胺甲磺酸盐.其分子结构如图1所示.该药是由瑞士诺华公司开发的一种小分子酪氨酸激酶抑制剂类抗肿瘤药物.通过与酪氨酸激酶的ATP结合位点特异性结合,竞争性地阻止酪酸激酶与ATP结合,阻断酪氨酸激酶的自身磷酸化及底物的磷酸化,彻底切断异常的酪氨酸激酶的信号传导从而达到抗肿瘤的目的.甲磺酸伊马替尼能够抑制包括p210Bcr-Abl、pl85Bcr-Abl、v-Abl和c-Abl酪氨酸激酶在内的各种Abl酪氨酸激酶,以及血小板衍生生长因子受体(PDGFR)和干细胞因子受体(c-Kit)等酪氨酸激酶的活性[1].由于具有突破性的抗肿瘤作用机制,2001年5月,甲磺酸伊马替尼以其具有突破性的抗肿瘤机制获得美国FDA特快审批,用于α-干扰素治疗失败后的慢性期、急变期及加速期的慢性粒细胞白血病(chronic myelocytic leukemia)的治疗.2002年2月,美国FDA又批准该药用于治疗不能手术切除或发生转移的恶性胃肠道间质细胞瘤(gastroin-testinal stromal tumours).该药对其他肿瘤的临床试验也在进行中[2].甲磺酸伊马替尼于2002年在我国上市.X射线粉末衍射(XRD)法是对药物的多晶型研究最主要的手段,已有较多文献报道[3-7].伊马替尼的分子结构如图1所示,它具有α、β等多种晶型[8-11],目前对它的研究重在合成工艺及使其产业化,公开的专利文献已有多篇[9-12] ,而对其稳定性如在加热过程中和高湿条件下的结构稳定性研究尚未见报道.图1 甲磺酸伊马替尼的分子结构Fig.1 Structure of imatinib mesilate(Mr 589.7) 1 材料与方法1.1 材料甲磺酸伊马替尼原料样品,样品批号为YMTN-66-1,由南京圣和药业有限公司提供.纯度为98%以上.1.2 仪器1.2.1 X 射线粉末衍射仪日本理学公司的D/max 2500VL/PC型转靶X射线衍射仪(XRD)及其原位高温附件(in situ high temperature).测定条件为管压:40 kV,管流:100 mA,Cu Kα 辐射,石墨弯晶单色器,DS=SS=1°,RS=0.3 mm.扫描速度:10 °·min-1.步进间隔:0.02°.1.2.2 差式扫描量热仪美国PERKIN-ELMER公司的差示扫描量热仪(Diamond DSC)测定条件:以氮气为保护气、升温速率为10℃·min-1,升温范围为25~300℃,进行差示扫描量热分析(DSC).2 结果与分析2.1 甲磺酸伊马替尼的晶型用X射线粉末衍射法测定了甲磺酸伊马替尼的晶型,表1列出了测量值与专利CN102321070A中的甲磺酸伊马替尼八强线数据,结果表明YMTN-66-1的甲磺酸伊马替尼原料为α晶型.图2为专利文献α-晶型甲磺酸伊马替尼XRD图谱,图3为本批次甲磺酸伊马替尼XRD图谱,根据衍射数据和图谱比较,确定YMTN-66-1的甲磺酸伊马替尼原料为α晶型.表1 X-Ray测定数据Table 1 X-Ray Data of Imatinib Mesylate110.480 10.400 2 14.920 14.840 3 17.700 17.660 4 18.640 18.540 5 19.120 19.020 6 21.320 21.200 7 21.700 21.540 8 24.960 24.880图2 专利文献α-晶型甲磺酸伊马替尼XRD图谱Fig.2 X-Ray figure of α crystalline of imatinib mesylate图3 YMTN-66-1甲磺酸伊马替尼原料XRD图谱Fig.3 X-Ray figure of imatinib mesylate2.2 测定不同温度下的稳定性图4为甲磺酸伊马替尼的差示扫描量热分析图谱,由此可知在224.3℃时伊马替尼开始熔解,峰顶温度为226.2℃.用X射线衍射仪及原位高温附件,在真空条件下程序升温,测定其在不同温度下晶型结构的变化.根据其差示扫描量热分析结果,将温度点设定到25℃、50℃、100℃、150℃、165℃、180℃、200℃共7个温度点,每个点恒温1 min,然后保温检测其结构变化.图5显示的是伊马替尼在不同温度下的X射线衍射多重比较图谱.结果表明,α晶型甲磺酸伊马替尼的晶型结构在该区间不随温度变化而改变.图4 甲磺酸伊马替尼的差示扫描量热分析图Fig.4 DSC pattern of imatinib mesylate图5 α晶型甲磺酸伊马替尼在不同温度下的X射线衍射图谱Fig.5 X-Ray patterns of α crystalline of imatinib mesylate under different temprature 2.3 测定不同湿度下的稳定性将甲磺酸伊马替尼置于恒湿密闭容器中,于25℃、RH 75% ±5%条件下放置10天,在第5天和第10天取样检测,进行X射线衍射分析,检测其晶型结构变化情况.将甲磺酸伊马替尼置于恒湿密闭容器中,于25℃、RH 92.5% ±5%条件下放置10天,在第1天,第3天,第5天取样检测,进行X射线衍射实验,检测其结构变化状况.不同湿度下的X射线衍射图谱结果如图6、图7所示.结果表明,在25℃、RH 75% ±5%条件下,α晶型甲磺酸伊马替尼的晶型较为稳定.在25℃、RH 92.5% ±5%条件下,α晶型甲磺酸伊马替尼晶型变化较大,向无定形转化,第3天就已经转化为非晶态.图6 25℃、RH 75%±5%条件下放置第5天和第10天取样检测X射线衍射图谱Fig.6 X-ray patterns o f 25 ℃,RH 75% ±5%for the first 5 days and 10 days图7 25℃、RH 92.5%±5%条件下放置第1天,第3天,第5天取样检测X射线衍射图谱Fig.7 X-ray diffraction patterns of the sample under the conditionof 25 ℃,RH 92.5% ±5%after 1 day,3 days,and 5 days4 讨论稳定性研究的目的是考察温度、湿度等对药物质量的影响,为制剂加工过程及工艺优化过程做参考.本文采用X射线衍射法对甲磺酸伊马替尼原料样品的晶型进行分析,确定了它的晶型为α型.程序升温测定其在不同温度下的稳定性,发现伊马替尼在加热过程中直到分解前晶型结构稳定.很多药物,特别是有机药物,在加热过程中会发生晶型的转变.如那格列奈存在B晶型和H等多种晶型,其中B晶型在球磨或加热时会发生晶型的转化[3],其热稳定性不如H晶型,不宜药用.目前从已发表的专利及文献来看对伊马替尼的研究主要在合成工艺方面,而伊马替尼的晶型据文献报道多达20多种[9-12],多晶型由于其晶格能差异导致溶解度、制剂溶出度和生物利用度的差异,有些有效、有些无效甚至有害,所以对药物多晶型及晶型稳定性研究是现代药品报批必不可少的工作.本文通过对伊马替尼原料药α晶型的测定分析与研究,给出了相关晶体结构数据,证明其在熔点前加热过程中和RH 75% ±5%条件下的稳定性较好,而在RH 92.5% ±5%状态下晶型不稳定,逐渐向无定形转化.药物稳定性是评价药物有效期和安全期的重要指标之一,也是核定药物使用期的主要依据.本文考察的是甲磺酸伊马替尼晶型的稳定性,它是药物稳定性的一部分.而稳定性的研究是为了探索药物在贮藏期内质量变化的规律,保证药物在使用期内安全有效.本文的研究结果为甲磺酸伊马替尼药物质量评价提供了参考数据.[参考文献][1] Bree F,Sorbera L A,Fernandez R,et al.Imatinibmesilate(treatment of chronic myeloid leukemia bcr-abl tyrosine kinase inhibitor)[J].Drugsof the Future,2001,26(6):545 -552.[2]陈黎明.抗肿瘤新药STI-571研究新进展[J].国外医学:肿瘤分册,2002,29(5):333-337.[3] Yang L,Ru M L,Lang M D.The crystalline polymorph control and selection of gabapentin with polymer heteronuclei[J].Acta Pharm Sin,2010,45:109 -113.[4] Li G,Su G Q,Xu Q W,et al.A new crystal form of nateglinide [J].Acta Pharm Sin,2001,37:532 -534.[5]黄长高,李钢,郑海辉,等.蒙脱石中α -SiO2的定量分析[J].药物分析杂志,2009,29(2):265-268.[6]朱侃,陈小青,马超,等.头孢克洛结构测定与分析[J].药物分析杂志,2010,30(11):2 111-2 115.[7]黄张洪,赵惠,吕利强,等.热分析技术及其应用[J].热加工工艺,2010,39(7):19-23.[8]李铭东,李东,吉民.甲磺酸伊马替尼的合成[J].中国药学杂志,2008,43(3):228-229.[9]诺瓦提斯公司.甲磺酸伊马替尼的δ和ε 晶形:中国,CN101243066A [P].2008-8-13.[10]诺瓦提斯公司.甲磺酸伊马替尼的 F,G,H,I和 K 晶形:中国,CN101312960A[P].2008-11-26.[11]西科尔公司.甲磺酸伊马替尼的多晶型及其制备方法以及无定型和α型的甲磺酸伊马替尼:中国,CN101573350A[P].2009 -11 -4.[12]江苏省先声药物研究有限公司.一种伊玛替尼甲烷磺酸盐α晶型新的制备方法:中国,CN102146073A[P].2011-2-23.。
