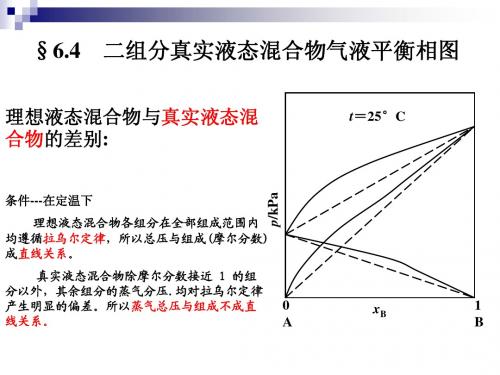
液态混合物和溶液-物理化学课件
合集下载
液态混合物和溶液-物理化学

所以 mB'=mAxB'MB/MA =1000g×8.24×10-6 ×32.0g.mol-1/(18.0g.mol-1) =0.015g
精品课件
14
计算挥发性溶质在平衡气相的组成:例4 -5
四、拉乌尔定律与亨利定律的比较 适用对象不同;
比例系数不同;
组成选择不同。
精品课件
15
例、20℃下HCl(B)溶于苯(A)达平衡。当气相中HCl 分压为101.325kPa时,溶液中HCl的摩尔分数为 0.0425。已知20℃ 苯的饱和蒸汽压为10.011kPa。 求20℃ 时HCl与苯蒸气的总压为101.325kPa时,苯 中溶解HCl的摩尔分数。 解:
p总 = p苯 +
pHCl
溶质服从Henry定律:pHCl=kxxHCl
溶剂服从Raoult定律: p苯=p*苯 (1-xHCl)
解得:xHCl= 0.0385
精品课件
16
§4.3 偏摩尔量 问题的提出
18.09 cm3 18.09 cm3
=
36.18 cm3
1mol H2O (l) + 1mol H2O (l)
第四章 液态混合物和溶液
溶液(solution)(混合物)
广义地说,两种或两种以上物质彼此以分子或离子 状态均匀混合所形成的体系称为溶液(混合物) 。
溶液和混合物的区别:
溶液有溶剂和溶质之分而混合物没有;对溶液中的 溶剂和溶质采用不同的研究方法,而对混合物则采 用同一的研究方法。
精品课件
1
溶剂(solvent)和溶质(solute)
13
(2)0℃,101325Pa的空气中, 1000g水中最多 可溶解多少克O2(g)。
精品课件
14
计算挥发性溶质在平衡气相的组成:例4 -5
四、拉乌尔定律与亨利定律的比较 适用对象不同;
比例系数不同;
组成选择不同。
精品课件
15
例、20℃下HCl(B)溶于苯(A)达平衡。当气相中HCl 分压为101.325kPa时,溶液中HCl的摩尔分数为 0.0425。已知20℃ 苯的饱和蒸汽压为10.011kPa。 求20℃ 时HCl与苯蒸气的总压为101.325kPa时,苯 中溶解HCl的摩尔分数。 解:
p总 = p苯 +
pHCl
溶质服从Henry定律:pHCl=kxxHCl
溶剂服从Raoult定律: p苯=p*苯 (1-xHCl)
解得:xHCl= 0.0385
精品课件
16
§4.3 偏摩尔量 问题的提出
18.09 cm3 18.09 cm3
=
36.18 cm3
1mol H2O (l) + 1mol H2O (l)
第四章 液态混合物和溶液
溶液(solution)(混合物)
广义地说,两种或两种以上物质彼此以分子或离子 状态均匀混合所形成的体系称为溶液(混合物) 。
溶液和混合物的区别:
溶液有溶剂和溶质之分而混合物没有;对溶液中的 溶剂和溶质采用不同的研究方法,而对混合物则采 用同一的研究方法。
精品课件
1
溶剂(solvent)和溶质(solute)
13
(2)0℃,101325Pa的空气中, 1000g水中最多 可溶解多少克O2(g)。
第四章,液体混合物与溶液

3. 化学势(chemical potential)
(1)
G G G dG dnB dT p dp n T p ,nB B T , n B B T , p , n
C
当组成不变时,
G dG SdT Vdp dnB n B B T , p ,nC
2.单选题: (1)1molA与 nmol B组成的溶液,体积为0.65 dm3 ,当xB = 0.8 时,A的偏摩尔体积VA=0.090dm3· -1,那么B的偏摩尔VB 为: mol (A) 0.140 dm3· -1 ; mol (B) 0.072 dm3· -1 ; mol (C) 0.028 dm3· -1 ; mol (D) 0.010 dm3· -1 。 mol
ΔG TΔS
1
ΔS2 ΔS1 ΔS 56.25J K
1
ΔG2 ΔG1 ΔG 298.15 56.25J 16.77kJ
(5)化学势与温度的关系
B SB,m T p,nB
4. 恒温下理想气体混合物化学势
(1)单组分纯理想气体
RT dGm Vmdp dp p
T Gm RT ln p
Gm RT ln p C
* (Pg) O (g) p RT dp O (g) RT ln( p / p O ) p O p
B
G T p ,nB T , p ,n
S
C
nB T , p ,n
S
B ,m
C
(3) 等温等压下, 系统内发生相变化或化学变化时, 有
物理化学(第五版) 演示文稿4-4 理想液态混合物与理想稀溶液

溶 质,T , p,b
的关系?
溶质B的标准态 (T, p , b)
b,B
(溶
质
,
T
,
b
)
Δµ 溶质B在的T, p下
(T, p , b)
b,B (溶 质,T , p,b )
b,B(溶质,T, p,b) b,B(溶质,T,b)
p
GB p VBdp
b,B 溶 质 , T , p , b
为什么?
f
* A
A
f
* BB
fAB
V(A分子) ≈ V(B分子)
各组分单独存在或在混合物中的逸出能力几乎相同。
1. 理想液态混合物的化学势
根据相平衡条件
μB(l)=μB(g)
g
若气体是理想气体
μBg
μBg,T RT ln
pB p
l
所以
μBl
μBg,T RT ln
pB p
又因为
pB
p
* B
x
p, b )
RT ln
bB b
b,B
(溶
质
,
T
,
b
)
表示标准态的化学势
标准态:T、p下,溶质B的质量摩尔浓度bB=b,又 遵守亨利定律的溶液中溶质B的(假想)状态
{p}
kb,B
pB=kb,BbB 标准态
实际状态
0 {b } 1
B
理想稀溶液中溶质B的标准态
b ,B
溶 质,T ,b
与 b,B
标准态:纯液体A在 温度为T,p 下的状态。
2. 稀溶液中溶质B的化学势
相平衡 μb,B(溶质)=μB(g)
假定气体是理想气体
物理化学(第三版)第3章 液态混合物和溶夜

B
dnB
B
dnB
...
B dnB
B
B
B
dG
B
dnB
≤0
B
< 自动进行 = 平衡
应用条件:( 恒温、恒压、 W’=0)
化学势在相平衡中的应用
设有物质的量为dn的纯物质A,在恒温恒压无非体积功的 条件下,由液相转移到气相。
A(l) T, p,W'0 A(g)
l
g
dnl dng
dn g
dG
溶液中组成可分为溶质和溶剂。
以物态可分为气态溶液、固态溶液和液态溶液。
3.1 偏摩尔量与化学势
一、偏摩尔量的定义 多组分系统的广度性质X不仅是温度、压力的
函数,还与系统的组成有关,即
X = f(T,p,nB,nC…)
dX
X T
p,nB ,nC L
dT
X p
T ,nB ,nC L
dp
解: (1)NaCl饱和溶液的质量分数:
w(
NaCl)
=
m(
m(NaCl) NaCl) + m(H
2O)
= 3.173 =0.2644 26.44% 12.003
(2)NaCl饱和溶液中
n(NaCl) = m(NaCl) 3.173= 0.0542mol M (NaCl) 58.5
n(H2O)
4.质量摩尔浓度--bB
bB
nB mA
单位:mol·kg-1
【例3-1】 在常温下取NaCl饱和溶液10.00cm3,测得 其质量为12.003g,将溶液蒸干,得NaCl固体3.173g 。求:(1)NaCl饱和溶液的质量分数,(2)饱和 溶液中NaCl和H2O的物质的量分数,(3)物质的量 浓度,(4)质量摩尔浓度。
物理化学(3)

X 即:X B n B T , p ,nCB
系统中B物质的偏摩尔量
偏摩尔量是:在恒T、p条件下,保持除B组元外 的其他组元量不变,向溶液中加入dnB的B 组元 引起溶液容量性质X(如 S,U,H,A,G,V等)的变化
等温等压下: dX X B dnB
* A
pB p xB
* B
二、 Henry定律 对挥发性溶质(气体):
pB k x ,B xB
k x ,B —— Henry常数,与pB有相同的量纲。
浓度的表示形式有多种, 但Henry定律形式一定。
即,溶液中B组元在与溶液平衡的蒸气中的分压 pB与其在溶液中的浓度成正比:
pB k x ,B xB km,BmB kc ,BcB kw,B wB
fB 则: B (T ) RT ln p
B
fB ——逸度,相对于理想气体的校正压强; 集中了各种压强因素(理想、非理想),
§5. 稀溶液的两个经验定律一、Leabharlann aoult定律 大量实验发现
加入溶质
导致
溶剂蒸气压↓
且蒸气压降低量只与溶质的量有关,而与溶质
的种类无关。如,同浓度的蔗糖水溶液和尿素
三、化学势与温度、压强的关系 1.化学势与温度的关系 G B GB , ( ) p S T B GB S ( )p ( ) p S B ( )T , p ,nCB T T nB 2.化学势与压强的关系 G B GB , ( )T V p
V溶液
20 40 60 80
cm3 100.4 100.4 100.4 100.4
cm3 31.68 84.47 190.05 506.80
《物理化学第4版》第四章4-6 真实液态混合物和真实溶液ppt课件

微观上 分子作用力相同 分子结构相似
分 子 大 小 几乎相 同 热力学上 各组分在全部浓度 范围内都遵守Rault定律
真实液态混合物
有体积 效 应 有热效 应 分 子作用力不同 分子结构不同
分子大小差别较大 各组分 都
不 遵 守 Rault 定 律
2
正偏差与负偏差 *真实液态混合物的任意组分均不遵守 拉乌尔定律; *真实溶液的溶剂不遵守拉乌尔定律, 溶质不遵守亨利定律
10
比较
理想液态混合物
pB pB* xB
真实液态混合物
pB pB* fB,x xB pB* aB,x
11
二、真实溶液中溶剂和溶质的化学势
1、溶剂 A 的活度aA和渗透因子A及化学势
aA
def
exp
A
RT
A
A def (A A ) / RTMA bB
B
并且
lim bB 0
9
解:乙醇在平衡气相的实际分压可按分压定律 计算
p1 = py1=28.89kPa0.742=21.44kPa a B,x = p1 / pB* = 21.44kPa /29.45kPa
= 0.726 f B,x = a B,x / xB = 0.726 / 0.8817 = 0.823
**由计算结果可以看出,该系统中乙 醇对拉乌尔定律产生 负偏差.
4
真实液态混合物中任意组分B的
活度aB与活度因子fB,x
aB,
x
def
exp
B
(l)
B,x
RT
(l)
且
fB, x
def
aB, x xB
lim
xB 1
fB
xliBm1(aB, x
分 子 大 小 几乎相 同 热力学上 各组分在全部浓度 范围内都遵守Rault定律
真实液态混合物
有体积 效 应 有热效 应 分 子作用力不同 分子结构不同
分子大小差别较大 各组分 都
不 遵 守 Rault 定 律
2
正偏差与负偏差 *真实液态混合物的任意组分均不遵守 拉乌尔定律; *真实溶液的溶剂不遵守拉乌尔定律, 溶质不遵守亨利定律
10
比较
理想液态混合物
pB pB* xB
真实液态混合物
pB pB* fB,x xB pB* aB,x
11
二、真实溶液中溶剂和溶质的化学势
1、溶剂 A 的活度aA和渗透因子A及化学势
aA
def
exp
A
RT
A
A def (A A ) / RTMA bB
B
并且
lim bB 0
9
解:乙醇在平衡气相的实际分压可按分压定律 计算
p1 = py1=28.89kPa0.742=21.44kPa a B,x = p1 / pB* = 21.44kPa /29.45kPa
= 0.726 f B,x = a B,x / xB = 0.726 / 0.8817 = 0.823
**由计算结果可以看出,该系统中乙 醇对拉乌尔定律产生 负偏差.
4
真实液态混合物中任意组分B的
活度aB与活度因子fB,x
aB,
x
def
exp
B
(l)
B,x
RT
(l)
且
fB, x
def
aB, x xB
lim
xB 1
fB
xliBm1(aB, x
理想混合物(理想溶液)和理想稀溶液PPT课件

91.3k Pa (1- 0.0120) KHx,B 0.0120
KHx,B 927k Pa
例2 97.11℃时,wB=0.0300的乙醇水溶液的蒸气总 压 为 101.325kPa , 纯 水 的 pA*=91.3kPa 。 设 可 看 作理想稀溶液,试求:xB=0.0200 时的蒸气总压 和气相组成。
20℃ 时 它 们 的 饱 和 蒸 气 压 分 别 为 9.96kPa 和
2.97kPa。试计算:(1) xA=0.200 时,混合物中苯 和 甲 苯 的 分 压 和 蒸 气 总 压 ; (2) 当 蒸 气 的
yA=0.200时,液相的xA和蒸气总压。
(2)
yA
pA p
pA* xA pA* xA pB* xB
MA 18.02103 kg mol 1 , MB 46.07 103 kg mol 1
解:先求乙醇的亨利系数
xB wB
wB MB MB wA
0.0300 46.07
0.0120
MA 0.0300 46.07 0.9700 18.02
p 101.325k Pa pA pB pA* xA KHx,B xB
K Hx,B
pB xB
101.325 0.0425
2384 kPa
p pA xA KHx,B xB pA (1 xB ) KHx,B xB pA (KHx,B pA )xB
xB
p pA KHx,B pA
101.325 10.01 2384 10.01
0.0385
mB
xB xA
二元系A—B
pA pA xA
pB K Hx,B xB K Hb,BbB K Hc,BcB
p总 pA pB pA xA KHx,B xB
物理化学第四章 溶液

上一内容 下一内容 回主目录
返回
2012-3-17
二、亨利定律
稀溶液上挥发性溶质的分压与溶质的摩尔分数成正 比。但比例常数不为pB*(1803年,Henry): pB=kx,B xB 换算浓度可有:pB=kc,B cB /c (c =1mol/L); pB=kb,B bB/b (b =1mol/kg); pB=k%,B[%B] 等。 k称为亨利系数,其值与T、p、溶剂、溶质以及溶液 组成的表示方法有关。 使用亨利定律要求溶质在气、液两相中的存在形态 相同。如水中NH3、HCl不能用,CO2只可近似应用。
∂∆ G ∆ mix S = − mix = − R ∑ nB ln xB ∂T p B
B
∂∆ mix G = 0 ∆ mixV = ∂p T
上一内容 下一内容 回主目录
∆ mix H = ∆ mix G + T ∆ mix S = 0
返回
2012-3-17
上一内容 下一内容 回主目录
返回
2012-3-17
三、偏摩尔量的的几个重要公式
1、集合公式 、 定T定p定组成条件下:
dZ = ∑ Z BdnB
nk
在保持偏摩尔量不变的情况下,对上式积分
Z = Z1 ∫ dn1 + Z 2 ∫ dn2 + ⋅ ⋅ ⋅ + Z k ∫ dnk
0 0 0 n1 n2
= n1 Z1 + n2 Z 2 + ⋅ ⋅ ⋅ + nk Z k
上一内容 下一内容 回主目录
返回
2012-3-17
三、拉乌尔定律与亨利定律的应用
1、用拉乌尔定律测定非挥发性溶质的摩尔质量M 、用拉乌尔定律测定非挥发性溶质的摩尔质量
返回
2012-3-17
二、亨利定律
稀溶液上挥发性溶质的分压与溶质的摩尔分数成正 比。但比例常数不为pB*(1803年,Henry): pB=kx,B xB 换算浓度可有:pB=kc,B cB /c (c =1mol/L); pB=kb,B bB/b (b =1mol/kg); pB=k%,B[%B] 等。 k称为亨利系数,其值与T、p、溶剂、溶质以及溶液 组成的表示方法有关。 使用亨利定律要求溶质在气、液两相中的存在形态 相同。如水中NH3、HCl不能用,CO2只可近似应用。
∂∆ G ∆ mix S = − mix = − R ∑ nB ln xB ∂T p B
B
∂∆ mix G = 0 ∆ mixV = ∂p T
上一内容 下一内容 回主目录
∆ mix H = ∆ mix G + T ∆ mix S = 0
返回
2012-3-17
上一内容 下一内容 回主目录
返回
2012-3-17
三、偏摩尔量的的几个重要公式
1、集合公式 、 定T定p定组成条件下:
dZ = ∑ Z BdnB
nk
在保持偏摩尔量不变的情况下,对上式积分
Z = Z1 ∫ dn1 + Z 2 ∫ dn2 + ⋅ ⋅ ⋅ + Z k ∫ dnk
0 0 0 n1 n2
= n1 Z1 + n2 Z 2 + ⋅ ⋅ ⋅ + nk Z k
上一内容 下一内容 回主目录
返回
2012-3-17
三、拉乌尔定律与亨利定律的应用
1、用拉乌尔定律测定非挥发性溶质的摩尔质量M 、用拉乌尔定律测定非挥发性溶质的摩尔质量
4-3多组分系统热力学-理想液态混合物与理想稀溶液

物理化学
Physical Chemistry
物理化学(上册)
绪论 第一章 气体 第二章 热力学第一定律 第三章 热力学第二定律 第四章 多组分系统热力学 第五章 化学平衡 第六章 相平衡
第四章 多组分系统热力学
§4-!本章基本要求 §4-1多组分系统热力学概念 §4-2拉乌尔定律与亨利定律 §4-3偏摩尔量 §4-4化学势 §4-5理想液态混合物 §4-6理想稀溶液 §4-7活度活度系数 §4-8化学势小节 §4-$小结与学习指导
d* S*dT V *dp
B
B
B
mixG p
T
B
nBVB
B
nBVB* mixV
2. mixV 0 或 V mix m 0
mix p
G
T
(RT
nB ln xB )
B
p
T
0
§4-5理想液态混合物
四、理想液态混合物混合性质
dG B S B dT VB dp
dG * S * dT V *dp
B
B
6.
mixU mix H P mixV 0
mixU 0 或 mixU m 0
§4-5理想液态混合物
四、理想液态混合物混合性质
小结: 1. mixV=0 , mixU=0 , mixH=0 2. Q=0, W=0 3. mixS=-RnBlnB>0 (绝热 S>0)
mixA=RTnBlnB<0 (恒温恒容W =0 A<0) mixG=RTnBlnB<0 (恒温恒压W =0 G<0)
§4-6理想稀溶液
一、理想稀溶液定义 无限稀溶液,溶质的浓度趋于零的溶液。 对溶剂(A表示)用符合拉乌尔定律
Physical Chemistry
物理化学(上册)
绪论 第一章 气体 第二章 热力学第一定律 第三章 热力学第二定律 第四章 多组分系统热力学 第五章 化学平衡 第六章 相平衡
第四章 多组分系统热力学
§4-!本章基本要求 §4-1多组分系统热力学概念 §4-2拉乌尔定律与亨利定律 §4-3偏摩尔量 §4-4化学势 §4-5理想液态混合物 §4-6理想稀溶液 §4-7活度活度系数 §4-8化学势小节 §4-$小结与学习指导
d* S*dT V *dp
B
B
B
mixG p
T
B
nBVB
B
nBVB* mixV
2. mixV 0 或 V mix m 0
mix p
G
T
(RT
nB ln xB )
B
p
T
0
§4-5理想液态混合物
四、理想液态混合物混合性质
dG B S B dT VB dp
dG * S * dT V *dp
B
B
6.
mixU mix H P mixV 0
mixU 0 或 mixU m 0
§4-5理想液态混合物
四、理想液态混合物混合性质
小结: 1. mixV=0 , mixU=0 , mixH=0 2. Q=0, W=0 3. mixS=-RnBlnB>0 (绝热 S>0)
mixA=RTnBlnB<0 (恒温恒容W =0 A<0) mixG=RTnBlnB<0 (恒温恒压W =0 G<0)
§4-6理想稀溶液
一、理想稀溶液定义 无限稀溶液,溶质的浓度趋于零的溶液。 对溶剂(A表示)用符合拉乌尔定律
中国石油大学华东物理化学课件溶液4-5

二、理想液态混合物中各组分的化学势 设 (A+B) 理 想 液 态 混 合 物 , 一 定 温 度 、 压 力
下达到气液平衡时:
对A组分 A (l) A (g)
ΘA (T )
RT
ln
pA pΘ
ΘA (T )
RT
ln
pA* xA pΘ
ΘA (T )
RT
ln
pA* pΘ
RT
ln
xA
A* (l) RT ln xA
RT ln xA(2) 2RT ln xB(2) 2RT ln xA(1) 2RT ln xB(1)
8.314
298(ln
1 3
2 ln
2 3
2 ln
1 2
2 ln
1 2
)J
2139.4J
∴ WR G 2139.4J
例4 20℃下,将压力为pΘ的1mol气态NH3溶解到大
量的物质的量之比为 nNH3 : nH2O 1: 21 的溶液中。
例3 在298.15K时,要从下列混合物中分出1mol纯A,试计算 Gibbs自由能的变化值及最少必须做功的值。 (1)大量的A 和B的等物质的量的混合物; (2)含A和B的物质的量各为2mol的混合物。 (p267 7题参考)
解:(1)
大量A和B混合物 T, p一定,G大量A和B混合物
nA : nB 1:1
GΘ m
NH3
Θ NH3
RT ln
pNH3 pΘ
8.314
293
.15
ln
3.6 101 .325
J
8134
J
问 题
0.5mol萘溶于1升苯中形成的溶液,与
0.25mol萘溶于0.5升苯中形成的溶液,二溶液
物理化学6-2ppt
l1+l2
C´ wB/%
l 100 B
苯 (A) - 硫 (B)系统 3) 苯 - 硫系统在 163°C 以下部分互溶,在 226°C以 上也部分互溶,但在这两个 温度之间却完全互溶。此类 系统的低会溶点位于高会溶 点的上方。 t p=const. l1+l2 C´ tC C l1+l2 l
0 A
g+l
g
l
0.0 A
xB
氯仿 - 丙酮系统的 温度 - 组成图(具有最大负偏差)
1.0 B
对恒沸混合物,下列说法错误的是 A. 不具有确定的组成 B. 平衡时气、液相组 成相同 C. 其沸点虽外压改变而改变 D. 与化合物一 样具有确定的组成
小结
(1)正偏差不是很大的体系 等温
p
pB
等温
pB*
wB/%
c
N
100 B(苯酚)
液相的相点分别沿 L1 L1´ 和 L2 L2´ 变化, 两液相的质量也不断变化,水层减少,苯 酚层逐渐增加。在 L2´ 水层状态为L1´ , 然后水层消失,只剩一个苯酚层。此为第 一种类型。
当系统由a 升温到L2´时,两个共轭
t
p=const. e b C L’ L11´ L2 ’ l ´
0 A
xB
p/kPa
1 B
氯仿
乙醚
t=25°C 蒸气总压对理想情况为正偏 差,但在某一组成范围内,混合 物的蒸气总压比易挥发组分的饱 和蒸气压还大,因而蒸气总压出 现最大值。 例子: 甲醇(A) - 氯仿(B)系统。 p/kPa 0 A 甲醇
3) 具有最大正偏差的系统:
xB
1 B 氯仿
特点: p实 > p理 在 p-x 图上有最高点,即p实 >pB*>pA* ,
理想液态混合物 与理想溶液的区别

●如果两种纯液体组分能按任意的比例相互混溶,那么就会形成理想液态混合
物。
在一定的温度和压力下,液态混合物中任意一种物质在任意浓度下均遵守拉乌尔定律的液态混合物称理想液态混合物。
●溶液中的任一组分在全部浓度范围内都符合拉乌尔定律的溶液称为理想溶
液。
二者的区别:
①理想液态混合物是混合物,至少有两个相态存在.理想溶液是溶液只有一个相态存在.
②在一定的温度和压力下,理想液态混合物满足其中任意一种物质在任意浓度下均遵守拉乌尔定律
③理想溶液中,当各组分混合成溶液时,没有热效应和体积的变化。
④除了光学异构体的混合物、同位素化合物的混合物、立体异构体的混合物以及紧邻同系物的混合物等可以(或近似地)算作理想溶液外,一般溶液大都不具有理想溶液的性质。
⑤如果两种纯液体组分能按任意的比例相互混溶,那么就会形成理想的液态混合物。
通常,两种结构相似或极性相似的化合物可以按任意比例混合,并形成接近理想的液态混合物,如苯和甲苯、水和重水等。
《物理化学第4版》第四章4-1 多组分系统组成表示法ppt课件

第四章 液态混合物和溶液
1. 混合物及溶液的分类
多组分系统
非均相(多相) 均相(单相)
混合物 溶液
1
(i) 对混合物中的各组分不区分为溶 剂及溶质,对各组分均选用同样 的标准态;
(ii) 对溶液中的各组分区分为溶剂 及溶质,并选用不同的标准态加 以研究。
2
按聚集状态不同,
气态混合物如空气;
混合物液态混合物如苯和甲苯;
固态混合物如粘土和沙石。 液态溶液如Mn Fe液态合金;
溶液 固态溶液(固溶体黄铜 青铜等);
3
液态溶液— 简称溶液电非解电质解溶质液溶如 液食 (盐 分水 子溶 溶液液; 如高分子溶液)
非电解质溶液:蔗糖水溶液; 氧O2溶于水; 乙醇水溶液 H2O(l)—— C6H5NH3(l)溶液;
金属溶液: Fe(l)—— Mn(l)溶液; Cu(l)——Zn(l)溶液。
MA
bB
MA
17
def cB nB /V
SI单位:moldm-3
8
五、溶质B的质量摩尔浓度 溶质B的物质的量与溶剂的质量之比。
bB 或mB def nB / mA
用于液态或固态溶液的溶质,也可 以用下式定义:
bB 或mB def nB /(nAM A )
SI 单位:molkg-1 9
由于溶质B的质量摩尔浓度与温度无 关,在热力学处理中比较方便。在电 化学中也主要采用该浓度表示电解质 的浓度。
12
x1 = n1 / (n1 + n2 )= 0.321 mol / (0.321 mol+0.652 mol) = 0.329 b1= n1 /m2 = 0.321 mol / 30.0 10-3 kg = 10.7 molkg-1 w1 = m1 / ( m1+ m2 ) = 25.0 g / (25.0+30.0) g = 0.455
1. 混合物及溶液的分类
多组分系统
非均相(多相) 均相(单相)
混合物 溶液
1
(i) 对混合物中的各组分不区分为溶 剂及溶质,对各组分均选用同样 的标准态;
(ii) 对溶液中的各组分区分为溶剂 及溶质,并选用不同的标准态加 以研究。
2
按聚集状态不同,
气态混合物如空气;
混合物液态混合物如苯和甲苯;
固态混合物如粘土和沙石。 液态溶液如Mn Fe液态合金;
溶液 固态溶液(固溶体黄铜 青铜等);
3
液态溶液— 简称溶液电非解电质解溶质液溶如 液食 (盐 分水 子溶 溶液液; 如高分子溶液)
非电解质溶液:蔗糖水溶液; 氧O2溶于水; 乙醇水溶液 H2O(l)—— C6H5NH3(l)溶液;
金属溶液: Fe(l)—— Mn(l)溶液; Cu(l)——Zn(l)溶液。
MA
bB
MA
17
def cB nB /V
SI单位:moldm-3
8
五、溶质B的质量摩尔浓度 溶质B的物质的量与溶剂的质量之比。
bB 或mB def nB / mA
用于液态或固态溶液的溶质,也可 以用下式定义:
bB 或mB def nB /(nAM A )
SI 单位:molkg-1 9
由于溶质B的质量摩尔浓度与温度无 关,在热力学处理中比较方便。在电 化学中也主要采用该浓度表示电解质 的浓度。
12
x1 = n1 / (n1 + n2 )= 0.321 mol / (0.321 mol+0.652 mol) = 0.329 b1= n1 /m2 = 0.321 mol / 30.0 10-3 kg = 10.7 molkg-1 w1 = m1 / ( m1+ m2 ) = 25.0 g / (25.0+30.0) g = 0.455
溶液ppt课件
旳化学势,它不是原则态。
上一内容 下一内容 回主目录
2024/9/28
溶质旳化学势
Henry定律因浓度表达措施不同,有如下三种形式:
pB kx xB kmmB kccB
(1)B (T , P) B (T ) RT ln(PB / P )
B (T ) RT ln(Kx / P ) RT ln xB
2024/9/28
溶质旳化学势
上一内容 下一内容 回主目录
2024/9/28
4.7 稀溶液旳依数性
依数性质:(colligative properties)当把一种不挥发
性物质溶于某一溶剂,构成稀溶液时,该溶液旳某些 性质只与溶质旳质点数(即多少)有关,而与溶质本 身旳性质无关,我们把稀溶液旳此种特征称为“依数 性”。 依数性旳种类:
2024/9/28
4.2 溶液构成旳表达法
4.质量分数wB(mass fraction)
wB
WB W (总)
溶质B旳质量与溶液总质量之比称为溶 质B旳质量分数。为无量纲量。
上一内容 下一内容 回主目录
2024/9/28
4.3 稀溶液中旳两个经验定律
拉乌尔定律(Raoult’s Law)
1887年,法国化学家拉乌尔在屡次试验旳基础上总
p)
(T
,
p
)
RTIn
P P
纯物质旳摩尔吉布斯自由能等于化学势
(T ,
P)
(T ,
P
)
RT
ln
P P
上一内容 下一内容 回主目录
2024/9/28
理想气体旳化学势
(T ,
P)
(T ,
P
)
RT
物理化学 第四章 第三节 完全互溶双液体系

若将P=P*A+(P*B-P*A) xB 代入PyB=P*BxB 可得
Px yB * PA ( P P ) xB
理想溶液的 p-x-y 图
* B B * * B A
(xA= 1-xB) (yA =1-yB)
据此可以分别求得气相和液相的组成。
如果要全面描述溶液蒸气压与气、液两相 平衡组成的关系,可根据在P-x图上画出液相线, 然后从液相线上取不同的xB值代入上式求出相应 的气相组成yB值,把它们连接起来即构成气相线。 气相线总是在液相线的下面(见图)
四、蒸馏、分馏与精馏
x t
8
y8 x7 x6 x5
y7 y6
y5 x4
x3 x2 x1 y4 y3 y2
x0
y1 y0
B
A
x xB
根据上面讨论,对于完全互溶的二组分液液体系,把气相不断地部分冷凝,或将液相不 断地部分气化,都能在气相中浓集易挥发组 分,在液相中浓集难挥发组分。这样进行一连 串的部分气化和冷凝,可将混合液A、B完全 分离,这就是精馏原理。 工业上和实验室中这种部分气化和冷凝是在 精馏塔和精馏柱中进行的。精馏实际上是简单 蒸馏的多次组合。所以塔板数越多,蒸馏的次 数亦越多,分离的效果亦就越好(见下图所示)。
塔板上气-液两项重新分配
精馏塔中,塔顶得低沸点物, 塔底得高沸点物。
四、蒸馏、分馏与精馏
如果溶液介于A和C之 间,假定为x1,则经 精馏后,从塔顶蒸出 组成 的是具有最低恒沸 x1 x2 B A C 点的恒沸物C,流入 塔釜的是沸点高的纯组分A。如果溶液组成介于C和B之间, 设为x2 ,则经分离后得到的馏出液为C与残液为纯B。
四、蒸馏、分馏与精馏
进料
加 热 棒 精馏塔示意图
物理化学(第五版) 演示文稿4-5 理想液态混合物和溶液的相平衡

解: 以100g混合物为计算基准
mFe
xFe
M Fe
mFe M Fe
mMn M Mn
99.00 / 55.85 99.00 1.00 55.85 54.93
0.9898
x(Fe)=0.9898; x(Mn)=0.0102 p(Fe)=p*Fe x(Fe)=133.3Pa 0.99=132Pa p(Mn)=p*Mn x(Mn)=101325Pa0.0102=1033Pa p = p(Fe) + p(Mn)=1165Pa y(Fe)=p(Fe)/p=132Pa/1165Pa=0.113 y(Mn) =1-0.113 = 0.887
T
b
T
b
T
b
T
b
当溶液很稀时, -lnxA= -ln(1-xB) xB ,
而且当 Tb与Tb* 相差不大时, TbTb* Tb* 2
又令 Tb = Tb – Tb* , 则:
xB
vap H m ,A R(Tb* )2
Tb
对于稀溶液:
xB = nB / nA= nBMA / mA = bBMA
RT ln
pA* p
A
A (g) A
RT ln
pA p
* A
A
半透膜
pA* pA
* A
A
称为渗透压,阻止水分子渗透必须外加的最小压力。
若外加压力大于渗透压,水分子向纯水方渗透,
称为反渗透,可用于海水淡化、污水处理等。
Π cBRT —范特荷夫公式
(仅适用于稀溶液)
诺贝尔化学奖
首位得主
van't Hoff (1852-1911) , 荷兰
A(g, T, p)
第四章 液态混合物和溶液

上一内容 下一内容 回主目录
返回
2013-6-28
§4.2 拉乌尔定律和亨利定律
一、液态混合物和溶液的气、液平衡
气态混合物的总压力为
p pA pB pC pB
B
yA, yB, yC pA,pB,pC A,B,C…… xA ,xB , xC
T一定 平衡
§4.4 理想液态混合物和理想稀溶液的化学势 例:
已知AgCl、PbCl2在800℃时可做为理想液态混合物, 求300g PbCl2和150g AgCl混合成混合物时的熵变 和吉布斯函数的变化。 已知:M(PbCl2) = 228 gmol-1 M(AgCl) = 143.5 gmol-1
上一内容
B B,[%] RT ln[%B]
在p下, [%B]=1 且仍遵守亨利定律时, 纯溶质B的化学势
上一内容
下一内容
回主目录
返回
2013-6-28
§4.5 真实液态混合物和真实溶液的化学势
一、真实液态混合物 1、定义 混合物中任意组分B均不遵守拉乌尔定律 2、活度与活度因子
aB
上一内容
下一内容
回主目录
返回
2013-6-28
§4.2 拉乌尔定律和亨利定律
例3:
0℃,p (O2)= 101325Pa 时,1000g水中至多可溶 解氧气48.8 cm3 求:(1)0℃,外压为101325Pa时,氧气溶于水的 亨利系数 (2) 0℃,每1000g置于101325Pa的空气中的水 最多可溶解多少克氧气 (氧气可看成理想气体)
def
f B xB
组分B的活度因子
任意组分B的活度
上一内容 下一内容 回主目录
返回
返回
2013-6-28
§4.2 拉乌尔定律和亨利定律
一、液态混合物和溶液的气、液平衡
气态混合物的总压力为
p pA pB pC pB
B
yA, yB, yC pA,pB,pC A,B,C…… xA ,xB , xC
T一定 平衡
§4.4 理想液态混合物和理想稀溶液的化学势 例:
已知AgCl、PbCl2在800℃时可做为理想液态混合物, 求300g PbCl2和150g AgCl混合成混合物时的熵变 和吉布斯函数的变化。 已知:M(PbCl2) = 228 gmol-1 M(AgCl) = 143.5 gmol-1
上一内容
B B,[%] RT ln[%B]
在p下, [%B]=1 且仍遵守亨利定律时, 纯溶质B的化学势
上一内容
下一内容
回主目录
返回
2013-6-28
§4.5 真实液态混合物和真实溶液的化学势
一、真实液态混合物 1、定义 混合物中任意组分B均不遵守拉乌尔定律 2、活度与活度因子
aB
上一内容
下一内容
回主目录
返回
2013-6-28
§4.2 拉乌尔定律和亨利定律
例3:
0℃,p (O2)= 101325Pa 时,1000g水中至多可溶 解氧气48.8 cm3 求:(1)0℃,外压为101325Pa时,氧气溶于水的 亨利系数 (2) 0℃,每1000g置于101325Pa的空气中的水 最多可溶解多少克氧气 (氧气可看成理想气体)
def
f B xB
组分B的活度因子
任意组分B的活度
上一内容 下一内容 回主目录
返回
物理化学课件二组分体系相图

假定 H vap m的值与温度无关,积分得:
lnp2 vapHm(11)
p1
R T1 T2
这公式可用来计算不同温度下的蒸气压或摩尔蒸发热。
6.2.2 Clapeyron方程
三条两相平衡线的斜率均可由Clausius-Clapeyron 方程或Clapeyron方程求得。
f * * = ( 3 - 1 ) - 1 + 0 = 1 ( X B )
d ) T = 4 5 0 ℃ , P = 1 5 0 P θ , 有 催 化 剂 , 发 生 反 应
投 料 比 : N 2 ∶ H 2 = 1 ∶ 3 R ’ = 1 f * * = ( 3 - 1 - 1 ) - 1 + 0 = 0
注意:
a ) 独 立 的 浓 度 限 制 条 件 ( 初 始 条 件 或 分 解 )
说明:不同物质在同一相中的浓度限制条件 R’=0 C a C O 3 ( s ) → C a O ( s ) + C O 2 ( g )
b ) 独 立 的 化 学 反 应 数 “ R ” 表 示
化 学 平 衡 时 , 平 衡 常 数 限 制 浓 度
d dT PV Sii,,m m
Si,m Vi ,m
Si,m Vi,m
相变摩尔熵 相变摩尔体积
Si,m
Hi,m T
得:
dP H i,m
Clapeyron equation 适用于纯物质两相
dT
TVi , m
平衡
6.2.2 Clapeyron方程
在一定温度和压力下,任何纯物质达到两相平 衡时,蒸气压随温度的变化率可用下式表示:
§ 6.1.1 基本概念
相(phase) 体系内部物理和化学性质完全均
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PA=PA*(1-xB)
PA*- PA=ΔPA= PA*xB
(4-2)
溶剂的蒸汽压下降与溶质的摩尔分数成比例。
2.若溶质不止一种,则
pA p*A xB B 学习交流PPT
(4-3)
9
二、亨利定律-溶质的气液平衡规律
❖ 在一定温度和平衡状态下,气体在液体里的溶解度与 该气体的平衡分压pB成正比。用公式表示为:
若溶质为非挥发性的,则溶液足够稀时有:
xB
nB nA
mB mA
/MB /MB
代入式(4-2) PA*- PA=ΔPA= PA*xB
得 MB=PA*MAmB/(PA*-PA)mA (4-7)
式中MA和mA分别为溶剂的摩尔质量和质量,mB 为溶质的质量。
学习交流PPT
11
例4-2 将1.52g非挥发性溶质溶于100g 苯中, 20℃时测 得溶液的蒸气压为9835Pa, 20℃时纯苯的蒸气压 PA*=9954Pa,求溶质的MB.
如果组成溶液的物质有不同的状态,通常将液态 物质称为溶剂,气态或固态物质称为溶质。
如果都是液态,则把含量多的一种称为溶剂,含 量少的称为溶质。
以物态分
气态溶液(如空气)、 固态溶液(如金属固熔体) 液态溶液。
以溶质的导电性分 电解质溶液 非电解质溶液。
学习交流PPT
2
混合物(mixture)
多组分均匀体系中,溶剂和溶质不加区分,各组 分均可选用相同的标准态,使用相同的经验定律, (一视同仁)这种体系称为混合物,也可分为气态 混合物(如空气)、液态混合物(如石油)和固态 混合物(如合金)。
bB(或mB)
nB mA
单位:mol·kg-3
37 B的摩尔比:
rB
nB nA
学习交流PPT
6
§4.2 拉乌尔定律和享利定律
一:拉乌尔定律-溶剂的气液平衡规律
在一定的温度下 PA< PA*
A(g) PA*
A(L)
PA A+B
❖ 在一定温度下,稀溶液中溶剂的蒸汽压PA等于纯溶剂 的 蒸 汽 压 PA* 与 其 溶 液 中 纯 溶 剂 的 摩 尔 分 数 xA 的 乘 积 用数学式可表示为:
学习交流PPT
3
§4.1 液态混合物及溶液组成的表示方法
在液态的非电解质溶液中,对于混合物中任一 组分B的浓度表示法主要有如下七种:
•质量浓度 •质量分数 •物质的量浓度 •摩尔分数 •体积分数 •质量摩尔浓度 •摩尔比
学习交流PPT
4
31
B的质量浓度:
B
mB V m ix
单位:kg·m-3
2
B的质量分数:
学习交流PPT
13
(2)0℃,101325Pa的空气中, 1000g水中最多 可溶解多少克O2(g)。
解 (2) :PB'=PyB'=101325Pa×0.21=21278Pa xB'=PB'/Kx,B=21278Pa/(2.58×109Pa)=8.24×10-6
xB'=nB'/nA=(mB'/MB)/(mA/MA)
pB kx,BxB pB kb,BbB pB k,BB
kx,B( kb,B、 kw,B)—亨利系数,kx,B kb,B kw,B 一定温度压力下与溶剂、溶质及组成表示的选择有关。
亨利定律的使用,要求B组分在气、液两相有相同
的存在形态(无解离、无聚合)。
学习交流PPT
10
三、拉乌尔定律与亨利定律的应用 测定非挥发性溶质的摩尔质量M
p总 = p苯 + pHCl 溶质服从Henry定律:pHCl=kxxHCl
溶剂服从Raoult定律: p苯=p*苯 (1-xHCl)
解得:xHCl= 0.0385
学习交流PPT
所以 mB'=mAxB'MB/MA =1000g×8.24×10-6 ×32.0g.mol-1/(18.0g.mol-1) =0.015g
学习交流PPT
14
计算挥发性溶质在平衡气相的组成:例4 -5
四、拉乌尔定律与亨利定律的比较 适用对象不同;
比例系数不同;
组成选择不同。
学习交流PPT
15
例、20℃下HCl(B)溶于苯(A)达平衡。当气相中HCl分 压为101.325kPa时,溶液中HCl的摩尔分数为0.0425。 已知20℃ 苯的饱和蒸汽压为10.011kPa。求20℃ 时 HCl与苯蒸气的总压为101.325kPa时,苯中溶解HCl 的摩尔分数。 解:
第四章 液态混合物和溶液
溶液(solution)(混合物)
广义地说,两种或两种以上物质彼此以分子或离子 状态均匀混合所形成的体系称为溶液(混合物) 。
溶液和混合物的区别:
溶液有溶剂和溶质之分而混合物没有;对溶液中 的溶剂和溶质采用不同的研究方法,而对混合物 则采用同一的研究方法。
学习交流PPT
1
溶剂(solvent)和溶质(solute)
❖
PA= PA* xA (4-1)
学习交流PPT
7
注意:
1、拉乌尔定律适用于稀溶液中溶剂;对于溶质 浓度趋于零的无限稀溶液拉乌尔定律严格适用.
2、计算XA所依据的液相溶剂分子必须与平衡气 相中的溶剂分子有相同分子结构
学习交流PPT
8
其它形式的拉乌尔定律:
1.对于由A和B组成的双组分系统,xA=1-xB,
解:MA=78.0g.mol-1, mB=1.52g,mA=100g, pA=9825Pa 代入(4-7)式得:
MB= PA*MAmB/(PA*-PA)mA =99.2×10-3Kg.mol-1
学习交流PPT
12
利用亨利定律求难溶气体的溶解度
例4-3. 0℃,P(O2)=101325Pa,1000g水中至多可溶 解氧气48.8cm3,求(1)0℃外压力为101325Pa时
O2(g)溶于H2O的B /n A 4 8 .8 1 1 0 0 0 3 0 d g m / 3 1 / 8 2 g 2 ..m 4 d o m l 3 1 .m o l 1 3 .9 2 1 0 5
Kx,B=PB/xB=101325Pa/(3.92×10-5)=2.58×109Pa
B
mB mB
B的百倍质量分数: [% B]100B10m m 0BB
3
B的物质的量浓度:
cB
nB V m ix
单位:mol·m-3
学习交流PPT
5
4
B的摩尔分数:x B
nB nB
xB多用于液相组成, yB多用于气相组成
35 B的体积分数:
BxBVm *,B/ xAVm *,A
A
6
B的质量摩尔浓度:
