综述低磷血症对机体的影响
钙磷代谢紊乱(低钙血症、高钙血症、低磷血症、高磷血症)
钙磷代谢紊乱
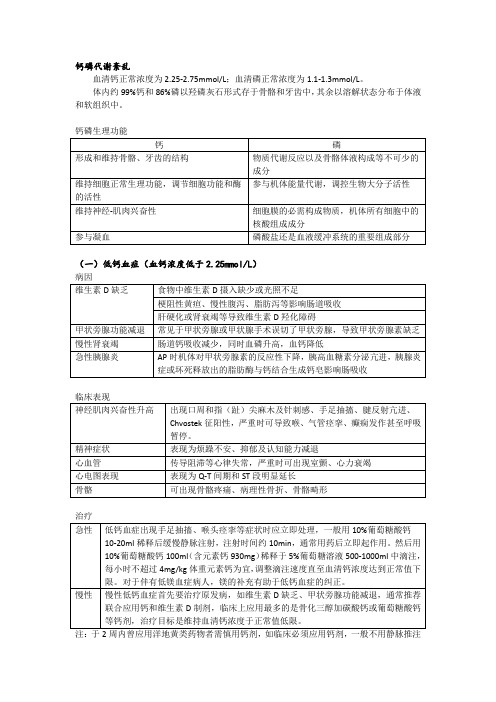
血清钙正常浓度为2.25-2.75mmol/L;血清磷正常浓度为1.1-1.3mmol/L。
体内约99%钙和86%磷以羟磷灰石形式存于骨骼和牙齿中,其余以溶解状态分布于体液和软组织中。
钙磷生理功能
(一)低钙血症(血钙浓度低于2.25mmol/L)
病因
治疗
注:于2周内曾应用洋地黄类药物者需慎用钙剂,如临床必须应用钙剂,一般不用静脉推注
而采用滴注,且应进行心脏监护。
(二)高钙血症血钙浓度大于2.75mmol/L
病因
临床表现
治疗
病因治疗:甲状旁腺功能亢进者手术切除腺瘤或增生的腺组织科彻底治愈。
降低血钙治疗
(三)低磷血症血清无机磷小于0.8mmol/L
治疗
和低镁血症以及水、酸碱代谢紊乱,维护心、肺等重要脏器功能。
(四)高磷血症(血清无机磷>1.6mmol/L)
临床表现
无特殊临床表现。
急性高磷血症可增加钙磷沉积风险,从而导致软组织及肾脏钙化,引起肾衰竭。
常继发性低钙血症。
病人可因低钙引起抽搐、心律失常、低血压等症状。
治疗
原发病防治无症状或肾功能正常的高磷血症无需特殊治疗,过量的磷可以通过肾排出。
低磷血症的症状

低磷血症是指体内磷酸盐浓度降低,因此引起一系列的临床症状。
磷酸盐是人体内重要的无机盐之一,在生命活动中具有重要的生物学作用。
本文将介绍低磷血症的病因、症状、诊断及治疗等相关内容。
病因营养不良:磷是人体必需的微量元素,如长期营养不良或长期摄入含磷量极低的食物,会导致体内磷酸盐不足,从而引起低磷血症。
药物使用:一些药物如肾上腺皮质激素、营养剂等,也可能引起低磷血症。
过度利尿:由于利尿药的使用、肾上腺醇增多症等原因,导致肾小管对磷的重吸收下降,使磷酸盐丢失过多,从而产生低磷血症。
代谢性疾病:如甲状腺功能亢进、糖尿病酮症酸中毒等,也可能引起低磷血症。
症状低磷血症的症状取决于磷酸盐浓度的下降程度和发展速度。
常见的症状包括:肌无力:低磷血症引起骨骼肌磷酸盐不足,导致肌无力、疲劳、腱反射减弱或消失等。
骨骼症状:低磷血症会干扰骨骼的代谢过程,导致骨质疏松、骨折等。
精神异常:低磷血症可以引起神经症状,包括头晕、脑震荡、昏迷等症状。
呼吸系统症状:低磷血症也会引起呼吸系统异常,包括呼吸急促、低氧血症和呼吸抑制等。
心血管症状:低磷血症可以引起心动过缓、心脏杂音等症状。
诊断血磷水平:低磷血症的诊断首先要基于血浆磷酸盐水平的检测。
一般人体血清磷酸盐浓度低于2.5mg/dL可以判断为低磷血症。
电解质测定:电解质测定也是确定低磷血症的必要指标。
低磷血症患者常常同时存在低血钙和低血镁等电解质异常。
心肌酶测定:低磷血症可以引起心肌病变和心肌酶浓度升高,因此可以通过心肌酶测定来诊断低磷血症。
治疗环境改变:低磷血症患者需要根据具体原因进行住院或在环境中改变某些方面,比如过度利尿或饮食不当等患病原因,以便恢复平衡。
增加磷酸盐的摄入:通过食物或药品等方式摄入磷酸盐以增加体内磷酸盐水平,帮助患者恢复健康。
补充血清:补充血清用于恢复血液磷酸盐水平,如注射慢性磷酸盐,可以增加磷酸盐水平。
预防低磷血症通常可以通过良好的饮食和生活方式来预防。
饮食管理:选择含磷高的食物,例如鱼、肉、奶制品等,确保摄入足够的磷酸盐。
(整理)低磷血症

(整理)低磷血症引言低磷血症是一种体内磷含量低于正常范围的疾病,可以由多种原因引起。
本文将对低磷血症的定义、病因、症状和治疗方法进行整理和介绍。
定义低磷血症是指血浆总磷浓度低于正常范围的情况。
根据磷浓度的具体数值,可以分为轻度、中度和重度低磷血症。
病因低磷血症的病因非常多样,主要包括以下几种情况:1. 营养不良:体内摄入的磷含量不足,导致磷供给不足。
2. 肾脏功能异常:肾小管对磷的重吸收受损,导致磷排出过多。
3. 药物使用:某些药物如抗癫痫药物和退钠利尿药可以抑制肾小管对磷的重吸收。
4. 酸碱平衡失调:酸中毒时,体内磷会转移到细胞内,导致血浆磷浓度降低。
5. 代谢性疾病:某些代谢性疾病如甲状旁腺功能亢进症也可引起低磷血症。
症状低磷血症的症状主要与磷的代谢异常以及与骨骼、肌肉、神经系统等器官相关。
常见症状包括:1. 骨骼疼痛:低磷血症会导致骨骼矿物质减少,从而引起骨骼疼痛。
2. 肌无力:磷是细胞内ATP的重要组成部分,低磷血症会导致能量供应不足,引起肌无力。
3. 疲劳和乏力:能量供应不足也会导致全身疲劳和乏力。
4. 神经系统症状:低磷血症会引起神经系统症状,如注意力不集中、焦虑和抑郁等。
治疗方法针对低磷血症的治疗主要包括以下几个方面:1. 磷补充:通过口服或静脉途径补充磷以提高血浆磷浓度。
2. 饮食调整:增加富含磷的食物摄入,如鱼类、牛奶、奶制品等。
3. 基础病治疗:对于低磷血症的病因进行针对性治疗,如肾功能异常需要进行肾脏疾病的治疗。
4. 避免不当药物使用:对于可能引起低磷血症的药物,应避免或减少使用。
结论低磷血症是一种常见的代谢紊乱疾病,病因复杂多样。
了解低磷血症的定义、病因、症状和治疗方法对于准确诊断和治疗非常重要。
医生应根据患者的具体情况制定合理的治疗方案,以达到良好的疗效。
以上是关于低磷血症的整理和介绍,希望能对读者有所帮助。
小儿低磷血症的研究现状

小儿低磷血症的研究现状南阳市张仲景国医院(南阳市中医院)、南阳市中西医结合儿童医院张炜低磷血症是重要的、致死性的电解质紊乱,但不被重视,小儿低磷血症更是如此,未引起我国儿科高层的关注,可供参考的文献也极其有限。
儿童血磷的正常值、诊断标准不统一,发病率和近期预后缺乏系统的研究,缺乏官方的治疗方法,有诸多待研究的空白点。
希望本文能唤起对小儿低磷血症的关注,减少危重病人的死亡。
一、血磷正常值新生儿:《实用新生儿学》第三版记录的早产儿血磷正常值为出生时 1.81~2.58 mmol/L,6~10天1.97~3.78 mmol/L,20~25天2.13~3.04 mmol/L;足月儿:出生时1.62~2.52 mmol/L,3天1.87~2.91 mmol/L, 6~12天1.58~2.87 mmol/L,1月1.62~3.07 mmol/L;《诸福棠实用儿科学》第7版记录的新生儿血磷正常值为1.4~2.8mmol/L。
陈昌辉等在《中国实用儿科杂志》1997年第2期报告的足月儿血磷正常值为男1.82±0.53 mmol/L,女1.95±0.53 mmol/L。
三者的差距较大,尤其是早产儿血磷正常值参考价值有限。
婴儿:《诸福棠实用儿科学》第7版记录的婴儿血磷正常值为2~2.75mmol/L。
儿童:《诸福棠实用儿科学》第7版记录的儿童血磷正常值为1.5~1.78mmol/L。
成人:0.9~1.3mmol/L(《实用内科学》第13版),国外认为正常成人血清磷浓度为0. 96~1. 45mmol/L。
二、诊断标准1.早产儿:极重度<0.4mmol/L,重度<~0.6mmol/L,中度<~0.8mmol/L,轻度<~1.0mmol/L(施旭红,李小红,21例早产儿低磷血症的观察和护理,护理与康复2006年6期)。
新生儿:根据陈昌辉等的报告,<1.5mmol/L应是比较合理的。
2.儿童:<1.29 mmol/L(杜嗣廉,小儿水电解质平衡与液体疗法[M]北京:人民卫生出版社1993:134- 137),有的人认为<1.0 mmol/L,或低于<1.45mmol/L。
连续性血液净化治疗中的低磷血症

•血液净化•连续性血液净化治疗中的低磷血症史学刚综述刘健审校摘要连续性血液净化治疗(CBP)中患者常出现电解质紊乱,其中低磷血症十分常见。
机体磷水平的下降会影响呼吸、循环、神经肌肉等多个系统,引起多脏器的功能不全。
CBP中出现低磷血症可能造成呼吸衰竭、机械通气时间延长、脱机困难。
因此,在行CBP时,应评估患者营养、肾脏功能等情况,监测血磷并及时干预。
本文主要介绍行CBP中低磷血症的发生机制、可能的不良影响及干预措施。
关键词连续性血液净化低磷血症疗效Hypophosphatemia in continuous blood purificationSHI Xue g ang,LIU JianDepartment of Nephrology,The First Affiliated Hospital of Xinjiang Medical University, Xinjiang Medical University,Urumqi 830000,ChinaABSTRACT Electrolyte abnoimalities often occur in patients undergoing continuous blood purification(CBP),and hypophosphatemia is very common.CBP can cause continuous loss of serum phosphate.The decrease of phosphorus level may cause insufficiency of multiple organs,such as respiration,circulation and neuromuscular system.Hypophosphatemia during CBP may induce respiratory failure,prolonged mechanical ventilation,and difficulty in weaning.Therefore,during CBP, patients r nutrition and renal function should be evaluated,serum phosphorus should be monitored.Individualized phosphate replacement was effective and safe.Hypophosphatemia in CBP is still a neglected problem.This review mainly introduces the mechanism,possible effects and intervention measures of hypophosphatemia in CBP patients.Key words continuous blood purification hypophosphatemia efficacy连续性血液净化(continuous blood purification, CBP)技术发展迅速,其临床应用范围也逐渐扩大。
低磷性佝偻病汇报ppt课件

非药物治疗方法探讨
营养支持治疗
保证患者充足的营养摄入,特别是钙 、磷等矿物质的摄入,有助于改善病 情。
运动康复治疗
适当的运动可以促进骨骼发育和矿化 ,提高骨密度和骨强度。对于低磷性 佝偻病患者,应根据病情制定合适的 运动康复计划。
心理干预和支持
低磷性佝偻病可能对患者的心理造成 不良影响,如焦虑、抑郁等。因此, 心理干预和支持也是治疗的重要组成 部分。
遗传咨询
对于家族中有低磷性佝偻病史的患儿 ,应进行遗传咨询和基因检测,以便 早期发现和干预。
处理方法介绍和效果评价
• 药物治疗:对于严重低磷血症的患儿,可给予口服或静脉补充磷剂,同时补充 维生素D,以促进钙磷吸收和利用。在药物治疗过程中,需密切监测血磷、血 钙等指标,防止高磷血症和高钙血症的发生。
02
发病机制及生理影响
磷代谢异常机制
01
02
03
磷摄入不足
饮食中磷含量不足,导致 磷摄入不足,无法满足生 理需求。
磷吸收障碍
肠道对磷的吸收减少,如 维生素D缺乏、肠道疾病 等,导致磷吸收不良。
磷排泄增加
肾脏对磷的排泄增加,如 肾小管重吸收障碍、甲状 旁腺功能亢进等,导致磷 丢失过多。
对骨骼和牙齿的影响
家属参与心理支持
鼓励家属积极参与患者的心理支持工作,如陪伴患者、倾听患者心 声、给予关爱和鼓励等,帮助患者缓解焦虑、抑郁等负面情绪。
家属互助组织
建立家属互助组织或线上交流平台,让家属之间可以互相交流经验、 分享心得,共同为患者提供全方位的支持和帮助。
THANK YOU
骨骼畸形
低磷血症导致骨骼矿化障碍,骨基质不能正常矿化,骨骼变 软、变形,出现佝偻病表现,如颅骨软化、方颅、肋骨串珠 、鸡胸等。
血清磷的临床意义

血清磷的临床意义血清磷是人体内的重要无机元素之一,对于维护骨骼健康、细胞代谢、能量传递以及酸碱平衡等方面具有重要的作用。
正常情况下,血清磷的浓度在0.8-1.5mmol/L之间,对于维持正常生理功能至关重要。
在下面,我们将详细探讨血清磷的临床意义。
1.骨骼健康:磷是骨骼中的重要成分之一,约有85%的体内磷储存在骨骼中。
因此,血清磷水平与骨骼健康之间有着密切的关系。
低血磷症可能导致骨骼矿物质流失和骨质疏松。
高血磷症可能引发骨质疾病,例如继发性甲状旁腺功能亢进症。
2.细胞代谢:磷酸盐基团是重要的能量供应物,磷酸盐通过磷酸根的转移反应参与细胞内的能量传递、DNA和RNA的合成以及蛋白质的合成等关键过程。
因此,血清磷浓度的变化可能直接影响细胞的正常功能。
3.酸碱平衡:血液中的磷酸盐还可以作为缓冲剂,调节细胞内外的酸碱平衡。
当酸性物质增加时,细胞会释放磷酸根来中和过多的酸性物质。
因此,血清磷水平的正常维持对于维持酸碱平衡具有关键作用。
除此之外,血清磷的临床意义还表现在以下几个方面:4.肾功能监测:磷在正常情况下通过肾脏排出,所以血清磷水平的改变可以作为肾功能的指标之一、肾脏疾病,特别是肾功能不全,可以导致血清磷浓度升高,因为肾脏对磷的排泄能力下降。
反之,低血磷症也可能是肾小管重吸收功能障碍的表现。
5.代谢疾病诊断:高血磷症可以是一些代谢性疾病的表现,如甲状旁腺功能亢进症、维生素D缺乏,或者肝脏疾病等。
通过监测血清磷水平,可以辅助医生对这些代谢性疾病进行诊断和治疗。
6.营养评估:血清磷浓度可以反映人体的营养状况。
在患有长期营养不良的患者中,血清磷浓度常常降低。
因此,血清磷测定可以作为监测营养状况的指标之一7.药物治疗监控:一些药物的使用会对血清磷产生影响。
例如,一些抗癫痫药物会引起血清磷浓度的下降;一些药物如低分子量肝素和磷酸食盐肠净会导致高血磷症。
因此,在给予这些药物的患者中,定期检测血清磷浓度可以确保用药安全。
无机磷0.79

无机磷0.79含义
无机磷是人体内重要的元素之一,它对于维持人体正常的生理功能具有非常重要的作用。
然而,当无机磷的浓度低于正常范围时,可能会引起一系列的问题。
首先,无机磷0.79mmol/L偏低可能会导致身体乏力。
这是因为无机磷是构成ATP(三磷酸腺苷)的重要成分之一,而ATP则是人体能量的主要来源。
如果无机磷的浓度过低,就会导致ATP 的合成受到限制,从而影响人体的能量供应,使人感到疲乏无力。
无机磷0.79mmol/L偏低还可能会导致营养不良。
这是因为无机磷是构成DNA、RNA等生物大分子的重要成分之一,而这些生物大分子则是细胞内进行各种代谢活动所必需的。
如果无机磷的浓度过低,就会影响这些生物大分子的合成和功能,从而导致营养不良的发生。
无机磷0.79mmol/L偏低还可能会引起缺乏维生素D的问题。
这是因为维生素D是一种脂溶性维生素,它需要与脂肪一起被吸收才能发挥作用。
而无机磷正是构成脂肪的一种重要成分,如果无机磷的浓度过低,就会影响维生素D的吸收和利用,从而导致缺乏维生素D的问题发生。
无机磷0.79mmol/L偏低还可能会引起肠道感染和甲状腺功能病变等问题。
这是因为肠道感染和甲状腺功能病变都可能导致机体内无机磷的流失增加或者吸收减少,从而导致无机磷的浓
度下降。
综上,无机磷0.79mmol/L偏低可能会引起身体乏力、营养不良、缺乏维生素D、肠道感染、甲状腺功能病变等影响。
因此,如果您发现自己的无机磷浓度偏低,建议及时到医院进行检查,采取针对性措施进行治疗。
同时,您还可以通过饮食调节来提高机体内的无机磷含量,例如多吃富含磷的食物如牛奶、鸡蛋、豆类等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
综述低磷血症对机体的影响
磷是人体细胞膜和核酸组成的必需营养元素,是机体的一个重要组成元素,在正常成年人体内的含量仅约700~800g,约2 g左右存在于细胞外液,但仅有15% 的磷酸盐与蛋白质结合。
其化合物在机体的新陈代谢、维持酸碱平衡、维持人体细胞功能等方面所起作用至关重要,维持细胞膜结构完整、功能正常,是体内必不可少的重要元素。
同时,磷元素还是细胞内绝大多数酶的重要调节因子,尤其是在能量供给方面,直接参与三羧酸循环,其化合物在ATP酶的储存、转运等过程中直接参与能量代谢。
又是红细胞2,3-二磷酸甘油酸的重要成份之一。
磷的缺乏会引起一系列的病理生理改变,如氧离曲线左移、血细胞功能下降、心肌收缩功能减退、急性呼吸功能衰竭、免疫能力降低、神经及肌肉细胞功能障碍等。
而我们临床工作中,常常发现大多危重病患者都存在不同程度的低磷血症。
两者之间的关系往往被大家所忽视。
已有研究证实ICU具有低磷血症的高发生率,并且其发病率在逐渐上升。
而在危重症患者中,其发病率则更高。
下面我们就探讨重症患者发生低磷血症的原因:
主要包括以下几方面:
(1)危重症患者常常接受机械通气治疗,多数存在进食障碍;由于使用葡萄糖液体或TPN治疗,而忽略对磷的补充,造成了磷的摄取减少。
比如AECOPD的病人,为了防止消化道出血,临床上经常应用服用抑酸剂,这些制剂可以直接与磷结合导致磷吸收障碍,所以长期使用抑酸剂会导致降低血磷,故而我们临床目前日益泛滥的应用抑酸剂,应当受到控制。
同时神经系统疾病也可以导致降低磷的摄入和吸收,多种中枢损害致神经调节紊乱,导致胃肠功能紊乱,脑干和下丘脑功能障碍,影响神经内分泌功能,从而影响胃肠道血流动力学和胃肠动力,最终影响营养成分的消化吸收,减少磷的吸收,最终造
成血磷降低,另外,当呕吐、胃肠减压、消化道淤血、右心功能不全等多种因素,都影响了胃肠道对磷的摄取。
(2)补液时输入葡萄糖,促进肝脏磷酸化,使磷从细胞外更进一步的向细胞内转移。
静脉高营养解决方案的氨基酸在体内蛋白质合成,也使磷的转移到细胞内,这些因素均会造成磷的重新分布,导致其在细胞外液的浓度下降。
(3)重症病人往往合并明显的水肿,比如肺水肿和脑水肿,使得临床上不可避免的应用脱水剂和利尿剂治疗,增加磷在肾脏的排泄,降低血磷。
(4)危重患者往往有不同程度的酸碱失衡,酸中毒可以减少葡萄糖的运动,增加血清磷酸盐浓度,以及尿磷排泄;过度通气会造成太多的二氧化碳呼出,导致呼吸性碱中毒,此时,磷转移到细胞内,可引起严重的低磷浓度。
(5)重症病人的感染也能导致血磷下降,细菌和毒素,主要为革兰氏阴性细菌,细菌产生内毒素可引起碳水化合物代谢障碍,阻止磷代谢途径,降低血磷。
(6)重症患者往往处于应激状态,一系列的反应促进分解代谢激素(如儿茶酚胺和胰高血糖素、糖皮质激素、甲状腺素等)分泌增加,加速了蛋白质、脂肪分解,糖异生、糖产量增加在肝脏,血糖,能使机体处于高分解代谢状态,导致体内磷的再分配、尿磷排泄增加,血磷降低。
以上因素均可导致低磷血症,总体而言,可归纳为三类:磷的摄入减少,磷的重新分布及磷的排泄增加。
而低磷血症往往缺乏特异性的临床表现,严重低磷会导致能量代谢障碍,导致细胞出现严重的能量供给不足。
事实上,国内外多项临床研究均已证实,严重的低磷血症与危重患者的病情严重程度、预后转归都密切相关,血磷水平也与危重病APACHEⅡ评分密切相关,也就是说,血磷水平可以作为疾病严重程度的指标之一。
此外,也有报道提示,严重的低磷浓度可以作为感染性休克患者死亡的独立预测因子。
磷与机体各个系统器官的关系密切,低磷血症时,全身各组织器官的功能也都受到不同程度的影响和变化。
首先是呼吸系统。
体内缺乏磷酸,ATP随之减少,因此,能量的传导受到严重影响,呼吸肌群疲劳,并且跨肺压进一步下降,引起呼吸衰竭。
第二,磷作为红细胞,2,3 -二磷酸甘油酸(2、3 DPG),氧气输送过程中的重要参与者,血磷浓度的下降就会导致氧解离曲线的左移,血红蛋白与氧的亲和力下降,造成机体各器官组织缺氧。
再者,血磷降低也会导致肺泡表面活性物质生成的减少,极易导致肺泡塌陷,肺不张等,进一步加重了呼吸衰竭。
低磷血症在机械通气患者中很常见,也是常见的脱机失败的原因之一,特别是老年患者的器官功能恶化,机体的抵抗力更差,并且多合并心脑血管疾病,更容易依赖呼吸机。
所以,有必要对每一位机械通气的病人,在插管上机前和机械通气后,密切监测血磷变化,尽早纠正低磷血症,以使危重患者的抢救成功率更高,脱机成功率也得到改善,最终减低患者的病死率。
低磷血症与机械通气二者往往互为因果,由于血磷下降,更容易出现组织缺氧,ATP供能下降,从而导致膈肌等呼吸肌群收缩力下降,呼吸肌功能障碍,出现肌无力,导致呼吸肌功能障碍、心功能下降,机械通气时间延长,甚至脱机失败。
所以对于机械通气的危重患者,应该更加重视低磷血症的防治。
此外,值得一提的是,重度低磷血症的患者易发生脱机困难,但因低磷导致肌无力,呼吸阻力减小,其机械通气所需的的压力水平也相对较低,具体差异尚待进一步研究证实。
消化系统方面,其与磷吸收代谢关系非常密切,低磷血症与消化道功能之间的互为因果关系也日益受到重视,低磷血症与肠内营养息息相关。
各种曾经停止过肠内营养的病人,当病情变化允许或需要再次开展肠内营养时,容易发生再喂养综合征,其以广泛的电解质紊乱为主要表现,尤其常见的是低磷血症。
他们的研究还发现,对于再喂养的患者,在开始再喂养前,其血清前白蛋白水平,或是预测患者发生低磷血症等再喂养综合征的指标因子。
前白蛋白水平越低,则后期
发生各种电解质紊乱的可能就越大。
同时喂养速度与低磷亦有明显相关,发生低磷血症,则提示肠内喂养速度过快。
在神经肌肉系统方面,因为磷与ATP的生成密切相关,在体内氧化磷酸化的过程中起重要作用,所以血磷降低会严重影响ATP的生成。
神经肌肉系统症状可能是由于细胞缺乏磷供应,糖酵解难以顺利进行,从而影响细胞的功能,导致ATP的生成和能量供应的不足,肌肉功能受到影响,同时引起细胞膜去极化,细胞内的水钠潴留。
这些因素会导致异常的肌电图、磷酸肌酸激酶的增加、神经传导速度下降。
最后会导致较严重的四肢无力,肌张力减退、腱反射消失,抽搐、昏迷、意识障碍等症状和体征。
此外,呼吸链中细胞色素氧化酶、琥珀酸脱氢酶的含量,在心衰是明显降低,这些酶的减少或也与低磷存在相关性。
总而言之,低磷血症会导致并加重心力衰竭,心衰的患者更应该注重磷的补充。
此外的其他方面,危重病人出现恶心、呕吐、厌食等胃肠道反应相当普遍。
也常有肝功能异常,甚至肝昏迷等情况。
中医传统医学认为,肾,主骨生髓,而骨骼的重要元素就是磷和钙,磷的异常往往在肾脏疾病中有所相关,比如尿磷的增加,磷的重吸收等等方面,加强患者总体病情。
对于低磷血症的预防和治疗,目前对其看法不一,大多数低磷都是因为出现了细胞内外磷元素的再分配,身体内的磷含量,并没有明显减少,所以,一部分人认为轻中度的患者,可以密切观察,并不需要积极干预治疗,只要纠正酸碱平衡紊乱,扭转了磷的重新分布,便可以提高外周血的磷浓度。
但事实上,危重患者合并低磷的原因是错综复杂的,他们往往互为因果,往往重叠存在,形成恶性循环。
我们进行正确的病因治疗,积极的抗感染、营养支持等综合治疗,血磷常常仍难以恢复正常,所以建议对所有危重病合并低磷血症患者进行补磷治疗,提高患者血磷水平。
尤其是严重低磷患者,治疗后通过积极补充纠正血磷水平,其与轻中度低磷血症组患者的APACHEⅡ评分间无明显统计学差异,所以我们有理由认为正确的补磷治疗是有效和必
需的,可以促进临床进展,改善患者预后。
血磷水平在一定程度上,反映了危重患者疾病的严重程度,反映了人体的各器官功能,血磷的浓度可以在一定程度上作为预后的预测指标。
在重症医学专业领域,一些常见的重要疾病,比如ARDS,感染性休克、重症肺炎、严重创伤和严重酸中毒,以及诊疗过程重度机械通风和连续血液净化治疗,均与低磷血症存在密切关系。
低磷血症的预防和治疗,应该得到我们足够的重视,血磷水平的早期检测,同时尽早纠正低磷血症,更进一步的改善危重病患者的预后。
