物质的分类结构图
物质的基本结构

第四章物质的基本结构本章导读世界是物质的。
物质的结构层次是怎样的?构成物质的基本单元是什么?这是自然科学研究的重大基本问题,也是从古到今,人类一直不断探索的问题。
从微观角度,物质的基本结构分为三个层次:分子和原子层次、原子核层次、基本粒子层次。
它们分别是原子物理和化学、原子核物理学和粒子物理学研究的内容。
目前,人们对微观世界的认识尺度已经达到1910 米,已发现的基本粒子有400多种,构成物质的基本单元是夸克、轻子和传播子。
基本粒子研究的内容:四种基本相互作用力,粒子的物理性质、粒子的分类、粒子的波粒二象性。
第一节 物质的基本结构人类对物质组成的最小结构的不断探索,推进了人类对微观世界的认识。
所谓的微观世界是指m 1010-(原子的直径为m 1010-)以下的物质世界。
微观世界的研究可分为三个层次:分子和原子层次微观世界 原子核层次基本粒子层次它们分别是原子物理和化学、原子核物理学和粒子物理学研究的内容。
图4-1 从分子到夸克和轻子一、对分子、原子层次的认识过程从古代开始,人类在探索自然奥秘的过程中,就不断探求物质的最小结构单元。
但运用实验和数学分析等手段和方法,真正对物质的基本结构进行科学的研究和解释,是从17世纪开始的。
1661年,英国科学家玻义耳提出了化学元素的概念,为科学地研究化学奠定了基础。
1803年,被誉为近代化学之父的英国化学家和物理学家道尔顿提出了原子论。
认为:元素的最小单元—原子是不可再分割的物质粒子。
1811年,意大利科学家阿伏加德罗提出了分子学说,弥补了道尔顿原子论中忽视了分子和原子区别的缺陷,两者结合形成了“原子—分子学说”。
使化学有了惊人的发展,许多新的化学元素不断被发现。
1871年,俄国化学家门捷列夫研究了原子量与元素性质之间的关系,提出了较完整的化学元素周期表。
周期表揭示出:元素性质的规律性变化与物质结构有关。
启示人们对物质更高层次的探索。
二、对原子核层次的认识过程19世纪,物理学家通过光谱分析技术,发现不同元素的原子都有不同的光谱结构,而同种元素的原子其光谱结构也相当复杂。
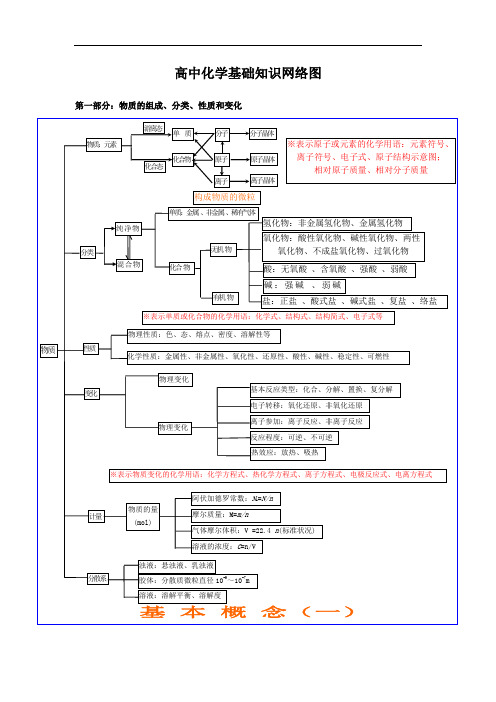
高中化学知识结构图

高中化学知识结构图一:物质分类变化模块。
1:物质的组成,性质,分类。
重难点知识:A:物质的分类原则(氧化物分类)。
B:纯净物与混合物的区分,性质的不同点总结。
C:化学性质与物理性质的区别,化学变化与物理变化的区别。
D:既能与酸反应又能与碱反应物质总结。
E:平均相对分子质量的求法(十字相乘法)。
F:化学反应基本类型。
G:同位素基本概念。
2:物质的量,常见化学计量。
重难点知识:A:基本概念:物质的量,摩尔质量,气体摩尔体积,物质的量的浓度及配置。
B:物质的量与阿伏加德罗常数间的换算关系,阿常数的推论总结。
C:物质的量使用时的注意事项。
D:气体摩尔体积条件状态的说明及常温常压下的推导公式。
E:配置物质的量浓度的仪器,步骤,以及与浓度的换算,误差分析。
F:平均相对分子质量求法总结。
G:质量,物质的量,微粒(分子,原子,离子)数目,气体体积(标况),物质的量浓度的关系。
3:分散系重难点知识:A:分散系的分类,特征,性质。
B:胶体性质,制备,提纯,凝聚方法。
C:关于溶解度的计算。
(晶体析出类,温度改变类)D:常见胶体及应用。
4:离子反应重难点知识:A:离子方程式的书写规则。
B:离子方程式中的过量,少量问题。
加入顺序问题。
C:离子共存的判断,包括隐含条件的应用规律。
D:电解质的概念。
E:归纳总结沉淀,弱电解质。
5:氧化还原反应:重难点知识:A:氧化还原反应的本质及特征。
B:表示方法:单线桥法,双线桥法。
C:氧化剂,还原剂,氧化产物,还原产物。
D:氧化还原反应的配平原则及步骤(重点四种题型:基本题型/脚标变化题型/歧化反应/归中反应1E:氧化还原反应的计算题。
二:金属元素模块1:碱金属元素:重难点知识:A:钠的性质,用途。
B:氧化钠,过氧化钠,碳酸钠,碳酸氢钠。
C:碱金属的性质(相似性,递变性)。
D:二氧化碳与氢氧化钠溶液反应产物的判断方法,技巧总结。
E:漂白原理总结,漂白剂分类及介绍。
F:焰色反应原理及运用。
物质的构成

2006年沈阳市第20题 归纳和比较是学习化学的重要方法。对待同一个问 题,从不同的角度我们可以找到不同的规律,从而得出 不同的答案。请按要求及示例完成下表:
物质
与众不同的 物质
理
由
KCl K2SO4 K2CO3 BaCO3
KCl
KCl中不含氧元素,其 他物质中均含有氧元素
END
2006年宜宾市 第16题
核对 者
L
送检 医师
检验 师
⑴ 这位少年患者由于长期偏食、挑食造成营养不良和食 欲不振,请从上述检验单中指出患者体内缺乏哪些元素? 这些元素在人体内含量均超过0.01%,应称为什么元素? ⑵这位患者体内钠元素偏高,请对他的饮食习惯提出改 进建议。
物质的分类
区分纯净物与混合物的标准:物质是否是一种 纯净物:只由一种物质组成 物 它具有固定的组成和性质 质
联 都是纯净物,都有固定的组成。 系 同一种元素的原子可能存在单质或化合物里。
单质
纯 净 物 化合物
有机化合物 无机化合物
区分无机物和有机物的标准:是否含碳元素
注:CO、CO2、含CO2-、 HCO-的物质例外 3 3
单质
金属单质 非金属单质 稀有气体
氧化物
纯净物 物 质 按 组 成 分 化 合 物 混合物
核外电子排布的初步知识 ①.在含有多个电子的原子里,电子的能量并不相同,故电子 是分层排布的. 电子层数 一二三四五六七 离核距离 近→远 电子能量 低→高 填充顺序 先→后 ②.原子结构示意图. 如图,镁原子的结构示意图含义 +12 表示原子核及核内有12个质子(即原子核带有12个单 位正电荷), 弧线表示电子层 弧线上的数字表示该电子层上的电子数
项 目 血清钾 血清钠 血清氯 钙 离子钙 磷 镁 二氧化碳结合力
(完整)高中化学知识结构图
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
物质的组成、分类、性质

第二章
化学物质及其变化
4.物质微观构成 微粒 原子直接 构成 常考实例 晶体硅、碳化硅、SiO2等
分子直接 非金属单质(O 、P 、稀有气体等) 2 4 构成 离子直接 离子化合物(含有金属阳离子或铵 构成 根的化合物)
性质上,同素异形体之间的转化属于 ___变化。 化学
第二章
化学物质及其变化
三、混合物和纯净物
1.纯净物:由同种单质或化合物 __________________组成的物质。 由几种不同的单质或化合物 2.混合物: _______________________组成的物质。 [温馨提示] 常见混合物:(1)分散系,如溶液、胶体、
[答案] 非金属氧化物不一定是酸性氧化物,如CO、
NO;酸性氧化物不一定是非金属氧化物,如Mn2O7。
4.酸性氧化物一定能和H2O反应生成相应的酸吗?
[答案] 不一定,如SiO2不能与H2O反应。
第二章
化学物质及其变化
题组一 物质的分类考查
(2014· 高考四川卷 ) 下列关于物质分类的说法正确 的是( A.
浊液等;(2)高分子,如蛋白质、纤维素、聚合物、淀粉
等;(3)常见特殊名称的混合物:石油、石油的各种馏
分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、
水煤气、铝热剂等。
1.硅、氯、硫、氮元素在自然界中存在状态是什
第二章
化学物质及其变化
么?
[ 答案 ]
硅、氯元素在自然界中以化合态存在;
硫、氮元素在自然界中既有游离态又有化合态。
例如:利用交叉分类法对下列物质分类,将Ⅰ中物质与Ⅱ中
高中化学知识结构图

高中化学知识结构图第一部分:物质的组成、分类、性质和变化基本概念(一)第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)电化学知识图表化学反应速率化学平衡电解质溶液第三部分:元素化合物转化关系Mg 3MgXMg(OH)2 3 MgCl 2 H O NaOHMg(HCO 3)2 煅烧 HCl H 2O CO 2 △ 或 OH -HCl Na 2CO 3 2 NaCl COONa NaHCO 3稀 2 Fe(OH)3FeSO Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3KSCN KSCN H 2SO Cl 2、HNO 浓 O 2和H 2OHClCuCuOCu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2SSH + HNO3或H 2SO 4(浓)NaOHO 2CO 、Al 、H 2△H +第四部分:有机化学烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃烷烃:C n H 2n+2(n≥1)R—CH 3 不饱和链烃 烯烃:C n H 2n (n≥2) R—CH=CH 2二烯烃:C n H 2n-2(n≥4)R—CH=CH —CH=CH 2炔烃:C n H 2n-2(n≥2) R—C≡CH 环烷烃C n H 2n (n≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n≥1)R—X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n≥1)R—OH 醚 C n H 2n+2O (n≥2)R—O —R酚(苯酚)(官能团:—OH )C n H 2n-6O (n≥2) OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n≥1)R—COOH醛 (官能团:—CHO )C n H 2n O (n≥1) R —CHO酮 (官能团:—CO —)C n H 2n O (n≥3)R—CO —R’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n≥2)R—COOR ′硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2 单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料合成橡胶 合成纤维有机化合物。
物质的分类树状图p3

1、下列物质中前者从属于后者的是( B )
A、纯净物、混合物 B、氧化物、化合物
C、盐、正盐
D、金属氧化物、碱性氧化物
2、下列说法中,正确的是 ( DE )
A、非金属氧化物都是酸性氧化物 B、酸性氧化物都是非金属氧化物 C、金属氧化物都是碱性氧化物 D、碱性氧化物都是金属氧化物
萃取剂的要求
1、与原溶剂互不相溶 2、被萃取的物质在萃取剂中的溶解度远远大于在原溶 剂中的溶解度
物质的分离和提纯的要求
1、不能引入新的杂质 2、被提纯的物质不能减少 3、除杂试剂应该过量 4、过量试剂必须除去 5、除杂中用到多种物质时,要考虑加入试剂的顺序 6、被提纯或分离的物质要复原
1.已知粗盐中含有泥砂、MgCl2、CaCl2、Na2SO4等杂质 设计实验除去以上杂质得到精盐
E.H的摩尔质量是1g.mol-1 F.氩气的摩尔质量在数值上等于它的相对原子质量 G.1mol任何物质的质量等于该物质的相对分子质量
气体摩尔体积
1、决定体积的因素
固体 液体
粒子数 气体
粒子大小
粒子数 粒子间距
2、标准状况下气体摩尔体Vm≈22.4L/mol
1、下列说法正确的是
( CD )
A、1mol氖气和1 mol氧气体积相同
工方法首次合成得到的有机物是 ( C )
A、甲烷 B、乙醇 C、尿素 D、醋酸
分解反应
化合反应
氧化还原反应
置换反应
复分解反应
物质的量
1.下面说法正确的是
( CE )
A.1mol米是6.02 ×1023粒米
B.10mol氢所含粒子数为6.02 ×1024
C.摩尔是物质的量的单位
物质的组成和结构
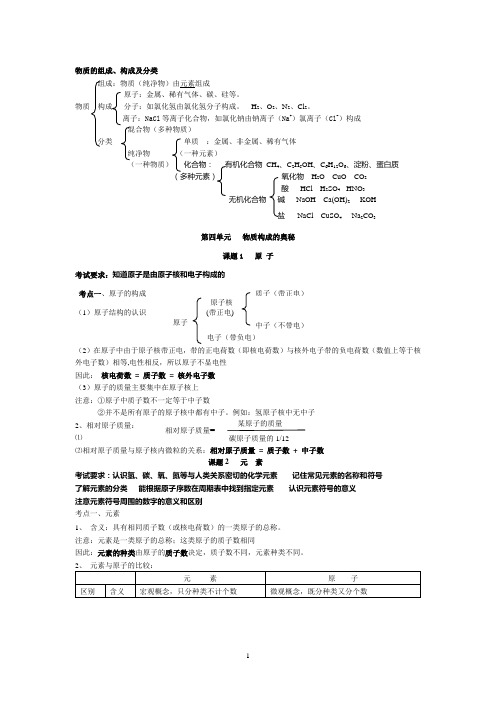
物质的组成、构成及分类组成:物质(纯净物)由元素组成原子:金属、稀有气体、碳、硅等。
物质 构成 分子:如氯化氢由氯化氢分子构成。
H 2、O 2、N2、Cl 2。
离子:NaCl 等离子化合物,如氯化钠由钠离子(Na +)氯离子(Cl -)构成混合物(多种物质)分类 单质 :金属、非金属、稀有气体纯净物 (一种元素)(一种物质) 化合物: 有机化合物 CH 4、C 2H 5OH 、C 6H 12O 6、淀粉、蛋白质(多种元素) 无机化合物第四单元 物质构成的奥秘课题1 原 子考试要求:知道原子是由原子核和电子构成的 考点一、原子的构成 (1)原子结构的认识(2外电子数)相等,电性相反,所以原子不显电性 因此: 核电荷数 = 质子数 = 核外电子数 (3)原子的质量主要集中在原子核上 注意:①原子中质子数不一定等于中子数2、相对原子质量:⑴ ⑵相对原子质量与原子核内微粒的关系:相对原子质量 = 质子数 + 中子数课题2 元 素考试要求:认识氢、碳、氧、氮等与人类关系密切的化学元素 记住常见元素的名称和符号 了解元素的分类 能根据原子序数在周期表中找到指定元素 认识元素符号的意义 注意元素符号周围的数字的意义和区别 考点一、元素1、 含义:具有相同质子数(或核电荷数)的一类原子的总称。
注意:元素是一类原子的总称;这类原子的质子数相同因此:元素的种类由原子的质子数决定,质子数不同,元素种类不同。
相对原子质量=适用范围从宏观描述物质的组成。
常用来表示物质由哪几种元素组成。
如水由氢元素和氧元素组成从微观描述物质(或分子)的构成。
常用来表示物质由哪些原子构成或分子由哪些原子构成,如水分子由氢原子和氧原子构成;铁由铁原子构成。
联系元素是同类原子的总称,原子是元素的基本单元3、元素的分类:元素分为金属元素、非金属元素和稀有气体元素三种(考点二)4、元素的分布:①地壳中含量前四位的元素:O 、Si 、Al 、Fe ②生物细胞中含量前四位的元素:O 、C 、H 、N ③空气中前二位的元素:N 、O 注意:在化学反应前后元素种类不变 二、元素符号(考点三)1、 书写原则:第一个字母大写,第二个字母小写。
专题二 物质的组成、结构和分类网络图

初中化学 专题二 物质的组成、结构和分类23234()e,Fe Fe ++⎧⎪⎪⎪⎪⎨⎪⎪⎩1.决定元素种类的是核电荷数(即质子数), 即一种元素和另一种元素的区别是质子数或核电荷数不同2.决定元素化学性质的是最外层电子数,概念:具有相同核电荷数即质子数的一类原子的总称 同种元素具有相同的核电荷数,如F ,都称为铁元素, 但最外层电子数不同,所以它们的化学性质不同3.核电荷数相同的粒子不一定是同种元素,如Ne,HF,H O,NH ,CH 元素223⎧⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎧⎪⎪⎪↓↑⎨⎪⎪⎪⎩⎩分类:金属元素,非金属元素,稀有气体元素种类:地壳中含量居前四位的元素:氧,硅,铝,铁;生物细胞中居前四位的元素:碳,氢,氧,氮表示方法:元素符号,如 氮N,氢H,氧O 单质:同种元素组成,如:Fe,O 存在形式:化合分解 化合物:不同种元素组成,如:Fe O 1.3.υ+-↑分概念:保持物质化学性质的最小微粒分子只保持物质化学性质,物理性质是多个分子集体表现,单个分子无法体现。
2.构成物质的微粒有分子,原子,离子,由什么微粒直接构成,其化学性质由什么来保持。
如:保持NaCl 化学性质的最小微粒为Na 和Cl 由分子构成的物质在发生物理变化时,分子本身没变化分子 4.分子由原子构成,在化学变化中分子可分性质:1.体积小,质量小; 2.不断运动;T ,22,,;,P d υυ⎧⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪↑↓↓⎪↑↑↓⎪⎪⎪⎪⎩子分子分子分子;T 3.相互间有间隔;T 4.同种分子化学性质相同,不同种分子化学性质不同。
表示方法:化学式 如:H O,O1.⎧⎪⎧⎨⎨⎪⎩⎩≈概念:化学变化中的最小微粒1.原子是构成物质的一种微粒,可直接构成物质2.在化学变化中,一种原子不会变成另一种原子, 只是分子破裂,原子重新组合构成别的分子或物质核外电子(带负电)结构:原子(不带电)质子(带正电)原子核(带正电)原子中子(不带电)相等关系:相对原子质量质量数=质子数+中子数一个原子只有一个原子核,体积很小,位于原子中心,集中原4.⎧⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩子全部正电荷2.由于原子质量很小,所以原子核几乎集中了原子的全部质量3.电子所带电荷量与质子所带电荷量相等而电性相反,所以原子显中性原子核内质子数不一定等于中子数2334+-+-+--+⎧⎪⎧⎧>⎪⎪⎪⎨⎪<⎪⎪⎩⎨⎨⎧⎪⎪⎨⎪⎪⎩⎩概念:带电的原子或原子团阳离子--带正电荷,如:Na ,核电荷数核外电子数按离子所带电荷的电性分阴离子--带负电荷,如:Cl ,核电荷数核外电子数离子分类:单核离子(简单离子)--带电荷的原子,如:Na ,Cl按离子的构成来分多核离子(复杂离子)--带电荷的原子团,如CO ,ClO ,NO ,NH 离子所带电荷数=核电荷数-核外电子数,如:⎪⎪⎪⎪⎪⎩2222422343⎧⎪⎧⎧⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎧⎧⎨⎪⎨⎪⎪⎪⎪⎪⎨⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎩⎩混合物金属 如:Fe,Cu...单质非金属 如:C,S,H ...稀有气体 如:He,Ne,Ar...分类氧化物 如:MgO,H O,CO ...纯净物酸 如:H SO ,HCl...无机化合物化合物碱 如:NaOH,Ca(OH)...盐 如:NaCl,Na CO ...有机化合物,如CH ,CH COOH ⎪⎪⎪⎪⎪⎪⎪⎩定义相同点区别联系原子分子化学变化中最小微粒保持物质化学性质的最小微粒1都是构成物质的基本粒子;2都有一定间隔;3都在不停运动;4不/同种分子化学性质不/相同,不/同种原子性质不/相同化学变化中不能再分化学变化中可再分原子 分子物质构成构成构成定义区别联系应用范围元素原子具有相同核电荷数的一类原子的总称化学变化中的最小微粒是同类原子的总称,只讲种类,不讲个数,无数量多少的含义是微观粒子,既讲种类,又讲数量原子的核电荷数 元素种类原子最外层电子数 元素化学性质决定决定物质宏观组成物质微观组成纯净物混合物概念由同种物质组成两种或两种以上的物质组成组成 1 宏观:由同种物质组成2 微观:由同种微粒构成,对于分子构成的物质而言,由同种分子构成3 有固定不变的组成 1 宏观:由两种或两种以上的物质组成2 微观:由不同微粒构成,若是分子构成则不同分子组成3 无固定组成性质有固定熔、沸点无固定熔沸点,这些物质间发生化学反应,各持自己原有性质举例H ,O 空气,牛奶,牙膏转化纯净物 混合物两种或两种以上物质的简单混合提纯,分离2纯净物纯净纯净22原子离子概念电性表示方法数量关系相似点及转化化学变化中的最小微粒带电的原子或原子团中性,不带电带电阳离子-正电阴离子-负电元素符号;如纳原子,Na,2个纳原子:2Na 元素符号右上角先写出电荷数(1省略),后标出电性(+或-)。
化学必修一思维导图

化学必修一思维导图一、物质及其变化1. 物质的结构原子结构:由原子核和核外电子组成,原子核由质子和中子组成。
分子结构:由原子通过化学键连接而成。
晶体结构:由原子、分子或离子按照一定的规律排列而成。
2. 物质的分类纯净物:由同种元素或化合物组成,具有固定的组成和性质。
3. 物质的性质物理性质:不涉及物质组成和结构变化的性质,如颜色、状态、密度等。
化学性质:涉及物质组成和结构变化的性质,如可燃性、氧化性等。
二、化学键与化学反应1. 化学键离子键:由正负离子之间的静电作用力形成。
共价键:由原子间共享电子对形成。
金属键:由金属原子间的自由电子云形成。
2. 化学反应化学反应类型:合成反应、分解反应、置换反应、复分解反应等。
化学反应条件:温度、压力、催化剂等。
化学反应速率:反应物浓度、温度、催化剂等。
三、元素周期表1. 元素周期律元素周期表按照原子序数排列,具有周期性变化的规律。
元素周期表中,同一周期的元素具有相似的化学性质,同一族的元素具有相似的物理性质。
2. 元素周期表的应用元素周期表可以用于预测元素的化学性质和物理性质。
元素周期表可以用于解释元素的电子结构和化学键的形成。
四、化学计量学1. 物质的量物质的量:表示物质中含有的基本粒子数,单位为摩尔。
摩尔质量:表示1摩尔物质的质量,单位为克/摩尔。
2. 化学反应的计量关系化学方程式:表示化学反应的物质及其量的关系。
化学方程式的平衡:反应物和物的物质的量保持一定的比例。
3. 化学反应的热力学焓变:表示化学反应中能量的变化,单位为焦耳。
反应热:表示化学反应中吸收或释放的热量,单位为焦耳。
五、溶液与胶体1. 溶液溶液的定义:由溶质和溶剂组成的均匀混合物。
溶液的浓度:表示溶液中溶质的含量,单位为摩尔/升。
2. 胶体胶体的定义:由分散相和分散介质组成的混合物,分散相粒子的大小介于分子和宏观粒子之间。
胶体的性质:具有丁达尔效应、布朗运动等特性。
六、酸碱反应1. 酸碱理论酸碱质子理论:酸是质子(H+)的供体,碱是质子的受体。
物质构成组成

2-
)
D、氧元素
四、一种元素组成的物质是( D ) A、一定是单质 B、一定是混合物 C、可能是化合物 D、可能是纯净物 五、元素的种类决定于( BD ) A、电子数 B、质子数 C、中子数 D、核电荷数 六、元素的化学性质决定于(D ) A、核外电子数 B、质子数 C、中子数 D、最外层电子数
4、结构、组成、性质、变化之间的关系
(1)结构或组成不同决定性质不同 ①O2、O3分子构成不同,化学性质不同。
②H2O、H2O2分子构成不同,化学性质不同。
③Na、Na+最外层电子数不同,决定化学性质不同 ④金属元素和非金属元素最外层电子数不同,化学 性质不同。
(2)性质决定用途 ①氮气有稳定性,可用作保护气
3、化合价口诀: +1 +1 +1 +1 +1 K、Na、Ag、H、NH4正一价 +2 +2 +2 +2 +2 Ca、Mg、Ba、Zn、Hg 正二价
+1 +2 +2 +3 +3 Cu Cu Fe Fe Al
-1 -1 -1 -1 -1 -1 F、Cl、Br、I、OH、NO3根负一价 -2 -2 -2 SO4、O、CO3负二价
C、二氯乙烷中由碳、氢、氯三种元素的质量比为12: 2:71 D、二氯乙烷用于冷冻麻醉与其沸点较低、易挥发吸 热有关
混合物 (如溶液、合金、空气、海水、石灰石等) 金属(如Fe、Cu等)
单 质 非金属
物 质
He,Ne,Ar C,S,P,Si O2,H2,N2,Cl2 有机化合物 小分子:CH4、C2H5OH、C6H12O6…… 有机高分子: 蛋白质、油脂、淀粉等
物质分类

一定含氢、氧两种 一定含有非金属元 元素 素
返回
一、酸和碱
HCl H2SO4 HNO3
酸
H+ + Cl2H+ +SO42H+ +NO3在水溶液中 电 离
H+ + 酸根离子
NaOH KOH Ca(OH)2
Na+ + OHK+ + OHCa2+ + 2OH金属离子 + OH—
在水溶液中 碱 电 离
3.常见的酸有盐酸(HCl)、硫酸(H2SO4)、 硝酸(HNO3)、还有磷酸(H3PO4)、碳酸(H2CO3)、 醋酸(CH3COOH)等。 从名称上看它们最后一个字都是“酸”,从 组成上看都含有氢元素。
一种可去铁锈的酸 H2SO4
一种溶于水的碱 NaOH 一种可做杀菌剂的盐
CuSO4
一种可做氮肥的盐 NH4NO3
例10 从Ca、Mg、O、H、Cl中的选择适当的 元素,按要求写出相应物质的化学式: (1)一种非金属单质 ; (2)一种金属氧化物 ; (3)一种难溶性的碱 ; (4)一种可溶性的盐 。
3.下列物质中,属于纯净物的是
A.茶饮料
B.蒸馏水
C.苹果醋
重要概念考 查的载体, 都是生活中 最常见的物 质名称
D.纯牛奶
8
讨论2
–根据下列物质的化学式,你能找出其中的单质和化合物吗? Fe NaCl 铁 氯化钠 氢气 H2 碳酸钠 Na2CO3 氢氧化钙 Ca(OH)2 二氧化硫 SO2
硝酸钾
※酸、碱、盐
项目 概念 酸 碱 盐
电离时生成的阳 离子全部是氢离 子的化合物
电离时生成的阴 离子全部是氢氧 根离子的化合物 均为化合物
物质的组成和分类

物质的组成和分类能力解读1.认识:物质的多样性。
2.识别:混合物与纯净物,化合物与单质,有机物和无机物,常见的酸、碱、盐和氧化物。
3.懂得:元素的简单分类。
4.知道:物质由元素组成。
知识梳理1.物质分类及典型实例体系总图2.物质的定义⑴ 组成混合物,⑵ 组成纯净物①单质: 的纯净物...。
②化合物: 组成的纯净物...。
ⅰ氧化物: 组成的化合物...。
酸性氧化物:能与 ,如 CO2、SO2。
中性氧化物:碱性氧化物:能与 ,如:CaO 。
。
ⅱ酸:水溶液中电离出的阳离子 的化合物...。
⑼有机物:含 元素的化合物...。
非金属单质 稀有气体单质:如:He 、Ne 、Ar 等 金属单质:如Mg 、Al 、Zn 、Fe 、Cu 、Hg 、Ag 等气态:H 2、O 2、N 2、Cl 2 固态:C 、S 、P 、Si 、I 2 物质 纯净物 如:空气、自然界中的水、化石燃料、溶液、合金、盐酸等 单质 化合物 无机化合物有机化合物:如CH 4、C 2H 5OH 、CH 3COOH 、C 6H 12O 6等 如(C 6H 10O 5)n 等相对分子质量大于1万的,为有机高分子化合物 碱 盐:如NaCl (中性)、Na 2CO 3(碱性)、CuSO 4(酸性)等酸 碱性氧化物:如CuO 、MgO 等 酸性氧化物(酸性):如CO 2、NO 2、SO 2、SO 3、等 含氧酸:如H 2SO 4、H 2CO 3、HNO 3等 无氧酸:如HCl 、H 2S 等 可溶:如NaOH 、KOH 等难溶:如Mg(OH)2、Fe(OH)3、Cu(OH)2等 微溶:Ca(OH)2等 中性氧化物(中性):如H 2O 、CO 等 混合物ⅲ碱:水溶液中电离出的阴离子的化合物...。
ⅳ盐:由和金属离子或铵根离子组成的化合物。
3.混合物:分散系:的体系,叫分散系。
分散质:(可以是气体、液体、固体)分散剂:(可以是气体、液体、固体)1.2.溶液的配制步骤:3.胶体的性质:4.分离提纯法:练习1.现有C、H、O、Na、Cu、S六种元素,从中选出相关元素组成下列类别物质的化学式:(每类各写两例)⑴单质⑵酸⑶碱⑷盐⑸氧化物⑹有机物2.下面是物质分类图,请将“氧化物”、“化合物”、“单质”、“纯净物”、“盐”等名词填写在适当的框中:3⑴将上表①~⑤中主要成分进行分类(填序号,下同):属于酸的是__________;属于碱的是_________;属于盐的是__________;属于有机物的是__________。
物质的结构

同种物质的分子性 质相同,不同种物 质的分子性质不同
分子的性质巧记
•固态氢和液态氢都具有可燃性 •氢具有可燃性,氧气能支持燃烧,具有氧化性,不具有可燃 性
两小一动一间隔;分子相同性相同
三 分子可以分为原子
分子的概念:保持物质化学性质的最小粒子。 注: 保持的含义是指构成该物质的每一个分子与该物质的化学性 质是一致的。 分子只能保持物质的化学性质,不能保持物质的物理性质。 最小不是绝对意义上的最小,而是保持物质化学性质的最小。 原子的概念及性质 a原子的概念:原子是化学变化中的最小粒子。 b原子的基本性质: 原子的质量和体积都很小 原子总是在不断运动着 原子之间有间隔 分子、原子的联系与区别
四 相对原子质量
概念:以一种碳原子(原子核中含有6个质子和6个中子)质 量的1/12作为标准,其他原子的质量跟它相比较,所得到的 比作为这种原子的相对原子质量,符号为Ar。 公式:某原子的相对原子质量
(Ar)=
一个该原子的实际质量(kg) 一个碳12原子的实际质量(kg)X1/12
单位:相对原子质量是一个比值,单位为1,一般不写出。
说说生活中的那 些物质是分别由 原子、分子、离 子构成的?
元素
定义:元素是质子数相同的一类原子的总称。 元素与原子的比较
元素 概念 具有相同质子数的一类原 子的总称。一种元素可包 含几种原子。 宏观概念,只讲种类,不 讲个数 原子 化学变化中的最小粒子。 同种原子,质子数相同; 不同种原子,质子数不相 同。 微观概念,既讲种类,也 讲个数
三元素符号
元素符号的写法: 由一个字母表示的元素符号要大写,如H、C等 由两个字母表示的元素符号,第一个字母要大写,第 二个字母要小写,如Na,Mg等 元素符号的含义: 从宏观上表示一种元素,微观上表示这种元素的一个 原子。 对于由原子直接构成的单质,元素符号还表示一种单 质。
物质的分类1
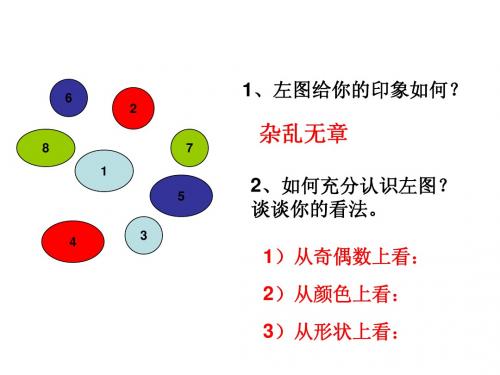
利用丁达尔效应是区分胶体与溶液的一种常 用的物理方法。
丁达尔效应
CuSO4溶液
Fe(OH)3胶体
利用丁达尔效应是区分胶体与溶液的一种常 用的物理方法。
讨论:常见的丁达尔效应 雨后彩虹 、海市蜃楼 、树林中的晨曦
电泳---电学性质
在外加电场的作用下,胶体的粒子在 分散剂里向阴极(或阳极)作定向移 动的现象,叫做电泳。 电泳现象证明了胶体粒子带有电荷。
• (3)明矾的净水作用 • (4)江河入海口处形成三角洲 • (5)豆腐的制作原理
光束照射时的现象
Fe(OH)3胶体
CuSO4溶液
Fe(OH)3胶体 Fe(OH)3悬浊液
形成一条光亮的“通 路” 没有明显现象 过滤后的现象 没有滤渣残留在滤纸上 有滤渣残留在滤纸上
结论:1、区分胶体、溶液的方法:丁达尔效应
2、胶体粒子能够通过滤纸!
3、浊液粒子直径>滤纸孔径>胶体粒子直径>溶液粒子直径
气溶胶
晨雾
烟
白云
固溶胶
烟 水 晶
有 色 玻 璃
一、胶体、溶液、浊液的制备及性质探究
1、Fe(OH)3胶体制备:将饱和FeCl3溶液逐滴滴入 沸水中,边滴加边摇动试管,继续煮沸至溶液呈 红褐色,停止加热。
△ 原理:FeCl3+3H2O(沸水)=Fe(OH)3(胶体)+3HCl
2、CuSO4溶液 3、Fe(OH)3悬浊液制备: FeCl3+3NaOH=Fe(OH)3↓+3NaCl 4、观察胶体、溶液、浊液的外观、颜色等物理性 质。 5、用激光笔照射Fe(OH)3胶体、CuSO4溶液 6、将胶体、浊液进行过滤操作
九种分散系(分类)
九种分散系的实例
九年级化学知识结构图

化学反应的基本类型
化学反应可分为化合反应、分解反应、 置换反应和复分解反应四种基本类型。
溶液、酸碱盐基础
溶液的概念和组成
溶液是一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物,由溶质和溶剂 组成。
酸碱盐的定义和性质
酸指电离时产生的阳离子全部都是氢离子的化合物;碱指电离时产生的阴离子全部都是氢 氧根离子的化合物;盐指电离时生成金属阳离子(或铵根离子)和酸根离子的化合物。酸 碱盐具有不同的化学性质。
九年级化学知识结构图
目 录
• 基础知识概述 • 微观世界探秘 • 宏观物质变化规律 • 实验技能与科学探究 • 环境保护与可持续发展观念培养 • 总结回顾与拓展延伸
01 基础知识概述
物质的组成与分类
01
02
03
物质的组成
物质由元素组成,元素是 同一类原子的总称,原子 由质子、中子和电子构成。
物质的分类
化学键
分子或离子之间通过相互 作用力形成的稳定结构, 包括离子键、共价键和金 属键等。
微观粒子间相互作用力
离子键
由阴、阳离子之间通过静电作用 所形成的化学键,如NaCl中的离
子键。
共价键
原子之间通过共用电子对所形成 的化学键,如HCl中的共价键。
分子间作用力
分子之间存在着相互作用的弱力, 包括范德华力和氢键等,影响物
氧化还原反应
化学反应中元素化合价发生变化的反应称为氧化还原反应, 其中失去电子(或化合价升高)的过程称为氧化,得到电 子(或化合价降低)的过程称为还原。
原电池与电解池
利用氧化还原反应将化学能转化为电能的装置称为原电池; 利用电能引起氧化还原反应的装置称为电解池。
电极反应与电池反应
(人教版)中考化学九年级总复习【专题1】物质的组成、构成和分类(62页)

2021/5/21
考点知识梳理
中考典例精析
4专题训练
宇轩图书
2021/5/21
考点知识梳理
中考典例精析
5专题训练
宇轩图书
例 1(2014·泰安)“微观—宏观—符号”三重表征是化 学独特的表示物质及其变化的方法,请结合图示完成下列 问题。
2021/5/21
考点知识梳理
中考典例精析
6专题训练
宇轩图书
答案:(1)金属 失去 Mg2+ (2)Na2S (3)从左至右最 外层电子数依次增大
2021/5/21
考点知识梳理
中考典例精析
1专2题训练
宇轩图书
例 3(2014·东营)A、B、C、D、E、F 都是初中化学常 见的物质,A、C 都是维系人类生命最重要的物质,B 是用 于光合作用和灭火的气体,D 可用于保护树木,防止冻伤, 并防止害虫生卵,E 是人体胃液中含有的酸,它们之间的转 化关系如图所示。(“—”表示两端的物质能发生化学反应; “→”表示物质之间的转化关系。)
存放,四个药品柜,已存放了下列药品,现学校实验
室新购进一瓶硝酸,正确存放它的药品柜是( )
药 品 甲柜 柜
乙柜
丁 丙柜
柜
药 盐酸、 氢氧化钠、氢 红磷、 铜、
品 硫酸 氧化钙
硫锌
A.甲柜 B.乙柜 C.丙柜 D.丁柜
2021/5/21
考点知识梳理
中考典例精析
3专5题训练
宇轩图书
解析:硝酸是由氢离子和硝酸根离子构成的,属 于酸,应和酸存放在一起。盐酸、硫酸均是由 H+和酸 根离子构成,均属于酸,故 A 选项正确。
2专7题训练
宇轩图书
6.(2014·黄冈)下列物质:①空气、②硫酸、 ③
