第五章阳离子聚合及其应用
阳离子性聚合物的合成及其应用

阳离子性聚合物的合成及其应用随着人们对新材料的需求日益增长,合成阳离子性聚合物已经成为一种越来越被关注的研究方向。
阳离子性聚合物具有许多优异的性质,例如电荷密度高、吸附能力大等,这些性质为其在各个领域中的应用提供了基础。
在本文中,我们将讨论阳离子性聚合物的合成方法、常见的应用领域以及未来的发展方向。
一、阳离子性聚合物的合成方法阳离子性聚合物的合成方法主要分为两类:碳碳键开环聚合和离子协同聚合。
碳碳键开环聚合是将含有双键、环氧基、环丙基等不饱和键的单体进行聚合,一般需要催化剂的作用。
离子协同聚合是以离子为引发剂,引发带电单体的自由基聚合,常见的单体有甲基丙烯酸甲酯(MMA)、丙烯酸(AA)等。
在合成过程中,常使用一些交联剂以提高阳离子聚合物的物理性质和稳定性。
此外,阳离子性聚合物还可以通过掺杂有机或无机染料、纳米粒子等来调节其性质和应用。
二、阳离子性聚合物的应用领域1. 生物医学在生物医学领域中,由于阳离子聚合物具有高度的阳离子性和吸附能力,在药物传递和癌症治疗中有着广泛的应用。
例如,聚(2-甲基-5-乙烯基吡啶)(PMEP)可以被降解为酸性代谢物,在靶向性和药物释放方面具有潜力。
6-(2-(3-取代基丙烯基)吡啶)-6-氟-1,6-异氰酸酯基-3,9-二氧-12H-5,12-氧代-4,9-氨基-2,10-二奥基-4,8,11-三氮杂-5-环十二烷(FITC-C12)阳离子聚合物可以通过特异性和非特异性靶向性和药物释放递送到肿瘤组织内。
此外,阳离子聚合物也可以用于构建人工器官、组织工程等领域。
2. 污水处理由于阳离子聚合物具有良好的吸附和沉淀能力,可以有效地去除水中的悬浮物和有机物等。
例如,聚乙烯亚胺和聚乙烯酸甲酯(PAMMA)可以作为污水处理剂,具有良好的吸附性能和快速沉淀速度。
3. 墨水阳离子性聚合物可以被用于制造印刷墨水。
墨水的粘稠度可以被阳离子性聚合物的溶液浓度、分子量等因素所控制,反应条件可通过改变 pH 值或添加离子之类的方式进行调节。
第五章离子型聚合

_
[CH2 CH]n+1
_
_ _ [CH CH2]n+1 C4H9
_ [CH _ CH] Si _ _ C4H9 [CH CH2]n+1 C4H9 2 n+1
+CH3OH
_ [ CH_ CH ] _[CH _ CH] _ CH CH OH 2 2 2 n HOCH2CH2 2 n
与二氧化碳反应——生成高相对分子质量的一元酸或二元酸:
_ [CH _ CH] _ CH _ CH- Li + ..... C4H9 + CO2 2 2 n
+ H+
_ [CH _ CH] _ C4H9 2 n+1 COOH
2. 与特殊化合物进行链终止——遥爪聚合物的合成 遥爪聚合物: 聚合物分子链的两端带有相同官能团的聚合物 。
与环氧乙烷反应生成高相对分子质量的一元醇或二元醇:
C4H9 [CH2 CH]n CH2 _ _ _ _ _ _ ..... Li + + CH2 _CH2 CH O _ _ _ -..... + CH2 O Li
3)链终止 在阴离子聚合中,由于活性中心都带有负电荷,因 此不会发生类似自由基那样的双基终止反应。 1.向质子性物质转移终止
.....Li+ + CH3OH → ~ CH2 _ CH2 + CH3OLi ~ CH2 CH CN CN _ _ + ~ CH2 CH .....Li + HOH → ~ CH2 CH2 + LiOH CN CN _
+
_ _ _ .....- CH _ CH2 _[ CH_CH2 ]n [CH2 CH]n CH2 _ CH -..... Na + Na
高分子化学 第五章 离子聚合(wfy)

聚合度 在下列条件下: 引发剂全部很快地转变成活性中心 搅拌良好,单体分布均匀,所有链增长同时开始 无链转移和链终止反应 解聚可忽略
转化率达100%时,活性聚合物的平均聚合度等于 单体浓度与大分子活性链数之比:
[M] n[ M ] Xn [M ] [C ] n
式中 [C] 引发剂浓度
阳离子聚合通式可表示如下:
A B M AM B M M n
式中B-为反离子,又称抗衡离子 (通常为引发
剂碎片,带反电荷)。A+为阳离子活性中心(碳阳
离子,氧鎓离子。
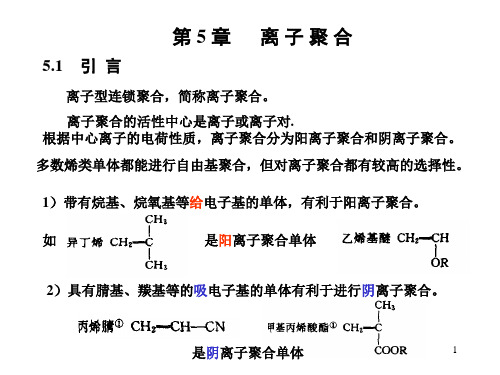
1. 阳离子聚合单体
具有推电子基的烯类单体
A B
+Байду номын сангаас
CH2
CH R
不可能将体系中的杂质完全清除干净
离子对
紧密离子对
在极性溶剂中 可以是
自由离子
疏松离子对
活性次序:自由离子 > 疏松离子对 > 紧密离子对 如:苯乙烯以萘钠引发, 在THF中,kp()= 80 ; kp(-)= 6.5×104 在二氧六环中 kp()= 3.4 l / mol· s l / mol· s
一般是一些含氧氮等杂原子的环状化合物63阴离子聚合的单体引发体系及引发作用引发体系及引发作用碱金属引发碱金属引发lilinanakk外层只有一个价电子容易转移给单外层只有一个价电子容易转移给单体或中间体生成阴离子引发聚合体或中间体生成阴离子引发聚合电子直接转移引发电子直接转移引发阴离子聚合的活性中心是阴离子对于阴离子聚合的活性中心是阴离子对于为金属反离子为金属反离子单体自由基阴离子由亲核试剂碱类提供由亲核试剂碱类提供电子间接转移引发电子间接转移引发碱金属将电子转移给中间体形成自由基阴离子碱金属将电子转移给中间体形成自由基阴离子再将活性转移给单体如再将活性转移给单体如萘钠在萘钠在thfthf中引发中引发ststthf碱金属不溶于溶剂属非均相体系利用率低碱金属不溶于溶剂属非均相体系利用率低绿色绿色红色红色绿色绿色红色红色萘钠在极性溶剂中是均相体系碱金属的利用率高萘钠在极性溶剂中是均相体系碱金属的利用率高金属氨基化合物金属氨基化合物是研究得最早的一类引发剂是研究得最早的一类引发剂主要有主要有nanhnanh22液氨液氨knhknh液氨液氨体系体系有机金属化合物引发有机金属化合物引发形成自由阴离子形成自由阴离子金属烷基化合物金属烷基化合物引发活性与金属的电负性有关
高分子化学第五章

是紧靠活性中心的引发剂碎片,与活性中心 所带电荷相反,称反离子或抗衡离子。
B
A B
是阳离子聚合的引发剂,其中 A 为引发剂 的活性中心
5.2.2 阳离子聚合的单体与催化剂 1. 具有推电子基的烯类单体原则上可进行阳离 子聚合
5.2.2 阳离子聚合的单体与催化剂
1. 1 α-烯烃
乙烯(Ethylene): 无侧基,C=C电子云密度低,对质子亲和力小,难以 阳离子聚合。 丙烯(Propylene)、丁烯(Butylene): 烷基供电性弱,生成的二级碳阳离子较活泼,易发生 重排等副反应,生成更稳定的三级碳阳离子。
5.2.3 阳离子聚合的机理
HMnM
kt (CR)
Mn+1 +
H (CR)
2、链终止:
(1)与反离子加成终止(反离子有足够的亲
CH3 CH 3 C + BF3OH CH3 + CH2 CH3 C CH3 CH3 CH3 C + CH3
CH2
BF 3OH CH3 C
+
-
CH3 CH3 C CH 2 CH3 M CH3 CH3 C CH2 CH3
CH3 C + BF 3OH CH3 CH 3 C CH 3
n
* CH2
-
CH3
CH3 CH2 C CH3 97% r1 =2.5 3% r2=0.4 CH2 CH3 C CH3 98.5% 1.5% n
* 2 CH
CH3 + CH2 C CH CH2
-100℃
CHCl3溶剂
AlCl3 +H2O引发
CH3 C CH CH2 m
5.2.1 研究现况
3、
第5章 离子聚合1(全)
阳离子聚 合单体 重排生成碳阳离子 弱 络合物
这个过程能量高, 比较难于实现。
所以,绝大部分Lewis 酸需要共引发剂(如水)作为质子或 碳阳离子的供给体,才能引发阳离子聚合。
9
B、阳离子引发剂与共引发剂组成阳离子引发体系
阳离子共引发剂有两类: a. 能析出质子的物质,如H2O、 ROH、HX、RCOOH等。 Lewis酸与水生成络合物:
脱去H:- 生成更 稳定的叔C+
叔 C+
Y
+
Y
+
——这也称为异构化聚合或氢转移聚合。
6
5.2.2 阳离子聚合引发体系及引发作用 化学反应中,习惯使用“催化剂”一词,离子聚合反 应的“催化剂”,其碎片进入聚合物,参与反应,因此称 为引发剂或引发体系。 阳离子聚合引发剂都是亲电试剂,常有下列几种: (1)质子酸 (2)Lewis 酸 (3)其它能产生阳离子的物质
12
(3)其它能产生阳离子的物质引发 其它阳离子引发剂(除Lewis酸和质子酸之外)主要有: 碘、氧阳离子、高氯酸盐[CH3CO+(ClO4)-]等,还有电 离辐射。 A、碘: 分子碘通过下列反应引发
阳离子活性中心
I2 + I 2 I+ ( I3 ) -
B、氧阳离子: 环缩醛的阴离子开环聚合(P153)。 C、电离辐射:
阳离子聚合反应通式为: 阳离子聚合单体
阳离子引发剂 式中:A+ 为阳离子活性中心 (一般先由阳离子引发剂提供); M+ 可以是碳阳离子,也可是氧阳离子; B- 是紧靠中心离子的引发剂碎片,称为反离 子或抗衡离子。
3
5.2.1 阳离子聚合的单体
带有给电子基的烯类单体,有利于阳离子聚合,可成为阳离子聚合单体。
高分子物理与化学 第5章 离子聚合

4、工业上生产的产品举例: 等规聚丙烯 PP 高结晶非极性聚合物,熔点176℃,使用上限温 度100~120℃。耐酸、碱和极性溶剂,机械强度高。 透光性和抗冲击性和球晶大小有关,工业上加成核 剂使易于结晶,减小球晶尺寸,提高抗冲击性核透 明度。 聚丙烯有α甲基,叔碳原子上的氢原子易被氧化, 导致断链变脆,温度、光线核机械力可促进氧化进 展,因此制品要加入抗氧剂和抗紫外剂。 一种很好的工程塑料和纤维、薄膜、管道材料。 民用的编织袋、包装绳、丙纶纤维、微波炉饭盒、 保鲜膜等
溶剂对反应有影响,要选择不参于反应的惰
性溶剂,可用卤代烷、二硫化碳、液态二氧 化碳、液态二硫化碳; 水也是影响聚合的因素,非常干燥。阳离子 聚合要在高真空条件进行。 目前,工业化的阳离子聚合的产品不多,主 要是生产成本高,只要自由基聚合能进行的 聚合反应,都不用离子聚合。
目前在生产的产品有; ①丁基橡胶,以异丁烯为单体,和少量异戊二烯或 丁二烯(1.5~4.5%)共聚。共聚单体给分子链提 供双键,以供交联用。 工业上采用淤浆法聚合,氯代甲烷做溶解,可溶解 单体、不溶解聚合物,聚合物成小颗粒沉淀出来, 成淤浆状。 AlCl3和水做引发剂。,聚合温度-100。 丁基橡胶耐候性好,在-50℃仍有柔软性和气密性好 (为天然橡胶的5~11倍)。大部分的丁基橡胶用 于车辆的内胎。 该阳离子聚合反应速度极快,只要一分钟左右就可 完成,采用连续聚合的方式。 ②特殊用途的低聚物(聚合度很低的化合物)
1、单体 可进行配位聚合的单体:α-烯烃,二烯烃 和环烯烃 2、催化剂 分主催化剂、助催化剂、第三组分和载体 主催化剂是周期表中Ⅳ~Ⅷ副族的过渡金 属元素的卤化物和氧卤化物。其中主要钛、 钒、钼、铬、锆的化合物。
助催化剂是周期表中Ⅰ~Ⅲ族的金属的有 机金属化合物,主要有铝、锂、镁、锌的烷 基=芳基化合物活它们的氢化物。 第三组分是具有给电子能力的Lewis碱, 如含N、O、P等的有机化合物。 工业上常用的主催化剂是四氯化钛,真正 使用的是β-三氯化钛,一般由三乙基铝还原 四氯化钛得到;助催化剂为三乙基铝。根据 聚合度的不同一般钛/铝的摩尔比1.0~5.0范 围。用量一般10~70克/升。
高分子化学第05章 聚合方法

聚氯乙烯不溶于氯乙烯单体,因此本体聚合过程中发生 聚合物的沉淀。本体聚合分为预聚合和聚合两段:
9
预聚合:小部分单体和少量高活性引发剂(过氧化乙酰 基磺酰)加入釜内,在50℃ ~70℃下预聚至7%~11%转化率, 形成疏松的颗粒骨架。
2
5.2 本体聚合
本体聚合(Bulk Polymerization):是单体本身在不加溶 剂以及其它分散剂的条件下,由引发剂或直接由光热等作 用下引发的聚合反应。 优点:无杂质,产品纯度高,聚合设备简单。 缺点:体系粘度大,聚合热不易扩散,反应难以控制,易 局部过热,造成产品发黄。自动加速作用大,严重时可导 致暴聚。
39
乳化剂的作用主要有三点: 降低表面张力,使单体分散成细小的液滴 在液滴表面形成保护层,使乳液稳定 增溶作用:形成胶束,使单体增溶 乳化剂能形成胶束的最低浓度叫临界胶束浓度(简称CMC), CMC越小,越易形成胶束,乳化能力越强。
40
亲水亲油平衡值(HLB):衡量表面活性剂中亲水和亲油部分 对水溶性的贡献。其值越大亲水性越大。
32
乳液聚合的缺点 ①需要固体产品时,乳液需经凝聚、洗涤、脱水、干燥等工 序,成本较高 ②产品中留有乳化剂等杂质,难以完全除净,有损电性能等
33
乳液聚合应用
①聚合后分离成胶状或粉状固体产品
丁苯、丁腈、氯丁等合成橡胶;ABS、MBS等工程塑料和抗冲 改性剂;糊用聚氯乙烯树脂、聚四氟乙烯等特种塑料。
12
缺点: 单体浓度较低,聚合速率慢,设备生产能力较低; 单体浓度低和向溶剂链转移使聚合物的分子量降低; 使用有机溶剂时增加成本、污染环境; 溶剂分离回收费用高,除尽聚合物中残留溶剂困难。
第五章-阳离子聚合解读PPT课件

.
28
= Kp / Kt
自终止
.
29
Rtr, M = ktr [HM+ (CR)-] [M] Rp= kp [HM+ (CR)-] [M]
kp
.
30
温度对链转移情况的影响:
向单体溶剂为主 分子量低
向单体转移为主 分子量高
.
31
.
32
(醚、酮、酯等)
.
33
.
34
K = A exp(- E /RT)
.
1
.
2
结构可控
.
3
.
4
.
5
.
6
.
7
(只能自由基和配位聚合) (只能配位聚合)
H H
H H +
C H 2 C H 3
H 3 C+ C H 2 C 重 H 3 排H 3 C+C C H H 3 3
.
8
H
CH3
H
CH3
H
CH3
H
+
H
CH3
.
9
.
10
共聚后体系残留双键供硫化交联
ቤተ መጻሕፍቲ ባይዱ
.
11
.
.
16
快 快难
自由基聚合为慢引发,因.为 Ei = 105~125 KJ/mol
17
H
H C
阳 离 子 聚 合
H
C H 3
H
C H 2 CC H 2C C H 2 C
H C HC H 3 H 3 C
C H H 3 C C H 3
C H 3 H 3 C C H C H 3
.
第5.1-5.2节 阳离子聚合

共引发剂有两类: (1) 析出质子的物质:H2O,ROH,HX,RCOOH 析出质子的物质: ROH,HX, 如:无水BF3不能引发无水异丁烯的聚合,加 无水BF 不能引发无水异丁烯的聚合, 入痕量水,聚合反应立即发生: 入痕量水,聚合反应立即发生:
757
CH2
CH C2H5
791
无取代基, 无取代基,不易 极化, 极化,对质子亲 和力小, 和力小,不能发 生阳离子聚合
质子亲和力较大,有利于反 质子亲和力较大, 应,但一个烷基的供电性不 不快; 强,Rp不快;仲碳阳离子较 活泼,容易重排, 活泼,容易重排,生成更稳 定的叔碳阳离子
H
+
CH2
CH C2H5
A CH3 CH A X CH3 CH X
2. Lewis酸引发 酸引发
Lewis酸从工业角度看,是阳离子聚合最重要 酸从工业角度看, 的引发剂
Lewis酸包括: 酸包括: 酸包括 金属卤化物: 金属卤化物: BF3 , AlCl3, SnCl4 , TiCl4等 金属卤氧化物: 金属卤氧化物 POCl3,CrO2Cl,SOCl2,VOCl3 ,
根据中心离子的电荷性质 碳阳离子 碳阴离子
离子聚合对单体有较高的选择性
带有1,1-二烷基、 带有1,1-二烷基、烷氧基等推电子基的单体才 能进行阳离子聚合; 能进行阳离子聚合; 具有腈基、 具有腈基、羰基等强吸电子基的单体才能进行 阴离子聚合; 阴离子聚合; 带苯基、乙烯基的烯类单体,如苯乙烯、丁二 带苯基、乙烯基的烯类单体,如苯乙烯、 烯等属于共轭体系,既能进行阳离子聚合, 烯等属于共轭体系,既能进行阳离子聚合,也能进 行阴离子聚合; 行阴离子聚合;
高分子化学7(阳离子聚合)

聚合反应分类
根据聚合机理,聚合反应可分为连锁 聚合和逐步聚合。阳离子聚合属于连 锁聚合的一种。
根据聚合物的结构和性能,聚合反应 可分为均聚合、共聚合和嵌段聚合等 。阳离子聚合可用于制备均聚物和共 聚物。
02
阳离子聚合基本原理
阳离子聚合的机理
01
02
03
链引发
引发剂在阳离子作用下形 成活性中心,引发单体聚 合。
高分子化学7(阳离子聚合)
• 引言 • 阳离子聚合基本原理 • 阳离子聚合的单体 • 阳离子聚合催化剂 • 阳离子聚合的影响因素 • 阳离子聚合的应用 • 结论
01
引言
主题简介
01
阳离子聚合是一种通过阳离子引 发的高分子聚合反应,其特点是 聚合过程中聚合物链带有正电荷 。
02
阳离子聚合在工业生产中具有重 要应用,如合成橡胶、塑料、涂 料等。
动力学参数的确定
通过实验数据拟合动力学方程,求得反应速率常数、活化能等动力 学参数。
阳离子聚合的活化能
活化能的概念
01
指引发聚合反应所需的最低能量。
活化能的影响因素
02
引发剂类型、单体类型、溶剂极性等。
活化能与聚合速率的关系
03
活化能越高,聚合速率越快;反之,活化能越低,聚合速率越
慢。
03
阳离子聚合的单体
选择依据
选择催化剂时应考虑其活性、稳定性、毒性等因素,以及聚合物的性能要求和 生产成本等因素。
05
阳离子聚合的影响因素
温度和压力的影响
温度
阳离子聚合反应是放热反应,温度升高会导致聚合速率增加,但同时也会加速聚 合物链断裂,影响聚合物分子量。因此,需要选择适当的温度以获得高分子量聚 合物。
阳离子聚合物的聚合度

链转移的结果,动力学链不终止。
向单体转移终止
ktr,m
HMn HM (CR)
增长活性中心向单体转移,生成含有不饱和端基的聚合 物,同时生成离子对再增长
阳离子聚合的CM(10-2)>>自由基聚合的CM (10-4)
向反离子转移终止-自发終止
kt HMnM (CR)
Mn+1 +
H (CR)
大分子上的H向反离子转移,结果形成未端为不饱和的大分子链, 同时又形成原来的引发剂。
2)动力学链終止
与反离子加成
HMnM (CR)
HMn M (CR)
当反离子亲核性较大时,与碳阳离子结合成共价键,导致链终止; 活性中心与反离子中亲核性较强的共引发组份结合,导致链终止;
添加链终止剂。
但现在也可以作到活性聚合。
四. 阳离子聚合反应动力学
•引发反应非常复杂
聚合速率快,引发和增长几乎同时完成,且反应易受微量杂质 的影响——实验数据重现性差。 快引发、难终止、易转移的特点——很难建立“稳态”假定。 但在特定的反应条件下,仍可采用“稳态”假定
1. 动力学方程(采用低活性引发剂进行分析)
第五章 离子聚合(ionic polymerization)
5.1 引言(introduction)
连锁聚合
自由基聚合
(Chain polymerization) 离子聚合
离子聚合活性中心——离子(ion)或离子对(ionpair)
离子聚合
根据活性中心 的电荷性质
阳离子聚合 阴离子聚合
反应机理及动力学与自由基聚合相比不成熟
如:α—烯烃
乙烯(ethylene):
无侧基,C=C电子云密度低,且不易极化,对质 子亲和力小,难以阳离子聚合。
阳离子聚合

可得自发终止的阳离子聚合速率方程:
Rp=kpc(HMnM (CR) )c(M)
kpkiKc(C)c(HR)c(M)2 Rp = kt
• • ② 成键终止 成键终止动力学方程与自发终止相当,式(4.5)同样适用。 (4.5)
• 式 (4.5) 是假定引发过程中 , 控制引发速率的是配合物与单 体加成生成活性单体的反应,结果聚合速率与单体浓度的二次 方成正比。 • 若
• • •
⒉ 链增长反应 ⑴ 用Lewis酸作引发剂的链增长反应
H CH2
CH3 CH3 C (BF3OH) + n CH2 C CH3 CH3
CH3 CH3 C ]nCH2 C (BF3OH) CH3 CH3
H [ CH2
4.2
阳离子聚合
写成通式:
HMnM (CR)
•
+ M
kp
HMn+1M (CR)
4.2
阳离子聚合
•
⒋ 其它能产生阳离子的物质
• 如卤素中I2、氧翁离子、高氯酸盐[CH3CO(ClO4)]、砷酸盐 [(C6H5)3C(SbCl6)]、[C7H7(SbCl6)]和高能射线等。 • 三、 阳离子聚合反应的机理 • 阳离子聚合也属于连锁聚合的范畴。 • 聚合的全过程也分为链引发、链增长、链终止和链转移等基 元反应。 • ⒈ 链引发反应 • 链引发反应是形成增长活性中心的过程。 • 链引发反应随所用引发剂、单体及反应条件的不同,引发机 理有很大的差别。 • ⑴ 用含氢酸引发 CH3 CH3 • H A + CH2 C H CH2 C A CH3 CH3
CH2 O O CH2 O
三聚甲醛
O H C H
甲醛
O
CH2 CH2
高分子化学第5章--离子聚合

第5章离子聚合(Ionic Polymerization)【掌握内容】1阳离子聚合常见单体与引发剂、阳离子聚合离子对平衡式及其影响因素。
2阴离子聚合常见单体与引发剂、活性阴离子聚合聚合原理、特点及应用。
3阴离子、阳离子聚合、自由基聚合的比较【教学难点】1. 阳离子聚合聚合机理。
2. 阴阳离子对平衡式影响规律。
3. 活性阴离子聚合条件、特点及其应用。
5.1 引言离子聚合的理论研究开始于五十年代.1953年,Ziegler在常温低压下制得PE; 1956年,Szwarc 发现了“活性聚合物”.离子聚合有别于自由基聚合的特点:根本区别在于聚合活性种不同离子聚合的活性种是带电荷的离子:通常是碳阳离子\碳阴离子离子聚合对单体有较高的选择性:带有1,1-二烷基、烷氧基等推电子基的单体才能进行阳离子聚合; 具有腈基、羰基等强吸电子基的单体才能进行阴离子聚合;羰基化合物、杂环化合物,大多属离子聚合 .聚合机理和动力学研究不如自由基聚合成熟原因:聚合条件苛刻,微量杂质有极大影响,聚合重现性差;聚合速率快,需低温聚合,给研究工作造成困难;反应介质的性质对反应也有极大的影响,影响因素复杂。
5.2 阳离子聚合5.2.1. 阳离子聚合单体具有推电子基的烯类单体原则上可进行阳离子聚合从两方面考虑:推电子基团使双键电子云密度增加,有利于阳离子活性种进攻碳阳离子形成后,推电子基团的存在,使碳上电子云稀少的情况有所改变,体系能量有所降低,碳阳离子的稳定性增加。
能否聚合成高聚物,还要求:质子对碳-碳双键有较强的亲合力;增长反应比其它副反应快,即生成的碳阳离子有适当的稳定性。
两个甲基使双键电子云密度增加很多,易与质子亲合,820 kJ / mol。
生成的叔碳阳离子较稳定,可得高分子量线型聚合物。
亚甲基上的氢,受四个甲基的保护,不易夺取,减少了重排、支化等副反应;是唯一能进行阳离子聚合的a-烯烃。
5.2.2. 阳离子聚合引发体系及引发作用阳离子聚合的引发剂都是亲电试剂,即电子接受体阳离子聚合的引发方式:引发剂生成阳离子,引发单体生成碳阳离子;电荷转移引发,即引发剂和单体先形成电荷转移络合物而后引发。
高分子化学(上海交大) 第5章 离子聚合

5.2.4 阳离子聚合反应动力学
• 阳离子聚合体系总伴有共引发剂,使得反应体系 复杂化,微量的共引发剂或杂质对聚合速率影响 巨大; • 离子对和自由离子共存,两者影响难以区分; • 聚合速率极快,引发和增长几乎同时完成,数据 重现性差; • 难确定真正的终止反应,稳态假定不一定适用等;
一、聚合速率:
k p [M ]
丁基橡胶: 在CH3Cl溶剂中低温聚 合,是向单体链转移 还是向溶剂链转移, 这受聚合温度控制。 低于 -100℃,主要 向单体转移终止;高 于-100℃,主要向溶 剂转移终止。见左图5 - 2。
BF3 H2O X CH2 C Y H+(BF3OH)H+(BF3OH)X [ CH2 C H+(BF3OH)- ] Y X
+ CH2 C (BF3OH)
Y
阳离子引发剂共有两类: 1、质子供体:如H2O, ROOH, HCl, RCOOH, HX等; 2、碳阳离子供体,如RCl, RCOX, (RCO)2O, ROR等; 两者的共引发作用如下:
参照自由基聚合,阳离子聚合物的聚合度为:
kt 1 [S ] CM CS [M ] X n k p [M ]
单基终止时:
Xn
Rp Rt
k p [M ] kt
向单体转移时:
Xn
Rp Rtr,M
kp ktr,M
1 CM
向溶剂转移时: X n
Rp Rtr,S
1 [M ] ktr,S [S ] CS [S ]
1、聚合条件苛刻,微量水﹑空气和杂质有影响, 实验重现性差。 2、聚合速率快,需低温。 3、引发体系常常非均相。 4、反应介质影响大。 丁基橡胶﹑异戊橡胶﹑聚甲醛﹑聚氯醚等重 要聚合物只能通过离子聚合制备。制备嵌段共聚 物,离子聚合也起重要作用。
高分子化学第五章离子聚合打印稿

3、 链转移反应
链转移反应是阳离子聚合中常见的副反应
(i)向单体链转移:增长链碳阳离子以H+形式脱 去β-氢给单体,这是阳离子聚合中最普遍存在的也 是难以抑制的内在副反应:
C H 2 C H 2 X + H 2 C C H C H C H + H 3 C C H X
P h
P h
P h P h
由于H+引发通常得到低分子量的产物,因此脱H+链 转移易导致聚合产物分子量的下降和分子量分布变 宽,是不希望发生的副反应,可通过添加Lewis碱加 以抑制。
5.1 阳离子聚合
环内双键也可进行阳离子聚合:
一、单体
O
苯并呋喃
茚
-蒎烯 二聚戊二烯
CH2=CH(NRR’)和CH2=CHOR由于N和O原子上 的未成对电子能与双键形成p-π共轭,使双键电子 云密度增大,因而特别活泼。
5.1 阳离子聚合
一、单体
(2)异核不饱和单体R2C=Z,Z为杂原子或杂原 子基团;如醛RHC=O,酮RR’C=O(丙酮除外, 因其最高聚合温度为-273 oC),硫酮RR’C=S, 重氮烷基化合物RR’CN2等。
紧 对
松 对
离解程度增加
反应活性增加
5.1 阳离子聚合
一般特性:链增长活性中心多样化;单体 与引发剂之间存在选择性;无双基终止。
一、单体
(1)带给电子取代基的烯烃 如偏二烷基取代乙烯 CH2=CRR’ 共轭双烯CH2=CR-CH=CH2 芳环取代乙烯CH2=CHAr (π+n)给电子取代乙烯 CH2=CH(NRR’) 烷基乙烯基醚CH2=CHOR
一般质子酸(如H2SO4,HCl等)由于生成的抗衡 阴离子SO42-、Cl-等的亲核性较强,易与碳阳离子 生成稳定的共价键,使增长链失去活性,因而通 常难以获得高分子量产物;
第五章 阳离子聚合及其应用ppt课件

• 应用:
– 低分子量和中分子量聚异丁烯可以用作油品添 加剂、胶黏剂、密封剂、涂料、润滑剂、增塑 剂和电缆浸渍剂等 – 高分子量聚异丁烯可用作塑料、生胶、热塑性 弹性体的添加剂
• 聚苯:
AlCl3-H2O-CuCl2
n
• 氯醇胶(环氧氯丙烷阳离子开环聚合)
* OCH CH2Cl H2 C
* OCH CH2Cl H2 C
CH3 CH2 CH CH CH3
R+
CH3 RCH2 H C+ CH CH3 RCH2
CH3 H2 C C+ CH3
CH3
H2C
CH3 H2 C C CH3
H2C
CH3
H2 C
H2 C C
H2 C
H2 C C CH3
结晶聚合物
CH3
CH3
H2 C
CH3 CH
CH H2 C
H2 C C
H2 C C CH3
主要内容
①负离子聚合特征 ②主要产品介绍
③活性聚合体系
阳离子聚合
阳离子聚合的本质:
– 亲电试剂(活性中心)进攻双键或亲电化合物。 – 活性中心活泼。
阳离子聚合
• 阳离子聚合特征
• 碳正离子的特点:
H H C+ H
甲基正离子
H R C+ H
伯碳正离子
R R C+ H
仲碳正离子
R R C+ R
叔碳正离子
CH3 I-CH2 C
+
CH3
• 苯乙烯及其衍生物
苯环的共轭效应,若带有供电基团,无疑增加单体活性。
CH2 CH CH2 CH CH2 > N H3C CH3 OCH3 > CH3 C > CH2 CH
高分子化学第5章离子聚合

CH3 重排通常是通过电子或个别原子的转移进行的。
这种通过增长链碳阳离子发生重排的聚合反应称为 异构化聚合。
CH CH3 CH3
CH2 CH2 C
③链转移和链终止
离子聚合的增长活性中心带有相同的电荷,不能双分 子终止,只能发生链转移终止或单基终止。 这一点与自由基聚合显著不同。ຫໍສະໝຸດ 动力学链不终止(链转移反应)
HA
H A
H A
CH X CH3 CH A X
+ CH2
条件
酸要有足够的强度产生H+,故弱酸不行 酸根的亲核性不能太强,否则会与活性中 心结合成共价键而终止,如
A CH3 CH A X CH3 CH X
不同质子酸的酸根的亲核性不同
氢卤酸的X-亲核性太强,不能作为阳离子聚合引 发剂,如HCl引发异丁烯:
如:无水BF3不能引发无水异丁烯的聚合,加入痕 量水,聚合反应立即发生:
BF3 + H2O
CH3 CH2 C + H (BF3OH) CH3
H (BF3OH)
CH3 CH3
引发剂共引发剂 络合物
C (BF3OH) CH3
对于析出碳阳离子的情况:
SnCl4 + RX
CH3 CH2
R (SnCl5)
H
+
CH2
CH C2H5
CH3 CH C2H5
(CH3)3C
故丙烯、丁烯阳离子聚合只能得到低分子油状物
CH3 CH2 C CH3
CH3 CH2 C CH3 CH2
两个甲基使双键电子云密度增加很多, 易与质子亲合; 生成的叔碳阳离子较稳定,可得高分子 量的线型聚合物。
第五章离子聚合(ionicpolymerization)

第五章离子聚合(ionic polymerization)【课时安排】5.1 引言20分钟5.2 阳离子聚合2学时30分钟5.3 阴离子聚合3学时5.6 开环聚合2学时总计8学时【掌握内容】1阳离子聚合常见单体与引发剂2阳离子聚合聚合机理3阳离子聚合离子对平衡式及其影响因素4阴离子聚合常见单体与引发剂5阴离子聚合聚合机理6活性阴离子聚合聚合原理、特点及应用7阴离子、阳离子聚合、自由基聚合的比较【熟悉内容】1. 假阳离子聚合、异构化聚合。
2. 阴离子聚合的自发终止;溶剂、温度与反离子对反应的影响。
【了解内容】1. 阳离子聚合动力学。
2. 其它类的活性聚合。
【教学难点】1. 阳离子聚合聚合机理。
2. 阴阳离子对平衡式影响规律。
3. 活性阴离子聚合条件、特点及其应用。
【教学目标】1. 掌握阴阳离子聚合相关基本概念。
2. 掌握阴阳离子聚合常见单体与引发剂及聚合反应特点。
3. 能按规范写出正确的阴阳离子聚合引发反应式、聚合机理、应用反应式。
4. 运用计量聚合进行简单计算。
5.1 引言5.2 阳离子聚合【教学内容】5.1 引言5.2 阳离子聚合5.2.1 单体5.2.2 引发剂(亲电试剂)5.2.3 聚合机理5.2.4 聚合反应影响因素及特点5.2.5 工业化品种【授课时间】3学时30分钟【教学重点】阳离子聚合常见单体与引发剂;聚合反应特点;离子对平衡式及其影响因素【教学难点】阳离子聚合聚合机理;离子对平衡式影响规律【教学目标】1 掌握阳离子聚合常见单体与引发剂及聚合反应特点2 能正确写出阳离子聚合引发反应式、异丁烯等阳离子聚合机理 3能综合分析影响聚合反应速率的因素 【教学手段】课堂讲授,多媒体 【教学过程】 5.1 引言 一 定义单体在引发剂作用下按离子历程聚合得到大分子的过程 二 特点1反应条件苛刻 2聚合速率快3离子活性高,反应介质影响大 三 意义1.将难以自由基方式聚合的单体,以离子聚合方式合成新产品2.同一单体通过自由基和离子聚合得到的产物的结构与性能不同3.可设计5.2 阳离子聚合 发展历史 反应通式 R-X →R -X +5.2.1 单体一 要求:足够亲核性,足够活性,一定稳定性 二 主要种类1带推电子取代基的乙烯基单体—异丁烯 2共轭烯烃—苯乙烯,丁二烯,异戊二烯 3含有带独电子杂原子的单体--烷基乙烯基醚 三活性比较 烷基乙烯基醚»异丁烯›苯乙烯›异戊二烯›丁二烯 5.2.2 引发剂(亲电试剂)一 要求:足够亲电性,反离子亲核性弱 二 种类1质子酸:其引发阳离子为离解产生的质子H + (1)组成:无机酸:H 2SO 4, H 3PO 4等有机酸:CF 3CO 2H, CCl 3CO 2H 等超强酸: HClO 4 , CF 3SO 3H, ClSO 3H 等 (2)活性:反离子亲核性对活性有较大影响 HX t-BuX H 2SO 4,H 3PO 4 二,三聚体R X +H 2C CHYR CH 2CH Y X 单体聚合抗衡阴离子HClO 4,CF 3COOH,HSO 3Cl 聚合物(几千分子量,用作润滑剂,燃料等) (3)采用质子酸获取高分子量聚合物需考虑 2 路易斯酸体系组成 (1)组成: ①引发剂 a.质子给体: b.阳离子给体: c.卤素:②助引发剂(酸性越强,活性越大)a.金属卤化物: BF 3>AlCl 3>TiCl 4>SnCl 4b.有机金属化合物 AlCl 3> AlRCl 2> AlR 2Cl> AlR 3c.卤氧化合物 POCl 3,CrO 2Cl,SO 2Cl,VOCl 3 (2)反应式H +[BF 3OH]-+CH 2=C(CH 3)2五元环过渡态 (CH 3)3C + [BF 3OH]-SnCl 4+H 2O 。
阳离子聚合 应用部分

阳离子聚合工业化产品及其应用烯烃或杂环单体通过阳离子聚合得到的工业化产品达到36种以上,总产量接近3000kt/a。
其中,聚异丁烯和丁基橡胶是主要产品。
一、聚异丁烯1873年,首次由强酸引发异丁烯经阳离子聚合得到低聚物。
1931年,德国的一家公司采用BF3在低温下引发异丁烯阳离子聚合反应得到高分子量聚异丁烯,引发工业兴趣。
性质:1、气密性聚异丁烯具有优异的气密性。
2、溶解性聚异丁烯可溶于脂肪烃、芳香烃、汽油、矿物油、二硫化碳中;部分溶于高级的醇类(如正丁醇)和酯类,或在醇、醚、酯、酮类等溶剂以及动植物油和油脂中溶胀,溶胀程度随溶剂碳链长度增加而增大。
3、粘弹性在玻璃化转变温度T g以上,分子链缠结而形成分子网络,因而高分子量聚异丁烯在拉伸强度、弹性、回弹性、弹性记忆、电性能、溶解性能等方面与天然橡胶相似。
4、稳定性聚异丁烯是化学惰性很强的聚合物之一,可以耐强酸碱物质。
聚异丁烯热稳定性好,可在140~200℃下加工,分子量基本不变。
生产工艺与流程①原材料的提纯与精制;②引发体系配制,引发体系通常由BF3和H20组成;③聚合反应;④引发活性中心的破坏和清除;⑤脱气与聚合物纯化;⑥未反应组分(单体、溶剂)的回收再利用。
应用:1、油品及其添加剂相对分子质量为200~500的异丁烯低聚物,可以用作高校润滑冷却流体和乙烯压缩机的润滑油,其性能优于流动石蜡油和矿物油。
此外还可作为润滑油添加剂,在车辆系统中作为传动液。
2、胶黏剂具有天然粘性和稳定性的浅色聚异丁烯是胶黏剂的理想成分,其中低分子量聚异丁烯贡献粘性,高分子量聚异丁烯贡献强度和抗流动性。
基于聚异丁烯的胶黏剂,可用于粘结木材、金属、玻璃等。
3、嵌缝和密封材料聚异丁烯具有优异的气密性、水密性、抗老化性和粘合性能,是制备高质量嵌缝和密封材料的粘接组分。
低分子量聚异丁烯作为热流动性密封剂,广泛用于建筑、车辆、冰箱等方面,特别是在军工方面可以作为穿甲弹的密封剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 聚异丁烯
– 低分子量聚合物
– 高分子量聚合物
• 应用:
– 低分子量和中分子量聚异丁烯可以用作油品添 加剂、胶黏剂、密封剂、涂料、润滑剂、增塑 剂和电缆浸渍剂等
– 高分子量聚异丁烯可用作塑料、生胶、热塑性 弹性体的添加剂
• 聚苯:
AlCl3-H2O-CuCl2
H2 H2
H2C C C C C C C C C
结晶聚合物
CH3
c.易发生连转移反应 d.消除反应
CH3
CH3
CH3
H2
H2
H2C C C C
H2
CH C
CH3 H2 CC
CH3 CH
H3C
CH3
CH3
橡胶状聚合物
阳离子聚合
• 聚合体系
– 单体 – 引发剂 – 溶剂
阳离子聚合
• 正离子聚合特征——聚合单体
CH2 CH >
阳离子聚合
• 聚合单体
CH2 CH O
O CO CH3
CH2 CH O
O H2C
COOEt
CH2 CH O O CO
CH2 CH O O
HC (COOEt )2
阳离子聚合
• 引发剂
– 物理方法:辐射能;电能 – 化学方法: – (1)质子酸(HA)
引发条件:HA能够离解;H+碳碳双键有足够 的亲核力;形成的碳正离子有一定的稳定性;反 离子亲核性小
聚合物合成
与制备
之
阳离子聚合及其应用
韩丙勇 2020/3/26
主要内容
①负离子聚合特征 ②主要产品介绍 ③活性聚合体系
阳离子聚合
阳离子聚合的本质:
– 亲电试剂(活性中心)进攻双键或亲电化合物。 – 活性中心活泼。
阳离子聚合
• 阳离子聚合特征
• 碳正离子的特点:
H H C+
H
甲基正离子
H R C+
例如:硫酸引发松节油转变成树脂
阳离子聚合
• 引发剂
– 稳定的碳正离子:
+
C+
反离子有:ClO4-; SbCl6-; BF4-; SnCl5-
仅适用于活性较高的单体
阳离子聚合
• 引发剂
– 以阳离子源/路易斯酸为基础的引发剂
• 阳离子源:H2O; 有机羧酸叔酯;有机叔醇;有机叔 醚;有机叔卤代物等
• 路易斯酸:如BCl3 ; AlCl3等
n
• 氯醇胶(环氧氯丙烷阳离子开环聚合)
H2 * OCH C
CH2Cl
CO
H2
H2
H2
H
*
OCH C n OCH2 C m * *
OCH C n OCH2 C m *
CH2Cl
CH2Cl
OCH2CH CH2
ECO
GCO
H2
H2
*
OCH C n OCH2 C m OCH2
• 石油树脂
CH2Cl
C5树脂; C9树脂
GECO
H
C q*
OCH2CH CH2
阳离子聚合
• 活性聚合体系
– 1). HI/I2引发剂体系
• 单体:异丁基乙烯基醚(IBVE)
– 2). HI/ZnX2 – 3). 一元磷酸酯/ZnX2
THANKS
Any more information please give some questions
>
>
>
N H3C CH3
OCH3
阳离子聚合
• 聚合单体
• 异丁烯
CH3 CH3 C CH2
I-CH2
CH3 C CH3
+
• 苯乙烯及其衍生物
苯环的共轭效应,若带有供电基团,无疑增加单体活性。
阳离子聚合
• 聚合单体
CH2 CH
CH2 CH
> N H3C CH3
– 乙烯基醚
OCH3
CH3 CH2 C >
δ-
δ+
CH2=CH
R 共轭效应(推电 子能力促进聚 合反应)
关注:推电子能力对聚合反应的影响
阳离子聚合
• 聚合单体
• 异丁烯
CH3 CH3 C CH2
• 苯乙烯及其衍生物
I-CH2
CH3 C CH3
+
苯环的共轭效应,若带有供电基团,无疑增加单体活性。
CH2 CH
CH2 CH
CH3 CH2 C
CH2 CH
丁基胶
合成工艺:溶液法(淤浆聚合)
应用:40%轮胎相关产品
种类:低分子量(300-16000);中分子量(20000-45000);高分 子量(75000-600000);超高分子量(760000)
性能特点:
• 气密性:
• 稳定性
• 卤化丁基橡胶
– 品种:氯化丁基胶(chlorobutyl、rubber),氯含 量1.1-1.3%;溴化丁基胶(bromobutyl rubber) 溴含量1.9-2.1%
阳离子聚合
• 溶剂
– 作用:聚合热的散发;提供反应介质 – 要求:不与活性种强烈络合或反应;极性适中;
聚合物的溶液粘度低;保证均相;容易脱除 – 常用:二氯甲烷;氯甲烷;乙烯;乙烷等
阳离子聚合
• 工业产品
• 丁基橡胶:异丁烯和异戊二烯(1.5~4.5%)的
共聚物
CH3
CH3
AlCl3
CH3 C CH2 + CH = CH CH = CH2 CH3Cl, -100OC
H
伯碳正离子
R R C+
H
仲碳正离子
R R C+
R
叔碳正离子
a.活性大,寿命短 (总反应活化能一般在-42~60kJ/mol (加成反应) )
阳离子聚合
• 正离子聚合特征
CC
+
R
+
CC R
CC
+
H
+
CC H
稳定正离子的方法
G C+
吸电基团使正离 子不稳定
CC
+
R
烷基迁移
CC
+
H
负氢迁移
G C+
推电基团使正离 子稳定
例如:3-甲基-1-丁烯在低于-100℃聚合产生负氢离子迁移的异构化现象,得 到结构规整的结晶聚合物; -100℃ 以上聚合得到重排与非重排结构共存的 橡胶状聚合物
CH3 CH2 CH CH R+
CH3
RCH2
CH3 H C CH
+
CH3
CH3
RCH2
H2 C
C+
CH3
CH3ቤተ መጻሕፍቲ ባይዱ
CH3
CH3
H2
H2 H2
