化学平衡综合测试题
第二章“化学反应速率和化学平衡”综合测试题

.
—
( ) 8为 s : , 9 图 1 4图 i 一 图 、 0所示硅酸盐 o
离子 的符 号 — — 、 — — . () 1 5 由 3个 正 四 面 体 结 合 成 的环 状 结 构
() u + i; + H 0= u O ) + 3 c s 一 2 2 C ( H 2 o
因
— —
顶点 , 个 四面体与另外的 四面体共享 3个顶 y 点.
由硅原 子 守恒得 : Y=1 + 3
,
通 入 C 2能 使 溶 液 的 O
红 色褪 色, 离子方 程 式
.
( ) 某 些 盐 混进 硅 酸 钠 溶 液 时 , 会 向 3将 盐 上扩散 长成很 漂 亮 的树 状 , 树 会 保 留金 属 离 且
中 , 用 催化剂 的 目的是 ( ) 使
・
2将 2 o 气体 A和 3 o 气 体 B在一 . at l o at l o
定 条件 下发 生 反 应 : g A( )+3 g # 2 g , B( ) C( )
化
( C)气 体 的平 均 摩 尔 质 量 不 随 时 间 变 化
一
3在一定条 件下 , . 已达 平 衡 的 可 逆 反 应 : 2 g A( )十B g 2 ( ) 下 列 说 法 中正 确 的是 () c g ,
( )
定量 的 0 , 生下 列 反应 : S g 2发 2 0 ( )+0 ( ) 。 g 2 O ( ) 当 反应 进 行 到 4 r n时 , 得 S S ,g , i a 测 O
由氧原子守恒得: + = 7 3 ÷y 3
解 得 : 9 Y= . : , 4
子 的特征 颜 色, 如 : u O 5 O和 N 2i 3 例 C S 4・ H2 aSO
(完整版)化学平衡练习题及答案

化学平衡练习题一、是非题,以下各题的表达可否正确,对的画√错的画×1、 对于理想气体反应,等温等容下增加惰性组分时平衡不搬动。
( )O2、指定状态下的r G或B B 就是定温定压下G ~ 曲线上某一点切线的斜率。
()B3、化学反应达到平衡时,反应的摩尔吉布斯函数 r G m =0。
()4、恒 T 、p 、W ˊ=0 下,化学反应的平衡条件为: rGmB B 0 。
()5、某一反应在等温等压且可是体积功的条件下 rGm0 ,则该反应不能够正向进行。
( )6、理想气体化学反应A( g)B( g)C ( g) ,在恒温下增大总压时,反应物转变率将增大。
( )7、对理想气体反应: 0 =B B ,在定温定压下当 B >0 时,随着惰性气体的加入而平衡向右搬动。
()8、由 r G =-RTlnK ,因为 K 是平衡常数,所以 r G是化学反应达到平衡时的摩尔吉布斯函数变化值。
()9、等温等压且不涉及非体积功条件下,所有吸热且熵减小的反应,均不能够自动发生。
( )10、 对于B的理想气体反应,等温等压下增加惰性组分时平衡不搬动。
( )B11、标准平衡常数变了,平衡必然会搬动。
反之,平衡搬动了,标准平衡常数必然会改变。
()(χeq) Bx12、对理想液态混杂物中的反应,标准平衡常数 K ( T )≈ B。
( )BK 13、任何一个化学反应都能够用标准摩尔吉布斯函数来判断反应的方向。
()14、某反应的平衡常数是一个不变的常数。
( )15、在必然温度和压力下, 某反应的 r G 0,所以要采纳合适的催化剂, 使反应得以进行。
()二、选择题1、温度高升时,固体氧化物的分解压力(分解反应是吸热反应):( )。
( 1)降低;(2)增大;( 3)恒定;(4)无法确定。
12、 HgO(s)的标准摩尔生成吉布斯函数f G为 - 58.52 kJ ·mol -1,其分解反应为: 2HgO(s) == 2Hg(l) + O 2(g),HgO(s)在 298K 的分解压力是:( )。
高三化学化学平衡试题答案及解析

高三化学化学平衡试题答案及解析1.可逆反应mA(g)+nB(s)rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分含量和温度T 或压强P关系如图所示,下列叙述中正确的是A.温度降低,化学平衡向正反应方向移动B.使用催化剂,D的物质的量分数增加C.化学方程式系数m+n = r+qD.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动【答案】A【解析】A.由左图知,温度T2为先到达平衡,故T2>T1,升高温度,升高温度,D%减小,则平衡向逆反应移动,A正确;B.使用催化剂,缩短到达平衡时间,平衡不移动,D%的不变,B错误;C、由右图可知,压强为P2先到达平衡,故P2>P1,增大压强,D%不变,则平衡不移动,反应中B为固体,故m=r+q,C错误;D.B为固体,物质B的颗粒越小,接触面积越大,反应越快,但对平衡移动没有影响,D错误.【考点】考查化学平衡的移动,化学平衡的影响因素,化学评横的图像等知识。
2.(14分)中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。
因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:NH SO NO-5-5-5根据表中数据计算PM2.5待测试样的pH =。
(2) NOx 是汽车尾气的主要污染物之一。
汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:① N2(g)+O2(g)2NO(g)△H=。
②当尾气中空气不足时,NOx 在催化转化器中被还原成N2排出。
写出NO被CO还原的化学方程式。
③汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现?。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:①用离子方程式表示反应器中发生的反应。
化学平衡练习题带答案
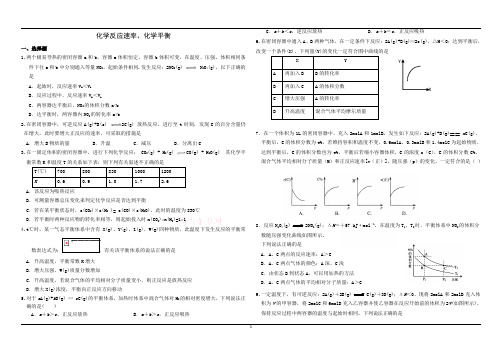
化学反应速率、化学平衡一、选择题1.两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在温度、压强、体积相同条件下往a和b中分别通入等量NO2,起始条件相同.发生反应:2NO2(g) N2O4(g),以下正确的是A.起始时,反应速率V a<V bB.反应过程中,反应速率V a<V bC.两容器达平衡后,NO2的体积分数a<bD.达平衡时,两容器内NO2的转化率a>b2.在密闭容器中,可逆反应A(g)+B(s) 2C(g) 放热反应,进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是A.增大B物质的量 B.升温 C.减压 D.分离出C3.在一固定体积的密闭容器中,进行下列化学反应: CO2(g) + H2(g) CO(g) + H2O(g) 其化学平衡常数K和温度T的关系如下表:则下列有关叙述不正确的是T(℃) 700 800 830 1000 1200K0.6 0.9 1.0 1.7 2.6A.该反应为吸热反应B.可测量容器总压变化来判定化学反应是否达到平衡C.若在某平衡状态时,c(CO2)×c(H2 )= c(CO)×c(H2O),此时的温度为830℃D.若平衡时两种反应物的转化率相等,则起始投入时n(CO2):n(H2)=1:14.t℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:,有关该平衡体系的说法正确的是A.升高温度,平衡常数K增大B.增大压强,W(g)质量分数增加C.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应D.增大X(g)浓度,平衡向正反应方向移动5.对于a A(g)+b B(g) c C(g)的平衡体系,加热时体系中混合气体对H2的相对密度增大,下列说法正确的是( )A.a+b>c,正反应放热B.a+b>c,正反应吸热C.a+b<c,逆反应放热D.a+b=c,正反应吸热6.在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)2c(g),△H<0;达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是X YA 再加入B B的转化率B 再加入C A的体积分数C 增大压强A的转化率D 升高温度混合气体平均摩尔质量7.在一个体积为1L的密闭容器中,充入2molA和1molB,发生如下反应:2A(g)+B(g)==x C(g),平衡后,C的体积分数为w%,若维持容积和温度不变,0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数也为w%。
化学平衡经典试题(附答案).doc

化学平衡经典试题(附答案)1.恒温、恒压下, a mol A 和 b mol B 在一个容积可变的容器中发生如下反应:A(g) +2B(g) 2C(g) ,一段时间后达到平衡,生成n mol C .则下列说法中正确的是( )A.物质 A、 B 的转化率之比为a∶bnB.起始时刻和达到平衡后容器中的压强比为(a +b) ∶(a + b- )2C.若起始时放入2a mol A和2b mol B,则达到平衡时生成2n mol CD.当 v 正 (A) = 2v 逆 (B) 时,可确定反应达到平衡解析:生成 n mol C 时参加反应的A、 B 的物质的量分别为n/2 mol 、 n mol ,转化率之比为n n bC 的量也成倍地增加;反应∶ =;恒温、恒压过程成倍地增大反应物的量,则平衡时2a b 2a速率之比等于化学计量数之比,当2v 正 (A) = v 逆(B) 时,可确定反应达到平衡.答案: C2.在一个容积为 VL 的密闭容器中放入:2L A(气 ) 和 lL B(气 ), 在一定条件下发生下列反应:13A( 气 )+B( 气 ) nC(气 )+2D( 气 ) 达到平衡后, A 物质的量浓度减少2,混合气体的平均摩1尔质量增大8,则该反应的化学方程中n 的值是( )A. 1 B . 2 C . 3 D . 43. ( 2011 四川)可逆反应① X(g)+2Y(g) 2Z(g) 、② 2M( g)N( g)+P(g) 分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。
反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是A.反应①的正反应是吸热反应B. 达平衡( I )时体系的压强与反应开始时体系的压强之比为14:15C.达平衡( I )时, X 的转化率为511D. 在平衡(I )和平衡(II )中M的体积分数相等4.反应 mA(固) +nB(气)pC(气)+Q在一定温度下的关系如图2-11 所示,下列叙述中正确的是()B 的体积分数(B%)与压强变化①m+n> P;②x 点表示该反应的正反应速率大于逆反应速率;③n>p;④x 点比y 点时的反应速率慢。
高三化学化学平衡练习题及答案

高三化学化学平衡练习题及答案化学平衡是高中化学学习中重要的概念之一,它描述了化学反应中各种物质的浓度、压力以及化学反应速率之间的关系。
通过化学平衡的学习,我们可以深入了解反应物和生成物之间的相互转化及其动力学特性。
为了帮助同学们更好地掌握化学平衡的知识,以下是一些高三化学平衡的练习题及相应的答案。
练习题一:1. 下列反应哪个是属于平衡反应?A. HCl + NaOH → NaCl + H2OB. 2O3 → 3O2C. N2 + 3H2 → 2NH3D. CaCO3 → CaO + CO22. 对于下列反应,哪个条件能够增加产物的生成?A. 增加反应温度B. 减少反应物浓度C. 增加反应物浓度D. 增加反应体系的压力3. 在反应N2 + 3H2 ⇌ 2NH3中,正确描述下列哪项?A. 该反应是放热反应B. 正向反应速率等于反向反应速率C. 反应后体系中氨气的浓度将降低D. 反应后体系中氢气的浓度将增加4. 对于反应H2 + Br2 ⇌ 2HBr,以下哪个条件会偏向生成反应物(HBr)?A. 增加反应温度B. 减少反应物浓度C. 增加反应物浓度D. 增加反应体系的压力答案:1. C2. A3. C4. C练习题二:1. 环状反应A ⇌ B ⇌ C中,正向反应的平衡常数为K1,反向反应的平衡常数为K2。
那么下列哪个等式为真?A. K1 = K2B. K1 > K2C. K1 < K2D. 无法确定2. 以下哪个因素不会影响反应平衡的位置?A. 反应物浓度B. 温度C. 压力D. 储存时间3. 什么情况下可以利用Le Chatelier原理来预测平衡位置的变化?A. 改变反应物的总量B. 改变反应温度C. 改变反应的催化剂D. 改变反应物的种类4. 根据Le Chatelier原理,当体系中压力升高时,会对平衡位置产生怎样的影响?A. 偏向生成较少分子数的物质B. 偏向生成较多分子数的物质C. 不会对平衡位置产生影响D. 无法确定答案:1. A2. D3. A4. A以上是高三化学平衡练习题及答案。
化学中的化学平衡常数测试题

化学中的化学平衡常数测试题在化学的世界里,化学平衡常数就像是一把神奇的钥匙,能够帮助我们打开理解化学反应限度的大门。
为了更好地掌握这一重要概念,让我们一起来通过一些测试题来加深对它的理解和运用吧!一、选择题1、对于反应 3A(g) + B(g) ⇌ 2C(g),在一定温度下达到平衡时,若C²/(A³ × B) = K,则下列说法正确的是()A K 越大,表明正反应进行的程度越大B 增大压强,K 值增大C 升高温度,K 值增大D 增加 A 的量,K 值增大答案:A解析:K 是化学平衡常数,它只与温度有关。
K 值越大,说明生成物的浓度越大,反应物的浓度越小,正反应进行的程度越大,A 选项正确;压强和浓度的改变不会影响 K 值,B、D 选项错误;对于吸热反应,升高温度 K 值增大,对于放热反应,升高温度 K 值减小,C 选项未说明反应的热效应,无法确定 K 值的变化。
2、已知反应 2NO(g) + O₂(g) ⇌ 2NO₂(g) 的平衡常数为 K₁,2NO₂(g) ⇌ N₂O₄(g) 的平衡常数为 K₂,则反应 2NO(g) + O₂(g) ⇌N₂O₄(g) 的平衡常数 K 为()A K₁+ K₂B K₁ K₂C K₁ × K₂D K₁/ K₂答案:C解析:对于多个反应组合而成的总反应,其平衡常数等于各分步反应平衡常数的乘积。
第一个反应乘以 1/2 加上第二个反应,得到总反应,所以总反应的平衡常数 K 为 K₁ × K₂。
3、在一定温度下,可逆反应 A(g) + 3B(g) ⇌ 2C(g)达到平衡的标志是()A C 生成的速率与 C 分解的速率相等B 单位时间内生成 n mol A,同时生成 3n mol BC A、B、C 的浓度不再变化D A、B、C 的分子数之比为 1 : 3 : 2答案:AC解析:C 生成的速率与 C 分解的速率相等,说明正逆反应速率相等,达到平衡,A 选项正确;单位时间内生成 n mol A,同时生成 3n mol B,都是逆反应方向,不能说明达到平衡,B 选项错误;各物质浓度不再变化,说明达到平衡,C 选项正确;A、B、C 的分子数之比为 1 : 3 :2 ,不一定是平衡状态,与初始投料和反应条件有关,D 选项错误。
化学平衡试题类型及答案

化学平衡试题类型及答案一、选择题1. 下列关于化学平衡的描述中,正确的是()。
A. 化学平衡是动态平衡B. 化学平衡是静态平衡C. 化学平衡时,正反应和逆反应速率相等D. 化学平衡时,反应物和生成物的浓度不再变化答案:A、C、D2. 在一定条件下,下列物质中不能建立化学平衡的是()。
A. 可逆反应B. 不可逆反应C. 反应物和生成物浓度保持不变的反应D. 反应物和生成物浓度随时间变化的反应答案:B3. 影响化学平衡移动的因素包括()。
A. 浓度B. 温度C. 压强D. 催化剂答案:A、B、C二、填空题1. 当一个化学反应达到平衡状态时,正反应速率和逆反应速率______,各物质的浓度保持______。
答案:相等;不变2. 增加反应物的浓度,化学平衡会向______方向移动,以减小浓度的变化。
答案:正反应3. 根据勒夏特列原理,当一个处于平衡状态的系统受到外部条件的改变时,系统会自动调整以______原有的平衡状态。
答案:抵消三、简答题1. 描述化学平衡的特征。
答案:化学平衡具有以下特征:(1)动态平衡,正逆反应速率相等;(2)平衡时各物质的浓度保持不变;(3)平衡状态可以受到浓度、温度、压强等因素的影响。
2. 解释为什么催化剂不会影响化学平衡的位置。
答案:催化剂通过降低反应的活化能来加速反应速率,但它对正反应和逆反应的影响是等同的,因此不会改变正逆反应速率的相对大小,从而不会影响化学平衡的位置。
四、计算题1. 假设在一个封闭容器中,氮气(N2)和氢气(H2)反应生成氨气(NH3),反应方程式为:N2(g) + 3H2(g) ⇌ 2NH3(g)。
初始时,氮气和氢气的浓度分别为0.1 mol/L和0.3 mol/L。
如果反应达到平衡时,氨气的浓度为0.2 mol/L,求平衡时氮气和氢气的浓度。
答案:根据化学平衡常数和初始浓度,可以计算出平衡时氮气的浓度为0.05 mol/L,氢气的浓度为0.15 mol/L。
高中化学平衡试题及答案

高中化学平衡试题及答案1. 某化学反应可表示为:2A(g) + B(g) ⇌ 3C(g) + D(g),如果开始时A、B、C、D的浓度分别为0.1 mol/L、0.3 mol/L、0.1 mol/L、0.1 mol/L,反应达到平衡时,A的浓度变为0.05 mol/L,求平衡时B、C、D的浓度。
答案:根据化学平衡的等效平衡原理,起始时A的浓度减少0.05mol/L,因此B的浓度减少0.025 mol/L,C的浓度增加0.075 mol/L,D的浓度增加0.025 mol/L。
所以平衡时B的浓度为0.275 mol/L,C的浓度为0.175 mol/L,D的浓度为0.125 mol/L。
2. 已知一个化学反应的平衡常数Kc为100,反应物A和B的初始浓度分别为1 mol/L和2 mol/L,求平衡时A和B的浓度。
答案:设A和B的浓度变化量分别为x mol/L,则平衡时A的浓度为(1-x) mol/L,B的浓度为(2-x) mol/L。
根据平衡常数的定义,有Kc = [C]/[A][B],代入数值得到100 = [1-x]/(1)(2-x),解得x = 0.6 mol/L。
因此,平衡时A的浓度为0.4 mol/L,B的浓度为1.4 mol/L。
3. 某化学反应的速率方程为v = k[A]^2[B],其中k为速率常数,[A]和[B]分别为反应物A和B的浓度。
若初始时[A] = 0.1 mol/L,[B] = 0.2 mol/L,且反应速率为0.01 mol/(L·s),求速率常数k。
答案:将初始浓度和反应速率代入速率方程,得到0.01 =k(0.1)^2(0.2),解得k = 50 L^2/(mol^2·s)。
4. 一个化学反应的活化能Ea为50 kJ/mol,温度T为300 K,求该反应的速率常数k。
答案:根据阿累尼乌斯方程,k = Ae^(-Ea/RT),其中A为指前因子,R为气体常数,T为温度。
化学平衡测试答案

化学平衡测试答案⼀、选择题(40分)1在⼀定温度下,可逆A(g) + 3B(g)2C(g)达到平衡的标志是:()。
A. C的⽣成速率与B的⽣成速率相等B. 单位时间⽣成nmolA,同时⽣成3nmolBC. 单位时间⽣成nmolA,同时消耗2nmolCD. 单位时间⽣成3nmolB,同时⽣成2nmolC2.可逆反应:2HI(g)H 2(g)+I2(g)在密闭容器中进⾏,当下列选项中条件不随时间变化时,才能说明反应已达平衡()A.容器内压强B.平均相对分⼦质量C.各组分物质的量浓度D.混合⽓体的颜⾊(g)+I2(g)2HI(g)(正反应为放热反应)达到平衡后,3.⼀定温度下,在带活塞的密闭容器中,反应H下列说法中不正确的是()A.恒压时,通⼊HI⽓体,则开始时正反应速率会减⼩B.恒温时,减⼩容积平衡不移动,但⽓体颜⾊加深C.恒容时,通⼊H2,则I2的质量分数减⼩。
D.恒容时,升⾼温度,平衡向逆反应⽅向移动,正反应速率减⼩4.在密闭容器中,可逆反应mA(g)+nB(g)pC(g)(正反应为放热反应)处于平衡状态,则下列说法正确的是()①升⾼温度时,c(B):c(C)的⽐值增⼤②充⼊C,则A、B的物质的量增⼤③充⼊B,则A的转化率变⼤④加⼊催化剂,⽓体的总物质的量不变A.③④B.①②C.②④D.①②③④5.把6mol A⽓体和5mol B⽓体混合放⼊4L密闭容器中,在⼀定条件下发⽣反应:3A(⽓)+B(⽓)2C(⽓)+x D(⽓)经5min达到平衡,此时⽣成C为2mol,测定D的平均反应速率为0.1mol/(L·mim),下列说法中错误的是()A. x=2B.B的转化率为20%C.平衡时A的浓度为0.75mol/LD.恒温达平衡时容器内压强为开始时的85%6.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)2C(g)达到平衡时,测得A、B、C物质的量之⽐为2:2:1。
若保持温度不变,以2:2:1的物质的量之⽐再充⼊A、B、C,下列判断正确的是()A.平衡向逆反应⽅向移动B.平衡不会发⽣移动C.C的质量分数增⼤D.C的质量分数可能减⼩7.把6mol A⽓体和5mol B⽓体混合放⼊4L密闭容器中,在⼀定条件下发⽣反应:3A(⽓)+B(⽓)2C(⽓)+x D(⽓)经5min达到平衡,此时⽣成C为2mol,测定D的平均反应速率为0.1mol/(L·mim),下列说法中错误的是()A. x=2B.B的转化率为20%C.平衡时A的浓度为0.75mol/LD.恒温达平衡时容器内压强为开始时的85%8.如图A、B是等体积容器,K是开关,活塞可以左右移动.在⼀定温度下,关闭K,向A中通⼊⼀定量的NO2.发⽣:2NO2(g)?N2O4(g);△H<0.则以下说法不正确的是()A.保持活塞位置不变,打开K,体系中⽓体颜⾊先变浅、然后略加深B.打开K⼀会,再关闭它,向右推动活塞时,最后A容器的⽓体颜⾊⽐B的浅C.打开K⼀会,再关闭它,把A容器加热,活塞不移动,A中⽓体颜⾊⽐B中深D.打开K⼀会,再关闭它,向B中通⼊氩⽓,B中⽓体颜⾊不变9.向反应器充⼊1mol N 2和3mol H2,在⼀定条件下发⽣反应:N2(g)+3H2(g)2NH3(g),平衡时测得N2的转化率为12%,则在相同温度和压强下,平衡时混合⽓体的体积是反应前的()A.94%B.92%C.88%D.76%10.2SO2+O2?2SO3(g)ΔH<0 向同温同体积的三个密闭容器中中分别充⼊⽓体:(甲)2 mol SO2和1 mol O2;(⼄) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系⼀定正确的是( )A.容器内压强p:p甲=p丙>2p⼄B.SO3的质量m:m甲=m丙>2m⼄C.c(SO2)与c(O2)之⽐k:k甲=k丙>k⼄D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q⼄11.在恒温时,⼀固定容积的容器内发⽣如下反应:2NO 2(g)N2O4(g)达到平衡时,再向容器内通⼊⼀定量的NO2(g),重新达到平衡后,与第⼀次平衡时相⽐,NO2的体积分数()A.不变B.增⼤D.⽆法判断12.在⼀个密闭容器中,⽤等物质的量的A和B发⽣反应:A(g)+2B(g)2C(g)。
高考化学平衡练习题(难)

高考化学平衡练习题(难)化学平衡练习题一、化学反应速率1、向绝热恒容密闭器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
由图可得出的正确结论是( )A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.△t1=△t2时,SO2的转化率:a—b段小于b—c段2、向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)⇌bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息,下列说法正确的是()A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/L•minB.根据上图可求得方程式中a:b=1:3C.推测在第7min时曲线变化的原因可能是升温D.推测在第13min时曲线变化的原因可能是降温3、某恒温密闭容器发生可逆反应:Z(?)+W (?)X(g)+Y(?)△H,在t 1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是()A.Z和W在该条件下至少有一个是为气态B.t 1~t 2时间段与t 3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等C.若在该温度下此反应平衡常数表达式为K=c (X),则t 1~t 2时间段与t 3时刻后的X浓度不相等D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小4、(14分)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。
采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。
但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。
相关反应的热化学方程式如下:CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ) CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)请回答下列问题:(1)应Ⅰ能自发进行的条件是。
化学平衡测试题

化学平衡测试题(总4页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除化学反应速率和化学平衡单元测试一、选择题1. 反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是A.υ(D)= mol / L·s B.υ(C)= mol / L·sC.υ(B)= mol / L·s D.υ(A)= mol / L·s2. 在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g) 4C(g) +5D(g)。
若经5s 后,剩下的A是,则B的反应速率是()A. mol / L·s B. mol / L·s C. mol / L·s D. mol / L·s3. 可逆反应达到平衡的根本原因是()A.反应混合物中各组分的浓度相等 B.正逆反应都还在继续进行C.正逆反应的速率均为零 D.正逆反应的速率相等4. 已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,恒容密闭容器中反应达到平衡时,正确的是A.通入稀有气体使压强增大,平衡将正向移动B.X的正反应速率是Y的逆反应速率的m/n倍C.降低温度,混合气体的平均相对分子质量变小D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m5.一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是()A.c1∶c2=3∶1 B.平衡时,Y和Z的生成速率之比为2∶3C.c1的取值范围为0.04 mol/L<c1<0.14 mol/L D.X、Y的转化率相等6.某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:a A(g)+B(g)C(g)+D (g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则()A.a=3 B.a=2 C.B的转化率为40% D.B的转化率为60%7.在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g) 2c(g) △H 1<0; x(g)+3y(g) 2z (g) △H2>0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )A.等压时,通入惰性气体,c的物质的量不变B.等压时,通入z气体,反应器中温度升高C.等容时,通入惰性气体,各反应速率不变D.等容时,通入z气体,y的物质的量浓度增大8.可逆反应:3A(g)3B()+C()(△H>0),随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是()A. B和C可能都是固体B. B和C只能有一个是气体C. B和C一定都是气体D. 若C为固体,则B一定是气体9.在一密闭容器中,反应a A(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是A.平衡向正反应方向移动了 B.物质A的转化率增大了C.物质B的质量分数增加了 D.a>b 10.某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的倍,下列叙述正确是()A. 平衡正移B. (a+b)>(c+d)C. Z的体积分数变小D. X的转化率变大11.反应2X(g)+Y(g) 2Z(g) ΔH 在不同温度(T1、T2)及压强(P1、P2)下产物Z 的物质的量n(Z )与反应时间(t )的关系如下图所示,下列判断正确的是 A .T1<T2 P1<P2 ΔH<0 B .T1<T2 P1>P2 ΔH>0 C .T1>T2 P1>P2 ΔH<0 D .T1>T2 P1<P2 ΔH>0 12. 某温度下,反应SO 2(g)+21O 2(g) SO 3 (g) 的平衡常数K 1=50,在同一温度下,反应2SO 3(g)2SO 2(g) + O 2(g)的平衡常数K 2的值为( )A. 2500B. 100C. 4×10-4D. 2×10-213.在密闭容器中,反应X 2(g )+Y 2(g ) 2XY (g ) ΔH <0,达到甲平衡。
化学平衡复习题

第四章 化学平衡测试题(一)参考答案1.对于摩尔反应吉布斯自由能Δr G m ,下列理解错误的是: 参考答案: B(A) Δr G m 是在T 、p 、ξ一定的条件下,进行一个单位反应时吉布斯自由能的改变;(B) Δ r G m 是在有限反应系统终态和始态吉布斯自由能的差值,即实际过程的ΔG ;(C) Δ r G m 是指定条件下反应自发进行趋势的量度,Δr G m < 0,反应自发向右进行;(D)p T G G ,m r ⎪⎪⎭⎫⎝⎛∂∂=∆ξ,等于G ~ξ图中反应进度为ξ时的曲线斜率 。
2.有一理想气体反应 A + B = 2C ,在某一定温度下进行,按下列条件之一可以用m r G ∆直接判断反应方向和限度:参考答案: C(A) 任意压力和组成;(B) 总压101.325 kPa ;(C) 总压303.975 kPa ,x A = x B = x C = ⅓ ; (D) 总压405.300 kPa ,x A = x B = ¼ ,x C = ½ 。
3. 某温度时,NH 4Cl(s)分解压力是标准压力,则分解反应的平衡常数K 0为: ( ) 参考答案: C(A) 1 (B) 1/2 (C) 1/4(D) 1/84. 化学反应体系在等温等压下发生Δξ= 1 mol 反应,所引起体系吉布斯自由能的改变值Δr G m 的数值正好等于体系化学反应吉布斯自由能 (∂G/∂ξ)T,p , 的条件是: ( ) 参考答案: D(A) 体系发生单位反应 (B) 反应达到平衡(C) 反应物处于标准状态(D) 无穷大体系中所发生的单位反应5.已知下列反应的平衡常数:H 2(g) + S(s) = H 2S(g) ① K 1 ;S(s) + O 2(g) = SO 2(g) ② K 2 。
则反应 H 2(g) + SO 2(g) = O 2(g) + H 2S(g) 的平衡常数为:参考答案: D(A) K 1 + K 2 ;(B) K 1 - K 2 ;(C) K 1·K 2 ;(D) K 1/K 2 。
化学平衡测试题

第二章化学平衡单元验收题原子量:I:127一、选择题(本题包括25小题,每小题有1~2个答案,每小题3分,共75分)1.把稀硫酸倒在亚硫酸钠粉末上,能使反应的最初速率加快的是:()A.增大亚硫酸钠粉末的量B.硫酸浓度增大一倍,用量减少为原来的一半C.硫酸浓度不变,用量增加1倍D.使反应在较高温度下进行2.使可逆反应2AB(气)A 2(气)+B2(气)体系的压强增加时,其影响是()A.正反应速率比逆反应速率增大得多B.逆反应速率比正反应速率增大得多C.相同程度地增大正逆反应速率D.正逆反应速率不变3.将固体NH4Br置于2L密闭容器中,在某温度下发生如下反应Br(固) NH3(气)+HBr(气) 2 HBr(气)Br2(气)+H2(气)NH2min时反应达到平衡,测得H2为1mol,HBr为8 mol。
则上述反应中生成NH3的速率为:()A.0.5mol/(L·min) B.2 mol/(L·min) C.2.5 mol/(L·min) D.5 mol/(L·min)+3B2C2的化学反应速率,甲测得4.有两个学生在条件完全相同的情况下测定可逆反应AV(A2)= 0.5mol/(L·min),乙测得V(B2)=1.5mol/(L·min),则这两个同学的测定结果()A.都正确B.都错误C.甲对乙错D.都对或都错5.对于某一可逆反应来说,使用催化剂的作用是:()A.提高反应物的转化率B.以同样速率改变正逆反应速率C.增大正反应速率,减小逆反应速率D.改变平衡混合物的组成6.在一个密闭容器中,下列反应已达平衡:aA(气)+bB(气)cC(气)+dD(气)+Q,如果升高温度或降低压强,则C(气)物质的量都增大,试判断下列各组中正确的是()A.a+b<c+d Q<0 B.a+b>c+d Q<0 C.a+b<c+d Q>0 D.a+b=c+d Q<07.两个完全相同容积固定不变容器A和B,已知A装有SO2和O2各1克,B中装有SO2和O2各2克,在同温下,反应达到平衡,设A中SO2的转化率为a%,B中SO2的转化率为b%,则A、B两个容器中SO2转化率的关系:()A.a%> b% B.a%=b% C.a%<b% D.无法确定8.在一定条件下将1molCO和1mol水蒸气放入密闭容器发生反应CO+H 2O CO2+H2,达到平衡时测得CO2为0.6mol。
高中化学化学平衡、转化率、平衡移动练习题(附答案)

高中化学化学平衡、转化率、平衡移动练习题一、单选题1.一定量的2CO 与足量的碳在体积可变的恒压密闭容器中反应: 2C(s)+CO (g)2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(p 分)=气体总压(p 总)×体积分数。
下列说法正确的是( ) A.550℃时,若充入惰性气体,v 正、v 逆均减小,平衡不移动 B.650℃时,反应达平衡后2CO 的转化率为25.0%C.T ℃时,若充入等体积的2CO 和CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数p 24.0K p =总 2.可逆反应①X(g)+2Y(g)2Z(g)、②2M(g)N(g)+P(g),分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。
反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是( ) A.反应①的正反应是吸热反应B.达平衡(Ⅰ)时体系的压强和反应开始时体系的压强之比为14:15C.达平衡(Ⅰ)时,X 的转化率为511D.在平衡(Ⅰ)和平衡(Ⅱ)中,M 的体积分数相等3.将物质的量均为3.00 mol 的气体A 、B 充入5 L 恒容密闭容器中,发生如下反应3A( g) + B( g)==C(g)他条件一定时,反应过程中C 的物质的量分数ϕ(C)随温度T 的变化曲线如图所示,下列有关说( )A.M点对应反应体系中反应速率v正=v逆B.该反应为放热反应C.X、Y两点对应反应体系中A物质正反应速率v( A)Y =v( A)xD.温度T<T0时,曲线上的点对应的反应未达到平衡4.向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g) c C(g) ΔH<0(有关数据如下表所示)。
测得两容器中c(A)随时间t的变化如图所示:A.x=1B.Q1=2Q2C.根据题中信息无法计算a值D.保持其他条件不变,起始时向乙容器中充入0.2mol A、0.2mol B、0.2mol C,则此时v正>v逆5.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)=SO3(g)+NO(g)达到平衡,在此过程中正反应速率随时间变化的曲线如图所示,由图得出的结论正确的是( )A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.若Δt1=Δt2,则SO2的转化量:a~b段小于b~c段6.在恒温恒容条件下,有反应:2A(g)+2B(g)C(g)+3D(g)。
化学平衡测试题(附答案)

化学平衡测试题(附答案)第三节化学平衡同步测试一、选择题: 1、可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。
下列各关系中能说明反应已达到平衡状态的是() A.3υ正(N2)=υ正(H2) B.υ正(N2)=υ逆(NH3) C.2υ正(H2)=3υ逆(NH3) D.υ正(N2)=3υ逆(H2) 2、.压强变化不会使下列化学反应的平衡发生移动的是 ( ) A.H2(g)+I2(g) 2HI(g) B.3H2(g)+N2(g) 2NH3(g) C.2SO2(g)+O2(g) 2SO3(g) D.C(s)+CO2(g) 2CO(g) 3、对于反应2SO2+O2 2SO3,下列判断中正确的是( ) A.2体积SO2和足量O2反应,必定生成 2体积SO3 B.其他条件不变,增大压强,平衡必定向右移动 C.平衡时,SO2消耗速度必定等于O2生成速率的两倍 D.平衡时,SO2浓度必定等于O2浓度的两倍 4、在一定温度下,向aL 密闭容器中加入 1molX 气体和2molY 气体,发生如下反应:X(g)+ 2Y(g) 2Z(g)此反应达到平衡的标志是( ) A .容器内压强不随时间变化 B.容器内各物质的浓度不随时间变化 C.容器内 X、Y、Z 的浓度之比为1∶2∶2 D .单位时间消耗 0.1molX 同时生成 0.2molZ 5、已知反应A2(g)+2B2(g)2AB2(g)的△H<0,下列说法正确的是() A.升高温度,正向反应速率增加,逆向反应速率减小 B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 6、在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) 1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是() A.加催化剂同时升高温度 B.加催化剂同时增大压强 C.升高温度同时充入N2 D.降低温度同时增大压强 7、对已达化学平衡的下列反应:2X(g)+Y(g) 2Z(g)减小压强时,对反应产生的影响是() A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 C.正、逆反应速率都减小,平衡向逆反应方向移动 D.正、逆反应速率都增大,平衡向正反应方向移动 8、在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是() A.反应的化学方程式为:2 M N B.t2时,正逆反应速率相等,达到平衡 C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍 9、一定温度下,反应2SO2 + O2 2SO3达到平衡时,n(SO2)∶n(O2)∶n(SO3) =2∶3∶4。
高考化学平衡移动练习题(含答案)-

化学平衡移动专题练习1.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是()A.反应混和物的浓度B.反应物的转化率C.正、逆反应速率D.反应混和物的压强2.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是()A.2NO+O22NO2B.Br2(g)+H22HBr C.N2O42NO2 D.6NO+4NH35N2+3H2O 3.在某温度下,反应ClF(g) + F2(g)ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。
下列说法正确的是()A.温度不变,缩小体积,Cl F的转化率增大B.温度不变,增大体积,Cl F3的产率提高C.升高温度,增大体积,有利于平衡向正反应方向移动D.降低温度,体积不变,F2的转化率降低4.已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是()①生成物的百分含量一定增加②生成物的产量一定增加③反应物转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂A.①②B.②⑤C.③⑤D.④⑥5.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则()A.平衡向逆反应方向移动了B.物质B的质量分数增加了C.物质A的转化率减小了D.a>b6.在一固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2(g) N2O4此时平衡混合气体中NO2的体积分数为x%;若再充入1mol N2O4,在温度不变的情况下,达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是()A.x>y B.x=y C.x<y D.不能确定7.下列事实中,不能用列夏特列原理解释的是( )A.溴水中有下列平衡:Br2+H2O HBr+HBrO当加入AgNO3溶液后溶液颜色变浅B.对二氧化硫的品红溶液加热可使颜色变深C.反应CO+NO2CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动D.合成氨反应N2+3H22NH3(正反应放热)中使用催化剂8.在密闭容器中进行H2(g)+Br2(g) 2HBr(g)+Q;反应达到平衡后,欲使颜色加深,应采取的措施是()A.升温B.降温C.减小容器体积D.增大容器体积9.在体积可变的密闭容器中,反应mA(g)+nB(s )pC (g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。
高中化学选修一化学平衡综合测试附答案

高中化学选修一化学平衡综合测试学校:___________姓名:___________班级:___________考号:___________ 一、单选题1.NH 3分解的热化学方程式为-13222NH (g)N (g +3H (g) ΔH=+92.1kJ mol ).在Co-Al催化剂体系中,压强P 0下,氨气以一定流速通过反应器,得到不同催化剂下氨气的转化率随温度的变化曲线如图所示。
下列说法错误的是A .活化能最小的催化剂是 90 Co-A1B .如果增大气体流速,则b 点对应的点可能为eC .温度为T 时,向体积为1L 的恒容容器中加入0.8 molNH 3和0.1molH 2,达到平衡时,NH 3的转化率为75%,则平衡常数为K =7.5D .在两个体积均为VL 的绝热密闭容器中分别投入①2 mol NH 3,②3 mol H 2和1mol N 2,达到平衡时,NH 3的体积分数相同2.在二氧化碳加氢制甲烷的反应体系中,除主反应(反应Ⅰ)外,还会发生副反应(反应Ⅱ)。
反应Ⅰ:()()()()2242CO g 4H g CH g 2H O g ++ K Ⅰ:反应Ⅱ:()()()()222CO g H g CO g H O g ++ K Ⅱ一定压强下,向某容积可变的密闭容器中通入2CO 和2H 的混合气体(其中2CO 和2H 的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得2CO 的转化率、4CH 的选择性、CO 的选择性随反应温度的变化情况如图所示。
已知:4CH 或CO 的选择性指反应生成4CH 或CO 时所消耗的2CO 的物质的量占参与反应的2CO 总物质的量的百分比。
下列说法正确的是A .相同温度下,反应()()()()2242CO g 2H g CO g CH g ++的平衡常数K K=K ⅠⅡB .温度升高,反应Ⅰ的平衡常数K Ⅰ和反应Ⅱ的平衡常数K Ⅱ都增大C .通过控制反应温度、调节压强等措施可提高()4CH g 的选择性D .500℃时,反应达到平衡后,增大压强,体系中CO 和4CH 的体积分数均减小3.如图中,表示2A(g)+B(g)2C(g) ΔH <0这个可逆反应的正确图像为A .B .C .D .4.实验室中模拟合成氨反应:催化剂223N (g)+3H (g)2NH 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:实验序号 温度(℃)2H 浓度(mol/L )0min 10min 20min 30min 40min 50min 60min1 300 2.00 1.70 1.50 1.36 1.25 1.20 1.202 300 2.00 1.50 1.28 1.20 1.20 1.20 1.203 2002.001.601.391.291.271.271.27下列有关说法不正确的是A .当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态B .实验2中,前20min 内以3NH 的浓度变化表示的化学反应速率为110.012mol L min --⋅⋅C .比较实验1和2,说明实验2使用了更高效的催化剂D .实验3中,40min 时向容器中充入一定量He ,则正反应速率正v 不变 5.下列叙述与图对应的是A .对于达到平衡状态的反应:N 2(g)+3H 2(g)⇌2NH 3(g),图①表示在t 0时刻充入了一定量的NH 3,平衡逆向移动B .由图②可知,P 2>P 1、T 1>T 2满足反应:2A(g)+B(g)⇌2C(g) ΔH <0C .图③表示的反应方程式为:2A=B+3CD .对于反应2X(g)+3Y(g)⇌3Z(g) ΔH <0,图④y 轴可以表示Y 的百分含量6.反应()()E g 2G g =经历两步:①()()E g F g →;②()()F g 2G g →。
化学反应速率和化学平衡综合测试题

选修4第二章化学反应速率化学平衡单元测试题第一部分选择题一、选择题每小题只有一个选项符合题意1.在2A+B 3C+4D反应中,表示该反应速率最快的是A.υA=mol/L·s B.υB=mol/L·sC.υC=mol/L·s D.υD= 1 mol/L·s2.下列说法正确的是A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大B.有气体参加的化学反应,若增大压强即缩小反应容器的体积,可增加活化分子的百分数,从而使反应速率增大C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率3.过程的自发性的作用是A.判断过程的方向 B.确定过程是否一定会发生C.判断过程发生的速率 D.判断过程的热效应4.在2升的密闭容器中,发生以下反应:2Ag+ Bg 2Cg+Dg ;若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为 mol/L·s,则10秒钟时,容器中B的物质的量是A. 1.6 molB. molC. molD. mol 5.一定条件下反应2ABg A2g+B2g达到平衡状态的标志是A.单位时间内生成nmolA2,同时消耗2n molABB.容器内,3种气体AB、A2、B2共存C.AB的消耗速率等于A2的消耗速率D.容器中各组分的体积分数不随时间变化6.在一定温度不同压强P1<P2下,可逆反应2Xg 2Yg + Zg中,生成物Z 在反应混合物中的体积分数ψ与反应时间t的关系有以下图示,正确的是7.α1和α2分别为A、B在两个恒容容器中平衡体系Ag2Bg和2Ag Bg 的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是A.α1、α2均减小 B.α1、α2均增大C.α1减小,α2增大 D.α1增大,α2减小8.对可逆反应4NH3g+ 5O2g2Og,下列叙述正确的是A.达到化学平衡时,4υ正O2= 5υ逆NOB.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大D.化学反应速率关系是:2υ正NH3= 3υ正H2O9.已知反应A2g+2B2g2g△H <0,下列说法正确的A.升高温度,正向反应速率增加,逆向反应速率减小B.升高温度有利于反应速率增加,从而缩短达到平衡的时间C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动10.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:甲乙N2O4 2 △H> 0a将两容器置于沸水中加热b在活塞上都加2 kg的砝码在以上两情况下,甲和乙容器的体积大小的比较,正确的是A .a 甲>乙,b 甲>乙B .a 甲>乙,b 甲=乙C .a 甲<乙,b 甲>乙D .a 甲>乙,b 甲<乙 二、选择题每小题有一个或两个选项符合题意11.在可逆反应中,改变下列条件一定能加快反应速率的是A .增大反应物的量B .升高温度C .增大压强D .使用催化剂 12.右图曲线a 表示放热反应 Xg + YgZg + Mg + Ns 进行过程中X的转化率随时间变化的关系;若要改变起始条件,使反应过程按b 曲线进行,可采取的措施是 A .升高温度 B .加大X 的投入量C .加催化剂D .增大体积 13.下列能用勒沙特列原理解释的是 A .FeSCN 3溶液中加入固体KSCN 后颜色变深 B .棕红色NO 2加压后颜色先变深后变浅C .SO 2催化氧化成SO 3的反应,往往需要使用催化剂D .H 2、I 2、HI 平衡混和气加压后颜色变深 14.在密闭容器中进行如下反应:X 2g+Y 2g2Zg,已知X 2、Y 2、Z 的起始浓度分别为L 、L 、L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 A . Z 为L B . Y 2为L C . X 2为L D . Z 为L 15.反应:Ls +a Ggb Rg 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p 1>p 2,x 轴表示温度,y 轴表示平衡混合气中G 的体积分数;据此可判断oabXyxp 1p 2A.上述反应是放热反应 B.上述反应是吸热反应C.a>b D.a<b16.在恒温时,一固定容积的容器内发生如下反应:2NO2g N2O4g 达到平衡时,再向容器内通入一定量的NO2g,重新达到平衡后,与第一次平衡时相比,NO2的体积分数A.不变 B.增大 C.减小 D.无法判断17.反应4Ag+5Bg4Cg+6Dg △H =-Q,在一定温度下达到化学平衡状态时,下列说法正确的是A.单位时间里生成n mol C,同时生成 mol DB.若升高温度最终能生成更多的C和DC.单位时间里有4n mol A消耗,同时有5n mol B生成D.容器里A、B、C、D的浓度比是4:5:4:618.在密闭容中发生下列反应aAg cCg+dDg,反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的倍,下列叙述正确的是A.A的转化率变小 B.平衡向正反应方向移动C.D的体积分数变大 D.a < c+d19.反应PCl5g PCl 3g+Cl2g ①2HIg H2g+I2g ②2NO2g N2O4g ③在一定条件下,达到化学平衡时,反应物的转化率均是a%;若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率A.均不变 B.均增大C.①增大,②不变,③减少 D.①减少,②不变,③增大20.某温度下,在固定容积的容器中,可逆反应Ag+3Bg 2Cg达到平衡,此时测得n A∶n B∶n C=2∶2∶1;若保持温度不变,以n A∶n B∶n C=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是A. 刚充入时反应速率υ正减少,υ逆增大B. 平衡不发生移动C. 平衡向逆反应方向移动D. 物质C的质量分数增大第一部分选择题题号 1 2 3 4 5 6 7 8 9 10三、本题包括3小题,共30分21.8分在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应;这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致;为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象;实验用品:仪器略,凡是实验需要的都有药品:L盐酸、L硫酸、L硫酸,相同大小的铝片纯度>%实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的L盐酸、L硫酸、L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况;结果如下:,而L 盐酸与铝片反应的现象却十分明显;1写出铝与酸反应的离子方程式______________________________________________2反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是___________________________________________________________________________________________________;3根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪 些假设或猜想列出两种即可 假设一:_____________________________________________________________________ 假设二:______________________________________________________________________22. 1对于下列反应:2SO 2 + O 22SO 3 , 如果2min 内SO 2的浓度由6mol/L 下降为2 mol/L,那么,用SO 2浓度变化来表示的化学反应速率为____________,用O 2浓度变化来表示的反应速率为_____________;如果开始时SO 2浓度为4mol/L,2min 后反应达平衡,若这段时间内v O 2为L·min ,那么2min 时SO 2的浓度为________;26分下图左表示在密闭容器中反应:2SO 2+O 22SO 3+Q 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b 过程中改变的条件可能是 ; b c 过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d 处.3酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系;解释曲线变化原因 ; 23.12分将1 mol I 2g 和2 mol H 2置于2L 密闭容器中,在一定温度下发生反应:I 2g + H 2g 2HIg ;△H <0,并达平衡;HI 的体积分数wHI 随时间变化如图速度温度A vV 正 V 正 V 正 V 逆 V 逆V 逆曲线Ⅱ所示:1达平衡时,I2g的物质的量浓度为 ;2若改变反应条件,在甲条件下wHI的变化如曲线Ⅰ所示,在乙条件下wHI 的变化如曲线Ⅲ所示;则甲条件可能是 ,则乙条件可能是 ;填入下列条件的序号①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;④恒温条件下,扩大反应容器体积;⑤恒温恒容条件下,加入适当催化剂;3若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2g、b mol H2g 和c mol HIa、b、c均大于0,发生反应,达平衡时,HI的体积分数仍为,则a、b、c的关系是 ;24.在一定体积的密闭容器中,进行如下化学反应:CO2g+H2g COg+H2Og,其化学平衡常数K和温度t的关系如下表:t℃700 800 830 1000 1200K回答下列问题:1该反应的化学平衡常数表达式为K = ;2该反应为反应选填吸热、放热;3能判断该反应是否达到化学平衡状态的依据是多选扣分;a.容器中压强不变 b.混合气体中c CO不变c.υ正H2=υ逆H2O d.c CO2=c CO4某温度下,平衡浓度符合下式:c CO2·c H2=c CO·c H2O,试判断此时的温度为℃;选修4第二章化学反应速率化学平衡单元测试题答案第一部分 选择题共90分三、本题包括3小题,共30分 21.8分12Al + 6H + = 2Al 3+ + 3H 2↑ 2分2反应放出热量,温度升高,使化学反应速率加快3分3说明:可能存在多种假设,但只要假设合理均可Cl -能够促进金属铝与H +反应;SO 42- 对H +与金属铝的反应起阻碍作用;3分解析氢离子浓度和铝片均相同,造成的差异应该与反应即2Al + 6H + = 2Al 3+ + 3H 2↑所处环境的不同Cl - 和SO 42-有关; 22.16分16分2mol/L ·min ; 1mol/L ·min ; 2mol/L26分升温;减小 SO 3 浓度;34,酶蛋白因受热变性而失去催化作用,23.6分m+n > P ; 逆; 气; 四、本题包括3小题,共30分 24.12分1 mol/L 3分 2③⑤3分; ④ 3分 34a +c =2b 3分 25.9分 1]][[]][[222O H CO O H CO ;3分2吸热;2分 3b 、c ;2分 4830 2分26.9分,各3分1逆方向进行 2正方向进行 3反应已达平衡状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学平衡·综合测试题一、选择题(本题包括21个小题,每小题有1~2个正确选项) 1.下列各组实验中反应速率最快的是[ ]参加反应的物质Na 2S 2O 3H 2SO 4组号反应温度(℃)体积(mL)浓度(mol/L)体积(mL)浓度(mol/L)H 2O 体积(mL)A 0100.1100.10B 1050.1100.15C 3050.150.110D3050.250.2102.一氧化氮与一氧化碳都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳.对此反应,下列叙述中正确的是[ ]A .使用催化剂不能改变反应速率B .使用催化剂能增大反应速率或减小反应速率C .降低压强能增大反应速率D .升高温度能增大反应速率3.下列反应加压后,对化学反应速率无影响的是[ ]A .N 2+O 22NOB .2SO 2+O 22SO 3C .CO +H 2O(g)CO 2+H 2D .H 2SO 4+2NaOH=Na 2SO 4+2H 2O 4.反应aA(g)+bB(g)cC(g)若v A = c mol/(L ·s)则v C 为[ ]A mol /(L s)B mol /(L s)C ac mol /(L s)D c mol(L s)2.·.·.·.·c aac22 5.在2A(g)+B(g)4C(g)+D(s)-Q 已达化学平衡时,能使正、逆反应速率同时加快,又使平衡向正反应方向移动,应采取的措施[ ]A .增大压强B .增大C 的浓度C .使用催化剂D .升高温度6.已知工业上真空炼铷的反应方程式为2RbCl+Mg MgCl2+2Rb(g),对于此反应能够进行正确解释的是[ ] A.Rb比Mg金属性强B.MgCl2对热稳定性差C.高温下Mg2+得电子能力比Rb+弱D.铷的沸点低,当把铷蒸气抽走时,平衡向正反应方向移动7.在N2+3H22NH3+Q的反应中,为提高NH3的产率,在下列措施中能采取[ ] A.使用催化剂B.升温C.加压D.延长反应时间8.对可逆反应A(g)+nB2C(g),恒温下,其反应物B的转化率(αB%)与压强的关系如图,则下列叙述中正确的是[ ] A.B为固体n>1 B.B为液体n>1C.B为气体n>1 D.B为气体n<19.在200℃,1.01×105Pa条件下,H2+I22HI+Q反应达到平衡时,再改变温度到300℃时,H2的物质的量是[ ] A.不变B.增大C.减少D.无法确定10.在一化学平衡mA(g)+nB(g)pC(g)+qD(g)A的转化率(αA%)同压强(Pa)、温度(T)的关系如图,分析下图可以得出的正确结论是[ ] A.正反应是吸热反应m+n>p+qB.正反应是吸热反应m+n<p+qC.正反应是放热反应m+n>p+qD.正反应是放热反应m+n<p+q11.在温度相同,压强分别为p1、p2条件下,A(g)+2B(g)nC(g)的反应体系中,C的体积分数(C%)随时间(t)变化的曲线如图所示.下列结论正确的是[ ] A.p1>p2n<3 B.p1<p2n>3 C.p1<p2n=3 D.p1>p2n>312.在2SO2+O22SO3可逆反应中,为了充分利用SO2,可采用的方法是[ ] A.增大压强B.使用催化剂C.增加氧气的浓度D.增大SO2的浓度13.2HI(g)H2(g)+I2(g),在密闭容器中,装入1mol HI,在一定温度下,有50%发生分解,这时容器内气体的总物质的量是[ ] A.0.5molB.1.5molC.1molD.2mol14.在温度和压强不变时,1 L NO2分解,按2NO22NO+O2反应达到平衡状态,若NO2的转化率为40%,则平衡时体积变为[ ] A.2.4LB.2.0LC.1.2LD.1.0L15.某温度下,反应N2O4(g)2NO2(g)-Q在密闭容器中达到平衡,下列说法中不正确的是[ ] A.体积变小时,将使正反应速率增大B.体积保持不变,加入少许NO2,将使正反应速率减小C.体积保持不变,加入少许N2O4,再达到平衡颜色变深D.体积保持不变,升高温度,再达到平衡颜色变深16.酶是蛋白质,因而具有蛋白质的特性.酶能催化多种化学反应,下列表示温度T与速率v关系的曲线(在下页),有酶参加的是[ ]17.某温度下,反应A+B2C在密闭容器中进行,当反应达到平衡时,下列叙述中正确的是[ ] A.当升高温度时,平衡逆向移动,说明正反应是放热的B.升高温度时可增大正、逆反应速率、对平衡移动没有影响C.若增加或减少B物质的量时,对化学平衡无影响,则B所处状态为气态D.若A为气态,而加压平衡不移动,则B一定是气态,C也是气态18.下列叙述中,正确的是[ ] A.在某一特定的可逆反应中,只要其它条件不变,不论是否使用催化剂,平衡时产物的浓度总是一定的B.SO2氧化成SO3是放热反应,升高温度,逆反应速率增加,正反应速率减少,平衡向左移动C.对气体反应来说增加压强不一定会使化学平衡发生移动D.如果1 mol N2和3 mol H2在一定条件下,在密闭容器中反应,达到平衡时其必然生成2 mol NH319.在可逆反应x+2y2z-Q中,x、y、z是三种气体,为了有利于z的生成应采用的反应条件(1)高温(2)高压(3)低温(4)低压(5)除去z (6)使用催化剂[ ] A.(1) (2) (6) B.(1) (2) (5)C .(4) (5) (6)D .(2) (3) (5) 20.在密闭容器中进行下述反应: aA +bBcC +dD 当反应达到平衡时物质C 的浓度为[C]1,然后向容器中加入一定量的C ,待反应再一次达到平衡时,C 的浓度为[C]2.[C]1和[C]2的关系是[ ]A .[C]1<[C]2B .[C]1>[C]2C .[C]1=[C]2D .不一定,要视反应中方程式的系数而定21.取1 mol A 和a mol B 按A(g)+aB(g)bC(g)进行反应,当A的转化率为%时,同温同压下,测得混合气体的密度是原来的,5043则a 、b 可能是 [ ]A .a =1,b =1B .a =3,b =3C .a =2,b =3D .a =3,b=2二、填空、简答、计算 1.在N 2+3H 22NH 3反应中,经2s 后,NH 3浓度增加0.6mol/L ,则在此2s 内,用H 2浓度变化表示的平均反应速率为________2.氨水中的平衡关系,用方程式表示为________在平衡状态下,(1)增大压强,平衡________,则溶液的碱性________.(2)加入几滴强碱,平衡________.则溶液中________离子减少.(3)加入同浓度的氨水,平衡________.氨水的浓度________,碱性________.3.在一定条件下,将A 2和B 2两种气体,通入2L 密闭容器中,反应按下式进行:mol/(L ·s),v C =1mol/(L ·s),则x 的值为________,y 的值为________. 4.在一密闭容器内,盛有HI 气体,在400℃时建立如下平衡:2HI H 2+I 2-Q 如果降低温度、混合气体物质的量________,颜色________.*5.在一个容积不变的反应容器中,可以通过调节温度使下列反应A(g)+2B(g)2C(g)达到平衡时保持容器内气体总物质的量为15mol .现向反应容器中加6.5molA 、XmolB 、4molC .(1)若X=5.5时需要降低体系温度才能使反应达平衡时符合题设条件,则正反应为________热反应.(2)欲使该反应起始时维持逆向移动,则X的取值范围________.(3)今有一定温度压强下的另一反应D(g)+E(g)2F(g),当按1∶2的物质的量之比充入D、E两种气体后达平衡时,D在平衡混合气体中的体积为P%.今向容器中投入m mol D和n mol F及一定量E,达平衡后测得D的体积分数仍为P%,则所投入的E为________mol.*6.将4.6gN2O4晶体放入容积为4L的密闭容器里加热到298K,这时N2O4全部气化并发生反应:N2O4(g)2NO2(g),ΔH>0.在反应达到平衡时,(298K)测得混合气体的压强为同温度下N2O4气体尚未分解时压强的1.5倍.求:(1)平衡时容器内混合气体的总物质的量及压强各是多少?(2)平衡时容器内NO2与N2O4的物质的量之比是多少?*7.有反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在一定条件下达到平衡.(1)如果上述反应在定容的密闭容器中进行,随反应由开始至平衡,混合气体对同条件下氢气的密度将做何变化?(2)如果上述反应(定容定温)达到平衡后再向容器中压入一定体积的氩气,平衡将有何变化?(3)如果上述反应于定温时在定压容器中达到平衡后,再充入氩气,平衡将有何变化?*8.已知在800K时,FeO分解的K=3.5×10-14,H2O(g)分解的K=5.1×10-14.试比较在高温下和较低温度下,上述物质分解的难易程度.*9.在1000K恒温下,在密闭容器中发生反应:A(g)+3B(g)2C(g)并达到平衡.测得其平衡时的浓度分别为:[A]=2mol/L,[B]=5mol/L,[C]=3mol/L,求:(1)起始时A、B的物质的量浓度.(2)同温下将压强增大一倍,通过平衡常数的计算,说明平衡移动的方向.三、计算题1.在一定温度、压强和有催化剂存在时将N2和H2以体积比为1∶3混合,反应达到平衡时,混合气体中NH3占25%(体积分数).如果混合前N2为100mol.试计算有多少mol N2转化为NH3?2.在373K时把0.5mol N2O4气体通入5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2浓度为0.02mol/L.在60s时,体系达到平衡,此时容器内压强是开始时的1.6倍.求:(1)在2s 时体系的压强为开始的多少倍?(2)在平衡体系内N 2O 4的物质的量.参考答案一、1.D 2.B 、D 3.D 4.A 5.D 6.D 7.C 8.C 9.B 10.A 11.D 12.A 、C 13.C 14.C 15.B 16.B 17.A 、D 18.A 、C 19.B 20.A 21.A 、D二、1.0.45mol ·L -1·s -1 2.NH 3+H 2ONH 3·H 2ONH 4++OH -(1)正向移动,增强 (2)逆向移动,NH 4+ (3)不移动,不变,不变 3.x=1,y =3 4.不变,变浅5.(1)放热(此时n 总=16mol ,反应需朝体积减小的正方向进行才能维持容器内n 总=15mol)为维持逆向进行要求: ①6.5+x 1+4<15,x <4.5 ②6.5+2+x 2+4=15 x=2.5 ∴2.5<x <4.5 (3)2m +n/2*6(1)n =0.05molN 2O 4.=·根据后前后前后46921510051...gg mol p p n n n -==n 后=0.075mol . 由PV =nRTp 4.6410Pa 4==×××=×nRT V 00758312984103..-(2)设分解的N 2O 4为x 由 N 2O 42NO 2得 0.05-x +2x=0.075 x =0.025则达平衡时∶=×∶-=∶=∶平平n n 0.0252(0.050.025)0.050.02521NO 2N2O 4*7.(1)减小 (2)不移动 (3)向正反应方向移动*8.温度越高,分解越容易;温度越低,分解越难.而且水的分解比FeO 的分解难易程度的变化更显著则[A]起=2mol ·L -1+1.5mol ·L -1=3.5mol ·L -1 [B]起=5mol ·L -1+4.5mol ·L -1=9.5mol ·L -1 (2)压强增大一倍,即浓度增大一倍即[A]=4mol ·L -1 [B]=10mol ·L -1 [C]=6mol ·L -1K =[C]0.036Q [C]=0.009=910K 223[][][][]A B A B ·=·=加压后的浓度商=·=·×<3233233256410-因此反应向正方向移动.三、1.由气体状态方程得出平衡时NH 3占混合气体的摩尔分数也是25%21003002nn n n -+-+=%=25n 40 mol所以有40 mol N 2转化为NH 3.由气体状态方程有P P 2100252002505=0.5=1.1-+...××即2s 时体系的压强为开始的1.1倍平衡-== (0.5x)mol 1.6x 0.3mol05205..-+x x平衡时N 2O 4的物质的量为0.5-0.3=0.2mol。
