第九章 醛酮醌新
有机物醛、酮、醌

OH R-C-OR' H
OR' R-C-OR' H
¥¥¥¥ ° ¨¥¥¥ ¨¥
¥¥¥ ¨¥¥ ¨¥
缩醛具有双醚结构,对碱和氧化剂稳定,但遇酸迅速水解 为原来的醛和醇 O OR' + H O/H R-C-H + 2R'OH R-CH-OR' 2
¥¥ ¥¥¥¥¥¥¥¥ ¨
所以,制备缩醛时必须用干燥的HCl气体,体系中不能含水。
O O CH3C-CH2-CCH3 2,4- 戊二酮 戊二酮
三、 醛和酮的物理性质
物态:CH2O为气体;C2-C12醛、酮为液体;C13以上醛、 酮为固体。
沸点:与分子量相近的醇、醚、烃相比, 醇>醛、酮>醚>烃。 原因:a. 醇分子间可形成氢键,而其它不能形成氢键; b. 醛、酮的偶极矩大于醚、烃的偶极矩:
一些醛和酮的物理常数
四、 醛和酮的化学性质 (1) 羰基的亲核加成
(甲) 加氢氰酸 (乙) 加格氏试剂 (丙) 加亚硫酸氢钠 (丁) 加醇 (戊)加氨的衍生物
(2) α-氢原子的反应
(甲) 卤化反应 (乙) 缩合反应
(3) 氧化反应 (4) 还原反应 (5) Cannizzaro反应(岐 化反应)
H2/Ni
NaBH4
RCH=CHCHO
-CH=CHCHO
¥¥¥
RCH2CH2CH2OH
-CH=CHCH2OH
¥¥¥
(B)
C=O
[H]
CH 2 (Clemmensen还原法,酸性介质)
[H]: Zn-Hg/HCl
5、 岐化反应
没有-活泼氢的醛在强碱作用下,发生分子间的氧化还原而 生成相应醇和相应酸的反应。
+
09有机化学第四版课件编(第9章_醛酮醌)课件

含3个α-H的醛、酮在碱性条件下卤代时, 3个α-H全被 卤素取代。生成的三卤代醛、酮,在碱性溶液中分解成 CHX3和羧酸盐。称为卤仿反应。
用次碘酸钠(I2+NaOH)作试剂,产生具有特殊气味的黄 色结晶的碘仿,称为碘仿反应(iodoform reaction)。
O CH3C -R
I2/NaOH
O I3CC-R
C=N Y
CO +
H2N OH H2N NH2
H2N NH
NO2
H2N NH
NO2
O
H2N NHCNH2
C N OH
肟
C N NH2
腙
C N NH
苯腙
NO2 2,4-二硝
C N NH
NO2 基苯腙
O
C N NHCNH2
缩氨脲
羰基化合物与羟氨、2,4-二硝基苯肼及氨基脲的加成缩 合产物,都是结晶,具有固定熔点,可用来鉴别醛、酮。 加成缩合产物,在稀酸作用下能水解为原来的醛和酮,可 用这些反应分离、提纯醛、酮。
第九章 醛 酮 醌
Ⅰ 醛(aldehydes)和酮(ketones)
第一节 醛和酮的化学性质
4、还原反应
RCH H
Oδ 1、亲核加成反应 Cδ+ H 3、氧化反应
R
2、α-H的反应
1、羰基上的亲核加成反应(nucleophilic addition)
(1)与 HCN 加成反应 反应是可逆的
δC+=δO- +
砖红色
注意 Fehling试剂不氧化芳醛 Benedict试剂不氧化甲醛
酮类一般不易被氧化。在强氧化剂条件下,被氧化成 碎片,无实际意义。
O RCH2-a C-b CH2R' [O]
有机化学课件第五版汪小兰第9章醛、酮、醌

醛、酮、醌
• 醛、酮、醌的结构、分类和命名
• 醛、酮、醌的物理性质
• 醛、酮、醌的化学性质
9-1 醛和酮的结构、分类及命名
一、结构 • 醛、酮:分子中含有羰基,故称为羰基化合物。
• 官能团: 羰基
C O
O R C H 醛
O C H 醛基
O R C R1
O C 酮基
酮
• C、O:sp2 杂化;
3-戊酮
O CH3CH2C CH CH3
5 4 3 2 1
CH2=CHCHO 丙烯醛
CH3
2-甲基-3-戊酮
O CH3C CH CH CH3
1 2 3 4 5
5 4 3 2 1 CH3CH CHCHCH3
OH
3-戊烯-2-醇
3-戊烯-2-酮
CHO
苯甲醛 苯乙醛
CH2CHO
COCH 3
苯乙酮
O CH2C CH3
CH
CH
CH R
CH3
4 CH
3 CH
H 2 C 1 O
H
+ RMgX 1,4-加
H CH C OH
成 CH 3
CH R
CH
C
OMgX
H+, H2O
CH3
CH R
CH3CHCH2CHO R
CH3CH=CH-CHO
1,2加成
+
CH3CH2MgX
CH3CH=CH-C
OH
CH2CH3
1,4加成
CH3CH
• 酮较难与一元醇反应,与1 ,2-或1,3-二员醇比较容易 进行,产物为环状缩酮。
O
O
O
+ HOCH2CH2OH
《医用化学》第九章

π键 C σ键 O
一、醛和酮的分类、结构和命名
(三)醛和酮的命名
1.普通命名法
简单的脂肪醛按分子中的碳原子的数目,称为某醛。
O HCH
甲醛
O H C CH3
乙醛
O CH3 CH2 CH2 C H
丁醛
简单的脂肪酮可按羰基所连接的两个烃基命名。
在酸或碱的催化作用下,醛、酮的 α-H 被卤素取代的反应称为醛、酮αH 的卤化。
C CH O
酸或碱 + X2
C CX + HX O
二、醛和酮的性质
(二)醛和酮共有的化学类化合物与次卤酸钠作用产生卤仿的反应称为卤仿反应,即甲基 酮类化合物在碱性条件下与氯、溴、碘作用分别生成氯仿、溴仿、碘仿(统 称卤仿)的反应。
醛、酮的氧原子可以与水形成氢键,因此低级醛、酮可以与水混溶, 但随着相对分子质量的增加,它们在水中溶解度迅速降低。
醛和酮易溶于苯、乙醚等有机溶剂。脂肪族醛、酮相对密度小于1,芳 香族醛、酮大于1。
二、醛和酮的性质 (二)醛和酮共有的化学性质
1.亲核加成反应
由亲核试剂与带正电荷的羰基碳之间发生的加成反应称为亲核加成反应。 亲核加成反应的通式为
三、与医学有关的醌类化合物 (一)维生素 K
• 维生素 K 又称凝血维生素,是醌类化合物的一种。 • 维生素 K 的来源丰富,健康成人和年长儿童一般不会因为膳食供
给不足而发生维生素 K 缺乏。 • 血清维生素 K2 及维生素 K2 缺乏诱导产生的异常蛋白检测技术的突
破。 • 维生素 K2 能够消除导致帕金森综合征的一个遗传缺陷的影响。
一、醌的结构和命名
O
9 醛酮和醌

应用举例 甲醛→ 甲醛→ 1°醇
O H C
1.R"MgX/干醚 H 2.H2O/H+
R"CH2OH
环氧乙烷→ 环氧乙烷→ 1°醇
CH2 CH2 1.R"MgX/ 干醚 2.H2O/H+ O
R"CH2CH2OH
其它醛→ 其它醛→ 2°醇
O R C H
1.R"MgX/ 干醚 2.H2O/H+
R" RCH OH
应用举例
O CH3CCH3
HCN
OH CH3CCH3 CN
α-甲基 α-羟基丙腈 甲基- 羟基丙腈 甲基
OH
H2O H+
H2SO 4
CH3CCOOH CH3
CH2
CCOOH CH3
2-甲基 羟基丙酸 甲基-2-羟基丙酸 甲基
2-甲基丙烯酸 甲基丙烯酸
CH3OH
CH2 H2SO 4
CCOOCH3 CH3
O O
O
1,4-萘醌 α-萘醌) 萘醌(α 萘醌) 萘醌 1,2-萘醌(β-萘醌) 萘醌(β 萘醌 萘醌(β 萘醌)
O
9,10-蒽醌(蒽醌) 蒽醌(蒽醌) 蒽醌
O
§8-2
醛和酮的理化性质
一、结构与性质 σ σ π Cσ
O
C O
δ+
δ-
C O
C和O:sp2杂化,π键成键电子对在氧原子周 和 : 杂化 杂化, 键成键电子对在氧原子周 围出现的几率较大,电子密度分布不均等。 围出现的几率较大,电子密度分布不均等。
OH CH3CCH3 CN
OH
HCN
H+
不反应 2 ~ 3min反应完成 反应完成
汪版有机第九章醛酮醌

CH3CHCH2CHO OH
Δ
CH3CH CHCHO + H2O
除乙醛的羟醛缩合得到直链化合物外,其他醛的羟醛 缩合产物都是带有支链的。
产物特点:羟基在β-碳上,支链在α-碳上。 使用两种带有α-氢的不同的醛进行羟醛缩合,则产物 较复杂,至少有四种,不适于在合成上应用。
用一种无α-氢的醛和另一种有α-氢的醛,进行交叉羟醛 缩合,则有合成价值。
CH3CHCH2CHO OH
CH3CH CHCHO + H2O
羟醛缩和反应的历程,同时体现了羰基化合物的两大特 性:α-氢的酸性,和羰基的亲核加成。
-
CH3CHO + OH CH3 C O
-
[CH2CHO
-
CH2
CH] + H2O
O-
H + CH2CHO
CH3CHCH2CHO
O-
H2O
CH3CHCH2CHO OH
制备少一个碳的羧酸盐
这一反应称为卤仿反应。
若使用的卤素是碘,就称为碘仿反应。 碘仿是不溶于水的黄色固体,有特殊气味,因此常用 碘仿反应来检验乙醛或甲基酮的存在。 羟基在2-位上的醇,可被次卤酸钠氧化成甲基酮结构, 也能起碘仿反应。
I2 + 2NaOH
NaIO + NaI + H2O
OH
NaIO
1)给电子性基团增多 2)空间位阻增大
R > H
R C=O > 甲基酮 C=O R'
反应活性降低
α-羟基腈分子中的氰基可以水解为羧基,也可以还原为 氨基,进而转化为许多有用的化合物。
H2O,H+
CHCN OH
CHCOOH OH
第9章 醛酮醌
说明:
Ⅰ用途:鉴别醛类 制不饱和酸
Ⅱ只氧化醛基,不影响双键。
幻灯片48
练习:
步骤:
羟醛缩合,加热脱水,本尼迪特试剂作用.
幻灯片49
5.还原反应 (适应 醛酮)
1)羰基还原为羟基
Ⅰ催化氢化
幻灯片50
幻灯片51
Ⅱ金属氢化物NaBH4 (硼氢化钠)
优点:选择性强,只还原醛、酮、酰卤中的羰基,不还原其它基团。
异丁醛
丙烯醛
幻灯片6
B.酮酮的命名与醚相似,按照羰基所连烃基来命名。
二甲(基)酮
苯乙酮
幻灯片7
系统命名法
选主链:含羰基和重键,Ar–取代基
编 号:近羰基端,指明羰基位置和数目
3-甲基丁醛
βα
β-甲基丁醛
3-苯基-2-丙烯醛
幻灯片8
4-苯基-2-丁酮
4-羰基戊醛
或:4-ቤተ መጻሕፍቲ ባይዱ酮醛
幻灯片9
练习
Z-13-二十碳烯-10-酮
幻灯片52
幻灯片53
2)羰基还原为亚甲基的反应
Ⅰ沃尔夫—凯惜纳—黄鸣龙反应
幻灯片54
练习:
步骤: 酰基化, 黄鸣龙反应.
幻灯片55
Ⅱ克莱门森还原法Zn—Hg / HCl
对碱敏感时可用克莱门森还原法(锌汞齐)
幻灯片56
幻灯片57
6.歧化反应——坎尼扎罗(Cannizzaro)反应
条件: 无α-H 的醛
反应活性
亲核试剂一定,不同类型醛酮反应活性大小
结论:醛>酮,R小的> R大的
幻灯片20
④分析
相同点:都有双键,都能加成.
不同点:
亲核加成
有机化学课件-第九章醛、酮、醌

O
O C-CH 2CH 3 1 环己基 1 丙酮
O
COCH 2CH 2CH 3
C-CH 3 1 苯基 1 乙酮 α 萘 1 丁酮
2 环己烯酮
苯乙酮
炔烃水合
•乙炔水合生产乙醛。
•在汞盐催化下,生成羰基化合物,除乙炔外,其他炔 烃水合均生成酮:
例1:
例2:
傅-克酰基化反应 •芳烃在无水三氯化铝催化下,与酰卤 或酸酐 作用, 生成芳酮:
• 醛与二元醇反应生成环状缩醛:
例如: 制造合成纤维“维尼纶”:
聚乙烯醇
甲醛
• 酮也能与醇生成半缩酮或缩酮,但反应较为困难。 而酮和1,2-或1,3-二元醇比较容易生成环状缩酮:
• 常用1,2-或1,3-二元醇与生成环状缩醛以保护羰基。
补充1:保护羰基 例1
补充2:保护羰基
(4)与H2O加成:生成胞二醇,称为羰基的水合
O R R an ketone
9.1.1 醛、酮的结构和命名 (1)醛酮的结构
易受亲核试剂进攻, 发生亲核加成
sp2
羰基π电子云示意图 甲醛的结构
偶极矩 2.27D
偶极矩 2.85D
(2)醛酮的命名 (1) 脂肪族醛酮命名: 以含有羰基的最长碳链为主链, 支链作为取代基,主链中碳原子的编号从靠近羰基 的一端开始(酮需要标明位次):
-甲基丙烯酸甲酯(90%)
• 第二步包含:水解、酯化和脱水等反应。
(2)与亚硫酸氢钠加成 • 醛和脂肪族甲基酮 (或七元环以下的环酮 )与之 反应,生成 -羟基磺酸钠
在酸碱下可逆反应,分离提纯
• -羟基磺酸钠易溶于水,不溶于饱和亚硫酸氢钠。将 醛酮与过量的饱和亚硫酸氢钠水溶液混合在一起,醛和 甲基酮很快会有结晶析出。可以此来鉴别醛酮。
醛

*2 反应机理
CH3 CH3
-
C=O
CN
可逆
CH3 CH3
CN CN H2O CH3 C C OH O- 不可逆 CH3
*3 反应条件
反应必须在弱碱性条件下进行。 反应必须在弱碱性条件下进行。
(3)醛、酮与炔化钠的加成 )
R-C≡C-Na+ + ≡ NaNH2 (-NH3) R-C≡CH ≡
C=O
乙醛( 乙醛(89%) ) 环己酮( 环己酮(~35%) )
O
O
丙酮( 丙酮(56.2%) ) 3-戊酮(2%) 戊酮( ) 戊酮
O
丁酮( 丁酮(36.4%) ) 苯乙酮( ) 苯乙酮(1%)
O
>
>
>
反应体系须维持弱酸性 强酸性和强碱性可使加成产物分解
*4 应 用
提纯醛、甲基酮、环酮。 提纯醛、甲基酮、 制备α 羟晴 制备α-羟晴
*1 反应式
亲核加成
CH3CH=O + NH3
HO H CH3CH-NH
-H2O -H2O
CH3CH=NH
HO H 亲核加成 CH3CH=O + RNH2 CH3CH-NR
亚胺
CH3CH=NR
H OH -H2O 亲核加成 CH CH-NR CH3CH=O + R2NH 2 2
亚胺 西佛碱
CH2=CHNR2
O O
*2 反应机理
碱 催 化
C=O ROC OOR
ROH OH C + OR H -H2O C + OR
ROH C
OH OR
-H+
C=O
H
+
有机化学ppt-醛酮醌

a.α-C上含有三个活泼氢的醛,酮与碘的氢氧化钠溶液作用, 生成碘仿(黄色沉淀,有特殊气味)和羧酸钠,称碘仿反应。
b.常用此反应鉴别乙醛和甲基酮以及有( 醇。
)结构的
(2)羟醛缩合反应
O
H
OH
稀OH-
CH3 C H + CH2 CHO
CH3 CH CH2 CHO
乙醛
乙醛
β- 羟基丁醛
是增长碳链的一种方法。
O
O
O
O
O
O
1,4-苯醌 (对苯醌)
1,2-苯醌 (邻苯醌)
O
1,4-萘醌 (α-萘醌)
1,2-萘醌 (β-萘醌)
二、重要的醌及性质 (一) α-萘醌和维生素K
许多天然的植物色素含有α-萘醌的结 构,如维生素K类,它们存在于绿叶蔬菜 中,具有促进凝血作用,故在医学上常用 作止血剂,亦可用于预防长期口服广谱抗 生素药物引起的K族维生素缺乏症。
3-甲基丁醛 β -甲基丁醛
O CH3CHCCH2CH3
CH3 2-甲基-3-戊酮
CH3CH=CHCHO
2-丁烯醛
(CH3)2CHCH2COCH3 4-甲基-2-戊酮
CH3COCH2COCH2CH3 2,4-己二酮
O
CH3CH=CHCCH2CH3
4-己烯-3-酮
OHCCH2CHO 丙二醛
三、醛酮的物理性质
目录
Contents
第一节 醛和酮 第二节 醌
第二节 醌
一、醌的结构和命名 醌是一类具有环状共轭体系的环己二烯二酮类化合物
O
O
O
O 对位
邻位
一、醌的结构和命名
命名:以相应的芳烃衍生物来命名,苯醌、萘醌、蒽醌等,两
经典:第九章醛酮醌习题答案
OH CH 3CH 2C CH 2CH 3
CH3 CH3
O CH2 (3) CH3CH2CH
O CH2
(4)
CH CH CHO
CH C CHO
(5) H3C
CH2OH + HCOO
OH
OH
(6) CH 3CH CH CH CH 3 CH 3CH2CH 2CH CH 3
(8)
CH N OH
O
(10)
OH
环己醇环己酮饱和nahso环己醇乙醚羟基磺酸钠环己醇蒸馏纯化环己酮蒸馏纯化干燥某化合物a的分子式为c5h12o氧化后得分子式为c5h10o的化合物bb能和24二硝基苯肼反应得黄色结晶并能发生碘仿反应
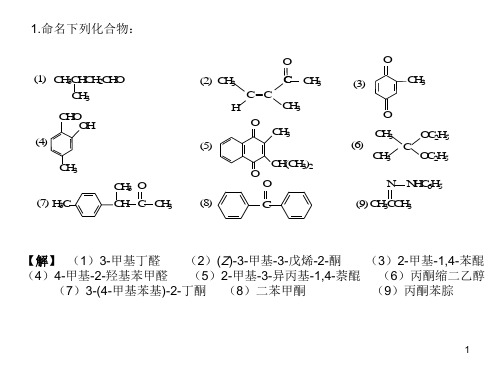
1.命名下列化合物:
(1) CH3CHCH2CHO CH3
CHO OH
(4)
CH3 (7) H3C
CH3 O CH C CH3
O OCH3
(7)
CH 2CH 3
(9)C6H 5CH 2CO O + CH I3
4
4.完成下列合成(无机试剂可任选):
Br (1) 由CH2=CH2合成CH3CH2CHCH3
O (3)由CH3CH2CH2OH合成CH3CH2CH2CCH2CH3
O
(5)由 合成
CH2 C
OH (2) 由CH CH合成CH3CH2CHCH3
【解】 ①A:C6H12O,=1 A为一个含双键链状或单环含氧化合物; ②A可与羟胺反应,但不与吐伦试剂、饱和亚硫酸氢钠溶液反应 A为脂肪族链状非 甲基酮;
③A催化加氢得到B:C6H14O,=0 B为饱和链状脂肪族仲醇; ④B同浓硫酸共热脱水生成C:C6H12 C为烯烃; ⑤C经臭氧化后还原水解得到化合物D和E D和E为醛酮类化合物; ⑥D能发生碘仿反应,但不能发生银镜反应 D为甲基酮; ⑦E不能发生碘仿反应,但能发生银镜反应 E为超过2个碳原子的醛。 由于C只有6个碳原子,所以D和E分别为丙酮和丙醛:
第九章-醛酮醌

9.5.2. 醌的制备 苯醌:
萘醌 蒽醌
9.5.3. 醌的化学性质
碳碳双键的性质 羰基的性质 共轭双键的性质
(1)加卤素(碳碳双键的性质)
双烯合成-----Diles-Alder反应
(2)共轭加成(共轭双键的性质)
(3)羰基加成 互变异构体
(4)还原反应 (醌氢醌)
C H 2 = C H -C H O + 2 C H 3 C H 2 O HH +
O C 2 H 5 C H 2 = C HC H
O C 2 H 5
K M n O 4 C H 2C HC H O C 2 H 5 H + C H 2 C H C H O 冷 O HO H O C 2 H 5 H 2 OO HO H
有机玻璃的单体
—CN作为亲核试剂,负电荷在碳原子上,与之相似的 是炔基负离子也可与醛、酮发生亲核加成.用于制备炔 醇,且反应不可逆:
增链反应
(2)与亚硫酸氢鈉加成
反应历程:
饱和(40%)
鉴别
白色结晶
适用范围:醛、脂肪族甲基酮、少于八个碳的环酮
可逆性:
分离
间接法制备-羟基腈:
(3)与醇加成
(无水) (无水)
亲核加成
亲核加成反应——由亲核试剂进攻而引起的加成反应
亲核加成反应历程:
决定反应速度
sp2
比较——亲电加成反应
决定反应速度
sp3 X–
影响亲核加成反应因素: 电子因素:凡是增加羰基碳原子的正性有利于亲核加成 空间因素:空间障碍大不利于亲核加成
故:醛比酮易于反应
反应易难顺序:
试比较下列化合物发生亲核加成反应的活性大小:
【有机化学(纺织)】第9章 醛、酮和醌

第九章1.(1)苯乙酮 (2) 2-(1-甲基)丙基苯甲醛 (3)环己酮缩乙二醇 (4)1,5,5-三甲基-2-氧代环己甲醛 (5)2-甲基-1-苯基-3-羟基-1-丁酮 (6)4-甲基-7-氧代辛醛 (7)5-乙基-6-庚烯醛 (8)3-丁烯-2-酮 (9)(E)-1,4-二苯基-2-丁烯-1,4-二酮 (10)对溴苯基苯基甲酮肟 (11)5-硝基-2-萘甲醛 (12)1-环丙基-2-丙酮 2. CH=CHCHOCH 3CH(CH 3)2OCH 22CH 3OCCH 23O Br(1)(2)(3)(4)CH 3CH 3CH 3CH 2CCH 3NCONH 2CH 3CH=CHC=NNHC 6H 5(5)(6)(7)(8)OOCH 3CH 3CH 3CH 3CH 2CCH 3NCONH 2CH 3CH=CHC=NNHC 6H 5(5)(6)(7)(8)O OCH 33. (1)乙醛丁醛黄色沉淀(-)(+)(-)环戊酮NaOH土伦试剂(+)(-)银镜反应(-)无变化(2)CH 2CH 2CHO CH 23CHOC 2H 5O 土伦试剂(+)银镜反应(+)银镜反应(-)斐林试剂(+)砖红色沉淀饱和亚硫酸氢钠丙醛丙酮丙醇异丙醇I NaOH黄色沉淀(+)黄色沉淀(+)(-)(-)土伦试剂(+)银镜反应(-)丙酮异丙醇白色固体(-)(3)(-)戊醛2-戊酮环戊酮苯甲醛NaOH黄色沉淀(+)(-)(-)斐林试剂(4)(-)(+)银镜反应4.(1)正丁醇>丁酮>乙醚(2)HHOO O CH 2CHOCH 3CHO CH 33O >>>(3)CHO CHO CH 3CH 23OCH 33O>>>(4)丙酮>丁酮>2-戊酮 5.(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)N HN PhOMgBrCH(OH)2Cl 3CNCOOHHOOCCOOHOOH OOHOH OH SO 3Na6.(1)(2)(3)(4)OH+CH 3CHOO+HO OHO+HOOHCHOOH+CH 3OH半缩醛半缩酮缩酮缩醛7.(CH 3)3CCOCH 3COCH 3CH 2CHCH 3OH以上化合物能发生碘仿反应 8.(略) 9.(1)(2)(3)(4)COOHCHOOHHOCHOCOOHCH 3+CHCl 3CHI 3+10. 1、3、5、6 11.(1)(2)(3)(4)(5)(6)(7)(8)Me 3CCHOH+Me 3CCOONaOH+HOONaCOOHOHOHCH 3CH 2COONa12.(1)(2)(3)(4)(5)(6)(7)OClOClNCCHOOHCOOAgOHCH 3CHO +OHCCHO13.羰基吸收不同,双键和三键吸收不同,末端炔烃的吸收 14.(1)2-甲基-1,4-苯醌 (2)1,2-苯醌 (3)1,4-萘醌 (4)2,5-二氟-3,6-二羟基-1,4-苯醌 (5)1-氟-5-羟基-9,10-蒽醌 (6)5-羟基-1,4-萘醌 15.(1)(2)(3)(4)Br Br Br BrOONOHNOHHOClOOO16.CH 32CH 3O--CH 2CCH 2CH 3O BrCH 22CH 3O2CH 32CH 3O -OH-优先进攻酸性强和立体位阻小的氢CH 32CH 3OH +CH 32CH 3OH+CH 2CH 3CH 3OHCH 2OHCH 2CH 3(I)(II)2CH 2CCHCH 3O(I) 烯醇式结构更稳定17.(1)(2)(3)(4)(5)CH 3CH=CH-CH 2CH 2CH(OCH 3)2BrOCH 3C 6H 5COCHCNOH CH 32CH 3NHOH CHO CHOOO CH 3CH 3(11)OCH 3Br (12)18. BrCCH 3O (1)CH 2OH 2HClO OCH 3Br1) Mg, 无水乙醚2) CO 23) H 3O +O OCH 3HOOCH OH H 2SO 4H O +CCH 3O HOO43OH CH 3OOCCH 3O CH 3OOC CHOC OH CNCH 3CH 3C OH COOHCH 3242HgSO 4NaCN3+(2)(6)(7)(8)Ph PhOMgBr Ph PhOH CH 2OHCH 3CH 3COOH OH OOCH 2CH 3OOH (9)(10)Na(3)Br+CH 3CH 2CHOOHBrD1) Mg, 无水乙醚2)H 3O 1) Mg, 无水乙醚2)D 2O(4)KMnO H+OO1) NaOH 2)O(5)OOBrBrCH CH CH COClAlCl 3Br 2FeHCl(6)CH 3CH 2Br+PPh 3Ph C CH 3CHCH 33OPh 3P-CH 2CH 3Br -(7)HC CHNaC CNaC C CH 2CH 2CH 3CH 3CH 2CH 2322NaNH 2NH 3HgSO 4CH 3CH 2CH 22CH 2CH 2CH 3O(8)CHOCHOO Zn1) NaOH 2)CHO19.OCOOC 2H 5C 2H 5ONaOCOOC 2H 5-Na +3O CH 2Michael 加成O COOC 2H 5CH 3O2553COOC 2H 5OHOCOOC 2H 5O2C 2H 5OH (1)-2CHCCH CH CCH 3O O O CH 3CCH 2CH 2CCH 3O -OCH 3ONaOH (2)CH 3C H C PhO H +-H +CH 3H OH H CH 3C HOH +CH 3C H C OH Ph +PhCOCH 2CH 3重排H++(3)20.CH 3CH 33OH CH 3CH 33O CH 3CH 3CH 3CH 3CH 3O +CH 3CHO(A)(B)(C)[o]1) O 32) Zn, H 2OCH 3CH 3CH 3OH (A)H SO CH 3CH 3CH 3(C)21.CH 3OCH 3OCH 3CHOCH 3COOH COOH(A)(B)HClKMnO 422.HOCH 23O HOCH 2CHCH 3OH HOCH 2CH 2CH 3CH 3OCH 2CH 2CH 3(I)(II)(III)(IV)23.CH 3C CH 3C3CH 2CH 2CHOHOCH 3OOCH 3O(I)(II)or24.(1)红外光谱,后者在1700 cm -1附近有醛羰基的红外吸收峰。
第九章 醛 酮 醌
1. 羰基的加成反应:
羰基中碳原子电子云密度较低,易受 亲核试剂进攻,发生亲核加成反应
加成反应历程可用下列通式表示:
R1
δ+ C
δO
+
R1
O C
-
Nu (亲核试剂) (R) H
-
H Nu
+
R1 C
OH
(R) H
(R) H
Nu
亲核加成:反应活性影响因素 (1)羰基C上电子云密度:高,则反应活性小 (2)羰基C上空间位阻 :大,则反应活性小
第 九 章 醛 酮 醌 (C=O)
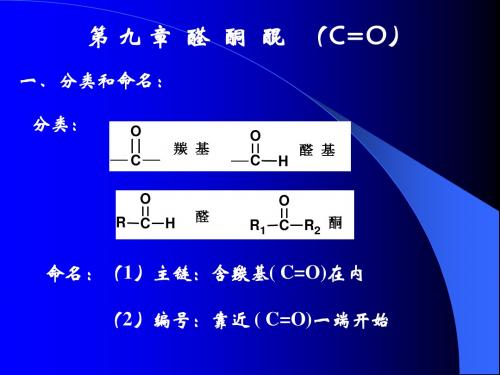
一、分类和命名: 分类:
O 羰 基 C
O R C H 醛
O C H
O R1 C
醛 基
R2 酮
命名:(1)主链:含羰基( C=O)在内 (2)编号:靠近 ( C=O)一端开始
O CH3
4
CH3
CHO
CH
3
1 CH2 CH 2
CH3
5
CH CH2
4 3
C
2
CH3
1
CH3 3-甲 基 丁 醛
+
CH
C
H
R CH
CH
C H O
H R H OH CH R C H O R CH C H
H2O
酮的羟醛缩合反应:空间效应和电子效应作用,活性小 不同分子间:交叉羟醛缩合 产物复杂,难以分离,合成意义不大 一般使用一分子有α-H,一分子无α-H的醛
OH CHO
+
CH3CHO
CH CH2 CHO
CH CH CHO
H
C2 H5
O 4-甲 基-2-戊 酮
CH3
有机化学 第9章 醛酮醌
HCN(bp26.5℃),常把无机酸加入醛(酮)和 NaCN水溶液,加酸时注意pH=8为好
增长碳链的一种方法 产物羟基腈是一类活泼化合物,便于转化为其 它化合物。 OH
H3O +
CH3 – C – COOH
CH3
O OH
HCN
OH
H
CH3CCH3
CH3 – C – CN
CH3
- H2O
CH3 – C – CH2NH2 CH3 CH3 CH2 = C—CN
C 6H 5 >
C H C H2 >
R
H
O
H
C H 2C H O H
C H 2C O C H 3 H
HC
CH
H
CH3
C H 2C H 3 H
pK a
1 5 .7 4
17
20
25
49
50
d
_
O
α-H活泼原因:-I,σ- π
R
C
H
C
d+
互变异构 在溶液中有α-H的醛、酮是以酮式和烯醇式互变 平衡而存在的
O 2N CHO > CHO > CH3 CHO
空间效应 羰基碳原子上连有较大的基团,不利于反应进 行,R或R’基团愈小,加成反应愈容易(羰基C 由SP2变成SP3立体障碍小)
H H C CH3 O > ph C CH3 O > CH3 C O > C 2H 5 O > C 2H 5 同碳数环酮比开链酮 活泼,因加成时羰基 碳 由 SP
C = N—NHCONH2 (缩氨脲)
(二)α-H原子的反应
有机化学理论课 第九章 醛、酮、醌

第九章 醛、酮、醌一、教学目的和要求1、掌握醛、酮的结构特点及主要化学性质,以及如何运用这些性质上的异同点进行鉴别。
2、熟练掌握醛、酮的系统命名法,了解醌的系统命名法。
3、熟练掌握醛、酮的结构、理化性质及用途。
4、掌握亲核加成机制、醛酮氧化特性、羧醛缩合、Canizzaro 反应、碘仿反应特征。
5、了解典型醛、酮、醌的性能、用途。
二、教学重点与难点重点是醛、酮亲核加成机制、羧醛缩合、Canizzaro 反应、碘仿反应特征。
难点是醛、酮亲核加成机制、羧醛缩合。
三、教学方法和教学学时(1)教学方法:以课堂讲授为主,结合必要的课堂讨论。
教学手段以板书和多媒体相结合,配合适量的课外作业。
(2)教学学时:4学时。
四、教学内容 1、醛和酮(1)醛、酮的概述 (2)醛、酮物理性质 (3)醛、酮化学性质 (4)个别化合物 2、醌3、合成例题五、总结、布置作业9.1 醛和酮(Aldehyde and Ketone )醛、酮、醌统称羰基化合物。
醛:羰基至少连有一个H 原子,官能团:醛基 酮:羰基与两个烃基相连,官能团:羰基或酮羰基 醌:一种特殊的不饱和环状二酮一、醛、酮的分类和命名:4-甲基戊醛 6-甲基-2-庚酮3H 33CH 34-甲基-2,6-庚二酮 4-甲基环己酮CHO苯甲醛 苯乙酮1-苯基-1-丙酮4-甲基-2-戊烯醛5-苯基-4-戊烯-2-酮α –氯丁醛二、醛、酮的化学性质回顾烯烃亲电加成的特征:亲电试剂、π-络合物及正碳离子的形成羰基进行加成反应时,其历程与C =C 加成相同吗? 碳-碳双键及碳-氧双键的比较C C羰基碳显正电性,易受亲核试剂的进攻羰基碳氧双键与烯烃碳碳双键相似,也是由一个σ键和一个π键构成,但氧原子电负性比碳大,使成键电子云偏向O ,O 原子上电子云密度较大而C 原子上电子云密度较小。
醛、酮有许多相似的化学性质,但醛比酮更活泼。
醛、酮分子中比较容易发生反应的部位是羰基、醛基上的H 和烃基上的α-H 等。
有机化学-第九章 醛 酮 醌

B CH3CHO + CH3CH2MgBr
分别由苯及甲苯合成2-苯基乙醇
CH
3
Cl 2 光照 Br Br
2
CH 2 Cl
Mg Et 2 O
CH 2 MgCl
1 ) HCHO 2) H +
CH 2 CH 2 OH
MgBr O Mg Et 2 O H
+
Fe
H 2O
N u· ·
-
δ+
δ-
加成
+
C
O
Nu
C
O
-
进一步反应
产物
氧亲核试剂——RO-,OH硫亲核试剂——SO3H-,RS氮亲核试剂——RNH2,HONH2,RNHNH2
碳亲核试剂——CN-,RMgX
(1) 加氢氰酸: 醛、脂肪族甲基酮、8个碳以下的环酮可以和HCN加成, 生成α-羟基腈。 α-羟基腈水解得α-羟基酸。
羟胺
OH
- H 2O R
[R
C R
NH
OH] R
C
N
OH
肟
R C R O + NH2 NH2
R C R N NH2
肼
腙
R C R O + NH2 N H C 6H 5
R C R N N H C 6H 5
苯肼
R C R O + NH2 NHCONH 2 R R
苯腙
C
N
NHCONH2
氨基脲
缩氨脲
这类反应一般在pH = 5的条件下进行。
醛酮互为同分异构体
(碳数相同的一元饱和醛酮有相同的通式CnH2nO) 醛有碳链异构、酮有碳链异构和官能团位置异构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+
H C C
O
H C
O C
O C C
H C
O C
+
C
O C
C HO
C
•醛酮的自身羟醛缩合
OH 2 CH3CH2CH2CH O KOH CH3CH2CH2CHCHCH C2H5 NaOEt 2 C7H15CH O C7H15CH CCH C6H13 O CH3 CH3 O KOH O CH3 OH CH3 CH3 - H2O O CH3 O O
•合成应用
H2O H C O C HCN NaOH H+ H C OH C CN 浓 H2SO4 H C OH C COOH
羟基酸 COOH C C 不饱和酸
与格氏试剂的加成:
O C MgX
dry ether
OMgX C H2O
OH C R
+
R
R
•合成应用:
CH2O 1)RMgX R'CHO 2)H2O O R' C R'' R' OH C R'' R R' R CH2 OH CH R OH
C H
C
H(R)
碳有吸电子基 氢有弱酸性
羰基碳有亲电性 可与亲核试剂结合
9I.2.2 羰基上的亲核加成反应: 常见的亲核试剂:
R RMgBr, RLi R C CMgBr , R C CNa LiAlH4, NaBH4 NaCN NaHSO3
负离子型
Nu
R C C H CN HOSO2
亲核性 较强
醛酮-H 的弱酸性和有双位反应性的 烯醇负离子:
O R' C H CHR R' OH C CHR
烯醇enol
O R' C CHR H B R'
O C CHR R'
O C CHR
烯醇负离子 enolate E+
碳负离子 E+ O
E
O C R' CHR R'
C CHR E
主要反应
•一些羰基-H酸性的比较:
分子型
NuH
H2NR, HNR2 HOR H2O
亲核性 不强
与NaCN 的加成(生成-羟基腈) :
O C OH HCN NaOH(微量) C CN
-羟基腈
HCN + OH O C + CN
CN O C
+ H2O OH CN HCN C CN
•羰基碳的电正性越高,亲核加成越容易; •羰基所连烃基的位阻越大,反应越难;
•碱催化下含-H的醛以-C对另一分子 羰基亲核加成,形成-羟基醛的反应;
O O C + C H O C OH OH C C O C or C C C
-羟基醛(酮)
-不饱和醛(酮)
羟醛缩合示例:
O H3C C H + H3C O C H OH H3C CH CH2 O C H
OH
•碱催化下羟醛缩合反应机理:
O R C H H3C O C H H O C H
醛
aldehyde
乙醛
acetaldehyde
甲醛
formaldehyde
•羰基连两个烃基为酮;
O R C R' O H3C C CH3 O H3C C CH2CH2CH3
酮
ketone
丙酮
acetone
2-戊酮
2-pentanone
•羰基连一个羟基则为羧酸;
[H] H3C CH
OH + H
OH CH CH2
OH
双键和酯基 不受影响
Clemmensen还原醛酮羰基至亚甲基
O R C R'(H) Zn-Hg HCl 克莱门森还原 R CH2 R'(H)
O Cl Ar H AlCl3 C R Ar
O C R
Zn-Hg HCl
Ar
CH2
R
CH3 O Cl C R AlCl3
O R C O R C ONa + Cu2O 土红色沉淀 ONH4 + 2 Ag 银镜
强氧化剂能使酮氧化成羧酸, 包括
•KMnO4;
• K2CrO7;
• HNO3 ;
O R CH2
1
O CH2R
2
O OH + HO C O CH2R2 + O OH + HO C R2
C
强氧化剂
R1
C
R1CH2
H3C
O C
CH2CH2CH2CH2
O CH3CH2CHCH2CH2 OH C H
O
H
4-羟基己醛 - 羟基己醛
4-苯基-3-丁烯醛
- 苯基- , -丁烯醛
芳基作为取代基
CHO
CHO O
CHO
2-丁烯醛 巴豆醛
苯甲醛
呋喃甲醛 糠醛
简单的酮多用普通命名,叫某(基)某 (基)酮,有时烃基中的基字可以省略, 烃基中简单的列在前面;
氨基脲
H2NHN O2 N
NO2பைடு நூலகம்
H - H2O
C
N NH O2N 2, 4-二硝基苯腙 黄色固体
NO2
2, 4-二硝基苯肼
与醇的加成:
O C ROH 干HCl C OR 半缩醛(酮) OH ROH 干HCl OR 缩醛(酮) OR C + H2O
与醇的加成:
O C H+ OH C OH - H+ C +H RO HOR H
伯醇
仲醇
H3C
CH CH
CH
Catalyst
Catalyst = Ni, Pt, Rh等
•催化氢化是立体选择性反应;
位阻小
N H2 Ni O OH
H3C
H3C N H +
H3C N OH H
位阻大
主要产物
次要产物
氢化金属还原(第IIIA族元素)
R'CHO LiAlH4 or NaBH4 O R' C R OH LiAlH4 or NaBH4 H2O R' CH R 仲醇 H2O R CH2 OH
酸催化卤化机理:
H O C H O C X C H XO C X C + HX C C H OH C
Slow
- H+ C 烯醇化 X C X
O
H
酸催化卤化反应活性次序:
H H C H O C R' H C H O C R' R" C H O C
羟醛缩合(aldol condensation)
PK= 9.0
醛酮-位的卤代反应: 碱催化卤代:
O C H C O X2 , OH C C
X = Cl, Br, I
X
•碱催化卤代机理:
O C H X OH X C C C O C X O C
•碱催化卤代反应活性比较:
H H C H O C R' H C H O C R' R" C H O C
C CH3 CH3
H3+O
H3C C (CH2)2 C CH3
9I.2.3 羰基的还原反应 催化氢化 •反应中不饱和键将全部被还原,包括 羰基、双键等:
R C H R C R' O O
H2 Catalyst H2 Catalyst O H2
R CH H R CH R' OH H3C CH2 CH2 CH2 OH OH
O R C OH H O C OH O H3CH2C C OH
羧酸
carboxylic acid
甲酸
formic acid
丙酸
propionic acid
醛的系统命名法: 选择含醛基的最长 碳链作母体, 醛基碳开始为1顺次编号; 普通命名中把与羰基碳相连的碳叫碳,其后称-、-、-、-等;
-H C NR
•醛(或酮)与氨衍生物的加成缩合反应收 率很高,产物易于提纯,并有特征颜色, 可用于分离及鉴定氨或醛酮:
H2NOH
H - H2O H - H2O
C
N
OH
羟胺
H2NNHR"
肟 oxime 腙类 hydrazone
C
N
NHR
取代肼
C O O H2NHN C NH2
O H - H2O C N NH C NH2 缩氨基脲
O H3C C (CH2)2 Br H3C O C (CH2)2 OH C CH3 CH3
O H3C C (CH2)2 Br
OH OH H+
O O H3C C (CH2)2 Br OH
Mg 无水乙醚 O
O O H3C C (CH2)2 MgBr OH CH3
O O 1) acetone H3C C (CH2)2 2)H2O
伯醇
•氢化金属还原历程:
Al O C Al H O C H H2O
OH C H
•LiAlH4 与 NaBH4 的比较:
试剂要求
LiAlH4 NaBH4 无水 可有水
反应速度
快 较慢
还原能力
强 较弱(温和)
选择性
较差 较好
•氢化金属还原示例:
O H3C CH CH CH
H O 1)LiAlH4 2) H2O CH2OH O C OMe 1)NaBH4 2) H2O HO C H O OMe CH2OH
+
OH C OR
OH2 +H -H
+
HOR - H2O C OR
