“脑淀粉样发作”3例临床及影像分析
颅内淀粉样变诊断标准

颅内淀粉样变诊断标准全文共四篇示例,供读者参考第一篇示例:颅内淀粉样变(Cerebral Amyloid Angiopathy,CAA)是一种以脑血管中淀粉样蛋白沉积为特征的疾病。
随着人口老龄化的加剧,颅内淀粉样变的发病率也逐渐增加。
对于颅内淀粉样变的早期诊断至关重要,可以帮助医生及时采取治疗措施,提高患者的生存质量。
下面将介绍颅内淀粉样变的临床表现、影像学特征和诊断标准。
一、临床表现颅内淀粉样变主要表现为多发小血管病变所致的脑出血、蛛网膜下腔出血、梗死等病变。
病变发展较慢,早期症状可能不明显,常见的临床表现包括头痛、脑干症状、认知障碍、肢体活动障碍等。
有时也会出现视觉障碍、言语障碍、偏瘫等症状。
二、影像学特征颅内淀粉样变的影像学特征主要表现在颅内血管的影像学改变和脑实质淀粉样斑块的影像学表现。
在颅内血管的影像学检查中,可见血管壁增厚、狭窄、扩张等异常改变,有时还可见到颅内出血灶。
在脑实质淀粉样斑块的影像学检查中,可见脑实质内出现淀粉样斑块,多为局限于血管周围。
三、诊断标准目前,颅内淀粉样变的诊断主要依靠临床表现、影像学检查和病理学检查。
根据美国神经学会的颅内淀粉样变诊断标准,颅内淀粉样变的确诊需要符合以下两个条件:1. 脑组织或脑血管中存在淀粉样蛋白沉积;2. 在病理学检查中,淀粉样蛋白沉积局限于血管。
临床表现和影像学检查也是确诊颅内淀粉样变的重要依据。
如患者有反复蛛网膜下腔出血、脑出血、短期认知功能损害等临床表现,结合影像学检查发现脑血管壁增厚、异常扩张等影像特征,有助于进一步提高颅内淀粉样变的诊断准确性。
颅内淀粉样变是一种常见疾病,对于其早期诊断至关重要。
通过临床表现、影像学检查和病理学检查的综合分析,可以提高颅内淀粉样变的诊断准确性,有助于及时采取治疗措施,提高患者的生存质量。
【实际字数约772字】第二篇示例:颅内淀粉样变是一种罕见而严重的神经退行性疾病,通常表现为大脑中的淀粉样斑块聚集在神经元周围,影响神经元的正常功能。
病例报道:脑淀粉样血管病相关炎症

病例报道:脑淀粉样血管病相关炎症男,76岁,右利手。
因为认知功能下降3周,车祸3天就诊。
既往:高血压,房颤和肾功能障碍。
查体发现血压190/106 mmHg,其他生命体征正常。
蒙特利尔认知评价总分为12/30分,Gerstmann综合征表现。
脑CT如下图1A,显示非对称性双侧顶枕叶、左侧颞叶低密度。
脑MRI显示T2/Flair相应区域高信号(图1B),GRE可见微出血(图1C),DWI未见弥散抑制,无强化。
影像学鉴别诊断包括转移癌,胶质瘤,原发性CNS淋巴瘤,ADEM,PML,可逆性后部脑病综合征,血管炎。
血液系统检查、生化、代谢等各项检查正常,肾功能异常(具体数值未提供)。
抗核抗体,ANCA,抗磷脂抗体,血沉,C反应蛋白正常。
腰穿CSF常规正常,糖6.2 mmol/l,蛋白1.03 g/l;微生物阴性。
基因分析为APOEε3等位基因纯合子。
因为基因分析为APOEε3等位基因纯合子,结合病史和神经印象,临床诊断为脑淀粉样血管病(CAA)相关炎症(译者注:APOEε3等位基因纯合子发生CAA相关炎症的报道少见,大多为ε4/ε4基因型)。
给予甲强,病情很快好转。
3个月后复查脑MRI显示白质病变完全消失(图2),微出血数量未见明显增加。
6个月时蒙特利尔认知评分改善为24/30。
最终诊断为CAA相关炎症。
CAA相关炎症的诊断要点包括:1.急性/亚急性起病2.年龄>= 40岁3.头痛或认知功能改变或局灶性神经系统体征或癫痫4.MRI显示T2/Flai片状或融合高信号5.CAA的其他MRI表现(译者注:比如微出血?)6.排除其他疾病文献出处:doi: 10.1212/WNL.0000000000003131.。
脑淀粉样血管病临床特点及诊疗指南

脑淀粉样血管病(CAA)是一种以皮质和软脑膜血管壁内存在β淀粉样(Aβ)蛋白为特征的脑小血管病,可导致小血管壁损伤、微出血、梗死、脑皮质表浅铁沉积(cSS)、脑凸面蛛网膜下腔出血(cSAH)及脑叶出血。
近几年磁敏感成像、正电子发射断层显像和脑脊液生物标志物分析领域的新技术发展促进了对CAA 的认识,CAA的临床意义也越来越受到重视。
临床表现:CAA多见于60岁以上老年人。
CAA可以表现出急性症状及慢性症状。
急性症状包括脑叶出血、短暂局灶性神经系统事件(TFNEs)等症状。
少见情况下还可以因淀粉样血管炎或相关炎症引起快速进展认知和神经功能下降。
慢性症状包括逐渐发生的痴呆、认知障碍、语言障碍和步态障碍等症状。
短暂局灶性神经系统事件又称为淀粉样蛋白发作。
TFNEs是脑淀粉样血管病重要而特别的临床表现。
在TFNEs的一系列症状中,又可以分成阴性症状和阳性症状两类表现,阴性症状与阳性症状发生的比例大致相同。
阴性症状表现为刻板发作性的运动无力、吞咽困难、失语或视野缺损。
产生的原因可能是由于淀粉样蛋白沉积造成的血管闭塞、痉挛等引起。
阳性症状表现为扩散蔓延的麻木、刺痛感;头痛的先兆症状(如闪光,视物模糊,暗点);抽搐等[1,2]。
目前认为阳性症状与皮质浅表铁沉积/凸面蛛网膜下腔出血有关,皮质浅表铁沉积常出现在脑中央沟,进而刺激了手和面部皮质感觉区而出现上述扩散性发作症状。
阳性症状会被误认为是癫痫或者偏头痛。
典型的阳性症状描述之一是:症状从手部(涉及几个手指)开始出现,呈刺痛麻木样,逐渐延伸到上臂,面部,持续数分钟到半小时。
CAA的慢性症状表现中,目前研究表明认知障碍在CAA患者中很常见,CAA 增加了患有痴呆的可能性,可能独立于其它因素而促进痴呆发生。
中度和重度CAA与认知能力的加速下降、语言能力和情景记忆的下降有关[3]。
CAA的认知障碍与血管源性的白质高信号负荷有关;另外CAA相关的微梗死破坏白质传导束等可引起皮质萎缩;CAA还可与其它疾病重叠作用而加重痴呆,例如阿尔茨海默病和CAA经常并存,最近的神经病理学研究表明CAA对阿尔茨海默病的痴呆有着独立影响。
脑淀粉样变性的临床特点及影像表现

脑淀粉样变性的临床特点及影像表现【定义】脑血管淀粉样变性(CAA)是指β-淀粉样蛋白在大脑皮层和髓质的中小动脉中层和外膜上沉积引起的少见疾病。
CAA常导致脑皮层-皮层下或脑叶出血,也被称为脑血管淀粉样变性脑出血(CAA-ICH),为老年人自发性、非外伤性、非高血压性脑出血的常见原因之一。
【病因与病理】淀粉样蛋白沉积于脑皮层和髓质血管中层与外膜,增加基底膜厚度,使血管腔狭窄,内弹力层断裂,引起血管壁类纤维蛋白样坏死,微动脉瘤形成,从而造成颅内出血。
CAA病因并不十分明确,目前关于CAA 病因研究有以下几种观点:①CAA可能是神经系统变性疾病的一种形态学标志;②与遗传有关,具有特异性基因突变引起的病变;③与不同类型的血管炎有一定关系;④自身免疫性疾病。
⑤老年人机体β-淀粉样蛋白的清除能力下降,是导致CAA发病的重要因素之一,而老年人动脉粥样硬化和高血压造成的血管壁损伤,则是CAA发病的潜在促动因素。
【临床特点】老年人好发,平均发病年龄68岁,且随年龄增加发病率明显增高。
【临床表现】临床表现无特征性,主要表现为痴呆,常因颅内出血被发现,表现为头痛、脑膜刺激征及呕吐等。
【影像特点】①脑叶或皮层及皮层下多发性、反复性出血。
②常规T1WI、T2WI表现为急性期、亚急性期和慢性期血肿混合存在。
③血肿大小不一,形态多样(分叶状和不规则形)。
④可破入脑室及蛛网膜下腔。
⑤SWI可显示直径小于5mm的脑微小出血灶,表现为大脑皮层多发性斑点状低信号灶,为反复发生的皮层斑点状出血致含铁血黄素沉着所致。
【检查首选】MRI SWI或GRE序列。
【诊断】①CAA的特征性MRI表现:脑叶浅表区域多发性、分叶状和不规则形出血及不同时期出血混合存在,有助于诊断与鉴别诊断。
②SWI能检出常规T1WI、T2WI序列不能显示的脑微小出血灶,能够提供比常规MRI更加详细、准确的诊断信息。
③CAA确诊需病理诊断,淀粉样蛋白HE染色为一种非结晶的嗜伊红物质,在刚果红染色偏振光显微镜下呈现一种特征性的黄绿色双折射光。
【影像视界】脑血管淀粉样变性的诊断

【影像视界】脑血管淀粉样变性的诊断脑血管淀粉样变性是老年人中常见的一种血管病变,主要累及脑皮质小动脉、中动脉、微动脉及毛细血管,表现为血管壁Aβ的进行性沉积。
脑血管淀粉样变性被认为是老年人自发性颅内出血和认知损害的重要原因。
相对其他脑血管意外不断改善的预后和生存率而言,脑血管淀粉样变性所致颅内出血的病死率仍接近50%。
因而深入了解脑血管淀粉样变性,对正确预防、治疗自发性颅内出血具有重要意义。
脑血管淀粉样变性相关的临床表现主要包括:反复颅内出血,认知受损和痴呆等。
脑血管淀粉样变性所致颅内出血的临床表现与其他脑叶出血的临床表现类似,患者大多急性起病,表现为局灶性神经功能缺损,可以伴有头痛、恶心、呕吐、癫发作等症状。
大的脑叶出血常可导致患者出现意识水平的改变,典型的脑叶出血比深部出血更易导致患者出现癫发作。
脑叶出血的预后通常较差,年龄较大、脑叶出血量较大等是预后不良的影响因素,颅内出血容易反复发作,其严重程度会随着发作次数的增加越来越严重。
研究表明,脑血管淀粉样变性会导致患者认知水平的显著下降,约30%的脑血管淀粉样变性患者可以出现老年痴呆症状,如严重的记忆障碍、注意力、定向力和计算力减退,或精神异常。
但也有很多患者可无痴呆表现。
因此,无痴呆者不能轻易排除脑血管淀粉样变性的诊断。
此外,由于脑皮质血管内因淀粉样物质沉积导致血流灌注减少,可以出现缺血性梗死或出血性梗死,还可以表现为短暂神经功能缺损的症状,如局限性无力、麻木和语言障碍。
在这些情况下,明确脑血管淀粉样变性的诊断具有非常重要的意义,因为使用抗血小板或抗凝治疗有可能会加重患者的出血。
从病理学角度脑血管淀粉样变性可以分为两型,Ⅰ型的主要病理改变是皮质微血管内Aβ的异常蓄积;Ⅱ型的Aβ主要沉积于脑膜血管及皮质动脉、小动脉,偶尔会累及静脉。
严重时,微血管内Aβ的沉积会导致微血管阻塞。
ApoE34 基因主要与Ⅰ型相关,而ApoE 32 基因主要与Ⅱ型相关。
脑血管淀粉样变

脑血管淀粉样变【所属科室】神经内科【临床病史】男,75岁,进行性记忆力减退1年。
【影像图片】【影像描述】双侧基底节区、放射冠、半卵圆中心、侧脑室旁及额颞顶叶见多发斑片状异常信号,T1WI呈稍低信号,T2WI呈稍高信号,FLIAR呈稍高及低信号,DWI呈低信号,右侧半卵圆中心可见结节样高信号。
SWI:双侧额颞顶叶皮层及皮层下、基底节区、放射冠见多发斑片状、结节样低信号。
【结果】病理穿刺诊断:纤维镜下可见淀粉样沉积物位于小动脉的中层和外膜,HE染色为非结晶的嗜伊红物质。
脑血管淀粉样变。
【病例小结】脑血管淀粉样变(cerebral amyloid angiopathy,CAA)是指淀粉样蛋白在大脑皮质和髓质的中小动脉中层和外膜上的沉积,临床缺乏特异性表现,通常为脑出血而发现。
CAA是一种少见脑血管疾病,好发于老年人,其病因还不是十分明确。
CAA本身常无症状,多因颅内出血而被发现。
CAA通常发生于6O岁以上患者,无明显性别差别,发生率随年龄增加而增加, CAA常见症状为头痛、脑膜刺激征及呕吐等,血肿压迫对侧半球、脑干或颅内压升高可导致意识水平降低,其程度与血肿大小和部位有关。
CAA具有多发性和易复发特点,其临床表现可有很大变化,病变定位困难。
淀粉样蛋白沉积于脑血管的中层和外膜,使基底膜增厚、血管腔狭窄和内弹力层断裂,进而引起血管壁类纤维蛋白样坏死、微动脉瘤形成等,这些继发性改变是引起CAA 的病理基础。
CAA主要累及脑皮层和髓质血管,对供应丘脑、基底节和脑干的穿支血管及小脑血管影响少,因此CAA常发生于脑皮质和皮质下白质,而基底节、丘脑、脑干及小脑出血发生率很低。
CAA的MRI表现及诊断价值:常规T1WI、T2WI上CAA具有脑出血所形成的血肿信号变化特点,出血部位以脑叶皮质和皮质下白质为主,呈多发性分布,这是CAA的典型表现。
SWI是利用组织磁敏感性不同而成像的技术,对含铁血黄素沉积和局部磁场差异性很小的不均匀高度敏感,能够准确显示常规T1WI、T2WI不能检出的微小出血灶,表现为边缘清楚的低信号区,多分布在皮层下。
“脑淀粉样血管病(CAA)”的发生机制及影像特点深度解析

“脑淀粉样血管病(CAA)”的发生机制及影像特点深度解析脑淀粉样血管病影像表现脑淀粉样血管病(CAA)是一组具有生化和遗传多样性的疾病,主要病理变化是β淀粉样蛋白在脑皮质及皮质下、柔脑膜及小血管中外膜沉积。
淀粉样物质沉积使血管壁变薄,继而导致无症状性微出血和症状性脑内出血(ICH)。
CAA是引起老年人原发性脑叶出血常见原因。
平扫CT能明确显示血肿,常位于脑皮质及皮质下,少见于深部白质、基底节及脑干。
其他典型征象有表现多样化和脑叶出血再发倾向。
可以伴发蛛网膜下腔、脑室内或硬脑膜下出血,尤其是当出血量较大时。
怀疑CAA时,除了MRI检查,还要做梯度回波序列(GRE)或磁敏感加权成像(SWI),这些检查对局部磁场的不均匀很敏感,能清晰显示脑皮质及皮质下点状出血(图1,图2)。
点状出血直径通常小于5 mm,有时会严重多发(图2),是诊断CAA脑内出血的特异性征象。
最近研究表明,利用能结合β淀粉样蛋白的匹兹堡复合物B的正电子发射断层成像(PET)有望成为检测CAA的非侵入性手段。
CAA的其他常见非特异性征象包括白质疏松和全脑萎缩。
重点提示CAA是一种常见的无症状性疾病,发病率随年龄增长而升高。
通过影像学检查能对CAA做出准确诊断,便于给予合适的治疗,避免不必要的处置。
典型临床表现CAA患者大部分都是年龄大于55岁的中老年人,表现为与急性ICH或痴呆相关的局灶性神经功能障碍。
波士顿标准是当前比较完善和规范的CAA的诊断标准。
鉴别诊断CAA相关脑出血必须与其他ICH常见原因进行鉴别,如高血压、外伤、凝血障碍、血管畸形、肿瘤及非法药物的使用。
临床表现结合特征性影像表现有助于做出正确的诊断。
例如,高血压性脑出血常见于基底节、丘脑或脑干,而CAA很少累及这些部位。
尽管高血压患者也会有微出血病灶,但常局限于深部灰质,一般不累及皮质,以及皮质下结构。
很多疾病在GRE或SWI上表现类似CAA,包括弥漫性轴索损伤(DAI)、多发性海绵状血管瘤和出血性转移瘤等(图3)。
脑淀粉样蛋白发作

脑淀粉样蛋白发作脑淀粉样蛋白发作(amyloid spells)是容易误诊为TIA,偏头痛,癫痫的短暂局灶神经系统事件(TFNE),认识不足会导致治疗失误,尤其是要作为TIA的鉴别诊断。
现以文献实例进行描述。
病例1短暂局灶神经系统事件66岁男性到急诊就诊,症状为从右手的两个手指开始出现感觉异常, 延伸到右上臂,右面部及口唇,持续超过10分钟。
在此期间,患者感觉嘴麻木像"牙科打了麻醉剂"一样。
在急诊科期间患者出现3次相似的发作。
患者在头部CT扫描(图1)后,开始按TIA给予抗血小板治疗(注:此图CT可以看到异常影像)。
第二天查MR,显示左侧中央沟少许蛛网膜下腔出血(图2),停用抗血小板治疗。
第二个月,患者出现几乎每日发作的手、面部刺痛、麻木感,每次持续20分钟(注:此时的症状易误诊)。
其中一次喉部异常感,患者数分钟不能说话。
患者还经常头昏头痛,第二次MR(梯度回波序列)检查见双侧中央沟含铁血黄素沉积,但没有皮质微出血及出血。
符合波士顿可能CAA诊断标准。
分析:软脑膜血管中β-淀粉样蛋白沉积会导致血管壁受损和出血,出现脑皮质表浅铁沉积,而脑皮质表浅铁沉积症反过来又提示脑出血高风险。
患者这种脑表面铁沉积影像学表现在脑淀粉样血管病患者中越来越受到重视。
14.5%-20%的脑淀粉样血管病患者出现短暂局灶神经系统事件或称“淀粉样蛋白发作”,而脑皮质表面铁沉积则更支持解释这种发作现象。
淀粉样蛋白发作通常包括阳性和阴性症状, 数分钟或持续到30分钟。
阳性症状可能为含铁血黄素刺激引起的皮层扩散性抑制(麻木感扩散蔓延样,头痛先兆样),阴性症状可能是淀粉样蛋白沉积后的血管闭塞和痉挛引起的(偏瘫,失语,视野缺损)。
阴性症状症状与阳性症状比例接近。
当患者描述了不典型的反复出现的局灶性发作症状时(和偏头痛先兆或TIA相似),不管这些症状的真实本质是什么,都建议做血液敏感成像和扩散加权成像。
这个患者的淀粉样蛋白发作表现为从手到面部缓慢蔓延,或可反映脑皮质功能代表区, 因为皮质表面铁沉积通常沉积于中央沟, 覆盖了手和面部皮质感觉区。
淀粉样脑血管病的影像诊断与鉴别诊断

淀粉样脑血管病(CAA)是老年人自发性脑出血的主要原因之一,多数患者因脑出血入院,而CAA相关脑出血复发率高,所以根据Boston诊断标准,通过影像检查进行早期诊断对患者预后尤为重要。
CAA主要影像表现有脑叶出血、脑微出血、大脑凸面蛛网膜下腔出血及脑表面铁沉积,临床可常规运用磁敏感加权成像序列以增加CAA病灶的检出率。
淀粉样脑血管病(cerebral amyloid angiopathy,CAA)是老年人自发性脑出血的主要原因之一。
其早期临床症状不易被察觉,多数患者因脑出血入院,且CAA相关脑出血复发率高,所以早诊断、早预防对患者预后尤为重要。
CAA影像表现具有一定特点,可根据影像表现进行病理确诊前的诊断。
笔者对CAA的临床及影像学特征进行归纳总结,以期进一步提高广大医师对该病的认识。
CAA是一种以β淀粉样蛋白(amyloid-β,Aβ)沉积于皮质及软脑膜血管为主要病理特征的颅内微血管病变。
病因不明,可能与基因突变有关。
年龄和阿尔茨海默病(Alzheimer disease,AD)为两个最常见的危险因素,随着年龄的增长,CAA的患病率增高。
其他危险因素包括载脂蛋白E(ApoE)等基因相关危险因素和高血压及抗淀粉样蛋白治疗等非基因相关危险因素。
ApoE ε4等位基因与CAA有关,ApoE ε2等位基因与CAA相关脑出血及血肿扩散有关。
实验研究和临床实践表明,针对AD患者Aβ的免疫疗法将导致CAA相关并发症的出现。
CAA病理改变的主要学说为蛋白清除机制紊乱学说,即各种原因使血管周围间隙(perivascular spaces,PVSs)对于Aβ的清除减少而导致Aβ沉积于小血管周围进而产生一系列病理改变。
Aβ早期沉积于外膜,外膜饱和后,即在中膜的平滑肌中进一步沉积,使血管壁持续性增厚,同时Aβ的细胞毒性作用使得平滑肌细胞发生变性坏死,血管壁变薄、变脆。
晚期阶段,Aβ削弱细胞外基质,导致内膜与中膜分离。
脑淀粉样血管病的临床以及影像学特征分析

脑淀粉样血管病的临床以及影像学特征分析/h1脑淀粉样血管病(CAA)即淀粉样物质在脑膜中小血管与脑实质中沉积后形成的疾病实体。
该现象主要被发现于1909年,但直到20世纪后期才受到广泛关注,因其与老年人出血、痴呆以及缺血性脑损伤有密切关联,是老年人出现认知损害、非外伤性以及自发性脑出血的主要原因。
日本与欧美国家已经详尽研究脑淀粉样血管病发生于老年人脑中的几率、分布情况以及临床影像学特征等。
我国也有较多研究,但是研究深度还不够。
本文为探讨脑淀粉样血管病的临床分布与影像学特征,现选取本院收治的老年脑淀粉样血管病患者20例作为研究对象,对其临床资料进行回顾性分析,现报告如下。
1、资料与方法1.1一般资料选取本院2010年10月~2014年10月收治的老年脑淀粉样血管病患者20例作为研究对象,对其临床资料进行回顾性分析。
所有患者均采用SWI诊断。
20例患者中男12例,女8例;年龄61~89岁,平均年龄(74.2±4.9)岁。
20例患者中轻度8例,中度7例,重度5例。
1.2诊断标准参考波士顿脑淀粉样血管病研究组制定的诊断标准:①明确为皮质、皮质下或者脑叶出血,并伴随有相关血管病变,非高血压性脑出血;②年龄在55岁以上,行影像学检查发现多灶性出血局限于皮质、皮质下或者脑叶,很可能为CAA;③年龄55岁以上,影像学检查发现皮质、皮质下或者单个脑叶出血,可能为CAA。
均排除其他脑出血原因。
排除标准:①钙化灶,鉴别时主要使用相位图;②出血由外伤引发。
1.3一般方法应用超导型MR扫描仪,头颅8通道相控阵线圈。
设置如下参数:TE25.8ms,FOV220mm,448×384为矩阵,2mm为层厚,1.5mm为层间隔。
扫描后计算机自动重建对PWI图像以及最小强度投影图予以获取。
2、结果2.1病变分布出血位置多集中于皮质-皮质下白质,不存在局限于单个脑叶的多发出血,所有患者均多发微出血在两个及其以上脑叶,其中18例为额叶,9例颞叶,12例为顶叶,每个脑叶微出血灶均10个,脑叶出血灶数量在20个以上的为14例;伴小脑出血9例,微出血个数均在10个以下。
脑淀粉样血管病临床特征和影像学研究进展

•综述.脑淀粉样血管病临床特征和影像学研究进展承易芳仏©唐北沙川杨样川【关键词】脑淀粉样血管病B淀粉样蛋白凸面蛛网膜下腔出血脑表面含铁血黄素沉积CAA相关炎症免疫治疗脑淀粉样血管病(cerebral amyloid angiopathy,CAA)是脑小血管病最常见的类型之一,随着磁共振新技术、正电子发射断层摄影术和脑脊液生物标志物的拓展叫近年来关于CAA的研究获得了长足的进展。
本文就近年来CAA 的临床特征及影像学研究进展作一综述,以进一步提高对本病的认识和关注。
1临床表现1.1脑出血多发性脑叶出血是CAA相关脑出血的特征性表现,最常累及枕叶和颖叶,可能由于枕叶小动脉走形弯曲,影响管周引流有关。
少见部位包括小脑、脑干、深部脑白质。
但鉴于大部分研究并未有效的控制混杂因素,CAA 可能并不是单独引起脑叶出血的充分病因,其他因素如高血压、神经退行性病变或抗凝药物的使用也可能与之相关。
支持CAA和抗凝药物相关脑出血的证据显示,这种出血通常在INR处于治疗剂量范围内的患者中出现,提示脑小血管内在病变更为重要;此外,4po%2基因型在华法林合并脑出血患者中较无脑出血者更常见,也提示CAA在其发病中的作用。
1.2认知功能受损和痴呆前瞻性队列数据结果表明,CAA患者脑出血后4.5年痴呆的发生率高达29%[2】。
一项尸检研究发现中度-重度CAA的认知损害在执行功能尤其是知觉速度(perceptual speed)和情景记忆方面更为突出[习。
doi:10.3969/j.issn.l002-0152.2019.09.011☆湖南省科技重大专项(编号:2016SK1001);湖南省自然科学基金(编号:2018JJ3828)*中南大学湘雅医院老年病科(长沙410008)△中南大学湘雅医院国家老年疾病临床医学研究中心尿中南大学湘雅医院神经内科®通信作者(E-mail:yifang_xy@)另外两项住院患者研究则报告CAA患者存在显著的加工速度(processing speed)受损和轻度认知障碍&习。
脑淀粉样血管病影像学特点

脑淀粉样血管病影像学特点脑淀粉样血管病的特征性神经影像学改变包括脑微出血(CMBs)、脑白质高信号(WMH)、扩大的血管周围间隙[EPVS,亦称扩大的Virchow-Robin间隙(dVRS)]和皮质表面含铁血黄素沉积;此外,全脑皮质萎缩(GCA)和颞叶内侧萎缩亦是脑小血管病和神经变性病的影像学特征。
皮质下微梗死(CMIs)是新近发现的脑小血管病特征性影像学改变,并认为可以用于评价脑淀粉样血管病的严重程度。
1. 脑微出血主要是由颅内血管壁损伤,含铁血黄素外渗沉积于血管周围所致,特征性影像学表现为T2*梯度回波序列(T2*GRE)或磁敏感加权成像(SWI)呈圆形或类圆形低信号影,直径2-5mm、有时达10mm。
脑微出血最常见于颞顶叶皮质,可导致患者执行功能减退、信息处理速度减慢、简易智能状态检查量表(MMSE)评分减少,对注意力、视空间能力、记忆力、额叶执行功能等认知域的损害有一定预测价值。
AGES-Reykjavik研究(Age,Gene/EnvironmentSusceptibility-ReykjavikStudy)显示,脑微出血灶≥3个即可影响患者记忆力和信息处理速度。
2. 脑白质高信号脑白质高信号与Aβ沉积引起的脑组织低灌注、血-脑屏障破坏和皮质下微梗死有关。
影像学表现为T1WI等或低信号、T2*GRE或SWI高信号,常见于脑室周围。
脑白质高信号体积增加与社会和自我认知、注意力、记忆力下降等认知功能障碍有关,尤其对注意力以及执行功能的影响更为显著。
脑白质高信号与多个认知域功能障碍相关,其主要包括智力(Fisher Z=-0.100,95%CI:-0.190--0.040)、记忆力(Fisher Z=-0.080,95%CI:-0.130--0.060)、信息处理速度(Fisher Z=-0.110,95%CI:-0.170--0.070)、注意力以及执行功能(FisherZ=-0.110,95%CI:-0.160--0.070)、感知和(或)构造(FisherZ=-0.150,95%CI:-0.210--0.070),其机制可能是通过影响皮质-皮质下白质纤维环路联系,特别是胆碱能和单胺能系统而引起认知功能障碍。
脑血管淀粉样变性相关脑出血的临床特点与MRI表现

采用微量输液泵于患者左肘静脉内持续
.6统计学分析计量资料以均值±标准差表示.
输 注4 min(2.4 mL/min)。McE开始后,用S.VHS高
组 间计量资料用t检验,计数资料用卡方检验,P<
பைடு நூலகம்
O.05为差异有显著性。
2 作 者单位:511400广州市番禺区人民医院心内科 2
结果
万方数据
万方数据
而CD8+CD28.细胞(TS)降低。TC的升高必然引起 TC2的细胞增多,这些细胞产生IL一4、IL;兰譬羹;TS 蒿疆粪TH蠢薹葡囊鋈i霪答墓囊薹萋萋巧萋TC霎
蓁笨重薛鍪鏖霪霪藿得茎|萋嚣羹羹薹j冀疆羹霪蠹霎 蠹薯篓孽筹囊篓妻薹蕈=冀舔螋CD4塞薹CD8囊 CD28+磊囊塞赢心丽;翼蠹封TH2蒽TC2霎篓;TH2
达 到最大剂量。(4)室性心动过速或持续性室上性心 动 过速。(5)严重的高血压,收缩压>220 mmHg或舒 张 压>100 mmHg。(6)收缩压明显降低。(7)受试者难
以 忍受。
1
气 体,微泡平均直径2.5斗m,每瓶重59 mg,实验时按 要 求以生理盐水配制成5 mL心肌造影剂。
1 .3 MCE
1.2仪器设备 1.2.1仪器美国GE ViVid 7型彩色多普勒仪。s4 探 头,基波频率2~4 MHz,谐频频率1.8~3.6 MHz, 采 用谐频能量多普勒模式,按1:4的比例于收缩末
期 触发的方式提取图像。12导联心电图仪,德国贝朗
计 分的总和除以所见节段数即为室壁运动指数。
LDDsE时计分减少≥1分定义为有心肌存活。
M CE定义心肌存活性为显影作用≥0.5分.无显影作
用 表示无心肌存活性。
1.4
LDDsE在患者MCE结束后进行.同样采用微 min增加剂量到10、15、20斗g/(kg・
脑淀粉样血管病
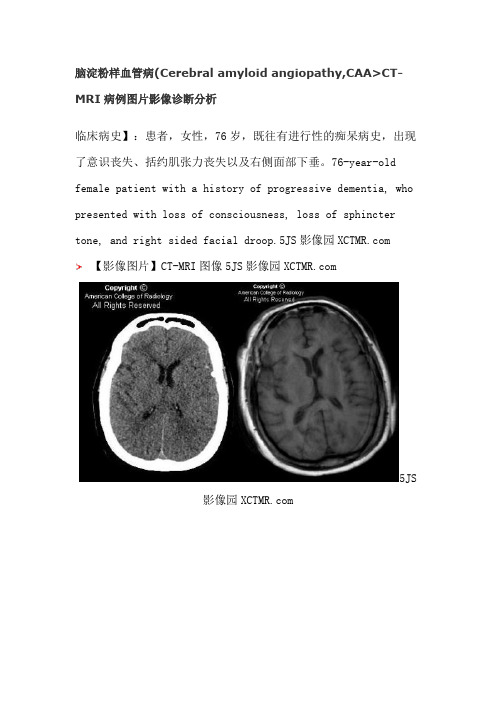
脑淀粉样血管病(Cerebral amyloid angiopathy,CAA>CT-MRI病例图片影像诊断分析临床病史】:患者,女性,76岁,既往有进行性的痴呆病史,出现了意识丧失、括约肌张力丧失以及右侧面部下垂。
76-year-old female patient with a history of progressive dementia, who presented with loss of consciousness, loss of sphincter tone, and right sided facial droop.5JS影像园 【影像图片】CT-MRI图像5JS影像园5JS影像园5JS 影像园5JS 影像园5JS影像园【影像表现】:MRI of the brain without contrast shows diffuse cortical atrophy as well as multiple small (< 5 mm> cortical-subcortical foci of decreased signal intensity, best seen in GRE sequences (green arrows Figure 1 and Figure 2>. Some of these focal areas of low signalintensity are not seen or are barely discernible on T2-weighted sequences (yellow arrows Figure 3 and Figure 4 >, and not seen at all on T1-weighted (Figure 5 and Figure 6> or FLAIR sequences (Figure 7 Figure 8>. No areas of abnormal signal intensity are seen in the basal ganglia. In addition, areas of increased white matter signal intensity, compatible with leukoencephalopathy, are best seen on FLAIR sequences (blue arrows in Figure 7 and Figure 8 >.颅脑MR平扫显示弥漫性的皮质萎缩和多发性小点状<<5mm)皮质-皮质下的局灶性低信号影,在GRE序列上显示的最清楚<图1,2)。
Neurology病例:硬脑膜淀粉样瘤:中枢神经系统淀粉样变性的罕见表现

Neurology病例:硬脑膜淀粉样瘤:中枢神经系统淀粉样变性的罕见表现46岁既往体健女性,表现为反复发作的左侧额部和枕部头痛。
头颅MRI可见双侧硬脑膜增厚(图1,上排)。
脑脊液检查未见明显异常。
脑膜活检证实为典型的淀粉样瘤(图2)。
进一步检查未发现浆细胞肿瘤,多发性骨髓瘤,系统性淀粉样变性,炎症性疾病或恶性肿瘤的证据。
随访复查的头颅MRI提示类固醇激素治疗和放疗后硬脑膜病变消退(图1,下排)。
淀粉样变性是一组以细胞外的淀粉样蛋白沉积为特征的疾病。
颅内脑实质外受累罕见,但碰到弥漫脑膜增厚的患者,尽管无系统性淀粉样变的存在,仍需考虑到硬脑膜淀粉样瘤的可能。
(图1:弥漫硬脑膜淀粉样瘤。
MRI可见大脑镰和左侧额顶部大脑凸面硬脑膜肥厚[箭头],T1WI呈等信号[A],增强后明显强化[B];冠状位T2WI可见病灶主要呈低信号[C];3年后的随访MRI可见病灶进展,硬脑膜强化累及海绵窦和左侧后颅窝和颞窝[D];6年后的随访MRI可见强化病灶明显消退[E]。
患者接受类固醇激素治疗和放疗)(图2:淀粉样瘤的活检切片。
HE染色[A]和刚果红染色[B]提示纤维结缔组织中多核巨细胞和淋巴单核细胞浸润,周围非晶形的嗜酸性物质沉积[×50])[参考文献]Shibao S, Dalprá FA, Andrade CS, Leite CC.Dural amyloidoma: An unusual presentation of CNS amyloidosis.Neurology. 2016 Mar 29;86(13):1266-7.温馨提醒请尊重我们的劳动成果,转载不要忘了注明出处哦~~~。
脑淀粉样血管病

? 增强后血肿周边环状强化,可持续2周
影像特点
? DSA:小部分伴有血管炎,均无阳性发
现
? MRI:皮层和皮层下各阶段的多发斑点状 皮层出血和脑室旁白质变性
? 最有价值的是 GRE(梯度回波脉冲序 列),有效增强 ,由于慢性出血造成的局
部铁质沉着的信号的发放和磁敏性
CAA严重程度分级
? 0-血管中无刚果红染色存在 ? 1-少许肌层染色 (+),外观正常 ? 2-刚果红物质完全取代中膜 ? 3-受累血管至少 50%的周径血管壁断裂
(双腔样改变 )
? 4-受累血管存在纤维素样坏死
诊断标准 ---分型 ? 确定的 CAA 相关出血
全尸检发现存在至少 3级CAA伴有皮层皮
枕叶,颞后,顶叶或额叶皮层,皮层下
区可见各期影象,常破入蛛网膜下腔, ? 影象 ? 反复性和多发性
? 病理确诊
鉴别诊断
? 对于无出血表现的CAA特别要与脑肿瘤进 行鉴别。有些 CAA表现局限性或多发性非
出血占位性病灶, CT为弥漫白质低密度,
无强化, MRI为广泛长 TI,T2,易与胶
质瘤混淆。
层下出血,排除其他原因出血
诊断方法
? 病理可能的 CAA 相关出血 血肿清除术或皮层活检表明至少存在 1 级CAA 而无其他可诊断的出血原因
诊断方法
? 临床可能的 CAA 相关出血
存在多灶的皮层皮层下出血,年龄〉 60
岁,临床和 MRI 上无其他可诊断的出血原 因
诊断方法
? 可疑的 CAA 相关出血
1。脑叶出血
? 最主要,最严重的并发症 ? 额顶颞枕叶均可受累,很少在基底节,
小脑,脑干,海马等,此点有别于高血
脑淀粉样变性

可见继发性/反响性〔如透析相关性淀粉样变形〕 深部构造〔基底节、丘脑、小脑〕>皮层、皮层下白质 淀粉样脑血管病“自发性〞脑叶出血的发病率是4-10% 是老年人“自发性”脑叶出血的常见原因
急性脑叶出血多为大量出血
淀粉样变=由细胞外β淀粉样蛋白质沉积造成的罕见的系统性疾病 病人年龄小于脑淀粉样血管病〔<65岁〕 皮层下白质〔灰白质交界处〕
鉴别诊断
高血压性微出血 深部构造〔基底节、丘脑、小脑〕>皮层、皮层下白质 通常与脑淀粉样血管病并存 病人年龄小于脑淀粉样血管病〔<65岁〕 伴微出血的缺血性脑卒中患者 多灶性含铁血黄素沉积 见于10%-15%的急性缺血性脑卒中患者 出血性腔隙性脑堵塞 多发性血管畸形 海绵状血管畸形 寻找具有液-液平面的出血腔或多发的处于不同分期的出血灶 CT上常因钙化而呈高密度 毛细血管扩张症 模糊的、刷状的或明显增强 在T2*〔GRE〕上成多灶性黑色斑点。 多发于脑干
病人年龄小于脑淀粉样血管病〔<65岁〕 见于10%-15%的急性缺血性脑卒中患者 脑淀粉样血管病(Cerebral amyloid angiopathy, CAA) 淀粉样变=由细胞外β淀粉样蛋白质沉积造成的罕见的系统性疾病 是老年人“自发性”脑叶出血的常见原因
皮层下白质〔灰白质交界处〕
微出血灶和大量出血灶在脑淀粉样血管病代表截然不同的疾病实体
增厚的血管壁倾向于形成微出血灶而非大量出 血灶
形态
急性期血肿常表现为大量、形态不规那么 的出血,并伴有相应的血液沉积。
CT表现
NECT 皮层/皮层下斑片状或融合形血肿,边界不
规那么,并伴有周围水肿 出血可破入蛛网膜下腔或脑室 常见:弥漫性脑萎缩 罕见:脑回样钙化 CECT 无强化,除非形成淀粉样瘤
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“脑淀粉样发作”3例临床及影像分析
淀粉样发作(amyloid spells)亦称短暂性局灶性神经症状发作(transient focal neurological episodes,TFNE),常表现为自肢体远端向近端发展(尤以从手指向上肢近端蔓延多见)的播散性感觉异常,临床多表现为反复、短暂、刻板样发作[1];近年发现其作为脑淀粉样血管病的一种特征性表现,与影像学上所示的皮层表面含铁血黄素沉着(cortical superficialsiderosis,cSS)或孤立皮层蛛网膜下腔出血(convexitysubarachnoid hemorrhage,cSAH)相关,且可预测未来致命性脑叶出血风险[2]。
此外,由于此类患者临床极易误诊为短暂性脑缺血发作(transient ischemic attack,TIA)而给予抗栓药物,反而增加病程后期致命性脑叶出血风险。
因此,早期及时识别对于进一步的治疗决策非常关键。
本文报道3例表现为淀粉样发作患者,结合其临床诊治及转归情况进行分析。
1对象和方法
回顾性分析我院连续3例(2016年4月至2016年12月)临床表现为淀粉样发作,影像学提示对侧半球cSAH,依据Boston标准[3]诊断为很可能的脑淀粉样血管病(probable cerebral amyloidangiopathy,CAA)的患者资料;分析其临床表现、影像学特征和脑电图特点及治疗预后情况(表1)。
2结果
本组3例均为老年患者;既往均存在长期高血压病史,且发病前血压控制不良,短期内波动明显;均呈急性起病、反复发作刻板样症状;例1表现为发作性自左手开始向近端蔓延的感觉症状;例2表现为发作性言语不能和右手活动不灵。
例3表现发作性右上肢麻木、无力。
3例发作性症状均于数分钟内自行缓解,缓解期查体无神经系统体征,发作最频繁时4次/d。
患者对控制血压和抗癫痫药(例1和例2)治疗反应良好。
颅脑影像:3例头影像学均提示cSAH:例1和2急性期和亚急性期头颅CT均可见患肢对侧额叶脑沟内条形高密度影(图1A,图2A、
2B),3例患者Flair序列显示相应脑沟条形高信号(图1D,图2D、2E,图3B),为临床发作责任病灶;T2*-GRE序列:多发脑叶皮层微出血及皮层表面含铁血黄素沉着(图1E、1F,图2F,图3C、3F)。
此外,MRI同时发现多发腔隙和脑白质高信号等脑小血管病影像学标志物(图1D,图2D,图3B、3E)。
同时,CT血管造影(CTA,图1B1、1B2)或磁共振血管造影(MRA,图2C1、2C2)未发现可解释发作的大血管狭窄,例1和例2行磁共振静脉成像(MRV,图1C1、1C2)检查未发现皮层静脉异常病变,不支持皮层静脉血栓。
脑电监测:例1和例2行脑电监测,均表现为病灶局部周围慢波,例1可见局部癫痫样异常放电。
治疗反应及随访:3例均于急诊第一时间疑诊CAA可能,给予严格控制血压治疗,2例及时停止病前长期服用的抗栓治疗,同时给予抗癫痫治疗,患者临床发作停止,病情均控制良好;例1因2个月后自行减量降压药和停用抗癫痫药物,血压升高,症状再发,恢复治疗后发作终止,继续随访未再发。
例2随访半年患者未出现cSAH再发或症状性脑叶出血。
例3经严格控制血压,症状好转,未应用抗癫痫药物。
表13例短暂性局灶性神经症状发作患者临床资料汇总
3讨论
CAA是一类老年人群常见的脑小血管病,以皮层及软脑膜小血管管壁进行性β淀粉样物质沉积为病理特征[1,4];临床常见表现为自发性症状性脑叶出血或认知损害[5];随着影像学的进步,在既往经典的影像学表现(脑出血和脑叶微出血)之外,更多CAA相关的影像学标志物
被识别(如cSS、cSAH、皮层微梗死等),并发现其与临床存在相关性[6,7]。
其中,cSAH或cSS导致的TFNE,作为CAA患者特征性症状之一,越来越引起关注[1,4]。
Greenberg等[4]早期描述的7例无脑叶出血的CAA患者中,4例表现为TFNE;一项多中心队列研究显示,CAA 患者14.5%(25/172)表现为TFNE[8]。
TFNE是一种反复发作、形式刻板、短暂的(≤30min)刺激(“阳”)性或缺失(“阴”)性神经系统症状[9]。
其最经典发作形式为沿解剖部位在体表连续播散性的皮层症状(如感觉异常)、类似偏头痛先兆样表现和痫性发作样的局部运动症状等[1]。
为了排除症状性脑叶出血灶对淀粉样发作的可能影响,Ni等[1]对90例无症状性脑叶出血的疑似CAA患者研究发现,41例(46%)影像学可见cSS和(或)cSAH,且存在上述影像改变患者中TFNE发生率更高;且TFNE与急性cSAH直接相关,而与cSS无关;提示老年患者如临床表现淀粉样发作,影像学表现cSAH时,需高度怀疑CAA可能[1,10]。
本组3例症状上均表现反复刻板的皮层发作症状,结合影像学提示对侧运动皮层附近相应脑沟内cSAH的表现,支持很可能的CAA诊断。
临床上,TFNE需要与以下疾病进行鉴别:首先需要鉴别TIA[11],两者均呈短暂发作性神经系统症状;但TIA表现形式无TFNE特征性的皮层播散性分布特征,且一般反复刻板发作的TIA多数存在责任病灶区域相关的供血血管狭窄,甚至影像学可见相应区域脑梗死;及时行包括CT、MRI-T2-Flair和GRE-T2*(或SWI)序列等在内的头颅影像学检查,有助鉴别。
其次,TFNE要与偏头痛先兆、局灶癫痫发作区分,上述影像学和其他脑小血管病影像学标志物(如腔隙、新近发生的腔梗、血管周围间隙、白质高信号及脑萎缩等)可资鉴别[1]。
有关cSAH的病因鉴别,中青年(≤60岁)中常见病因为可逆性脑血管收缩综合征、静脉系统疾病或硬膜下血肿[12,13,14];但老年患者表现为局限于单一脑沟内SAH,CAA为最常见病因;本组3例均老年发病,MRV静脉显影良好,不支持皮层静脉血栓形成,且无外伤或肿瘤等因素,同时合并存在多种其他小血管病影像学标志物(图1D、2E和3E),支持CAA诊断。
部分患者抗癫痫药可中止TFNE发作,推测其可能与局灶性部分性
癫痫发作或皮层播散性抑制相关[15]。
本组3例病初均连续多次刻板样症状发作,例1脑电监测提示右额颞局灶慢波异常,存在右额为著癫痫样异常放电,病例2可见局部慢波;应用抗癫痫药物治疗后均好转,同样支持癫痫样发作或皮层播散抑制是其可能的机制的理论。
但Ni等[1]、Charidimou等[8]分别观察15例和5例TFNE,发作期和发作间期脑电监测均未见癫痫样放电,但部分可见同侧半球不伴有波幅改变的间歇性局灶性慢波(6/15)及广泛低波幅改变(1/15)[1],提示确切机制尚需进一步研究。
图1短暂性局灶性神经症状发作(病例1)头颅影像:急性期(A-E)和3个月后(F)
图2短暂性局灶性神经症状发作(病例2)头颅影像:发病当天(A)及发病第5天(B~F)
图3短暂性局灶性神经症状发作(病例2)发病第2天头颅MRI影像
参考文献(略)。
