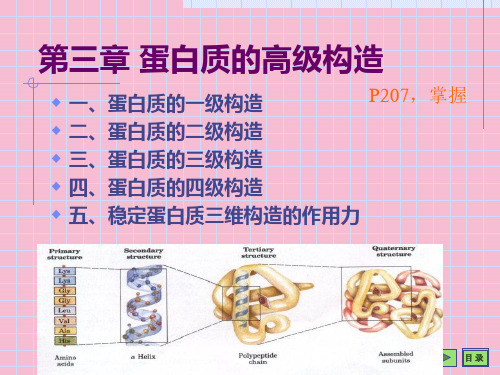
蛋白质的三维结构PPT课件
合集下载
蛋白质的三维结构5课件.ppt

(二)-折叠片
(三)-转角和-凸起
-转角
-转角
-凸起
四 纤维状蛋白质
1α-角蛋白
1α-角蛋白
2 -角蛋白
2 -角蛋白
3 胶原蛋白:一种三股螺旋
3 胶原蛋白:一种三股螺旋
五 超二级结构
五 超二级结构
六 结构域
六 结构域
结构域分类
七 蛋白质的三级结构与球蛋白
疏水键、离子键、氢键和 Van der Waals力等。
主要的化学键
整条肽链中全部氨基酸残基的相对空间位置。即肽链中所有原子在三维空间的排布位置。
三级结构定义
球状蛋白
1 多肽链折叠成球形 2 大多包含几个二级结构 3 功能多样:酶调节蛋白
肌红蛋白
三维结构特征
纤维状蛋白质通常只含一种二级结构,而球蛋白通常含有多种二级结构. 球状蛋白质具有明显的折叠层次 一级结构 二级结构 超二级结构 结构域 三级结构或亚基 四级结构 球蛋白是紧密的球状或椭球状实体 疏水残基埋藏于球体内,亲水残基暴露于球体外 表面有一空穴(裂沟,凹槽或口袋),这个空穴能结合配体,蛋白质的活性部位 由二级结构向三级结构转变的主要动力是疏水作用.
-螺旋 ( -helix ) -折叠 ( -pleated sheet ) -转角 ( -turn ) 无规卷曲 ( random coil )
(一) -螺旋目 录1 偶极矩2 α-螺旋的右旋和左旋
3 影响α-螺旋结构的因素
脯氨酸 (亚氨基酸)
(二)-折叠片
(二)-折叠片
蛋白质的四级结构
1、对称性
血红蛋白质四级结构
多聚蛋白:病毒外壳
2、缔合蛋白的优越性
增强稳定性: 减少蛋白质的相对表面积 自身缔合稳定的需要 屏蔽亚基上的疏水残基以利于更加稳定 提高遗传经济和效率 编码同聚蛋白的小亚基比编码大一倍的蛋白质更经济 使催化集团靠近 亚基的催化基团聚集以形成活性中心 不同催化亚基聚合催化关联反应:A B C 发挥协同效应与别构效应 别构效应:别构部位与配体的结合可影响其他亚基,增 强或减弱对底物的结合 协同效应: 正协同效应,负协同效应
第5章蛋白质化学-蛋白质的三维结构ppt课件

二个或二个以上具有独立的三级结构的多肽 链(亚基),彼此借次级键相连,形成一定的空间结 构,称为四级结构。
具有独立三级结构的多肽链单位,称为亚基 或亚单位(subunit),亚基可以相同,亦可以不同。 四级结构的实质是亚基在空间排列的方式。
(二)亚基的缔合
血红蛋白(Hb)是四个亚基缔合而成,聚合动力:疏 水作用(主要),二硫键,离子键,氢键等。
纤维状蛋白质是结构蛋白,含大量的α-螺旋, β-折叠片,整个分子呈纤维状,广泛分布于脊椎和 无脊椎动物体内,起支架和保护作用。角蛋白来 源于外胚层细胞,包括皮肤以及皮肤的衍生物:发, 毛,鳞,羽,翮,甲,蹄,角,爪,啄等.角蛋白可分为α-角 蛋白和β- 角蛋白。
α-角蛋白,如毛发中主要蛋白质。β-角蛋白, 如丝心蛋白。
结构域间的裂缝,常是酶的活性部位,也是反应物的 出入口
三、蛋白质三级结构
(一).三级结构的特点 (二). 肌红蛋白(Mb)的构象 (三). 一级结构与三级结构的关系 (四).维持三级结构的作用力
(一)三级结构的特点
一条多肽链中所有原子在三维空间的整 体排 布,称为三级结构,是包括主、侧链在内的空间 排列。大多数蛋白质的三级结构为 球状或近似球 状。在三级结构中,大多数的亲水的R侧基分布 于球形结构的表面,而疏水的R侧基分布于球形 结构的内部,形成疏水的核心。
三级结构形成后,生物学活性必需基团靠近,形成活 性中心或部位,即蛋白质分子表面形成了某些发挥生物学 功能的特定区域。
(三) 一 级 结 构 与 三 级 结 构 的 关 系
四、寡聚蛋白的四级结构
(一)寡聚蛋白的概念 (二)亚基的聚合 (三)亚基的空间排布 (四)血红蛋白(Hb)的构象
(一) 寡聚蛋白的概念
主要的化学键 包括:疏水键、 离子键、氢键 和 范德华力等。
具有独立三级结构的多肽链单位,称为亚基 或亚单位(subunit),亚基可以相同,亦可以不同。 四级结构的实质是亚基在空间排列的方式。
(二)亚基的缔合
血红蛋白(Hb)是四个亚基缔合而成,聚合动力:疏 水作用(主要),二硫键,离子键,氢键等。
纤维状蛋白质是结构蛋白,含大量的α-螺旋, β-折叠片,整个分子呈纤维状,广泛分布于脊椎和 无脊椎动物体内,起支架和保护作用。角蛋白来 源于外胚层细胞,包括皮肤以及皮肤的衍生物:发, 毛,鳞,羽,翮,甲,蹄,角,爪,啄等.角蛋白可分为α-角 蛋白和β- 角蛋白。
α-角蛋白,如毛发中主要蛋白质。β-角蛋白, 如丝心蛋白。
结构域间的裂缝,常是酶的活性部位,也是反应物的 出入口
三、蛋白质三级结构
(一).三级结构的特点 (二). 肌红蛋白(Mb)的构象 (三). 一级结构与三级结构的关系 (四).维持三级结构的作用力
(一)三级结构的特点
一条多肽链中所有原子在三维空间的整 体排 布,称为三级结构,是包括主、侧链在内的空间 排列。大多数蛋白质的三级结构为 球状或近似球 状。在三级结构中,大多数的亲水的R侧基分布 于球形结构的表面,而疏水的R侧基分布于球形 结构的内部,形成疏水的核心。
三级结构形成后,生物学活性必需基团靠近,形成活 性中心或部位,即蛋白质分子表面形成了某些发挥生物学 功能的特定区域。
(三) 一 级 结 构 与 三 级 结 构 的 关 系
四、寡聚蛋白的四级结构
(一)寡聚蛋白的概念 (二)亚基的聚合 (三)亚基的空间排布 (四)血红蛋白(Hb)的构象
(一) 寡聚蛋白的概念
主要的化学键 包括:疏水键、 离子键、氢键 和 范德华力等。
-蛋白质的三维结构ppt课件
两个肽键衍生而来
目录
影响螺旋构成的要素〔P208,熟习〕
(1) R侧链对α-螺旋的影响
R侧链的大小和带电性决议了能否构成α-螺旋以及 构成的α-螺旋的稳定性。
① 多肽链上延续出现带同种电荷基团的氨基酸残基, (如Lys,或Asp,或Glu),那么由于静电排斥,不能 构成链内氢键,从而不能构成稳定的α-螺旋。如多聚 Lys、多聚Glu。而当这些残基分散存在时,不影响α螺旋稳定。
目录
β-凸起(了解)
β-凸起是一种小片的非反复性构 造,能单独存在,大多数经常作 为反平行β-折叠片中的一种不规 那么情况而存在。 β-凸起可以为是β-折叠股中额外 插入的一个残基,它使得在两个 正常氢键之间、在凸起折叠股上 是两个残基,而另一侧的正常股 上的一个残基。 β-凸起可引起多肽链方向的改动, 但改动的程度不如β-转角。
目录
〔1〕超二级构造〔掌握〕
在蛋白质分子中,由假
αα
设干相邻的二级构造单元组
合在一同,彼此相互作用,
构成有规那么的、在空间上
能识别的二级构造组合体。
几种类型的超二级构造:
ββ
αα;ββ;βαβ;
★超二级构造在构造层
次上高于二级构造,但没有
聚集成具有功能的构造域.
βαβ
目录
〔2〕构造域〔P222,掌握〕 多肽链在二级构造或超二级构造的根底 上构成三级构造的部分折叠区,它是相对 独立的严密球状实体,称为构造域。 *对于那些较小的蛋白质分子或亚基来说, 构造域和三级构造是一个意思,也就是说 这些蛋白质或亚基是单构造域的,如红氧 还蛋白、肌红蛋白等; *对于较大的球状蛋白质或亚基,其三级 构造往往由两个或多个构造域缔合而成也
我国1965年在世界上第一个用化学方法人工合成 的蛋白质就是这种牛胰岛素。
蛋白质的三维结构PPT课件

Hydrophilic Face
螺旋轮作图
• 一个螺旋轮是螺旋沿着螺旋轴的二维投射图,具体作图步骤是:在 纸平面上画一条直线(0 º)。该线的底端表示螺旋轴,顶端表示螺 旋的第一个氨基酸的侧链,用画圈的数字表示位置;然后,按顺时 针方向转100 º画第二条线,并使其一端在螺旋轴,另一端为画圈的 2表示第二个氨基酸;再从第二条线向顺时针旋转100º画第三条线, 依次类推,直到将螺旋上的所有氨基酸都画上。注意让离我们越近 的数字圆圈轮画得越大。按照这种作图,在第五圈以后,图的样式 将会重复,即第19号位的氨基酸残基将位于1号位残基的上面。
Hydrophobic Face
G
L
GL
E
S
I
DN F
R
A helical wheel representation of an amphipathic a-helix from alcohol dehydrogenase is shown. In a helical wheel, a crosssectional view of the a -helix is drawn as a spiral with amino acids occurring every 100o along the spiral (360o divided by 3.6 amino acids per turn gives 100o per amino acid).
授课:XXX
13
常见螺旋的类型
(1)3.613-螺旋:常见,特性见前面。
(2)310-螺旋:每螺圈残基数(n)为3.0,每个肽基的C=O与其前面 的第2个肽基的N-H形成氢键,构成10元环,每残基高度0.2nm, 螺距0.6nm,螺旋直径约为0.4nm。比3.613-螺旋紧密。
第5章蛋白质的三维结构PPT课件

第8页/共72页
第3节多肽主链折叠的空间限制
3.2、多肽主链折叠的空间限制
• 一个蛋白质的构象取决 于肽单位绕N-Cα和CαC键的旋转,这些键连接 着多肽链中的刚性的肽 单位。绕N-Cα键旋转 的二面角称φ,绕Cα-C 键旋转的称ψ。
第9页/共72页
第3节多肽主链折叠的空间限制
• 当φ或ψ旋转键所在的酰胺平面的取向二等分H-Cα-R平面,且该旋转键两 侧的主链处于顺式构型时,规定φ=0°或ψ=0°
• 例如毛的纤维是由多个原纤维平行排列,并由氢 键和二硫键作为交联键将它们聚集成不溶性的蛋 白质。
• -角蛋白的伸缩性能很好,当-角蛋白被过度拉 伸时,则氢键被破坏而不能复原。此时-角蛋白 转变成-折叠结构,第2称7页为/共72页-角蛋白。
第5节 纤维状蛋白质
毛发的结构
• 一根毛发周围是一层鳞 状细胞,中间为皮层细 胞。皮层细胞横截面直 径约为20m。在这些 细胞ห้องสมุดไป่ตู้,大纤维沿轴向 排列。所以一根毛发具 有高度有序的结构。
第五章 蛋白质的三维结构
在生物学条件下一种蛋白质占优势 的构象只有一种(或少数几种), 它们是热力学上最稳定的,并且具 有生物学活性,这种构象称为天然 蛋白质(native protein)。
第1页/共72页
第五章 蛋白质的三维结构 主要内容
• 研究蛋白质构象的方法 • 稳定蛋白质三维结构的作用力 • 多肽主链折叠的空间限制 • 蛋白质的二级结构 • 纤维状蛋白质 • 超二级结构和结构域 • 球状蛋白质与三级结构 • 亚基缔合与四级结构 • 蛋白质的变性与折叠
肽键的特点:
1.肽键具有部分双键性质: C-N单键键长0.149nm C=N双键键长0.127nm 肽键键长0.132nm
第3节多肽主链折叠的空间限制
3.2、多肽主链折叠的空间限制
• 一个蛋白质的构象取决 于肽单位绕N-Cα和CαC键的旋转,这些键连接 着多肽链中的刚性的肽 单位。绕N-Cα键旋转 的二面角称φ,绕Cα-C 键旋转的称ψ。
第9页/共72页
第3节多肽主链折叠的空间限制
• 当φ或ψ旋转键所在的酰胺平面的取向二等分H-Cα-R平面,且该旋转键两 侧的主链处于顺式构型时,规定φ=0°或ψ=0°
• 例如毛的纤维是由多个原纤维平行排列,并由氢 键和二硫键作为交联键将它们聚集成不溶性的蛋 白质。
• -角蛋白的伸缩性能很好,当-角蛋白被过度拉 伸时,则氢键被破坏而不能复原。此时-角蛋白 转变成-折叠结构,第2称7页为/共72页-角蛋白。
第5节 纤维状蛋白质
毛发的结构
• 一根毛发周围是一层鳞 状细胞,中间为皮层细 胞。皮层细胞横截面直 径约为20m。在这些 细胞ห้องสมุดไป่ตู้,大纤维沿轴向 排列。所以一根毛发具 有高度有序的结构。
第五章 蛋白质的三维结构
在生物学条件下一种蛋白质占优势 的构象只有一种(或少数几种), 它们是热力学上最稳定的,并且具 有生物学活性,这种构象称为天然 蛋白质(native protein)。
第1页/共72页
第五章 蛋白质的三维结构 主要内容
• 研究蛋白质构象的方法 • 稳定蛋白质三维结构的作用力 • 多肽主链折叠的空间限制 • 蛋白质的二级结构 • 纤维状蛋白质 • 超二级结构和结构域 • 球状蛋白质与三级结构 • 亚基缔合与四级结构 • 蛋白质的变性与折叠
肽键的特点:
1.肽键具有部分双键性质: C-N单键键长0.149nm C=N双键键长0.127nm 肽键键长0.132nm
生物化学课件:4 蛋白质三维结构
2级结构
3级结构
4级结构
蛋白质的高级结构
蛋白质二级结构的基本类型
二级结构:靠氢键维系的部分蛋白质主链有规 律的折叠结构。(链内或链间形成的氢键)
主要有-螺旋、-折叠、-转角、无规卷曲。 其中-螺旋是蛋白质中最常见,含量最丰富的 二级结构
二级结构产生的原因
➢ Peptide bond不能转动 → 肽平面
0.54 nm 3.6 个残基
第n+3个肽键的H原子 第n个肽键的O原子
C原子 O原子 N原子 H原子
N-端
0.5 nm
(a)
理想α-螺旋的特性
①肽链上C=O氧与它后面 (C端)第四个残基上C的原子 N-H氢形成氢键,氢键O取原子 向与主轴基本平行。 N原子
H原子
②螺旋一圈占3.6个AA,螺 距0.54 nm,每个AA旋转 100o,沿轴上升0.15nm。
➢ 肽链中连续出现大侧链的氨基酸(如Ile),由于空 间位阻,也难以形成α-螺旋。
➢ 在多肽链中连续的出现带同种电荷的极性氨基酸, α-螺旋就不稳定,如多聚Lys、多聚Glu。
2. β-折叠(β- sheet)
-折叠是由两条或多 条伸展的多肽链平行 排列,由相邻肽链上 的酰胺H和羧基O间形 成的氢键所维持有规 则的结构。(也可以 在同一肽链的不同部 分之间形成)
蛋白质的三维结构
➢二级结构 ➢三级结构 ➢四级结构 ➢蛋白质变性与复性 ➢抗体
蛋白质的二级结构
➢肽平面 ➢二级结构的基本类型 ➢二级结构类型的代表性蛋白
肽平面
肽基 (peptide group) ➢ 构成肽链主链的基本单元,叫做肽基——
主链骨架重复单位,它包括两个α-碳原子 及其中间的一个肽键,Cα-CO-NH-Cα;
第5章蛋白质的三维结构(共105张PPT)

上图:L-Ala残基的拉氏构象图,横坐标为的取 值,纵坐标为 的取值。
32
多肽主链形成三维结构的空间限制
拉氏图不仅对蛋白质的构象研究起到了简化作用,对于 判断所得到的蛋白质结构模型的正误也有意义。 实际得到的许多蛋白质的三维结构证实了拉氏图是根本 正确的。
33
5.4 二级结构:多肽链折叠的规那么方式 Secondary structure :The common regular
• 反平行折叠片较稳定,重复单位为0.7 nm, 即每个氨基酸的长度为0.35nm;
α螺旋的偶极矩
α螺旋相当于在N—末端 积累了局部负电荷,在 C—末端积累了局部正电荷
43
Protein Secondary structure
α螺旋的手性
• 蛋白质中的α螺旋几乎
都是右手的 (除胶原蛋白外)。
44
影响α螺旋形成的因素
• 与它的氨基酸组成和序列有极大的关系:
– 侧链R-基团所带的电荷。如多聚赖氨酸, 不能形成;
多数情况下,这些基团分布在球状蛋白质分子的 外表,与水分子作用形成排列有序的水化层,稳 定蛋白质的构象。
16
5.2.5 二硫键 Disulfide bond
Covalent bond between side chains of two cysteine residues
17
Disulfide bond
Bond Energy (kJ/mol)
13-30 4-8 12-20 12-30 210 376.81
21
5.3 多肽主链折叠的空间限制
5.3.1 肽键和肽平面
多肽主链是由-NH-Cα-CO-相连重复排列 形成的。164
肽基〔peptide
32
多肽主链形成三维结构的空间限制
拉氏图不仅对蛋白质的构象研究起到了简化作用,对于 判断所得到的蛋白质结构模型的正误也有意义。 实际得到的许多蛋白质的三维结构证实了拉氏图是根本 正确的。
33
5.4 二级结构:多肽链折叠的规那么方式 Secondary structure :The common regular
• 反平行折叠片较稳定,重复单位为0.7 nm, 即每个氨基酸的长度为0.35nm;
α螺旋的偶极矩
α螺旋相当于在N—末端 积累了局部负电荷,在 C—末端积累了局部正电荷
43
Protein Secondary structure
α螺旋的手性
• 蛋白质中的α螺旋几乎
都是右手的 (除胶原蛋白外)。
44
影响α螺旋形成的因素
• 与它的氨基酸组成和序列有极大的关系:
– 侧链R-基团所带的电荷。如多聚赖氨酸, 不能形成;
多数情况下,这些基团分布在球状蛋白质分子的 外表,与水分子作用形成排列有序的水化层,稳 定蛋白质的构象。
16
5.2.5 二硫键 Disulfide bond
Covalent bond between side chains of two cysteine residues
17
Disulfide bond
Bond Energy (kJ/mol)
13-30 4-8 12-20 12-30 210 376.81
21
5.3 多肽主链折叠的空间限制
5.3.1 肽键和肽平面
多肽主链是由-NH-Cα-CO-相连重复排列 形成的。164
肽基〔peptide
第三节蛋白质的三维结构PPT精品文档46页

βββ
回形拓扑结构
5 2回形拓3 扑4结构1
卵溶菌酶的三级结构中的两个结构域
结构域1
-螺旋
结构域2 二硫键
-转角
-折叠
七.球状蛋白与三级结构
多肽键在二级结构的基础上,通过侧链基团的相互 作用进一步卷曲折叠,借助次级键维系使α-螺旋、β -折叠片、β-转角等二级结构相互配置而形成特定的 构象。三级结构的形成使肽链中所有的原子都达到空间 上的重新排布。
血红蛋白四级结构
四 级 结 构 的 结 构 模 型
更多精品资请访问
更多品资源请访问
实例:肌红蛋白 核糖核酸酶
肌 红 蛋 白 三 级 结 构
核糖核酸酶三级结构示意图
N
His119
Lys41 His12
C
球状蛋白三维结构的特征:
1.球状蛋白分子含多种二级结构元件; 2.球状蛋白三维结构具有明显的折叠 层次; 3.球状蛋白分子是紧密的球状或椭球 状实体; 4.球状蛋白质疏水侧链埋藏在分子内 部,亲水侧链暴露在分子表面; 5.球状蛋白分子的表面有一个孔穴。
完全伸展的多肽主链构象碳原子酰胺平面180的多肽主链构象酰胺平面非键合原子接触半径蛋白质中非键合原子之间的最小接触距离蛋白质中非键合原子之间的最小接触距离a3203002928028270242202726027260242202726024220200190多肽链中的各个肽平面围绕同一轴旋转形成螺旋结构螺旋一周沿轴上升的距离即螺距为054nm含36个氨基酸残基
• 肽链内形成氢键,氢键的取 向几乎与轴平行,第一个酰 胺基团的-CO基与第四个酰 胺基团的-NH基形成氢键。
• 蛋白质分子几乎都为右手螺旋。
Ser
Val
T yr
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢键, α-螺旋遇 到Pro就会被中 断而拐弯
3、其他类型的螺旋
• 310-螺旋 • π螺旋(4.316-螺旋)
(二) -折叠 ( -pleated sheet)
• 由两/多条几乎完全伸展的肽链平行排列, 通过链间的氢键交联而形成。
• 肽链主链呈锯齿状折叠构象。
1、-折叠结构特点
• C总是处于折叠的角上 • AA的R基团处于折叠的棱角上并与之垂直 • 氢键主要在链间/同一肽链不同部分间形成 • 几乎所有肽键都参与链内氢键的交联 • 氢键与链的长轴接近垂直
• 肽链主链骨架180°的回折结构
特点:
• 由4个连续的AA残基组成
• 第一个残基C=O • 第四个残基NH
形成氢键
O ……( 氢 键 )……… H
—C—(NH—CH—CO)2—N— R
• 比较稳定的环状结构 主要存在于球状蛋白分子中 多数处在蛋白质分子的表面
2、 β凸起( β bugle)
•反平行β折叠片中的一种不规则排列 •实质上是多出来的一个AA残基
皮肤与皮肤的衍生物
主要由-螺旋构象的多肽链组成
微纤维 毛发的结构 α
鳞状 细胞
大纤维
螺 旋
皮层细胞
初 原 纤 维
微 原 纤 维
卷发(烫发)的生物化学基础
角蛋白在湿热条件下伸展转变为—构象, 冷却干燥时可自烫发发地时 恢复原状。 • 侧链R基一般较大,不适于处在—构象 • 螺旋多肽链间有着很多的二硫键交联 ——交联键使外还力原剂解除后肽链恢复原状
• 肽键、二硫键——一级结构
• 氢键、疏水作用、范德华力、离子键、二 硫键——三维结构
外力(外因)
与溶剂及其他溶质作用力
(1)氢键( Hydrogen bond )
• 两负电性原子对氢原子的静电引力所形成 X—H…Y
• 质子给予体X-H和质子接受体Y间相互作用 • 氢键具有:
方向性-(键角)指X—H与H…Y间的夹角 饱和性- X—H只与一个Y结合
• 这种旋转是受到限制的
(二)可允许的φ和ψ值: • 拉氏构象图
四、二级结构(Secondary Structure)
• 指肽链的主链在空间的排列,或规则的 几何走向、旋转及折叠。
• 只涉及主链构象及链内/间形成的氢键 • 主要有-螺旋、 -折叠、-转角、无
规卷曲等。
(一)-螺旋 (-helix)
• 平行肽链间以氢键从侧面连接的构象
2、-折叠的类型
平行的β-片层结构中,两个残基的间距为0.65nm; 反平行的β-片层结构,则间距为0.7nm
• 平行式: 所有肽链 的N-端 都在同一 边
• 反平行式: 相邻两条 肽链的方 向相反
(三) -转角和凸起
1、 β转角( β turn/bend/hairpin structure)
• 又称盐键:具有相反电荷的两个基团间的 库仑作用。
F:吸引力 Q1/2:电荷电量 ε :介质介电常数 R:电荷质点间距离
多肽链
R基团间的相互作用及稳定蛋白质三维构象的作用力
a.盐键 b.氢键 c.疏水键 d.范德华力 e.二硫键
键能
• 肽键
90kcal/mol
• 二硫键
• 离子键
3kcal/mol
(二)-角蛋白
丝蛋白的结构
六、 超二级结构与结构域
(一)超二级结构 若干相邻的二级结构单元按照一定
规律有规则组合在一起、相互作用, 形成在空间构象上可彼此区别的 二级结构组合单位。
(二)结构域
二级/超二级结构基础上形成的特定区域, 稳定、相对独立的球状实体。
结构域存在的原因: 1、局域分别折叠比整条肽链折叠在动力学
(3)疏水作用
( Hydrophobic Interactions)
• 非极性侧链为避开极性溶剂水彼此靠近所 产生
• 主要存在蛋白质的内部结构 蛋白质表面通常具有极性链或区域
• 蛋白质可形成分子内疏水链/腔/缝隙
——稳定生物大分子的高级结构
Hale Waihona Puke (4)离子键 ( Electrostatic attraction )
(2)范德华力(van der Waals force )
这是一种普遍存在的作用力,是一个原子的原 子核吸引另一个原子外围电子所产生的作用力。它 是一种比较弱的、非特异性的作用力。
这种作用力非常依赖原子间的距离,当相互靠 近到大约0.4~0.6nm(4~6A)时,这种力就表现 出较大的集合性质。
范德华力包括引力和排斥力,其中作用势能与 原子距离的6次方倒数成正比。
1.4 蛋白质的三维结构
一、 研究蛋白质构象的方法
(一)研究蛋白质结晶体: X射线衍射法
(二)研究处于溶液中蛋白质构象的 光谱学方法:
紫外光谱 核磁共振 荧光和荧光偏振 圆二色性 扫描隧道显微
伦琴1901年获 诺贝尔物理奖
二、稳定蛋白质三维结构的作用力
1、影响蛋白质结构的因素
内力(内因)
蛋白质分子内各原子间作用力
• 氢键
1kcal/mol
• 疏水键
1kcal/mol
• 范德华力
0.1kcal/mol
这四种键能远小于共价键,称次级键
提问:次级键微弱但却是维持蛋白质三级结构中主 要的作用力,原因何在?
数量巨大
三、多肽主链折叠
(一)酰胺平面与α-碳原子的二面角
OC
+
N
共振形式
相邻的肽平面构成两面角
多肽链:通过可旋转的Cα连接的酰胺平面链
(四)无规卷曲(random coil)
——泛指不能归入明确的二级结构 如折叠片和螺旋的多肽片断。
五、纤维状蛋白质
脊椎动物体中50%以上是纤维状蛋白质 支架、防护作用 规则的线性结构
不溶性纤维蛋白 (角蛋白、胶原蛋白、弹性蛋白) 纤维蛋白
可溶性纤维蛋白 (肌球蛋白 血纤蛋白原)
(一)-角蛋白 (Keratin)
1、-螺旋的结构
• 螺距0.54nm • 每圈含3.6个AA残基
每个AA残基占0.15nm 绕轴旋转100°
• 链内形成氢键与轴平行 • 多为右手螺旋
O
H
H —C—(NH—C—CO)3 N—
R 3.613 (ns)
2、影响-螺旋形成的因素
①R基大小:较大的难形成,如多聚Ile ; R为Gly时, 由于Ca上有2个氢,使Ca-C、Ca-N的转动的自由度很 大,即刚性很小,所以使螺旋的稳定性大大降低。 ②R基的电荷性质:不带电荷易形成。 带相同电荷的氨基酸残基连续出现 在肽链上时,螺旋的稳定性降低。 ③ Pro无法形成链内
3、其他类型的螺旋
• 310-螺旋 • π螺旋(4.316-螺旋)
(二) -折叠 ( -pleated sheet)
• 由两/多条几乎完全伸展的肽链平行排列, 通过链间的氢键交联而形成。
• 肽链主链呈锯齿状折叠构象。
1、-折叠结构特点
• C总是处于折叠的角上 • AA的R基团处于折叠的棱角上并与之垂直 • 氢键主要在链间/同一肽链不同部分间形成 • 几乎所有肽键都参与链内氢键的交联 • 氢键与链的长轴接近垂直
• 肽链主链骨架180°的回折结构
特点:
• 由4个连续的AA残基组成
• 第一个残基C=O • 第四个残基NH
形成氢键
O ……( 氢 键 )……… H
—C—(NH—CH—CO)2—N— R
• 比较稳定的环状结构 主要存在于球状蛋白分子中 多数处在蛋白质分子的表面
2、 β凸起( β bugle)
•反平行β折叠片中的一种不规则排列 •实质上是多出来的一个AA残基
皮肤与皮肤的衍生物
主要由-螺旋构象的多肽链组成
微纤维 毛发的结构 α
鳞状 细胞
大纤维
螺 旋
皮层细胞
初 原 纤 维
微 原 纤 维
卷发(烫发)的生物化学基础
角蛋白在湿热条件下伸展转变为—构象, 冷却干燥时可自烫发发地时 恢复原状。 • 侧链R基一般较大,不适于处在—构象 • 螺旋多肽链间有着很多的二硫键交联 ——交联键使外还力原剂解除后肽链恢复原状
• 肽键、二硫键——一级结构
• 氢键、疏水作用、范德华力、离子键、二 硫键——三维结构
外力(外因)
与溶剂及其他溶质作用力
(1)氢键( Hydrogen bond )
• 两负电性原子对氢原子的静电引力所形成 X—H…Y
• 质子给予体X-H和质子接受体Y间相互作用 • 氢键具有:
方向性-(键角)指X—H与H…Y间的夹角 饱和性- X—H只与一个Y结合
• 这种旋转是受到限制的
(二)可允许的φ和ψ值: • 拉氏构象图
四、二级结构(Secondary Structure)
• 指肽链的主链在空间的排列,或规则的 几何走向、旋转及折叠。
• 只涉及主链构象及链内/间形成的氢键 • 主要有-螺旋、 -折叠、-转角、无
规卷曲等。
(一)-螺旋 (-helix)
• 平行肽链间以氢键从侧面连接的构象
2、-折叠的类型
平行的β-片层结构中,两个残基的间距为0.65nm; 反平行的β-片层结构,则间距为0.7nm
• 平行式: 所有肽链 的N-端 都在同一 边
• 反平行式: 相邻两条 肽链的方 向相反
(三) -转角和凸起
1、 β转角( β turn/bend/hairpin structure)
• 又称盐键:具有相反电荷的两个基团间的 库仑作用。
F:吸引力 Q1/2:电荷电量 ε :介质介电常数 R:电荷质点间距离
多肽链
R基团间的相互作用及稳定蛋白质三维构象的作用力
a.盐键 b.氢键 c.疏水键 d.范德华力 e.二硫键
键能
• 肽键
90kcal/mol
• 二硫键
• 离子键
3kcal/mol
(二)-角蛋白
丝蛋白的结构
六、 超二级结构与结构域
(一)超二级结构 若干相邻的二级结构单元按照一定
规律有规则组合在一起、相互作用, 形成在空间构象上可彼此区别的 二级结构组合单位。
(二)结构域
二级/超二级结构基础上形成的特定区域, 稳定、相对独立的球状实体。
结构域存在的原因: 1、局域分别折叠比整条肽链折叠在动力学
(3)疏水作用
( Hydrophobic Interactions)
• 非极性侧链为避开极性溶剂水彼此靠近所 产生
• 主要存在蛋白质的内部结构 蛋白质表面通常具有极性链或区域
• 蛋白质可形成分子内疏水链/腔/缝隙
——稳定生物大分子的高级结构
Hale Waihona Puke (4)离子键 ( Electrostatic attraction )
(2)范德华力(van der Waals force )
这是一种普遍存在的作用力,是一个原子的原 子核吸引另一个原子外围电子所产生的作用力。它 是一种比较弱的、非特异性的作用力。
这种作用力非常依赖原子间的距离,当相互靠 近到大约0.4~0.6nm(4~6A)时,这种力就表现 出较大的集合性质。
范德华力包括引力和排斥力,其中作用势能与 原子距离的6次方倒数成正比。
1.4 蛋白质的三维结构
一、 研究蛋白质构象的方法
(一)研究蛋白质结晶体: X射线衍射法
(二)研究处于溶液中蛋白质构象的 光谱学方法:
紫外光谱 核磁共振 荧光和荧光偏振 圆二色性 扫描隧道显微
伦琴1901年获 诺贝尔物理奖
二、稳定蛋白质三维结构的作用力
1、影响蛋白质结构的因素
内力(内因)
蛋白质分子内各原子间作用力
• 氢键
1kcal/mol
• 疏水键
1kcal/mol
• 范德华力
0.1kcal/mol
这四种键能远小于共价键,称次级键
提问:次级键微弱但却是维持蛋白质三级结构中主 要的作用力,原因何在?
数量巨大
三、多肽主链折叠
(一)酰胺平面与α-碳原子的二面角
OC
+
N
共振形式
相邻的肽平面构成两面角
多肽链:通过可旋转的Cα连接的酰胺平面链
(四)无规卷曲(random coil)
——泛指不能归入明确的二级结构 如折叠片和螺旋的多肽片断。
五、纤维状蛋白质
脊椎动物体中50%以上是纤维状蛋白质 支架、防护作用 规则的线性结构
不溶性纤维蛋白 (角蛋白、胶原蛋白、弹性蛋白) 纤维蛋白
可溶性纤维蛋白 (肌球蛋白 血纤蛋白原)
(一)-角蛋白 (Keratin)
1、-螺旋的结构
• 螺距0.54nm • 每圈含3.6个AA残基
每个AA残基占0.15nm 绕轴旋转100°
• 链内形成氢键与轴平行 • 多为右手螺旋
O
H
H —C—(NH—C—CO)3 N—
R 3.613 (ns)
2、影响-螺旋形成的因素
①R基大小:较大的难形成,如多聚Ile ; R为Gly时, 由于Ca上有2个氢,使Ca-C、Ca-N的转动的自由度很 大,即刚性很小,所以使螺旋的稳定性大大降低。 ②R基的电荷性质:不带电荷易形成。 带相同电荷的氨基酸残基连续出现 在肽链上时,螺旋的稳定性降低。 ③ Pro无法形成链内
