小鼠ros相关蛋白-概述说明以及解释
自噬和线粒体自噬在糖尿病心肌病中的作用研究进展

自噬和线粒体自噬在糖尿病心肌病中的作用研究进展王敏;余薇;查文良【摘要】近年来,由于社会老龄化及肥胖发病率的不断升高,糖尿病患者的数量也逐年上升,然而,约一半以上的糖尿病患者死于糖尿病心血管病并发症.线粒体质量控制与心功能关系密切,高糖可致心肌细胞内线粒体受损而发生心功能障碍,因此,及时有效降解受损线粒体能抑制糖尿病心肌病的发生.线粒体自噬具有清除功能障碍的线粒体、控制线粒体质量、保障细胞内环境稳定的作用.该文通过介绍参与线粒体自噬的蛋白分子及信号通路,对自噬与线粒体自噬在糖尿病心肌病中的作用做一综述.【期刊名称】《中国药理学通报》【年(卷),期】2018(034)010【总页数】4页(P1337-1340)【关键词】糖尿病心肌病;氧化应激;自噬;线粒体自噬;凋亡;AMPK;mTORC1;Parkin;PINK1;NIX【作者】王敏;余薇;查文良【作者单位】湖北科技学院药学院,湖北咸宁 437100;湖北科技学院药学院,湖北咸宁 437100;湖北科技学院药学院,湖北咸宁 437100【正文语种】中文【中图分类】R-05;R329.24;R542.2;R587.1;R587.221世纪以来,由于社会老龄化程度不断加重及肥胖率的快速增加,糖尿病的患病率也与日俱增。
迄今为止,全世界糖尿病的患病人数大概是4.2亿,推测到2040年,糖尿病患者将达到6.42亿[1],中国是糖尿病高发国家。
糖尿病可引起全身多器官、多系统的损害,约一半以上的糖尿病患者死于糖尿病心血管病并发症,其中糖尿病心肌病(diabetic cardiomyopathy,DCM)的危险因素占首位,可导致患者心力衰竭而死亡。
1 DCM与线粒体损伤DCM是一种不同于高血压性心脏病、冠心病及其他心脏病变的糖尿病并发症。
临床上表现为心功能异常,最后演变成心力衰竭、心律失常和心源性休克,严重者猝死。
目前,DCM的具体发病机制不明,已有研究表明,糖脂代谢异常、心脏自主神经病变、胰岛素抵抗、肾素-血管紧张素系统(renin-angiotensin system, RAS)激活、氧化应激、心肌纤维化、心肌细胞凋亡、线粒体损伤等均参与DCM的发生发展。
小鼠Aurora-A_蛋白的生物信息学分析

332023年12月下 第24期 总第420期科技创新驱动China Science & Technology Overview0引言极光激酶A(Aurora-A)是一种丝氨酸/苏氨酸蛋白激酶,是近年来广受关注的细胞周期调节因子。
Aurora-A 激酶主要定位于有丝分裂期细胞中心体和纺锤体微管,在中心体复制阶段开始表达,促进中心体的成熟、分离、纺锤体的精确组装及胞质分裂。
Aurora-A 以有丝分裂激酶依赖的方式调控多种细胞的发育分化和稳态维持,主要参与调控G2/M 期的细胞周期进程[1]。
多项研究表明,Aurora-A 在造血恶性肿瘤、乳腺癌、结直肠癌等多种类型的癌症中异常高表达,是多种肿瘤治疗的靶点分子[2]。
尽管Aurora-A 以有丝分裂激酶依赖的方式调控多种细胞的发育分化和稳态维持,目前有研究指出Aurora-A 也以有丝分裂激酶非依赖的方式调控细胞多种生命活动,例如,Aurora-A 调控免疫突触的微管形成介导T 细胞活化[3]、介导微管形成调控神经元轴突延伸等[4]。
此外,Aurora-A 作为丝苏氨酸激酶可通过磷酸化与中心体功能无关的蛋白质,如Taga 等人发现在U20S 人骨肉瘤细胞中,Aurora-A 可诱导Akt 和mTOR 癌蛋白的磷酸化,从而促进癌细胞扩增[5]。
近年来也有研究报道,Aurora-A 存在着经典的SUMO 化保守序列,体内和体外实验均证明Aurora-A 通过SUMO 化促进自身激酶活性从而确保细胞的有丝分裂正常进行[6]。
Aurora-A 以有丝分裂激酶依赖和非依赖的方式调控多种细胞的生命活动,但是Aurora-A 激酶活化的结构基础和具体作用机制目前还不清楚。
研究小鼠Aurora-A 的蛋白性质和蛋白结构对研究其功能具有重要的意义,目前尚未见Aurora-A 蛋白性质和结构的相关报道。
本研究利用生物信息学工具对小鼠Aurora-A 蛋白的性质和结构进行预测和分析,旨在为研究Aurora-A 蛋白在生理和病理条件下的功能和调控机制奠定基础。
ros相关基因

ros相关基因ROS相关基因:探索细胞氧化应激的新视角细胞氧化应激是指细胞内外环境因素引起的氧化还原失衡,导致细胞内ROS(reactive oxygen species,活性氧)水平升高,从而引发一系列细胞损伤和疾病。
ROS是一类高度活性的分子,包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(·OH)等,它们可以与蛋白质、脂质、核酸等细胞分子发生氧化反应,导致细胞膜的损伤、DNA的突变、蛋白质的失活等,从而引发多种疾病,如癌症、心血管疾病、神经退行性疾病等。
ROS的产生与清除是细胞氧化应激的关键环节。
ROS的产生主要来自于线粒体呼吸链、NADPH氧化酶、脂质代谢等过程,而ROS的清除则依赖于一系列抗氧化酶和分子,如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶(GR)等。
这些抗氧化酶和分子可以将ROS转化为无害的物质,从而保护细胞免受氧化应激的损伤。
ROS相关基因是指参与ROS产生、清除和信号转导的基因。
近年来,越来越多的研究表明,ROS相关基因在细胞氧化应激中发挥着重要作用。
例如,SOD基因家族中的SOD2基因编码的超氧化物歧化酶主要存在于线粒体内,是线粒体ROS的主要清除酶,其突变与多种疾病的发生密切相关。
GPx基因家族中的GPx1基因编码的谷胱甘肽过氧化物酶是细胞内最主要的H2O2清除酶,其缺失可导致氧化应激和疾病的发生。
Nrf2基因编码的转录因子可以调节一系列抗氧化酶和分子的表达,从而保护细胞免受氧化应激的损伤。
除了参与ROS产生和清除外,ROS相关基因还可以通过调节细胞信号转导途径发挥作用。
例如,ROS可以激活MAPK、NF-κB等信号通路,从而影响细胞的生长、分化、凋亡等生命活动。
另外,ROS还可以通过氧化修饰蛋白质、DNA等分子,从而影响它们的功能和稳定性。
ROS相关基因在细胞氧化应激中发挥着重要作用,对于深入理解氧化应激的分子机制、预防和治疗氧化应激相关疾病具有重要意义。
细胞信号转导途径中与ROS相关的蛋白质酶解及功能分析

细胞信号转导途径中与ROS相关的蛋白质酶解及功能分析细胞信号转导途径是指细胞内外环境变化所引起的一系列的细胞内信号传递过程,涉及到多个信号通路和多种生物分子的参与。
其中,氧化还原反应中产生的活性氧(ROS)在细胞信号转导途径中发挥着重要的作用。
ROS对细胞信号转导途径的影响可以通过调节蛋白质酶解来实现。
一、ROS的生成与对细胞的影响ROS(reactive oxygen species),是指一类具有高度活性的氧分子。
ROS可以包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(•OH)等异种氧自由基。
ROS在生物体内主要由线粒体、NADPH氧化酶、躯体组织细胞的周期性氧化还原酶等产生。
当体内的抗氧化系统不能有效清除ROS时,导致ROS浓度过高,会对细胞质膜、细胞器膜和DNA产生直接损伤。
此外,高浓度的ROS还会引起细胞凋亡和坏死,影响细胞的生理功能。
二、蛋白质酶解对ROS的调节ROS除了对细胞质膜、细胞器膜和DNA产生直接损伤外,还可以通过调节蛋白酶的水解作用来影响细胞信号传递的过程。
蛋白酶包括许多酶类,它们的功能和作用机制各异。
目前,已经有许多研究表明,蛋白质酶解在ROS调节细胞信号转导途径中起到了重要的作用。
1. MIOXMIOX(myo-inositol oxygenase)是一种与细胞生存和ROS相关的调节分子。
MIOX能够调节细胞内ROS的产生和清除,并对蛋白质酶解起到重要的调节作用。
研究表明,当细胞接受到外界刺激时,MIOX能够通过对蛋白质酶的调节,影响其下游信号分子的活性和丰度,从而调节细胞信号传递的方向。
2. GSK3βGSK3β(glyc ogen synthase kinase 3β)是一种既能负调节蛋白质酶又能正调节蛋白质酶的蛋白质激酶。
在ROS对细胞信号转导途径的调节过程中,GSK3β的水解作用和丰度的变化同样起到了至关重要的作用。
当ROS处于高水平时,GSK3β的负调节作用被抑制,其正调节酶活性发生改变,从而影响下游蛋白酶和信号分子的水解和活性。
小鼠活性氧ROS酶联免疫分析ELISA
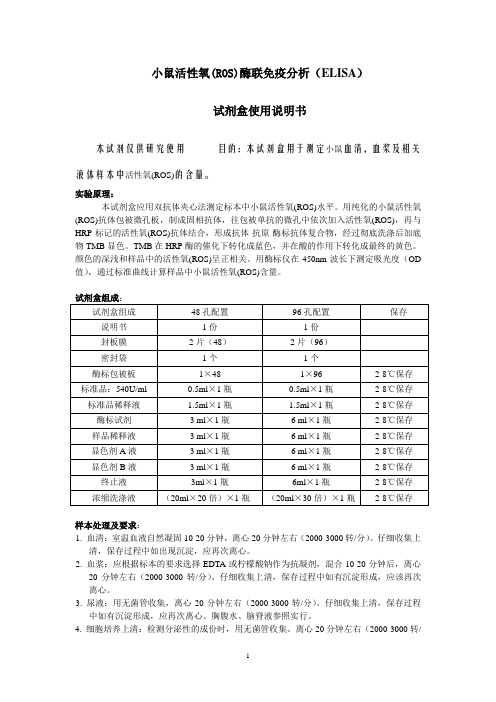
小鼠活性氧(ROS)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定小鼠血清,血浆及相关液体样本中活性氧(ROS)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中小鼠活性氧(ROS)水平。
用纯化的小鼠活性氧(ROS)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入活性氧(ROS),再与HRP标记的活性氧(ROS)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的活性氧(ROS)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠活性氧(ROS)含量。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
siglec-f的表达位置

siglec-f的表达位置全文共四篇示例,供读者参考第一篇示例:Siglec-F是一种跨膜蛋白,属于免疫球蛋白超家族的一员。
它在哺乳动物的免疫系统中扮演着重要的角色,主要通过其在不同细胞类型上的表达位置来调节细胞间的相互作用和信号传导。
在本文中,我们将探讨Siglec-F的表达位置及其在免疫调节中的作用。
Siglec-F在小鼠中的表达位置主要集中在各种免疫细胞上,如肺泡巨噬细胞、肺间质细胞、唾液腺上皮细胞等。
它的表达异常会导致肺部疾病的发生和发展,如哮喘、肺炎等。
研究表明,Siglec-F通过与其配体结合,调节免疫细胞的活性和功能,从而影响炎症反应的发生和发展。
Siglec-F在人类肿瘤中的表达位置也备受关注。
研究表明,Siglec-F在多种肿瘤细胞中高表达,与肿瘤的生长、转移和耐药性密切相关。
通过抑制Siglec-F的表达或活性,可以有效抑制肿瘤的发展,提高患者的生存率。
Siglec-F在不同细胞类型和不同疾病中的表达位置和作用有所差异,但都具有重要的免疫调节功能。
未来的研究将进一步探讨Siglec-F的分子机制和调控网络,为开发新的免疫疗法和治疗策略提供重要的理论基础。
Siglec-F的研究将有助于深入了解免疫系统的调节机制,为预防和治疗各种免疫相关疾病提供新的思路和途径。
【注:本文为虚构内容,仅供参考。
】第二篇示例:Siglec-F是一种免疫细胞表面的蛋白质,属于Siglec家族的一部分。
Siglec-F在哺乳动物的免疫系统中发挥着重要的作用,主要是通过与特定糖基相互作用来调节免疫反应。
最近的研究表明,Siglec-F在一些免疫相关疾病中起着关键作用,因此对其表达位置进行深入研究具有重要意义。
Siglec-F主要表达在哺乳动物的免疫细胞上,特别是在巨噬细胞和嗜酸性粒细胞(eosinophils)中。
巨噬细胞是一种对抗病原体和清除死细胞的重要细胞,其表面上的Siglec-F可以通过与特定糖基相互作用来调节巨噬细胞的活性。
ROS介导的氧化应激与自噬

ROS介导的氧化应激与自噬高婷;王子旭;陈祝茗;曹静;董玉兰;董彦君;陈耀星【摘要】自噬是真核细胞所特有的细胞内物质成分被溶酶体降解过程的统称.生命体借此清除细胞内的废物,重建结构从而维持蛋白质代谢平衡及细胞内环境稳定.氧化应激是指体内氧化与抗氧化作用失衡,倾向于氧化,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量活性氧中介物(ROS),而ROS直接参与细胞存活和死亡调节.大量研究表明,氧化应激中产生的ROS在多种条件下都是自噬的重要调节因子,它能诱导自噬发生,而自噬能通过不同的信号通路来缓解氧化应激造成的损伤,从而保护细胞存活.ROS在多种条件下都是自噬的重要调节因子.作者主要对自噬的形成过程、氧化应激诱导自噬产生机制(包括调控mTOR信号通路、丝裂原活化蛋白激酶(MAPK)信号通路机制)及自噬缓解氧化应激的途径(mTOR信号通路、PI3K介导的信号通路和调控p53等)进行综述,以期为畜牧生产中通过调控自噬缓解动物氧化应激的措施提供理论依据.【期刊名称】《中国畜牧兽医》【年(卷),期】2018(045)003【总页数】7页(P656-662)【关键词】氧化应激;自噬;ROS【作者】高婷;王子旭;陈祝茗;曹静;董玉兰;董彦君;陈耀星【作者单位】中国农业大学动物医学院,北京100193;中国农业大学动物医学院,北京100193;福建省漳州市动物疫病预防控制中心,福建363000;中国农业大学动物医学院,北京100193;中国农业大学动物医学院,北京100193;中国农业大学动物医学院,北京100193;中国农业大学动物医学院,北京100193【正文语种】中文【中图分类】Q2551990 年,Sohal等[1]首次提出氧化应激这一概念,即机体自由基生成增加或(和) 清除能力降低,引起机体氧化系统和抗氧化系统紊乱,导致自由基在体内积累而引起的氧化损伤过程。
研究表明,过量的活性氧中介物(ROS)是造成氧化应激的直接引物。
ROS介导的蛋白质氧化的生化机制

子(tumour necrosis factor receptor-associated factor 2,TRAF2)和CARD9等,都可能在MALT淋巴瘤染色体的负性易位的发病机制中起作用。
研究表明,CARD膜相关鸟苷酸激酶蛋白1[membrane-associatedguanylate kinase(MAGUK) protein 1,CARMA1]和CARD9在淋巴细胞的活化中起重要作用,其过度表达可能与胃B细胞淋巴瘤的发生发展有关。
Nakamura等[14]通过RT-PCR方法,分别检测65例原发性胃B细胞淋巴瘤患者和18例慢性胃炎患者的组织标本的CARMA1、CARD9、BCL10的mRNA表达水平,发现其在淋巴瘤患者中的阳性率分别为55%、48%、98%,而在慢性胃炎患者中仅17%的患者检测到CARMA1 mRNA,在所有胃炎患者中都没有检测到CARD9 mRNA、BCL10 mRNA的表达。
4. 展望CARD9在组织细胞中的广泛表达,为其生物学功能研究提供了良好基础。
随着研究的逐步深入,CARD9在先天性免疫中的作用将得到进一步阐明。
在先天性免疫应答中,CARD9作为传感器、活化剂、媒介物的作用,将可能成为新的治疗性药物设计靶点,为免疫性疾病患者带来福音。
参 考 文 献[1]Bertin J et al. J Biol Chem,2000,275(52): 41082-41086[2]Janeway CA Jr et al. Annu Rev Immunol,2000,20: 197-216[3]Medzhitov R et al. Science,2002,296(5566): 298-300[4]Brown GD. Nat Rev Immunol,2006,6(1): 33-43[5]Gitlin L et al. Proc Natl Acad Sci USA,2006,103(22):8459-8464[6]Hofmann K. Cell Mol Life Sci,1999,55(8-9): 1113-1128[7]Rogers NC et al. Immunity,2005,22(4): 507-517[8]LeibundGut-Landmann S et al. Nat Immunol,2007,8(6):630-638[9]Gross O et al. Nature,2006,442(7103): 651-656[10]Hara H et al. Nat Immunol,2007,8(6): 619-629[11]Colonna M. Nat Immunol,2007,8(6): 554-555[12]Hsu YM et al. Nat Immunol,2007,8(2): 198-205[13]Zhou Y et al. Br J Haematol,2006,133(1): 35-42[14]Nakamura S et al. Cancer,2005,104(9): 1885-1893文章编号: 1000-1336(2007)06-0516-05收稿日期:2007-08-29国家科技计划863项目(2007AA02Z433)、湖南省科技计划重点项目(06FJ3001)、湖南师范大学特聘教授基金、湖南师范大学博士启动基金(53112-1392)、湖南师范大学青年基金(53112-1184)资助作者简介:李国林(1977-),男,博士生,E-mail:hnsdlgl@hotmail.com;印大中(1955-),男,教授,联系作者,E-mail:dazhongyin@ hotmail.comROS介导的蛋白质氧化的生化机制李国林 印大中( 湖南师范大学生命科学学院蛋白质化学与发育生物学教育部重点实验室,长沙 410081 )摘要:活性氧(reactive oxygen species,ROS)介导蛋白质氧化的生化机制。
小鼠(Mouse)活性氧簇(ROS)-NEWA

本试剂盒只能用于科学研究,不得用于医学诊断小鼠(Mouse)活性氧簇(ROS)ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被活性氧簇(ROS)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的活性氧簇(ROS)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体-HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释上海笃玛生物科技有限公司底物A6mL3mL无底物B6mL3mL无终止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、30、60、120、240、480U/ml试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
小鼠肝再生过程中ros及线粒体代谢变化规律的研究

小鼠肝再生过程中ros及线粒体代谢变化规
律的研究
小鼠肝再生过程中ROS(活性氧物种)及线粒体代谢的变化是细胞生理学中的一个重要研究领域。
肝再生是肝脏损伤后恢复正常结构和功能的过程,ROS和线粒体代谢在此过程中发挥着重要的调节作用。
本文将从ROS、线粒体生物学基础、小鼠肝再生过程中ROS和线粒体代谢的变化规律等方面展开讨论。
首先,我们先了解ROS和线粒体的基本概念。
ROS是一类活性氧物种,包括超氧阴离子(O2·-)、过氧化氢(H2O2)、羟基自由基(·OH)等。
ROS在正常生理过程中起到调节细胞生长、凋亡、炎症等多种功能。
然而,过量的ROS会导致氧化应激,对细胞膜、蛋白质和核酸等造成氧化损伤。
线粒体是细胞中的能量合成中心,通过氧化还原反应产生细胞所需的ATP。
此外,线粒体还参与钙离子调节、细胞凋亡等多种细胞功能。
小鼠肝再生过程中ROS的变化在很大程度上与肝细胞的增殖和凋亡相关。
在肝脏损伤后,ROS的产生量会显著增加。
研究表明,ROS通过激活多种信号通路,如JNK、ERK和PI3K/Akt等,参与肝细胞的增殖。
此外,ROS还能通过抑制脂肪酸合成、调节细胞周期等,影响细胞增殖的过程。
然而,过量的ROS也会引起肝细胞的凋亡。
氧化应激会导致线粒体膜电位的下降,释放线粒体内的细胞色素C和。
ros响应肽段

ros响应肽段
ROS响应肽段是由对ROS(活性氧)响应的两亲嵌段共聚物聚L-蛋氨酸-嵌段-nε-三氟-乙酰-L-赖氨酸(PMK)和CRGD肽修饰的聚乙二醇(PEG)外壳所组成的。
这种肽段能够靶向aHSCs(活化肝星状细胞),并在aHSCs细胞内ROS水平高的情况下控制RES (某种药物或物质,具体需要根据上下文确定)的释放。
体外实验表明,ROS响应肽段能显著增强对ROS的消耗,减少胶原蛋白积累,避免aHSCs 被激活。
体内实验结果表明,该肽段能有效减轻纤维化小鼠的炎症浸润,防止纤维化,保护肝细胞免受损伤。
因此,ROS响应肽段在靶向肝纤维化aHSCs和实现ROS响应性药物控释等方面具有巨大的应用潜力。
以上信息仅供参考,如需了解更多关于ROS响应肽段的信息,建议咨询相关领域的专家或查阅相关文献。
ROS

活性氧和细胞凋亡进入九十年代以来,越来越多的肿瘤、发育和神经生物学家、免疫学家和其他生物学工作者以极大的热情致力于细胞凋亡(apoptosis)或称细胞程序化死亡的研究,使之成为当今生命科学研究中最引人注目的领域之一。
许多研究显示活性氧(reactiveosygenspecies,ROS),即氧自由基及其衍生物与细胞凋亡密切相关。
例如,低浓度的H2O2能诱导某些类型的细胞(如血管内皮细胞、HL60细胞)凋亡,氧化的低密度脂蛋白可诱导淋巴细胞凋亡,过氧亚硝基自由基可诱导胸腺细胞凋亡,等。
本文拟就ROS和细胞凋亡的关系作进一步综述。
1 ROS和凋亡细胞的线粒体功能变化的关系细胞游离系统(cell-freesystem)为认识细胞凋亡机制提供了良好的模型。
该系统通过分离细胞核和细胞浆,制备去核细胞(cytoplast)和无浆细胞,可以独立分析细胞浆和细胞核在细胞凋亡中的作用。
以此为基础的两大发现强力地揭示线粒体在细胞凋亡中的重要性:①细胞自发的受Bcl-2抑制的核固缩和DNA裂解依赖线粒体的存在;②caspase的活化依赖细胞色素C自线粒体释放。
随后的研究显示各种因素诱导的细胞凋亡均出现线粒体功能紊乱,尤其是线粒体跨膜电位(△ψm)的破坏。
业已清楚,造成△ψm下降的主要原因是线粒体膜通透性转运孔(MPT)的开放。
MPT 位于线粒体内、外膜之间,由一组蛋白复合体构成。
许多因素可影响MPT的开关。
其中,定位于线粒体内膜的腺嘌呤核苷酸转位蛋白(ANT)发挥重要作用。
ANT分子的构象改变,尤其是其相邻巯基的氧化还原状态明显影响MPT的开关。
当相邻巯基氧化为二硫键或类似于二硫键的交联复合物时,MPT开放。
反之,MPT关闭〔1〕。
因此,MPT的开放及△ψm的破坏与细胞的氧化还原状态,如巯基氧化、细胞GSH 缺少和ROS的堆积密切相关。
Macho等〔2〕在研究胸腺细胞凋亡机制中发现,早期凋亡细胞胞内GSH下降和ROS含量轻度升高。
ros相关基因

ros相关基因ROS相关基因随着生物科技的不断发展,ROS(Reactive Oxygen Species)已成为研究的热点之一。
ROS是一类极强的活性氧化物质,可以作为氧化还原反应的强氧化剂参与细胞的代谢过程,但其水平过高会导致细胞的氧化应激,从而对细胞造成负面影响。
ROS与多种疾病的发生发展密切相关,如癌症、心血管和神经系统疾病等。
在细胞内,帮助调节ROS的水平的就是ROS相关基因。
这篇文章将按照类别介绍ROS相关基因。
第一类:抗氧化剂细胞内的抗氧化剂是维护细胞内氧化还原平衡的重要物质,它们可以通过捕获ROS分子减少其浓度。
神经元中的抗氧化剂包括谷胱甘肽(GSH)、超氧化物歧化酶(SOD)和谷胱酰转移酶(GST)等。
多个研究表明,抗氧化剂在机体内具有广泛的生物学作用,能够通过减少ROS水平从而减缓氧化应激反应的发生,抑制癌症和心血管疾病的发生和发展。
而抗氧化剂的基因是否具有突变或变异,也会影响其有效性。
第二类:炎症相关基因炎症是许多疾病的根源,如阿尔茨海默病、糖尿病、心血管疾病等,其中很多炎症与ROS有关。
炎症反应从细胞水平到组织水平至全身,都会导致ROS水平的不平衡。
因此,一些炎症相关基因也被认为是ROS相关基因,如NF-κB、NLRP3、IL-1β等。
第三类:线粒体相关基因线粒体是常见的细胞器之一,其正常功能对于维持细胞代谢和生命活动至关重要。
ROS浓度过高会破坏线粒体的功能,导致线粒体的损伤,而线粒体的受损又会进一步导致ROS的积累,形成恶性循环。
因此,维持线粒体的正常功能是ROS水平平衡的一个重要模块。
线粒体与ROS相关的基因主要包括:线粒体膜转运蛋白(MTP)、线粒体氨基酰-tRNA合成酶(mtARS)等。
第四类:免疫相关基因免疫是人体防止感染的最主要的手段之一。
但免疫神经系统的过度兴奋或不充分的免疫反应都有可能导致ROS水平的不平衡,从而对机体内部产生负面作用。
因此,免疫相关基因也与ROS相关。
过氧亚硝酸_ros响应__概述说明以及解释

过氧亚硝酸ros响应概述说明以及解释1. 引言1.1 概述过氧亚硝酸(ROS)是一类在细胞内产生的高度活跃的氧化性分子,包括超氧阴离子、过氧化氢和羟基自由基等。
它们在正常生理状态下起着重要的调节作用,但当其生成过量或清除能力降低时,就会对细胞和组织造成损伤。
1.2 文章结构本文将首先对过氧亚硝酸ROS进行概述说明,包括其定义、特征以及形成过程。
接着,我们将介绍ROS在细胞中的功能和调控机制,以及与生理功能和疾病关联性、细胞信号传导通路调控作用以及抗氧化损伤机制研究进展相关的重要意义。
随后,我们将解释影响过氧亚硝酸ROS响应的因素和调控策略,包括外源环境因素对ROS生成的影响及应对策略、内源生物分子与ROS反应关系解析及有效措施以及针对过氧亚硝酸ROS胁迫下防治方法研究现状。
最后,在结论与展望部分,我们将探讨未来研究方向、潜在应用价值以及对生物医学领域的启示。
1.3 目的本文旨在全面介绍过氧亚硝酸ROS响应的概述说明和解释。
通过深入探讨ROS 在细胞中的功能、调控机制以及重要意义,我们可以更好地理解ROS对生物体的影响。
同时,通过解释影响ROS响应的因素和调控策略,有助于发展新的防治方法并提供新思路用于生物医学领域的研究和应用。
2. 过氧亚硝酸ROS响应概述说明:过氧亚硝酸(ROS)是指包括过氧化氢、超氧阴离子和羟基自由基等一类活性氧物质,它们在细胞代谢中广泛存在,并在多种生物学过程中发挥重要作用。
ROS 的生成主要通过细胞内的线粒体、内质网和细胞色素P450等特定位置的酶系统产生。
正常情况下,细胞能够平衡ROS的产生与清除,以保持正常的生理状态。
然而,在某些病理条件下,如外源环境因素的刺激、炎症反应以及遗传缺陷等情况下,细胞内ROS的生成会大量增加,导致细胞内的氧化应激状态增强。
过氧亚硝酸ROS在细胞中具有双重作用。
一方面,适量的ROS参与细胞信号转导、调节基因表达和蛋白质修饰等过程,发挥正向调控作用。
ROS对FOXO蛋白激活和基因表达的影响

ROS对FOXO蛋白激活和基因表达的影响吕舸; 周吉芳; 杨杰; 丁启龙【期刊名称】《《药学研究》》【年(卷),期】2019(038)005【总页数】5页(P286-289)【关键词】叉头框转录因子家族O亚族; 活性氧簇; 活性调节; 蛋白表达调节【作者】吕舸; 周吉芳; 杨杰; 丁启龙【作者单位】[1]中国药科大学医学基础实验教学中心江苏南京211198【正文语种】中文【中图分类】R363“Fork head”最初在果蝇体内发现,作为一种潜在的转录因子,随后证明其有翼状DNA结合区域,此时意识到它可能是已发现的其他转录调节因子,如HNF-3A,即现在的转录因子叉头框蛋白A1(FOXA1)[1]。
它存在于所有的真核生物中,在哺乳动物中叉头框转录因子家族O亚族(FOXO家族)包括4个成员:FOXO1、FOXO3、FOXO4、FOXO6,在体内广泛表达,FOXO6最晚被发现,在结构和功能上和其他3个差别较大[2]。
FOXO家族均有一个由110个氨基酸构成的DNA结合结构域,结合到靶基因的TTGTTTAC序列,从而发挥作用,包括调节糖异生、细胞周期停滞、分化、DNA修复,自噬和细胞凋亡等。
FOXO家族不同成员有不同的调节作用,FOXO1主要调节葡萄糖稳态,FOXO3是无脊椎动物、小鼠和人类中重要的调节寿命的因子,也和氧化应激反应和肿瘤抑制活性密切相关[3]。
机体氧化应激状态下会产生过多的活性氧簇(ROS),ROS是电子轨道最外层有未配对电子的活性基团,包括自由基和一些强活性的分子。
活性氧过多产生会对机体产生危害,最初被认为是有毒的,是有氧代谢的产物。
但现在发现ROS可以作为信号传导的“第二信使”,在细胞信号通路中扮演重要角色,特别是在应激反应下,体内ROS会产生变化,对氧化应激进行调节[4]。
FOXO是细胞内应激应答的重要调节因子,刺激编码抗氧化蛋白基因的表达,对抗细胞内的氧化反应[5]。
另一方面,ROS也能在多种水平调节FOXO的活性,包括转录后修饰和转录修饰[6]。
ros生物学解释

ros生物学解释ROS 生物学解释在生物学的广袤领域中,ROS(活性氧物质)是一个相当重要的概念。
ROS 并非是某种单一的物质,而是包括了一系列具有高反应活性的含氧分子或离子。
要理解 ROS,首先得知道它们是如何产生的。
在正常的细胞代谢过程中,比如线粒体的有氧呼吸,就会产生一定量的 ROS。
线粒体是细胞的“能量工厂”,在生产能量的同时,一些电子可能会“逃逸”,与氧气反应生成 ROS。
此外,细胞内的一些酶促反应,像 NADPH 氧化酶催化的反应,也会导致 ROS 的产生。
那么,ROS 到底都包含哪些成员呢?比较常见的有超氧阴离子(O2·)、过氧化氢(H2O2)、羟自由基(·OH)等等。
这些家伙可都不是“省油的灯”,它们的化学性质极为活泼。
ROS 对生物体既有好处,也有坏处。
先来说说好的方面。
在免疫反应中,ROS 可以帮助我们抵抗病原体的入侵。
例如,当巨噬细胞吞噬了细菌等病原体后,会通过产生大量的 ROS 来杀灭这些“不速之客”。
此外,ROS 还在细胞信号传导中发挥着一定的作用。
适度的 ROS 水平可以调节细胞的生长、分化和凋亡等过程,就像是细胞内的一个“微调器”。
然而,如果 ROS 的产生失去了控制,那问题可就大了。
过多的ROS 会对细胞内的各种生物大分子造成损伤。
比如说,ROS 可以攻击细胞膜上的脂质,导致脂质过氧化,破坏细胞膜的结构和功能。
蛋白质也是它们攻击的目标,ROS 会使蛋白质的结构发生改变,影响其正常的功能。
对于 DNA 来说,ROS 能造成碱基的修饰、链的断裂等,这可能会引发基因突变,甚至导致细胞癌变。
在生物体中,为了应对 ROS 带来的威胁,有着一套复杂而精妙的抗氧化防御系统。
酶类的抗氧化剂,像超氧化物歧化酶(SOD)能够将超氧阴离子转化为过氧化氢,然后过氧化氢酶和谷胱甘肽过氧化物酶会把过氧化氢进一步转化为水,从而降低 ROS 的水平。
非酶类的抗氧化剂,比如维生素 C、维生素 E 和谷胱甘肽等,也能够通过直接与ROS 反应来保护细胞。
小檗碱通过激活Nrf2-HO-1GPX4通路抑制小鼠海马神经元HT22细胞的铁死亡

细胞死亡的类型根据细胞形态可以分为3种:自噬、凋亡以及细胞坏死[1]。
铁死亡是区别于以上3种细胞形态的新的细胞形态,它与铁离子水平相关,是由于脂质过氧化物产生而发生的[2]。
它的实质是氧化损伤,即主要为依赖铁离子的脂质过氧化物产生过量并积累,随后产生线粒体变化[3]。
线粒体功能障碍和异常的能量代谢是许多急性和慢性神经退行性疾病的常见上游介质。
研究发现,多种疾病与铁死亡的关联紧密,如阿尔茨海默病、帕金森病等神经退行性疾病[4-7]。
神经退行性疾病是由神经元结构和功能的渐进性丧失或神经元死亡引起的疾病[8]。
大多数神经退行性疾病的发病机制尚不清楚,但越来越多的证据表明,神经退行性疾病的发病机制与兴奋毒素和氧化应激有Berberine inhibits erastin-induced ferroptosis of mouse hippocampal neuronal cells possibly by activating the Nrf2-HO-1/GPX4pathwayHUANG Qingyang 1,JI Dongdong 1,TIAN Xiuyun 1,MA Linyan 2,SUN Xiaojin 21Department of Clinical Medicine,2Department of Pharmacy,Bengbu Medical College,Biochemical Drugs Engineering and Technological Research Center of Anhui Province,Bengbu 233030,China摘要:目的探讨小檗碱对于Erastin 诱导小鼠海马神经元HT22细胞的铁死亡的保护作用及其可能机制。
方法以HT22小鼠海马神经元细胞为研究对象,分为对照组、Erastin 模型组、Erastin+30μmol/L BBR 组、Erastin+60μmol/L BBR 组。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠ros相关蛋白-概述说明以及解释1.引言1.1 概述概述部分的内容可以包括对ROS相关蛋白和小鼠的简要介绍,以及本文将要介绍的内容和研究的重要性。
概述:小鼠是一种常见的实验动物模型,广泛应用于生物学、医学等领域的研究中。
在研究生物过程和疾病机制时,我们经常会涉及到一类重要的蛋白质,那就是ROS相关蛋白。
ROS是指活性氧物种(reactive oxygen species),其包括一系列活性氧离子和分子,如超氧阴离子、羟基自由基和过氧化氢等。
ROS在细胞内广泛存在,并参与许多生理和病理过程。
本文将重点关注小鼠中的ROS相关蛋白,并对其定义、作用以及研究进展进行探讨。
ROS相关蛋白是一类具有特定功能的蛋白质,其作用涉及细胞的氧化应激、抗氧化防御和信号传导等多个方面。
通过研究小鼠ROS 相关蛋白的结构、功能和相互调控关系,我们可以更好地理解这些蛋白质在小鼠生物体内的重要作用。
了解小鼠ROS相关蛋白的研究进展对于揭示细胞内氧化应激和抗氧化机制具有重要意义。
这些蛋白质在细胞自由基平衡调节、DNA损伤修复、凋亡和细胞增殖等方面发挥着重要的调控作用。
通过深入了解小鼠ROS相关蛋白的功能特点和调控机制,我们可以进一步认识到这些蛋白质在维持细胞稳态、疾病发生机制以及药物治疗中的潜在价值。
在本文的正文部分,我们将首先介绍ROS相关蛋白的定义与作用,进一步展开讨论小鼠ROS相关蛋白的研究进展。
最后,在结论部分我们将总结ROS相关蛋白在小鼠中的重要性,并展望未来在该领域的研究方向。
通过本文的阐述,我们希望能够加深对小鼠ROS相关蛋白的认识,并为进一步的研究提供参考和指导。
1.2文章结构文章结构:本文将包含以下几个部分,以探讨小鼠ROS相关蛋白的研究进展及其在小鼠中的重要性。
首先,引言部分将对ROS相关蛋白的概念进行概述,并介绍文章的结构和目的。
接下来,正文将分为两个主要章节。
第一章将详细描述ROS相关蛋白的定义和作用,探讨其在细胞内的功能及与小鼠健康状况的关联。
第二章将重点介绍小鼠ROS相关蛋白的最新研究进展,包括其在疾病模型中的表达和调控机制等内容。
最后,结论部分将总结ROS相关蛋白在小鼠中的重要性,并展望未来研究的方向和可能的应用前景。
通过对这些内容的探讨,本文旨在增加对小鼠ROS相关蛋白领域的理解,为进一步的研究提供指导和启示。
1.3 目的本文的目的是综述和分析小鼠ROS相关蛋白的研究进展,以期增进对这些蛋白在小鼠中的作用和重要性的理解。
通过对ROS相关蛋白的定义、作用以及在小鼠中的研究进展的探讨,旨在揭示小鼠ROS相关蛋白的功能和调控机制。
具体目标如下:首先,我们将从概述入手,对ROS相关蛋白的基本概念进行介绍,阐明其在细胞内氧化应激反应中的重要作用。
然后,我们将重点关注小鼠ROS相关蛋白的研究进展,包括其鉴定、结构、功能及其在小鼠生理和疾病中的作用。
通过对这些进展的客观分析,我们希望能够全面了解小鼠ROS相关蛋白的多样性和复杂性。
在文章的结论部分,我们将总结小鼠ROS相关蛋白在小鼠中的重要性,并展望未来的研究方向。
通过对这些蛋白的研究,我们有望深入理解小鼠细胞内氧化应激反应的调控机制,为相关生理和疾病的预防和治疗提供新的思路和方向。
总之,本文的目的是系统地梳理和总结小鼠ROS相关蛋白的研究进展,探讨其在小鼠中的作用和重要性。
我们希望通过这篇文章能够为研究人员提供一个全面了解小鼠ROS相关蛋白的参考,促进相关研究的发展,并为进一步揭示ROS相关蛋白与小鼠生理和疾病之间的关联提供理论和实践支持。
2.正文2.1 ROS相关蛋白的定义与作用在细胞内,ROS(Reactive Oxygen Species,活性氧)是一类具有高度活性的氧化性物质,包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟基自由基(·OH)等。
虽然ROS在正常细胞代谢过程中产生,并参与一系列重要的细胞信号传导和调节机制,但过高的ROS水平会导致细胞氧化应激,引发一系列疾病和衰老过程。
为了对抗ROS的有害作用,细胞内存在一系列ROS相关蛋白,它们能够调节活性氧的生成、清除和信号传导,维持细胞内氧化还原平衡,保护细胞免受氧化应激损伤。
这些ROS相关蛋白包括抗氧化酶、氧化还原酶、转录因子等。
其中,抗氧化酶是一类重要的ROS清除酶,能够通过催化剂活性消除ROS。
最常见的抗氧化酶包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)等。
这些酶能够将具有活性的ROS转化为无害物质或可供利用的代谢产物,从而减轻细胞内氧化应激造成的损伤。
另外,氧化还原酶能够调节ROS的生成和信号传导,维持细胞内氧化还原平衡。
其中,NADPH氧化酶(NOX)家族成员是ROS产生的重要途径,通过电子传递反应将氧还原为超氧阴离子。
另外,谷胱甘肽(GSH)循环系统也是一种重要的维持细胞内还原环境的机制,其中谷胱甘肽和谷胱甘肽还原酶(GR)是其中的关键成员。
此外,转录因子在ROS应答中起着关键的调控作用。
例如,NF-E2相关因子2(Nrf2)是一种与抗氧化反应紧密相关的转录因子,能够启动一系列抗氧化基因的表达,提高细胞对氧化应激的适应能力。
综上所述,ROS相关蛋白在细胞内起着重要的调节和保护作用。
通过参与ROS的清除、调控ROS的生成和信号传导,这些蛋白能够维持细胞内氧化还原平衡,减轻氧化应激对细胞的损害。
进一步研究小鼠ROS相关蛋白的功能和调控机制,有助于深入理解氧化应激对细胞和生物体的影响,为相关疾病的治疗和预防提供新的思路和途径。
2.2 小鼠ROS相关蛋白的研究进展小鼠是常用的实验动物模型,在ROS(活性氧化物种)相关蛋白的研究中也扮演着重要的角色。
这些ROS相关蛋白在小鼠中发挥着调控细胞内平衡和应对氧化应激的重要功能。
通过对小鼠ROS相关蛋白的研究,我们能够更好地理解这些蛋白的生物学功能以及它们在疾病发生中的作用。
首先,一些研究表明小鼠中的调节ROS水平的蛋白包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)等。
这些蛋白具有清除ROS的能力,能够保护细胞免受氧化损伤。
研究发现,小鼠中这些蛋白的突变会导致ROS堆积和细胞损伤,从而引发多种疾病。
另外,小鼠模型还被广泛应用于研究ROS相关疾病中的其他重要蛋白如Nrf2、Keap1和Sirt1等。
这些蛋白参与调控氧化应激反应和纠正ROS 水平异常。
通过对小鼠中这些蛋白的功能和调控机制的研究,我们可以更好地了解它们在疾病发生中的作用,并寻找潜在的药物治疗靶点。
此外,近年来,小鼠模型也被用于研究ROS相关的肿瘤发生和转移过程。
一些研究发现,小鼠中的ROS调控因子在肿瘤形成和发展过程中发挥着重要的作用。
通过基因敲除或过表达小鼠模型,研究人员能够进一步了解这些ROS相关蛋白在肿瘤中的作用机制,并寻找新的治疗方法。
综上所述,小鼠作为ROS相关蛋白研究的重要模型动物,为我们揭示了这些蛋白的生物学功能和对疾病发生的影响提供了重要线索。
随着进一步研究的展开,我们可以更好地了解小鼠ROS相关蛋白的作用机制,为疾病治疗提供新的策略和目标。
(字数:338)3.结论3.1 ROS相关蛋白在小鼠中的重要性ROS相关蛋白在小鼠中的重要性ROS(Reactive Oxygen Species)相关蛋白在小鼠的生理过程中起着重要的调节和保护作用。
ROS是一类高度活性的氧化物,包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(•OH)等。
在正常的生理条件下,细胞产生ROS被认为是正常的代谢产物,而且维持着正常的细胞功能。
然而,当ROS水平超出正常范围时,会引起细胞和组织的氧化应激,导致多种疾病的发生和发展。
在小鼠中,ROS相关蛋白的功能主要通过调节氧化应激来维持细胞的稳态。
其中包括抗氧化酶、氧化还原酶、热休克蛋白等。
抗氧化酶包括超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)等,它们能够迅速清除细胞中产生的ROS,防止ROS对细胞膜、蛋白质、DNA等生物分子的氧化损伤。
氧化还原酶主要参与细胞内氧化还原平衡的调节,如谷胱甘肽还原酶(GR)和NADPH氧化酶(NOX)等。
热休克蛋白则能够通过保护蛋白质的正确折叠和分解来维持细胞的正常功能。
小鼠中ROS相关蛋白的重要性体现在多个方面。
首先,它们在维持细胞内氧化还原平衡方面起着关键的作用。
氧化还原平衡是细胞正常功能的基础,当氧化还原平衡被打破时,会导致细胞功能异常甚至细胞死亡。
ROS 相关蛋白能够及时清除细胞内过多的ROS,防止氧化应激的发生,保障细胞的正常功能。
其次,ROS相关蛋白在小鼠抗氧化防御系统中具有重要地位。
抗氧化防御系统是维持小鼠身体健康和防止多种疾病发生的重要组成部分。
这些蛋白质能够有效地清除自由基,保护细胞和组织免受ROS的损害,减缓衰老过程,延缓疾病的发展。
最后,ROS相关蛋白在小鼠疾病的发生和发展中发挥着重要的调节作用。
过多的ROS可以引起多种疾病的发生,如心血管疾病、肿瘤、糖尿病等。
研究发现,调节ROS相关蛋白的表达和活性能够改善这些疾病的病理过程,并提供新的治疗策略。
例如,增强抗氧化酶的活性可以减轻心肌梗死引起的心肌损伤;抑制ROS的产生和清除修复剂能够抑制肿瘤的生长和转移;调节热休克蛋白的表达可以改善糖尿病的病情。
综上所述,ROS相关蛋白在小鼠中的重要性不可忽视。
它们通过调节氧化应激、维持氧化还原平衡和抗氧化防御等多种途径,保护小鼠细胞和组织免受ROS的损害,维持身体健康和防止多种疾病的发生。
未来的研究将有助于更深入地揭示ROS相关蛋白的调节机制和作用途径,并为相关疾病的治疗和预防提供新的思路和方法。
3.2 未来研究的展望随着对小鼠ROS相关蛋白研究的深入,我们已经取得了一些重要的发现,但仍有许多问题需要进一步探索和解决。
在未来的研究中,我们可以从以下几个方面展望。
首先,我们需要进一步阐明小鼠ROS相关蛋白的功能和作用机制。
虽然我们已经对其中一些蛋白的功能有了初步的了解,但仍存在许多未知的蛋白及其功能待发现。
通过结合多种实验手段如基因敲除、转基因小鼠模型的构建以及蛋白相互作用的研究,我们可以更好地揭示这些蛋白在小鼠身体中的作用机制。
其次,我们还需要对小鼠ROS相关蛋白与疾病之间的关联进行更深入的研究。
许多疾病如癌症、心血管疾病等与ROS的紊乱有密切的关系,而小鼠作为人类疾病模型动物,可以为我们揭示这些蛋白在疾病发生发展中的作用。
因此,进一步研究小鼠ROS相关蛋白在疾病过程中的调控机制,有助于我们寻找新的治疗策略和药物靶点。
此外,我们还可以利用最新的技术手段如单细胞转录组学和蛋白组学等,全面地了解小鼠ROS相关蛋白在不同细胞类型和组织中的表达模式以及相互关系。
