中级无机化学复习试题
中级无机化学复习题

中级无机化学复习题一、选择题1、[Pt(NH3)2(OH)2Cl2]可能存在的几何异构体为(D )A)6 B)3 C)4 D)52、根据酸碱质子理论,下列物质可作为碱的有( B )A)H2SO4B)[Co(H2O)5(OH)]2+ C) [Fe(H2O)6]3+ D) H3O+3、下列物质属于软酸的是(B )A)Fe3+ B)Ag+ C)NH3D)F-4、关于酸碱理论的描述,错误的是( B )A)阿仑尼乌斯提出酸碱电离理论B)乌萨诺维奇提出酸碱质子理论C)路易斯提出酸碱电子理论D)皮尔逊提出软硬酸碱理论5、下列物质中不属于质子溶剂的是( D )A)NH3 B) HAc C ) SO2D)NaCl6、下列配合物属于配位异构的是( D )A)[CoBr(NH3)5]SO4和[CoSO4(NH3)5]BrB)[Cr(H2O)6]Cl3和 [Cr(H2O)5Cl]Cl2·H2OC)[CoNO2(NH3)5]Cl2和[CoONO(NH3)5]Cl2D)[Co(NH3)6][Cr(CN)6] 和 [Cr(NH3)6][Co(CN)6]7、根据软硬酸碱理论,下列卤化物中热稳定性最好的是(D )A)PH4F B)PH4Cl C) PH4Br D)PH4I8、在埃灵罕姆(Ellingham)图中,位于上方的金属氧化物的标准生成自由能比下方的金属氧化物的标准生成自由能( A )A)一定大 B)一定小 C)相等 D)有可能大,也有可能小9、根据鲍林对含氧质子酸强度的经验规则,HClO4属于很强的酸,这是因为该酸中m值为( D )A)0 B)1 C) 2 D) 310、下列氢酸酸性最强的是( A )A)H2Te B)H2Se C)H2S D) H2O11、下列氢化物相对于质子来说,最强的碱是( A )A)NH2- B)PH2- C)AsH2- D)NH312、下列不易生成多Pπ—Pπ重键的元素是( A )A)硅 B)碳 C)氧 D)氮13、在反应BF3 + NH3→ F3BNH3中,BF3为(D )(A) Arrhenius 碱 (B) Brφnsted 酸 (C) Lewis 碱 (D) Lewis 酸14、H2PO4?的共轭酸是(A )(A) H3PO4(B) HPO42 ? (C)H2PO3? (D) PO43?15、Fe3+具有d 5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能P 所要满足的条件是(C )(A) △和P 越大越好 (B) △> P (C) (C)△< P (D) △= P16、[Co(NH3)4(H2O)2]3+具有几何异构体的数目是(B )(A) 1 (B) 2 (C) 3 (D) 417、下列具有不同d x电子构型的离子,在八面体弱场中具有最大的晶体场稳定能的是(C )(A) d 1 (B) d 2 (C) d 3 (D) d 418、由英国化学家N·Bartlett 发现的第一个稀有气体化合物是(D )(A) XeF2 (B) XeF4(C) XeF6(D) XePtF619、下列碳酸盐中最难分解为氧化物的是(B )(A) CaCO3 (B) BaCO3(C) MgCO3(D) SrCO320、在[Ru(NH3)4Br2]+中,Ru 的氧化数和配位数分别是(C )(A) +2 和4 (B) +2 和6 (C) +3 和6 (D) +3 和4C,p8422. 相同浓度的下列几种酸的水溶液中,酸性最弱的是(D )(A) HCl (B) HBr (C) HI (D) HF23. 0.01mol 氯化铬(CrCl3·6H2O)在水溶液中用过量AgNO3 处理,产生0.02mol AgCl 沉淀,此氯化铬最可能为…( B)(A) [Cr(H2O)6]Cl3(B) [Cr(H2O)5Cl]Cl2·H2O(C) [Cr(H 2O)4Cl 2]Cl·2H 2O (D) [Cr(H 2O)3Cl 3]·3H 2O24.按晶体场理论,在八面体场中因场强不同有可能产生高自旋和低自旋的电子构型 是(C ) (A) d1(B) d3(C) d5(D) d825. 下列金属中,热力学金属活泼性最大的是 (B ) (A) Ca (B)Na (C)Mg (D) Li26.按酸碱质子理论考虑,在水溶液中既可作酸亦可作碱的物质是 (C ) (A) Cl ?(B)NH 4+(C) HCO 3- (D) H 3O+27、根据Pauling 近似规则,HClO 4的pKa 大约为( D ) (A )-2 (B)-4 (C )-6 (D) -8 28、下列物质中酸性最强的是( A ) (A )H 2Te (B) H 2Se (C) H 2S (D) H 2O 29、NH 3分子所属点群是( B )(A )C 3 (B )C 3v (C )D 3 (D )D 3h 30、对于CoF 63-配离子,下列叙述正确的是( C ) (A )CoF 63-的晶体场分裂能大 (B ) F-为强场配体 (C )CoF 63-是顺磁性的 (D )所有论述都不对 31、下列化合物中,服从18电子规则的是( A )(A )Fe(CO)5 (B)Mn(CO)5 (C )W(CH 3)6 (D) Cr(C 5H 5)(C 6H 6) 32、二茂铁离子(η5-C 5H 5)2Fe +是( A )(A) 强氧化剂 (B )强还原剂 (C )弱氧化剂 (D )弱还原剂 33、运用Wade 规则判断下列物种中属闭式构型的是( A ) (A )B 9C 2H 11 (B)B 5H 9 (C) B 5H 11 (D) B 6H 10 34、运用Wade 规则判断下列物种中属巢式构型的是(B ) (A )B 9C 2H 11 (B)B 5H 9 (C) B 5H 11 (D) B 6H 1035、下列离子半径最大的是( C)(A)Al3+ (B)Fe3+ (C) Y3+ (D) Co3+36、下列原中原子半径最小的是(D )(A)Rb (B)Sr (C)In (D)Te37、贵金属包括(D)(A)Pt、Pd、Rh (B)Os、Ir、Ru (C)Au、 Ag (D)上述全部38、FeO42-在酸性溶液中(B )(A) 很稳定(B)很不稳定(C)比在碱性溶液中稳定(D)比在中性溶液中稳定39、镧系元素离子的颜色一般比过渡金属离子的颜色浅,是因为f-f电子跃迁能级较d-d电子跃迁能级(B)(A)高(B)低(C)差不多(D)与此无关40、下列离子的草酸盐在水中溶解度最小的是( C )(A)Ti2(C2O4)3(B)Fe2(C2O4)3(C)Ce2(C2O4)3(D)Al2(C2O4)3二、填空题1、根据路易斯理论,凡能提供电子对的物质叫做碱;凡能接受电子对的物质叫做酸。
中级无机化学习题答案已打印

第一章、酸碱理论1.下列化合物中,哪些是路易斯酸,哪些是路易斯碱?BH4-,PH3,BeCl2,CO2,CO,Hg(NO3)2,SnCl2解答:路易斯酸BeCl2,CO2,CO,Hg(NO3)2,SnCl2路易斯碱PH3,CO,SnCl22.写出下列物种的共轭酸和共轭碱:NH2,NH2,H2O,HI,HSO4-解答:共轭酸共轭碱NH3:NH4+ NH2-NH2-:NH3NH2-H2O:H3O+OH-HI:I-HSO4-:H2SO4SO42-3.下列各对中哪一个酸性较强?并说明理由。
(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+ (b) [Al(H2O)6]3+和[Ga(H2O)6]3+(c) Si(OH)4 和Ge(OH)4 (d) HClO3和HClO4(e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4解答:(a) [Fe(H2O)6]3+和[Fe(H2O)6]2+路易斯酸性:前者,中心离子电荷高,吸引电子能力大质子酸性:前者,中心离子电荷高,对O的极化能力大,H+易离解;(b)[Al(H2O)6]3+和[Ga(H2O)6]3+路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(c) Si(OH)4 和Ge(OH)4路易斯酸性:前者,中心离子半径小,d轨道能量低质子酸性:前者,中心离子半径小,对O的极化能力大,H+易离解;(d) HClO3和HClO4 (e) H2CrO4 和HMnO4 (f) H3PO4和H2SO4均为后者,非羟基氧原子多,酸性越强。
4.应用Pauling规则,(1) 判断H3PO4(pKa=2.12)、H3PO3(pKa=1.80)和H3PO2(pKa=2.0)的结构;(2) 粗略估计H3PO4、H2PO4-和HPO42-的pKa值。
解答:(1)根据pKa值判断,应有相同非羟基氧原子。
(2)H3PO4:一个非羟基氧原子,pKa值约为2;H2PO4-pKa值增加5,约为7;HPO42-pKa约为12。
中级无机化学习题

《中级无机化学》课程介绍《中级无机化学》习题及解答目录第1章酸碱理论与非水溶液 (2)第2章对称性与群论基础 (8)第3章配位化学基础 (12)第4章配合物的电子光谱 (30)第5章簇状化合物 (42)第6章无机固体化学 (54)2006年2月第1章 酸碱理论与非水溶液1. 已知在水溶液中,Cu 的电位图为 Cu V Cu V Cu 521.0 153.0 2++,而在乙腈非水介质中却为 Cu V Cu Cu 0.118 V 0.1242 2-++,解释这种差别。
答:在非水介质乙腈中,离子与溶剂间的静电作用比在水中时要弱得多,因而Cu 2+溶剂化所放出的能量不足以补偿Cu +的电离所耗能量,以致Cu +可以稳定存在,不发生歧化。
2. 排列下列离子Ce 4+,Lu 3+,Eu 2+,La 3+水解程度的大小顺序。
答:Ce 4+ > Lu 3+ > La 3+ > Eu 2+3. (CH 3)2N —PF 2有两个碱性原子P 和N ,与BH 3和BF 3形成配合物时与BH 3相结合的原子是 ,与BF 3相结合的原子是 。
答:P ,N4. 按照质子亲和势增加的顺序将下列各碱HS -,F -,I -,NH 2-排序为。
答: I - < F - < HS - < NH 2-5 . 在下述各组化合物中按题目要求进行选择。
(A) 最强的Lewis 酸:(1) BF 3,BCl 3,BBr 3;(2) BeCl 2,BCl 3;(3) B(n -Bu)3,B(t-Bu)3;(B) 对B(CH 3)3的碱性较强:(1) Me 3N ,Et 3N ;(2) (2-CH 3)C 5H 4N ,(4-CH 3)C 5H 4N ;(Bu 丁基;C 5H 4N 吡啶)答:(A) (1) BBr 3;(2) BCl 3;(3) B(n -Bu)3;(B) (1) Me 3N ;(2) (4-CH 3)C 5H 4N6. 解释酸性变化规律HOI < HOBr < HOCl 。
中级无机化学复习题及参考答案

济南大学继续教育学院中级无机化学复习题一、单项选择题1.相同温度下,与质量分数1%的尿素水溶液具有相同渗透压的葡萄糖溶液的质量分数约为A. 1%B. 2%C. 3%D. 4%2.从天然铀分离235U的方法是A. 气体扩散B.电解C. 电离D. 水解3.将NH4NO3固体溶于水,溶液变冷。
则该过程的△G、△H和△S的符号依次为A. + --B. + + -C. - + -D. - + +4.将pH=1的盐酸与pH=12的NaOH溶液等体积充分混合,则混合溶液的pHA. 介于1~2B. 介于6~7C. 介于7~8D. 介于12~135.下列反应在较高温度下才可能自发进行的是A. N2(g) + O2(g) = 2NO(g), △H= +163 kJ·mol-1B. 2Ag(s) + Cl2(g) =2AgCl(s), △H= -254 kJ·mol-1C. 2HgO(s) = 2Hg(l) + O2(g), △H= +183 kJ·mol-1D. 2H2O2(l) =2H2O(l) + O2(g), △H= -196 kJ·mol-16.下图是酸性溶液中Mn元素的电势图。
则酸性溶液中稳定存在的微粒是A. MnO4-B. MnO42-C. Mn3+D. Mn2+7. 在1273 K、98.66 kPa下,硫蒸气的密度是0.5977 g·dm-3,则其分子式为A.SB.S2C.S4D.S88. 298 K、100 kPa时,下列几种气体组成的混合气体中分压最小的是A. 0.5 g 氢气B. 1.0 g 氦气C. 5.0 g氮气D. 10.0 g二氧化碳气体9. 下列氧化还原电对中,E 值最大的是A. Ag+/AgB. AgCl/AgC. AgBr/AgD. AgI/Ag10.电极电势与pH无关的电对是A. H2O2/H2OB. MnO4-/MnO42-C. MnO2/Mn2+D. IO3-/I-11.下列分子或离子中,中心原子采取等性sp3杂化的是A. NCl3B. SF4C. CHCl3D. H2O12. 下列有关物质的性质对比判断正确的是A. 分解温度Na2CO3 > CuCO3B. 熔点KCl > NaClC. 溶解度AgCl > AgFD. 分子间作用力HCl > HI13. M2+离子原子核外第三电子层中有15个电子,则M的元素符号是A. NiB. CoC. FeD. Mn14.下列各组元素第一电离能按递减顺序排列的是A.Mg Al SiB.B C NC.P As SbD.S Cl Br15.下列化合物属于“含非极性共价键的离子化合物”的是A. H2O2B. CH4C. NaOHD. Na2O216.下列化合物中,氧呈现+2氧化态的是A. Cl2O5B.BrO2 C. HClO2 D. F2O17.在甲醛(HCHO)及甲酰氯(HCOCl)中,碳的氧化态分别是A. +4,+4B. +4,+2C. 0,0D. 0,+218.在Cr2O72-/Cr3+半电池中,如果Cr2O72-、Cr3+的浓度均为1mol·dm-3,H+的浓度2mol·dm-3,则电极电势比标准电极电势A. 大B. 小C. 不变D. 不能判断19.在NO3--NO的半电池中,降低溶液的酸度,NO3-的氧化能力A. 增大B. 减小C. 不变D. 无法判断20.下列反应:4Al+3O2+6H2O→4Al(OH)3的△r G m =-zFE ,式中z等于A. 12B. 6C. 4D. 321.相同温度下,与质量分数3%的葡萄糖水溶液具有相同渗透压的尿素溶液的质量分数约为A. 1%B. 2%C. 3%D. 4%22.氢气和氧气的扩散速率比为A. 16B.4C. 1/4D. 1/1623.浓硫酸溶于水的过程中下列热力学函数变量△G、△H和△S的符号依次为A. - + -B. + + +C. - - +D. - + +第 1 页共14 页。
《中级无机化学》试题及答案
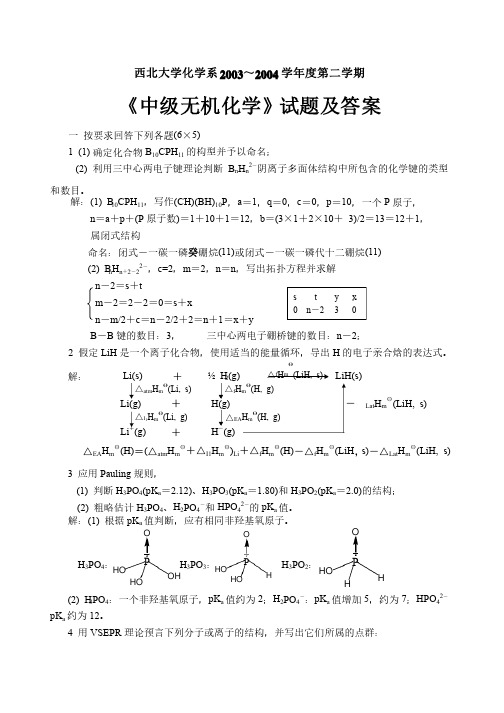
西北大学化学系2003~2004学年度第二学期《中级无机化学》试题及答案一 按要求回答下列各题(6×5)1 (1) 确定化合物B 10CPH 11的构型并予以命名;的构型并予以命名;(2) 利用三中心两电子键理论判断B n H n 2-阴离子多面体结构中所包含的化学键的类型和数目。
和数目。
解:(1) B 10CPH 11,写作(CH)(BH)10P ,a =1,q =0,c =0,p =10,一个P 原子,原子,n =a +p +(P 原子数)=1+10+1=12,b =(3×1+2×10+ 3)/2=13=12+1,属闭式结构属闭式结构命名:闭式-一碳一磷癸硼烷(11)或闭式-一碳一磷代十二硼烷(11)(2) B n H n +2-22-,c=2,m =2,n =n ,写出拓扑方程并求解,写出拓扑方程并求解n -2=s +tm -2=2-2=0=s +xn -m/2+c =n -2/2+2=n +1=x +y B -B 键的数目:3, 三中心两电子硼桥键的数目:n -2;2 假定LiH 是一个离子化合物,使用适当的能量循环,导出H 的电子亲合焓的表达式。
解:解: Li(s) + ½ H 2(g)LiH(s) Li(g)+ H(g) -△Lat H m θ(LiH, s)Li +(g) + H -(g) △EA H m θ(H)=(△atm H m θ+△I 1H m θ)Li +△f H m θ(H)-△f H m θ(LiH ,s)-△Lat H m θ(LiH, s) 3 应用Pauling 规则,规则,(1) 判断H 3PO 4(pK a =2.12)、H 3PO 3(pK a =1.80)和H 3PO 2(pK a =2.0)的结构;的结构;(2) 粗略估计H 3PO 4、H 2PO 4-和HPO 42-的pK a 值。
值。
解:(1) 根据pK a 值判断,应有相同非羟基氧原子。
中级无机化学试题及答案

中级无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,哪一个是过渡金属?A. 铁B. 碳C. 氧D. 钠答案:A2. 以下化合物中,哪一个是共价化合物?A. NaClB. HClC. MgOD. Fe答案:B3. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D4. 哪个元素的原子序数是26?A. 铁B. 钴C. 镍D. 锌答案:C5. 以下哪个元素是碱土金属?A. 锂B. 铍C. 钙D. 钡答案:C6. 哪种类型的键是离子键?A. NaCl中的键B. HCl中的键C. O2中的键D. C2H4中的键答案:A7. 以下哪个化合物是超酸?A. HClB. H2SO4C. H3PO4D. H2S答案:B8. 哪个元素属于卤素?A. 氟B. 氯C. 溴D. 碘答案:B答案:A, B, C, D9. 以下哪种化合物是金属有机化合物?A. 四氯化碳B. 四氯化钛C. 四氯化锆D. 四氯化铌答案:B10. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D二、填空题(每题2分,共20分)11. 过渡金属元素通常位于周期表的________区和________区。
答案:d区和f区12. 根据八隅体规则,碳原子最多可以形成________个共价键。
答案:413. 金属键是由________和________之间的相互作用形成的。
答案:金属离子和自由电子14. 元素周期表中,第________周期是最长的周期。
答案:六15. 元素的电负性越大,其非金属性越________。
答案:强16. 金属晶体的堆积方式主要有简单立方堆积、体心立方堆积和________堆积。
答案:面心立方17. 碱金属元素位于周期表的________族。
答案:一18. 元素的原子半径随着原子序数的增加而________(增大/减小)。
东北大学中级无机化学复习资料

第一章酸碱理论与非水溶液化学>>学习单元1 酸碱概念1、NH4+的共轭碱是(B)。
(A) OH-(B) NH3(C)NH2-(D) NH2-提示:由质子理论定义: NH4+(酸) H++NH3(碱),故选B。
2、在反应BF3 + NH3 F3BNH3中,BF3为(D)。
(A) Arrhenius碱(B) Br nsted酸(C) Lewis碱(D) Lewis酸提示:B具有缺电子性,可以接受孤对电子,故为Lewis酸。
3、根据酸碱的溶剂理论,在液态 SO2体系中的碱是( B )。
(A) SOCl2(B) Na2SO3(C) Na2SO4(D) PCl3 提示:2SO2 SO2+ SO32-,能生成溶剂阴离子的是Na2SO3,故选B。
为什么Fe3+与F-形成的配合物的稳定性大于Fe3+与Cl-形成的配合物的稳定性?酸碱定义:电负性较小的路易斯碱称为软碱;与软碱形成稳定配合物的路易斯酸为软酸。
电负性较大的路易斯碱称为硬碱硬”对应的是小的、高氧化态的粒子,这些粒子都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无;与硬碱形成稳定配合物的路易斯酸为硬酸。
硬”对应的是小的、高氧化态的粒子,这些粒子硬”对应的是小的、高氧化态的粒子,这些粒子都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无都很难被极化。
相反,“软”是指大的,低氧化态的粒子,很容易被极化。
软-软和硬-硬之间的酸碱反应最为稳定。
这个理论在有机化学和无机化学均有应用。
酸碱反应实质:硬酸倾向于与硬碱反应(硬亲硬),软酸倾向于软碱反应(软亲软)。
Fe3++6F–=[FeF6]3-(硬-硬)Hg2++4I-=[HgI4]2-(软-软)Fe4++4:Cl–=[FeCl4]–(硬-软),故[FeCl4]–不稳定第一章酸碱理论与非水溶液化学>>学习单元2 酸碱强度一、填空题1、判断相对Lewis碱性(1)(H3Si)2O和(H3C)2O;(2)(H3Si)3N和(H3C)3N ;其中较强的是(1)__(H3C)2O __,(2)__(H3C)3N___。
无机化学复习题(含参考答案)

无机化学复习题全卷满分100分,考试时间90分钟。
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 A1—27 Fe—56K—39 Cl—35.5 Mg—24 S—32 Cu—64一、选择题〔每小题只有一个选项符合题意,每小题3分,共48分〕1.下列现象或应用不能用胶体知识解释的是〔〕A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗B.牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐有固体析出C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体D.水泥厂、冶金厂常用高压电除去工厂烟尘,减少对空气污染2.有关晶体的下列说法中正确的是〔〕A.晶体中分子间的作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.晶体中若存在阳离子,则肯定存在阴离子D.氯化钠熔化时离子键未被破坏3.下列说法正确的是〔〕A.任何化学反应都伴随着能量的变化B.1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热C.在101kPa 时,1 mol 碳燃烧放出的热量就是碳的燃烧热D.在化学反应中需要加热的反应就是吸热反应4.在生物体内,由细胞膜内的葡萄糖,细胞膜外的富氧液体与细胞膜构成的生物原电池中,有关判断正确的是〔〕A.负极的电极反应可能是O2+4e+2H2O==4OH-B.正极的电极反应可能是O2+4e===2O2- C.负极反应主要是C6H12O6生成CO2或HCO3-D.正极反应主要是C6H12O6生成CO2或HCO3-5.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是〔〕A.④>②>①>③B.②>①>③>④C.④>②>③>①D.③>②>④>①6.下列溶液中:①石灰水②H2S溶液③KMnO4溶液④溴水⑤酸化的Ba(NO3)2溶液⑥品红溶液,不能..区别SO2和CO2气体的是A.只有①B.①⑤ C.①②③⑤D.②③④⑤7.中学化学教材中提供了不少数据(图表)。
中级无机复习题.doc

判断题键的极性越大,H+越易析出,酸性越强,所以HF的酸性大于HC1。
()配合物制备方法中,加成反应的特点是中心原子的配位数不变,氧化态不变。
()配合物制备方法中,取代反应的特点是中心原子的配位数不变,氣化态不变。
()配合物制备方法中,鉍化或还原反应:中心原子的鉍化态改变,配位数不变。
()根据品体场理论,形成高自旋配合物的理论判据是分裂能<成对能。
()根据品体场理论,形成低A旋配合物的理论判据是分裂能<成对能。
()晶体场稳定化能的人小与分裂能和屮心离了的电了构型无关。
()形成离子晶体的化合物屮不可能柯共价键。
()co外不是很强的路鉍斯碱,但它却能跟金属形成很强的化学键。
()Frenkel缺陷属于点缺陷,这种缺陷会影响整个岡体的化学计朵关系。
()名词解释水-离子理论:凡在水溶液中电离出H+的物质叫酸,在水溶液中是产牛.OH-的物质叫碱。
质子理论:任何能释放质子的物种叫做酸,任何能结合质子的物种叫做碱。
溶剂体系理论:凡在溶剂屮产生该溶剂的特征阳离了的溶质是酸,产生该溶剂的特征阴离_了的溶质是碱。
Lewis电子理论:能接受电子对的物种足酸,凡能提供电子对的物种足碱。
Lux氧负离子理论:酸为氧负离子02-接受体,碱是氧负离子02-的给予体。
EAN规则:是说金属的d电子数加上配体所提供的o电了•数之和等于18有机金属化合物:指含有至少1个M—C键的化合物,也称为金属有机化合物。
原子簇:指原子间互相成键形成的笼状或多面体结构化合物。
晶胞:能反映晶体结构全部对称牲的蛣小重S单位。
幻数:质子数为2, 8, 20, 28, 50, 82, 114,和164;中子数为2, 8, 20, 28, 50, 82, 126,184, 196, 228 和318的核数特别稳定,这些数字被称为幻数。
电子亲和能:一个能暈最低的气态原子(基态)在标准状态K获得一个电子成为-1价气态阴离子吋所放出的能撒。
电离能:从一个气态原了移去一个电了所需要的敁小能fi。
[0049]《中级无机化学》
![[0049]《中级无机化学》](https://img.taocdn.com/s3/m/4871ce68be23482fb4da4cde.png)
1、下列氢氧化物溶解度最小的是()。
Ba(OH)2La(OH)3Lu(OH)3Ce(OH)42、用作治疗癌症的含铂药物是().顺式-[Pt(NH3)2Cl2]反式-[Pt(NH3)2Cl2]H2PtCl6PtCl43、B4H10属于()分子。
闭式巢式网式链式4、估算配合物中自旋对磁矩的贡献最大的是()。
[Co (NH3)6]3+[Fe (H2O)6]2+[Fe (CN)6]3-[Cr(NH3)6]3+5、Pr的磷酸盐为Pr3(PO4)4,其最高氧化态氧化物的化学式是()Pr2O3Pr2OPrO2Pr3O46、在可见区内La3+和Ce3+的颜色分别为()。
无色无色;"绿色,无色;无色,粉红色绿色,粉红色7、下列不是π-配体的是()。
CH2=CH2CO5H5-8、下列元素第一电离能最大的是()。
BCNO9、B12H122-的名称为()。
闭式-十二硼烷阴离子(2-)十二硼烷阴离子(2-)十二硼烷阴离子(-2)闭式-十二硼烷阴离子(-2)10、下列哪种过渡金属具有低密度、高熔点和抗腐蚀的性质,而且强度高,能够制造军用飞机()。
水银钛钪铬11、在酸性介质中,Cr2O72-的氧化性比MoO42-的氧化性()。
大小相等12、在单质金属中,导电性最好的是(),熔点最高的是()。
Cs,WHg;CrOs,Mo。
Ag,W13、下列元素中,可形成多酸的是()。
NaFeAgMo14、下列提炼金属的方法,不可行的是()。
Mg还原TiCl4制备Ti热分解Cr2O3制备CrH2还原WO3制备W羰化法提纯Ni15、上述各金属中可用羰化法提纯的是()。
TiNiHgW16、金属羰基配合物的特点有()。
一氧化碳与金属能形成很强的化学键中心原子总是呈现出较低的氧化态大多数配合物服从有效原子序数规则以上三种17、CO是()电子给予体。
234118、估计Os3(CO)12中共有()个M—M键123419、硼氢化物B2H6,B6H10,B10H14,B5H9中酸性最强的是()。
中级无机化学试题

Question 11. 下列芳香醛在m-CPBA(间氯过氧苯甲酸)存在条件下氧化产物为相应的芳香酸的有Question 22. 下列氧化反应中,能够选择性地将醇类化合物氧化为相应的羰基化合物而不会发生过度氧化生成羧酸的是Pinnick氧化Dess-Martin氧化Swern氧化IBX氧化Question 33. 化合物1在MgBr2•Et2O条件下去保护得到的产物是Question 44. 下列保护基中对酸稳定、对碱不稳定的是Boc保护基Cbz保护基Fmoc保护基MOM保护基Question 55. 化合物12a经过苯炔中间体机理转化为Question 66.H2, Pd/CH2, Pd(OH)2/CHI, H2OMgBr2, Et2OQuestion 77.请问在此反应中CuCN的主要作用是什么?控制1,4-、1,2-加成反应产物的比例控制手性异构体比例亚铜离子与氧配合增强羰基正电性氰根离子与镁配合增强格式试剂反应活性Question 88. 以下各种还原剂, 可用于将酸或酰胺, 腈还原到醛的有(注: 所有试剂均可以控制温度, 浓度, 和溶剂)Red-Al: Na[AlH2(OCH2CH2OMe)2]LiAlH(OiPr)3NaBH4B2H6/THFLiAlH4NaBH3(CN)DIBAL: HAl(iBu)2 Question 9–Boc–Cbz–Bn–FmocQuestion 1010. 如下三组分反应最可能的产物是什么:Question 1111. 在swern氧化的机理中,ABCD所示的哪一部分反应机理有错误?DCABQuestion 1212. 在如图所示的Heck反应中,产物的立体选择性是由哪一步或哪几步机理引入的?ACDBQuestion 1313. 在如下的反应中,1和2代表什么物质?1:甲酸,2:碳酰氯1:甲酸,2:草酰氯1:乙酸,2:草酰氯1:乙酸,2:碳酰氯Question 1414. 下列反应条件哪些可以还原酯基为醇?NaBH3CNNa-EtOHNaOH-(CH2SH)2 , then Raney Ni-H2LiAlH4SOCl2 ,then Lindler cat.-H2 , S Question 1515. 下列反应哪一个是Pictet-Spengler反应?Question 1616. 下列说法哪个是正确的?NaBH3CN还原能力比NaBH4强,反应比较剧烈芳香羧酸的酸性因芳香环上存在邻位取代基而增强SOCl2与PCl3氯代均使产物构型翻转Pinnick氧化需要保证体系为弱碱性,还需要加入异戊烯吸收次氯酸Question 17Pinnick氧化反应Heck反应Darkin氧化反应Swern氧化反应Question 18Pd催化加氢DDQ氧化HCl-有机溶剂MgBr2.Et2O+KI Question 19Suzuki反应Hunsdiecker反应Stille反应Negishi反应Question 20氢化铝锂可以还原孤立的碳碳双键Birch还原得到的产物为共轭二烯衍生物用NaBH3CN替代硼氢化钠是为了增强还原能力Lindlar催化剂将炔烃催化氢化为顺式烯烃Question 21硅基所连基团的电子效应羟基所连基团的体积大小硅基所连基团的体积大小羟基所连基团的电子效应Question 2222. 下列哪一项氧化还原过程是不能使用Dess-Martin氧化反应来完成的?Question 2323. 判断下面反应的主产物.。
中级无机化学习题(含答案)

(B) 对 B(CH3)3 的碱性较强:(1) Me3N,Et3N;(2) (2-CH3)C5H4N,(4-CH3)C5H4N;(Bu
丁基;C5H4N 吡啶) 答:(A) (1) BBr3;(2) BCl3;(3) B(n-Bu)3;(B) (1) Me3N;(2) (4-CH3)C5H4N 6. 解释酸性变化规律 HOI < HOBr < HOCl。
9. 比较下列每组两个化合物与乙醇形成氢键的能力:
2
(1) (H3Si)2O 和(H3CH2C)2O;(2) (H3Si)3N 和(H3C)3N 答:对同一种 H 给体(如乙醇)而言,Lewis 碱性越强形成的氢键也越强。因为 O 和 N 上
的电子可扩充到 Si 的空 d 轨道上,因此与 Si 结合的 O 和 N 较与 C 结合的 O 和 N 的
Lewis 碱性低,因而可以预期(1)中的乙醚和(2)中的三甲胺形成的氢键更强些。
10.比较 HCF3 与 HCH2NO2 的酸性强弱,叙述理由。 答:HCF3 酸性较弱。按照诱导效应似应是前者的酸性强,因为 3 个电负性很大的 F 使 C
原子上带很高的正电荷。然而 HCF3 失去质子形成的 CF3-基团 C 上的负电荷离域化程 度并不高,而在 HCH2NO2 失去质子形成的 CH2NO2-基团 C 上的负电荷可以向 NO2 基 团的*轨道离域而稳定。所以后者的酸性较强。
子是
,与 BF3 相结合的原子是
。
答:P,N
4. 按照质子亲和势增加的顺序将下列各碱 HS,F,I,NH2-排序为。 答: I- < F- < HS- < NH25 . 在下述各组化合物中按题目要求进行选择。
(A) 最强的 Lewis 酸:(1) BF3,BCl3,BBr3;(2) BeCl2,BCl3;(3) B(n-Bu)3,B(t-Bu)3;
中级无机化学-习题及答案-完整版

(2)属D4h点群,含对称元素C4、C2、2 C2' 、 2C2'' 、i、2S4、σh、2σv、2σd
(3)若忽略H原子,属C2v点群,含对称元素C2、2σv (4)属D3d点群,含对称元素C3、3C2'⊥C3、i、2S6、3σd (5)属C3v点群,含对称元素C3、3σv (6)属D2h点群,含对称元素C2、2C2'⊥C2、i、2σv、σh (7)属D∞h点群,含对称元素C∞、∞C2'、σh、∞σv、i、S∞ (8)属C2v点群,含对称元素C2、2σv
2.8 PtCl42-属于什么点群?画出它的结构,标出各类操作元素(每类只标一个)。
2.9 已知下列分子(离子)所属的点群,画出它们的结构: (1)B(OH)3(C3h);(2)Cr(en)33+(D3);(3)Co(gly)3(C3); (4)Mn2(CO)10(D4d);(5)(H2C=C=CH2)(D2d)。
H2CO3 + OH-(水-离子理
论:解离出OH-,或溶剂体系理论:生成溶剂的特征阴离子),所以NaHCO3水溶液显碱性
因为SO3 + H2O → H+ + HSO4-(水-离子理论和质子理论:解离出H+),或SO3 +
2H2O → H3O+ + HSO4-(溶剂体系理论:生成溶剂的特征阳离子),所以SO3水溶液显酸
2.5 [MA2B2]2-呈平面四边形构型时属D2h点群,含有对称元素:C2、2C2'、σh、i、2σv。[MA2B2]2 -呈四面体构型时属C2v点群,含有对称元素:C2、2σv。
2.6 C4h点群比D4h点群缺少 4 条垂直于主轴的C2'旋转轴。D4h点群的例子有配离子PtCl42-,C4h 点群例子有:
《中级无机化学》习题1

《中级无机化学》习题1中级无机化学习题(一)1、[Pt(NH3)2(OH)2Cl2]可能存在的异构体为()A)6 B)3 C)4 D)52、根据酸碱质子理论,下列物质可作为碱的有()A)H2SO4B)[Co(H2O)5(OH)]2+C) [Fe(H2O)6]3+D) H3O+3、下列物质属于软酸的是()A)Fe3+B)Ag+C)NH3D)F-4、关于酸碱理论的描述,错误的是()A)阿仑尼乌斯提出酸碱电离理论B)乌萨诺维奇提出酸碱质子理论C)路易斯提出酸碱电子理论D)皮尔逊提出软硬酸碱理论5、酸在水中拉平到_________,而碱在水中拉平到___________6、冰醋酸可作为HClO4, HBr, H2SO4, HCl的___________溶剂。
7、由液氨的Ks,在液氨中碱性pH标度为多少?8、氨的自离解方程式为何?9、氨在醋酸中的反应方程形式为何?10、写出蔡斯盐的制备反应方程式11、用DCD模型说明蔡斯盐的结构有何特点?12、粗略估计H5IO6的pK1值13、试判断配离子[AuCl4] -(反磁性的)的几何构型和电子结构?14、已知配合物的中心原子为M,A、B、C为配位体,在具有化学式为MA2BC(四面体)的配合物中,几何异构体为多少?15、什么叫协同成键作用?16、CO是一种很不活泼的化合物,为什么它跟过渡金属原子能形成很强的配位键?配位原子是碳还是氧?为什么?17、为了使钒的羰基化合物符合EAN规则,它的最简单的分子应该是什么?为什么它实际上是不稳定的?18、为什么羰基配合物中过渡金属元素可以是零价甚至可以是负价?19、论在V(CO)6-, Cr(CO)6, Mn(CO)6+系列中,CO的伸缩振动频率的变化趋势。
20、金属原子簇合物与普通多核配合物有何区别?21、运用Wade规则,指出物B4C2H6种所属的结构类型22、运用Wade规则,指出物B3H8-种所属的结构类型23、运用Wade规则,指出物B4H10种所属的结构类型24、运用Wade规则,指出物B10H14种所属的结构类型25、为什么第七副族后的元素不易达到族号氧化态?26、过渡元素高价氧化态稳定存在的条件是什么?27、根据埃灵罕姆图,说明氧化物TiO2的热还原法,选用什么还原剂合适?28、根据埃灵罕姆图,说明氧化物Fe3O4的热还原法,选用什么还原剂合适?29、什么叫稀土元素?30、通常说的轻稀土元素是指哪些元素?31、镧系元素的原子的电子结构有哪些特点?32、试说明镧系元素的特征氧化态为+3,而镨却常呈现+4氧化态,铕又可呈现+2所化态?33、试说明镧系元素的特征氧化态为+3,而钕却常呈现+4氧化态,铥又可呈现+2所化态?34、镧系离子和d过渡金属离子的电子吸收光谱有何差异?说明原因。
中级无机化学习题DOC

《中级无机化学》课程介绍《中级无机化学》习题及解答目录第1章酸碱理论与非水溶液 (2)第2章对称性与群论基础 (8)第3章配位化学基础 (12)第4章配合物的电子光谱 (30)第5章簇状化合物 (42)第6章无机固体化学 (53)2006年2月第1章 酸碱理论与非水溶液1. 已知在水溶液中,Cu 的电位图为 Cu V Cu V Cu 521.0 153.0 2++,而在乙腈非水介质中却为 Cu V Cu Cu 0.118 V 0.1242 2-++,解释这种差别。
答:在非水介质乙腈中,离子与溶剂间的静电作用比在水中时要弱得多,因而Cu 2+溶剂化所放出的能量不足以补偿Cu +的电离所耗能量,以致Cu +可以稳定存在,不发生歧化。
2. 排列下列离子Ce 4+,Lu 3+,Eu 2+,La 3+水解程度的大小顺序。
答:Ce 4+ > Lu 3+ > La 3+ > Eu 2+3. (CH 3)2N —PF 2有两个碱性原子P 和N ,与BH 3和BF 3形成配合物时与BH 3相结合的原子是 ,与BF 3相结合的原子是 。
答:P ,N4. 按照质子亲和势增加的顺序将下列各碱HS -,F -,I -,NH 2-排序为。
答: I - < F - < HS - < NH 2-5 . 在下述各组化合物中按题目要求进行选择。
(A) 最强的Lewis 酸:(1) BF 3,BCl 3,BBr 3;(2) BeCl 2,BCl 3;(3) B(n -Bu)3,B(t-Bu)3;(B) 对B(CH 3)3的碱性较强:(1) Me 3N ,Et 3N ;(2) (2-CH 3)C 5H 4N ,(4-CH 3)C 5H 4N ;(Bu 丁基;C 5H 4N 吡啶)答:(A) (1) BBr 3;(2) BCl 3;(3) B(n -Bu)3;(B) (1) Me 3N ;(2) (4-CH 3)C 5H 4N6. 解释酸性变化规律HOI < HOBr < HOCl 。
福师《中级无机化学专题》期末复习题

福师《中级无机化学专题》期末复习题(单选题)1.由于镧系收缩使性质极相似的一组元素是()。
A: Sc和LaB: Fe、Co和NiC: Nb和TaD: Cr和Mo正确答案: C(单选题)2.有关各对物质的碱强度的比较,正确的是 ( ).A: 酸性:[Fe(H2O)6]33+< [Fe(H2O)6]32+B: 酸性:[Al(H2O)6]33+<[Ga(H2O)6]33+C: 酸性:Si(OH)4< Ge(OH)4D: 酸性:H2CrO4 < HMnO4正确答案: D(单选题)3.下列配合物中, M为配合物的中心离子, A、B、C为配体,其中有两种异构体配合物 ( )。
A: MA5BB: MA6C: MA2BC(平面四边形)D: MA2BC(四面体)正确答案: C(单选题)4.下列物质在纯硫酸中显酸性的是( )A: CH3COOHB: NH3C: H2S2O7D: HNO3正确答案: C(单选题)5.下列物种中具有极性的是( )A: SO2B: CO2D: SO42?正确答案: C(单选题)6.磷酸的Ka1值大约是( )A: 10?7B: 10?2C: 103D: 108正确答案: B(单选题)7.[PtCl4]2?配离子中,Pt(II)的杂化类型为( )A: sp2B: sp3C: dsp2D: d2sp3正确答案: C(单选题)8.Y通常与重稀土元素共生是因为它们( )A: 都是金属元素B: 都含有f电子C: 都形成M3+离子D: 半径接近正确答案: D(单选题)9.下列配合物或配离子中属于低自旋构型的是( )A: Fe(H2O)63+;B: Co(H2O)62+;C: Co(H2O)63+;D: CoF63-正确答案: C(单选题)10.19世纪末英国科学家Rayleigh和Ramsay发现的第一个稀有气体是()A: HeB: NeD: Kr正确答案: C(单选题)11.下列氧化物和浓HCl反应有Cl2 放出的是()A: Fe2O3B: CeO2C: TiO2D: SnO2正确答案: B(单选题)12.下列离子中,可以发生岐化反应的离子是()。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中级无机化学复习题
1.为什么第二周期与第三周期同族元素性质存在明显差异?
2.为什么在矿物中Mg、Ca、Sr、Ba等金属离子以氧化物、氟化物、碳酸盐和硫酸盐等形式存在?Cu、Ag、Pb、Zn、Hg则以硫化物形式存在?
3.通过计算说明钾原子最后一个电子填充在4s 轨道上。
4.比较Lewis碱强度:NH3NF3NCl3NBr3
比较Lewis酸强度:BBr3BCl3BF3
5.完成下列化学反应:
CO(NH2)2+H2SO4→
HNO3 +HF →
H-+NH3 →
6.由于形成水合物必须放热,试分析M c X a(s)在298K时形成四水合物至少放热多少?(假定正、负离子在无水盐和含水盐中对摩尔熵的加和贡献相等。
已知每mol晶格水对水合物的摩尔熵的独立加和贡献约为39 J·K-1·mol-1,
S mθ(H2O,l)=69.91 J·K-1·mol-1)
7.试通过估算Xe[PtF6]的反应焓变来说明由Xe(g)和PtF6(g)可以制备Xe[PtF6]。
(已知:PtF6-的半径为310 pm,Xe+半径为180 pm;Xe(g) 的第一电离能I1=1170 kJ mol-1,PtF6(g)的电子亲合能-771 kJ mol-1)
8.利用HSAB理论判断下列反应进行的方向,并说明理由。
HgF2 + BeI2= BeF2 + HgI2
Ag+ + HI = AgI + H+
9.下图为自由能-温度图,回答下面问题:
(1)为什么CO2线几乎与温度坐标轴平行,而CO线是一条向下的斜线?
(2)已知CO2线有△Gθ=-393.5-3.3×10-3T,CO线有△Gθ=-221-0.18T,求二线交点温度。
(3) 分别写出当温度低于和高于交点
温度时,用碳还原金属氧化物MO 时的反
应方程式?
(4)为什么可以采用加热的方法制备Ag?
10.通过设计热力学循环计算CrCl 的生成焓,并讨论其能否稳定存在? (已知Cr +的半径估计约为100 pm, r (Cl -)=181 pm ,Cr 的升华焓和电离能分
别为397和653 kJ mol -1,Cl 2的离解能为243.4 kJ mol -1, Cl 的电子亲合能为368.5
kJ mol -1)。
11. 已知酸性介质中下面两个元素的元素电势图:
请回答下列问题:
1) 计算:φo (IO 3-/I -)=? φo (IO 3-/HIO)=?
2) 指出电势图中哪些物质能发生歧化反应;
3) 在酸性介质中H 2O 2与HIO 3能否反应;
4) 在酸性介质中I 2与H 2O 2能否反应;
5) 综合3)、4)两个反应,HIO 3与H 2O 2反应最终结果是什么?用反应式说明.
12. 利用价层电子对互斥理论完成下列问题
1)判断ClF 3、IF 5分子结构,画出分子构型图,说出构型名称。
IO 3- HIO I 2 I -1.1951.450.535O 2 H 2O 2 H 2O
1.770.68
2)判断并画出OCl2和OF2的分子构型图。
比较键角∠Cl-O-Cl和∠F-O-F相对大小,并说明理由。
13、根据软硬酸碱理论,判断下列各组物质的相对稳定性,并说明理由。
(1)HF HCl HBr HI ;(2)AgF AgCl AgBr AgI 14、在钒的系统中欲只使V(Ⅱ)稳定存在,有Zn、Sn2+和Fe2+三种还原剂,应选择哪一种?。
