燃烧热-盖斯定律-2018.9.4
人教版 选修4 第一章 第二节 燃烧热 能源 盖斯定律

第二节燃烧热能源盖斯定律一、燃烧热1.燃烧热定义:,叫做该物质的燃烧热。
注意(1)在101 kPa时,生成稳定的氧化物。
如C完全燃烧应生成,H2燃烧生成,S燃烧生成。
(2)燃烧热通常是由测得的。
(3)可燃物以作为标准进行测量。
(4)计算燃烧热时,热化学方程式常以分数表示。
H2(g)十1/2O2(g)=H2O(l);△H=-285.8kJ/mol已知:热化学方程式:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol燃烧热与中和热的区别与联系二、能源1.能源是指提供能量的自然资源,它包括化石能源(煤、石油、天然气)、阳光、风力、流水、潮汐以及柴草等。
我国目前使用的能源主要是化石燃料。
2.一级能源指在自然界中以现成形式提供的能源称为一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。
如化石能源、流水、潮汐等为一级能源,而氢气、电能等则为二级能源。
重点提醒(1)在选择燃料时我们可从:物质的燃烧热、燃料的储量、开采、运输、储存的条件、价格、对生态环境的影响等各方面综合考虑。
(2)煤作为燃料在开采时造成地面塌陷,煤的燃烧产生有毒气体和烟尘对环境造成严重污染,同时化石能源不可再生,储量也极其有限。
(3)提高煤的燃烧效率,减少污染的方法:可以将煤气化或液化。
如煤和水蒸气反应生成CO和H2(水煤气),也可以把煤经过处理变成甲醇、乙醇等液体燃烧,从而提高煤的燃烧效率。
(4)未来的新能源主要有:太阳能、燃料电池、风能、氢能、生物能、地热能、海洋能等,新能源的特点是:资源丰富、可以再生、对环境污染少或没有污染等。
三、盖斯定律:1.1840年,盖斯(G.H.Hess,俄国化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其是相同的。
也就是说,化学反应的只与反应的和有关,而与具体反应进行的无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是的,这就是盖斯定律。
《燃烧热盖斯定律》课件

如何计算甲烷的升华热
实际应用案例分析
工业生产
燃气轮机、内燃机等主要以 燃烧热为能源
热分析
对含氧化物的物质搭配控制 炉温以达到更好效果
环境监测
通过燃烧热进行含水样品水 含量的测定
燃烧热盖斯定律的局限性
燃料组成
燃料成分会影响燃烧热的计算,并提高难度 和复杂性.
杂质含量
可以影响燃烧热的计算和使用情况。
《燃烧热盖斯定律》PPT 课件
在这个课件中,让我们一起探讨燃烧热盖斯定律的定义、原理、计算方法、 应用案例以及局限性。
热力学基础知识介绍
1 热力学基本概念
热、功、能量等
2 热力学第一定律
能量恒原理,能量转 化形式的类比
3 热力学第二定律
热力学乃至自然界存在 的方向性,熵增原理
燃烧热盖斯定律的定义和原理
温度影响
在太高时,其假设的前提条件就难以满足, 导致公式的误差增大.
实际情况与理论计算地区
由于很难在空气中实现完全燃烧,因此理论 计算的燃烧热值往往高于实际运用中的数值。
相关实验和研究成果
1
达尔文消磨时间的瓶子
2
研究了可燃性气体的燃烧对它的内能、
压力等的影响
3
托里切利实验
证明了燃气的热容比值为固定的常数
制备二氧化铅的实验
用燃烧热来算出产生的热量、氧化物 的生成量等等
总结和展望
总结
燃烧热盖斯定律是热力学中重要而基础的理论, 理解和熟练应用它对于相关领域的现实应用非常 重要。
展望
随着现代科技的发展,燃烧热盖斯定律的应用与 适用性正不断扩大和深化,进一步带动着科学发 展,未来的前景仍不可估量。
定义
燃烧热 中和热 盖斯定律

解: 方程式①×2+②×1/2-③×1/2即得目标方程式,则:
△H= △H1×2+ △H2×1/2- △H3×1/2
=-2372.4kJ/mol
燃烧热 中和热 盖斯定律
(3)某次发射火箭,用N2H4(肼,气体)在NO2中燃烧, 生成N2、液态H2O。请写出发射火箭反应的热化学方程式。
已知:(1)N2(g)+2O2(g)=2NO2(g) (2)N2H4(g)+O2(g)=N2(g)+2H2O(l) △H1=+67.2kJ/mol △H2=-534kJ/mol
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H
解: 方程式(2) ×2+(3) ×2-(1)即得目标方程,则: △H=△H2×2+ △H3×2- △H1
=-488.3KJ/mol
燃烧热 中和热 盖斯定律
(2)根据下列反应的焓变,计算:C(石墨)与H2(g)反应生成1molC2H2(g)的焓变 ①C(石墨)+O2(g)=CO2(g) ②2H2(g)+O2(g)=2H2O(l) ③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H1=-393.5kJ/mol △H2=-571.6kJ/mol △H3=-2599.2kJ/mol
燃烧热 中和热 盖斯定律
一、燃烧热和中和热
1. 燃烧热
1mol
稳定
kJ/mol
1 393.5
负 注:几种元素燃烧后对应的稳定产物: C S CO2(g) H N H2O(l) N2(g)
SO2(g)
燃烧热 中和热 盖斯定律
【练一练】判断下列说话的正误:
燃烧热盖斯定律

C
ΔH1
ΔH3 ΔH2 CO
CO2
ΔH1 =ΔH3—ΔH2
①C(s)+1/2O2(g) = CO(g) ΔH1=? ②CO(g)+1/2O2(g) = CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g) = CO2(g) ΔH3=-393.5kJ/mol
• ①=③-②, • 所以:
C(s) + 1/2O2(g) == CO(g) ΔH1=? 阅读教材P11: 一、盖斯定律
1、盖斯定律
不管化学反应是一步完成或分 几步完成,其反应热是相同的。 化学反应的反应热只与反应体 系的始态和终态有关,而与反应的 途径无关。
B(反应体系的终态)
H
登山的高度只与 起点和终点的相 对高度有关,与 上山的途径无关
答案:1.首先,因气体易扩散,故气体燃料与空气混 合充分,容易发生完全燃烧,与固体燃料相比有较高 的能量利用率。 其次,气体燃料便于管道运输、使用方便(易点燃、 易熄灭)、无渣无尘、清洁卫生。 第三,固体煤中含有硫、氮等杂质,直接燃煤,会产 生大量二氧化硫、氮氧化物(NOx)、粉尘,造成大 气污染,住宅环境、居室空气的污染则更严重。
ΔH1 =ΔH3—ΔH2 = -393.5kJ/mol + 283.0kJ/mol = -110.5kJ/mol
例2:已知:
①C(石墨,s)+O2(g)==CO2(g) △H1= -393.5kJ/mol ②C(金刚石,s)+O2(g)==CO2(g) △H2= -395.0kJ/mol
写出石墨变成金刚石的热化学方程式。
B. C(s)+O2(g)=CO2(g)
C. 2H2(g)+O2(g)=2H2O(l)
届高考化学一轮复习方案课件(人教版)第18讲_燃烧热中和热能源盖斯定律

第18讲 │ 考向互动探究
4.依据燃烧热数据,利用公式直接计算反应热 Q=燃烧热×n(可燃物的物质的量) 5.利用盖斯定律计算 应用盖斯定律计算常用以下两种方法: (1)热化学方程式相加或相减,如由 C(s)+O2(g)===CO2(g) ΔH1; C(s)+12O2(g)===CO(g) ΔH2; 可得:CO(g)+12O2(g)===CO2(g) ΔH=ΔH1-ΔH2
第18讲 │ 考向互动探究
[易错解惑] (1)表示燃烧热的热化学方程式,要注意:①可燃 物的物质的量必须是 1 mol;②生成稳定的氧化物:H→H2O(l)、 C→CO2(g)、S→SO2(g)、P→P2O5(s)等。
(2)表示中和热的热化学方程式,要注意:生成 1 mol 液态水, 强酸和强碱反应的中和热数值恒定为 57.3。
13、He who seize the right moment, is the right man.谁把握机遇,谁就心想事成。2021/9/142021/9/142021/9/142021/9/149/14/2021 •14、谁要是自己还没有发展培养和教育好,他就不能发展培养和教育别人。2021年9月14日星期二2021/9/142021/9/142021/9/14 •15、一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。2021年9月2021/9/142021/9/142021/9/149/14/2021 •16、教学的目的是培养学生自己学习,自己研究,用自己的头脑来想,用自己的眼睛看,用自己的手来做这种精神。2021/9/142021/9/14September 14, 2021 •17、儿童是中心,教育的措施便围绕他们而组织起来。2021/9/142021/9/142021/9/142021/9/14
反应热

【学案】燃烧热 中和热 盖斯定律考点三 两类重要反应热——燃烧热、中和热1.燃烧热(1)概念:在101 kPa 时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
燃烧热的单位一般用kJ·mol -1表示。
燃烧热的限定词有恒压(101 kPa 时)、可燃物的物质的量(1 mol)、完全燃烧、稳定的氧化物等,其中的“完全燃烧”,是指物质中下列元素完全转变成对应的氧化物:C→CO 2(g),H→H 2O(l),S→SO 2(g)等。
(2)表示的意义:例如C 的燃烧热为393.5 kJ·mol -1,表示在101 kPa 时,1 mol C 完全燃烧放出393.5 kJ 的热量。
(3)书写热化学方程式:燃烧热是以1 mol 物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以燃烧1 mol 物质为标准来配平其余物质的化学计量数。
例如:C 8H 18(l)+252O 2(g)===8CO 2(g)+9H 2O(l) ΔH =-5 518 kJ·mol -1,即C 8H 18的燃烧热为5 518 kJ·mol -1。
(4)燃烧热的计算:可燃物完全燃烧放出的热量的计算方法为Q 放=n (可燃物)×ΔH式中:Q 放为可燃物燃烧反应放出的热量;n 为可燃物的物质的量;ΔH 为可燃物的燃烧热。
2.中和热(1)概念:在稀溶液中,强酸跟强碱发生中和反应生成1 mol 液态H 2O 时的反应热叫中和热。
(2)注意几个限定词:①稀溶液;②产物是1 mol 液态H 2O ;③用离子方程式可表示为OH -(aq)+H +(aq)===H 2O(l) ΔH =-57.3 kJ·mol -1。
(3)中和热的测定①测定原理ΔH = m 酸+m 碱 ·c · t 终-t 始 nc =4.18 J·g -1·℃-1=4.18×10-3 kJ·g -1·℃-1;n 为生成H 2O 的物质的量。
高考化学盖斯定律及其在热化学方程式中的应用

盖斯定律及其在热化学方程式中的应用一:盖斯定律要点1840年,瑞士化学家盖斯(G 。
H 。
Hess,1802—1850)通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
例如:可以通过两种途径来完成。
如上图表:已知:H 2(g )+21O 2(g )= H 2O (g );△H 1=-241.8kJ/mol H 2O (g )=H 2O (l );△H 2=-44.0kJ/mol根据盖斯定律,则△ H=△H 1+△H 2=-241.8kJ/mol+(-44.0kJ/mol )=-285.8kJ/mol盖斯定律表明反应热效应取决于体系变化的始终态而与过程无关。
因此,热化学方程式之间可以进行代数变换等数学处理。
该定律使用时应注意: 热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
二:盖斯定律在热化学方程式计算中的应用 盖斯定律的应用价值在于可以根据已准确测定的反应热来求知实验难测或根本无法测定的反应热,可以利用已知的反应热计算未知的反应热。
,它在热化学方程式中的主要应用在于求未知反应的反应热,物质蒸发时所需能量的计算 ,不完全燃烧时损失热量的计算,判断热化学方程式是否正确,涉及的反应可能是同素异形体的转变,也可能与物质三态变化有关。
其主要考察方向如下:1.已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1、将0.3mol 的气态高能燃料乙硼烷(B 2H 6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ 热量,该反应的热化学方程式为_____________。
又已知:H 2O (g )=H 2O (l );△H 2=-44.0kJ/mol ,则11.2L (标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ 。
高考化学一轮复习 第19讲 燃烧热 中和热 能源 盖斯定律精品 新人教版

物理状态的稳定,如C燃烧需生成气体二氧化碳,Na燃烧生成固 态过氧化钠,S燃烧生成稳定的氧化物指生成气态SO2而不是SO3, 氢气燃烧生成液态的水等。
(2)书写表示燃烧热的热化学方程式时,可燃物的化学计量 数一定是1。
2.对燃烧热、中和热、能源等概 念的考查。该考点往往会以新信息 为载体进行判断性的考查,试题以 选择题为主,难度较小。
精品课件
第19讲 │ 要点探究
要点探究
► 探究点一 燃烧热 中和热 能源 【知识梳理】 1.燃烧热与中和热的比较
相 能量变化
同
点
ΔH
燃烧热 放热反应
中和热
ΔH<0,单位常用kJ·mol-1
精品课件
第19讲 │要点探究
强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
分别向1 L 0.5 mol·L-1的NaOH溶液中加入:①稀醋酸
②浓H2SO4 ③稀硝酸,恰好完全反应的ΔH的绝对值分别
为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
精品课件
第19讲 │要点探究
②量取反应物并且测定其_初__始_____温度。 ③混合反应物并且测定反应的_最__高_____温度。 ④平行试验。 重复实验__两____次,取测量所得数据的__平__均____值作为计算 依据。 ⑤根据实验数据计算中和热。 (2)为了使获得的实验数据尽可能地准确,在实验过程中采 取的措施: ①酸和碱溶液的物质的量浓度尽可能准确。 ②所需酸和碱的浓度不宜太大,如可以都采用0.5 mol·L-1。 ③为使中和反应充分进行,应该使酸或者碱稍__过__量___。
燃烧热中和热盖斯定律(与“物质”有关文档共7张)

在101kPa时,1mol物质完全燃烧生成
其反应热是相同的。 (1)燃烧的物质必须为:1mol
若用弱酸代替强酸,或用弱 碱代替强碱,因中和过程中弱电解质电离吸热,会使测得的中和热的数值偏低。 不管化学反应是分一步完成或分几步完成,其反应热是相同的。 可能是1mol,也可能是0. △ H= -57.
①×2 + ②×4 - ③
ΔH=ΔH1×2 +ΔH2×4 -ΔH3
=-283.2 kJ/mol ×2 -285.8 kJ/mol ×4 +1370 kJ/mol
=-339.6 kJ/mol
第7页,共7页。
第6页,共7页。
方程式合并拆分要求
同向加,异向减,调整系数
已知 ① CO(g)+1/2O2(g)=CO2(g) ΔH1= -283.2 kJ/mol
② H2(g)+1/2O2(g)=H2O(l) ΔH2= -285.8 kJ/mol ③C2H5OH(l)+ 3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370 kJ/mol 试计算 2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH
比较项目
燃烧热
中和热
能量变化 放热反应 (3)区分燃烧热和燃烧放出的热量
相 【一般考虑强酸或强酸酸式盐与强碱中和】
稳定的物质(通常是氧化物)时所放出的热量,叫做该物质的燃烧热
同 (1)燃烧的物质必须为:1mol
点 △H △ H= -57.
(3)区分燃烧热和燃烧放出的热量
△H<0 单位:kJ/mol
△ H= -57.
①条件: 稀溶液
②反应物:酸与碱 【一般考虑强酸或强酸酸式盐与强碱中和】
第18讲 燃烧热 中和热 能源

ΔH=-393.5 kJ· -1 mol
则 4Fe(s)+3O2(g)===2Fe2O3(s)
-1 641.0 kJ· mol-1
第18讲 │ 考向互动探究
[解题技巧] 利用盖斯定律进行计算时,无论是“相加”还是 “相减”,都以将无关物质“消去”为基本目的。
第18讲 │ 考向互动探究
变式题 1 [2011· 海南化学卷] 已知:2Zn(s)+O2(g)===2ZnO(s) - ΔH=-701.0 kJ· mol 1 2Hg(l)+O2(g)===2HgO(s) ΔH=-181.6 kJ· -1 mol 则反应 Zn(s)+HgO(s)===ZnO(s)+Hg(l)的 ΔH 为( C ) A.+519.4 kJ· -1 mol B.+259.7 kJ· -1 mol - - C.-259.7 kJ· mol 1 D.-519.4 kJ· mol 1
燃烧热
中和热
能源
第18讲 │ 考向互动探究
2.中和热 (1)定义:在稀溶液中,酸和碱发生中和反应生成 1 mol _________水时的反应热。 (2)举例: 稀的盐酸与稀的 NaOH 溶液发生中和反应生 成 1 mol H2O 水时, 放出 57.3 kJ 的热量, 该反应的热化学 HCl(aq)+NaOH(aq)===H2O(l)+NaCl(aq) 方程式为_______________________________________ Δ H=-57.3 kJ·mol-1 ________________________。
+
第18讲 │ 考向互动探究
4.依据燃烧热数据,利用公式直接计算反应热 Q=燃烧热×n(可燃物的物质的量) 5.利用盖斯定律计算 应用盖斯定律计算常用以下两种方法: (1)热化学方程式相加或相减,如由 C(s)+O2(g)===CO2(g) ΔH1; 1 C(s)+ O2(g)===CO(g) ΔH2; 2 1 可得:CO(g)+ O2(g)===CO2(g) 2ΔH=ΔH1-ΔH2来自第18讲 │ 考向互动探究
盖斯定律优质课人教课件

② H2(g)+1/2O2(g) = H2O (l) △H2
2.盖斯定律的应用
① H2(g)+1/2O2(g) = H2O (g)
2.盖斯定律的应用
2.盖斯定律的应用
如何得到C(s) + 1/2O2(g) = CO(g)的反应热?
(4)CH3COOH (aq) + NaOH (aq) =
B
氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:H2(g)+1/2O2(g)=H2O(l); △H=-285.8kJ/molCO(g)+1/2O2(g)=CO2(g); △H=-283.0kJ/molC8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l); △H=-5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l); △H=-890.3kJ/mol相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时放出热量最少的是( ) A. H2(g) B. CO(g) C. C8H18(l) D. CH4(g)
A
盖斯定律的灵活应用
3.已知胆矾溶于水时溶液温度降低,A盖斯定律的灵活应用
已知H+ (aq) + OH- (aq) = H2O (l) ; △H=-57.3 kJ/mol 现有下列反应(1)H2SO4 (aq) + 2NaOH (aq) = Na2SO4 (aq) + H2O (l) ;(2)H2SO4 (aq) + 2BaOH (aq) = BaSO4(s)+ H2O (l) ;(3)HCl (aq) + NH3·H2O (aq) = NH4Cl (aq) + H2O (l) ;
燃好热与盖斯定律

第二节燃烧热能源【学习目标】:1.知识与技能:理解燃烧热的概念,认识能源是人类生存和发展的重要基础,了解化学在解决能源危机中的重要作用。
【重点、难点】:燃烧热的概念【学习过程】:【温习旧知】·回忆反应热、焓变的知识,解答:1、如右图所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。
试回答下列问题:Array (1)实验中观察到的现象是___________________。
(2)产生上述现象的原因是______。
(3)写出有关反应的离子方程式:____________ _。
(4)由实验推知,MgCl2溶液和H2的总能量______(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
【学习新知】一、燃烧热阅读教材,找出燃烧热的概念,并把它填写在下面的空格中。
1、定义:注意:(1)条件:(2)燃烧的物质一定为mol(3)生成的物质一定要稳定a、状态要稳定;b、要完全燃烧(生成物不能再燃烧)。
一般指:C -- CO2 (g)N2– NO2 (g)S – SO2 (g)H– H2O(l)2.表示的意义:如: CH4的燃烧热为890.3KJ/mol.含义:3.表示燃烧热的热化学方程式的书写:应以mol物质的标准来配平其余物质的化学计量数(常出现分数)4.一定量可燃物完全燃烧时放出的热量Q放=n(可燃物)×△H1、选择燃料的标准是什么?2、煤作为燃料的利弊?提高煤燃烧效率的措施有哪些?【随堂练习】1、已知:2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH=-571.6 kJ/molH2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH=-241.8 kJ/mol求氢气的燃烧热。
2、石墨与金刚石的燃烧热是否相同,为什么?3.下列各组物质的燃烧热相等的是:()A.碳和一氧化碳B.1moL碳和2moL碳C.1moL乙炔和2moL碳D.淀粉和纤维素二、能源阅读课文,讨论下列问题:1.能源就是能提供的自然资源,包括等。
第18讲燃烧热中和热能源盖斯定律课件

第18讲
16
第18讲
► 探究考向二 盖斯定律及反应热的计算 【知识梳理】
相同 终态
始态和
17
第18讲
【要点深化】
18
第18讲19Fra bibliotek18讲20
第18讲
• 【特别提醒】
21
第18讲
• 【典例精析】
22
第18讲
23
第18讲
24
第18讲
[答案] C
25
第18讲
26
第18讲
[答案] B
•
17、儿童是中心,教育的措施便围 绕他们 而组织 起来。 7:46:28下午7:46下午 19:46:2810月-23
谢谢观赏
You made my day!
我们,还在路上 … … 33
27
第18讲
28
第18讲 备用习题
【备用理由】本题考查了盖斯定律的应用,作为2010的高 考题未选用作为例题或变式题。
29
第18讲
[答案] A
30
第18讲
【备用理由】本题较好地考查了中和热的有关知识,但题 目较为陈旧,故未作为例题给出。
[答案] D
31
第18讲
32
•
9、要学生做的事,教职员躬亲共做 ;要学 生学的 知识, 教职员 躬亲共 学;要 学生守 的规则 ,教职 员躬亲 共守。 10月- 2310月- 23Monday, October 2, 2023
•
15、一年之计,莫如树谷;十年之 计,莫 如树木 ;终身 之计, 莫如树 人。十 月 237:46下午10月-2319:46October 2, 2023
•
16、提出一个问题往往比解决一个 更重要 。因为 解决问 题也许 仅是一 个数学 上或实 验上的 技能而 已,而 提出新 的问题 ,却需 要有创 造性的 想像力 ,而且 标志着 科学的 真正进 步。2023/10/2 19:46:2819:46:2802 October 2023
燃烧热盖斯定律-文档资料PPT文档23页

▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!
23
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
燃烧热盖斯定律-文档资料
1、合法而稳定的权力在使用得当时很 少遇到 抵抗。 ——塞 ·约翰 逊 2、权力会使人渐渐失去温厚善良的美 德。— —伯克
3、最大限度地行使权力总是令人反感 ;权力 不易确 定之处 始终存 在着危 险。— —塞·约翰逊 4、权力会奴化一切。——塔西佗
5、虽然权力是一头固执的熊,可是金 子可以 拉着它 的鼻子 走。— —莎士 比
《燃烧热盖斯定律》PPT课件

CO(g)
H1
H2
C(s)
H3 CO2(g)
△H1 = △H3 -△H2
C(s)+O2(g)==CO2(g)
△H3=-393.5
-)
kJ/mol CO(g)+1/2O2(g)==CO2(g)
△H2=-283.0
Ck(Js/)m+1o/l 2O2(g)==CO(g) △H1=?
△H1 = △H3 - △H2 = -393.5 kJ/mol -(-283.0
1molH2O时所释放的热量。△H=57.3kJ/mol 3、假设某一化学反响可分为多步进展,那么其 总反响热为各步反响的反响热之和。
即△H= △H1+ △H2+ △H3+……
4、假设多步化学反响相加可得到新的化学反响, 那么新反响的反响热即为上述多步反响的反响热之 和。
பைடு நூலகம்
那么
C Zn(s)+ HgO(s) = Hg(l)+ ZnO(s),△H值为 〔〕
A、△H2-△H1
B、△H2+△H1
C、△H1-△H2
D、-△H1-△H2
小结:
1、燃烧热:在101 kPa时,1 mol 纯物质完 全燃烧生成稳定的氧化物时所放出的热量,叫 做该物质的燃烧热。 2、中和热:稀强酸与稀强碱发生中和反响生成
kJ/mol) = -110.5 kJ/mol
例:某次发射火箭,用N2H4〔肼〕在NO2中燃烧, 生成N2和水蒸气。
2 N2H4+ 2NO2== 3N2+4H2O
:① N2(g)+2O2(g)==2NO2(g)△H1=+67.7kJ/m ol
②N2H4(g)+O2(g)==N2(g)+2H2O(g) △H2=-534kJ/mol
燃烧热
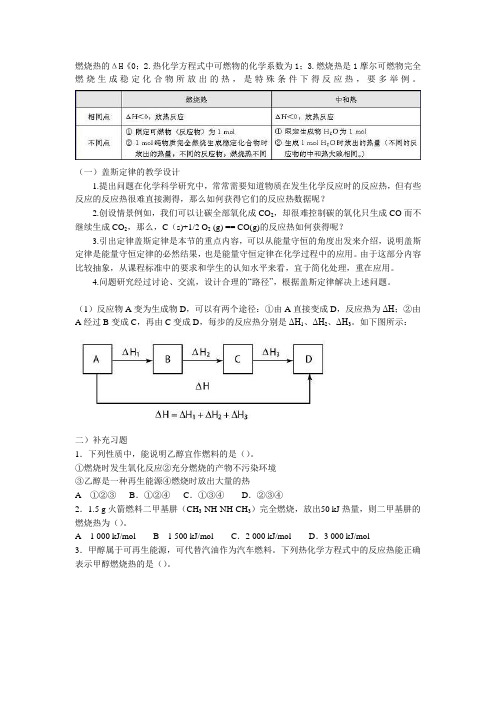
燃烧热的ΔH《0;2.热化学方程式中可燃物的化学系数为1;3.燃烧热是1摩尔可燃物完全燃烧生成稳定化合物所放出的热,是特殊条件下得反应热,要多举例。
(一)盖斯定律的教学设计1.提出问题在化学科学研究中,常常需要知道物质在发生化学反应时的反应热,但有些反应的反应热很难直接测得,那么如何获得它们的反应热数据呢?2.创设情景例如,我们可以让碳全部氧化成CO2,却很难控制碳的氧化只生成CO而不继续生成CO2,那么,C(s)+1/2 O2 (g) == CO(g)的反应热如何获得呢?3.引出定律盖斯定律是本节的重点内容,可以从能量守恒的角度出发来介绍,说明盖斯定律是能量守恒定律的必然结果,也是能量守恒定律在化学过程中的应用。
由于这部分内容比较抽象,从课程标准中的要求和学生的认知水平来看,宜于简化处理,重在应用。
4.问题研究经过讨论、交流,设计合理的“路径”,根据盖斯定律解决上述问题。
(1)反应物A变为生成物D,可以有两个途径:①由A直接变成D,反应热为ΔH;②由A 经过B变成C,再由C变成D,每步的反应热分别是ΔH1、ΔH2、ΔH3。
如下图所示:二)补充习题1.下列性质中,能说明乙醇宜作燃料的是()。
①燃烧时发生氧化反应②充分燃烧的产物不污染环境③乙醇是一种再生能源④燃烧时放出大量的热A ①②③B.①②④C.①③④D.②③④2.1.5 g火箭燃料二甲基肼(CH3-NH-NH-CH3)完全燃烧,放出50 kJ热量,则二甲基肼的燃烧热为()。
A 1 000 kJ/molB 1 500 kJ/mol C.2 000 kJ/mol D.3 000 kJ/mol3.甲醇属于可再生能源,可代替汽油作为汽车燃料。
下列热化学方程式中的反应热能正确表示甲醇燃烧热的是()。
4.家用液化气中主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量5×105kJ。
试写出丁烷燃烧的热化学方程式。
5.为减少大气污染,一些城市公共汽车逐步使用CNG(压缩天然气)清洁燃料,实验测得0.16 g该气体燃料,完全燃烧生成224 mL CO2(标准状况)和0.36 g液态水,并放出8.903 kJ 的热量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
的热化学方程式为______________
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l) △H=-1366.2kJ/mol
5.在同温同压下,下列各组热化学方程式中a>b的一组是
A.CH4 (g)+2O2(g)═CO2 (g)+2H2O(l)△H=a kJmo B.2H2(g)+O2(g)═2H2O(g)△H=a kJmol-1
氢气
H2(g)
-285.8
-283.0 -890.31
乙炔
乙醇 丙烷
C2H2(g)
-1299.6
一氧化碳 CO(g) 甲烷 CH4(g)
C2H5OH(l) -1366.8 C3H8(g) -2219.9
甲醇
CH3OH(l) -726.51
苯
C6H6(l)
-3267.5
分别写出石墨和金刚石燃烧的热化学方程式。
S(s)+O2(g)═SO2(g)△H=b kJmol-1
试写出白磷转化为红磷的热化学方程式 P (s 、 白磷)=4 P(s、红磷); H = -29.2 kJ/mol 4 _________________________________。
3、实验中不能直接测出由石墨和氢气反应生成甲烷的
反应热,但可通过测出 CH4 、石墨及 H2 燃烧反应的反
应热,再求由石墨生成甲烷的反应热。已知:
可知碳的燃烧热为110.5 kJ· mol—1
C.反应热的大小与反应物所具有的能量和生成物所具 有的能量无关 D.l molNaOH分别和l molCH3COOH、1molHNO3反应 放出的热量:CH3COOH<HNO3
4.已知1g乙醇(C2H5OH)完全燃烧生成CO2气体
和液态水时,放出29.7kJ的热量,写出乙醇燃烧热
C(石墨,s)+ O2(g)= CO2(g) ΔH= -393.5 kJ/mol
C(金刚石,s)+ O2(g)= CO2(g)ΔH= -395.0 kJ/mol
1、能否根据式子
1/2CH4(g)+O2 (g) =1/2CO2 (g) +H2O(l) ΔH=-445.15kJ/mol
认为甲烷的燃烧热是445.15kJ/mol?
如:C CO2(g)、H H2O(l)、S SO2(g)
文字叙述燃烧热时,用“正值”或“ ΔH” 表示。 例如,CH4的燃烧热为890.31 kJ/mol或ΔH= -890.31 kJ/mol。
一些物质燃烧热
名称 石墨 金刚石 化学式 C(s) C(s) ΔH/kJ· mol-1 名称 -393.5 -395.0 乙烷 乙烯 化学式 C2H6(g) C2H4(g) ΔH/kJ· mol-1 -1559.8 -1411.0
3、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖 的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、 890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程 式正确的是(D) A.C(s)+O2(g)=CO(g);△H=-393.5 kJ/mol B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol C.CH4g)+2O2(g)=CO2(g)+2H2O(g); △H=-890.3 kJ/mol D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l); △H=-1 400 kJ/mol
H2(g)+1/2O2(g)==H2O(l) △H=△H1+△H2=-285.8kJ/mol
CO(g) H1 C(s) H3 H2
CO2(g)
已知CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0kJ/mol C(s)+O2(g)=CO2(g) ΔH3=-393.5kJ/mol 求算C(s)+1/2O2(g)=CO(g) ΔH1=?
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=b kJmol
C
H2(g)+ 1/2O2(g)═H2O(g)△H=b kJmol-1
C.C(s)+ O2 (g)═CO(g)△H=a kJmol-1
C(s)+O2(g)═CO2(g)△H=b kJmol-1
D.S(g)+O2(g)═SO2 (g)△H=a kJmol-1
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH1=-890.3 kJ· mol-1 ②C(石墨)+O2(g)=CO2(g)ΔH2=-393.5 kJ· mol-1
1 ③H2(g)+2
O2(g)=H2O(l)
ΔH3=-285.8 kJ· mol-1
求:④C(石墨)+2H2(g)=CH4(g)
燃烧热与中和热的比较 燃烧热 相 同 点 能量变化 ΔH及其单 位 反应物的量 放热反应 ΔH<0,kJ·mol-1 1 mol 中和热 放热反应 ΔH<0,kJ·mol-
1
不一定为1 mol
生成物的量
不 同 点 反应热 的含义
不一定为1 mol
101 kPa时,1 mol 纯物质完全燃烧生 成稳定的化合物时 所放出的热量
C2H2(g)+5/2O2(g)==2CO2(g)+H2O(l) ΔH=-1300 kJ/mol
2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=-2600 kJ/mol
3、下列关于反应热的表述正确的是
D
A.当△H<0时,表示该反应为吸热反应
B.由C(s)+0.5O2(g)= CO(g)的反应热为110.5kJ· mol—1,
不管化学反应是分一步完成或分几步 完成,其反应热是相同的。 化学反应的反应热只与反应体系的始 态和终态有关,而与反应的途径无关。
1、某次发射火箭,用N2H4(肼)在NO2中燃烧,生
成N2、液态H2O。已知: N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol 写出发射火箭反应的热化学方程式。
ΔH4=______________
-74.8 kJ· mol-1
应用盖斯定律计算反应热时应注意的事项 1.热化学方程式中物质的化学计量数同乘以某 一个数时,反应热数值也必须乘上该数。 2.热化学方程式相加减时,同种物质之间可相 加减,反应热也随之相加减。
3 .将一个热化学方程式颠倒时, ΔH 的“+”、
2、已知: 2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH= - 571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH= - 241.8 kJ/mol
求氢气的燃烧热。
答:ΔH=-285.8 kJ/mol
由于计算燃烧热时,可燃物质是以1 mol 作为标准来计 算的,所以热化学方程式的化学计量系数常出现分数。
1 mol
在稀溶液里,酸 与碱发生中和反 应生成1 mol水时 所释放的热量
第三节
化学反应热的计算
下列数据△H1表示燃烧热吗?
H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/mol
H2的燃烧热△H究竟是多少?如何计算?
已知:
H2O(g)==H2O(l)
△H2=-44kJ/mol
Zn(s)+
ΔH3的值是( ) A.-441.8 kJ· mol-1 C.-438.9 kJ· mol-1
D
B.-254.6 kJ· mol-1 D.-260.4 kJ· mol-1
2、若2.6 g 乙炔(C2H2,气态)完全燃烧生成 液态水和CO2(g)时放热130 kJ。则乙炔燃烧 的热化学方程式为
第二节 燃烧热
一、燃烧热
什么是燃烧热?是不是物质燃烧放出的 热量就叫燃烧热呢? 1、 在101 kPa时,1 mol 物质完全燃 烧生成稳定的氧化物时所放出的热量,
叫做该物质的燃烧热。燃烧热通常可由
实验测得。
在理解物质燃烧热的定义时,要注意以下几点: ①研究条件:101 kPa ②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1 mol
“-”号必须随之nO(s) ΔH1=-351.1 kJ· mol-1 2 Hg(l)+ 1 O2(g)=HgO(s) ΔH2=-90.7 kJ· mol-1 2 由此可知 Zn(s) + HgO(s) = ZnO(s) + Hg(l) Δ H 3 ,其中
2 N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) △H=-1135.2kJ/mol
2、已知: H1 = -2983.2 kJ/mol P4(s、白磷)+5O2(g)=P4O10(s);
P(s、红磷)+5/4O2(g)=1/4P4O10(s); H2 = -738.5 kJ/mol
