大学本科有机化学37 胺-1 PPT课件
有机化学课件-16胺

NH2 (CH3CO)2O
NHCOCH3 HNO3
H2SO4
NHCOCH3 △ (1)H3O+ (2)OH-
NH2
NO2
NO2
五、磺酰化:
即磺酰氯的胺解,常用的磺酰氯是对甲苯磺酰氯(TSCl),又 称为Hinsberg(兴斯堡)试剂;
RNH2
通式为: R2NH
R3N
O p-CH3C6H4-S Cl
O CH3 C
Cl
CH3CONHR CH3CONR2
HCl-H2O
R3N
R3N
CH3CONHR 油相 CH3CONR2 水相 (R3NH+Cl-)
油相
NaOH
△
油相
RNH2
H2O
R2NH
水相 NaOH 油相 (R3N)
H2O
(2)保护氨基避免副反应,对于芳香胺,可使亲电反应活性降低, 避免多取代;
例:
NH2
2-甲基-4-氨基戊烷
CH3CH2CHCH3
N(CH2CH3)2
2-二乙氨基丁烷
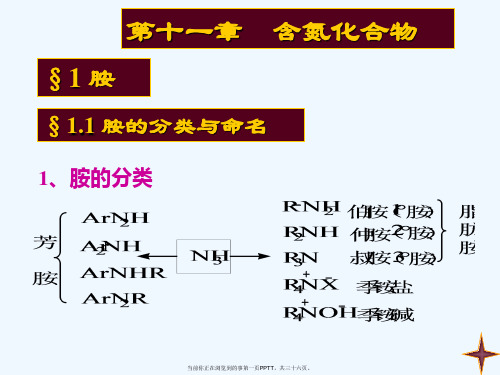
(三)季铵盐及季铵碱: 类似无机物NH4X或NH4OH的命名
(CH3)4N+Cl- C6H5CH2N+(C2H5)3Cl- (CH3)2N+(C2H5)2OH-
氯化四甲基铵 氯化三乙基苄基铵 氢氧化二甲基二乙基铵
注意:氨、胺及铵在命名时用法不同;
R'' R NH+X-
R NH + HX R' R''
R N + HX
R'
R'
R'
R'' R N + R'''X
大学化学《有机化学-胺》课件

E1cb
(单分子共 轭碱消除)
H CC
L
B: - HB
CC L
LC=C
碳负离子很不稳定。 按这种机制进行的 情况很少。
-OH
H1
H2
CH3CH2-C3H-C2H-C1 H2 +N(CH3)3
四 级 铵 碱 的 E2 消 除(符合霍夫曼规则,动 力学控制的产物。 )
B:
H1
H2
CH3CH2-C3H-C2H-C1 H2
碱
CH3CH2CH2CH2CH=CH2 Hofmann烯烃
L的变化规律 L
I
吸 电 子 能 力 增 强
离 去 能 力 减 弱
Br Cl F
Hofmann烯烃的含量
CH3O-/CH3OH
t-BuO-/t-BuOH
19.3
69.0
27.6
80.0
33.3
87.6
69.9
97.4
+NMe3
96.2
98
L吸电子能力增强,试剂的碱性增强,试剂的体积 增大时, Hofmann烯烃的含量也增大。
铵 (+)酸(-)胺 盐 (-) 酸(-)胺
HCl HCl
有机酸(+) 有机酸(-)
非对映体利用溶解度 等物理性质上的差别 予以分离。
17.4.3 四级铵盐及其相转移催化作用
1 四级铵盐
(1)四级铵盐的制备:由三级胺和卤代烃反应制备。
C6H5CH2Cl + (C2H5)3N
C6H5CH2N+(C2H5)3Cl四级铵盐
10.5 % ~7 %
霍夫曼产物
eg 5.
H3C
+ N(CH3)3
本科五年制 基础 有机化学第12章 胺
N
N
N
N
OH
ONa
无偶联 能力
② 酚或胺:
OH
OH -
偶联慢
NH 2
H+
O-
偶联快
NH 3+
H+ OH-
能偶联
不能偶联
偶联的条件为:低温、弱酸或弱碱。
思考题
重氮盐稳定存在的条件是什么?为什么? 为什么重氮盐被羟基取代要强酸条件,而偶 联反应要弱酸、弱碱?
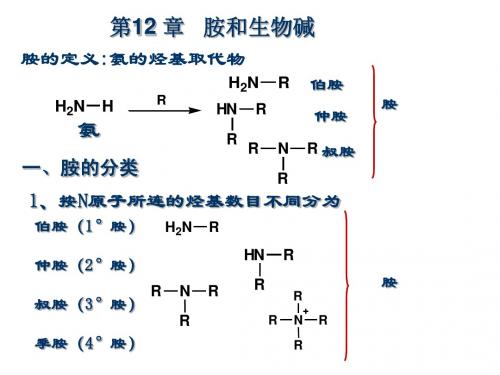
生物碱 (Alkaloid) 一、生物碱的概念及临床应用
胺
脂肪胺 芳香胺 R-NH2 Ar-NH2
3、根据分子中氨基的数目分类
胺 一元胺 多元胺
CH3CH2NH2 H2NCH2CH2NH2
注:芳香胺为N原子 直接连在芳香环上 的胺,如果不是直 接连在芳香环上, 即使有芳香环也不 属于芳香胺。
4、季铵盐和季铵碱
氢氧化铵或铵盐分子中四个氢原子完全被烃基取代而 成的化合物分别称为季铵碱或季铵盐。
MDMA
2-(2-氯苯基)-2-(甲氨基)环己酮 氯胺酮(K粉)
苯丙胺为中枢神经兴奋剂, 是国家严格管制的精神类药品。 甲基苯丙胺俗称“冰毒”, 属于联合国规定的苯丙胺类毒品。 MDMA 属于致幻剂类毒品,是“摇头丸”的主要成分。 氯胺酮俗称K粉。临床上用作麻醉剂或麻醉诱导剂, 有精神 依赖性,其致幻作用是导致被滥用的主要原因。
R R' N H OH2 "R
R R' H OH 2 H OH 2
< <
N
<
H OH 2 R N H OH 2 H OH 2
H OH2 H2O H N H OH2 H OH2
大学有机化学总ppt课件

03 胺的化学性质
包括碱性、亲核性、还原性、 氧化性以及酰化反应等。
0 胺的制备方法 4可通过氨或胺的烷基化、酰胺
还原、腈的还原以及含氮化合 物的重排等方法制备。
重氮和偶氮化合物
重氮化合物的结构和性质 重氮化合物含有重氮基团,具有不稳 定性,易放出氮气。
偶氮化合物的结构和性质
偶氮化合物含有偶氮基团,具有颜色, 并可用于染料和指示剂等。
医药领域中的有机化学知识应用举例
药物合成
有机化学在药物合成中发挥着重 要作用,许多药物都是通过有机
合成方法制备得到的。
药物分析
药物分析中的许多方法都涉及到 有机化学知识,如色谱法、光谱 法等,这些方法可以用于药物的
定性和定量分析。
药物代谢
药物在体内的代谢过程也涉及到 有机化学知识,如药物的吸收、来自分布、代谢和排泄等。07
有机化学在日常生活中的应用
食品中的有机化学知识应用举例
食品添加剂
许多食品添加剂都是有机化合物, 如防腐剂、色素、香料等,它们 能够改善食品的色、香、味和保 质期。
营养强化剂
维生素、矿物质等营养强化剂也常 是有机化合物,添加到食品中可以 提高食品的营养价值。
食品包装材料
食品包装材料中常使用有机高分子 化合物,如聚乙烯、聚丙烯等,它 们具有良好的加工性能和保护性能。
环境问题中的有机化学知识应用举例
1 2 3
大气污染 大气中的许多有机污染物都是有机化合物,如挥 发性有机物、多环芳烃等,它们对环境和人体健 康都有危害。
水体污染 水体中的有机污染物也常是有机化合物,如农药、 染料、酚类等,它们会导致水质恶化并危害水生 生物。
土壤污染 土壤中的有机污染物包括农药、多氯联苯等有机 化合物,它们会在土壤中积累并通过食物链危害 人类健康。
胺和酰胺 PPT课件

例如: O
→ NH2 + H3C—C—Cl
O NH—C—CH3 + HCl
=
=
应用:
• 1、可用于伯、仲胺与叔胺的分离,因为生成的酰胺 容易水解,而叔胺无此反应,
• 2、可用于鉴别伯胺和仲胺,生成的酰胺是中性物质, 均为有固定熔点的晶体,
• 3、降低毒性,可用于药物修饰, 如对氨基苯酚→扑
例如:
乙酰胺
苯甲酰胺
2、取代酰胺
取代酰胺分子中的氮原子上连有烃基,命名是把烃基的 名称写在某酰胺前,并在其名称前面加N—或者N,N—,
例如:
N-甲基乙酰胺
N,N-二甲基乙酰胺
N-甲基-N-乙基苯甲酰胺
N-甲基苯甲酰胺
练习 根据结构写名称。
O ① CH3CH2—C—NH2
O
=
丙酰胺
=
② CH3—C—ONH—CH2CH3 N-乙基乙酰胺
仲胺或叔胺分子中烃基不同时,命名时应先写小基 后写大基的次序规则分别列出各个烃基名称,
① H3C-NH-CH2CH3
甲乙胺
② H3C-N-CH2CH2CH3 CH2CH3
甲乙丙胺
练习 给下列物质命名,
① NH2-CH2CH2CH3 丙胺 ② CH3CH2-NH-CH2CH3 二乙胺 ③ CH3-N-CH3 三甲胺
CH3 ④ CH3-NH-CH2CH2CH3 甲丙胺
二 结构较复杂的胺
结构较复杂的胺, 则把氨基作为取代基, 以烃 为母体, 按系统命名法命名.
练习 给下列物质命名,
CH3NH2 ① CH3 CHCHCH3
2-甲基-3-氨基丁烷
② CH3-CH-CH2-CH2-CH-CH3
CH3
NH2
生化全套ppt胺和生物碱专选课件

盐酸苯胺或苯胺盐酸盐 (aniline hydrochloride)
注意: “氨”用于表示取代基,如氨基酸。 “胺”表示氨的烃基衍生物,如三甲胺 “铵”用于季铵类化合物和胺的离子型化合物。
• 三、胺的结构
氮原子的电子结构为:
↑ ↑↑
E ↑↓ 2P
2S
跃迁
↑
↑ ↑ ↓↑ 杂化
2Px 2Py 2PZ
2S
N
113.9 0
H
N
H H
• 四、胺的物理性质
常温下的状态
甲胺、二甲胺、三甲胺和乙胺为气体,其它胺为液体或固体。
许多胺类有难闻的气味,如三甲胺有鱼腥味、1,4-丁二胺俗 称腐肉胺、1,5-戊二胺俗称尸胺。
沸点(b.p)
与醇相似,伯胺、仲胺可以形成分子间氢键,其沸点高于相 对分子质量相近的非极性化合物(如烷烃),而低于相应的醇或羧 酸(为什么?)。
3-戊胺
H 2 N C H 2 C H 2 C H 2 C H 2 N H 2 1,4-丁二胺
2.N-取代芳香胺(氨基直接连在苯环上)
当氮上同时连有芳基和脂肪烃基时,以芳胺作母体,在脂 肪烃基前加“N”字表示脂肪烃基连在氮原子上。
NH CH3
CH3 N
C2H5
N-甲基苯胺
N-甲基-N-乙基苯胺
3.复杂的胺
电子效应: 3°胺>2°胺>1°胺 空间效应: 1°胺>2°胺>3°胺 溶剂化效应: 1°胺>2°胺>3°胺
RNH HO O 2 2H H >RNHO2H >R RNHO2H HO2H R HO2H R 共 轭 酸 稳 定 性 好 , 酸 性 弱 , 碱 性 强 。
:
:
:
:
:
2. 芳胺
有机化学 第十七章 胺

邻苯二甲酰亚胺氮上的氢受到两个拉电子基团
影响呈现酸性(pKa8. 3),用K0H处理很容易生成相 应的钾盐。
该法除合成伯胺外,还用于合成α-氨基酸(参
阅第二十一章)。
三、硝基化合物还原 通过硝基化合物还原制备胺类是极为重要的方
法,因芳香硝基化合物很容易由芳烃硝化得到,因 此该法主要用于合成芳香伯胺。还原主要有催化氢 化和化学还原两种方式。
二、盖布瑞尔(Gabriel)合成 由卤代烃直接氨解制备伯胺时常会有仲、叔胺
生成,盖布瑞尔[S. Gabriel(1851—1924)出生于 德国,在Berlin大学获博士学位,而后在该校任化 学教授,主要在胺及氨基酸合成方面作出了贡献。] 提供了一个由卤代烃制备纯伯胺的好方法。邻苯二 甲酰亚胺的钾盐与卤代烃发生亲核取代反应,生成 N-取代亚胺后水解或肼解可获得高产率伯胺。
ቤተ መጻሕፍቲ ባይዱ
工业上由油脂水解得到高级脂肪酸(14.4节), 把该酸转化为酰胺,进而脱水生成腈,催化氢化可 得到长链伯胺(参看15. 3节)
2.酰胺还原
酰胺在醚中用LiAlH4处理可把羰基还原为亚甲 基获得较高产率的胺。氮上无取代基的酰胺可得到
伯胺,N-取代酰胺可得到仲、叔胺。
3.肟的还原 醛、酮与羟氨反应生成肟,肟是不饱和含氮化
17.4 胺的化学反应 由于胺中氮上具有孤对电子,使得它能在化学反
应中提供电子,体现了胺的一系列化学性质,如碱性、 亲核反应及氨基致活芳环上的亲电取代反应等。 一、碱性与成盐
1.碱性 按路易斯(Lewis)酸碱概念讲,反应中接受质子 或提供电子对的化合物为碱。由于胺中孤对电子的存 在,能从水中接受质子,故呈碱性。
七、曼尼希(Mannich)反应 具有α氢的酮与甲醛(或其他简单脂肪醛)及
大学本科有机化学37胺

阿尔维德·卡尔森(Arvid Carlsson)1923年出生于瑞典的乌普萨拉,19 51年毕业于瑞典隆德大学,1959年获瑞典哥德堡大学药物学教授头 衔,目前任职哥德堡大学药理学系。卡尔森是自1982年以来首位获得诺贝 尔奖的瑞典科学家。他此次获奖的原因是他发现了多巴胺这种重要的神经 递质。他的研究成果使人们认识到帕金森症和精神分裂症的起因是由于病 人的脑部缺乏多巴胺,并据此可以研制出治疗这种疾病的有效药物。
叔胺 (三级胺)
R3
R1 N R4 X R2
季铵盐 (四级铵盐)
R = 烷基: 脂肪胺 芳基: 芳香胺
胺类化合物的结构
N R
R'
快速翻转
R"
R' R
N
脂肪胺 N 原子一 般为 sp3 杂化
R" 转180o "R
N R
R'
对映关系,但无手性
手性胺或手性季铵盐
手性中心
N N
手性中心
手性中心
R1
N
R4
卡尔森的发现为美国神经科学家保罗·格林加德(Paul Greengard)、 埃里克·坎德尔(Eric Kandel的)工作奠定了基础,他们和卡尔森共同分
享今年的诺贝尔生理或医学奖。通过研究多巴胺释放的神经细胞,保 罗·格林加德揭示了信号通过突触时分子的级联活动,突触是神经细胞间 的联结。而 埃里克·坎德尔的研究表明突触机能的变化对学习和记忆功能 是至关重要的。卡尔森自己承认,诺贝尔奖多年来也影响了他的精神状 况。在得知获得诺贝尔奖不久,卡尔森告诉《科学》杂志说:“我在60 年代就认为我应该获得诺贝尔奖,自从那时开始,我为此忐忑不安了好
3. 胺盐和四级铵化合物的命名:
有机化学下册胺课件

RNH2
NH3
原因: 烷基给电子
H3C N CH3
H3C
NH3
H3CH2C NH
H3CH2C
H3CH2C N CH2CH3
H3CH2C
CH3NH2
NH3
原因: 溶剂影响﹠烷基给电子
23
水溶液中的溶剂效应
H2O H2O
H2O
H HNR
H
氢键数目 三
R'
H2O
HNR
二
H2O
H
R'
H2O
HNR
RNH2 + HCl
RNH3Cl NaOH
RNH2
+ NaCl + H2O
N原子上连有H原子, 加碱后立即发 生质子转移而生成水。季铵盐上的 N原子无H, 故与KOH、NaOH作用 不能释放出游离的胺。
21
2.胺碱性强弱, 用pKb表示
RNH2 + H2O
kb
RNH3 + OH
碱
共轭酸
_
Kb
[R
NH3][O H ] [RNH2 ]
降
引入给电子基,诱导效应使碱性上
升 CF3 N
F3C CF3
F N FF
几乎无碱性
26
5.芳胺
1)碱性比氨弱
N上孤电子与苯环共轭, 电子 分散, 接受质子能力降低。
NH2
脂肪胺
Alkyl amines NH3
N
pKb 3~4
4.76
9.40
13.80
N almost neutral
27
2)取代芳胺
(按顺序规则书写)
10
IUPAC 命名法
有机化学第12章胺

12.3胺的化学性质
12.3.1胺的碱性
(1)产生碱性的原因: N上的孤对电子
(2)判别碱性的方法: pKb的值;或其共轭酸的pKa的值;
以及形成的铵正离子的稳定性
胺类碱性在强弱取决于N上电子云密度的高低和与质子结合能 力的大小以及铵正离子的稳定性。
影响碱性强弱的因素: 诱导效应:胺的氮原子上所连的烷基增多,推电子能力增强,氮 原子上电子密度升高,碱性增强。 空间效应 烷基数目的增加,占据了氮原子外围更多的空间,使 质子难于与氮原子接近。使胺的碱性降低。 共轭效应:芳香胺中氨基氮原子上的未共用电子对与苯环的电子 形成共轭体系,使氮原子上的电子部分地移向苯环,降低了氮原 子上的电子云密度,与质子的结合能力降低,碱性减弱。 溶剂效应:N上取代基多,与H2O形成氢键少,与H+结合形成铵离 子后,溶剂化稳定作用弱,碱性减弱。
12.3.6.1卤化
12.3.6.2硝化
12.3.6.3磺化
12.4季铵盐和氢氧化四烃基铵
12.4.1季铵盐的性质
叔胺与卤代烷或活泼芳卤作用,则得到季铵盐;
季铵盐具有无机铵盐的一般性质:如溶于水,不溶于非极性
有机溶剂,不稳定,加热易分解成原来的叔胺和卤代烃。
具有长碳链的季铵盐是一类阳离子表面活性剂,具有良好的去 污、乳化、杀菌、消毒作用
1010主要内容主要内容胺的结构分类命名胺的结构分类命名胺的物理性质胺的物理性质胺的化学性质烃化酰化亚硝化胺的化学性质烃化酰化亚硝化氧化芳胺环上的亲电取代反应氧化芳胺环上的亲电取代反应胺的制法胺的制法根据胺分子中所含氨基的数目可以有一元二元或多元胺
第10章
胺
主要内容 胺的结构、分类、命名 胺的物理性质 胺的化学性质(烃化、酰化、亚硝化、 氧化、芳胺环上的亲电取代反应) 胺的制法 季铵盐与季铵碱
大学本科有机化学37 胺-1

C O
N H
R
的N类似物
异氰酸酯
H
OH − OH H2N R
+
HN
R
Hofmann 降解的立体化学
O R* C NH2 Br2 / NaOH
* R
NH2
+ CO2
迁移基团的构型保持
问题:请举出几个有类似 问题: 立体化学的重排反应。 立体化学的重排反应。
R*迁移过程 —— 同面迁移 R*迁移过程
O R1 R2 C C R
Ar X NaNH2 Ar NH2 R O2N N R
苯炔机理
O2N
X
R2NH
加成− 加成−消除 机理
三.胺类化合物的性质(I) 胺类化合物的性质(
结构分析
有未共用电子对
• 有碱性 • 有亲核性 • 可被氧化剂氧化
R
N H
H
R
N H
R
R
N R
R
有活泼氢
• 可被强碱夺取 • 可被氧化剂氧化
1. 胺类化合物的碱性
R' NH2 R X 碱 R NH R' +
此方法在合成上的 主要问题是什么? 主要问题是什么?
HX (碱吸收)
醛酮的还原胺化(亚胺的还原) 醛酮的还原胺化(亚胺的还原)
R C R' O NH2 H
+
R"
R C R' N R"
H2 / Ni
R CH R' NH R"
N-取代酰胺的还原
O R C NHR' (2) H2O (1) LiAlH4 RCH2NHR'
3. 脂肪族叔胺的制备
仲胺的烷基化
大学有机化学---胺与酰胺
当前你正在浏览到的事第五页PPTT,共三十六页。
§1.4 胺的化学性质 1、 碱性
胺中的氮原子和氨中一样,有一对未共用电 子对。能接受质子,因此胺具有碱性。
N-甲基乙酰苯胺
邻苯二甲酰亚胺
当前你正在浏览到的事第二十四页PPTT,共三十六页。
§3.2 酰胺的物理性质
室温下,除甲酰胺是液体外,其它酰胺多为无色晶 体。酰胺分子间能形成氢键,由于酰胺分子间氢键缔合 能力较强,因此其熔点、沸点甚至比分子量相近的羧酸 还高。当酰胺中氮原子上的氢被烷基取代后,缔合程度 减小,熔点和沸点则降低。脂肪族N-烷基取代酰胺一般 为液体。
脂肪伯胺
芳香伯胺
重氮盐 氯化重氮苯
当前你正在浏览到的事第十五页PPTT,共三十六页。
反应胺
反应式
脂肪1O胺
NaNO2,HCl
RNH2 0~5OC
+
RN
N Cl-
-N2 R+
得醇、烯、卤代 烃等混合物
脂肪2O胺
NaNO2,HCl
R2NH
SnCl2,HCl
R2N H
R2N N O
脂肪3O胺 R3N+HNO2 [R3NH]+NO2-
+ C H 65 NN Cl 能溶于水,水溶液能导电
当前你正在浏览到的事第十九页PPTT,共三十六页。
3、重氮基被取代的反应 重氮基可被多种基团取代,可发生反应,生成多
种化合物。重氮盐是一个非常活泼的化合物,在有机 合成上非常有用。
当前你正在浏览到的事第二十页PPTT,共三十六页。
《有机化学》PPT课件

《有机化学》PPT课件•有机化学概述•烃类化合物•卤代烃和醇酚醚类化合物•醛酮醌类化合物目录•羧酸及其衍生物•含氮有机化合物•杂环化合物和生物碱01有机化学概述有机化学定义与发展定义研究有机化合物结构、性质、合成、反应机理及应用的科学发展历程从早期经验总结到现代科学理论体系的建立,经历了漫长的发展历程当前研究热点绿色合成、不对称合成、超分子化学等分类方法按碳骨架分类(开链化合物、碳环化合物、杂环化合物)、按官能团分类(烃类、醇类、酚类、醛类、酮类等)特点种类繁多,结构复杂,性质各异重要类别烃类、醇类、酚类、醛类、酮类、羧酸类、胺类等有机化合物特点与分类03发展趋势绿色化学合成方法的研究与应用,有机光电材料的研究与开发等01研究意义揭示有机化合物结构与性质关系,指导有机合成和新材料开发02应用领域医药、农药、染料、涂料、塑料、橡胶等化学工业领域,以及生命科学、环境科学等领域有机化学研究意义及应用领域02烃类化合物碳原子间以单键相连,其余价键被氢原子饱和。
结构特点物理性质化学性质随碳原子数增加,沸点、熔点逐渐升高,密度逐渐增大。
相对稳定,主要发生自由基取代反应,如卤代反应。
030201结构特点含有一个或多个碳碳双键。
物理性质随碳原子数增加,沸点、熔点逐渐升高,但密度比相应烷烃小。
化学性质较为活泼,可发生加成、氧化、聚合等反应。
结构特点含有一个或多个碳碳三键。
物理性质与烯烃相似,但更为活泼。
化学性质容易发生加成反应,也可发生氧化、聚合等反应。
含有苯环或其他芳香体系的烃类化合物。
结构特点具有特殊芳香气味,沸点、熔点较高。
物理性质相对稳定,可发生亲电取代反应,如硝化、磺化等反应。
化学性质芳香烃结构与性质03卤代烃和醇酚醚类化合物卤代烃命名、结构及物理性质命名卤代烃的命名遵循系统命名法,以烃为母体,卤素作为取代基进行命名。
结构卤代烃分子中,卤素原子与烃基通过共价键连接,形成极性分子。
物理性质卤代烃多为无色或淡黄色液体,具有特殊气味。
胺 课 件

胺
胺的酰化反应有许多重要的应用。由于胺类易被酰卤、酸酐酰化 成对氧化剂较稳定的取代酰胺,而取代酰胺在酸或碱催化下加热水解, 又易除去酰基,把氨基游离出来。所以利用胺的酰化反应可以在有机 合成中“保护氨基”。例如:
胺
思考题12-2
完成下列反应式。
胺
(2)磺酰化反应(兴斯堡反应)
与酰基化反应类似,如果用苯磺酰氯、对甲苯磺酰氯等磺 酰化试剂与伯胺和仲胺反应可生成相应的磺酰胺。伯胺的磺酰 胺产物能与碱成盐而溶于氢氧化钠溶液中;仲胺的磺酰胺产物 氮原子上没有氢原子,不溶于氢氧化钠溶液中;叔胺没有此反 应。所以可利用此反应来把三种胺分离或提纯或鉴别伯、仲、 叔胺,此反应称为兴斯堡反应。
胺
1.3 胺的物理性质 1. 状态
低级脂肪胺,如甲胺、二甲胺和三甲胺等,在常温下 是气体,丙胺以上是液体,十二胺以上为固体。芳香胺是 无色高沸点的液体或低熔点的固体。相对分子质量较低的 胺有氨的气味,有的还有鱼腥味。有机胺类大多有毒性, 芳胺的毒性很大。例如,苯胺可以通过吸入、食入或者透 过皮肤吸收而致中毒。
作为取代基来命名。例如:
胺
(3)季铵盐、季铵碱和胺的盐类的命名 季铵盐、季铵碱和胺的盐类的命名类似无机铵类化合物。
例如:
胺
1.2 胺的结构
胺的结构与氨相似,N原子是以不等性sp3杂化成 键的,其构型成三角锥形。苯胺中的氮原子仍为不等 性sp3杂化,由于孤对电子所占据的轨道含有的p轨道 的成分多,所以形成的四面体比脂肪胺扁平一些,HN-H键的键角较大些。例如,苯胺的立体结构如下:
进行亚硝酸化,生成黄色油状或固体的N-亚硝基化合物。
胺
(3)叔胺 脂肪族叔胺与亚硝酸作用生成不稳定的、易水解的盐,
以强碱处理则重新游离出叔胺,在有机合成上没实用价值。
