第四章碱金属原子和电子自旋
原子物理学褚圣麟第四、五章复习

第四章:碱金属原子和电子自旋锂、钠、钾、铷、铯、钫化学性质相仿、都是一价、电离电势都比较小,容易被电离,具有金属的一般性质。
一、碱金属原子的光谱1、四个线系(锂为例):其他碱金属光谱系相仿,只是波长不同主线系:波长范围最广,第一条线是红色的,其余在紫外,系限2299.7埃;第一辅线系(漫线系):在可见部分;第二辅线系(锐线系):第一条线在红外,其余在可见部分;伯格漫线系(基线系):全在红外。
2、巴尔末氢原子光谱规律: ,5,4,3),1-21(1~22===n nR v H λ 碱金属原子光谱:2*∞-~~nR v v n = R 为里德伯常数,当,所以∞v ~是线系限的波数,且有效量子数*n 不是整数,Δ==-*n TR n 3、碱金属原子的光谱项:22*Δ)-(n R n R T == 4、同一线系的有效量子数与主量子数差别不大;与某一量子数对应不同线系的有效量子数差别明显,引进角量子数加以区分:5、每一线系线系限波数恰好是另一线系第二谱项值中最大的那个。
共振线:主线系第一条。
6、碱金属原子氢原子能级的比较n 很大时,碱金属原子能级 很接近氢原子能级;n 较小时,碱金属原子能级 与氢原子能级相差大; 且n 相同,l 不同的能级高低差别很大。
二、原子实极化和轨道贯穿:原子=原子实+价电子1、原子实:碱金属原子中的电子具有规则组合,共同点是在一个完整的结构之外,多余一个电子,这个完整而稳固的结构称为原子实。
由于原子实的存在,发生原子实的极化和轨道在原子实中的贯穿。
2、价电子:原子实外的那个电子称作价电子。
价电子在较大的轨道上运动,与原子实结合不是很强,容易脱离。
它决定元素的化学性质,在较大的轨道上运动。
3、原子实的极化:由于价电子的电场的作用,原子实中带正电的原子核和带负电的电子的中心发生微小相对位移,于是负电的中心不再在原子核上,形成一个电偶极子。
① 角量子数l 小:轨道偏心率大(椭圆),极化强,能量影响大;② 角量子数l 大:轨道偏心率小(接近圆),极化弱,能量影响小。
第四章 电子的自旋

在原子内部,有两种角动量 L 和 S
必然存在一个总角动量以及相 应的磁矩。
s 与s
l 与 l
分别共线,合成后
j ls
l s
三、 总角动量
电子的运动=轨道运动+自旋运动
电子有轨道角动量l,又有自旋角动量s,所以电子的 总角动量是
总自旋角动量: S Si
i e e Li L 总轨道磁矩: l li 2m i 2m i
i
总自旋磁矩:
e e s si S i S m i m i
总角动量: J L S
总磁量子数 m j j, j 1,, j 1, j.共2j1个值
对于单电子s=1/2,所以
1 1 1 l 0, j ; l 0, j l , l 取两个值 2 2 2
例如:当
1 3 l 1 时, j 1 2 2
1 1 j 1 2 2
h h L l (l 1) 2 2 2
h 3 h S s( s 1) 2 2 2
J
h 15 h 3 h j ( j 1) , 2 2 2 2 2
J 2 L2 S 2 2LS cos
J 2 L2 S 2 j ( j 1) l (l 1) s( s 1) cos 2 LS 2 l (l 1) s( s 1)
e L l (l 1) B 2m
外场方向投影:
共
z cos ml B
2l 1 个奇数,但实验结果是偶数。
第四章原子的精细结构:电子的自旋

不加磁场
加磁场经典预言
加磁场实验结果
斯特恩-盖拉赫实验对氢原子的结果 斯特恩盖拉赫实验时空间量子化的最直接的证明,它是第 一次量度原子的基态性质的实验,又是这个实验,进一步开辟 了原子束及分子束实验的新领域。
三、实验问题
1、先看例子(Ag、Zn l 0 )在屏上能看到几束
理论上:( 2l 1 1 )只有一个值
x vt
1 Fz 2 zt t 2m
d O
P
S1 S2
S N
z1
z2
x
D
通真空泵
原子束在经过磁场区(长度D)到达出口处时,已偏离x轴z1 距离,那时与x轴的偏角为:
Fz t dz1 Fz d arctan arctan arctan 2 dx mv mv d
§18 原子中电子轨道运动的磁矩
一、经典表示式
1、磁矩 从经典电磁学知道,一载流线圈有一个磁矩μ ,它可以表示成:
ˆ IS iSen
i
-----电流大小
S
-----载流线圈所围面积
ˆ en -----垂直与该面积的单位矢量,即和导线线圈平面垂直
因 和 S
线圈平面。
子的1/1836,实际核磁子值
因为核磁矩比电子磁矩
小得多,所以原子磁矩主要由电子磁矩组成。玻尔磁子
也可作为原子磁矩的单位。
2、磁相互作用比电相互作用小
4 0 2 e 1 e 2 B ec 2 2me 2 4 0 c me e 1 1 ea1 c c ea1 2 2
它在z方向的分量只有两个:
1 sz 2
1 : 即:自旋量子数在z方向的分量只能取 2
原子物理学4
s
电子的自旋轨道耦合
电子围着原子核做圆周运动, 原子的总磁矩和总角动量都来 源于电子的轨道运动和电子的 自旋。 j l s 总磁矩:
总角动量: P j Pl Ps
价电子
e
Ze
由量子力学可知,Pj也是量子化的, 相应的 总角动量量子数用 j 表示,且有
§4.4 电子自旋同轨道运动的相互作用
电子的自旋
Uhlenbeck and Goudsmit 在1925年提出: 实验依据: (1)史特恩-盖拉赫实验出现偶数分裂的事实 (2)碱金属原子光谱的精细结构
P 电子具有某种方式的自旋; s s ( s 1), s 1 2
相对于外磁场方向,自旋角动量Ps在空间只能取朝上和 P 1 朝下两种取向: s B Psz ms , ms z 自旋磁矩和自旋角动量的关系是:
碱金属原子态的符号:
电子态符号:l 0 ,1, 2 , 3 ,
s, p , d , f ,
比如: n=3时,3s, 3p, 3d
原子态符号:由价电子的诸量子数来描述
L 0 ,1, 2 , 3 , S , P , D , F ,
s 1 2 L l: j ls: ,2 s 1 2 :
2
j
*
j ( j 1) l ( l 1) s ( s 1)
c
j
l
*2
l
*
2
s
*
讨论: (1) n和l相同,s不变,只有j不同,不同的j值具有不同 的能量
l 0 时, j l s l 1 / 2 l 0 时, j l s l 1 / 2,或
原子物理学第4章

价电子的轨道:n ≥ 2
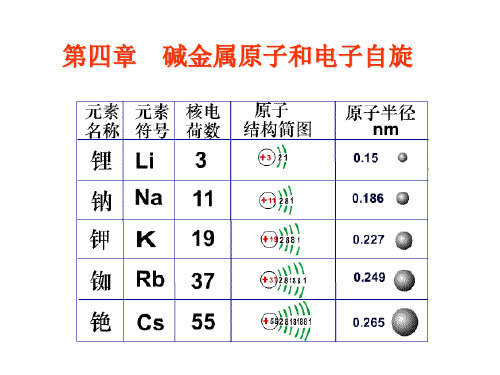
Li: Z=3=212+1 Na:Z=11=2(12+22)+1 K: Z=19=2(12+22+22)+1 Rb:Z=37=2(12+22+32+22)+1 Cs:Z=55=2(12+22+32+32+22)+1 Fr:Z=87=2(12+22+32+42+32+22)+1
3、Na原子的能级与能级跃迁
主线系:从l=1的p态→n=3, l=0的3s态, n=3,4… 锐线(二辅)系:从l=0的s态→n=3, l=1的3p态, n=4,5… 漫线 (一辅)系:从l=2的d态→n=3, l=1的3p态, n=4,5… 基线(柏格曼)系:从l=3的f态→n=3, l=2的3d态, n=4,5,6…
Rhc En 2 (n D l )
-e
●
r Rnl
●
2
2
21
20
n=2
r r1
图4-5、轨道的贯穿
0
4
r Rnl
2
2
32
31
30
n=3
r r1
0 9
l 越小,电子波 函数靠近核的概率 越大,贯穿的几率 越大,能量越低
小结:碱金属原子光谱
1、实验规律:
所有的碱金属原子的光谱,具有相仿的结构,实验观 察的谱线一般分为四个线系。
~D相同而n不同的光谱 和
R R 2、碱金属原子的光谱项: Tnl 2 n (n D l ) 2
• 量子数亏损:D l
nn
碱金属复习要点及答案

第四章 碱金属原子和电子自旋(1)单个f 电子总角动量量子数的可能值为:A. j =3,2,1,0; B .j=±3; C. j= ±7/2 , ± 5/2; D. j= 5/2 ,7/2(2)单个d 电子的总角动量投影的可能值为:A.2 ,3 ;B.3 ,4 ;C. 235, 215; D. 3/2, 5/2 . (4)锂原子光谱由主线系.第一辅线系.第二辅线系及柏格曼系组成.这些谱线系中全部谱线在可见光区只有:A.主线系;B.第一辅线系;C.第二辅线系;D.柏格曼系(5)锂原子主线系的谱线在不考虑精细结构时,其波数公式的正确表达式应为: A.nP S -=2~ν; B. S nP 2~→=ν; C .nP S →=2~ν; D .S nP 2~-=ν (6)碱金属原子的光谱项为:A.T=R/n 2; B .T=Z 2R/n 2; C .T=R/n *2; D. T=RZ *2/n *2(7)锂原子从3P 态向低能态跃迁时,产生多少条被选择定则允许的谱线(不考虑精细结构)?A.一条B.三条C.四条D.六条(8)已知锂原子光谱主线系最长波长为6707埃,辅线系线系限波长为3519埃,则Li 原子的电离电势为:A .5.38V B.1.85V C.3.53V D.9.14V(9)钠原子基项3S 的量子改正数为1.37,试确定该原子的电离电势:A.0.514V;B.1.51V;C.5.12V;D.9.14V(10)碱金属原子能级的双重结构是由于下列哪一项产生:A.相对论效应B.原子实的极化C.价电子的轨道贯穿D.价电子的自旋-轨道相互作用(11)产生钠的两条黄谱线的跃迁是:A.2P 3/2→2S 1/2 , 2P 1/2→2S 1/2;B. 2S 1/2→2P 1/2 , 2S 1/2→2P 3/2;C. 2D 3/2→2P 1/2, 2D 3/2→2P 3/2;D. 2D 3/2→2P 1/2 , 2D 3/2→2P 3/2(12)若已知K 原子共振线双重成分的波长等于7698.98埃和7664.9埃,则该原子4p 能级的裂距为多少eV ?A.7.4×10-2; B .7.4×10-3; C .7.4×10-4; D .7.4×10-5.(13)对锂原子主线系的谱线,考虑精细结构后,其波数公式的正确表达式应为: A.ν~= 22S 1/2-n 2P 1/2 ν~= 22S 1/2-n 2P 3/2 B. ν~= 22S 1/2→n 2P 3/2 ν~= 22S 1/2→n 2P 1/2C. ν~= n 2P 3/2-22S 1/2 ν~= n 2P 1/2-22S 3/2D. ν~= n 2P 3/2→n 2P 3/2 ν~= n 2P 1/2→n 21/2(14)碱金属原子光谱精细结构形成的根本物理原因:A.电子自旋的存在B.观察仪器分辨率的提高C.选择定则的提出D.轨道角动量的量子化(15)已知钠光谱的主线系的第一条谱线由λ1=5890埃和λ2=5896埃的双线组成,则第二辅线系极限的双线间距(以电子伏特为单位):A.0;B.2. 48⨯10-3;C.2.07⨯10-3;D.3.42⨯10-2(16)考虑电子自旋,碱金属原子光谱中每一条谱线分裂成两条且两条线的间隔随波数增加而减少的是什么线系?A.主线系;B.锐线系;C.漫线系;D.基线系(17)如果l 是单电子原子中电子的轨道角动量量子数,则偶极距跃迁选择定则为:A.0=∆l ;B. 0=∆l 或±1;C. 1±=∆l ;D. 1=∆l(18)碱金属原子的价电子处于n =3, l =1的状态,其精细结构的状态符号应为:A .32S 1/2.32S 3/2; B.3P 1/2.3P 3/2; C .32P 1/2.32P 3/2; D .32D 3/2.32D 5/2(19)下列哪种原子状态在碱金属原子中是不存在的:A .12S 1/2; B. 22S 1/2; C .32P 1/2; D. 32D 5/2(20)对碱金属原子的精细结构12S 1/2 12P 1/2, 32D 5/2, 42F 5/2,22D 3/2这些状态中实际存在的是:A.12S 1/2,32D 5/2,42F 5/2;B.12S 1/2 ,12P 1/2, 42F 5/2;C.12P 1/2,32D 5/2,22D 3/2;D.32D 5/2, 42F 5/2,32D 3/2(21)氢原子光谱形成的精细结构(不考虑蓝姆移动)是由于:A.自旋-轨道耦合B.相对论修正和极化贯穿C.自旋-轨道耦合和相对论修正D.极化.贯穿.自旋-轨道耦合和相对论修正(22)对氢原子考虑精细结构之后,其赖曼系一般结构的每一条谱线应分裂为:A.二条B.三条C.五条D.不分裂(23)考虑精细结构,不考虑蓝姆位移,氢光谱Hα线应具有:A.双线B.三线C.五线D.七线(24)氢原子巴尔末系的谱线,计及精细结构以后,每一条谱线都分裂为:A.五条B.六条C.七条D.八条(25)已知锂原子主线系最长波长为λ1=6707.4埃,第二辅线系的线系限波长为λ∞=3519埃,则锂原子的第一激发电势和电离电势依次为(已知R =1.09729⨯107m -1)A.0.85eV, 5.38eV;B.1.85V , 5.38V;C.0.85V , 5.38VD.13.85eV, 5.38eV 提示:P S 2211-=λ P 21=∞λh c T E -=(26)钠原子由nS 跃迁到3P 态和由nD 跃迁到3P 态产生的谱线分别属于:A.第一辅线系和基线系B.柏格曼系和锐线系C.主线系和第一辅线系D.第二辅线系和漫线系(27)d 电子的总角动量取值可能为: A. 215,235; B . 23,215; C. 235,263; D. 2,63.简答题(1)碱金属原子能级与轨道角量子数有关的原因是什么?造成碱金属原子精细能级的原因是什么?为什么S 态不分裂, ,,,,G F D P 态分裂为两层?(2)造成氢原子精细能级和光谱的原因是什么?4.计算题(1)锂原子的基态光谱项值T 2S =43484cm -1,若已知直接跃迁3P →3S 产生波长为3233埃的谱线.试问当被激发原子由3P 态到2S 态时还会产生哪些谱线?求出这些谱线的波长(R=10972⨯10-3埃-1) 提示:22)3()3(1P R s R ∆--∆-=λ 22)2(s R T s ∆-= 两方程中解得:p s ∆∆,后各问题便可解。
第四章 碱金属原子和电子自旋 小结

§4.5 单电子辐射跃迁的选择定则
从观察到的碱金属原子的光谱,可以得出这样一个结论, 发出辐射或吸收辐射的跃迁只能在下列条件下发生:
1; j0,1.
主量子数n的改变不受限制,可见产生辐射的跃迁是有选 择性的。上述选择定则是经验的总结,在量子力学中有理论的 推导。
§4.8 氢原子光谱的精细结构与L位移
条谱线即Hα线, 其强度分布如图,
这说明氢原子存在
Ⅰ1
精细结构。
Ⅰ3
Ⅰ2
Ⅱ3
频
Ⅱ2
率
0.328
3
2D
R 2
n3l(l 1)
33
R 2
2(2 1)
0.036 cm1
强度
2
2P
R 2
n3l(l 1)
33
R 2
1(1 1)
0.364 cm1
(0.364 0.036)cm1 0.328cm1
Ⅰ1
18459 A
4-3 K原子共振线波长为7665Å,主线系的系限波长为 2585Å 。已知K原子的基态4S。试求4S、4P谱项的量 子数修正项值(量子数亏损)△ s、△p各为多少? 解:
附:反常电子磁矩
g
s
sZ (以B为单位)
SZ (以为单位)
2.0023193048
20.0000000004
02
4-1 已知Li原子光谱主线系最长波长λ=6707Å,辅线系系限 波长λ=3519Å 。求锂原子第一激发电势和电离电势。 解:
主线系最长波长是电子从第一激发态向基态跃迁产生 的。辅线系系限波长是电子从无穷处向第一激发态跃迁产 生的。设第一激发电势为V1,电离电势为V∞,则有:
量子数亏损 有效电荷数
原子物理第四章

3)与 s 对应的磁矩,由 r L 式知, 轨道磁矩 l 与轨道角动量 L 之间的对应 关系是
e l L 2m
(3)
back
next
目录
结束
与此相类比, s 与相应的
s 之间也应有
(4)
相应的对应关系,这个对应关系是
e s S m
S s(s 1)
(1)
next 目录 结束
其中S 称为自旋量子数
back
2)
有2l +1个空间取向,则 s 也应该有 2s+1个空间取向
L
S z ms h
ms s, s 1,…-s (2)
实验表明,对于电子来说
1 s 2
1 1 ms , 2 2
即
s
有两个空间取向。
hv E Em En
1 1 Rhc (4) ' 2 2 (n l ) (m l )
back next 目录 结束
所以碱金属光谱的波数为
~
1 1 v R ' 2 2 (n l ) (m l )
nL mL
'
back
(5)
next
目录
结束
第三节、碱金属原子光谱的精细结构
• 一、光谱的精细结构 • 1、概念 • 2、光谱的精细结构的特点 • 二、光谱的精细结构和能量的联系 • 三、结论
第四节:电子的自旋同轨道运动的相互作用
史特恩-盖拉赫实验中出现偶数分裂的事实 启示人们,电子的轨道运动似乎不是全部的 运动。换句话说,
碱金属原子与电子自旋

碱金属原子的光谱碱金属原子的光谱有相仿的结构,一般观察到的线系有四种,主线系,第一辅线系(慢线系),第二辅线系(锐线系),伯格曼线系(基线系)。
特点;主线系第一条线为红色的,其余在紫外。
第一辅线系在可见光部分。
第二辅线系第一条线在红外,其余在可见光部分。
伯格曼线系全在红外。
碱金属光谱可用氢原子光谱相仿的公式表示,但是通过实验得出光谱中有效量子数不是整数,而是比相应的整数小,可用n-△表示。
有效量子数等于里德伯常数除光谱项后开方。
通过实验可得;主线系是p能级向s能级跃迁,第二辅线系是s 能级向p能级跃迁,第一辅线系是d能级向p能级跃迁,伯格慢线系是f能级向d能级跃迁。
光谱项表达式(把原来的n用n-△表示)能级图原子实的极化和轨道的贯穿通过对碱金属的研究,可以认为光谱是由原子最外面的电子产生的,内部电子及原子核构成正一价的原子实,与氢原子核相仿。
由于原子实有一定的空间结构易发生原子实的极化和电子在原子实内贯穿。
原子实的极化;原子实有Z个正电荷,Z-1个负电荷构成原子核在圆心的正一价的原子实。
由于原子实外负电子的作用,使得原子核负电子构成的球心不重合,产生一个电偶极子,使电子能量降低。
轨道的贯穿;电子在运动过程中有一段时间穿入原子实,使得电子绕动时内部电荷大于一,有公式光谱项与z方乘正比。
Z大于一,除到分母上使n变小。
碱金属原子光谱的精细结构通过对碱金属原子光谱的观察,可知;主线系的第一条谱线中的线间隔与第二辅线系的谱线中线间隔相等,主线系的谱线内线间隔随波数增加而减小,第二辅线系的谱线内线间隔不变,第一辅线系谱线内有三条线。
结论;s能级为单层,p,d,f为双层结构。
相同量子数n,随l 增大双层间距减小;相同l,随量子数n增大双层间距减小。
电子自旋同轨道运动的相互作用电子自旋与能级的分裂;乌楞贝克和古德史密斯提出电子有某种方式的自旋,自旋角动量为h/2π的一半,轨道定下来了,轨道角动量就是定值,轨道量子数L是取定值,角动量向有2L+1个取向,电子的自旋角动量的取向是不定的,自旋角动量的取向影响能量,观察能级是双层的,那么自旋角动量的取向为二,2s+1=2 ,s=1/2。
原子物理学 第四章 碱金属原子和电子自旋

的原子态,多重度:2
n 3 2 S1/ 2 表示: 3, 0, j 1/ 2 的原子态,多重度:2
32 D5 / 2
32 D3 / 2
Li原子能级图(考虑精细结构)
4.5 单电子辐射跃迁选择定则
1、选择定则
单电子辐射跃迁(吸收或发射光子)只能在下列条件下
发生:
l 1 j 0, 1
R hc (n l ) 2
n, 能级,即给定 En,l
但
Es 仍与 j 有关。
能量E由
n, l , j 三个量子数决定。
3、碱金属原子能级的分裂
1 时, j 能级不分裂 2 1 Rhc 2 Z *4 j El , s 1 2 3 2n (l )(l 1) 2 当 0 时, Rhc 2 Z *4 1 El , s j 1 2 2n3l (l ) 2
4.4 电子自旋与轨道运动的相互作用
一、电子自旋
1、电子自旋概念的提出
为了说明碱金属原子光谱的双线结构,和解释斯特恩-革拉赫 实验结果,两位不到25岁的荷兰大学生乌仑贝克和古兹米特 大胆地提出电子的自旋运动的假设。
“你们还年轻,有些荒唐没关系”(导师埃 按照这一假设,电子除轨道运动外,还存在一种自旋运动, 伦菲斯特)
和自旋运动相联系还存在自旋角动量。
2、电子自旋角动量量子数
1 s 2
3 电子自旋角动量大小 S s( s 1) 2
3、电子自旋角动量空间取向量子化
1 sz ms 2 1 1 ms s, s 1,......, s , 2 2 ms :自旋磁量子数
* * 0 q r 0 Z e (r m ) 0 Z e B 3 3 3 4 r 4 m r 4 m r e 0 Z *e 0 Z * e 2 s El , s s B S 2 3 3 4 m r m 4 mr
第四章 碱金属原子(答案)

第四章 碱金属原子一、选择题1、单个d 电子的总角动量可能值为:A 、2,3;B 、3,4;C 、5/2,7/2;D 、3/2,5/2。
2、已知一个价电子的l=1, S=1/2,试由m j =m i +m s 求j 值:A 、3/2,1/2,1/2;B 、3/2,1/2,-1/2,-3/2;C 、3/2,1/2;D 、0。
3、碱金属德锂原子光谱由主线系、第一辅线系、第二辅线系及柏格曼系组成,这些谱线系中全部谱线在可见光区域德只有:A 、主线系;B 、第一辅线系;C 、第二辅线系;D 、柏格曼系。
4、锂原子主线系的谱线,在不考虑精细结构时,其波数公式的正确表达式应为: A 、nP S v →=2~; B 、S nP v 2~→=; C 、nP S v→=2~; D 、nS nP v →=~。
5、碱金属原子的光谱项为:A 、2nR T =; B 、22n R Z T =; C 、2*nR T =; D 、2*2n R Z T =。
6、Li 原子从3P 态向基态跃迁时,产生多少条被选择定则允许的谱线(不考虑精细结构)A 、1条;B 、3条;C 、4条;D 、6条。
7、碱金属原子一般结构其能级和能级之间跃迁的选择定则由下列量子数决定:A 、1,0),,(±=∆=l l n R E 0;B 、1),,,(±=∆=l m l n R E ;C 、1),,(±=∆=l l n R E ;D 、1,0,1),,(±=∆±=∆=m l m l RE 。
8、碱金属原子一般结构的能级与氢原子能级相比其特点是:A 、对应一个主量子数n 有n 个能级,且每个能级数值均小于相同n 的氢原子能级数值;B 、对应一个主量子数n 仍为一个能级,但数值在相同n 的氢原子能级之下;C 、对应一个主量子数n ,其能级要由n,l 决定,其能级数值大于相同n 的氢原子能级;D 、对应一个主量子数n 仍为一个能级,但数值在相同n 的氢原子能级之上。
第四章习题

1 670 . 7
1
)
1
5 . 37 eV
351 . 9 nm
电离电势:5.37V.
8
第4章 碱金属原子和电子自旋
4.2 Na原子的基态3S。已知其共振线波长为5893Ǻ,漫线系第一条的波 长为8193Ǻ,基线系第一条的波长为18459Ǻ,主线系的系限波长为 2413Ǻ。试求3S、3P、3D、4F各谱项的项值。
1 ~ v 2P
2S
1 6707
1 3519
E hv h
c
hc
第一激发能: E
1
1240 eV nm 670 . 7 nm
1 . 85 eV
第一激发电势:1.85V.
E hc T
电离能: E
hc 2 P 1240 eV nm (
3P 3S 2P
不考虑精细结 构时,跃迁选 择定则: △l=±1
共四条谱线
2S
3
第4章 碱金属原子和电子自旋
4.5 为什么谱项S项的精细结构总是单层结构?试直接从碱金属光谱 双线的规律和从电子自旋与轨道相互作用的物理概念两方面分别说 明之。
主线系
~ 2 S nP
第二辅线系 ~ P nS
1 2
j l s , l s 1, l s 2, , l s | l |
1 2
,l
1 2
12
第4章 碱金属原子和电子自旋
4.7 原子光谱中得知其3D项的项值T3D=1.2274×106米-1,试计算该谱项之精 细结构裂距。
解、精细结构裂距(双层能级间隔用波数表示)
碱金属原子与电子自旋

p
主线系
s
§4.2 原子实的极化和轨道贯穿
锂、钠、钾、铷、铯、钫
3、11、19、37、55、87
2
都是1价,易电离
3=2×(1 )=1 2 2 11=2×(1 +2 )+1 2 2 2 19=2×(1 +2 +2 )+1 2 2 2 2 37=2×(1 +2 +3 +2 )+1 2 2 2 2 2 55=2×(1 +2 +3 +3 +2 )+1 2 2 2 2 2 2 87=2×(1 +2 +3 +4 +3 +2 )+1
— — — —
4f 4d 4p 4s
l 2 — 3d n 3, l 1 — 3p l 0 — 3s
(第二)
(第一) (主)
l 1 — 2p n 2,
l 0 — 2s
再介绍一个概念—共振线。 由第一激发态向基态跃迁时产生的谱线叫做共振线。
f
伯格曼线系
s
第二辅线系
d
第一辅线系
由原子中大部分电子组成的一个完整而稳定的结构叫做原子实
原子实之外的电子叫做价电子 价电子特别重要,它决定着原子的性质和光谱
价电子既可以在能量低的小轨道上运动, 也可以在能量高的大轨道上运动,在低能量的 轨道上吸收能量跃迁到较高能量的轨道,在高 能量的轨道上以电磁辐射的形式放出能量跃迁 到较低能量的轨道。
R 第二辅线系 s n s , n 3,, 45 2 (n s) R 第一辅线系 d n d , n 3, 4 2 (n d)
R 伯格曼线系 f n f , n 4, 5 2 (n f )
原子物理学 课件-第四章 碱金属原子和电子自旋

原子物理学
证:设是机械自旋 电子半径: 电荷: 磁矩:
安束2(焦/特)
(超过光速)
因此,电子自旋不是机械自旋
(电子自旋,其实一点也没有“自旋”的意义。最好称呼它 为“内禀角动量”,它是微观粒子内部属性,与运动状态毫 无关系。它的性质与角动量类似,但不能用任何经典语言 描述。在经典物理中,找不到对立物)。
原子物理学
二、由光谱精细结构推断碱金属原子能级(以锂为例)
1、二辅系: 的跃迁,由于双线间隔相 等,设想 能级不分裂,单层,p能级分裂,双层。 末态p能级:各能级共 同有关,双线间隔为 2p能级分裂间隔。
2、主线系: 的跃迁,双线间隔随 增 大而减小,p能级分裂间隔随 增大而逐渐减小
原子物理学
原子物理学
(2)自旋取向的意义:
原子实坐标
电子坐标 一个顺着磁场 一个逆着磁场
电子自旋取向:
原子物理学
二、从轨道,自旋角动量的耦合 看能级双分裂
角动量耦合:已知
求:总角动量
原子物理学
1、玻尔理论
与
夹角0,
2、量子力学
从上式可看出,
与
不能平行或反平行
原子物理学
三个终端 主 Ⅰ Ⅱ 柏
光谱项: 若测得T, 则可算得
每一线系限波数 恰为另一线系动 项中最大的一个
原子物理学
对于锂, 表4.1给出, (三)两个量子数 仿效氢光谱:
碱光谱:
即碱原子能量与两个量子数
碱金属原子能级图。
有关.
(1)对同一个主量子数 ,有几个能级 (2)能级按 分类, 相同属同一例
1925年,荷兰:两位大学生,库仑贝克,古兹密特 一)电子自旋假设: 1、每个电子都具有固有的自旋角动量
第四章碱金属原子光谱

dE q( E l cos ) dz
dz
)
z
qE
q
合力
dE dE Fz q l cos pz dz dz
pz p cos :
p 在外场方向的投影
2.磁矩:
(1)均匀磁场中: 方向与 i 方向满足右手螺旋关系
iA
M B F 0
~ T3S TnP 主 线 系: ~ 第一辅线系: T T
3P nd
,n = 3, 4… ,n =3,4,5… ,n =4,5… , n =4,5…
~ T3P TnS 第二辅线系: ~ T T
柏格曼系:
3d nf
§4.1.3能量和能级
R (n l ) 2 R En ,l hc 2 (n l )
e p n B 2m
z cos n cos
2 n 1 个奇数,但实验结果是偶数。
存在问题:
A、按玻尔理论,理论上预言应分为2n+1束,即 奇数束 实验上是两束,为偶数。
B、按量子力学处理 基态,
l (l 1) B ,
l 0,1,2,
dB dB Fz cos z dz dz
1.实验证明了原子的空间量子化。 两条细痕 两个 两个 两个
2.玻尔-索末菲理论与实验比较
轨道角动量:
外场方向投影: 轨道磁矩: 外场方向投影:
h p n 2
h p n 2
n 1,2,3, n
n 0,1,2,, n
z
面积:
i
一个周期扫过的面积:
A dA 0
T
1 2 1 T 2 1 T L dt dt r 0 mr 2m 0 Ldt 2m T 2 2m
原子物理学第四章

→
μ = −γ L
→
→
(4)
r 磁矩在外磁场 B 中将受到力矩的作用, 力矩将使得磁 r r 矩 μ 绕外磁场 B 旋进。我们将这种旋进称为拉莫尔进
动。相应的频率称为拉莫尔频率ν l 。下面我们来计算 这个频率。
由电磁学知道,在均匀外磁场中,磁矩不受力,但 受到一个力矩:
r τ = μ×B r r
引入自旋量子数后,原子的量子态需要由 n、L、S、 J 来表示: 2 S +1 J
n
L
氢原子基态为 S1/2 ,因此 L = 0,J = 1/2,S = 1/2
2
m j = ±1 / 2 3 1 0−3/4 gj = − ( )=2 2 2 3/4 m j g j = ±1
斯特恩-盖拉赫实验的解释
3 μ s = − s( s + 1) μ B = − μB 2 1 μ s , z = − ms μ B = m μ B 2
但上述表示与实验不符,为了与实验吻合,自旋磁矩 公式必须写为:
μ s = −2 s( s + 1) μ B = − 3μ B μ s , z = −2 m s μ B = m μ B
r r r r μ j = μl cos( l , j ) + μ s cos( s , j )
电子的自旋轨道耦合
r 电子绕核运动时,既有轨道角动量 L ,又有 r r 自旋角动量 S, 这时电子状态和总角动量 J 有关。 r r r J = L+S 这一角动量的合成,叫自旋轨道耦合。
由量子力学可知,J 也是量子化的, 相应的 总角动量量子数用 j 表示,且有 J = j ( j + 1) h r r l = 0 时, J = S,j = s = 1 / 2; l ≠ 0 时,j =rl +rs = l + 1 / 2,或 j = l − s = l − 1 / 2 r r
《原子物理学》(褚圣麟)第四章-碱金属原子和电子自旋要点58页PPT

11、用道德的示范来造就一个人,显然比用法律来约束他更有价值。—— 希腊
12、法律是无私的,对谁都一视同仁。在每件事上,她都不徇私情。—— 托马斯
13、公正的法律限制不了好的自由,因为好人不会去做法律不允许的事 情。——弗劳德
14、法律是为了保护无辜而制定的。——爱略特 15、像房子一样,法
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
R (n p )
2
2
,n = 2, 3, 4… ,n =3,4,5…
(2 p )
R (2 p )
R (n s )
R
2
(n d )
2
,n =3,4,5… , n =4,5,6…
1
柏格曼系:
R (3 d )
E ns E np E nd E nf E n
当电子远离原子实运动,价电子好象处在一个单位正电荷 的库仑场中运动,与氢原子模型完全相似,所以光谱和能 级与氢原子相同。
3、轨道贯穿 当 很小时,价电子的轨道扁, 价电子可能穿过原子实 轨 道贯穿。 实外 Z*=1 贯穿 Z* > 1 平均:Z* > 1 光谱项:
l 1 , j 0 , 1
对Li: n 2 P1 / 2 2 2 S 1 / 2
n P3 / 2 2 S 1 / 2
2 2
n 2, 3, 4 ...
对Na: n 2 P1 / 2 3 2 S 1 / 2
2
4.3 碱金属原子光谱的精细结构 1.碱金属光谱的精细结构实验事实 原子中电子和原子核的库仑作用导致了原子内 部的粗线条结构。用高分辨光谱仪观察发现,主 线系和锐线系都是双线结构,漫线系和基线系都 是三线结构。 例如钠的黄色光谱线,就是它的主线系的第一条线, 是由波长为5890Å和5896Å的两条分线构成。
................
碱金属原子的状态,可由描述价电子状态的量子数描述。
2 s 1
碱金属原子态符号:
n
Lj
n : 价电子的主量子数
示 0,1, 2, 3, 4...
n
2 s 1
Lj
L : 价电子的轨道角动量,用大写 S , P , D , F , G ... 表
j :电子的总角动量。
E l ,s
3
R h c Z
2
*4
j ( j 1) l ( l 1) s ( s 1) 2
n l (l
1 2
)( l 1)
原子的总能量 (不包括相对论修正):
E n j E n ,l E l , s
E l , s :能级的精细结构
E n , l hc
对 l 0, j l
在无外场情况下, j 守恒, 大小、方向不变, 和 s 绕 j 进动,且保持夹角不变。
1928年,Dirac从量 子力学的基本方程出 发,很自然地导出了 电子自旋的性质,为 这个假设提供了理论 依据。
二、自旋-- 轨道运动相互作用能
1、磁性物体在磁场中运动的附加能量
R h c Z
2 3
*4
n l ( l 1)
l 0 时, j s ,能级不分裂;
当
l 0 时,j l
, 能级分裂为双层。
2.能级分裂的间隔由 n l 决定 当 n 一定时,l 大, E 小,即
E4 p E4d E4 f
当
n l 一定时, 大, E 小,即
价电子如被激发到能量高状态上,则从能量高状态向下跃迁 时将发射光谱。
非贯穿轨道
贯穿轨道
价电子的轨道运动
2. 原子实极化
价电子在轨道近日点附近时, 吸引原子实中的正电部分,排 斥负电部分 原子实正、负电 荷的中心不再重合 原子实极 化 能量降低
l 小 , 轨道“扁”,近日点离原子实近,
极化强,能量低
R (n l )
2
对一给定 n , 能级,即给定 E n , l
但 E s 仍与 j 有关。
能量E由
n , l , j 三个量子数决定。
3、碱金属原子能级的分裂 当 0 时, j
1 2
能级不分裂
1 2
E l ,s R h c Z
2 *4
j
当 0
时,
的原子态,多重度:2
的原子态,多重度:2
2
3 D5 / 2
3 D3 / 2
2
Li原子能级图(考虑精细结构)
4.5 单电子辐射跃迁选择定则
1、选择定则
单电子辐射跃迁(吸收或发射光子)只能在下列条件下
发生:
l 1 j 0, 1
2、碱金属光谱的解释
2P 1/2
主线系
2P 3/2
2S 1/2
第四章 碱金属原子和电子自旋
4.1 碱金属原子光谱的实验规律
碱金属原子:Li,Na,K,Rb,Cs,Fr,一价元素
1.线系
碱金属原子光谱具有原子光谱的一般规律性;各种碱金属原 子的光谱,具有类似的结构。通常可观察到四个谱线系。
主线系;
第二辅线系(又称锐线系);
第一辅线系(又称漫线系);
柏格曼系(又称基线系)。
2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p ...
1s 2 s
2 2
2
1
2 6 1 2 6 1
Na:Z=11 基态电子排布: K: Z=19 基态电子排布:
1s 2 s 2 p 3 s
2 6
1s 2 s 2 p 3 s 3 p 4 s
共同之处:最外层有一个容易脱掉的电子价电子 其余电子和核形成一个紧固的团体原子实 碱金属原子:带一个正电荷的原子实 + 一个价电子 ( H原子:带一个正电荷的原子核+一个电子 )
0Z e
*
2 3
8 m r
2
s
详见:史斌星《量 子物理》附录
1 的处理: 量子力学方法:按几率分布所得 ☆ 的平均值 1 代替。 3 r 3
r
对碱金属原子,
1 r
3
Z
3
3 3
n ( 1 / 2 ) ( 1) a 0
☆ s 的处理:
j s
4、电子自旋磁矩 s
e
s e 2me l )
me (电子轨道运动磁矩:
5、单电子总角动量
j s
相 应 量 子 数 记 为 j: j=+s,+s-1,....-s
对于单电子s=1/2,所以:
对 l 0, j
1 2
; 1 2 ,l 1 2
碱金属原子三个线系的精细结构示意图
2.实验结果的分析推论
光谱线的任何分裂都是能级分裂的结果。
能级为什么会 发生精细分裂呢?
以Li原子为例。
二辅系:2P-nS
主线系:2S-nP
一辅系:2P-nD
推论:碱金属原子s 能级是单层的,而p,d,f 能级都是双 层的,对同一 值,双层能级间隔随量子数n增大而减小。
*
m
r
3
0Z e
*
4 m r
3
* 2 * 0Z e e 0Z e s s B S 2 3 3 4 m r m 4 m r
变换回以核为静止的坐标系,并考虑两坐标系变换的相对 论(时间差)效应后,再乘以因子 1 得:
2
E l , s
f =3
柏 格 曼 系
H
7 6 5 4 3
30000
2
2
40000
厘米-1
2 锂原子能级图
锂的四个线系
主
线
系:
第二辅线系: 第一辅线系: 柏格曼系:
钠的四个线系
2S nP ~ P nS
~ 2P nD
~
,n = 2, 3, 4… ,n =3,4,5… ,n =3,4,5… , n =4,5,6…
j 1 2
2 n (l
3
1 2
)( l 1)
2 *4
E l ,s
R h c Z 2 n l (l
3
1 2
)
能级分裂为双层, 间隔:
E R h c Z
2 3 *4
n l ( l 1)
l0
讨论:
1.能级由
当
n j l 三个量子数决定, Fra bibliotekE 1 2
~ 3D nF
主
线
系:
~ 3 S nP
~ 3P nS
~ 3P nD
,n = 3, 4… ,n =4,5… ,n =3,4… , n =4,5…
第二辅线系:
第一辅线系:
柏格曼系:
~ 3D nF
4.2 原子实的极化和轨道贯穿
1、价电子与原子实 1 s Li:Z=3 基态电子排布:
p = 0.05 f =0.000 p=0.86 f =0.000
碱金属原子的能级: (
E n , l hc
R (n l )
R n
2
2
氢原子:E n h c
)
4.能级图
0 10000 20000 5 4 3
s
=0 5 4 3
p =1 5 4 3
d =2 5 4
E B
2、自旋-轨道相互作 用能 电子的自旋运动和 轨道运动之间通过 磁相互作用。 在电子为静止的 坐标系上,原子 实(Z*e)绕电子 旋转,并产生磁 场B,并与自旋磁 矩作用。
0 B 4
E l ,s
q r r
3
0
4
Z e ( r m )
4.量子力学定量处理
远离原子实运动 靠近原子实运动 解薛定谔方程得能量和光谱项
V(r)
