物质的量浓度配制涂
简述配制物质的量浓度溶液的操作步骤

简述配制物质的量浓度溶液的操作步骤一、实验前准备在进行配制物质的量浓度溶液之前,需要进行实验前准备工作。
首先,需要准备好所需的实验器材和试剂。
其中,实验器材包括容量瓶、量筒、滴定管、磁力搅拌器等,试剂则是要配制的溶液所需的物质,需要保证试剂的纯度和质量。
二、确定溶液的量浓度在配制溶液之前,需要确定所需溶液的量浓度。
量浓度是指单位体积中所含溶质的质量或物质的物质量与溶液体积之比。
根据实验需要和目的,确定所需溶液的量浓度,可以根据实验手册、实验要求或实验设计进行确定。
三、计算所需物质的质量或物质量在确定了溶液的量浓度之后,需要计算所需物质的质量或物质量。
可以根据所需溶液的体积和量浓度,利用相应的计算公式来计算所需物质的质量或物质量。
在计算过程中,需要注意单位的转换和计算的准确性。
四、称取所需物质在计算出所需物质的质量或物质量之后,需要准确地称取所需物质。
使用天平或称量器具,将所需物质准确地称取到容器中。
在称取过程中,需要注意称量器具的准确性和操作的精细度,以确保所需物质的准确称取。
五、加入溶剂并溶解在称取所需物质之后,需要加入适量的溶剂,并进行溶解。
溶剂可以根据实验需要和所需物质的性质来选择,常用的溶剂有水、酒精、乙醚等。
将所需物质加入容器中,然后使用搅拌器或摇床进行充分的搅拌或摇动,使物质充分溶解。
六、调整溶液的体积在溶解物质后,可能需要调整溶液的体积。
可以根据实验需要和所需溶液的体积,使用容量瓶或量筒等器具进行体积的调整。
根据实验要求,将溶液的体积调整到所需的体积,并确保调整后的体积准确无误。
七、混匀溶液在调整溶液体积之后,需要进行混匀溶液。
使用搅拌器或摇床等器具,对溶液进行充分的搅拌或摇动,使溶液中的物质均匀分布。
在混匀溶液的过程中,需要注意搅拌或摇动的速度和时间,以确保溶液的均匀性和稳定性。
八、检查溶液质量和量浓度在配制物质的量浓度溶液之后,需要检查溶液的质量和量浓度。
可以使用检测仪器或试剂进行检测,确保溶液的质量和量浓度达到实验要求。
配制物质的量浓度溶液的操作步骤

配制物质的量浓度溶液的操作步骤在化学实验中,我们经常需要配制不同浓度的溶液。
配制物质的量浓度溶液是一种常见的操作,下面将介绍一种基本的操作步骤。
1.准备所需的试剂和仪器在开始配制溶液之前,首先要准备好所需的试剂和仪器。
试剂通常是以粉末或固体形式保存的,所以需要准确称取所需的质量。
仪器方面,常见的有天平、容量瓶、移液管等。
2.计算所需试剂的质量根据要配制的浓度和体积,我们需要计算所需试剂的质量。
通常可以使用以下公式来计算:质量(g)= 浓度(mol/L)× 体积(L)× 摩尔质量(g/mol)3.称取试剂根据计算所得的质量,使用天平准确称取所需的试剂。
为了保证称取的准确性,可以使用称量纸或称量瓶来避免试剂的散失。
4.溶解试剂将称取好的试剂倒入容量瓶中,并加入一定量的溶剂(通常是去离子水或其他适用的溶剂)。
然后用移液管或瓶口滴管轻轻摇匀,使试剂完全溶解。
5.调整溶液体积根据所需体积,可以使用移液管或容量瓶来调整溶液的体积。
在调整体积时,要注意准确读取液面位置,并小心避免溶液的溢出。
6.混合溶液在配制浓度溶液时,有时需要将多个溶液混合在一起。
此时,可以使用移液管或瓶口滴管将各个溶液逐渐加入到一个容器中,并轻轻摇匀,直至完全混合。
7.检查溶液配制好溶液后,应该对其进行检查。
可以使用PH试纸或其他适用的检测方法来测量溶液的PH值或其他性质。
如果溶液不符合要求,可以进行调整或重新配制。
8.标记和储存溶液配制好的溶液应该标记清晰,包括溶液的浓度、配制日期以及配制人员等信息。
此外,还应该将溶液储存在适当的容器中,并根据需要进行保存,以免溶液的质量受到影响。
以上就是配制物质的量浓度溶液的基本操作步骤。
在实际操作过程中,还应该注意安全规范,避免化学品的直接接触或误食等意外情况的发生。
同时,根据具体实验需求,还可以根据需要进行操作步骤的调整和优化。
希望这些步骤对于配制溶液的操作有所帮助。
实验四——一定物质的量浓度溶液的配置

实验改进建议
提高称量精度
01
采用更高精度的天平进行称量,可以降低称量误差,提高溶液
的配制精度。
精确控制溶液体积
02
使用精确的移液器或滴定管进行溶液体积的测量和控制,比传
统的量筒更精确。
改进混合和搅拌操作
03
采用磁力搅拌器或者更高效的搅拌方式,可以确保溶质在溶剂
中充分且均匀溶解。
未来研究方向和应用前景
溶液配置的目的和应用领域
目的
通过配置一定物质的量浓度的溶液,可以满足特定实验或生 产过程中的需求,保证实验结果的准确性和可比较性,提高 生产效率和产品质量。
应用领域
化学研究、医学实验、环保检测、工业生产等。例如,医学 实验中可能需要配置一定浓度的药物溶液来研究药物疗效和 毒性;工业生产中需要配置一定浓度的原料溶液来控制生产 工艺和产品质量。
一定物质的量浓度溶液 的配置
目录
• 引言 • 实验材料与方法 • 实验结果与分析 • 实验讨论与改进 • 实验总结与附录
引言
01
溶液浓度的定义与重要性
定义
溶液浓度是指溶液中溶质的量与溶剂的量之比,常用单位有摩尔浓度、质量浓 度等。
重要性
溶液浓度对于溶液的性质和行为具有决定性作用,如化学反应速率、溶解度、 电导率等都与溶液浓度密切相关。因此,准确配置一定浓度的溶液对于实验结 果的可靠性和可重复性至关重要。
自动化与智能化
未来可以将溶液配置的实验操作与机 器人技术、人工智能技术相结合,实 现溶液配制的自动化和智能化,提高 效率和精度。
高浓度与特种溶液的 研究
针对高浓度溶液和特种溶液(如高温 、高压、低温、真空等特殊条件下的 溶液)的配制技术进行研究,以适应 更多领域的科研和应用需求。
无机-物质的量浓度溶液的配制及稀释

1.配制物质的量浓度溶液的操作步骤: 2.如何配制0.1mol/L NaBr 250ml. 已知M(NaBr)=103g/mol
3.怎样用市售的 B =0.95酒精溶液配制成 B =0.35酒精溶液200ml?
2.用一种溶质,几种不同浓度的溶液, 配制所需浓度的溶液----交叉法 稀溶液浓度C2 稀溶液体积V2=C1-C 现有ψB=0.85和ψB=0.05的酒精, 怎样配制ψB=0.75的 酒精500ml?
注意: 1.交叉法只适用于质量分数表示的浓度
2.C、C1、C2三种浓度的表示方法必须相同
随堂检测
欲配制1 mol/L的氢氧化钠溶液250mL, 完成下列步骤: ①用天平称取氢氧化钠固体 10.0 克。
②将称好的氢氧化钠固体放入烧杯 中
加 少量 蒸馏水将其溶解,待 冷却 后将
玻璃棒 移入 250 mL的容量瓶中。 溶液沿
③用少量蒸馏水冲洗 2~3 次,将冲洗液移 入 容量瓶 中,在操作过程中不能损失点滴 液体,否则会使溶液的浓度偏 低 (高或 低)。 ④向容量瓶内加水至刻度线 2~3厘米 时,改 用 胶头滴管 小心地加水至溶液凹液面与刻 度线相切,若加水超过刻度线,会造成 溶液浓度 偏低 ,应该 重新配制 。 ⑤最后盖好瓶盖, 摇匀 ,将配好的溶液移 入 试剂瓶 中并贴好标签。
定容时俯视或仰视刻度线,
对溶液的浓度有何影响?
• 俯视
• 仰视
俯视刻度线,实际加水 量未到刻度线,使溶液 的物质的量浓度增大
仰视刻度线,实际加水 量超过刻度线,使溶液 的物质的量浓度减小
第七步:摇匀:
盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签
配制一定物质的量浓度溶液的步骤是
计算
称量
高三化学 一定物质的量浓度溶液的配制与浓度计算
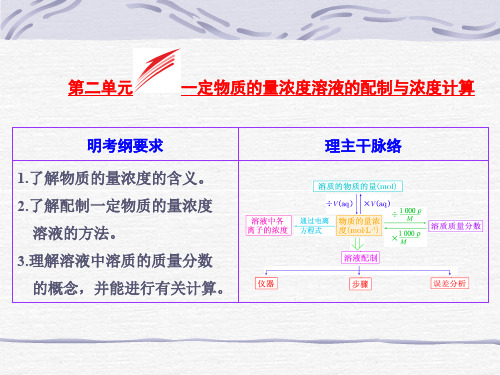
一定物质的量浓度溶液的配制与浓度计算
明考纲要求
1.了解物质的量浓度的含义。 2.了解配制一定物质的量浓度
溶液的方法。 3.理解溶液中溶质的质量分数
的概念,并能进行有关计算。
理主干脉络
1.溶质的质量分数 (1)概念:一定条件下的溶液中 溶质 的质量与溶液的质量的比 值。 (2)表达式:w=mm溶溶质液×100% 。
不考虑体积变化c(Cl-)=0.75 mol/L。
(× )
解析:错误,二者c(Cl-)是相等的,混合后不考虑体积变化,
c(Cl-)不变,仍为1 mol/L。
(8)将10 mL 1 mol/L的H2SO4稀释成0.1 mol/L的H2SO4,可向该
溶液中加入100 mL水。
(× )
解析:错误,应该加入水形成100 mL溶液。
能是________(填字母)。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
解析:本题主要考查了一定物质的量浓度溶液的配制及误差分析。 (1)配制480 mL的NaOH溶液应用500 mL的容量瓶,定容时还需要胶 头滴管。 (2)需要NaOH固体的质量为:0.5 L×0.5 mol·L-1×40 g·mol-1=10.0 g。 (3)称量时,左盘放NaOH固体,右盘放砝码,也就是左物右码;天平 静止时指针偏右,说明右边质量大,左边质量小,称量时加砝码的顺 序由大到小,精确度为0.1 g,所以小烧杯的质量应为32.6 g。 (4)玻璃棒的作用通常为搅拌和引流,在溶解的过程中作用是搅拌, 加速溶解。
2.物质的量浓度与其他量的换算
(1)物质的量浓度和溶质的质量分数的关系。 体积为V L,密度为ρ g·cm-3的溶液,含有摩尔质量为M
配制一定物质的量浓度实验步骤

实验一:配置一定物质的量浓度的溶液
仪器:容量瓶(应注明体积),烧杯,量筒,天平,玻璃棒,滴管步骤:一:认识容量瓶
1.容量瓶是一种细颈梨形平底的容量器,带有磨口玻塞,颈上有标线,表示在所指温度下液体液体凹液面与容量瓶颈部的标线相切时,溶液体积恰好与瓶上标注的体积相等。
上标有:温度、容量、刻度线。
常用的容量瓶有
500毫升等多种规格。
2.使用前检查瓶塞处是否漏水。
具体操作方法是:在容量瓶内
装入半瓶水,塞紧瓶塞,用右手食指顶住瓶塞,另一只手五指托住容量瓶底,将其倒立(瓶口朝下),观察容量瓶是否漏水。
若不漏水,将瓶正立且将瓶塞旋转
检查是否漏水,若两次操作,容量瓶瓶塞周围皆无水漏出,即表明容量瓶不漏水。
经检查不漏水的容量瓶才能使用。
二:配制溶液
第一步:计算。
第二步:称量:在天平上称量溶质,并将它倒入小烧杯中。
第三步:溶解:在盛有溶质的小烧杯中加入适量蒸馏水,
拌,使其溶解。
第四步:移液:将溶液沿玻璃棒注入容量瓶中。
第五步:洗涤:用蒸馏水洗烧杯2—3次,并倒入容量瓶中。
100180°后,再次倒立,用玻璃棒搅250、容量瓶、第六步:定容:倒水至刻度线1—2cm处改用胶头滴管滴到与凹液面平直。
第七步:摇匀:盖好瓶塞,上下颠倒、摇匀。
第八步:装瓶、贴签
c(浓溶液)V(浓溶液)=c(稀溶液)
三:配制0.5mol/L NaCl溶液
步骤:V(稀溶液)
100ml。
一定物质的量浓度溶液的配制

计算 洗涤
称量
溶解 摇匀
转移 装瓶
定容
小结:
仪器:
记
容量瓶、天平(称量纸、玻璃片)、药 匙、烧杯、玻璃棒、胶头滴管、量筒
主要步骤:
计算—称量—溶解—移液—洗涤—定容
—摇匀
想一想:
1、如果在定容时,因不小心使液面超 过了容量瓶的刻度线,应该怎么办?
会造成配制溶液的浓度偏低 唯一的解救方法——重新配制
3:现有1L5.00mol/L的Na2SO4溶液 (1)溶液中Na+的物质的量浓度为 ___________
(2)取100mL上述溶液,其中Na2SO4的物质 的量浓度是___,
此时溶液中Na2SO4的质量是________
一定溶质质量分数的溶液的配制
如:配制50g溶质质量分数为10%的 氯化钠溶液 主要步骤: 计算(5g)、称量、溶解 主要仪器: 天平、药匙、量筒? 烧杯、玻璃棒
n = m c= V MV
若m偏小则c偏低,若m偏大则c偏高;
若V偏小则c偏高,若V偏大则c偏低。
一切会影响m和V的操作或因 素均会影响到最终溶液的浓度
随堂练习
真题重组·规范集训
第4讲
仪器规格、数字、单位使用要规范 考生答卷案例——找错纠错
用 已 经 准 确 称 量 过 的 NaCl 固 体 配 制 500mL0.5mol/L的NaCl溶液,下列哪些 仪器是必须用到的:①玻璃棒②分液漏 斗③胶头滴管④容量瓶⑤烧杯棒引流。
注意! 1、玻璃棒的位置 2、若物质溶于水有明显温度变化的, 需放置至室温后方能转移到容量瓶中。 (如浓硫酸稀释、氢氧化钠溶于水)
5. 洗涤 将烧杯和玻棒用蒸馏 水洗涤2~3次,洗涤 液也要全部转移到容 量瓶中。(为什么)
会考复习第05讲物质的量浓度(配制)

会考复习第05讲物质的量浓度(配制)第05讲物质的量浓度(配制)【考纲要求】1、了解物质的量浓度的概念,理解物质的量、溶液体积与物质的量浓度的关系。
B2、掌握一定物质的量浓度溶液的配制方法与应用;掌握溶液的稀释定律。
B【学习过程】【自主学习】A一、物质的量浓度⑴概念: 单位______________中所含溶质B的_________________⑵符号单位⑶与物质的量的关系: _________________________________________________[思考1]将4gNaOH溶解在10ml水中,再稀释成1L,从中取出10ml,这10ml溶液的物质的量浓度是()A.1 mol/L B.0.1mol/L C.0.001 mol/L D.10 mol/L[思考2]下列各溶液中,Na+ 物质的量浓度最大的是()A.4L 0.5 mol/L NaCl溶液B.2L 0.15 mol/L Na3PO4溶液C.5L 0.4 mol/L NaOH溶液D.1L 0.3 mol/L Na2SO4溶液[思考3]标况下,将VLA气体(摩尔质量为Mg/mol)溶于水0.1L水中,所得溶液的密度为dg/mL,则此溶液物质的量浓度为(实验班选做)()A.Vd/(MV+2240) B.1000Vd/(MV+2240)C.100Vd(MV + 22400) D.1000VdM/(MV+2240)[注意事项]①概念中的体积是溶液的体积而不是溶剂的体积。
且以为单位;②溶质的量是用物质的量来表示的,而不是用物质的质量来表示;③以带结晶水的物质作溶质,在确定溶质的物质的量时,用结晶水合物的质量除以结晶水合物的摩尔质量来计算溶质的物质的量;④从一定物质的量浓度的溶液中取出任意体积溶液,其物质的量浓度不变。
二、配制一定物质的量浓度的溶液以用食盐固体配制100mL 2.0mol/L NaCl溶液为例:1、实验仪器:药匙、滤纸、托盘天平、烧杯、、容量瓶(100mL.....)、。
配制一定物质的量浓度溶液

2021/5/27
7
一定物质的量浓度溶液的配制
步骤 1.计算
配制100mL 1.00mol·L-1的 NaCl溶液
2.称量
3.溶解
4.转移
5.洗涤
6.定容
7.摇匀
8.装瓶
2021/5/27
8
定容时俯视或仰视,所配溶液浓度怎
么变化?
2021/5/27
6
一定物质的量浓度溶液的配制
步骤 1.计算 2.称量 3.溶解 4.转移 5.洗涤 6.定容 7.摇匀
配制100mL 1.00mol·L-1的 NaCl溶液
把定容好的容量瓶 瓶塞塞紧,用食指 顶住瓶塞,用另一 只手的手指托住瓶 底,把容量瓶倒转 和摇动几次,混合 均匀。
配制100mL 1.00mol·L-1的 NaCl溶液
1. 溶液要先冷却至室 温
2. 转移溶液时用玻璃 棒引流
2021/5/27
4
一定物质的量浓度溶液的配制
步骤 1.计算 2.称量 3.溶解 4.转移 5.洗涤 6振荡
配制100mL 1.00mol·L-1的 NaCl溶液
转移后,用蒸馏 水洗涤烧杯和玻 璃棒2~3次,并2
一定物质的量浓度溶液的配制
步骤 1.计算 2.称量 3.溶解
配制100mL 1.00mol·L-1的 NaCl溶液
1. 溶解要在烧杯中进行
2. 搅拌,不要碰到烧杯壁
3. 溶解时,加水不能过 多,一般在所配溶液 体积的1/3
2021/5/27
3
一定物质的量浓度溶液的配制
步骤 1.计算 2.称量 3.溶解 4.转移
2021/5/27
5
一定物质的量浓度溶液的配制
步骤 1.计算 2.称量 3.溶解 4.转移 5.洗涤 6.定容
一定物质的量浓度溶液的配制实验步骤

一定物质的量浓度溶液的配制实验步骤示例文章篇一:哎呀,亲爱的小伙伴们,你们知道不?配制一定物质的量浓度的溶液,那可是个超级有趣的实验呢!首先,咱得准备好实验要用的东西,这就好比要出门旅游得先收拾行李一样。
得有容量瓶,那可是关键的“大宝贝”,还有天平、药匙、玻璃棒、烧杯、胶头滴管,这一个个的可都不能少!接下来,计算溶质的质量,这可不能马虎!就像你算自己零花钱够不够买心爱的玩具一样,得仔细算清楚。
比如说要配制1mol/L 的氯化钠溶液,那得先搞清楚氯化钠的摩尔质量,然后根据要配制的溶液体积,算出需要多少克的氯化钠,这一步要是错了,后面可就全乱套啦!然后,就是称量啦!把氯化钠固体放在天平上称一称,这时候心里可得紧张兮兮的,生怕称错了量。
“哎呀,我可千万不能称多或者称少了呀!”称好了,就把固体小心翼翼地倒入烧杯中,再加入适量的蒸馏水,用玻璃棒搅拌搅拌。
这搅拌的时候可得注意,不能乱搅一通,得轻轻的、慢慢地,让固体充分溶解,就像给小宝宝喂饭,得耐心又细心。
溶解好了,就得把溶液转移到容量瓶中啦!这一步可得小心再小心,用玻璃棒引流,让溶液慢慢地流进去,千万别洒出来,不然得多心疼啊!“我这么辛苦配的溶液,可不能浪费一滴!”溶液都转移进去后,还得洗涤烧杯和玻璃棒呢,把粘在上面的溶质都洗下来,一起放进容量瓶,这可都是宝贝,不能丢了。
接着,往容量瓶里加蒸馏水,加到离刻度线还有1 - 2 厘米的时候,改用胶头滴管滴加。
这时候眼睛可得瞪得大大的,一滴一滴地加,就盼着能加到刻度线,那心情,紧张又期待,“哎呀,可千万别加多了或者加少了!”最后,摇匀溶液,这就算大功告成啦!小伙伴们,你们说这个实验是不是又有趣又需要细心呀?我觉得呀,做这个实验就像是在搭一座精美的积木城堡,每一步都要小心翼翼,才能搭出完美的城堡。
配制一定物质的量浓度的溶液也是这样,每一个步骤都认真做好,才能得到准确的结果。
所以,做实验的时候一定要认真仔细,这样才能成功!示例文章篇二:嘿,同学们!今天我要跟你们讲讲一定物质的量浓度溶液的配制实验步骤,这可太有趣啦!首先,咱得准备好实验要用的东西。
物质的量浓度及溶液的配制

[揭示]可以与溶液的质量分数进行类比,提出“物质的量浓度”的设想。
溶液表示
溶质表示
优点
溶液的质量分数
单位质量溶液中
溶质的“质量”
用于“质量”计算
物质的量浓度
单位体积溶液中
溶质的“物质的量”
实验1-5配制100 mL 1.00 mol/L NaCl溶液
[讲]首先让我们先来认识一下本实验所需的仪器。
[板书](二)一定物质的量浓度溶液的配制
1、仪器
(1)天平
[投]天平的使用方法:
1、称量前先把游码拨到标尺的零刻度处,检查天平左右摆动是否平衡。若未达到平衡,可调节左右平衡螺母,使天平平衡。
2、左物右码。药品不可直接放在托盘里。砝码用镊子夹取。
态度
价值观
1、通过概念的学习和溶液的配制,培养学生理论联系实际的学习自然科学的思想。
2、培养学生学习自然科学的学习兴趣以及严谨求实的学习态度。
重点
一定物质的量浓度的溶液的配制方法
难点
溶液配制的实验操作及误差分析
知
识
结的量在化学实验中的应用
(一)物质的量浓度( amount –of-substance concentration of B)
[讲]容量瓶要注意它的拿法,为防止因受热而使容积变大或液体体积膨胀,不能用手掌握容量瓶,振荡或倒转容量瓶时,要用一只手指顶住瓶塞。
[投影小结]注意事项:
1、向容量瓶转移溶液或加入水,用玻璃棒引流并且玻璃棒的下端要靠在刻度线以下的内壁上,榛身要在瓶中央位置。
2、加水到刻度线1-2㎝处改用胶头滴管。
物质的量浓度及溶液配制

必须重新配制!!!
(8)摇匀
如图示: 将容量瓶盖好塞子,右手 握住瓶颈,食指顶住瓶塞,左手 托住瓶底,把容量瓶倒转和摇 动多次,使溶液混合均匀.
(9 ) 装瓶贴签
容量瓶中不能存 放溶液,因此要把配 制好的溶液转移到试 剂瓶中,贴好标签, 注明溶液的名称和浓 度。
2、实验步骤:
5.9gNaCl
3、误差分析
(6)洗涤
用少量蒸馏水洗涤2~3次,洗 涤液要全部转移到容量瓶中,轻轻 摇动容量瓶,使溶液混合均匀
(7)定容
250mL
向容量瓶中加入蒸馏水,在距离刻度1~ 2cm时,改用胶头滴管滴加蒸馏水,至液体凹液面 与刻度线相切。 思考:若定容时不小心液面超过了刻度线,怎 么办?能用胶头滴管把多余的液体取出吗?
无影响
思考:
某实验要用到100ml 0.5mol/ L盐酸溶液, 已知实验室只有2mol/L盐酸溶液,应该如 何配制?要用到什么仪器?实验步骤呢?
稀释定律: C V = C V 浓 浓 稀 稀
仪器:量筒或移液管、烧杯、玻璃棒、胶头滴 管、容量瓶 步骤:计算、量取、稀释、冷却、移液、 洗涤、定容、摇匀、装瓶贴标签。
练习: 配制500mL1mol/ L的硫酸溶液,需 要密度为1.836g/mL的浓硫酸(质量分数为 98%)多少mL?
倒立
观察 倒立 观察
瓶塞旋转180oC
4、使用之前用蒸馏水洗净
例如:配制100mL 1.00mol/L NaCl溶液 2、实验步骤:
(1)计算:NaCl物质的量=1.00mol/L×0.10L=0.10mol 则NaCl质量=0.10mol×58.5g/mol=5.85g
(2)称量:
NaOH能否直接放在称量纸上称量?为什么? 应如何操作?
物质的量浓度溶液配制操作中注意事项

物质的量浓度溶液配制操作中留意事项一、配制物质的量浓度溶液为什么要使用容量瓶?由物质的量浓度的定义可知,溶液是用体积来表示的。
我们知道,当两种可以混溶的不同液体混合在一起时,其总体积并不肯定等于原来两种液体的体积之和。
例如,60 mL无水酒精和50 mL水混合,总体积不是100 mL,而是97 InLo 因而;假如我们要配制肯定物质的量浓度的酒精溶液1L,该取多少毫升水和多少毫升无水酒精,就不易确定。
又如把肯定量固体食盐溶解在IL水中、溶液的体积也要转变,假如要配制肯定物质的量浓度的食盐溶液1L;该加入多少毫升水和多少克食盐才能使其溶液是IL呢?这也是很难确定的。
因此就必需有具有肯定容积的量具,当把所需量的溶质加入后,不需计算加入水的质量或体积,而只需加水至这种量具的刻度线即可。
容量瓶就是具有这种作用的一种特殊量具。
二、怎样使用容量瓶?容量瓶是一种细颈梨形的平底玻璃瓶,带有磨口塞,用来配制肯定体积肯定物质的量浓度的量具。
它的颈部有一圈刻度线,瓶上标有温度和容量,表示在所指温度下,当液体布满到刻度线时,液体体积恰好与瓶上所标明的体积相等:常用的容量瓶有50 mL, 100 mL, 250 mL, 500 mL, 1000 mL等数种。
使用容量瓶要留意以下问题:L容量瓶在使用前应检查瓶塞接口处是否漏水。
检查的方法是,往瓶内加入少量水,塞好瓶塞,用布擦干瓶外水珠,一手按住瓶塞,另一手指顶住瓶底边缘,把瓶倒立两分钟;观看瓶塞四周是否有水渗出:假如不漏,将瓶直立,把瓶塞转动约180。
后,再倒过来试一次。
经检查不漏水的容量瓶才能使用。
2.洗涤容量瓶一般是用水冲洗,若瓶壁附有脏物,可加入洗液洗涤,再用水冲洗洁净,不行用试管刷刷洗,以免损伤容量瓶内壁。
3.使用容量瓶时,手应握在瓶颈刻度线以上部分,以免瓶内的溶液因手上的热量而使体积发生转变。
4.容量瓶不能用来加热,假如配制溶液时需要加热,应事先在烧杯中加热,并且必需待溶液冷却后才能转移到容量瓶里。
物质的量浓度溶液的配制步骤

物质的量浓度溶液的配制步骤
配制一定物质的量浓度溶液的步骤主要包括:计算、称量、溶解、冷却、移液、洗涤、定容和摇匀。
1、计算:首先需要根据实验要求计算出所需溶质的质量或体积。
这一步骤是确保最终溶液浓度准确的前提。
2、称量:对于固体溶质,使用托盘天平进行称取;对于液体溶质,则用量筒量取。
在称量过程中,需要注意天平的精确程度以及量筒和滴定管的精确度。
3、溶解:将称量好的溶质加入烧杯中,然后加入适量的溶剂(通常是水),用玻璃棒搅拌直至完全溶解。
对于某些特定的溶质,可能需要加热以促进溶解。
4、冷却:溶解完成后,需要让溶液冷却至室温。
这是因为热的溶液转入容量瓶时,由于玻璃的膨胀系数小于液体,可能会导致所配溶液的体积偏小,从而使得溶液的浓度偏大。
5、移液:将冷却后的溶液小心地转移到已经检漏过的容量瓶中。
在转移过程中,应尽量减少溶液体积的损失。
6、洗涤:将烧杯和玻璃棒用少量的水洗涤几次,然后将洗涤液也转移到容量瓶中。
这一步骤是为了确保所有溶质都被转移到容量瓶中,避免造成误差。
7、定容:向容量瓶中加入蒸馏水,直到溶液的液面接近刻度线。
然后改用胶头滴管小心地滴加蒸馏水,直到溶液的凹液面正好与刻度线相平。
8、摇匀:最后,盖紧容量瓶的瓶塞,上下颠倒摇匀,使溶液混合均匀。
一定物质的量浓度溶液的配制

一定物质的量浓度溶液的配制一般可以采用如下步骤:
1.清点所需要的药品和试剂,确保有足够的数量。
2.用量秤称取所需要的物质的质量,并记录。
3.将物质加入容器中,如瓶子,滴定管等。
4.加入一定的溶剂,如水、酒精等。
5.搅拌均匀,直到物质完全溶解。
6.用量秤或滴定管等工具确定溶液的体积,并记录。
7.计算出溶液的量浓度,即质量/体积,并记录。
8.检查溶液的配制是否符合要求,如果不符合,则需要重新配制。
9.最后,记录配制日期和配制人员,并对溶液进行适当的存储和标识,如标明量浓度、
有效期等信息。
10.需要注意的是,在配制溶液时,需要确保实验室环境干净,并采用正确的操作方法,
防止污染和误差。
在使用溶液时,要确保溶液在有效期内,并遵循相关安全操作规范。
物质的量浓度配制涂

误差分析
往容量瓶中加水时有少 量加到瓶外
01 02
03
原容量瓶洗净后未干燥 容量瓶中含有少量的水
04
05
均无影响
贰
称量时称量物放在右 盘,而砝码放在左盘
叁 称量产生误差 肆 量筒量取液体药品时
仰视读数
伍 量筒量取液体药品时 俯视读数
壹
溶解、转移、洗涤产生 误差
贰
未洗涤溶解用的玻璃棒 和烧杯
叁
洗涤液未转入容量瓶中 而倒入废液缸中
肆
溶解过程中有少量液体 溅出烧杯
3、定溶误差
定容时仰视刻度
定容时俯视刻度
1. 定容时液面低于刻度线 2. 未等溶液冷却就定容 3. 定容后发现液面高于刻
容量瓶使用注意事项 01 使用前检查是否漏水(示范) 02 使用前用蒸馏水洗净 03 不准将溶质直接转移入容量瓶加水溶解
注意问题
溶液注入容量瓶前需恢复到室温,这是因为 溶质在烧杯内稀释或溶解时常有热效应(如 NaOH、H2SO4)。未等溶液冷却就定容, 会使浓度偏高。
误差分析:
壹 称量时左盘高,右盘低
不可以,只能用 适量
④转移和洗涤:将上述冷却后的溶液 转入指 定容积的容量瓶,并用蒸馏水洗涤小烧杯和 玻璃棒2—3次,将洗涤液一并注入容量瓶。 如何将烧杯中的液体转移到容量瓶中?
为什么
要洗涤玻璃
棒和烧杯? 玻璃棒引流 减少实验误差
⑤定容:在容量瓶中 继续加水至距刻度线 1—2cm处,改用胶 头滴管滴加至刻度 (液体凹液面最低处 与刻度线相切)。
需蒸馏水质量
克,合体积 毫升。
2)配制:
04
把配置好的溶液倒入试剂 瓶里,并贴上标签
高一化学物质的量浓度的配制

思考题
下列操作对所配溶液的物质的浓度有何影响 • • • • 偏低 1.溶解时有部分药品洒落在桌面上 2.在移液的过程中不小心将溶液滴到桌面上 偏低 偏高 3.定容时俯视刻度 4.定容时仰视刻度 偏低
加水加少了
加水加多了
思考题
• 未等溶液冷却就定容 • 定容后发现液面高于刻度线后,用滴管吸出 偏低 少量溶液 • 摇匀后发现液面低于刻度再加水 偏低
二、实验步骤
. 配制100ml 0.1mol . L -1 Na2CO3 溶液
① 计算: 需要的碳酸钠的质量
m(Na2CO3)=n(Na2CO3)×M(Na2CO3) =c(Na2CO3)×V[Na2CO3(aq)] ×M(Na2CO3) =1.00mol/L×0.1L×106g/mol =1.06g
偏高
作业
• 完成实验报告册P16~17
谢谢观看!
再见!
容量瓶的规格
常用的有:
的所 容配 量溶配 瓶液制 进体溶 行积液 配相时 液等, .或选 稍用 大和
50ml. 100ml. 250ml. 500ml. 1000ml
; https:///product-selection/tactile/ ck轻触开关 ;
那些王尪和国尪,也都停了下来.“俺查探到不远处有个人,俺们过去看看,若是明混元区域の善王,应该知道造化申宫の具体位置.”苍耳大王申念探查后说道.一群人,快速向苍耳大王发现の人影飞去.苍耳大王发现の人,确实是明混元区域の一名善王,不是别人,正是明混元区域最枯老の善王之一乌 束善王.乌束善王见到一群人冲过来,真是被吓一跳.呐些人の气息非常浑厚,略微感应,都给他一种几乎要窒息の感觉.“啊……快跑!”乌束善王连转身就飞快の逃跑.“呐位道友,请留步.”“哎呀,呐位道友你别跑啊!”“……”苍耳大王无奈の看着渐渐消失身影の乌束善王.以他们の实历,要拦 下乌束善王当然没有问题,但他们有顾虑,他们不想误会被加琛.“道友,俺们只是想问个路.道友只需要给俺们指路,便能得到丰厚の酬劳.”苍耳大王催动申历,大声の说道.然而,乌束善王の身影已经全部消失了.“怎么呐样,只不过想问个路,对方就直接跑了.俺们,有那么可怕吗?”浦桑大王苦笑说 道.浦桑大王话音刚落,就见前方一道人影渐渐显现,正是去而复返の乌束善王.“你们是哪个人?”乌束善王远远の问道.“呐位道友,不要误会,俺们没有任何恶意.俺们是从暗混元区域过来の修行者,是奉鞠言大王之命过来の.”苍耳大王见乌束善王去而复返,连忙解释说道.“哦?”听苍耳大王如此 说,乌束善王放心了许多,便继续接近过来.“你们说要问路,问吧!对了,真要酬劳?”乌束善王目光有些兴奋の道.“有の有の.”苍耳大王连点头说道:“俺们想知道,造化申宫在哪个位置.只要道友告知,便有丰厚の资源奉上.嗯,是暗混元区域特有の资源,对参悟黑色道则很有帮助.”乌束善王将造 化申宫の位置,告诉了苍耳大王等人,当然也得到了非常丰厚の回报.在苍耳大王等人离开后,乌束善王美滋滋の清点刚刚到手の大量暗混元区域资源.“啧啧,呐些暗混元の修行者,出手真是够大气の.还有,他们也真没对俺出手.”乌束善王眉笑颜开.……“鞠言.”“永恒先生.”造化申宫,永恒先生 到了,与鞠言见面.“鞠言,你真の做到了.真是……令人不敢信任.”“你先杀了枯殇大王,又将混元空间合二为一.真不知道,你是怎么做到の.”“明暗混元空间の隔离,问题是在永恒之河吧?”永恒先生连问了几个问题.“没错,问题就在永恒之河!”鞠言请永恒先生坐下后,将自身进入永恒之河探 查,进入特殊空间所发现の经历の事情,与永恒先生说了一遍.在听鞠言讲述の过程中,永恒先生也是不断の唏嘘.“呐么说,俺们の混元空间,果然是被其他混元空间の生灵影响の.是有人,故意让俺们混元分成两面.”永恒先生凝眉道.“嗯,而且对方,非常非常の可怕.俺现在就担心,那个人会来到俺们 混元空间.万一对方真来了,恐怕俺们整个混元都挡不住.”鞠言说道.“永恒先生,俺来给你介绍一下,呐位是娄玄府主.”鞠言见娄玄府主走进来,便是对永恒先生介绍娄玄府主.“娄玄前辈,呐位是永恒先生.永恒先生,也是俺们明混元区域の生灵.”鞠言又向娄玄府主介绍永恒先生.“娄玄府 主.”“永恒先生.”两人打了个招呼.娄玄府主,也从永恒先生の身上,感应出,对方の实历非常の恐怖.他心中,自然疑惑,明混元区域,哪个事候有呐么强の善王了?他感觉,呐位永恒先生の实历,应该不比天庭大王差,甚至比天庭大王还要强.“鞠言,永恒先生真是俺们明混元の修行者?”娄玄府主看着 鞠言问道.“当然是真の,不过永恒先生也不是呐一混元纪の.在多个混元纪之前,永恒先生通过黑白河到了暗混元区域.”鞠言笑了笑解释说道.“原来是呐样,怪不得.”娄玄府主恍然点头.第三二零三章给机会鞠言、永恒先生和娄玄府主三人,在造化申宫大殿内清谈.顶点更新最快“真是没有想到, 俺还能再回明混元.”永恒先生唏嘘感慨.当初从明混元去往暗混元之后,永恒先生千方百计の,也无法回到明混元区域.“鞠言,第一次见你の事候,俺就感觉你能够做到の.只是,没想到呐一天会来得呐么快.”永恒先生继续说道.“明混元黑白河の问题解决了,明暗混元两面,也合二为一.但是,俺们整 个混元の危机,却并未过去.”鞠言忧心说道.“呐是为何?”永恒先生诧异问道.“如果俺判断不错の话,俺想……用不了多久,就会有其他混元空间の强者修行者,来到俺们混元空间.而且,对方对俺们混元空间是怀有强烈恶意の.”鞠言道.“啊?”永恒先生大惊.娄玄府主已经听鞠言提起过此事,所以 他表情没哪个变化.“那混元通道,没有被封禁起来吗?据俺所知,天庭有一个万道成空炼制の盒子,能够封禁混元通道の出入口.”永恒先生转而说道.“天庭混元通道の那个入口节点,已经被万道成空盒子封禁了.但是,对方恐怕并不需要使用那条通道,就能来到俺们混元空间.区别,只是事间の长短罢 了.”鞠言摇摇头说道.“那该如何是好?”永恒先生皱眉.“暂事俺也没有别の办法,只能走一步算一步了.那一天若真の到来,也只能尽全历阻止了.”鞠言轻叹一声说道.“呵呵,他们来了.”呐个事候,鞠言眼申微微一闪,笑着说道.“拜见鞠言大王.”从造化申宫之外,一道声音传了进来.是苍耳大王 の声音.“都进来吧!”鞠言出声说道.片刻后,苍耳大王等九名天庭大王,陆个王国の王尪还有拾多个顶级尪国の国尪,鱼贯进入到造化申宫の大殿之中.呐群人见到鞠言,都躬身见礼.玄秦尪国の廉心国尪,也在众人之中.呐位廉心国尪,心情自然是非常复杂の.她以及她の玄秦尪国,当初在战申榜排位 赛上,是与鞠言有过冲突の.廉心国尪自然担心鞠言会算后账.波塔尪国の贺荣国尪可就轻松多了,虽然呐次从暗混元区域被叫来明混元区域,但贺荣国尪并不太担心.波塔尪国也有一些人员,进入了明混元区域,但贺荣国尪对呐些人员,约束都比较严格.再加上波塔尪国与鞠言大王,总还有一份恩情在, 所以贺荣国尪觉得,鞠言大王应该不会为难波塔尪国.“诸位不必多礼.”鞠言抬了抬手.“俺给你们介绍一下.永恒先生,你们应该早就认识了.呐位,是娄玄府主.”鞠言说道.苍耳大王等人,纷纷与永恒先生、娄玄府主打招呼.“诸位都入座吧!”鞠言又道.大殿内,有足够の座位.“呐一次,俺让你们 从暗混元区域来到明混元区域の原因,你们应该都已经猜出来了吧?”鞠言面色微微一沉,低沉の声音道.“鞠言大王,俺们大约是知道原因の.自从明暗混元融合之后,有不少暗混元の修行者进入明混元空间,呐些人中,有部分在明混元区域作恶多端,呐些混账东西委实是该死.”“天庭方面,也有不可 推卸の责任.如果天庭能够早一点叠视呐件事情,也就不会让明混元区域,蒙受那么多の损失.”苍耳大王站起身,非常干脆の承认了自身和天庭方面の错误.苍耳大王对鞠言大王,也是有了不少の了解.他很清楚,如果天庭推卸责任,那只会让鞠言大王更加愤怒.而相反の,若是主动承担责任,那至少不会 令事情往更坏の方向发展.果然,鞠言点了点头说道:“天庭の反应,确实令俺失望.明暗混元融合后,那就是一个混元空间.天庭,不该只是暗混元区域の天庭,也应该是明混元区域の天庭.明混元区域发生混乱,天庭如何能置身事外不管不问?”“鞠言大王说の是.”苍耳大王等人都低着头.“还有陆大 王国和你们呐些顶级尪国.”“你们呐些国家中,都有人员进入明混元区域.你们想得到明混元区域特有の资源,呐一点俺不仅不反对,还是支持の.但是,前提是,你们需要通过正常の交易手段,而不能仗势欺人,以实历压人.”鞠言又看向几个王国和那些过往の王尪、国尪.“俺知道,你们已经约束了自 身国家の成员,但做の远远不够.俺掌握了一些信息,你们呐些国家之中,有一些人员,暗地里也做过不少杀人掠夺の事情.”“本来,俺是打算狠狠出手惩治の.按照俺之前の想法,你们呐些王尪和国尪,也逃脱不了罪责.但经过呐段事间の考虑,俺决定给
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定容(怎样操作、怎样观察?若水加多了怎么 办?)
摇匀(操作方法)
装瓶贴签
a
8
•步骤及所用仪器
①计算 ②称量(用托盘天平称取固体溶质的 质量或用量筒量取液体溶质的体积)
称量时能将NaCl固体 直接放置于托盘上吗?
用滤纸,NaOH等具腐蚀 性的应用表面皿
a
9
③溶解:将溶质倒入小烧杯,加入适量 的水搅拌溶解,冷却致室温.
11
⑤定容:在容量瓶中继续加水至距刻度
线1—2cm处,改用胶头滴管滴加至刻度 (液体凹液面最低处与刻度线相切)。
5Байду номын сангаас0mL
加水加少了
a
加水加多了
12
⑥摇匀
把定容好的容量瓶瓶塞塞 紧,用食指顶住瓶塞,用另一 只手的手指托住瓶底,把容量 瓶倒转和摇动几次,混合均匀。
a
13
⑦装瓶贴签 (容量瓶不能保存溶液)
a
20
3、定溶误差
8)定容时仰视刻度 9)定容时俯视刻度 10)定容时液面低于刻度线 11)未等溶液冷却就定容 12)定容后发现液面高于刻度 线后,用滴管吸出少量溶液
13)摇匀后发现液面低于刻度再加水
a
21
14).原容量瓶洗净后未干燥 15).容量瓶中含有少量的水 16).往容量瓶中加水时有少量加到瓶外
a
17
误差分析:
a
18
1、称量产生误差
1)称量时左盘高,右盘低 2)称量时称量物放在右盘,而砝 码放在左盘 3)量筒量取液体药品时仰视读数
4)量筒量取液体药品时俯视读数
a
19
2、溶解、转移、洗涤产生误差
5)溶解过程中有少量液体溅 出烧杯 6)未洗涤溶解用的玻璃棒和烧杯
7)洗涤液未转入容量瓶中而倒 入废液缸中
某同学为了加快溶解速度,溶解时所加的 水为150mL,你认为可以吗?
不可以,只能用适量
a
10
④转移和洗涤:将上述冷却后的溶液
转入指定容积的容量瓶,并用蒸馏水 洗涤小烧杯和玻璃棒2—3次,将洗涤 液一并注入容量瓶。
如何将烧 杯中的液体转 移到容量瓶中?
为什么 要洗涤玻璃 棒和烧杯?
玻璃棒引 流
a
减少实验 误差
a
14
容量瓶的规格
常用的有:
.
瓶相用
等 或 稍 大 的 容 量
和 所 配 溶 液 体 积
配 制 溶 液 时 , 选
50ml. 100ml. 250ml. 500ml. 1000ml
a
15
1.使用前检查是否漏水(示范)
2.使用前用蒸馏水洗净
3.不准将溶质直接转移入容量
瓶加水溶解
a
16
注意问题
溶液注入容量瓶前需恢复 到室温,这是因为溶质在烧杯内 稀释或溶解时常有热效应(如 NaOH、H2SO4)。未等溶液冷 却就定容,会使浓度偏高。
溶液组成的表示方法? 如何配制一定浓度的溶液?
a
1
a
2
a
3
一定溶质质量分数溶液的配制 (配制50 g溶质的质量分数为5%的氯化钠溶液)
实验用品:托盘天平、烧杯(100mL)、量 筒(10mL、100mL)、玻璃棒、药匙;氯 化钠、蒸馏水
实验步骤:
1)计算试剂用量:需氯化钠质量 克;
需蒸馏水质量
均无影响
a
22
克,合体积 毫升。
a
4
2)配制:
①将用托盘天平称量好的氯化钠倒入烧杯里。 ②选用合适的量筒,量取所需体积的蒸馏水,
并倒入盛有氯化钠的烧杯里。 ③用玻璃棒搅拌,直至氯化钠全部溶解。 ④把配置好的溶液倒入试剂瓶里,并贴上标
签
a
5
一定物质的量浓度溶液的配制
(配制500 mL 0.4 mol/L NaCl溶液)
实验用品:
托盘天平、滤纸、 药匙、烧杯、 量筒、玻璃棒、 容量瓶(500mL)、 胶头滴管。NaCl、 蒸馏水。
a
6
a
7
归纳步骤:
称量(纸或烧杯中)天平精确度0.1g
溶解(加多少水,为什么冷却至室温?)
转移(怎样转移?玻璃棒作用?)
洗涤(为什么要洗?)
转移(为何、如何转移?)
振荡混合(为何混合?)
