化学反应的盖斯定律
化学反应原理 第1章第3节 盖斯定律

图1图2ABCBAC△H1△H1△H2△H2△H3△H3第三节盖斯定律知识与能力5.1.8理解盖斯定律①理解盖斯定律的规律特点。
②知道盖斯定律的应用范围。
①根据盖斯定律写出相关反应的热化学方程式。
②根据盖斯定律计算有关反应的ΔH。
③根据盖斯定律判断反应热ΔH的大小关系。
【自研目标卡】一、盖斯定律1、概念:。
或者说化学反应的反应热只与有关,而与无关,这就是盖斯定律。
2、对盖斯定律的图示理解如由A到B可以设计如下两个途径:,途径一:A-→B(△H) 途径二:A--→C—→B(△H l+△H2)则焓变△H 、△H1 、△H2的关系可以表示为即两个热化学方程式相加减时,△H也可同时相加减。
3、盖斯定律是哪些自然规律的必然结果?是质量守恒定律和能量守恒定律的共同体现,反应是一步完成还是分步完成,最初的反应物和最终的生成物都是一样的,只要物质没有区别,能量也不会有区别。
4、盖斯定律的应用如:图1和图2中,△H1、△H1、△H3三者之间的关系分别如何?找出能量守恒的等量的关系(填写表中空白)步骤图1图2(1)找起点A(2)找终点C5、盖斯定律的应用实例盖斯定律在生产和科学研究中有很重要的意义。
有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。
【典例剖析】例题1、试利用298K时下列反应焓变的实验数据,C(s)+ O2 (g)=CO2(g) △H1= -393.5 KJ·mol-1反应1CO(g)+ 1/2O2 (g)=CO2(g) △H2= -283.0 KJ·mol-1反应2计算在此温度下C(s)+1/2 O2 (g)=CO(g)的反应焓变△H3.反应3方法1:以盖斯定律原理求解,以要求的反应为基准(1)找起点C(s),(2)终点是CO2(g),(3)总共经历了两个反应C→CO2;C→CO→CO2。
(4)也就说C→CO2的焓变为C→CO;CO→CO2之和。
则△H1=△H3+△H2(5)求解:C→CO △H3=△H1— △H2= -110.5 KJ·mol-1方法2:利用方程组求解, 即两个热化学方程式相加减时,△H可同时相加减。
盖斯定律及其计算

盖斯定律及其计算一:盖斯定律要点1840年,瑞士化学家盖斯(G 。
H 。
Hess,1802—1850)通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
这就是盖斯定律。
例如:可以通过两种途径来完成。
如上图表:已知:H 2(g )+21O 2(g )= H 2O (g );△H 1=-241.8kJ/mol H 2O (g )=H 2O (l );△H 2=-44.0kJ/mol根据盖斯定律,则△ H=△H 1+△H 2=-241.8kJ/mol+(-44.0kJ/mol )=-285.8kJ/mol盖斯定律表明反应热效应取决于体系变化的始终态而与过程无关。
因此,热化学方程式之间可以进行代数变换等数学处理。
该定律使用时应注意: 热效应与参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的方式、温度、压力等因素均有关,这就要求涉及的各个反应式必须是严格完整的热化学方程式。
二:盖斯定律在热化学方程式计算中的应用盖斯定律的应用价值在于可以根据已准确测定的反应热来求知实验难测或根本无法测定的反应热,可以利用已知的反应热计算未知的反应热。
,它在热化学方程式中的主要应用在于求未知反应的反应热,物质蒸发时所需能量的计算 ,不完全燃烧时损失热量的计算,判断热化学方程式是否正确,涉及的反应可能是同素异形体的转变,也可能与物质三态变化有关。
其主要考察方向如下:1.已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
例1、将0.3mol 的气态高能燃料乙硼烷(B 2H 6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ 热量,该反应的热化学方程式为_____________。
又已知:H 2O (g )=H 2O (l );△H 2=-44.0kJ/mol ,则11.2L (标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ 。
盖斯定律与化学平衡漫谈

盖斯定律与化学平衡漫谈盖斯定律是化学中非常重要的概念之一,它揭示了气体在不同条件下的行为规律。
化学平衡则是指在化学反应中,反应物和生成物之间达到一种稳定状态的状态。
本文将围绕盖斯定律和化学平衡展开,探讨它们之间的关系以及在化学反应中的应用。
首先,盖斯定律是由英国化学家亨利·盖斯在19世纪提出的。
它包括以下三个定律:而这三个定律分别是,盖斯第一定律:在恒温条件下,气体的压强与其摩尔浓度成正比;盖斯第二定律:在恒容条件下,气体的压强与其摩尔浓度成正比;盖斯第三定律:在恒压条件下,气体的摩尔浓度与其摩尔浓度成反比。
这些定律揭示了气体分子之间的运动规律,为理解气体的性质和反应提供了重要依据。
在化学反应中,盖斯定律与化学平衡密切相关。
化学平衡是指在封闭容器中,化学反应前后反应物和生成物浓度保持不变的状态。
在化学平衡中,根据盖斯定律,反应物和生成物的分压或摩尔浓度与其反应系数之间存在一定的关系。
根据盖斯定律,当温度和容积不变时,气体的压强与摩尔浓度成正比。
因此,当一个化学反应达到平衡时,根据盖斯定律,反应物和生成物的压强和摩尔浓度之间将达到一个稳定的比例关系。
在化学平衡中,根据盖斯定律可以推导出平衡常数表达式。
平衡常数是描述反应物和生成物浓度之间的关系的一个常数,它可以用于计算反应物和生成物的摩尔浓度。
根据盖斯定律,平衡常数与反应物和生成物的压强和摩尔浓度之间存在着一定的关系。
利用平衡常数,可以预测在不同条件下反应的方向和程度。
在化学平衡中,盖斯定律还可以用于解释气体的溶解性。
溶解度是指气体在液体中溶解的程度,它与气体的压强和溶液的温度有关。
根据盖斯定律,当温度不变时,气体的压强与其溶解度成正比。
因此,可以利用盖斯定律来计算气体在液体中的溶解度。
总之,盖斯定律是化学中非常重要的定律之一,它揭示了气体在不同条件下的行为规律。
化学平衡则是在化学反应中反应物和生成物达到稳定状态的状态。
在化学平衡中,根据盖斯定律可以推导出平衡常数表达式,利用平衡常数可以预测反应的方向和程度。
化学反应的盖斯定律

盖斯定律的数学表达
盖斯定律可以用数学表达式来表示。对于一个化学反应,其焓变(ΔH)可以表示为:ΔH = Σ(ΔHₘ)rxn + Σ(ΔHₘ)vap + Σ(ΔHₘ)solv等式中,ΔHₘ表示物质的标准摩尔生成焓,rxn表示化学反应方程式中各物质的计量系数,vap和solv分别表示气体和 溶液的体积变化。
反应热的比较
利用盖斯定律,可以比较不同化学反应的反应热 大小,从而判断反应的能量变化趋势。
3
反应热的测量
通过实验测量反应过程中温度的变化,结合盖斯 定律,可以更准确地测定化学反应的反应盖斯定律,可以选择出能量 最低的反应路径,即最有利于发 生的反应路径。
比较不同路径
实验结果分析与结论
分析数据
对实验数据进行统计分析,计算不同温度下反应 的焓变值。
验证盖斯定律
比较不同温度下反应的焓变值,验证盖斯定律的 正确性。
结论总结
根据实验结果得出结论,总结盖斯定律在化学反 应中的应用和意义。
盖斯定律在化学反应
04
中的应用
反应热的计算
1 2
计算反应热
盖斯定律可以用于计算化学反应的反应热,通过 已知的反应热和温度变化,可以求得未知反应的 反应热。
在化学合成中,可以利用盖斯定律优 化合成路径,降低能耗和减少环境污 染。
计算焓变和熵变
通过盖斯定律,可以计算化学反应的 焓变和熵变,进而了解反应的能量变 化和自发性的变化。
02
盖斯定律的原理
能量守恒原理
用盖斯定律和反应焓变计算h的步骤

盖斯定律和反应焓变是化学中常用的计算方法,在许多化学反应中,我们需要计算反应的焓变,以了解反应的热力学性质。
盖斯定律和反应焓变的计算方法可以帮助我们进行这样的计算。
在本文中,我们将介绍使用盖斯定律和反应焓变计算反应焓变的步骤。
一、盖斯定律的基本原理盖斯定律是气体态物质分子的热运动与气体的压强之间的关系的定律。
在一定温度下,气体的体积与压强成反比,即P1V1=P2V2。
二、反应焓变的定义反应焓变是指在定压下,单位摩尔化学反应发生时吸收或释放的热量变化。
通常情况下,我们使用焓变ΔH来表示反应的热量变化。
三、使用盖斯定律计算反应焓变的步骤1. 确定反应方程式我们需要确定反应方程式,以便了解反应生成物的物质的摩尔数和反应物的物质的摩尔数。
2. 使用盖斯定律计算反应物和生成物的摩尔气体体积比根据盖斯定律,我们可以得到反应物和生成物的摩尔气体体积比。
我们需要根据反应方程式,计算得到各物质所产生的气体的摩尔数,然后将这些摩尔数代入盖斯定律的公式中,即可得到反应物和生成物的摩尔气体体积比。
3. 根据盖斯定律计算反应焓变在得到反应物和生成物的摩尔气体体积比之后,我们可以使用盖斯定律来计算反应的焓变。
根据盖斯定律的公式P1V1=P2V2,我们可以根据反应物和生成物的摩尔气体体积比计算得到反应的焓变。
四、使用反应焓变计算反应焓变的步骤1. 确定反应方程式我们需要确定反应方程式,以便了解反应生成物的物质的摩尔数和反应物的物质的摩尔数。
2. 计算反应物和生成物的标准生成焓根据反应方程式,我们可以查找反应物和生成物的标准生成焓的数值。
通常情况下,这些数值可以在化学参考书中找到。
3. 计算反应的标准焓变根据反应物和生成物的标准生成焓的数值,我们可以计算得到反应的标准焓变。
通常情况下,反应的标准焓变等于生成物的标准生成焓减去反应物的标准生成焓。
以上就是使用盖斯定律和反应焓变计算反应焓变的步骤。
通过这些步骤,我们可以准确地计算得到反应的焓变,以便了解反应的热力学性质。
利用盖斯定律计算反应热的方法

利用盖斯定律计算反应热的方法盖斯定律(Gibbs' Law)是热力学中非常重要的定律之一,它可以用来计算化学反应的热力学热变化。
该定律可以表示为以下方程式:ΔG=ΔH-TΔS其中,ΔG表示反应的自由能变化,ΔH表示反应的焓变化,ΔS表示反应的熵变化,T表示温度。
1.确定反应物和生成物:首先确定化学反应中的反应物和生成物。
这些物质在反应方程式中是明确的。
例如,对于A+B→C+D的反应,A和B 是反应物,C和D是生成物。
2.确定反应的热化学方程式:根据反应物和生成物,建立反应的热化学方程式。
这些方程式描述了反应物与生成物之间的化学反应关系,同时还包括反应的系数和状态标识。
3.确定反应的焓变化:利用已知的标准生成焓(ΔH°)值,计算反应的焓变化。
标准生成焓是指在标准状态下,1摩尔物质形成的过程中放出或吸收的热量。
通过查阅化学手册或热化学数据库确定反应物和生成物的标准生成焓,然后根据反应方程中的系数计算反应的焓变化。
4.确定反应的熵变化:确定反应的熵变化也需要一些信息。
从反应物到生成物的熵变可以通过已知的标准摩尔熵(ΔS°)值计算得出。
标准摩尔熵是指在标准状态下,1摩尔物质的熵变。
5. 确定温度:在应用盖斯定律计算反应热时,还需要确定反应发生的温度。
温度的单位通常是Kelvin(K)。
6.应用盖斯定律计算反应热:根据以上确定的ΔH,ΔS和温度值,应用盖斯定律进行计算。
7.解释结果:根据计算所得的反应热ΔG值,可以判断反应是自发进行的还是不自发进行的。
当ΔG<0时,反应是自发进行的,反应具有较大的发生倾向性。
当ΔG>0时,反应是不自发进行的,需要提供能量才能发生。
需要注意的是,在进行计算时要确保所有物质的标准生成焓和标准摩尔熵都是在相同温度下进行计算的。
此外,这种计算方法适用于理想气体和溶液的状态,对于其他复杂的体系可能需要考虑更多因素。
总而言之,利用盖斯定律计算反应热的方法是根据盖斯定律的方程式和已知的物质的焓变化和熵变化,应用热力学原理进行计算,以确定反应的自发性和热力学热变化。
盖斯定律算平衡常数

盖斯定律算平衡常数盖斯定律(Gibbs' law)是指在一定温度和压力下,化学平衡的系统中,化学反应速率与反应物的摩尔浓度的关系。
根据盖斯定律,平衡常数(Kc)可以由化学反应物摩尔浓度的比值来计算。
在学习盖斯定律和平衡常数时,我们需要了解以下内容:1. 平衡常数(Kc)的定义和计算。
平衡常数是在化学平衡条件下,反应物摩尔浓度与反应物生成物摩尔浓度的比例关系。
对于一般的反应:aA + bB ⇌ cC + dD反应的平衡常数Kc定义为:Kc = [C]c[D]d / [A]a[B]b,其中方括号表示摩尔浓度。
2. 用平衡常数计算反应物和生成物的摩尔浓度。
当已知某一化学反应的平衡常数Kc和反应物的初始摩尔浓度时,我们可以通过平衡常数的定义,计算出反应物和生成物的摩尔浓度。
3. 利用平衡常数预测反应方向。
当已知某一化学反应的平衡常数Kc时,我们可以通过比较初始摩尔浓度与平衡常数的大小,来预测反应的方向。
当Kc大于1时,反应物的生成物更多,反应会向正向进行;当Kc小于1时,反应物的生成物较少,反应会向逆向进行。
4. 影响平衡常数的因素。
平衡常数会受到温度和压力的影响。
温度升高会增加反应物的分子平均动能,促使反应向生成物方向进行;而温度降低则会减少反应物分子的动能,使反应更趋向于逆向进行。
压力的影响与反应物和生成物的物态有关,在气体反应中,压力增加会促使反应向摩尔数较小的方向进行。
5. 平衡常数与反应热力学的关系。
平衡常数与反应的热力学函数(如反应焓变和反应熵变)之间存在关系。
根据热力学第二定律和盖斯定律,平衡常数与标准反应焓变(ΔH°)和标准反应熵变(ΔS°)之间有以下关系:ΔG° = -RTlnK c = ΔH° - TΔS°,其中ΔG°表示标准自由能变化,T表示温度,R为理想气体常数。
综上所述,盖斯定律和平衡常数是化学平衡中重要的概念。
高中化学--盖斯定律

高中化学--盖斯定律盖斯定律(英语:Hess's law),又名反应热加成性定律(the law of additivity of reaction heat):若一反应为二个反应式的代数和时,其反应热为此二反应热的代数和。
也可表达为在条件不变的情况下,化学反应的热效应只与起始和终了状态有关,与变化途径无关。
它是由瑞士化学家Germain Hess发现并用于描述物质的热含量和能量变化与其反应路径无关,因而被称为赫斯定律。
1.含义(1)不管化学反应是一步完成或分几步完成,其反应热是相同的。
(2)化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2.意义利用盖斯定律,可以间接地计算一些难以测定的反应热。
例如:C(s)+O2(g)===CO(g)上述反应在O2供应充分时,可燃烧生成CO2;O2供应不充分时,虽可生成CO,但同时还部分生成CO2。
因此该反应的ΔH不易测定,但是下述两个反应的ΔH却可以直接测得:(1)C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1(2)CO(g)+O2(g)===CO2(g) ΔH2=-283.0kJ·mol-1根据盖斯定律,就可以计算出欲求反应的ΔH。
分析上述两个反应的关系,即知:ΔH=ΔH1-ΔH2。
则C(s)与O2(g)生成CO(g)的热化学方程式为C(s)+O2(g)===CO(g)ΔH=-110.5 kJ·mol-1。
注意:1、热化学方程式可以进行方向改变,方向改变时,反应热数值不变,符号相反;2、热化学方程式中物质的化学计量数和反应热可以同时改变倍数;3、热化学方程式可以叠加,叠加时,物质和反应热同时叠加。
3.练习1、已知下列热化学方程式:①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1则反应FeO(s)+CO(g)===Fe(s)+CO2(g)的焓变为( )A.+7.28 kJ·mol-1 B.-7.28 kJ·mol-1C.+43.68 kJ·mol-1 D.-43.68 kJ·mol-1[解析] 根据盖斯定律,首先考虑目标反应与三个已知反应的关系,三个反应中,FeO、CO、Fe、CO2是要保留的,而与这四种物质无关的Fe2O3、Fe3O4要通过方程式的叠加处理予以消去:因此将①×3-②-③×2得到:6FeO(s)+6CO(g)=6Fe(s)+6CO2(g) ΔH=+43.65kJ·mol-1化简:FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=+7.28 kJ·mol-1答案A2.已知:H2O(g)===H2O(l) ΔH=Q1 kJ·mol-1C2H5OH(g)===C2H5OH(l) ΔH=Q2 kJ·mol-1C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3 kJ·mol-1若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( ) A.(Q1+Q2+Q3) KJ B.0.5(Q1+Q2+Q3)kJC.(0.5Q1-1.5Q2+0.5Q3) kJ D.(3Q1-Q2+Q3)kJ[解析] 46 g酒精即1 mol C2H5OH(l) 根据题意写出目标反应C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH然后确定题中各反应与目标反应的关系则ΔH=(Q3-Q2+3Q1)kJ·mol-1 答案D3.能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1。
盖斯定律

第3课时 化学反应热的计算[学习目标定位]一 盖斯定律1.在化学科学研究中,常常需要通过实验测定物质在发生化学反应的反应热。
但是某些反应的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接地获得。
通过大量实验证明,不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关,这就是盖斯定律。
2.从能量守恒定律理解盖斯定律从S →L ,ΔH 1<0,体系放出热量; 从L →S ,ΔH 2>0,体系吸收热量。
根据能量守恒,ΔH 1+ΔH 2=0。
3.根据以下两个反应:C(s)+O 2(g)===CO 2(g) ΔH 1=-393.5 kJ·mol -1CO(g)+12O 2(g)===CO 2(g) ΔH 2=-283.0 kJ·mol -1根据盖斯定律,设计合理的途径,计算出C(s)+12O 2(g)===CO(g)的反应热ΔH 。
答案 根据所给的两个方程式,反应C(s)+O 2(g)===CO 2(g)可设计为如下途径:ΔH 1=ΔH +ΔH 2ΔH =ΔH 1-ΔH 2=-393.5 kJ·mol -1-(-283.0 kJ·mol -1)=-110.5 kJ·mol -1。
4.盖斯定律的应用除了“虚拟路径”法外,还有热化学方程式“加合”法,该方法简单易行,便于掌握。
试根据上题中的两个热化学方程式,利用“加合”法求C(s)+12O 2(g)===CO(g)的ΔH 。
答案 C(s)+O 2(g)===CO 2(g) ΔH 1=-393.5 kJ·mol -1CO 2(g)===CO(g)+12O 2(g) ΔH 2=283.0 kJ·mol -1上述两式相加得C(s)+12O 2(g)===CO(g) ΔH =-110.5 kJ·mol -1。
盖斯定律

2、已知燃烧热求ΔH
已知:CH4(g) 、H2(g)、CO的燃烧热(△H)分别为- 890.3kJ/mol、-285.8 kJ/mol、-285.0 kJ/mol, 根据已知数据计算反应CH4(g)+CO2(g)===2CO(g)+ 2H2(g) △H=
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=−890.3kJ⋅mol−1 ②H2(g)+1/2O2(g)=H2O(l)△H=−285.8kJ⋅mol−1 ③CO(g)+1/2O2(g)=CO2(g)△H=−285.0kJ⋅mol−1 依据盖斯定律①−②×2−③×2得到: CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+251.3KJ/mol
724 kJ能量 ×
4、白磷与氧可发生如下反应:P4+5O2=P4O10。已知断 裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、 P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1
则该反应的△H为? (6a+5d-4c-12b)kห้องสมุดไป่ตู้·mol1
5、1.7 g NH3(g)发生催化氧化反应生成气态产物,放出 22.67 kJ的热量写出其热化学反应方程式
−41kJ/mol
A ×
2、下列实验装置(加热装置)或操作合理的是
盐酸
Na2SiO3溶液
A.除去 SO2 气 B.中和热 C.吸收 D.证明碳酸的 体中的 HCl 的测定 氨气 酸性比硅酸强
3.已知断裂1 mol N-N 键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,且N4的结构为
则1 mol N4气体转化为N2时要吸收
盖斯定律

第三节 化学反应热的计算第1课时 化学反应热的计算[目标要求] 1.理解盖斯定律的意义。
2.能用盖斯定律和热化学方程式进行有关反应热的简单计算。
一、盖斯定律 1.含义(1)不管化学反应是一步完成或分几步完成,其反应热是相同的。
(2)化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
例如,ΔH 1、ΔH 2、ΔH 3之间有如下的关系:ΔH 1=ΔH 2+ΔH 3。
2.意义利用盖斯定律,可以间接地计算一些难以测定的反应热。
例如:C(s)+12O 2(g)===CO(g)上述反应在O 2供应充分时,可燃烧生成CO 2;O 2供应不充分时,虽可生成CO ,但同时还部分生成CO 2。
因此该反应的ΔH 不易测定,但是下述两个反应的ΔH 却可以直接测得:(1)C(s)+O 2(g)===CO 2(g)ΔH 1=-393.5 kJ·mol -1(2)CO(g)+12O 2(g)===CO 2(g)ΔH 2=-283.0 kJ·mol -1根据盖斯定律,就可以计算出欲求反应的ΔH 。
分析上述两个反应的关系,即知:ΔH =ΔH 1-ΔH 2。
则C(s)与O 2(g)生成CO(g)的热化学方程式为C(s)+12O 2(g)===CO(g) ΔH =-110.5kJ·mol -1。
思维拓展 热化学方程式的性质(1)热化学方程式可以进行方向改变,方向改变时,反应热数值不变,符号相反。
(2)热化学方程式中物质的化学计量数和反应热可以同时改变倍数。
(3)热化学方程式可以叠加,叠加时,物质和反应热同时叠加。
二、反应热的计算1.根据热化学方程式进行物质和反应热之间的求算例1 由氢气和氧气反应生成4.5 g 水蒸气放出60.45 kJ 的热量,则反应:2H 2(g)+ O 2(g)===2H 2O(g)的ΔH 为( )A .-483.6 kJ·mol -1B .-241.8 kJ·mol -1C .-120.6 kJ·mol -1D .+241.8 kJ·mol -12.利用燃烧热数据,求算燃烧反应中的其它物理量例2甲烷的燃烧热ΔH=-890.3 kJ·mol-11 kg CH4在25℃,101 kPa时充分燃烧生成液态水放出的热量约为()A.-5.56×104 kJ·mol-1B.5.56×104 kJ·mol-1C.5.56×104 kJ D.-5.56×104 kJ3.利用盖斯定律的计算例3已知下列热化学方程式:①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)ΔH1=-26.7 kJ·mol-1②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g)ΔH2=-50.75 kJ·mol-1③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH3=-36.5 kJ·mol-1则反应FeO(s)+CO(g)===Fe(s)+CO2(g)的焓变为()A.+7.28 kJ·mol-1B.-7.28 kJ·mol-1C.+43.68 kJ·mol-1D.-43.68 kJ·mol-1知识点一盖斯定律及应用1.运用盖斯定律解答问题通常有两种方法:其一,虚拟路径法:如C(s)+O2(g)===CO2(g),可设置如下:ΔH1=ΔH2+ΔH3其二:加合(或叠加)法:即运用所给方程式就可通过加减的方法得到新化学方程式。
【高中化学】盖斯定律 化学反应及其能量变化复习

【高中化学】盖斯定律化学反应及其能量变化复习一. 教学内容:盖斯定律反应及其能量变化二. 教学目标1. 了解反应的途径、反应体系。
2. 从能量守恒定律角度理解盖斯定律。
3. 复习回顾反应热及其相关。
三. 教学重点、难点难点:反应热的有关计算四. 知识分析(一)盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
应用盖斯定律可以间接地计算出反应热。
说明:1. 化学反应不管是一步完成或分几步完成,其反应热是相同的。
如果一个反应可以分几步完成,则各步反应的反应热之和与该反应一步完成时的反应热是相同的。
(二)化学反应及其能量变化复习:说明:1. 反应热:在化学反应过程中所释放或吸收的能量都可以用热量(或换成相应的热量)来表示,叫反应热,又称“焓变”,符号用△H表示,单位一般采用kJ/mol当△H为“+”或△H>0时,为吸热反应。
2. 中和热和燃烧热:燃烧热:在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。
一般情况下,完全燃烧时,一般情况C生成CO2;H生成水;S生成SO2。
中和热、燃烧热的单位一般用kJ/mol表示。
3. 热化学方程式:能表示参加反应的物质的量和反应热的关系的化学方程式。
书写热化学方程式时要注意以下几点:状态、物质的量、反应热的单位及符号、条件等。
4. 反应热和中和热的测定:中和热的测定时同样要注意保温、隔热,要用强酸与强碱的稀溶液在室温下进行,测量温度时一定要读出最高点时的温度,计算时要将测量的热量换算成生成1mol水时所放出的能量。
5. 反应热的计算:燃烧热的计算:一定量的可燃物燃烧放出的总热量=燃烧热×可燃物的物质的量。
【典型例题例1. 按照盖斯定律,结合下列反应方程式,回答问题。
已知:(2)NH3(g)+H2O(l)=NH3?H2O(aq)△H=-35.1kJ?mol-1(4)NH3(aq)+ HCl(aq)= NH4Cl(aq)△H=-52.3kJ?mol-1则第(5)个方程式中的反应热是解析:根据盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
高中化学 盖斯定律
不能很好的控制反应的程度,故不能直接通过实验测得△H1
CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s)+O2(g) = CO2(g)
△H3=-393.5 kJ/mol
(1)消元法 写出目标方程式确定“多余物质”(要消去的物质)然后用消元法逐一消去 “多余物质”,导出“四则运算式”
分析: CO(g) △H1 + △H2 = △H3
H1
H2
C(s)
H3 CO2(g)
C(s)+O2(g) = CO2(g)
△H3=-393.5 kJ/mol
— CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s)+1/2O2(g) = CO(g) △H1=?
∴△H1 = △H3 - △H2 = -393.5 kJ/mol -(-283.0 kJ/mol)= -110.5 kJ/mol
ΔH2
C
ΔH3=ΔH1+ΔH2 ΔH1=ΔH3- ΔH2
(2)唯一法:对于比较复杂的几步反应,可以换个角度: 找唯 一,调方向,改倍数,不多余
测定 C(s)+1/2O2(g)=CO(g) 的焓变△H1
CO(g)+1/2O2(g) = CO2(g) △H2=-283.0 kJ/mol
C(s)+O2(g) = CO2(g)
△H3=-393.5 kJ/mol
盖斯定律的应用 (1)科学意义:对于无法或较难通过实验测定的反应的焓变,可应用盖斯定律 计算求得。 (2)方法——“叠加法”若一个化学反应的化学方程式可由另外几个化学反 应的化学方程式相加减而得到,则该化学反应的焓变即为另外几个化学反 应焓变的代数和。
“盖斯定律”知识解读

“盖斯定律”知识解读作者:李清
来源:《中学化学》2019年第10期
“盖斯定律”是热化学的重要定律,也是各类考试考查的重点。
现对其进行多角度分析,希望对复习有所帮助。
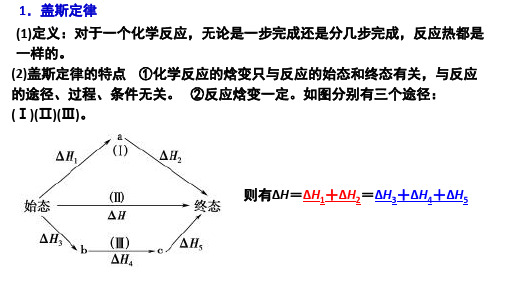
一、盖斯定律的内容
对于一个化学反应,无论是一步完成还是分几步完成,其反应热相同。
即:化学反应的反应热只与反应的始态和终态有关,而与反应的途径无关。
如图1所示,始态和终态相同,反应的途径有三种,则△H=△H1+△H2=△H3+△H4+△H5。
二、盖斯定律的应用
一是应用盖斯定律计算反应热;二是应用盖斯定律判断有关反应热之间的关系;三是应用盖斯定律书写热化学方程式。
三、应用盖斯定律时的注意事项
一是将热化学方程式乘以某一个数时,反应热也必须乘上该数;二是将热化学方程式相加减时,反应热也必须相加减;三是将一个热化学方程式颠倒时,△日的“+”、“一”随之改变,但数值不变。
四、有關盖斯定律的典例赏析
1.利用已知的反应热计算未知的反应热△H
例1火箭推进器常以联氨(N2H4)为燃料,过氧化氢为助燃剂。
已知下列热化学方程式:。
热力学盖斯定律

热力学盖斯定律
盖斯定律又名反应热加成性定律,主要内容是若一化学反应为两个反应式的代数和时,其反应热为这二个反应的反应热的代数和。
该定律也可表达为在条件不变的情况下,化学反应的热效应只与起始和终了状态有关,与变化途径无关。
实质:盖斯定律实际上是“内能和焓是状态函数”这一结论的进一步体现,对于恒容或恒压的化学反应来说,只要反应物和产物的状态确定了,反应的热效应也就确定了,反应是否有中间步骤或有无催化剂介入等均对反应的热效应没有影响。
意义:盖斯定律是化学热力学的基础。
对于一个不能直接发生的反应或者进行得太慢的或反应程度不易控制而无法直接测定反应热的化学反应,可以用赫斯定律,利用容易测定或已知的反应热来间接求得不容易测定或未知的反应热。
赫斯定律的建立,使得热化学反应方程式可以向普通代数方程式一样进行计算,有很大的实用性,故而我们常称盖斯是热化学的奠基人。
盖斯定律算平衡常数

盖斯定律算平衡常数一、引言盖斯定律是描述化学反应平衡的重要定律之一。
它是由荷兰化学家Hendrik Willem Bakhuis Roozeboom和美国化学家Walther Nernst在19世纪末提出的。
盖斯定律可以用来计算化学反应的平衡常数,从而预测反应的方向和强度。
二、什么是盖斯定律盖斯定律是指在恒温下,当一个系统达到平衡时,各组分的化学势之间存在一个固定的关系。
这个关系可以用下面的公式表示:ΔG = ΔG° + RTlnQ其中,ΔG表示系统自由能变化,ΔG°表示标准自由能变化,R为气体常数,T为温度(单位为开尔文),Q为反应物和生成物浓度比值(称为反应商)。
根据盖斯定律,在恒温下,当一个系统达到平衡时,其自由能变化为0。
我们可以将上述公式中ΔG置为0,并解出平衡常数K:K = e^(-ΔG°/RT)其中e表示自然对数的底数2.71828。
三、如何计算平衡常数在实际计算中,我们通常需要知道反应物和生成物的浓度,以及反应的温度。
这些数据可以通过实验获得或者参考文献中提供的数据。
1.计算标准自由能变化标准自由能变化ΔG°可以通过参考文献中提供的数据或者实验测定得到。
如果没有实验数据,我们可以通过计算反应物和生成物的摩尔生成焓(ΔH)和摩尔熵(ΔS)来估算ΔG°:ΔG° = ΔH° - TΔS°其中,ΔH°为反应物和生成物的摩尔生成焓之差,ΔS°为反应物和生成物的摩尔熵之差。
2.计算反应商反应商Q表示反应物和生成物在任意时刻的浓度比值。
在平衡状态下,Q等于平衡常数K。
我们可以通过测量反应物和生成物在任意时刻的浓度来计算Q,并从而得到K。
在以下化学方程式中:N2(g) + 3H2(g) ⇌ 2NH3(g)假设在某一时刻,氮气、氢气和氨气分别的浓度为0.1mol/L、0.05mol/L和0.02mol/L,则该时刻下的反应商为:Q = [NH3]^2/[N2][H2]^3 = (0.02)^2/(0.1)(0.05)^3 = 1.6×10^-3 3.计算平衡常数将ΔG°和Q代入上述公式,即可计算出平衡常数K:K = e^(-ΔG°/RT) = e^(-ΔH°/RT) × e^(ΔS°/R)在298K下,该反应的标准生成焓ΔH°为-92kJ/mol,标准熵变ΔS°为-198J/(mol·K),则该反应的平衡常数为:K = e^(92×10^3/(8.31×298)) × e^(-198/(8.31×298)) ≈4.7×10^9四、盖斯定律的应用盖斯定律广泛应用于化学反应的研究和工业生产中。
盖斯定律

重庆夜景
重庆轻交通线
一、盖斯定律
定义:不管化学反应是分一步完成或 分几步完成,其反应热是相同的。 化学反应的反应热只与反应体系的始态 和终态有关,而与反应的途径无关。
以能量守恒定律来论证盖斯定律:
△ H1 < 0 S(始态)
L(终态) △ H2 > 0 △ H1 +△ H2 = 0
如何理解盖斯定律?
A
ΔH 1
ΔH
ΔH 2
B
C
ΔH、ΔH1、ΔH2 之间有何关系?
ΔH=ΔH1+ΔH2
ห้องสมุดไป่ตู้
问题 情景
在化学科研中,经常要测量化学反应的反应热,但 是某些物质的反应热,由于种种原因不能直接测得,只 能通过化学计算的方式间接获得。如对于反应: C(s)+1/2O2(g) = CO(g),因为C燃烧时不可能完全生成 CO,总有一部分CO2生成,因此这个反应的△H 无法 直接测得,那么该反应的反应热是如何确定的呢?
试计算下述反应的反应热 2C(s) +2 H 2 (g) + O 2 (g)=CH 3 COOH(l)
实际应用(①写方程②确过渡③消过渡④代数
实际应用 实际应用(①写方程②确过渡③消过渡④代数据)
(1)式反写得: 2CO 2 (g) +2 H 2 O(l)=CH 3 COOH(l) +2 O 2 (g) (2)×2得:2H 2 (g) + O 2 (g)=2H 2 O(l) (3) ×2得: 2H 2 (g) + O 2 (g)=2H 2 O(l) -△H 1 =870.3kJ · mol -1 △H 2 =-787.0kJ · mol -1 △H 3 =-571.6kJ · mol -1
盖斯定律的应用

1、盖斯定律的涵义:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变是一样的的。
这就是盖斯定律。
也就是说,化学反应的反应热只与反应体系的始态和终态有关,而与具体的反应进行的途径无关。
2、盖斯定律的应用盖斯定律在科学研究中具有重要意义。
因为有些反应进行的很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。
此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。
例如:C(S)+0.5O2(g)=CO(g)上述反应在O2供应充分时,可燃烧生成CO2、O2供应不充分时,虽可生成CO,但同时还部分生成CO2。
因此该反应的△H无法直接测得。
但是下述两个反应的△H却可以直接测得:C(S)+O2(g)=CO2(g) ;△H1= - 393.5kJ/molCO(g)+0.5 O2(g)=CO2(g) ;△H2=- 283.0kJ/mol根据盖斯定律,就可以计算出欲求反应的△H3。
分析上述反应的关系,即知△H1=△H2+△H3△H3=△H1-△H2=-393.5kJ/mol-(-283.0kJ/mol)=-110.5kJ/mol 例5图由以上可知,盖斯定律的实用性很强。
3、反应热计算根据热化学方程式、盖斯定律和燃烧热的数据,可以计算一些反应的反应热。
反应热、燃烧热的简单计算都是以它们的定义为基础的,只要掌握了它们的定义的内涵,注意单位的转化即可。
热化学方程式的简单计算的依据:(1)热化学方程式中化学计量数之比等于各物质物质的量之比;还等于反应热之比。
(2)热化学方程式之间可以进行加减运算。
例1:按照盖斯定律,结合下述反应方程式,回答问题,已知:(1)NH3(g)+HCl(g)===NH4Cl(s)△H1=-176kJ/mol(2)NH3(g)+H2O(l)===NH3.H2O(aq) △H2=-35.1kJ/mol(3)HCl(g) +H2O(l)===HCl(aq) △H3=-72.3kJ/mol(4)NH3(aq)+ HCl(aq)===NH4Cl(aq) △H4=-52.3kJ/mol(5)NH4Cl(s)+2H2O(l)=== NH4Cl(aq) △H5=?则第(5)个方程式中的反应热△H是____。
