12含氮化合物
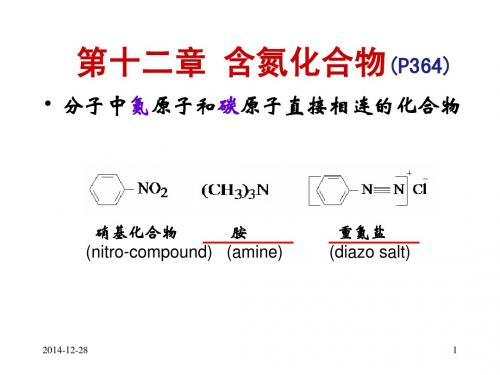
有机化学课件——Chapter 11 含氮和含磷有机化合物

C6H5NH3+ · Cl氯化苯铵
(C2H5NH3+)2 · SO42硫酸二乙铵
(CH3)3N+CH2C6H5 · Br- [(C2H5)2NH2+]2 · SO42溴化三甲基苄铵 硫酸二(二乙铵)
??? ???
C4H9N+ · OH四丁基氢氧化铵
有机化学课件
(C2H5)2NH2+ · HSO4硫酸氢二乙铵
有机化学课件 22 第11章 含氮和含磷有机化合物
一、胺的碱性
N上的未共用电子对能接受一个质子,能与大多数的无机酸成 盐,所以胺具有碱性.
R
NH2 + HCl
R
+NH Cl 3
碱性强弱顺序: 脂肪胺 > NH3 > 芳香胺 pKb 3—4.5 4.75 9—10
在脂肪胺中: RNH2 < R2NH > R3N 一级 二级 三级
Na+
(2) 与羰基化合物缩合
CH3 NO2
-
CH2 NO2
O + R C R'(H)
H2O
OH R C CH2NO2 R'(H)
有机化学课件
10
第11章 含氮和含磷有机化合物
五、硝基对芳环的影响
硝基是强吸电子基, 当其与苯环直接相连时, 使芳环上的亲电取代 反应活性降低, 以致不能进行(如F-C反应). 但在卤代芳烃卤原子(如-Cl)的邻、对位引入-NO2时,卤原子的 反应活性增加,易于发生亲核取代反应.
有机化学课件 25 第11章 含氮和含磷有机化合物
二、胺的酸性
伯、仲胺中N-H键可以电离.
R2NH
R 2N - + H +
有机化学第二版高占先课后习题第12章答案
H N
O NH2 H N
NH2
OHH N
H2/Pd
12-12 根据下列反应,试确定A的构造式。
(1)CH3I过量 A(C8H15N) (2湿)Ag2O, △ 答案 A N H
(1)CH3I过量 (2湿)Ag2O, △
12-13 (1)利用RX和NH3合成伯胺的过程有什么副反应? (2)如何避免或减少这些副反应? (3)在这一合成中哪一种卤代烷不合适? (1)可发生二烷基化、三烷基化反应,生成R2NH和R3N; (2)使NH3大量过量,以增加 RX和NH3的碰撞机会生成RNH2; (3)叔卤代烃将发生消除反应,芳卤ArX也不易发生该反应。
CH3 (4)
2HNO3 2 H2SO4
CH3 NO2
Cl2 hv
CH2Cl NO2
(1) NaCN
CH2COOH NO2
Fe/HCl
CH2COOH NH2
(2) H3O,△
NO2
NO2
NO2
NH2
(5)
2HNO3 2 H2SO 4
NO2
((NH4)2S
NO2
NO2
NaNO 2-HCl 0~5¡ æ
pH=8~10
NH2 NaNO2-HCl
0~5℃
N N OH
(3)
参考(1)合成
OH COCH3 CH2CH3
HNO3 H2SO4
CH2CH3
Sn/HCl
CH2CH3
CH3COCl AlCl3
Zn-Hg HCl
CH2CH3
NaNO2-HCl 0~5℃ pH=8~10
OH H3CH2C
NO2
HO
NH2
NaNO2 / HCl
有机化学 第12章 含氮化合物

NH2 对氨基苯磺酸
4.命名芳胺时,当氮上同时连有芳基和脂肪烃基时, 应在芳胺名称前冠以N– ,明确取代基位置。
NHCH3 N(CH3)2 CH3 NCH2CH3
N-甲基苯胺
N,N-二甲基苯胺
N-甲基-N-乙基苯胺
5.氨基连在侧链上的芳胺,一般以脂肪胺为母体来 命名
CH2CH2NH2 2-苯乙胺
(二)氨与醇或酚反应
Al2O3 350~400℃,0.5MPa
CH3OH + NH3
CH3NH2 + (CH3)2NH + (CH3)3N + H2O
OH
+ NH3
(NH4)2SO3 150℃,0.6MPa
NH2
+ H2O
二、由还原反应制胺
(一)硝基化合物的还原 这是制备芳胺常用的方法。 (二)醛和酮的还原氨化 醛和酮与氨或胺反应后,再进行催化氢化,称为醛 和酮的还原氨化。
NH2 MnO2,H2SO4 ~10℃ O O
§12—4 季铵盐和季铵碱
一、季铵盐 叔胺与卤代烷反应,生成季铵盐。 季铵盐是无色晶体,溶于水,不溶于非极性
有机溶剂。 季铵盐的最重要用途是用作阳离子表面活性 剂和相转移催化剂
二、相转移催化剂
(一)含义ຫໍສະໝຸດ 当两种反应物互不相溶时,就 构成了两相。由于反应物之间不容易接触, 反应较难进行,甚至不发生反应。若加入一 种催化剂使反应物之一由原来所在的一相, 穿过两相之间的界面,转移到另一相中,使 两种反应物在均相中反应,则反应较易进行。 这种催化剂叫做相转移催化剂。
(三)与叔胺反应 脂肪族叔胺在强酸性条件下,与亚硝酸形成盐。芳 香族叔胺与亚硝酸反应,生成氨基对位取代的亚硝 基化合物(芳环上的亲电取代反应)。
有机化学:第12章 含氮化合物

R4N+X22:46:50
R4N+OH- + X-
Br CO2H + NH3 (1 mol)
NH2 CO2H OH-
NH3+ CO2-
65-70%
PhNH2 + PhCH2Cl
PhNHCH2Ph 96%
Et3N + PhCH2Cl
Et3N+CH2PhClTEBA Triethybenzylammonium chloridel
——3o胺、叔胺
22:46:50
胺的命名
四、芳香族仲胺、叔胺,基前以N-示区 别苯环的取代(P223)
22:46:50
[胺的分类之二:芳香胺、脂肪胺(P222)]
胺的命名
五、结构比较复杂的胺,将氨基为取代 基(P223)
22:46:50
六、二元胺的命名
——[胺的分类之三:一元胺、二元胺等(P222)]
H2NCH2CH2CH2CH2NH2: 1,4-丁二胺
(腐胺)
H2NCH2CH2CH2CH2CH2NH2:1,5-戊二胺
(尸胺) 腐胺、尸胺是肉腐烂时产生的,极臭、剧毒
(P224)
22:46:50
七、季铵类化合物的命名
——胺、铵(P222)
(季铵碱,碱性与KOH相当)
22:46:50 (俗名: 1227——杀菌剂)
22:46:50
胺的命名
原则:
一、简单胺按所含烃基命名(P223)
22:46:50
胺的命名
二、多个烃基时表示出烃基个数(P223)
[胺的分类之一:伯、仲、叔(P222)]
22:46:50
胺的命名
三、烃基不同时先列简单的(P223)
2021届高考一轮复习课时强化训练课题十二 氮及化合物(含解析)

2021届高考一轮复习课时强化训练课时十二氮及其化合物1.2017年1月,南京理工大学胡炳成教授团队成功合成世界上首个全氮阴离子盐,全氮阴离子化学式为N-5。
下列关于全氮阴离子盐的说法正确的是()A.每个N-5含有26个电子B.N-5的摩尔质量为71 g·mol-1C.全氮阴离子盐既含离子键又含共价键D.全氮阴离子盐可能属于电解质,也可能属于非电解质1:C解析:每个N-5中含有的电子数为7×5+1=36,A项错误;N-5的摩尔质量为14 g·mol-1×5=70 g·mol-1,B项错误;盐类均含有离子键,全氮阴离子中存在共价键,则全氮阴离子盐中既含离子键又含共价键,C项正确;全氮阴离子盐属于电解质,D项错误。
2.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是()A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水B.将pH=11的氨水稀释1 000倍,测得pH>8,说明NH3·H2O为弱碱C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定D.将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO22:D解析:氨气极易溶于水生成氨水,所以将集有氨气的试管倒扣于水槽中,液体迅速充满试管,故A正确;常温下,pH=11 的氨水中c(OH-)=10-3 mol·L-1,稀释1 000倍,测得pH>8,c(OH-)>10-6 mol·L-1,说明稀释时NH3·H2O 的电离平衡正向移动,所以NH3·H2O为弱碱,故B正确;碳酸氢铵加热分解为氨气、二氧化碳和水,故C正确;氨气的氧化产物为NO,NO在锥形瓶口与氧气反应生成NO2,所以瓶口出现少量红棕色气体,故D错误。
3.实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是()A.用装置甲制取氨气B.用装置乙收集氨气时气体应该从a口进b口出C.装置丙中黑色固体变成红色时还原产物一定为铜D.可以用装置丁吸收氨气,进行尾气处理3:B解析:氯化铵受热分解生成氨气和氯化氢,二者在试管口遇冷又重新化合生成氯化铵,不能用装置甲制取氨气,A错误;氨气密度小于空气,可以用向下排空气法收集,即用装置乙收集氨气时气体应该从a口进b口出,B正确;装置丙中黑色固体变成红色时还原产物不一定为铜,因为氧化亚铜也是红色的,C错误;氨气极易溶于水,不能用装置丁直接吸收,应防倒吸,D错误。
华东理工大学有机化学课后答案含氮化合物

(3) .
N(CH2CH3)2 CH3CHCH2CH3
思考题12-15. 如何完成下列转变。
NH2
NHCOCH2CH2CH3 CH3CH2CH2CH2CHO H2 / Ni
答案: (1).
TM
C2H5
HCN CN SN2
C2H5 H CH3 NH2H2C
C2H5 H CH3
(2).
H CH3
Br
思考题 12-16 如保用 Gabriel 合成法来制备苯甲胺。
O C CH2Br NH C O KOH O C N CH2 C O
1. OH 2. H3O
CH2NH2
答案:
此反应为 SN2 历程,适用于位阻小的卤代烃参与的取代反应。
思考题12-17 当(R)-2-甲基丁酰胺在氢氧化钠的水溶液中与溴发生反应,预测产物的结构及它的立体化学。
答案:产物为(R)2-甲基丙胺,构型不变。
答案: (1)a>b>c>d 苯环上取代基硝基是强吸电子基,其通过共轭效应和诱导效应降低了酚氧原子上的电 子云密度,从而使质子容易离去,分子的酸性增强。 (2)a>b>c (3)b>a>c (4)A . b>c>a>d N 上供电子基团越多,N 原子上电子密度高,捕获质子能力就强。但在水中,
含氢少的胺溶剂化效应小,叔胺上没有氢,溶剂化效应极小,碱性反而比伯胺还弱。 B.a>b>c>d 仅有分子中 N 上取代基的电子效应作用。
NH2
(3).
OCH3
NO2
思考题 12-8. 请设计一个分离对甲基苯酚、环己基甲酸和对甲基苯胺混合物的方法。 答案:第一步往混合液中加入碳酸氢钠溶液 ,能溶解羧酸,分液后,(有机层留作第二步用) 往无机层中加 稀酸,羧酸即游离出。 第二步 向分离出的有机层中加入稀盐酸 ,胺能溶于盐酸溶液.分液,无机层中 加入氢氧化钠溶液即胺析出.
含氮有机化合物和杂环汇总

CH3NHCH2CH3 甲乙胺 (仲胺) 甲基-乙基-环丙基 H 3C N CH2CH3 胺(叔胺)
6
NHCH 3
N-甲基苯胺
邻-甲基苯胺 N-甲基-N-乙基 苯胺
7
NH 2 CH3
N CH3 CH2CH3
CH2NH 2
+ NH 3 Cl
苯甲胺(苄胺) 氯化苯铵 溴化四甲铵
-
(CH3)4N Br
31
第二节 重氮化合物 和偶氮化合物
重氮化合物 R-N=N(Ar)
偶氮化合物
R-N=N-R’ (Ar)
32
重氮化合物的化学性质 1.重氮基取代反应(放氮反应)
33
OH
+
N2
H
+
3 PO 2+ H 2O
O H2
/ △
N2
N2
N) 2 C ( u 2 C N KC
+
Cu
2X 2
+H
X
CN N2
X
+
27
(3) 叔胺和亚硝酸反应
N(CH3)2
N(CH3)2
+ HNO2
N O
28
鉴别:
伯胺 脂 肪 族 仲胺
HNO2
N2 黄色油 状物
叔胺
溶解
29
五.与医学有关的胺类
苯胺
NH 2 + 3Br2(水)
Br Br NH 2 Br + HBr
白
30
ห้องสมุดไป่ตู้
拓展
“新洁尔灭”
溴化二甲基十二烷基苄基铵,又称苯扎溴 铵(C6H5CH2N+(CH3)2C12H25Br-),商品名为 “新洁尔灭”。它为季铵盐型阳离子表面活性 广谱杀菌剂,杀菌力和去垢效力强,对皮肤和 组织无刺激性,对金属、橡胶制品无腐蚀作用, 不污染衣服,性质稳定,易于保存,属消毒防 腐类药物。1:1000~2000的新洁尔灭溶液广泛 用于手、皮肤、粘膜、器械等的消毒。
第12讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(解析版)

第12讲 氮及其化合物1.结合真实情境中的应用实例或通过实验探究,了解氮及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。
2.结合实例认识氮及其化合物性质的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
【核心素养分析】1.变化观念与平衡思想:分析氮及其化合物的化学反应,预测在一定条件下氮及其化合物可能发生的化学变化。
2.科学探究与创新意识:发现或提出对氮及其化合物有探究价值的化学问题,能依据探究目的设计并优化实验方案,完成实验操作,能对观察记录的实验信息进行加工并获得结论。
3.科学态度与社会责任:关注氮及其化合物的社会热点问题,认识环境保护的重要性,形成可持续发展意识和绿色化学观念。
知识点一 氮气及其氧化物 1.氮的固定(1)自然固氮(2)人工固氮:合成氨工业 2.氮气(1)物理性质:无色无味气体,密度比空气略小,难溶于水。
(2)化学性质①3Mg +N 2=====点燃Mg 3N 2; ②N 2+3H 2高温、高压催化剂2NH 3; ③N 2+O 2===========放电或高温2NO 。
3.氮的氧化物(1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,如N 2O 、NO 、N 2O 3、NO 2(或N 2O 4)、N 2O 5,其中属于酸性氧化物的是N 2O 3、N 2O 5。
(2)NO和NO2的比较性质NO NO2色、态、味无色、无味气体红棕色、有刺激性气味气体溶解性难溶于水毒性有毒,大气污染物之一有毒,大气污染物之一与水反应不反应3NO2+H2O===2HNO3+NO与氧气反应NO+O2===2NO2不反应NO与血红蛋白结合使人中毒,NO、NO2导致光化学烟雾、形成酸雨对环境的影响及破坏臭氧层【归纳总结】氮氧化物对环境的污染及防治(1)常见的污染类型①光化学烟雾:NO x在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
含氮及杂环化合物

2598 含氮及杂环化合物内容提要本章主要讲述含C 、H 、O 、N 、X 等原子的化合物,着重阐述硝基化合物,胺类化合物以及胺的衍生物。
一些简单实用的杂环化合物也是本章学习的重点。
从结构上理解它们的性质,且掌握这些化合物的应用价值。
有机化合物除了含C 、H 外,还可含O 、N 、X 等杂原子。
前面讨论了含O ,X 的有机化合物,本章着重介绍有机含氮及杂环化合物。
前面章节中学过了腈、酰胺等含氮化合物,本章重点讨论硝基化合物、胺、季銨盐、重氮化合物、偶氮化合物和叠氮化合物。
它们的一般结构通式为:R-NO 2(Ar-NO 2) R-NH 2(Ar-NH 2) R 4N X ArN 2X(RN 2X) Ar-N=N-Ar(Ar')硝基化合物胺季銨盐类重氮化合物偶氮化合物由结构通式可知它们是不同氧化态的含氮有机物,因此,它们的性质和制备方法既有区别又有关联。
此外,本章还讨论C 与杂原子(如O 、N 、S)组成的环状化合物,即杂环化合物。
8.1 硝基化合物8.1.1 硝基化合物的命名和结构特征分子中含有硝基-NO 2的化合物称为硝基化合物,结构通式为:R-NO 2(Ar-NO 2)。
硝基化合物从结构上可看作烃的一个或多个氢原子被硝基取代的产物,可分为脂肪族硝基化合物和芳香族硝基化合物,脂肪族硝基化合物又可分为伯、仲、叔硝基化合物。
硝基化合物的命名类似于卤代烃,即以硝基为取代基命名,例如:CH 3NO 2CH 3CHCH 3NO 2CH 3O 2N硝基甲烷 2-硝基丙烷 对硝基甲苯在硝基化合物中,N 原子为sp 2杂化态,形成三个共平面的σ键,未参加杂化的具有一孤对电子的p 轨道与两个氧原子的p 轨道形成π43共轭体系。
两个N=O 键是等价的。
但习惯上写成R N, 也有的写成R NO 。
硝基甲烷分子的键长和键角为:H 3CNO OC -N 147pm ,N -O 122pm ,∠ONO 为 127°两个N -O 键的键长相等,说明它们没有区别。
有机化学 第十二章 含氮化合物
胺的化学性质(P374)
结 构 分 析
2014-12-28
18
1、 胺的碱性和成盐反应
1) 胺的碱性
胺的水溶液和氨一样发生解离反应而呈碱性:
Kb值愈大或pKb值愈小则碱性愈强;反之愈弱。
2014-12-28 19
一些胺的pKb值
2014-12-28
20
①
脂肪胺的碱性大于芳香胺
脂肪胺 氨
芳香胺
2014-12-28
6
12. 2. 1 胺的分类、命名和结构(P370)
1 、 胺的分类:
① RNH2:伯胺; R2NH:仲胺; R3N:叔胺 ② RNH2--脂肪胺; ArNH2 --芳香胺 ③ RNH2:一元胺; H2NRNH2:二元胺;多元胺
*注意: 伯、仲、叔胺与伯、仲、叔醇的不同涵义 叔碳
Hofmann 消除的取向
2014-12-28
33
比较:卤代烷的消除取向—Saytzeff 取向 (决定于产物的稳定性)
H H3C CH2 CH ' CH X
H CH2 NaOC2H5 H3C CH2 CH CH
H CH2
主要
主要产物为双键上取代基最多的烯烃。
2014-12-28 34
Hofmann消除取向的解释 (决定于反应物的结构) 从β-氢的位阻和酸性的差别分析
1 含氮化合物的还原 2 酰胺的降解制备 3 氨或胺的烃基化
2014-12-28
50
1、 含氮化合物的还原
(1)硝基化合物的还原
还原剂:H2-Ni(orPt)、Fe(orSn)+HCl、(NH4)2S……
NO2 + 3H 2 NO2
Fe+HCl Ni 常温常压
氮及其化合物的转化关系-高考化学复习

二、氮及其化合物的转化与物质推断
3.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是 强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱 时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法不正确的是 A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4 B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
关键能力
一、氮在自然界中的循环
1.自然界中氮的循环如图所示。下列说法不正确的是 A.工业合成氨属于人工固氮 B.雷电作用下N2与O2发生了化学反应
√C.在氮的循环中不涉及氧化还原反应
D.含氮无机物与含氮有机化合物可相互转化
工业合成氨是氮气和氢气在高温、高压和催 化剂条件下生成氨气,属于人工固氮,故A 正确; 雷电作用下N2与O2发生反应生成NO,故B 正确; 在氮的循环中,工业合成氨、雷电作用过程
B.用装置乙作为反应过程的安全瓶 C.制备水合肼时从装置丙的a口通入NH3 D.用装置丁吸收反应中过量的NH3
浓氨水需受热或加入碱性物质才能分解产生NH3,CaCl2不能使浓氨水分解,A 项错误; 化学实验装置中的安全瓶的进气管和出气管均较短,B项正确; 氨气密度比空气小,为了利于氨气与NaClO溶液反应,应从装置丙的a口通入 氨气,C项正确; 氨气会污染环境,用装置丁可吸收过量的NH3,并能防倒吸,D项正确。
C.装置D使用冰水浴 D.装置F中所用试剂可为NH4Cl与熟石灰
A装置为碳酸钙与盐酸反应制备CO2的简易装置,该装置的优点是能够随时控 制反应的发生和停止,A正确; 氨基甲酸铵易水解,进入装置D的气体必须是干燥纯净气体,左侧装置B、C试 剂 可 分 别 为 饱 和 碳 酸 氢 钠 溶 液 、 浓 硫 酸 , 制 备 纯 净 干 燥 的 CO2 , 装 置 F 可 用 NH4Cl与熟石灰制备氨气,E中试剂需干燥氨气,可以选用碱石灰,但不能选 用P2O5固体,B错误、D正确; 制备氨基甲酸铵的反应为放热反应,制得的物质易分解,所以装置D需降温, 使用冰水浴,C正确。
有机-12-12-含氮化合物

O NHCCH3
=
Br2
O NHCCH3
=
H2O/H+
NH2
Br
Br
硝化: 芳香胺硝化,氨基应加以保护 磺化:苯胺用浓硫酸磺化时,首先生成盐,在加热下失 水生成对氨基苯磺酸(重排)
NH2
c H2SO4
NH3
+H
SO4
-
NH3+
Δ -H2O
内盐 SO3-
四. 个别化合物
H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
Байду номын сангаас
CH3 N CH2CH3 H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
N-甲基-N-乙基环戊胺
芳香胺:把芳香胺作为母体,其它烃基作为取代基
NHCH3 CH2CH3 Cl N-甲基苯胺 N CH2CH3 N,N-二乙基-4-氯苯胺 邻乙基苯胺 NH2 CH2CH3
复杂胺:以烃为母体,以氨基为取代基
R–C≡N R–N=C=O
Ar–N2+Cl-
异氰酸酯
亚胺 R–CH=NH
§12.1 胺
一. 分类、命名
胺可以看作是氨的烃基衍生物 伯胺(一级胺) 仲胺(二级胺) 叔胺(三级胺) 季铵盐(四级铵盐)
RNH2 R2NH R3N R4N+XArNH2 Ar2NH Ar3N
注意:伯/仲/ 叔胺与伯/仲/ 叔卤代烃及 伯/仲/叔醇分 类方法的区 别
脂肪胺亲核性比氨强,氨与卤代烃反应得混合物
季铵盐是强酸强碱盐,不能与碱作用生成季铵碱 季铵盐与AgOH作用因生成卤化银沉淀,可得到季 铵碱
R4N+X- + AgOH R4N+OH- + AgX↓
2022化学第三单元自然界中的元素第2节氮及其重要化合物学案

第2节氮及其重要化合物备考要点素养要求1.掌握氮元素单质及其重要化合物的主要性质及应用.2.了解氮元素单质及其重要化合物的制备方法。
3。
了解氮的重要化合物对环境的影响。
1。
宏观辨识与微观探析:能从不同层次认识含氮化合物的多样性,并对其进行分类。
2.科学探究与创新意识:能根据氮单质及其化合物的性质提出有探究价值的问题;能从问题和假设出发,确定探究目的,设计探究方法,进行实验探究.考点一氮气及氮的氧化物的性质必备知识自主预诊知识梳理1。
氮的固定2.氮气(1)物理性质:色味气体,密度比空气略小,溶于水。
(2)化学性质:写出有关反应的化学方程式:①;②;③。
3。
氮的氧化物(1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,如N2O、、N2O3、NO2(或)、N2O5,其中属于酸性氧化物的是N2O3、。
(2)NO和NO2的性质比较。
2NO+O2—2NO23NO2+H2O2HNO3+NO微点拨(1)氮的氧化物都有毒,其中NO2与N2O4存在平衡:2NO2N2O4,因此实验测得NO2的平均相对分子质量总是大于46。
(2)验证某无色气体为NO的方法是向无色气体中通入O2(或空气),无色气体变为红棕色.(3)NO能用排水法收集,不能用排空气法收集;而NO2能用向上排空气法收集,不能用排水法收集。
(4)氮氧化物对环境的污染。
①光化学烟雾:NO x在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾.②酸雨:NO x排入大气中,与水反应生成HNO3和HNO2,随雨雪降到地面形成酸雨。
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
自我诊断1。
判断正误,正确的打“√",错误的打“×”。
(1)N2分子的结构稳定,因而氮气不支持任何物质的燃烧。
()(2)豆科植物通过根瘤菌吸收空气中的氮属于氮的固定,是化学变化。
()(3)NO2与水反应生成硝酸,故NO2是酸性氧化物。
含氮有机化合物

CH 3
HOOCCH 2CH 2
CH 2CH 2COOH
整理课件
(二) 噻唑
噻唑是无色有臭味的液体,沸点117℃,与水混溶。许多 重要的药物如维生素B1、青霉素G等都含有噻唑环。
H N
O O
S CH3
N
CH3
COOH
青霉素G
整理课件
整理课件
(三) 咪唑
咪唑是无色晶体,熔点90℃~91℃,易溶于水和乙醇,具 有碱性,能与强酸生成稳定的盐。含咪唑环的药物如抗真菌 药克霉唑,抗阿米巴药、抗滴虫药、抗厌氧菌药甲硝唑等。
整理课件
三、重要的酰胺及其衍生物
(一)尿素
尿素简称脲,白色结晶,熔点为133℃,易溶于水和乙醇。
O H2N C NH2
整理课件
1.弱碱性
尿素分子中含有两个氨基,呈弱碱性,可与强酸生成盐。
硝酸脲
整理课件
2.水解反应
脲在酸或碱的催化下,加热时发生水解;在脲酶作用下, 水解反应在常温下就能进行。
CO( 2)2NH +2O脲 H 酶2 +3 CO 2NH CO(2N)2H + 2NaOH 2CO3 + N23aNH
N
N
N
O
S
N H
S
N
NN H
整理课件
一、杂环化合物的分类、命名
(一)分类
杂环
单杂环
五元杂环 六元杂环
苯稠杂环-苯环与杂环稠合 稠杂环
杂稠杂环-杂环与杂环稠合
整理课件
1.五元杂环
O
S
N
N
S
N
H
整理课件
N H
N N H
2.六元杂环
课时作业12 生产生活中的含氮化合物

课时作业12生产生活中的含氮化合物时间:45分钟满分:100分一、选择题(每小题4分,共44分)1.(2011·合肥模拟)通过一步反应不能直接完成的是:①N2→NO2'②NO2→NO'③NH3→NO'④NH3→NO2'⑤Cu→Cu(NO3)2'⑥HNO3→NO2()A.①⑥B.②⑤C.④⑤D.①④答案:D2.(2011·东莞模拟)下列变化中,属于物理变化的是()①加热氨水可得到氨气②氯化铵晶体受热后由试管底部移到试管上部③固体碘受热变成紫红色气体④液氨汽化⑤浓硝酸从无色液体变成黄色液体A.①③④B.③④C.②③④D.③④⑤答案:B3.如图利用培养皿探究氨气的性质。
实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。
下表中对实验现象所做的解释正确的是()4.在常温下向盛满水并倒置于水槽中的试管里先后通入4 mL NO2、4 mL NO、5 mL O2,经过一段时间后,试管里剩余的气体有()A .NOB .O 2C .NO 2和O 2D .NO 和O 2答案:B 5.有关氨气的实验较多,下面对这些实验的实验原理的分析中,正确的是( )A .氨气极易溶解于水的性质可以解释氨气的喷泉实验B .氨气的还原性可以解释氨气与氯化氢的反应实验C .铵盐的水溶性大是实验室中用NH 4Cl 和Ca(OH)2的混合物制取氨气的原因D .氨水的热稳定性较差可以解释实验室中用加热氨水的方法制取氨气答案:AD6.6.4 g 铜与过量的硝酸(8 mol·L -1 60 mL)充分反应后,硝酸的还原产物有NO 、NO 2,反应后溶液中含H +为n mol ,此时溶液中含NO 3-的物质的量为( )A .0.28 molB .0.31 molC .(n +0.2) molD .(n +0.4)mol答案:C7.13.8 g 63%的HNO 3溶液密度为1.38 g·cm -3和100 mL 13.8 mol·L -1的HNO 3溶液相比,正确的是( )A .都应用棕色广口瓶存储B .浓度不同的两种HNO 3(aq)C .溶液的体积不同但浓度相同D .均可与Au 反应而发生钝化现象解析:A 项,硝酸应装在棕色细口瓶中;B 项,63%的HNO 3溶液的物质的量浓度为13.8×63%63mol 13.81.38×10-3L =13.8 mol·L -1,两者浓度相同;C 项,13.8 g 63%的HNO 3溶液体积为13.8/1.38=10 mL ,两者体积不同;D 项,在浓硝酸中发生钝化的金属是铁和铝。
第12章 含氮化合物

(N为sp3,苯环的平面与氨基平面成39.4°) 苯胺是电子离域体系
NH2 NH2 NH2 NH2
Chapter 12
2. 构 型
N R1 R2
R3
R3
N
R2 R1
R
R
1
2
N
R
3
平面结构
E翻≈25 kJ· -1 mol
Chapter 12
12.4
胺的物理性质
12.4.1 12.4.2
一般物理性质 光波谱性质
仲胺 R1R2NH 季铵盐 R1R2R3R4N+X-
伯胺: CH3CH2NH2
乙胺 环戊胺
NH2
NH2
苯胺
NH
仲胺: CH3CH2 NHCH3
甲乙胺
(CH3CH2)2 NH
二乙胺
二苯胺
叔胺: (CH3CH2)3N
三乙胺
N(CH3)2
N,N-二甲基苯胺
Chapter 12
季铵盐:
+(CH3CH2)4 NBr
12.2.2
12.2.3
Chapter 12
12.2.1
a-氢的活泼性
O
R CH N H
O
硝基化合物的a-H有酸性:
CH3NO2 CH3CH2NO2
σ-π超共轭 -NO2 -I效应 -H很活泼
(CH3)2CHNO2 CH2(NO2)2
pKa 11
R CH N H
9
O O
OH + NaOH O
8
OH R C N H
迈克尔加成 (1,2-加成)
O2N COOCH3 NO2 R4NHO COOCH3
Chapter 12
氮和氮的化合物

N2H4(l)+O2(g)==N2(g)+2H2O(1) △rHθ=-
624kJ·mol-1
(2)二元弱碱
N2H4+H2O==N2H5++OH- K1=1.0×106(298K)
N2H5++H2O==N2H62++OH- K2=9.0×1016(298K)
(3)既作氧化剂又作还原剂:在酸性介质中是
强氧化剂;在碱性溶液中作强还原剂,能将
此时您正浏览在第25页,共116页。
2。性质(C级掌握)
(1)不稳定性:只要受到撞击立即爆炸而分解
2HN3==3N2+H2 △rHθ=-593.6kJ·mol-1
(2)弱酸性:为一元弱酸(K=1.9×10-5),与碱 或活泼金属作用生成叠氮化物。
HN3 + NaOH == NaN3 + H2O 2HN3 + Zn == Zn(N3)2 + H2
棕色可溶性的硫酸亚硝酰合铁(Ⅱ). FeSO4 + NO == [Fe(NO)]SO4
2。特殊生理作用
问题
16-2.10:请用分子轨道理论比较
NO+,NO,NO-的键长.(B级掌握)
此时您正浏览在第29页,共116页。
解:由分子轨道理论可知:它们的分子轨道排布式为:
NO+:(σ1S)2(σ*1S)2(σ2S)2(σ*2S)2(σ2Px)2
CuO,IO3-,Cl2,Br2等还原,本身被氧化为N2
4CuO + N H ==2Cu O + N O 此时您正浏览在第20页,共116页。
24
2
2 + 2H2
三:羟氨(NH2OH)
第12章 有机含氮化合物分析

12.1 硝基化合物的分类与结构
12.1.2 结构
硝基的结构: N
O
O N
共振杂化体
O O N-O键平均化,负电荷平均分布在 两个O原子上
O
O
通常写成
N
O
或
N
O
N:sp2杂化
在硝基苯中:
12.4.2 胺的结构
季铵化合物含有四个不同烃基时,可分离出 对映异构体:
(S)
(R)
COLLEGE OF CHEMISTRY AND MATERIALS SCIENCE, LYUN
12.5 胺的物理性质
1. 沸点
伯、仲胺能形成分子间氢键,沸点比相对分子质量相近 的烷烃高 N-H· · · N氢键比O-H· · · O氢键弱,沸点比相应的醇低
N
O
O
COLLEGE OF CHEMISTRY AND MATERIALS SCIENCE, LYUN
相对密度大于1; 不溶于水,溶于有机溶剂,溶于酸; 有毒;(勿触及皮肤,勿吸入蒸气) 多硝基化合物受热或振动易爆炸;
CH3 O2N NO2
12.2 硝基化合物的物理性 质 -NO2的极性强,硝基化合物具有较高的沸点;
2. 溶解度
伯、仲、叔胺都能与水形成氢键,低级胺溶于水
3. 毒性
大多数胺有毒;许多芳胺是致癌物
4. 气味
(CH3)3N 鱼腥味 H2N(CH2)4NH2 腐肉(味)胺 H2N(CH2)5NH2 尸胺
COLLEGE OF CHEMISTRY AND MATERIALS SCIENCE, LYUN
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
芳香伯胺
CH3
NH2
芳香胺 芳香仲胺 HN(C6H5)2
芳香叔胺 N(C6H5)3
NH2
NH
N CH3
NH2
NHCH3 N(CH3)2
3
2 胺的命名
① 简单的胺以习惯命名法命名:在 “胺”字前加以烃基的名称,称“某 胺”。
(C H 3)3C N H 2
叔 丁 胺
C H 2N H 2
N H 2
苯 甲 胺 ( 苄 胺 ) 环 己 胺
?
17
▪ 不符合Hofmann消除取向的例子
当β-碳上有强吸电子基团,或可形成共轭烯烃时, 往往不符合霍夫曼规律。
18
练习:写出下列化合物经过两次霍夫曼消除后的产物
CH3
N CH3
N ββ
N H
CH3①CH3I(过 量 ) ② AgO H
β N CH3OH △
CH3 CH3
CH 3
N CH 2 CH 3
N2 OH2,Ni T, P
N2 H
还原剂: Fe/HCl, Sn/HCl, SnCl2/HCl, FeCl2/HCl
NO2
NH2
Fe
HCl
NO2
NH2
(3) 选择还原
还原剂(弱): Na2S, NaSH, (NH4)2S(只还原一个硝基)
① C H 3I(过 量 ) ② A g O H
C H 2
N (C H 3)3 O H
△
CH2
19
3 酰基化和磺酰化反应
1)酰基化 在胺的N原子上引入酰基(亲核加成-消除)
应用:保护氨基或降 低氨基的致活性
NH2 + (CH3CO)2O
(orCH3COOH)
易三元溴代
易氧化
NHCOCH3
易一元溴代 不易氧化20
Br
如何得到一元溴代产物?
NH2
(CH3CO)2O
NHCOCH3
Br2
NHCOCH3
NH2
H2O/H+
Br
Br
25
2) 硝化反应
用混酸硝化苯胺时,可将苯胺氧化成焦油状物质。 故应先将苯胺溶于浓H2SO4 ,再硝化得间位产物:
--NH2为邻对位定位基;--NH3+为间位定位基
26
如何制备o-、p-NO2产物?
RNH2 NH2 NO2
NH
(CH3)3N N(CH3)2
NaNO2/HCl 0~5℃
N2 室温
N2
室低温温反应,水 解加热有气体
黄色油状物生成
无现象
绿色
24
温故知新 5 芳胺的亲电取代反应
-NH2:强活化基团,邻对位定位基 1) 卤化反应
NH2 + 3Br2 H2O
Br NH2Br (白 )(似苯酚,可检验苯胺)
可作表面活性剂、相转移催化剂。
12
2)季铵碱:
季铵碱 季铵碱具有无机碱的性质,碱性与无机碱相当。 有些季铵碱在生物体中存在着重要生理作用:
胆碱 [OHCH2CH2N(CH3)3]+OH以卵磷脂的形式在体内调剂脂肪的代谢;
乙酰胆碱 对动物神经有调节保护作用。
13
Hofmann 消除反应(重要)
含有β-H的季铵碱受热发生消除反应,脱去水和叔胺生成烯烃。
A
12含氮化合物
C
12. 2. 1 胺的分类、命名和结构
1 胺的分类:
根据氮上所连烃基的个数分为伯、仲、叔、季胺。 *注意: 伯、仲、叔胺与伯、仲、叔醇的不同涵义
叔碳
又可分为:脂肪族和芳香族胺;一元胺、二元胺等。
2
脂伯胺
CH2NH2
脂肪胺 脂仲胺 (CH3CH2)2NH
脂叔胺 (CH3CH2)3N
2) 磺酰化反应
黄色沉淀 黄色沉淀
----可用来分离、鉴别伯、仲、叔胺。 这一反应又称为兴斯堡反应。
21
4 与亚硝酸的反应(P349)
脂肪胺和芳香胺都可与亚硝酸反应生成不同产物: 1)伯胺:
22
2)仲 胺:
3)叔胺
脂肪胺不反应
黄色油状液体 R3NNHaC N 2 lO ╳
(绿色晶体)
23
不同的胺与亚硝酸反应现象不同,可用于鉴别 脂肪及芳香伯、仲、叔胺。例如:
烯烃
OH-离子进攻β-H原子,发生双分子消除反应。
14
Hofmann 消除的取向
比较:卤代烷(或醇)的消除取向—Saytzeff 取向15
Hofmann消除取向的解释
从β-氢的位阻和酸性的差别分析源自OHHHR
CH CH CH2
N (C H 3)3
16
Hofmann 消除反应举例
1) 2)
主要产物
H
RN
H R是 给电子基团, 使 N上 电 子 更 集 中 碱性增加。
N:sp3杂 化但有部 分sp2特征
孤对电子与苯环共轭,电 子云密度减弱,碱性减弱。
8
➢ 芳香胺之间的碱性比较
芳环上吸电子取代基使胺的碱性减弱,供电子基使增强。
碱性:
pKb:
13
9.4
8.6
芳胺中分享N上孤对电子的苯环愈多,碱性也就愈弱
9
例题 1 判断碱性强弱:
NH2
﹤
NO2
NH2
﹤
NH2
﹤
CH3
N H 3 ﹤ ﹤ CH3CH2NH2 (CH3CH2)2N H
2 如何解释苄胺(
)的碱
性与烷基胺基本相同,而与芳胺不同?
10
2)成盐反应及应用
胺能与许多酸作用生成盐:
N H 2H B r
N H 3 B rN aO H
N H 2
不溶于水
4
② 系统命名:把胺看作烃的氨基衍生物, 以烃为母体,氨基为取代基。
CH3 NH2 CH3-CH-CH2-CH-CH2-CH3
2-甲基-4-氨基己烷
CH3 CH3 CH3-CH-CH2-CH-N-CH2-CH3
CH2-CH3
2-甲基-4-(二乙氨基)戊烷
➢ 氮原子上同时连有芳香烃基和脂肪烃基的胺时,以芳 香胺为母体,脂肪烃基作为氮原子上的取代基。
5
➢季铵化合物的命名
它们的命名与无机盐、无机碱的命名原则相似。
NH4+Br-
NH4+OH-
注意“氨”、“胺”及“铵”的 含义 氨基 伯仲叔胺 铵盐/季铵类化合物
6
1 胺的碱性和成盐反应
1) 胺的碱性
胺的碱性强弱是电子效应、溶剂化效应和立体效应综 合影响的结果。不同胺的碱性强弱的一般规律为:
脂肪胺(仲>伯>叔)>氨>芳香胺
27
3) 磺化反应
28
6 胺的氧化
脂肪胺及芳香胺都容易被氧化。 久置空气中的氧可使苯胺由无色透明→黄→红棕。
苯胺遇漂白粉显紫色,可用该反应检验苯胺:
N H 2C a ( O C l ) 2 O N - N H 2 ( 紫 色 )
29
12.2.4 胺的制法
1. 硝基化合物还原 (1) 催化氢化 (2)酸性还原
溶于水
不溶于水
利用这一性质可分离、提纯不溶于水的胺类化合物。 由于铵盐的水溶性较大,所以含有氨基、亚氨基或 取代氨基的药物常以铵盐的形式供用。
11
2 烷基化和季铵碱的热反应
1)烷基化:胺与卤代烃等烷基化试剂反应
伯胺
仲胺
仲胺
叔胺
季铵盐
叔胺
❖ 季铵盐:胺彻底烃基化的产物
季铵盐在有机相和水中都有一定的溶解度,
