8.2 配合物的化学键理论
第二章 配合物的化学键理论

第二章配合物的化学键理论配合物的化学键理论:中心离子与配位体之间的化学键。
第一节配合物的静电理论静电理论的基本观点:认为中心离子是带正电荷的粒子,而配位体是带负电荷的粒子,配合物中的配位键是由单纯的静电相互吸引而形成的,形成配合物的结合能有两项:1 配体与中心离子的吸引能2 配体与配体之间的排斥能U结合=U吸引+U排斥有一些现象不能很好解释:配体一定时,半径相近的金属离子与之形成的配合物的稳定性应相近。
如Na b半径为0.95, Cu+半径为0.96形成的配合物的稳定性却相差很大改进的静电理论:静电极化理论,即中心离子和配位体在静电的作用下,相互会产生变形,中心离子的正电荷可吸引配体的电子,而配体的负电荷则排斥中心离子的电子。
1 自己变形两方面的作用2 使对方变形Na b , K+ , Mg2+ , Ca2+等离子,具有8电子结构,极化弱,因而与配体配位时,变形小Cu2+,Ag+ , Zn2+ , Cd2+等离子,具有18电子结构,极化强,与配体配位时,变形大规则:中心离子具有较强的极化作用或变形性强,与变形性强的配位体配位时,形成的配合物稳定静电理论的评价:提出较早,对早期的配合物的化学键理论有贡献。
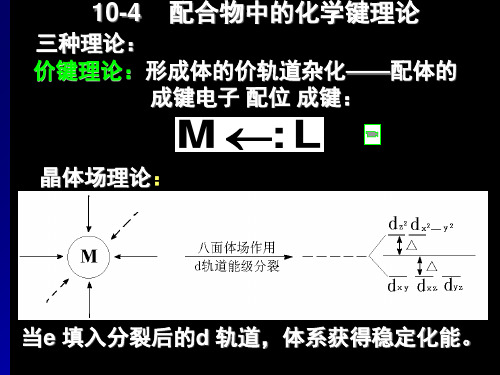
不足之处:1 不能解释象Ni(CO)4这样的配合物2 不能解释配合物的磁性和光谱第二节价键理论Sidywich 的配键理论主要的价键理论 Pauling 的电价和共价配位理论 Taube 的内轨和外轨理论主要介绍的价键理论的内容:1 Pauling 提出的杂化轨道理论 2 Taube 提出的内轨和外轨理论 IIIB IVB VB VIB VIIB VB IB IIB Sc Ti V Cr Mn Fe Co Ni Cu Zn 3d 1 4S 2 3d 2 4S 2 3d 3 4S 2 3d 5 4S 1 3d 5 4S 2 3d 6 4S 2 3d 7 4S 2 3d 8 4S 2 3d 94S 13d 10 4S 2Pauling 杂化轨道理论,用于处理配合物的形成其基本假设:中心离子,主要指过渡金属离子的价电子层中能量相近的(n-1)d, ns, np 或nd 轨道杂化后,形成能量等同的杂化轨道,接受配体的孤对电子而形成配合物,Pauling 称这种成键方式形成的为共价配合物。
第四章 配位键和配位化合物第二节 配合物的化学键理论

中心离子的氧化数相同,随半径增大,d电子离核越远,受晶体场 的影响越大,分裂能越大。如
[CrCl6]3- △○=162.7kJ.mol-1 [MoCl6]3- △○=229.7kJ.mol-1
2023/2/19
20
型
数
dxy
dyz
dxz
Dx2-y2
dz2
△
正八面体 6 -4.00 -4.00 -4.00 6.00 6.00 10.00
正四面体 4 1.78 1.78 1.78 -2.67 -2.67 4.45
平面正方 4 2.28 -5.14 -5.14 12.28 -4.28 17.42
直线
2 -6.28 1.14 1.14 -6.28 10.28 16.56
2023/2/19
9
●内轨型配合物
——定义 中心离子以部分次外层轨道((n-1)d轨道)与外层轨 道(ns、np轨道)杂化,再与配体成键 ——特点
•配体对中心离子影响大 •d轨道电子排布发生了变化,未成对电子数减小,磁性减小 •配位键稳定性强,键的共价性较强,水溶液中较难离解为简 单离子 ——示例 [Ni(CN)4]2-、[Fe(CN)6]3-、Fe(CO)5、[Cr(H2O)6]3+
4d
5s
5p
sp杂化
2023/2/19
3
(2)配位数为4的配合物 有两种构型。例,Ni2+
3d
4s
4p
●四面体构型 例,[Ni(NH3)4]2+。sp3杂化
3d
4s
4p
sp3杂化 ●平面正方形构型 例,[Ni(CN)4]2-,dsp2杂化,方向指向平面正 方形的四个顶点,Ni2+位于中心,4个CN-分占4个角顶
配合物中的化学键

对配体 CN-, △0= 30,000 cm-1 ; P =26,500 cm-1
将△0, P值代入上式,得 CFSE=-7,000 cm-1,
因此 Fe(CN)63- 取低自旋构型。
例 2 Co3+ (d6), 对 CoF63如果取高自旋,则 CFSE= -4Dq=-0.4 △0 ; 如果取低自旋,则 CFSE= -24Dq+2P= -2.4△0+2P 对配体 F-, △0= 13,000 cm-1 ; P =17,800 cm-1 将 △0, P 值代入上述两式,对高自旋,得 CFSE=-5,200 cm-1; 对低自旋,得 CFSE=4,400 cm-1, 因此CoF63- 取高自旋。
对 Co(H2O)63+, △0= 18,600 cm-1 ; P =17,800 cm-1
将 △0, P 值代入上述两式, 对高自旋,得
CFSE= -7,440 cm-1; 对低自旋,得 CFSE=
-8,080 cm-1, 因此Co(H2O)63+ 取低自旋构型。
分裂能有如下规律: a) 配体场的类型
处于高氧化态的中心离子经常形成低自旋配合物。
c) 中心离子的性质 同族元素由上到下, △o依次增加: 3d 4d △o 增加 40~50%; 4d 5d △o 增加 20~25% 例如, Co(NH3)63+ △o =22,900 cm-1 Rh(NH3)63+ △o =34,100 cm-1 Ir(NH3)63+ △o =41,000 cm-1 因此第二、第三系列过渡金属几乎都形成低自 旋配合物.
2、晶体场理论
几乎与价键理论同时,H.Bethe和J.H.Vleck在对晶体结 构的研究中先后与1929年和1932年提出了晶体场理论, 但到20世纪50年代才开始广泛用于处理配合物的化学键 问题。晶体场理论与价键理论不同,它不是从共价键角 度考虑配合物的成键,而是一种静电理论,它把配合物 的中心离子和配体看做是点电荷,在形成配合物时,带 正点荷的中心离子和带负电荷的配体以静电相吸引,配 体间则相互排斥。晶体场理论还考虑了带负电荷的配体 对中心离子最外层电子,特别是d电子的排斥作用。它把 由带负电荷的配体对中心离子产生的静电场叫做晶体场。
配合物的化学键理论

12
根据这个结构, 可以推测 Cu2+的配合物应当很容易地失去未配对的4p电子而迅速氧化为Cu3+, 但事实并非如 此。
因此, 价键理论有其局限性。它被配位场理论或分子轨道理论取代是必然的。
13
4.2 晶体场理论 1929年由Bethe提出, 30年代中期为Van Vleck等所发展, 及Puling的价键理论处于同一时代, 但当时并未引起
17
由于电子的总能量, 亦即各轨道总能量保持不变, eg能量的升高总值必然等于t2g轨道能量下降的总值, 这就是所谓的重 心守恒原理(原来简并的轨道在外电场作用下如果发生分裂, 则分裂后所有轨道的能量改变值的代数和为零)。
将eg和t2g这两组轨道间的能量差用△o或10Dq来表示, △o或10 Dq称为分裂能, 根据重心守恒原理, 则
的伸展较3d轨道远, 5d轨道在空间的伸展又比4d轨道远, 因而易受到配体场的强烈作用。
27
(4) 配体的本性 将一些常见配体按光谱实验测得的分裂能从小到大次序排列起来, 便得光谱化学序:
这个化学序代表了配位场的强度顺序。由此顺序可见:对同一金属离子, 造成△值最大的是CN-离子, 最小的是I -离子, 通常把CN-、NO2-等离子称作强场配体, I-、Br-、F-离子称为弱场配体。
优点:能够说明一些配合物的配位数、几何构型和稳定性。 缺点:将中心原子和配体都看作是没有内部结构的点电荷——离子键,不能说明配合物的磁学性质和光学性质。
3
➢价键理论 Sidgwick(1923)和Pauling(1928)提出了配位共价键模型,考虑了中心原子和配体的结构,能较好地说明许多配
合物的配位数、几何构型、磁性质和一些反应活性等问题。
显然, 配合物的配位数就是中心原子在成键时动用的空轨道数。
配合物的价键理论

sp sp2 sp3 d2sp2 d2sp3
直线型 三角形 正四面体 四方锥
正八面体 [Fe(CN)6]4-
一定程度上解释了配合物的磁学性 质
顺磁性的[Ni(H2O)6]2+:
•• •• •• •• •• ••Fra bibliotek3d4s
4p
4d
sp3d2杂化,外轨型
3、 价键理论的缺点
i. 不能预测配合物的高、低自旋状态
称为光谱化学序列 说明: (1)即配位场强的顺序,几乎和中心离子无关。 说明: )即配位场强的顺序,几乎和中心离子无关。 (2)强场配位体:∆o大 )强场配位体: 者 弱场配位体: 弱场配位体:∆o小者
值随中心离子而改变。 ②当配位体固定时, △o值随中心离子而改变。 当配位体固定时, A、中央离子电荷愈高,△o值愈大。 、中央离子电荷愈高, 值愈大。 例如
个配体需要6个杂化轨道 解:6个配体需要 个杂化轨道 d2sp3或 sp3d2 个配体需要 或
Mn2+ 3d5:
µ实测表明有1个单电子:
有2个内层空d轨道,采取d2sp3杂化; 八面体,内轨型,较稳定
2、价键理论的优点 很好地解释了配合物的空间构型和配位数
配位数 2 3 4 5 6 杂化轨道 空间构型 举例 [Ag(CN)2][CuCl3]2[MnCl4]2NiBr3(PR3)
⑴定义 d电子从未分裂的d轨道进入分裂的d轨道所产生的总能量下降 值,称为晶体场稳定化能,并用CFSE表示。 dz2, d(x2-y2) eg 10Dq
6Dq
Es
自由离子d轨道 球形场
4Dq
dxz,dxy,dyz
t2g
d轨道在Oh场中轨道能级的分裂图
量子力学指出:
配合物的价键理论

配合物的价键理论配合物中的化学键主要是指配合物内中心离子(或原子)M与配体L之间的化学键。
中心离子和配体之间通过什么样的作用力结合在一起?这种结合力的本质是什么?为什么配离子具有一定的空间构型而稳定性又各不相同?19世纪末,维尔纳(Werner A)曾试图回答这些问题,但没有成功。
直到20世纪,在近代原子和分子结构理论建立以后,用现代的价键理论以及晶体场理论、配位场理论和分子轨道理论,才较好地阐明了配合物中化学键的本质。
1931年鲍林首先将分子结构的价键理论应用于配合物,后经他人修正补充,逐步完善成配合物的现代价键理论。
1.配合物价键理论的要点(1) 中心离子(或原子)M与配体L形成配合物时,中心离子(或原子)以空的价轨道接受配体中配位原子提供的孤对电子,形成σ配键(用M←L表示)。
(2) 中心离子(或原子)所提供的空价轨道必须杂化,与配位原子的充满孤对电子的原子轨道相互重叠,形成配位共价键。
2.中心离子轨道杂化的类型在配合物的形成过程中,中心离子需提供一定数目的经杂化的能量相同的空的价轨道与配体形成配位键。
中心离子所提供的空轨道的数目,由中心离子的配位数所决定,故中心离子空轨道的杂化类型与配位数有关。
中心离子空轨道的杂化类型除了前面讲过的sp、sp2、sp3杂化外,能量相近的(n-1)d,n d轨道也能参与杂化。
(1) 配位数为2的中心离子的杂化类型讨论[Ag(NH3)2]+ 配离子的形成Ag+离子的价电子层结构为:Ag+离子和NH3形成[Ag(NH3)2]+配离子时,配位数为2,Ag+需提供二个空轨道。
Ag+离子外层能级相近的一个5s和一个5p轨道经杂化,形成二个等价的sp杂化轨道,容纳二个NH3中二个配位N原子提供的二对孤对电子,形成二个配键(虚线内杂化轨道中的共用电子对由配位氮原子提供):[Ag(NH3)2]+4d sp杂化轨道5p47Ag+(4d10)4d5s5p两个sp杂化轨道在空间成180°,故[Ag(NH3)2]+配离子的空间构型呈直线形。
配合物化学键理论

强场:o > P 弱场:o < P
d5 型
强场o > P
弱场o < P
(4) 影响CFSE的因素 ① d电子数目; ② 配位体的强弱; ③ 晶体场的类型
表1 过渡金属络离子的稳定化能(CFSE)
弱场CFSE/Dq
dn d0 离子 Ca2+,Sc3+ 正方型 0 正八面体 0 正四面 体 0 正方型 0
中心离子用外层(n-1)d,ns,np杂化轨道与电负性 较小的配位原子,如CN-、NO2-等形成内轨型配合 物。例如[Fe(CN)6]3-配离子,Fe采用d2sp3内轨型 杂化轨道,配合物的键能大,稳定,在水中不易 离解。
(3)内、外轨型配合物的测定---磁矩
由磁矩可判断内轨或外轨型配合物
s n—分子中未成对电子数
z
y
x
x
dz2
y z
dx2-y2
z
x
x
y
dxy
dxz
dyz
1.分裂能 (1)分裂能与配合物几何构型的关系
八面体型的配合物
在八面体型的配合物中,6个配位体分别占据八 面体的6个顶点,由此产生的静电场叫做八面体场。
(1)八面体场
八面体场中d轨道能级分裂
dz2 dx2-y2 eg 3 5 Δo =6Dq Δ o =10Dq 2 5 Δ o = 4Dq t2g dxy dxz dyz
[CrCl6]313600
[MoCl6]319200
分裂能与配位体的关系:光谱化学序列
[CoF6]3- [Co(H2O)6]3+ [Co(NH3)6]3+ o/cm-1 13000 18600 22900 [Co(CN)6]334000
2013-第三章--配合物的化学键理论解析

与羰基配合物成键过程相似,CN-配体中C上的 孤电子对向金属的杂化空轨道配位,形成σ配键,金 属的d电子向CN- π* 轨道配位,形成d-pπ配键。
(3) 烯烃配合物
1827年,Zeise合成了K[ PtCl3(C2H4) ]·H2O,这是第 一个有机金属化合物,但其结构直到120多年后才确定。 乙烯的成键π电子向铂的杂化轨道配位,按成键的对称 性应为σ配键;金属d轨道的电子向乙烯的 π* 轨道配位, 形成d-pπ配键。
z
y x
1. d轨道的分裂
dz2
dyz
dxz
dx2-y2
z
y
x
dxy
d 轨道分裂情况 八面体场中:
dz2 , dx2-y2, 轨道能量升高 (eg 或 dγ) dxy, dyz, dxz 轨道能量降低 (t2g 或 dε) 四面体场中:
dz2 , dx2-y2, 轨道能量降低 (eg) dxy, dyz, dxz 轨道能量升高 (t2g)
dx2-y2
x y
极大值指向面心
dxy
x
y
极大值指向棱的中点
1. d轨道的分裂 ( 在Oh场中的分裂 )
分裂能 o = 10 Dq 场强参数Dq: D—中心离子的
极化度 q:配体电荷
Dq具有能量单位
重心守恒原理: 分裂前后五个d轨 道的总能量相等
没有不成对电子
稳定性:内轨型配合物 > 外轨型配合物
根据实验测得的有效磁矩,判断下列各种离子分
别有多少个未成对电子?哪个是外轨?哪个是内轨?
① Fe (e n22)
5.5 B.M.
晶体场理论

影响分裂能的因素
△o/(kJ· mol-1)
六
[Ir(NH3)6]3+
490
第 8章 配位化合物 第8章 配位化合物 第8章 配位化合物 8.2 配位化合物的化学键理论
4.电子成对能和配合物高 低自旋的预测
、
电子在分裂后轨道上的分布: 遵循能量最 低原理, 泡利不相容原理和洪德规则
如 Cr3+ d3
波长(或能量) 243kJmol-1 发生d-d 跃迁, 最大吸收峰在490nm(蓝绿光) 处,所以呈紫红色
↑ ↑ ↑ ↑ ↑ ↑ ↑
↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑ ↑
d1 ↑ d2 ↑ ↑ d3 ↑ ↑ ↑ d4 ↑ ↑ ↑ d5 ↑ ↑ ↑ d6 ↑ ↑ ↑ d7 ↑ ↑ ↑ d8 ↑ ↑ ↑ d9 ↑ ↑ ↑ d10 ↑ ↑ ↑
↑ ↑ ↑ ↑ ↑
eg 电子数 t2g 1 ↑ 2 ↑↑ ↑↑↑ 3 ↑ ↑↑↑ 4 高 ↑↑ ↑↑↑ 5 ↑↑ 自 4 ↑↑↑ ↑↑ 旋 3 ↑↑↑ ↑↑ ↑↑↑ 2 ↑↑ ↑↑↑ 1 ↑↑ ↑↑↑ 0
△o <P, 形成高自旋配合物 △o >P, 形成低自旋配合物
第 8章 配位化合物 章 配位化合物 第8章 配位化合物 8.2 配位化合物的化学键理论 弱场 第8 强场 未成对 未成对
eg 电子数 t2g eg 电子数 d1 ↑ 1 ↑ 1 d2 ↑ ↑ 2 ↑↑ 2 ↑↑↑ d3 ↑ ↑ ↑ 3 3 4 3 ↑↑ ↑ ↑↑↑ 1 d 4 2 d d ↑ 构型的离子 ,d 电子分布只有一种形式 ↑↑↑ d5 ↑ ↑ ↑ ↑ ↑ 5 1 ↑↑↑ d6 ↑ ↑ ↑ ↑ ↑ 4 0 87 10构型的离子, d电子分布只有一种形式 d d ↑ ↑↑ ↑↑↑ ↑ d ↑↑ 3 1 8 ↑↑ ↑↑ ,d ↑↑↑ ↑↑ d4 2 2 d7↑ 构型的离子 电子分布有两种形式 ↑↑↑ ↑↑ d9 ↑ ↑ ↑ ↑ ↑ 1 1 ↑↑↑ ↑↑ d10 ↑ ↑ ↑ ↑ ↑ 0 0
配合物中的化学键理论.
例:(见例4、例6、)
8
②、内轨型配合物: A、定义: 指形成配合物时,中心离子提供外层 ( ns,np ) 和 次 外 层 空 轨 道 (n - 1)d 进 行 杂 化而与配体结合所形成的配合物。 B、特点: a、提供外层(ns, np)和次外层空轨道 (n-1)d进行杂化成键。 b、杂化类型为:dsp2和d2sp3杂化。 c、配合物有较少(或没有)未成对电子数。
10
例 : [Co(NH3)6]2+ 为 外 轨 型 , 则 [Co(NH3)6]3+为内轨型。 D、内轨型配离子的稳定性大于外轨型配离 子。
原因:由于次外层轨道能级比最外层的 低。
11
内容小结:
①:杂化——构型——类型
n M用以杂 杂化 空间构型 类型 化的轨道 轨道
示例
2 ns、np sp 直线型
外层轨道
成键类型: 外轨配键
内轨配键
配合物的类型: 外轨型
内轨型
成单电子状态: 高自旋
低自旋
空间构型
正四面体
平面正方形
5
规律:中心离子dsp2 杂化,配离子的空间构 型为平面正方形。
类似有:[Cu(NH3)4]2+、[Pt(NH3)4]2+等。
③、配位数为6的配离子 也有两种成键方式
A、以 SP3d2 杂化轨道成键: 例:
Ag(NH3)2+
4 ns、np sp3 正四面体 外轨型 Ni(NH3)42+
(n-1)d、 dsp2 平面四方 内轨型 Ni(CN)42ns、np
6 ns、np、 sp3d 正八面体 外轨型
nd
2
配合物的化学键理论

配合物的化学键理论The Chemical Bond Theories of Complexes配合物的化学键理论处理中心原子(或离子)与配体之间的键合本质问题,用以阐明中心原子的配位数、配位化合物的立体结构以及配合物的热力学性质、动力学性质、光谱性质和磁性质等。
几十年来,提出来的化学键理论有: 静电理论(EST) Electrostatic Theory 价键理论(VBT) Valence Bond Theory 晶体场理论(CFT) Crystal Field Theory分子轨道理论(MOT) Molecular Orbital Theory 角重叠模型(AOM) Angular Overlap Model在这一节中,我们讲授配合物的价键理论和晶体场理论。
分子轨道理论和角重叠模型在后续课程中学习。
一、价键理论(Valence Bond Theory )L .Pauling 等人在二十世纪30年代初提出了杂化轨道理论,首先用此理论来处理配合物的形成、配合物的几何构型、配合物的磁性等问题,建立了配合物的价键理论,在配合物的化学键理论的领域内占统治地位达二十多年之久。
1.价键理论的基本内容:(1) 配合物的中心体M 与配体L 之间的结合,一般是靠配体单方面提供孤对电子对与M 共用,形成配键M ←∶L ,这种键的本质是共价性质的,称为σ配键。
(2) 形成配位键的必要条件是:配体L 至少含有一对孤对电子对,而中心体M必须有空的价轨道。
(3) 在形成配合物(或配离子)时,中心体所提供的空轨道(s 、p ,d 、s 、p 或s 、p 、d)必须首先进行杂化,形成能量相同的与配位原子数目相等的新的杂化轨道。
2.实例:(1) 主族元素配合物 Be 4O(CH 3COO)6:每个Be 原子都采取sp 3杂化-4BF :B 原子为sp 3杂化,正四面体构型 -36AlF :-3][ Al 3+周围共有12个价电子 Al 3+采取sp 3d 2杂化 (2) 过渡元素配合物a .(n - 1)d 10电子构型中心体+243)Zn(NH sp 3杂化 正四面体-3HgI sp 2杂化 平面三角形b .(n - 1)d 8电子构型中心体F Al F F F FF+243])[Ni(NH sp 3杂化 正四面体 -24]Ni(CN)[ dsp 2杂化 平面四方-24PtCl dsp 2杂化 平面四方c .(n - 1)d x (x <8)电子构型中心体-36Fe(CN) d 2sp 3杂化 正八面体+363])[Co(NH d 2sp 3杂化 正八面体 +263])[Co(NH sp 3d 2杂化 正八面体-36FeF sp 3d 2杂化 正八面体3.讨论:(1) 配合物中的中心体可以使用两种杂化形式来形成共价键:一种杂化形式为(n - 1)d 、n s 、n p 杂化,称为内轨型杂化。
无机化学第8章

17
配体命名顺序:
(1)先无机配体,后有机配体。
(2)先阴离子,后中性分子。
( 3 )同类配体(指有机或无机类)接配位原子 元素符号的英文字母顺序排列。
18
( 4)某些配体具有相同的化学式,但由于配位原子不同
而有不同的命名,
NO2– 硝基(N配位) ONO– 亚硝酸根(O配位)
SCN– 硫氰酸根(S配位) NCS– 异硫氰酸根(N配位)
[Co(NH3)6]2+ 外轨型
[Co(NH3)6]3+ 内轨型
(3)配位原子的电负性 电负性较大的配位原子易形成外轨型配合物;电 负性较小的配位原子较易形成内轨型。
33
四、配合物的稳定性、磁性与键型的关系
1. 配合物的稳定性与键型的关系 Fe3+ 外轨型 内轨型
电子成对能
外轨型配合物 < 内轨型配合物
N O
四、配位数
配位数:在配位个体中与一个形成体成键的配位
原子的总数称为该形成体的配位数。
单齿配体:
配位数 = 配体数
多齿配体:
配位数=配位体数×每个配位体的配位原子数
13
影响配位数的因素:
1. 中心离子
电荷↑ 配位数↑
Pt2+ [PtCl4]2– Pt4+ [PtCl6]2–
34
2. 配合物的磁性与键型的关系
电子皆已成对 反磁性 有成单电子 顺磁性
μ n n+2
(波尔磁子记作B.M)
μ>0具有顺磁性,μ=0具有反磁性 测定 μ值 计算
35
单电子数
根据 n 0
n(n 2) 可用未成对电子数目n估算磁矩µ 。
1 2 3 4 5
配合物的化学键理论

K[PtCl5(NH3)] 五氯一氨合铂(Ⅳ)酸钾
2020/6/15
再如:
[Zn(OH)(H2O)3]NO3 硝酸一羟基三水合锌(Ⅱ)
[Co(NH3)5 (H2O)]Cl3 氯化五氨一水合钴(Ⅲ)
[Fe(CO)5]
五羰(基)合铁
[Co(NO2)3 (NH3)3] 三硝基•三氨合钴(Ⅲ)
[Ca(EDTA)]2- 乙二胺四乙酸根合钙(Ⅱ)配离子
2020/6/15
试试看: [CoCl(NH3)(en)2]SO4 命名: 硫酸 一氯 一氨 二(乙二胺)合钴(Ⅲ)
内界:
[CoCl(NH3)(en)2]2+
外界:
SO42-
中心原子: Co3+
配位体: Cl- NH3 en 配位原子: Cl N
配位数:
6
2020/6/15
配合物的分类
螯合物: 一个中心原子与多齿配体成键形成具有
H3N OH
反式 trans-
HO NH3
草酸 草酸
H3N O Pt
H3N O
Pt
H3N OH 不能反应
O C
CO
两种不同的二氯二氨合铂异构体具有不同的化学性质, 顺2式020/具6/15有抗癌活性,而反式则没有。
第二节 配合物的化学键理论
一.价键理论 (一)理论要点
1.中心原子与配体之间通过配位键形成配离子。 配位键:特殊的共价键。 一方提供共用电子,另一方提供空轨道。 如 NH4+等
向进攻配离子时,dz2、dx2-y2轨道和配位体处于迎头相 碰的状态,这些轨道受负电荷配体的静电排斥较大, 因而能量升高。而dxy dxz dyz不处于迎头相碰的状态, 因而能量降低。
配位化合物:配合物的化学键理论

3
sp2 等边三角形 [CuCl3]2-
4
sp3 正四面体形 [Ni(NH3)4]2+
dsp2
正方形 [Ni(CN)4]2-
5
dsp3 三角双锥形 [Fe(CO)5]
6
sp3d2 正八面体形
[CoF6]3-
d2sp3
[Co(CN)6]3-
8.2 配位化合物的化学键理论
[CoF6]3-—— 正八面体
正方形 [Ni(CN)4]2-
5
dsp3 三角双锥形 [Fe(CO)5]
6
8.2 配位化合物的化学键理论
[Fe(CO)5]—— 三角双锥体
Fe价层电子结构为
3d
3d
[Fe(CO)5]
4s 4p
5CO
dsp3
8.2 配位化合物的化学键理论
配位数 杂化类型 几何构型
实例
2
sp
直线形 [Hg(NH3)2]2+
中心原子或离子与电负性较小的配 位原子,形成内轨配键。这种配位 键, 离子性成分较小,共价键成分 较大,又称共价配键。
8.2 配位化合物的化学键理论
2. 配合物的稳定性、磁性与键型关系
稳定性 同一中心离子形成相同配位数
的配离子, 稳定性: 内轨型 > 外轨型
[FeF6]3-[Fe(CN)6]3[Ni(NH3)4]2+[Ni(CN)4]2
0 反磁性
/B.M.
2.83
0
— 磁矩,单位为波尔磁子, 符号 B.M.
=√n(n+2) n — 未成对电子数
8.2 配位化合物的化学键理论
=√n(n+2)
n(未成对电子数) 0 1 2 3 4 5
第三章配合物的化学键理论

d x2-y2
d
dz2
dxy
dxy , dyz , dxz dyz , dxz
八面体场中Ni2+ (d8)的电子排布 C不FS发E生= 0畸变(t2g6eg2)
无论采用哪一种几何畸变, 都会 引起能级的进一步分裂, 消除简并, 其 中一个能级降低, 从而获得额外的稳 定化能(左图为第一种情况的能级图)。
根据△G=△H -T△S=-RTlnK, 配合物的稳定性将 由△G决定, 由于各种配合物的△S相差不大, 所以主要决 定于△H, 显然, △H值越负, 则MLm愈稳定。
设m=6、4……时, 上述配合反应的△H值为 △H正八面体=6△bH(M-L)-CFSE正八面体 △H正四面体=4△bH(M-L)-CFSE正四面体 △H正方形 =4△bH(M-L)-CFSE正方形 ……
思考题:
组态为d1-10的离子在八面体对称场中 有哪些可能的电子排布?
eg d
t2g
㈢ 自旋交叉(Spin Crossover)
高自旋(HS) T⇌/h低自旋(LS)
例:配合物[Fe(phen)2(NCS)2]
NN
N F e N CS
N N CS
粉红色
H S (t2g4eg2)
白色
具有这种性质的物质 在一种持久外场的微 扰下 ,就能发生一种 稳定态向另一种稳定 态的转变 ,从而达到 信息储存和开关的作用。
L S (t2g6eg0)
T
FeII(phen)2(NCS)2的变温磁化率图
2-5 晶体场稳定化能(CFSE) •晶体场稳定化能(CFSE)
定义:由于d轨道的分裂所造成的体系总 能量的降低,即稳定性的增加
eg
6 Dq
t2g -4 Dq
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[Co(CN)6]3-—— 正八面体
3d
d2sp3
价电子发生重排
轨道杂化类型与配位个体的几何构型 配位数 杂化类型 几何构型 实例 2 sp 直线形 [Hg(NH3)2]2+ 3 sp2 sp3 dsp2 dsp3 sp3d2 d2sp3 等边三角形 [CuCl3]2-
4
5
正四面体形 [Ni(NH3)4]2+ [Ni(CN)4]2正方形 三角双锥形 [Fe(CO)5]
3. 分裂能及其影响因素 分裂能
分裂能——中心离子d轨道能级分裂后,
最高能级和最低能级之差。
△o=Eeg -
Et2g
单位:cm-1或kJ.mol-1
eg
E E0
t2g 自由离子 球形场中 八面体场
Es
△o
影响分裂能的因素
配合物的几何构型 同种配体
一般 △o > △t
4 △ t = 9 △o
o:八面体场 t:四面体场
此类配离子还有:[Cu(NH3)4]2+、[PtCl4]2-、 [Cu(CN)4]2-、[PtCl2(NH3)2]
轨道杂化类型与配位个体的几何构型 配位数 杂化类型 几何构型 实例 2 sp 直线形 [Hg(NH3)2]2+ 3 sp2 sp3 dsp2 dsp3 等边三角形 [CuCl3]2-
4
轨道杂化类型(全为等性)与配位个体的几何构型
配位数 杂化类型 几何构型 实例 2 sp 直线形 [Hg(NH3)2]2+
3
4
5
6
配合物几何构型
[Hg(NH3)2]2+——直线形
Hg2+价层电子结构为 [Hg(NH3)2 ]2+
5d 5d 6s 6p
2NH3
sp
价电子未重排
同类配离子还有: [Ag(CN)2]- [CuCl2]- [Ag(NH3)2]+ 4d10 3d10
价键理论的优缺点
优点:简单明了,易于理解和接受, 可以解释配离子的几何构型 及某些化学性质和磁性等。 缺点:不能定量地说明配合物的性质。 如不能解释配离子的颜色等。
8.2.2 晶体场理论(crystal field theory)
中心思想——静电理论 视中心离子和配体为点电荷,带正
电荷的中心离子和带负电荷的配体以
中心离子的电子构型
离子的电 形成配合物类型 形成体实例 子构型 d10 Cu+、Ag+、Zn2+ 外轨型 d8 大多数为内轨型 Ni2+、Pt2+、 Pd2+ d4~d7 内轨型、外轨型 Fe3+、Co2+ 、 3+ Co 视配体而定
配位键类型——内轨配键、外轨配键
影响因素: 中心离子的电荷 电荷增多,易形成内轨型配合物。 (对配位原子的孤电子对引力增强,以 有利于以其内层d轨道参与成键) [Co(NH3)6]2+ 外轨型配合物 [Co(NH3)6]3+ 内轨型配合物
静电相互吸引,配体间相互排斥。
考虑了带负电的配体对中心离子最 外层的电子的排斥作用,把配体对中
8-2-2 晶体场理论
心离子产生的静电场叫作晶体场。
1. 基本要点
中心离子和配体之间仅有静电的相互吸 引和排斥作用。 中心离子的5个能量相同的d轨道受周围 配体负电场的不同程度的排斥作用,发 生能级分裂,有的轨道能量升高,有的 能量降低。 由于d轨道的能级分裂,d轨道的电子需 重新分布,使体系能量降低,即给配合 物带来了额外的稳定化能。
4
5
正四面体形 [Ni(NH3)4]2+ [Ni(CN)4]2正方形 三角双锥形 [Fe(CO)5]
6
sp3d2
d2sp3
正八面体形
[CoF6]3[Co(CN)6]3-
[CoF6]3-—— 正八面体 价电子未重排 Co3+价层电子结构为
3d 4s 4p 4d 3d
6Fsp3d2
[CoF6]36CN-
sp3
外轨型 107. 96 <
dsp2
内轨型 1031. 3
[Ni(NH3)4]2+ [Ni(CN)4]2Байду номын сангаасNi2+的d电子构型 d8 杂化轨道 sp3 dsp2 配键类型 外轨型 内轨型 未成对电子数 2 0 磁性 顺磁性 反磁性 2.83 0 /B.M.
磁性
=√n(n+2)
—磁矩,单位为波尔磁子,符号 B.M.
根据磁矩的值判断内轨型或外轨型配合物
练习:p245思考题4 p245思考题5:CN-作配体全部形成内 轨配合物
性质比较
比较类型 内轨 外轨
杂化轨道类型 dsp2 d2sp3 d2sp3 sp,sp2,sp3,sp3d2 形成体电子分布 磁矩 键的离子性 稳定性 价电子重排 较小 较弱 较稳定 不重排 较大 较强 较不稳定
5
正四面体形 [Ni(NH3)4]2+ [Ni(CN)4]2正方形 三角双锥形 [Fe(CO)5]
6
[Fe(CO)5]—— 三角双锥体
Fe价层电子结构为
3d 4s 4p
5CO
[Fe(CO)5]
3d dsp3
价电子发生重排
此类型配离子还有 [Co(CN)5]3-
轨道等性杂化类型与配位个体的几何构型 配位数 杂化类型 几何构型 实例 2 sp 直线形 [Hg(NH3)2]2+ 3 sp2 sp3 dsp2 dsp3 等边三角形 [CuCl3]2-
2. 正八面体场中d轨道的能级分裂
无外电场作用下的d轨道
Ed = Ed = Ed = Ed = Ed
xy xz yz x2-y2
z2
在带负电荷均匀球形场的作用下,d轨 道能量均升高相同值,能级不发生分裂。
在呈八面体配体负电场(八面体场)的作 用下,d轨道能级发生分裂。 eg E Es t 2g E0 自由离子 球形场中 八面体场
3d 4s 4p
价电子未重排
[Ni(NH3)4]2+
3d
4NH3
sp3
这类配离子还有:[Zn(NH3)4]2+、[HgI4]2-、 [Ni(CO)4]、 [CoCl4]2-
[Ni(CN)4]2-—— 正方形 Ni2+价层电子结构为
3d 3d
4s
4p
4CNdsp2
[Ni(CN)4]2-
价电子发生重排
轨道杂化类型(全为等性)与配位个体的几何构型
配位数 杂化类型 几何构型 实例 2 sp 直线形 [Hg(NH3)2]2+
3 sp2 sp3 dsp2 等边三角形 [CuCl3]2-
4
5
正四面体形 [Ni(NH3)4]2+ [Ni(CN)4]2正方形
6
[Ni(NH3)4]2+—— 正四面体
Ni2+价层电子结构为
n—未成对电子数
配合物的磁性
磁 性:物质在磁场中表现出来的性质。由单电子数目 决定 顺磁性:被磁场吸引 n > 0 , µ > 0 反磁性:被磁场排斥 n =0 , µ = 0 铁磁性:被磁场强烈吸引。例:Fe,Co,Ni 磁 矩: µ =[n(n+2)]1/2 (B.M.)
计算值和测定值有时会有一定差异
P247习题8.6:已知[MnBr4]2-和[Mn(CN)6]3-的磁 矩分别为5.9BM和2.8BM,试根据价键理论推测 这两种配离子价层d电子分布情况及它们的几 何构型。 解:Mn2+价电子构型为3d5,有5个未成对电子; Mn3+价电子构型为3d4,有4个未成对电子 化学式 磁矩(BM) 单电子数目n [MnBr4]25.9 5 [Mn(CN)6]32.8 2
配体的性质 同一中心离子形成相同构型的配合物时, 其△ 随配体场不同而变化。 配离子 配体 分裂能△o/(kJ· mol-1) [CrCl6]3Cl158 配 3[CrF6] F 182 位 [Cr(H2O)6]3+ H2O 体 208 [Cr(NH3)6]3+ NH3 场 258 增 3+ [Cr(en)3] en 262 强 [Cr(CN)6]3- CN314
影响因素: 配位原子电负性越大则配位原子越 不易提供孤电子对,导致形成体以外层 轨道与之成键 电负性 易形成配合 物类型 外轨型 实例
大 小
F、Cl、O C(CN-、CO)
内轨型
配位键类型——内轨配键、外轨配键 形成体与电负性较大的配位原子形 成外轨配键。
形成体与电负性较小的配位原子形 成内轨配键。
基本要点
8-2-1 价键理论
形成体
价层电子构型
杂化轨道类型
配合物的几何构型和配位键的键型
1. 配合物的几何构型和配位键键型
几何构型
由于形成体的杂化 轨道具有一定的伸展方 向性,使形成的配合物 具有一定的几何构型。
配合物的常见空间构型
规律:
1.形成体在中间,配 位体围绕形成体排 布;
2.配位体倾向于尽可 能互相远离,能量 低,配合物稳定
该二轨道处于和配体迎头相碰的位置, 其电子受到静电斥力较大,能量升高。 e g 2 2 2 dx - y dz E Es t 2g E0 自由离子 球形场中 八面体场
该三轨道插在配体的空隙中间,其电子受 到静电斥力较小,能量比前二轨道低。 e g 2 2 2 dx - y dz E Es dxy dxz dyz t2g E0 自由离子 球形场中 八面体场
对比以上数据可知: [MnBr4]2- Mn2+的价层d电子分布不发生变化, 依旧是3d5。因此3d轨道不可能参与配位键的形 成,所以是外轨配合物,杂化方式是sp3,空间 构型为正四面体;
[Mn(CN)6]3- Mn3+价层d电子分布将发生变化,其 中两个单电子偶合,未成对单电子数由4减为2, 空出两个空3d轨道,将参与配位键的形成。所以 是内轨配合物,杂化方式是d2sp3,空间构型为 正八面体。
