广东省中山市2016中考化学 第十四章 化学反应基本类型复习课件 新人教版
中考化学反应的类型复习PPT课件(初中科学)
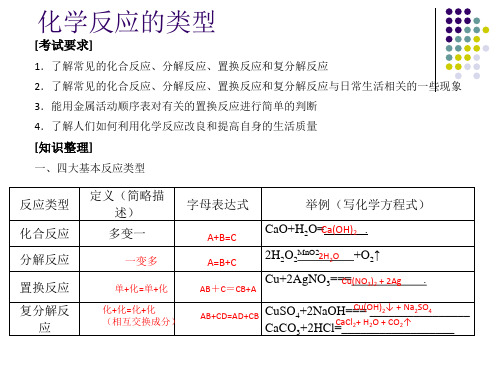
反应类型
化合反应 分解反应
置换反应 复分解反
应
定义(简略描 述)
字母表达式
举例(写化学方程式)
多变一
一变多
A+B=C A=B+C
CaO+H2O=Ca(OH)2 . 2H2O2MnO22H2O +O2↑
单+化=单+化
AB+C=CB+A Cu+2AgNO3==C=u(NO3)2 + 2Ag .
化+化=化+化 (相互交换成分)
B组
9.下列化学反应中不属于四种基本反应类型的是 ( C )
A.3Fe+2O2点燃Fe3O4
B.2H2O通电2H2↑+O2↑
C.CO+CuO Cu+CO2
D.CaCO3+2HCl=CaCl2+CO2↑+H2O
10.关于化学反应A+B=C+D,下列说法中正确的是 ( C )
A.若生成物C和D分别是盐和水,则反应物一定是酸和碱
化铜、硫酸中的某种,B常用于中和酸性土壤,E属于酸类。他们之间的相互关系如图所示
(其中实线表示物质间可以相互反应,虚线表示物质间不能反应)。请回答下列问题:
(1)E的化学式为
,B与E反应的化学方程式为:
.
,该反应的类型是
反应。
(2)C与D反应的化学方程式为
。
(3)虚线相邻物质间存在转化关系的是
→
(填化学式)。
(2)铁与氯化铜溶液产生置换反应,生成氯化亚铁和铜,反应的化学方程式为: Fe+CuCl2═FeCl2+Cu; (3)E是硫酸,A是二氧化碳,硫酸和碳酸钠反应生成二氧化碳,虚线相邻物质间存在转化 关系的是H2SO4转化为CO2. 【解答】(1)H2SO4, Ca(OH)2+H2SO4═CaSO4+2H2O,复分解; (2)Fe+CuCl2═FeCl2+Cu; (3)H2SO4,CO2.
中考化学反应的基本类型

专题7 化学反应的基本类型一、中考复习要求1、记住化合反应、分解反应、置换反应和复分解反应的概念,并能准确区分某些常见化学反应所属的基本类型。
2、记住14种常见金属的金属活动性顺序。
并熟练应用金属活动性顺序判断金属跟酸或盐溶液能否发生置换反应,会根据物质跟酸或盐溶液的反应现象判断金属活动性关系。
3、知道复分解反应发生的条件。
二、基础知识回顾化学反应的基本类型包括:、、和四大基本类型。
2、初中常见化学反应类型归纳(1)化合反应:A、单质 + 单质→化合物例如:B、单质 + 化合物→化合物例如:C、化合物 + 化合物→化合物例如:D、多种物质生成一种物质例如:NH3 + CO2 + H2O = NH4HCO3(2)分解反应:A、氧化物的分解例如:B、酸的分解(含氧酸)例如:H2CO3→C、不溶性碱的分解例如:Cu(OH)2→D、某些盐的分解例如: CaCO3 →(3)置换反应A 、 非金属 + 金属氧化物 → 金属 + 金属氧化物 例如:C 、+ CuO →B 、 金属(H 前面)+ 酸(稀盐酸、稀硫酸)→ 盐 + 氢气 例如:C 、 金属(一般不选K 、Na 、Ca )+ 盐溶液 → 另一金属 + 另一种盐 例如:D 、 水与其它单质的反应 例如:2Na + 2H 2O =2NaOH + H 2↑,C + H 2O = CO + H 2(4)复分解反应A 、 碱性氧化物 + 酸反应 → 盐 + 水 例如:B 、 碱 + 酸 → 盐 + 水 例如:C 、 碱 + 盐 → 另一种碱 + 另一种盐 例如:D 、 盐 + 盐 → 两种新盐 例如:E 、 盐 + 酸 → 另一种盐 + 另一种酸 例如:以上尽量多举出实例,写出反应的化学方程式。
3、化学反应发生的条件化学反应能否发生与反应物质本身的性质(内因)和外界条件(外因)有关。
(1)外界条件例如,燃烧需要点燃,氢气还原氧化铜需要加热,水分解需要通电,碳酸钙分解需要高温,氯酸钾分解制氧气需要加热和催化剂,象点燃、加热、高温、通电、催化剂都是外界条件。
中考化学专题复习:化学反应(共25张PPT)

热量(填“吸收”或“放出”),该反应的
反应类型是
,水的作用是
。
答案 (10分)(1)ac(2分,缺1项扣1分,有错项不得分)
(2)电(1分)
(1分) SiO2(1分) 2Mg+SiO2 2MgO+Si(2分)
(3)放出(1分) 化合反应或氧化还原反应(1分) 作催化剂(1分)
解析 (1)石油和煤炭都是不可再生能源。
实验操作:
;
(2)分别写出生成亚硫酸、硫酸的两个化学方程式:
①
;②
。
(3)以上两个化学反应都属于
反应(填基本反应类型);亚硫酸中硫元素的化合价为
价。
(4)亚硫酸、硫酸、盐酸和碳酸都能使石蕊试液变红色,从微观角度分析原因是
;
(5)为更多的吸收二氧化硫,防止二氧化硫散发至空气中。有以下试剂,你认为用来代替集气瓶中的水最为
(2)太阳能电池是将太阳能转化为电能的装置。Si的原子结构示意图为
;Si原子的最外层电子数
是4,则其最高正化合价为+4,对应的氧化物的化学式为SiO2。高温下Mg和SiO2反应生成Si和MgO,化学方程 式为2Mg+SiO2 Si+2MgO。 (3)镁和碘常温下几乎不反应,加入水后剧烈反应,说明水起催化作用;有大量紫色蒸气产生,说明反应放热, 使固体碘升华;镁和碘反应生成碘化镁,属于化合反应或氧化还原反应。
表达式:AB + CD→AD + CB 特 点:双交换,价不变
(四大基本反应类型之一)
复分解反应的范围
1.酸+金属氧化物=盐+水 2.酸+碱=盐+水(中和反应) 3.酸+盐=新酸+新盐 4.碱+盐=新碱+新盐 5.盐+盐=新盐+新盐 巧记:酸碱盐相互间,金属氧化物加上酸
中考化学总复习 主题十四 化学方程式及基本反应类型课件

2021/12/8
第十三页,共四十九页。
2021/12/8
变式练习2.(2014哈尔滨)下列应用的原理(用化学方程式
表示)及基本反应类型均正确的是( )
C
A. 用赤铁矿高炉(gāolú)炼铁
Fe2O3+3CO ═高═温2Fe+3CO2 置换反应
B. 硫酸厂污水可(gāo用wēn熟) 石灰中和处理
H2SO4+Ca(OH)2 ══ CaSO4+H2O 复分解反应
2021/12/8
第十七页,共四十九页。
变式练习1.(2014梅州)某化学反应的微观模拟示意图
是:
(“ ”表示氢原子,“
”表示氯原子),下列
说法错误的是( ) A
A. 此反应吸收热量
B. 此反应为H2+Cl2 ══点2燃HCl C. 此反应属于(shǔyú)化(合diǎn反rán应)
D. 此反应前后原子种类不变
2021/12/8
第二十三页,共四十九页。
变式练习(liànxí)1.(2014北京)下列化学方程式书写正确
的是( )B A. 2P+5O2 ═点r═án燃)P(2dOiǎn5 B. 2KMnO4 ══△K2MnO4+MnO2+O2↑
C. 2CO+O2 ══ 2CO2
D. H2SO4+ቤተ መጻሕፍቲ ባይዱaOH ══ NaSO4+H2O
③在题中写有关物质的相对分子质量与化学计量数的 乘积,已知量、未知量写在对应物质相关计算值的下 面。
2021/12/8
第二十九页,共四十九页。
一查化学式是否正确
二是否配平 查 — 三查反应条件及生成物状态是否
标注、标注是否恰当
广东2019年中考化学备考复习课件第14讲 化学方程式及化学反应类型(共16张PPT)

考点解读
考点2 基本反应类型的判断
·核心例题
【例2】(2018•哈尔滨市)下列有关叙述、对应的方程
式,所属基本反应类型都正确的是(
)
A.拉瓦锡研究空气成分、HgO
B.生石灰作干燥剂、CaO+H2O Na2SO3+H2O、复分解反应
Hg+O2↑、分解反应
Ca(OH)2、化合反应
C.三氧化硫与氢氧化钠溶液反应、SO3+NaOH D.葡萄糖在人体内氧化、C6H12O6+6O2 氧化反应
体,那么应该在生成气体的化学式后面标“↑”;在溶液 中发生反应时生成沉淀,才需要在生成沉淀的化学式后 标“↓”。
自主学习
2.认识几种化学反应 (1)四大基本反应类型 基本类型 概念 通式 由两种或两种以上的物 A+B+… 化合反应 质生成另外一种 ____物质的 →AB 反应 两种或 由一种物质生成____ 分解反应 AB→A+B+… 两种 ____以上物质的反应 单质与一种______ 化合物 一种____ 单质和 A+BC→AC+B 置换反应 反应生成另一种____ 另一种化合物 ______的反应 化合物相互交换成 两种______ 复分解 AB+CD→AD+ 两种化合物 分生成另外____ 反应 CB 的反应
第一轮
瞄准考点基础过关
物质的化学变化
第二部分
第14讲 化学方程式 及化学反应类型
自主学习
1.化学方程式
(1)概念:化学方程式是用化学式来表示化学反应的 式子。
生成 物以及反应______ 条件 ; (2)意义:①表示反应物、______
②表示反应物、生成物之间的粒子______ 个数 比;③
中考化学复习课件第讲 常见化学反应及其类型PPT共25页

▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!Βιβλιοθήκη 25中考化学复习课件第讲 常见 化学反应及其类型
31、别人笑我太疯癫,我笑他人看不 穿。(名 言网) 32、我不想听失意者的哭泣,抱怨者 的牢骚 ,这是 羊群中 的瘟疫 ,我不 能被它 传染。 我要尽 量避免 绝望, 辛勤耕 耘,忍 受苦楚 。我一 试再试 ,争取 每天的 成功, 避免以 失败收 常在别 人停滞 不前时 ,我继 续拼搏 。
33、如果惧怕前面跌宕的山岩,生命 就永远 只能是 死水一 潭。 34、当你眼泪忍不住要流出来的时候 ,睁大 眼睛, 千万别 眨眼!你会看到 世界由 清晰变 模糊的 全过程 ,心会 在你泪 水落下 的那一 刻变得 清澈明 晰。盐 。注定 要融化 的,也 许是用 眼泪的 方式。
35、不要以为自己成功一次就可以了 ,也不 要以为 过去的 光荣可 以被永 远肯定 。
中考化学复习课件 化学反应

• 2.实质:
生成
质量总和
• 化学反应前后一定不变的是__________、__________、 __________、__________; 原子种类 • 一定发生变化的是__________、__________; 元素质量 原子个数 元素种类 • 可能发生变化的是__________。
• 不属于复分解反应的典型反应,如 • CO2+Ca(OH)2 CaCO3↓+H2O等。
典例精析
• 【例1】下列化学方程式及反应类型均正确的是 D ( )
选项 A B
C
D
化学方程式 2CO+O2 2CO2 2KMnO△ K2MnO2+MnO2+ 4 2O2↑ 2Ag+H2SO4 Ag2SO4+H2↑ CuSO4+BaCl2 CuCl2+ BaSO4↓
__________ 多变一 __________ __________ 一变多 __________
__________ 二变二 __________ __________ 二变二 __________ (一般)
知识梳理
• 中和反应:
• 易错点:
酸与碱作用生成盐和水的反应 • __________________________。 • 中和反应一定属于__________反应。 复分解
分子种类 分子个数
物质种类
知识梳理
反应 • 二、化学方程式与基本反应类型 概念 类型 • 1.化学方程式(见课题6)。 两种或两种 以上物质 化合 由__________ • 2.基本反应类型 另一种 反应 生成 ______物质的反应 分解 由____ 一种 物质生成两种或 反应 两种以上其他物质的反应 由一种单质 ________与 一种化合物 置换 __________反应,生成 反应 另一种单质和另一种化合 物的反应 两种化合物 两种新的 复分 由__________相互交换 解反 化合物 成分,生成另外 应 __________ ____的反应 通式 特点
人教九年级化学上册化学反应归类复习(共17张PPT)

(3)若C、D 都属于盐,C为蓝色溶液,A中
含有氯离子,E是酸,则E的化学式为
A
C
B E溶液 D
2.如图:单质M、N与化合物甲、乙之间的关系。
(1)若N为氢气,则M 应满足的条件是
M
乙
(2)若乙为浅绿色溶液,
N为红色固体,则
M、甲的分别是什么? 甲
N
(3)若乙是一种无色气体,N为红色固体则M、 甲分别是什么?
抢 答! (下列式子表示什么反应类型)
AB------- A+B A+BC-----B+AC AB+CD----AC+BD
板答
完成下列化学反应的方程式 (1—5注明反应类型) 1.铁在氧气中燃烧 2.加热高锰酸钾制取氧气 3.将锌粒放入稀盐酸中 4.氢氧化钠与稀盐酸反应 5.将铁片放入硫酸铜溶液中 6.二氧化碳通入澄清的石灰水中
作业
整理本节课用到的相关方程式!
【展示提升2】
认真观察动画,指出下列反应能否发生,说明 理由。
教学资料 动画
【强化训练】
1.下图所示的转化关系中,各物质均是我 们初化学所学的。根据信息回答:
(1)若B为可溶性碱,C为蓝色沉淀,则A与B 反应的方程式可能是
(2)若D为不溶于稀硝酸的白色沉淀,A中含 有硫酸根离子,则A与B反应方程式可能是
点燃
2H2+O2===2H2O
(3)有水生成的分解反应:2H2O2===M=n2O2H2O+O2↑
H2CO3 == CO2 ↑ +H2O
(4)有水生成的置换反应: 加热 H2+CuO====Cu+H2O
(5)有水生成的复分解反应:
2HCl+CuO==CuCl2+H2O
中考专题复习:初中化学反应PPT课件 通用

2、复分解反应的反应物的类型有哪些? • • • • • • (1)酸与金属氧化物 (2)酸与盐 (3)酸与碱 (4)碱与盐 (5)盐与盐 【注意】复分解反应发生的条件:生成物 中有沉淀析出或有气体放出或有水生成, 其中碱与盐、盐与盐反应时,必须在溶液 中进行,即反应物都必须可溶。
• 【例题1】:下列几组物质在水溶液中都能 发生反应吗?能的写出化学方程式,不能的 说明理由。 • (1)BaCl2+Na2SO4 • (2)KNO3+NaCl • (3)Zn+CuSO4 • (4)Fe+AgCl • (5)FeCl3+Ba(OH)2 (6)Fe(OH)3+CuCl2
物质, 在一定条件下充分反应,测得反应 前后 各物质的质量如下:
物质
反应前质量 /g 反应后质量 /g
X
222 0
Y
0 160
Z
20 82
则该密闭容器中发生的化学反应类型为( A分解反应 B.化合反应 C.置换反应 D.复分解反应
)
在一个密闭容器内有A、B、C三种物质,在一定条 件下充分反应,测得反应前后各物质的质量如下:
巩固练习2
• 现有C、O2、CO2、H2O、CuO、HCl、NaOH 7种物质,以这7种物质作反应物,按下列要求写 出有关的化学反应方程式
• ①化合反 应 • ②分解反 应 • ③置换反 应 • ④复分解反应 ;
;
;
———————————
• 【例题3】根据下列化合物与单质相互转化的关系 回答:
化合物甲 单质x 单质y 化合物乙
要点
多变一
一变多
一换一
一交一
1、置换反应的反应物的类型有哪些? (1)金属冶炼、碳、氢气还原金属氧化 物 • H2+CuO△H2O+Cu (2) 活泼金属与稀硫酸、稀盐酸反应 • 位于氢前面的金属可以从酸中置换出氢 Zn+2HCl==ZnCl2+H2↑ (3)金属与盐溶液反应 • 排在前面的金属能把排在后面的金属从 它们的盐溶液中置换出来 • Cu+2AgNO3==Cu(NO3)2+Ag
中考化学专题复习:化学反应(共25张PPT)【完美版】

一种单质跟一种化合物反应生成另一种单质和另一种化合 物的反应叫做置换反应。
置换反应:
(A、B是单质)
判断 1、反应前后均为两种物质 方法 2、反应前后均为一种单质和一种化合物
(四大基本反应类型之一)
中考化学专题复习:化学反应(共25张 PPT)【 完美版 】
中考化学专题复习:化学反应(共25张 PPT)【 完美版 】
复分解反应:
两种化合物互相交换成分,生成另 外两种化合物的反应,叫做复分解反应 。
表达式:AB + CD→AD + CB 特 点:双交换,价不变
(四大基本反应类型之一)
中考化学专题复习:化学反应(共25张 PPT)【 完美版 】
中考化学专题复习:化学反应(共25张 PPT)【 完美版 】
复分解反应的范围
2NH3,符合化合 CO(NH2)2+H2O。
中考化学专题复习:化学反应(共25张 PPT)【 完美版 】
中考化学专题复习:化学反应(共25张 PPT)【 完美版 】
2.(2018山东德州,23,11分) 在学习“酸和碱”后,瑞娟同学对“硫在氧气中燃烧”实验进行再探究。想到实验生成的二氧化硫是非金 属氧化物,提出疑问:二氧化硫能否与水反应生成酸? 为此,瑞娟同学做了如下实验:将点燃的硫伸入盛有氧气的集气瓶(有少量的水)中,反应中产生刺激性气味 的气体;反应后,盖紧集气瓶口的玻璃片,振荡集气瓶;再打开玻璃片,仍能闻到刺激性气味;随后向其中滴入
中考化学专题复习:化学反应(共25张 PPT)【 完美版 】
中考化学专题复习:化学反应(共25张 PPT)【 完美版 】
几滴紫色的石蕊试液,瓶中液体变为红色。 瑞娟同学产生许多困惑:这种能使石蕊试液变红色的物质是什么?怎样防止二氧化硫排放到空气中去? 瑞娟询问老师,老师告知:在涉及的反应中,二氧化硫与二氧化碳的性质相似;二氧化硫与水反应生成“亚硫 酸”(化学式为H2SO3);亚硫酸还可进一步与氧气反应生成硫酸。 请你帮助瑞娟同学解答下列问题: (1)请结合下列图示中所给实验用品,设计一个实验用来验证:二氧化硫不能使石蕊变红色。
初中化学《化学反应》课件

初中化学《化学反应》课件化学反应是化学中最基本的概念之一,它描述了物质之间发生的转化过程。
本课件将介绍化学反应的定义、反应物与生成物、化学方程式、反应类型以及平衡反应等内容。
一、化学反应的定义化学反应是指在一定条件下,反应物发生转化,生成新的物质的过程。
在化学反应中,原子之间的连接被改变,旧的化学键被破坏,新的化学键被形成。
二、反应物与生成物反应物是指参与化学反应的起始物质,生成物是指化学反应之后产生的新物质。
反应物和生成物的组成可以通过化学方程式进行表示。
三、化学方程式化学方程式是用化学符号表示化学反应的过程。
化学方程式由反应物、生成物以及反应条件等组成。
举个例子,将氢气和氧气进行反应,生成水的化学方程式可以表示为:2H₂(g) + O₂(g) → 2H₂O(l)化学方程式中的数字称为化学计量系数,表示了反应物和生成物的摩尔比例。
化学方程式中的(g)表示气体,(l)表示液体。
四、反应类型化学反应可分为多种类型,包括化合反应、分解反应、置换反应、双替反应等。
1. 化合反应:两种或两种以上的物质反应生成一种新的物质。
例如,氢气与氧气生成水。
2H₂(g) + O₂(g) → 2H₂O(l)2. 分解反应:一种物质分解成两种或两种以上的物质。
例如,二氧化氢分解成氢气和氧气。
2H₂O(l) → 2H₂(g) + O₂(g)3. 置换反应:元素与化合物相互置换,生成不同的元素或化合物。
例如,氧气与铜反应生成铜(II)氧化物。
2Cu(s) + O₂(g) → 2CuO(s)4. 双替反应:两种化合物中的离子发生交换,生成两种新的化合物。
例如,氯化银与氯化钠反应生成氯化银和氯化钠。
AgCl(s) + NaCl(aq) → AgCl(aq) + NaCl(s)五、平衡反应在一些反应中,反应物和生成物之间存在一种动态平衡,称为平衡反应。
在平衡反应中,反应物与生成物之间的浓度、压力、温度等保持不变,但是反应仍在进行。
高中化学人教版化学反应课件

高中化学人教版化学反应课件化学反应课件是高中化学学习中重要的辅助资源。
在这个课件中,我们将深入探讨人教版高中化学教材中的化学反应相关内容,包括反应的基本概念、反应方程式的表示方法、化学反应速率和化学平衡等知识点。
一、化学反应基本概念化学反应是指物质之间发生的原子、离子或者分子的重新组合的过程。
在化学反应中,原有物质被消耗或转化,生成新的物质。
1.1 反应物和生成物:在化学反应中,起始参与反应的物质被称为反应物,而反应生成的新物质则称为生成物。
1.2 反应的基本特征:化学反应具有以下基本特征:(1)物质的消耗与生成物之间有一定的比例关系;(2)反应发生在能量变化下;(3)反应速率随条件的不同而变化。
二、反应方程式的表示方法反应方程式是用符号和化学式来表达化学反应的方法。
在反应方程式中,反应物和生成物用化学式表示,反应过程用化学符号表示。
下面以氢气和氧气反应生成水的反应为例,来说明反应方程式的表示方法:2H₂ + O₂ → 2H₂O在这个反应方程式中,2H₂表示两个氢气分子,O₂表示一个氧气分子,2H₂O表示两个水分子。
箭头“→”表示反应的进行方向,氢气和氧气是反应物,而水是生成物。
三、化学反应速率化学反应速率指的是单位时间内反应物浓度变化的量,可以用浓度、质量、压强等方式来表示。
反应速率受到温度、浓度、催化剂和表面积等因素的影响。
4.1 反应速率的计算方法:反应速率的计算方法可以通过观察反应物浓度或生成物浓度的变化来确定。
例如,对于反应方程式:2NO₂ + F₂ → 2NO₂F以观察NO₂消失速率来计算反应速率。
4.2 反应速率与碰撞理论:碰撞理论认为,只有具备一定能量且正确的碰撞才能导致分子间的反应。
反应速率与反应物的浓度、温度、反应物分子质量和单位体积碰撞次数有关。
四、化学平衡当一个化学反应达到一定条件下,反应物的消耗和生成物的生成达到动态平衡,此时称为化学平衡。
在化学平衡时,反应物和生成物的浓度保持一定比例,而不再发生显著变化。
人教版初中化学复习课:物质的变化 基本反应类型 课件(21张PPT)

19
公开课优质课研讨课人教版初中化学 复习课 :物质 的变化 基本反应类型 课件(21张PPT)免费下载课件下载PPT 下载
喜羊羊是:Na2CO3
① HCl 羊C羊u 回家CO的2 路N?aCl
② CO2 ③ Mg
CaCO3 NaCl CaCl2
→
Ca(OH)2 NaCl Cu
④ CO2 NaOH KCl Fe2O3
公开课优质课研讨课人教版初中化学 复习课 :物质 的变化 基本反应类型 课件(21张PPT)免费下载课件下载PPT 下载
归
类
示
例
请帮羊羊找到回家的路
羊羊代表碳酸钠, 途中只要能与之发生 反应的物质地方都会 遇到灰太狼,现在羊 羊要走哪条路才不会 遇到灰太狼安全到家 呢?
公开课优质课研讨课人教版初中化学 复习课 :物质 的变化 基本反应类型 课件(21张PPT)免费下载课件下载PPT 下载
化学变化
有新物质生 成的变化 产生了_新_____物质
构成物质的微粒本身 构成物质的微粒的组成或结构
没有 变化,变的是
__有____发生改变
微粒的间隔和排列方式
一般只发生形状或状态 一般有发光、放热、变色、
变化
放出气体、生成沉淀等现象
联系 发生化学变化的同时,一定发生物理变化; 发生物理变化的同时,不一定发生化学变化。。
一变多
置换 反应
由一种单质和一种化合物 反应,生成另一种单质和 A+BC =AC+B 另一种化合物的反应
单换单
复分 两种化合物互相交换成分 解反 生成另外两种化合物的反
应应
AB+CD _=__A_D_+__C_B_
二换二
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例题2
(2015 荆州) 在下列类型的化学反应中,各元素的化合 价一定不会发生变化的是( D )
A.化合反应 C.置换反应
B.分解反应 D.复分解反应
【思路与技巧】只要有单质参加或生成的反应,就一定 有化合价的变化;复分解反应中,因为是化合物相互交 换成分生成了新的化合物,一定没有化合价的变化。
二、其他反应
例题4
(2015 福州 ) 下列应用与中和反应原理无关的是 ( A) A.用浓硫酸干燥湿润的氧气 B.用熟石灰改良酸性土壤 C.服用含氢氧化铝的药物治疗胃酸过多 D.用氢氧化钠溶液洗涤石油产品中的残留硫酸 【思路与技巧】中和反应:酸+碱→盐+水;用浓 硫酸干燥湿润的氧气属于物理变化。
03 全国优秀试题分类精选
习题1
(2015 厦门) 已知在一定条件下发生反应:甲+乙―→丙+ 丁,下列判断正确的是( D ) A.甲、乙、丙、丁不可能含有同一种元素 B.丙为盐、丁为水,则该反应一定为复分解反应 C.甲、乙为化合物,则该反应一定为复分解反应 D.丙为Cu(NO3)2,则甲可能为单质、氧化物、碱或盐
【思路与技巧】CO2与NaOH反应生成盐Na2CO3和H2O,甲、乙、 丙、丁都含有氧元素,该反应甲、乙为化合物,丙为盐、丁为水, 但该反应不是复分解反应。
01 考纲要求和命题分析
1 . 常见的化合反应、分解反应、置换反应、复分解反应(认
识)
2.初中常见的化学反应类型,解释日常生活中一些化学的
现象(理解)
近三年广东省中考考查情况
年份 2013年 2014年 2015年 题型 填空 填空 选择、填空 分值 2 1 3 难易度 中等 容易 容易 考查点 复分解反应(中和反应) 复分解反应(中和反应) 置换反应、化合反应
【思路与技巧】反应物只有一种化合物,生成物 有两种单质,属于分解反应。
二、其他反应
酸和碱 作用生成盐和水的反应(属于复分解反应)。 3.中和反应:________
▲温馨提示: 化学反应的类型分两种情况,一是基本反应类型,二是其他反应类 型;其中,中和反应是复分解反应的一种,有氧气参加的反应同时也 一定是氧化反应。
习题2
(2015 成都) 按下表进行实验,有关说法及分析错误的是(
A
)
向少量NaOH溶液中滴加CuSO4溶液 向少量BaCl2溶液中滴加CuSO4溶液 现象 化学方程式 ① CuSO4+2NaOH===Cu(OH)2↓+ Na2SO4 白色沉淀 ②
A . ①有蓝色沉淀 B.②反应的化学方程式为CuSO4+BaCl2===BaSO4↓+CuCl2 C.两个反应都属于复分解反应 D.只要有沉淀生成的反应就属于复分解反应
习题3
D
04 突破练习
(2013 佛山) 硫酸钙转化为K2SO4和CaCl2·6H2O的工艺流程如下:
(1)吸收过程中发生了化合反应,化学方程式为____________________________ CO2+H2O+2NH3===(NH4)2CO3 。 过滤 (2)操作Ⅰ的名称为________ ,沉淀的主要物质为________( CaCO3 填化学式)。 AB (3)蒸氨过程中涉及的化应类型为________( 填编号)。 A.复分解反应 B.化合反应 C.分解反应 D.置换反应 (4)操作Ⅲ包含一系列操作:蒸发、浓缩、________ 冷却结晶 、过滤、洗涤、干燥。 (5)可循环利用的物质除了NH3外,还有________( CO2、CaO 填化学式)。
02 知识点归纳整理
一、化学反应的基本类型
化合反应 、________ 置换反应 分解反应 、________ 化学反应的基本类型包括:________ 复分解反应 四大基本类型。 和____________
反应类型
概念
两种 由________ 或________ 两种以上 的 物质生成________ 化合物 相互交 换成分,生成两种 新化合物 的反应。 ________
AB+CD===AD+ BC“两两互换成分 ”
HCl+NaOH === NaCl+H2O
例题1
(2015 揭阳) 如图所示的微观化学变化,其基本反应类型属于(
C
)
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
例题3 (2014 宜宾) 掌握初中化学中物质间反应规律是继续学习 化学的必备知识。在下列物质中按要求选出能相互反应的 组合。(填物质编号如“①⑥”,如有多种组合,组合间用 分号“;”相隔) ① CO2 ②KNO3 溶液 ③Ag ④CuSO4 溶液 ⑤稀硫酸 ⑥NaOH溶液 ⑦Fe ⑧NaCl溶液 ⑤⑦;④⑦ _____。 (1)常温下能发生置换反应的组合有______________ (2) 常 温 下 能 发 生 复 分 解 反 应 的 组 合 有 ______________ ④⑥;⑤⑥ _____。
特征 A+B===AB“ 多变一”
举例 点燃
化合反应
加热
分解反应
一种物质生成________ 两种 或 ________ 以上其他物质的 两种 反应
AB===A+B“ 一变多”
一、化学反应的基本类型
反应类型 概念 特征 举例 Zn+H2SO4 === _ H↑ ZnSO4+ 2
置换反应
单质 一种________ 跟一种 化合物 反应生成另 A+BC===B+AC“ ________ 单质 和另一 一种________ 一单换一单” 种________ 化合物 的反应。
1.氧化反应:氧化反应是指物质与 ________ 氧气 的反应(物质与氧气反应一 定是氧化反应,但氧化反应不一定是物质与氧气的反应)。 (1)缓慢氧化:如食物腐败、金属生锈、酒和醋的酿造。 (2)剧烈氧化:物质的燃烧。
氧 2 .还原反应:化合物中的 ________ 被夺走的反应。 C + 2CuO 高温 2Cu + CO2反应中:CuO中的________ 被C夺走生成了Cu,CuO发生了________ 氧 还原 反应,CuO是________ 氧化 剂,Cu是还原产物;C夺了CuO的氧生成了CO2, C发生了________ 氧化 反应,C是________ 还原 剂,CO2是氧化产物。
