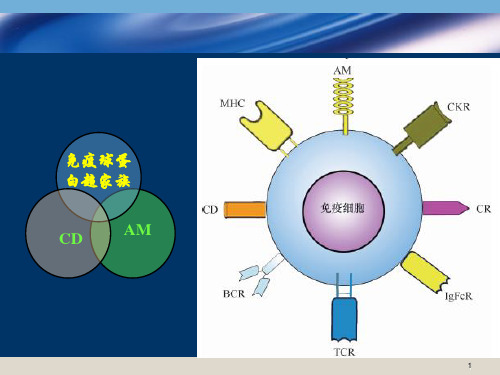
树突状细胞
抗原提呈细胞与树突状细胞的关系

抗原提呈细胞与树突状细胞的关系
抗原提呈细胞(Antigen presenting cells, APCs)包括树突状细
胞(dendritic cells, DCs)和其他细胞类型,如巨噬细胞和B
细胞。
树突状细胞是一类特殊的抗原提呈细胞,在免疫系统中起着重要的角色。
树突状细胞具有高度的抗原提呈和信号转导能力,能够有效地捕获外来抗原,并将其呈递给免疫系统中的其他细胞,如淋巴细胞。
树突状细胞通过特殊的细胞突起结构,增大了其表面积,从而增强了与其他细胞的接触和相互作用。
树突状细胞在抗原提呈过程中发挥着关键的作用。
它们首先通过胞吞作用或受体介导的内吞作用捕获外来抗原,随后将抗原进入细胞内部并进行加工。
在细胞内,抗原被分解为小片段,并与主要组织相容性复合物(MHC)分子结合形成MHC-抗
原复合物。
这些MHC-抗原复合物在树突状细胞的表面表达出来,从而呈递给免疫系统中的其他细胞。
树突状细胞呈递的抗原能够被免疫系统识别,并引导免疫系统产生特异性的抗体和细胞免疫反应。
它们在免疫应答的启动阶段起着重要的作用,可以促进T细胞的活化和分化,从而引
发免疫系统的全面反应。
总之,树突状细胞是一类重要的抗原提呈细胞,能够有效捕获、处理和呈递外来抗原,与其他免疫细胞相互作用,共同参与免疫应答的调节和调控。
树突状细胞

谢谢观看
DC与肿瘤的发生、发展有着密切关系,大部分实体瘤内浸润的DC数量多则患者预后好。有效的抗肿瘤免疫反 应的核心是产生以CD8+ T细胞为主体的细胞免疫应答,这也是DC作为免疫治疗手段的基础。
树突状细胞(17张)DC抗肿瘤的机制如下:①DC可以高表达MHC-Ⅰ类和MHC-Ⅱ类分子,MHC分子与其捕获加工 的肿瘤抗原结合,形成肽-MHC分子复合物,并递呈给T细胞,从而启动MHC-I类限制性CTL反应和MHC-Ⅱ类限制性 的CD4+ Thl反应。同时,DC还通过其高表达的共刺激分子(CD80/B7-1、CD86/B7-2、CD40等)提供T细胞活化所 必须的第二信号,启动了免疫应答。②DC与T细胞结合可大量分泌IL-12、IL-18激活T细胞增殖,诱导CTL生成, 主导Th1型免疫应答,利于肿瘤清除;激活穿孔素P颗粒酶B和FasL/Fas介导的途径增强NK细胞毒作用;③DC分泌 趋化因子(Chemotactic Cytokines, CCK)专一趋化初始型T细胞促进T细胞聚集,增强了T细胞的激发。保持效 应T细胞在肿瘤部位长期存在,可能通过释放某些抗血管生成物质(如IL-12、IFN-γ)及前血管生成因子而影响肿 瘤血管的形成。
树突状细胞
血液细胞
01 简介
03 来源 05 荣誉
目录
02 分布 04 功能
树突状细胞(也称DC细胞)是由加拿大学者Steinman于1973年发现的,是功能最强的抗原提呈细胞,因其成 熟时伸出许多树突样或伪足样突起而得名。
树突状细胞抗原提呈过程

树突状细胞抗原提呈过程
第一步,抗原捕获。
树突状细胞通过其表面上的特异性受体,如Toll样受体(TLR)和C型凝集素受体(CLR),能够识别和捕获外源抗原。
当DC细胞
接触到病原体或其他外源抗原时,这些受体会识别并结合抗原分子,将其内部化到细胞内。
第二步,抗原处理。
捕获到的抗原分子在DC细胞内被降解成小片段,这一过程发生
在特殊的细胞器内,如内质网和溶酶体。
这些小片段被称为抗原肽,它们将在后续步骤中被呈递给T细胞。
第三步,抗原呈递。
处理后的抗原肽将与主要组织相容性复合物(MHC)分子结合,
形成MHC-抗原肽复合物。
这些复合物将被转运到树突状细胞表面,
并在那里呈递给T细胞。
第四步,T细胞激活。
当T细胞受体识别到MHC-抗原肽复合物时,T细胞将被激活并开始免疫应答。
这将引发一系列的免疫反应,包括T细胞的增殖和分化,以及其他免疫细胞的活化。
树突状细胞抗原提呈过程的完成标志着免疫系统对外源抗原的识别和应答。
这一过程的精密调控对于维持免疫系统的平衡和功能至关重要。
对树突状细胞抗原提呈过程的深入理解也为疾病的治疗和预防提供了新的思路和方法。
2.树突状细胞 Microsoft PowerPoint 演示文稿 (2)

共同特征 * 形态上呈树突状 * 高表达 高表达MHC-II类抗原和多种粘附分子 类抗原和多种粘附分子 * 胞浆内存在特异性 胞浆内存在特异性Birbeck颗粒状结构 颗粒状结构 * 吞噬功能较低 * 可有效诱导静息 细胞活化 可有效诱导静息T细胞活化
2、分布与分类 、
广泛分布于脑以外的全身组织和脏器. 广泛分布于脑以外的全身组织和脏器 * 淋巴样组织中的 淋巴样组织中的DC: FDC、 IDC 、TDC; 、 ; * 非淋巴样组织中的 :包括 、 间质 ; 非淋巴样组织中的DC:包括LC、 间质DC * 循环 。 循环DC。
分布
• 脑以外的全身各脏器。 脑以外的全身各脏器。 • 淋巴样组织中的DC——并指状DC(interdigitating 淋巴样组织中的DC 并指状DC( DC 并指状DC IDC) 位 淋巴组T细胞区边缘区DC DC。 cell IDC)—位 淋巴组T细胞区边缘区DC。 • 非淋巴样组织中的DC 间质性DC, 非淋巴样组织中的DC——间质性DC, DC 间质性DC • 朗格汉斯细胞 ( Langerhans cell LC ) —移至淋 朗格汉斯细胞( LC) 移至淋 巴结高表达MHCⅠ 分子和Ⅱ 类分子缺乏FcR CR不 MHCⅠ分子和 FcR, 巴结高表达 MHCⅠ 分子和 Ⅱ 类分子缺乏 FcR , CR 不 成熟DC 高表达FcR CR、MHCⅠ、 DC, FcR, 成熟DC,高表达FcR,CR、MHCⅠ、Ⅱ分子 • BirBeck颗粒的特征性细胞器,可用于LC的鉴定。 BirBeck颗粒的特征性细胞器 可用于LC的鉴定。 颗粒的特征性细胞器, LC的鉴定 体液中的DC 隐蔽细胞和血液DC DC——隐蔽细胞和血液DC。 体液中的DC 隐蔽细胞和血液DC。
树突状细胞及其前体细胞分选

03
树突状细胞及其前体细胞分选的方法
基于表面标志的分选方法
总结词
基于表面标志的分选方法是最常用的树突状细胞及其前体细胞分选方法,通过抗体与细胞表面抗原的 特异性结合,将目标细胞从混合细胞群体中分离出来。
详细描述
这种方法利用树突状细胞及其前体细胞表面特有的抗原标记,如CD11c、CD123等,通过与相应抗体 结合后进行磁性分离或流式细胞仪分选。该方法具有较高的特异性和灵敏度,能够有效地分离出纯度 较高的目标细胞。
02
通过分选树突状细胞及其前体细胞,可以进一步研究它们的生物学特性和功能 ,为免疫学研究提供更多有价值的信息。
03
树突状细胞及其前体细胞分选还有助于开发新的免疫疗法和疫苗,为人类健康 和疾病治疗提供更多选择。
树突状细胞及其前体细胞分选的应用
在疫苗研发中,通过分选特定类型的树突状细胞,可以设计出更有效的 疫苗,提高免疫应答的效果和持久性。
基于细胞活力的分选方法
总结词
基于细胞活力的分选方法是根据细胞活力的差异,将活力较高的树突状细胞及 其前体细胞分离出来的方法。
详细描述
该方法利用不同细胞活力的特点,通过特定的染色或标记技术,将活力较高的 树突状细胞及其前体细胞选择性地分离出来。该方法能够保证细胞的活性,有 利于后续的实验和应用。
基于细胞大小和密度的分选方法
免疫荧光染色
利用特异性抗体对分选后的细胞进行免疫荧光染 色,通过显过检测特定基因的表达水平,评估分选后细胞 的纯度和功能状态。
分选结果的应用前景
疾病治疗
利用分选得到的树突状细胞及其前体细胞进行疾病治疗,如肿瘤 免疫治疗和自身免疫性疾病治疗。
药物筛选
将分选得到的细胞用于药物筛选,以发现具有潜在治疗作用的药物 分子。
树突状细胞的研究进展

利用树突状细胞治疗癌症的研究进展
肿瘤疫苗
利用树突状细胞制备肿瘤疫苗,通过激活机体免疫系统来攻 击肿瘤细胞,是目前癌症免疫治疗的重要研究方向。多项临 床试验已证明肿瘤疫苗在部分癌症治疗中具有一定的疗效。
免疫疗法联合治疗
树突状细胞与其他免疫疗法药物或手段联合使用,如与PD-1 抑制剂、CAR-T细胞疗法等联合,可提高癌症治疗的疗效和 生存率。
伦理问题
关于树突状细胞的研究涉及到 伦理问题,例如从胚胎或干细
胞中提取树突状细胞。
对未来研究的建议与展望
发展新技术
需要发展更先进的技术来分离、培养 和检测树突状细胞,以提高研究的敏 感性和特异性。
深入研究功能
需要进一步深入研究树突状细胞的功 能和异质性,以更好地理解其在免疫 系统中的作用。
促进临床应用
树突状细胞与其他疾病治疗的研究进展
自身免疫性疾病
树突状细胞在自身免疫性疾病中发挥重要作用,研究显示利用树突状细胞治疗 类风湿性关节炎、系统性红斑狼疮等疾病具有一定的疗效。
感染性疾病
树突状细胞在感染性疾病中具有免疫调节作用,研究显示利用树突状细胞治疗 某些细菌感染、真菌感染等疾病具有一定的疗效。
05
树突状细胞与癌症
1 2
癌症免疫逃逸
树突状细胞在癌症免疫逃逸中发挥重要作用,它 们能够通过调节T细胞活性,促进肿瘤生长和扩 散。
肿瘤抗原提呈
树突状细胞能够摄取并加工肿瘤抗原,将其呈递 给T细胞,激活抗肿瘤免疫反应。
3
肿瘤免疫治疗
利用树突状细胞的抗原提呈功能,开发肿瘤免疫 治疗方法,如DC疫苗,以激发机体抗肿瘤免疫 应答。
04
树突状细胞的最新研究成果
树突状细胞在免疫疗法中的应用
树突状细胞简介(共34张PPT)

2. 未成熟期DC
髓系DC在从前体发育为具有强免疫刺激功能的成熟DC的过 程中,需经过一个未成熟阶段,此阶段DC的功能对免疫应答十 分重要。
未成熟DC主要存在于多种器官及非淋巴组织上皮,能表达一 些膜受体如FcRII、甘露糖受体等,介导DC摄取抗原。未成熟 DC也能通过吞饮和吞噬作用摄取抗原。未成熟DC内含有一些重 要的细胞器包括内体、MIIC和溶酶体等,能合成MHC-I类分子 。
IDC是分布于淋巴组织胸腺依赖区和次级淋巴组织中的 重要APC,其表面缺乏FcR和C3bR,但富含MHC-I类和II类抗 原,现认为IDC是由皮肤内朗格汉斯细胞移行至淋巴结衍生 而来的一种细胞。
IDC通过其突起与周围T淋巴细胞密切接触,可有效地将 抗原提呈给特异性T细胞。大多数IDC易发生调亡,为短寿命 ;少量IDC为长寿APC,在维持T细胞的免疫记忆中发挥作用 。
淋巴样DC主要分布于淋巴结、脾脏、粘膜相关组织中的淋巴滤 泡生发中心,主要与B淋巴细胞功能有关。
髓样DC主要分布于T细胞富含区,与T细胞功能有关。按其 分布部位又可分为:
❖ Langhams细胞,主要分布于皮肤和粘膜。 ❖ 间质性DC,分布于心、肺、肝、肾、胃肠道等。
❖ 并指状DC,主要分布于脾脏、淋巴结和胸腺等T细胞富 含区。
疫应答的始动者,在免疫应答的诱导中具有独特的地位。
对DC的研究不仅有助于深刻了解机体免疫应答的调控机制,而且可以 通过调节DC的功能来调节机体的免疫应答,对感染、肿瘤、移植排斥、自 身免疫性疾病的发生机制的认识和防治措施的制定,具有重要意义。
因此,DC在机体免疫应答中的作用及其与某些疾病发生和防治 的关系,正受到高度关注。
1. 前体阶段DC
目前从人胎肝、脐血、骨髓、成人外周血以及小鼠的骨髓 和外周血中均分离出髓系前体,其功能在于产生各种髓系DC。 在体内,这些前体的作用可能是维持非淋巴组织内DC的数量达 到一定水平。
树突状细胞

器材
(1)水平式离心机(2)显微镜(3)血 )水平式离心机(2)显微镜(3 球计数板、血盖片(4 球计数板、血盖片(4)载玻片、盖玻 片(5)定量移液器、洗耳球(6 片(5)定量移液器、洗耳球(6)刻度 离心管(7)试管、滴管、橡皮滴头(8 离心管(7)试管、滴管、橡皮滴头(8) 小滤纸、擦镜纸
试剂
3、培基第3 天换液,轻轻吸去原培养液,加入 、培基第3 等量含有IL等量含有IL-4 和GM-CSF 的新鲜1640 培氧液, GM的新鲜1640 继续置CO2 继续置CO2 孵箱中培养。 4、 促树突状细胞成熟:单核细胞经与IL-4 和 促树突状细胞成熟:单核细胞经与ILGM-CSF 的共同孵育,7 天左右使其分化成树突 GM的共同孵育,7 状细胞,但并未成熟。此时轻轻吸去含有IL状细胞,但并未成熟。此时轻轻吸去含有IL-4 和GM-CSF 的1640 培养液,更换等量的含有 GMIFNIFN-α的RPMI1640 培养液,继续置5%CO2 孵箱 培养液,继续置5%CO2 中,37℃培养,至第9 中,37℃培养,至第9 天时可获得成熟的树突 状细胞。
基本原理 细胞因子GM细胞因子GM-CSF 和IL-4 使血液中单核细胞分化成树突状细 IL胞,并用IFN胞,并用IFN-α促进树突状细胞的成熟。 试剂和材料 ● 新鲜的外周(肝素)抗凝血液 ● 淋巴细胞分离液。无钙镁HanKs(CMF-HanKs)液 淋巴细胞分离液。无钙镁HanKs(CMF-HanKs)液 ● 制剂:人重组GM-CSF(hrGM-CSF)、hrIL-4、hrIFN-α。 制剂:人重组GM-CSF(hrGM-CSF)、hrILhrIFN●培养液: (1) RPMI1640 全培基:RPMI1640+10% 胎牛血清( FCS、 全培基:RPMI1640+10% FCS、 热灭活)+2mmol/LL-谷氨酰胺+100IU/ml 青霉素+100μg/ml 热灭活)+2mmol/LL-谷氨酰胺+100IU/ml 青霉素+100μg/ml 链霉素+1g/L 非必需氨基酸+1 链霉素+1g/L 非必需氨基酸+1 mmol/L 丙酮酸钠+5×105 丙酮酸钠+5× mol/L 2 巯基乙醇。 (2) RPMI1640/IL-4/GM-CSF:即RPMI 全培基+ILRPMI1640/IL-4/GM-CSF:即 全培基+IL4(40ng/ml)+GM4(40ng/ml)+GM-CSF(50ng/ml). (3) RPMI1640/IFN-α:即RPMI 全培基+ IFN-α(1 RPMI1640/IFN-α:即 全培基+ IFN10ng/ml)。 10ng/ml)。
黎衍敏树突状细胞的研究1

鼓励多学科交叉研究,利用其他学科的先进技术和方法,推动黎 衍敏树突状细胞研究的快速发展。
THANKS
感谢观看
,避免不必要的免疫反应。
04
黎衍敏树突状细胞在疾病中的作 用
在自身免疫性疾病中的作用
辅助T细胞分化
树突状细胞能够通过表达特定的 分子,辅助T细胞分化为Th1或 Th2细胞,影响自身免疫性疾病
的发展。
参与炎症反应
树突状细胞在自身免疫性疾病的 炎症反应中发挥重要作用,它们 可以分泌促炎因子,促进炎症的
分类
根据其发育来源和表型,树突状细胞可分为两类:骨髓来源的髓系DCs和淋巴组 织来源的淋巴系DCs。
树突状细胞的功能
01
02
03
抗原呈递
树突状细胞能够摄取并加 工处理抗原,将其呈递给 T细胞,激活适应性免疫 应答。
免疫调节
树突状细胞能够分泌多种 细胞因子和炎症介质,调 节免疫应答的强度和方向 。
诱导免疫耐受
黎衍敏树突状细胞具有抗原提呈作用,能够摄取并加工处理抗原,将抗原信息暴露在细胞表面,供T 细胞识别。
详细描述
在免疫应答中,树突状细胞扮演着关键角色,它们能够高效地摄取和加工处理抗原,将抗原信息暴露 在细胞表面,从而激活T细胞。这种抗原提呈作用是树突状细胞的核心功能之一,有助于触发适应性 免疫应答。
免疫调节作用
其生物学特性。
阐明细胞命运的决定机制
03
解析黎衍敏树突状细胞命运决定的分子机制,为干预其功能提
供理论依据。
探索黎衍敏树突状细胞在疾病治疗中的应用
1 2
开发新的治疗策略
基于对黎衍敏树突状细胞的深入理解,开发新的 治疗策略,为疾病的治疗提供新的思路。
树突状细胞的临床特点

树突状细胞的临床特点
树突状细胞是一类形状不规则的非单核吞噬系统细胞,特点是胞浆有
许多长突起呈触须状,使整个细胞的形态象一个蜘蛛。
树突状细胞分
散于全身的上皮组织和实质性器官,其细胞数量不超过局部细胞总数
的1%;也可迁移到血液和淋巴,其数量不超过血液有核细胞总数的0.1%.在不同组织中,树突状细胞有不同名称,例如血液中的树突状细胞、
皮肤中的Langerhans细胞、淋巴液中的帆状细胞、外周淋巴器官中胸
腺依赖区的并指状细胞等。
树突状细胞来源于骨髓的前体细胞,与单
核吞噬细胞系统有不同的祖细胞,但是对其发育过程目前尚了解不多。
树突状细胞的吞噬能力较弱,但细胞表面积大,且有丰富的MHCⅡ
类分子,所以捕获抗原和递呈抗原的能力很强。
树突状细胞有运动能力,所以能在体内搜寻罕见的特异性T细胞经递呈抗原,因此树突状细
胞在启动免疫应答方面有重要的意义。
另外,淋巴结皮质区内含有较多的滤泡树突状细胞,这类细胞不
表达MHCⅡ类分子,不能向TH递呈抗原;但富含Fc受体,能够通过结合
抗体以免疫复合物的方式捕获抗原。
所以FDC与B细胞的活化和再次抗
体应答相关。
树突状细胞检测方法

树突状细胞检测方法
嘿,咱今儿就来聊聊树突状细胞检测方法这档子事儿。
你说这树突
状细胞啊,就像是身体里的小哨兵,可重要着呢!那怎么才能知道它
们是不是在好好工作呀?这就得靠检测方法啦。
先来说说流式细胞术吧。
这就好比是给树突状细胞来个大点名,通
过各种标记,能清楚地知道它们的数量啊、状态啥的。
你想想,这是
不是很神奇?就像在茫茫人海中一下子就能认出特定的那些人一样。
还有免疫组化呢,这就像是给树突状细胞拍个特写照片。
能让我们
在显微镜下清楚地看到它们的样子,是不是很厉害?这能帮助我们更
直观地了解它们的分布和特征呀。
再讲讲酶联免疫吸附试验,这就好像是个超级侦探,能检测出和树
突状细胞相关的各种分子,从而推断出它们的活动情况。
你说妙不妙?
咱平时做这些检测,不就是为了更好地了解身体里的这些小哨兵嘛!要是它们出了啥问题,咱不就麻烦啦?那我们不得赶紧想办法解决呀!要是没有这些检测方法,咱不就像盲人摸象,啥都不知道啦?
比如说,要是不知道树突状细胞的数量少了,那免疫系统可能就没
办法好好工作啦,各种病菌不就趁机捣乱啦?那我们不得生病呀!所
以说,这些检测方法可太重要啦,它们就像是我们了解身体内部情况
的眼睛呀!
那检测的时候可得仔细着点,就跟咱出门得好好打扮一样,不能马虎呀!要是检测错了,那可就糟糕啦。
你说这树突状细胞检测方法是不是很有意思?它们能帮我们揭开身体里的好多秘密呢!咱可得好好利用这些方法,让自己的身体健健康康的呀!这可不是开玩笑的,咱得重视起来呀!总之,树突状细胞检测方法是我们了解身体、保护身体的重要手段,我们可不能小瞧它们哟!。
医学免疫学课件:树突状细胞
来源于 骨髓
胸腺中 分化
外周 激活
细胞 免疫
20
获得功能 TCR基 性TCR 因重排
获得MHC 限制性识 别能力 阳性选择
CD4-CD8+/ CD4+CD8单阳性细胞(SP)
成熟的 CD4+/CD8+
T细胞 <2%
双阴性细胞(DN)
CD4+CD8+双 阳性细胞(DP)
皮质
建立自身 皮髓质 阴性选择 抗原耐受 交界
4
树突状细胞(dentritic cell, DC医)学免疫学
成熟的DC具有树突样突起
免疫系统中的“哨兵”
5
树突状细胞(dentritic cell, DC医)学免疫学
2011
拉尔夫·马文·斯坦曼 Ralph Marvin Steinman
1943.1-2011.9
6
树突状细胞(dentritic cell, DC医)学免疫学
❖诱导型表达B7(CD80/CD86)
13
医学免疫学
14
自然杀伤细胞(natural killer,NK医)学免疫学
•大颗粒淋巴细胞:胞质含大嗜苯胺颗粒 •生物学特征:CD3CD19CD56+CD16+
能被IL-2、IL-12等细胞因子激活; 活化后可分泌IFN-γ和TNF-α等
•作用特点:无需抗原预先致敏即可杀 伤某些靶细胞(肿瘤细胞、病毒感染的细胞等异常细胞) •来源、分布:骨髓中淋巴样祖细胞分化而来;
❖单核/巨噬细胞具有吞噬、杀伤、分泌生物活 性分子及提呈抗原等功能。
3
The Long Arm of the Immune System 医学免疫学
Jacques Banchereau
树突状细胞的研究进展

树突状细胞的研究进展
其次,树突状细胞具有重要的抗原提呈功能。
树突状细胞通过捕获、处理和展示抗原,引发免疫系统的免疫应答。
研究表明,树突状细胞能够通过不同的抗原提呈通路来激活不同的免疫细胞,如T细胞和B细胞。
此外,树突状细胞还参与调节免疫应答的平衡,通过调节T细胞的分化和功能来控制免疫应答的程度和方向。
树突状细胞的研究还包括其分类与表观遗传调控。
研究人员通过对树突状细胞的表面标记物和功能特性的分析,将其分为多个亚群。
不同亚群的树突状细胞在免疫应答过程中具有不同的功能。
此外,近年来,科学家还发现树突状细胞的表观遗传调控在其发育和功能中起着重要的作用。
研究表明,一些表观遗传修饰可以调节树突状细胞的分化和活化过程。
树突状细胞的研究还涉及其在临床应用中的潜力。
由于树突状细胞在免疫应答中的重要性,科学家们试图利用树突状细胞来改善疫苗效果和免疫治疗效果。
研究表明,通过将抗原递呈给树突状细胞,可以提高疫苗的免疫保护效果。
此外,树突状细胞疫苗在癌症治疗中也显示出了潜力。
通过提取患者自身的树突状细胞并对其进行活化和负载肿瘤抗原,可以诱导患者产生特异性免疫应答来抑制肿瘤的生长。
树突状细胞的分类和功能

树突状细胞的分类和功能嘿,朋友们!今天咱来聊聊树突状细胞,这可真是身体里一群了不起的小家伙呢!树突状细胞啊,就像是免疫系统里的情报员和指挥官。
它们有不同的类型,就好像不同性格的人在干着不同的工作。
有一种叫髓样树突状细胞,它们就像是勇猛的战士,在前线冲锋陷阵,一旦发现敌人的踪迹,那绝对是第一时间发出信号。
还有一种叫淋巴样树突状细胞,它们呢,更像是智慧的谋士,在后方精心策划,调配着免疫系统的各种力量。
那它们都有啥功能呢?这可太重要啦!树突状细胞能够摄取抗原,这就好比它们有一双敏锐的眼睛,能迅速捕捉到那些“坏家伙”的特征。
然后呢,它们会把这些信息传递给其他免疫细胞,就像是给其他战士们指明了攻击的方向。
这要是没有它们,免疫系统不就像没头苍蝇一样乱撞啦?你想想看,要是身体里没有树突状细胞,那免疫系统得乱成啥样啊!就好比一场战斗没有了指挥,大家都不知道该打谁,怎么打。
树突状细胞还能激活免疫细胞呢!它们就像是点燃了免疫系统的斗志,让那些免疫细胞充满了力量,奋勇杀敌。
它们还能调节免疫反应,让免疫系统保持平衡,既不会过度反应,也不会毫无作为。
这多厉害呀,就像一个优秀的调节大师,把一切都安排得妥妥当当。
而且哦,树突状细胞还很聪明呢!它们知道什么时候该出手,什么时候该收敛。
它们不会盲目地发动攻击,而是会根据情况做出最恰当的反应。
这可真是不简单啊!咱身体里有这么一群厉害的树突状细胞在守护着我们,是不是感觉特别安心呢?它们默默地工作着,为我们的健康保驾护航。
我们可得好好感谢它们呀!所以说呀,树突状细胞可真是免疫系统里不可或缺的重要角色啊!它们的分类虽然不同,但都为了一个共同的目标努力着,那就是让我们的身体保持健康,远离疾病。
我们要珍惜它们的付出,好好爱护自己的身体,让这些小家伙们能更好地发挥它们的作用。
你们说是不是呀?。
树突状细胞及其前体细胞分选-V1

树突状细胞及其前体细胞分选-V1正文:树突状细胞是一类具有免疫功能的细胞,主要分布在淋巴组织和周围组织中。
近年来,研究人员深入探究树突状细胞在疾病诊断和治疗上的作用,发现分选树突状细胞及其前体细胞是实现这一目标的关键。
一、树突状细胞及其前体细胞的分选技术树突状细胞的分选技术有多种,包括磁珠分选法、荧光激活细胞分选法、流式细胞术等。
其中,磁珠分选法和荧光激活细胞分选法是最常用的方法。
但是,这些技术仍然存在一些问题,如低细胞产率、样本污染等。
针对以上问题,研究人员提出了新的树突状细胞分选技术。
该技术利用细胞表面标志物的特异性结合,选择性地分选出树突状细胞及其前体细胞,使得分选效率和细胞纯度大幅提高。
二、分选树突状细胞及其前体细胞的意义分选树突状细胞及其前体细胞对于研究人员而言具有重要的意义。
首先,分选出纯度高、细胞活性好的树突状细胞,可为检测、诊断、治疗和预防某些疾病提供更加可靠的实验依据。
其次,树突状细胞的前体细胞是一类极具潜力的细胞,可通过分选技术得到,进一步培养为树突状细胞,作为治疗癌症等疾病的新型治疗手段。
最后,树突状细胞及其前体细胞的分选技术对进一步探究人类免疫系统的生物学特性和机制具有重要意义。
三、树突状细胞及其前体细胞在疾病诊疗中的应用1、疫苗研制树突状细胞可用于疫苗的研制。
在病原体感染后,树突状细胞可识别病原体并进一步激活人类免疫系统,诱发人体产生特异性免疫应答,使人体产生抗体,从而防止疾病的发生。
2、免疫治疗树突状细胞可用于治疗某些疾病。
通过将病人的树突状细胞或其前体细胞分选出来,进一步培养并激活,再注射到病人体内,可刺激机体产生免疫应答,有助于治疗癌症等疾病。
3、临床检测树突状细胞可用于临床检测。
通过检测树突状细胞数量和功能状态等指标,可以了解免疫系统是否正常,从而为临床诊疗提供指导。
四、结语总之,分选树突状细胞及其前体细胞是研究人员深入探究树突状细胞在疾病诊断和治疗上的关键步骤。
树突状细胞信号传导机制研究

树突状细胞信号传导机制研究树突状细胞是一种免疫细胞,它们在体内的免疫防御中起着至关重要的作用。
树突状细胞的信号传导机制研究,对于深入了解免疫细胞在免疫防御中的作用机理,以及发现免疫相关疾病的机制,具有重要的意义。
树突状细胞是由单核细胞分化而来的,其形态独特,细胞体多枝,从而被称为树突状细胞。
这种细胞有着很强的抗原递呈功能,在体内的免疫调节及感染防御中都起到了关键的作用。
树突状细胞的信号传导机制十分复杂,其中最重要的部分即是针对抗原处理过程所引发的细胞信号分子的产生。
这些信号分子通过复杂的反应机制,参与了树突状细胞的成熟和活化,从而激活了免疫细胞的功能。
在树突状细胞的信号传导机制中,有着诸多的关键分子。
其中最为重要的一类分子,即是与T细胞活化和分化相关的细胞因子。
这些因子在树突状细胞的成熟和活化中,都具有不同的作用。
目前的研究表明,当树突状细胞处于成熟状态时,它们能够产生各种细胞因子,如IL-12、IL-15、IL-6等,这些因子能够激活T细胞,并促进其分化和增殖。
此外,树突状细胞还能够通过表面分子和共刺激分子来促进免疫应答,并与T细胞进行联系。
针对树突状细胞信号传导机制的研究,不仅是对于免疫学领域的重要进展,也为它们在各种疾病中的治疗提供了新的思路和方向。
例如,在病毒和细菌感染中,树突状细胞的信号传导机制是非常重要的,特别是在HIV感染过程中。
然而,目前的研究表明,HIV感染会破坏树突状细胞的正常功能,从而扰乱免疫系统的正常运作。
因此,对于树突状细胞的信号传导机制的深入研究,对于理解HIV感染的机制,针对性地开展疗法具有非常重要的意义。
除此之外,针对树突状细胞信号传导机制的研究还涉及到肿瘤的治疗。
在现有临床治疗技术中,使用免疫治疗来治疗肿瘤已成为一种热门的方法。
树突状细胞疫苗作为免疫治疗肿瘤的一种手段,在现代医学中越来越受到重视。
这种疫苗能够通过树突状细胞的抗原递呈功能,向机体中注入相应的抗原,从而激活机体的免疫反应,达到杀死肿瘤细胞的效果。
树突状细胞讲解

1.是免疫调节的核心角色之一,它能够识别和捕获外来抗原,并将其转化为适合T细胞识别的形式,使T细胞得以活化,从而加强身体的免疫应答能力。
2.树突状细胞的T细胞激活功能主要是通过表达共刺激分子、分泌细胞因子等方式实现的,这些机制能够促进T细胞的扩增、增强其杀伤力等,进而对抗各类病原体。
树突状细胞的结构与功能
02
树突状细胞在免疫调节中的作用机制
The mechanism of dendritic cells in immune regulation.
树突状细胞识别并展示抗原
3个Biblioteka 激活和招募免疫细胞诱导T细胞功能活化
树突状细胞在中发挥着重要的作用。具体来说,树突状细胞可以通过表达共刺激分子和分泌多种细胞因子,使得T细胞得到激活和增殖,并分化为不同类型的效应T细胞,如细胞毒性T细胞、辅助T细胞等,从而发挥不同的免疫调节功能。此外,树突状细胞还可以通过捕获、处理并呈递抗原,引导T细胞进行特异性免疫反应,依据受体多样性和不同种类的抗原处理途径,引导T细胞分化为特定亚型,并形成记忆T细胞。这些过程的顺利进行对于免疫机体的正常运作和捍卫机体免疫平衡至关重要。
2. 树突状细胞与CAR-T细胞联合治疗的适应症:该治疗方法适用于多种恶性肿瘤,包括淋巴瘤、白血病和实体瘤等。尤其是一些难治性疾病,如转移性肿瘤和复发性肿瘤,其治疗效果更为突出。
3. 树突状细胞与CAR-T细胞联合治疗的应用前景:随着细胞治疗技术的不断发展和完善,该治疗方法在临床应用中已经取得了一些成功。而且由于该治疗方法的特殊性质,其治疗效果相对持久,疗效持续时间较长,患者生存期明显延长。因此,该治疗方法具有广阔的应用前景,也是近年来细胞治疗领域的一个重要研究方向。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
树突状细胞的生物学功能的研究进展树突状细胞(dendritic cells,DC)是目前人体内最活跃,功能最强大的专职抗原呈递细胞,是人体对免疫原产生免疫应答的重要细胞之一。
DC 广泛存在于血液、淋巴、肝脾及皮肤黏膜等组织,能激活功能性淋巴细胞,并产生细胞毒作用,提高机体免疫水平。
DC对抗原和弱抗原都有很高的呈递效率,只需少量的抗原及DC即可激活T细胞,因此成为抗肿瘤和抗病毒免疫研究中的热点。
1DC的来源与分化发育DC 的产生分两个阶段:从祖细胞分化为未成熟DC和未成熟DC受外界刺激( 如细菌产物、坏死物及及各种细胞因子) 分化成熟。
1.1DC的分化体内DC 起源于多能造血干细胞,按来源其分化途径分为两条: ①髓系分化途径。
称为髓系DC( myebiod,DC1) ,最终分化为朗格汉斯细胞和间质DC两个亚群。
DC1 由髓样干细胞在粒细胞巨噬细胞集落刺激因子( granulocyte-macrophagecolony stimulati ng factor,GM-CSF) 、肿瘤坏死因子α刺激下诱生为DC。
亦有来源于外周血单核细胞,也称为DC1 前体细胞,在GM-CSF、白细胞介素4( interleukin-4,IL-4) 作用下或穿越内皮细胞并吞噬异物后分化为DC。
②淋巴系分化途径。
为淋巴系DC( lymphoid,DC2) ,最终分化为类浆细胞DC。
DC2 的前体细胞不表达髓系抗原,也无吞噬、吞饮抗原能力,低表达GM-CSF,高表达IL-3 受体,在IL-3 刺激下分化为DC2。
目前对DC 亚群及分化的研究主要来源于体外培养的方法,体内天然DC 亚群的分类仍有待于进一步研究[1]。
1.2DC的表型变化DC的发育分为成熟与未成熟阶段,两者具有不同的生物学特征和细胞表型。
正常情况下,体内多数DC 处于未成熟阶段,其广泛分布于全身各外周组织,高表达吞噬相关受体( Fc 受体、补体受体、甘露糖受体) ,而不表达或低表达共刺激分子和黏附分子( CD14、CD54、CD40、CD80) 。
未成熟DC 有较强的抗原内吞和加工处理能力,而激发混合淋巴细胞反应能力较弱。
经过抗原摄取、炎性因子活化等一系列过程,DC 由未成熟转变为成熟,成熟DC 则高表达主要组织相容性复合体( major histocompatibilityco mplex,MHC) Ⅱ类分子和CD54、CD40、CD80、CD86等共刺激分子和黏附分子,CD8 3、CD25为成熟DC 的特征性标志。
成熟DC 的抗原呈递能力及体外激发混合淋巴细胞反应的能力强,而抗原摄取能力弱。
DC 的成熟过程同时伴有迁徙,在外周组织中摄取抗原后,通过延长树突状突起,改变趋化因子受体表达等方式进入淋巴结及淋巴管中成熟,并激发T 细胞反应。
2DC在免疫应答中的作用2.1外源性抗原的摄取与加工未成熟DC 具有极强的内吞能力,通过膜皱缩和形成大囊泡,形成液相内吞作用,可使极低浓度( 10‐10 mol /L) 抗原得到呈递,也可通过受体介导对糖基化抗原进行内吞。
被DC摄取的抗原分子经过MHCⅡ类途径处理、加工成为抗原多肽,再以MHCⅡ类分子/肽复合物形式呈递在DC表面,并可以维持较长时间( 24‐48 h) 的免疫激发功能。
未成熟DC 对吞饮速度快,吞饮量大,是体内抗原的主要摄取者[2]。
2.2 DC在免疫激活的作用摄取抗原后的DC逐渐成熟并表现出很强的免疫激活能力。
在与T 细胞的互动中,除提供MHCⅡ类分子/肽复合物的第一信号外,还高表达B7-1、B7-2、CD40分子,为T 细胞提供充足第二信号,来促进T 细胞的激活。
实验证明,DC还可参与B细胞的生长、分化与抗体生成。
通过诱导T 细胞生成B 细胞刺激因子,作用于B细胞,使其分泌IgG、IgA、IgM[3]。
2.3诱导自身免疫耐受DC是体内唯一能激活静息型T 细胞产生初次免疫应答的细胞,并且能通过点状放大刺激,激活T 细胞增殖。
因此,在诱导T细胞活化或耐受过程中,DC发挥着十分重要的作用。
未成熟DC 诱导免疫激活的能力较弱。
有学者推测,未成熟DC很可能在免疫耐受的产生中发挥了重要作用,目前无直接证据支持这一理论。
有观点认为DC的不同成熟状态有着不同的功能,DC的不同成熟状态不仅决定T 细胞的激活程度,而且决定T细胞的反应类型[4]。
存在于非淋巴组织中( 如肝、肾、皮肤、血液等) 的DC 是一群未成熟DC,具有极强的摄取、处理和一定的呈递抗原能力。
由于缺乏B7等共刺激分子,不能活化T 细胞,反而使T 细胞功能失活,诱导T 细胞耐受,被认为是“耐受性DC”。
2.4抗原提呈DC通过受体介导的内吞作用,巨吞饮及吞噬作用捕获可溶性抗原。
可溶性抗原多数在富含主要组织相容性复合体II( MHCII) 类分子的细胞内隔室中被降解成多肽,并与MHCII 类分子结合成复合物表达于DC 表面,提呈给分化抗原4 阳性T 淋巴细胞( CD4 + T) ,少数通过主要组织相容性复合体I( MHCI)类分子途径提呈给分化抗原8阳性T 淋巴细胞( CD8 +T)[5]。
2.5与辅助性T 淋巴细胞( Th) 细胞相互作用并参与免疫调节Th 在免疫应答和免疫调节中发挥重要作用,按其产生细胞因子种类,Th可分为辅助性T 淋巴细胞1(Th1) 和辅助性T 淋巴细胞2(Th2)细胞,Th1和Th2细胞的分化和功能平衡在维持机体免疫自稳中有重要地位。
Th细胞的前体在抗原刺激下分化为中间阶段辅助性T 淋巴细胞(Th0),在不同微环境中Th0细胞选择性分化为Th1和Th2细胞。
髓系DC 通过分泌白介素12(IL-12)促使Th0向Th1分化,并介导细胞免疫应答;淋巴系DC通过分泌白介素4( IL-4)促使Th0向Th2分化,并介导体液免疫应答。
DC可分泌多种细胞因子和多种趋化因子,参与免疫调节及趋化免疫细胞[6]。
3 DC 抗肿瘤免疫机制人体的抗肿瘤免疫流程:①肿瘤相关抗原的摄取与呈递;②激活肿瘤相关抗原特异性T 细胞;③引导肿瘤相关抗原特异性T 细胞至肿瘤部位,杀灭肿瘤细胞。
机体抗肿瘤免疫主要依靠细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的免疫应答来杀伤肿瘤细胞,CTL并不能识别完整的肿瘤抗原分子,只能特异性地识别来源于肿瘤抗原亲本、由MHC分子呈递的抗原多肽。
在大部分恶性肿瘤中,肿瘤细胞表面的MHC 抗原肽、共刺激分子和黏附分子表达较低,不能有效地诱导T细胞活化,故需要抗原呈递细胞的协同作用[7-8]。
作为体内抗原呈递能力最强的专职抗原呈递细胞,DC 在抗肿瘤免疫中起到“中枢性”的作用,其作用的发挥依赖于以下环节: DC 浸润入肿瘤组织;DC对肿瘤抗原的摄取、加工和呈递;DC的活化以及迁移进入次级淋巴器官诱导T细胞活化。
除诱导细胞免疫外,DC还可以增强体液免疫: 一方面,DC通过促进抗原特异性CD4+ Th 的产生,促进抗体生成;另一方面,DC直接作用于B细胞,促进免疫球蛋白的分泌。
淋巴系DC 中的类浆细胞可分泌Ⅰ型干扰素,直接诱导初始和记忆B 细胞分化为浆细胞,产生大量免疫球蛋白IgM[9]。
DC可以通过与某些肿瘤细胞相互接触,直接抑制肿瘤细胞的生长[10]。
肿瘤抗原致敏的DC可释放一种具有抗原呈递能力的囊泡小体exosomes,该小体内含有大量MHCⅠ、Ⅱ类分子和共刺激分子,能显著刺激抗原特异性CD8+ T细胞增殖,并诱导抗原特异性C TL 反应[11]。
研究表明,在肿瘤患者体内,DC的数量下降,功能也受到了不同程度的抑制,不能有效摄取、处理、呈递肿瘤抗原,使机体的免疫反应处于抑制状态,从而导致肿瘤的发生、发展。
另外,DC浸润、迁移和活化的局部微环境的变化,导致DC 不能进入肿瘤组织,不能有效地识别肿瘤提供的“危险”信号。
DC迁出肿瘤组织困难,会抑制DC表型和功能的成熟进程,从而抑制免疫反应的产生。
肿瘤局部DC的数量和功能状态与肿瘤进展部的预后明显相关[12],因此通过人为方法保证DC的高效运作成为肿瘤免疫治疗的有效途径。
4 DC 的培养正常人体内DC数量少,不能满足科研和临床的需要。
体外诱导培养DC技术的进步使DC疫苗抗肿瘤治疗成为可能。
体外诱导培养DC技术的进步使DC 疫苗抗肿瘤治疗成为可能。
目前用于治疗的DC多来自骨髓或外周血CD34+ 造血祖细胞、外周血DC及单核细胞,其中以单核细胞来源的DC应用最广。
获取DC的方法有: ①将来源于骨髓或外周血C D34+造血祖细胞在体外与GM-CSF和肿瘤坏死因子α共同培养,获得大量DC[13]。
②单核细胞在GM-CSF和IL-4共同作用下诱导分化为未成熟DC并在外来因素刺激下进一步分化为成熟DC[14]。
③Flt3 配体能动员DC进入外周血,显著增加外周血中DC 的数量,进而直接从外周血中分离纯化到大量DC[15]。
另外,有研究使用脐血来源的单个核细胞制备DC[16],即用脐血单个核细胞,在GM -CSF、IL-4和脐血中的细胞因子作用下分化成未成熟DC。
该实验用脐血浆取代肿瘤坏死因子α在较短时间内促进脐血单个核细胞分化成DC,充分利用脐血中富含的细胞因子,减少了重组细胞因子的用量,提供了一个由脐带血制备DC的相对简单、高效的途径。
参考文献[1]Naik SH.Demystifying the development of dendritic cell subtypes,a little[J].Immunology and CellBiology,2008,86(05):439.DOI:10.1038/icb.2008.28.[2]龚非力.医学免疫学[J].北京:科学出版社,2008,:38-39.DOI:10.1007/s11999-009-0969-5.[3]Dubios B;Vanberbliet B;Fayette J.Dendritic cells enhance growth and differentiation of CD40-activated B lymphocytes[J].Journal of Experimental Medicine,1997,185(05):941-951.DOI:10.1084/je m.185.5.941.[4]Fairchild PJ;Waldmann H.Dendritic cells and prospects for transplantation tolerance[J].Current Opinion in Immunology,2000,12(05):528-535.DOI:10.1016/S0952-7915(00)00134-5.[5]Bykovskaia SN;Shurin GV;Graner S.Differentiation of immunostimulatory stem-cell- and monocyte-derived dendritic cells involves maturation of intracelluar compartments responsible for antige n presentation and secretion[J].Stem Cells,2002,20:380-393.DOI:10.1634/stemcells.20-5-380. [6]Albert,ML,Sauter,B,Bhardwaj,N et al.Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs.[J].Nature,1998,392(6671):86-89.DOI:10.1038/32183.[7]TATSUMI T;TAKEHARA T;KATAY AMA K.Expression of costimulatory molecules B7-1 and B7-2 on human Hepatocellular carcinoma[J].Hepatology,1997,2(05):1108-1114.DOI:10.1002/hep.510250511.[8]Nestle FO;Burg G;Dummer R.New perspectives on immunobiology and immuneotherapy of melanoma[J].Immunology Today,1999,20(01):5-7.DOI:10.1016/S0167-5699(98)01373-5.[9]Poeck H;Wagner M;Battiany J.Plasmacytoid dendritic cells, antigen, and CpG-C license human Bcells for plasma cell differentiation and immunoglobulin production in the absence of T-cell help[J].Blood,2004,103(08):3058-3064.DOI:10.1182/blood-2003-08-2972.[10]Bishop, J G,Schanbacher, F L,Ferguson, L C et al.In vitro growth inhibition of mastitis-causingcoliform bacteria by bovine apo-lactoferrin and reversal of inhibition by citrate and high con centrations of apo-lactoferin.[J].2004,.DOI:"".[11]Siguo Hao,Ou Bai,Jinying Yuan et al.Dendritic Cell-Derived Exosomes Stimulate Stronger CD8+ CTL Responses and Antitumor Immunity than Tumor Cell-Derived Exosomes[J].中国免疫学杂志(英文版),2006,3(3):205-211.[12]Bizzoca, Antonella,Corsi, Patrizia,Gennarini, Gianfranc et al.The mouse F3/contactin glycoprotein: Structural features, functional properties and developmental significance of its regulated expr ession[J].2010,.DOI:"".[13]Fay JW;Palucka AK;Paczesny S.Long-term outcomes in patients with metastatic melanoma vaccinated with melanoma peptide-pulsed CD34+ progenitor-derived dendritic cells[J].Cancer Immun ology Immunotherapy,2006,55(10):1209.DOI:10.1007/s00262-005-0106-6.[14]Burton, J D,Bamford, R N,Peters, C et al.A lymphokine, provisionally designated interleukin Tand produced by a human adult T-cell leukemia line, stimulates T-cell proliferation and the i nduction of lymphokine-activated killer cells.[J].2001,.DOI:"".[15]Lundie, RJ,de Koning-Ward, TF,Davey, GM et al.Blood-stage Plasmodium infection induces CD8(+) T lymphocytes to parasite-expressed antigens, largely regulated by CD8 alpha(+) dendritic cells[J].Proceedings of the National Academy of Sciences of the United States of America,20 08,105(38):14509-14514.DOI:10.1073/pnas.0806727105.[16]Saeid Abediankenari,Ghasem Janbabaei Mollae,Maryam Ghasemi et al.Vaccination of Diffuse Large B- Cell Lymphoma Patients with Antigen-Primed Dendritic Cells[J].Acta Medica Iranica,20 13,51(5).。
