水溶液中的三大平衡练习题
水溶液中的三大平衡练习题

水溶液中的“三大平衡”(1)题型:选择题6分,电离度(2016),沉淀溶解平衡、溶度积常数(2015、2013)、K sp 计算(2014)、离子积常数(2012) 选择题:每小题只有一项符合题意。
1.醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是①醋酸与水能以任意比互溶 ②醋酸溶液能导电 ③醋酸溶液中存在醋酸分子 ④0.1 mol ·L -1醋酸的pH 比0.1 mol ·L -1盐酸的pH 大 ⑤醋酸能和碳酸钙反应放出CO 2 ⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H 2速率慢 A .②⑥B .③④⑤C .③④⑥D .①②2.下列叙述正确的是A .盐酸中滴加氨水至中性,溶液中溶质为氯化铵B .NaHSO 4溶液、KF 溶液、KAl(SO 4)2溶液、NaI 溶液中,前三个都对水的电离平衡产生影响,且都促进水的电离C .向NaAlO 2溶液中滴加NaHCO 3溶液,有沉淀和气体生成D .25℃时,用醋酸溶液滴定等浓度NaOH 溶液至pH = 7,V (醋酸) > V (NaOH)3.将浓度为0.1 mol ·L -1HF 溶液加水不断稀释,下列各量始终保持增大的是A .c (H +)B .K a (HF)C .c (F -)c (H +)D .c (H +)c (HF)4.对滴有酚酞试液的下列溶液,操作后颜色变深的是 A .明矾溶液加热B .CH 3COONa 溶液加热C .氨水中加入少量NH 4Cl 固体D .小苏打溶液中加入少量NaCl 固体5.下列溶液中粒子的物质的量浓度关系正确的是A .0.1 mol ·L -1NaHCO 3溶液与0.1 mol ·L -1NaOH 溶液等体积混合,所得溶液中:c (Na +) > c (CO 2-3) > c (HCO -3) > c (OH -)B .20 mL 0.1 mol ·L -1CH 3COONa 溶液与10 mL 0.1 mol ·L -1HCl 溶液混合后溶液呈酸性,所得溶液中:c (CH 3COO -) > c (Cl -) > c (CH 3COOH) > c (H +)C .室温下,pH = 2的盐酸与pH = 12的氨水等体积混合,所得溶液中:c (Cl -) + c (H +) > c (NH +4) + c (OH -)D .0.1 mol ·L -1CH 3COOH 溶液与0.1 mol ·L -1NaOH 溶液等体积混合,所得溶液中:c (OH -) > c (H +) + c (CH 3COOH)6.常温下,0.2 mol ·L -1的一元弱酸HA 与等浓度的NaOH 溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是A .HA 为强酸B .该混合液pH = 7C .图中X 表示HA ,Y 表示OH -,Z 表示H+D .该混合溶液中:c (A -) + c (Y) = c (Na +)7.室温下,甲、乙两烧杯均盛有5 mL pH = 3的某一元酸溶液,向乙烧杯中加水稀释至pH = 4。
(完整版)水溶液中的离子平衡典型练习题及答案

水溶液中的离子平衡1.常温下将稀NaOH溶液和稀CH3COOH溶液混合,溶液中不可能出现的结果是().A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)D.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)2. 在25℃,将a mol/L的氨水与b…的盐酸等体积混合,反应后显中性…用含a和b的代数式表示该混合溶液中一水合氨的电离平衡常数是?3.水的电离平衡曲线如图所示,下列说法中,正确的是()A、图中A、B、D三点处Kw的大小关系:B>A>DB、25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3?H2O)的值逐渐减小C、在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点D、A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、S042-4. 设水的电离平衡线如图所示:(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____增加到____,造成水的离子积增大的原因是____.(2)将pH=8的Ba(OH) 2 溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲混合溶液pH=7,则Ba(OH) 2 溶液与盐酸的体积比为____.(3)100℃时,已知某强酸溶液的pH酸与某强碱溶液的pH碱存在如下关系:pH酸+ pH碱=13,若要使该强酸与该强碱混合后溶液呈中性,则该强酸溶液的体积与强碱溶液的体积之比为__5. 已知NaHSO4在水中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确的是()A.该温度高于25℃B.由水电离出来的H+的浓度是1.0×10-10mol/LC.加入NaHSO4晶体抑制了水的电离D.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性6.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=已知某无色溶液的AG=12,则在此溶液中能大量共存的离子组是( )A.Na+、AlO2-、K+、NO3-B.MnO4-、K+、SO42-、Na+C.NH4+、NO3-、Al3+、Cl-D.Mg2+、SO42-、HCO3-、Na+7.下列事实能说明醋酸是弱电解质的是( )①醋酸与水能以任意比互溶②醋酸溶液能导电③醋酸溶液中存在醋酸分子④1mol/L醋酸的pH比0.1mol/L盐酸pH大⑤醋酸能和碳酸钙反应放出CO2⑥0.1mol/L醋酸钠溶液pH=8.9⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢A.②⑥⑦B.③④⑥⑦C.③④⑤⑥D.①②③8.关于小苏打水溶液的表述正确的是()A.c (Na+)=c (HCO3-)+c (CO32-)+2c (H2CO3)B.c (Na+)+c (H+)=c (HCO3-)+c (CO32-)+c (OH-)C.HCO3-的电离程度大于HCO3-的水解程度D.存在的电离有:NaHCO3=Na++HCO3-,HCO3-⇌H++CO32-,H2O⇌H++OH-9.下列有关电解质溶液中微粒的物质的量浓度关系正确的是()A.在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)B.在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)10. (1)在25°C时,已知0.1mol/LHCN溶液的PH=4,0.1mol/LNaCN溶液的pH=12.现将0.2mol/L 的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液中各种离子的浓度有大到小的关系为______.(2)常温下,将0.01molNH4Cl和0.002molNaOH溶于水,配制成0.5L混合溶液.试回答(填写数据):①溶液中c(NH4+)+c(NH3•H2O)一定等于______②溶液中n(OH-)+n(Cl-)-n(NH+4)=______.11某二元弱酸的酸式盐,NaHA溶液,若PH<7,则溶液中各离子的浓度关系不正确的是A C(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)B c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)C c(H+)+ c(HA-)= c(OH-)+ c(H2A)D c(Na+)= c(HA-)+ c(H2A)+ c(A2-).答案1.在电解质溶液中存在三个守恒:①电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),②物料守恒,③质子守恒,故B正确;D项pH=7,c(H+)=c(OH-),则有c(Na+)=c(CH3COO-),故D项错;A项NaOH是强电解质NaOH====Na++OH-,当两溶液混合OH-参加反应被消耗,而Na+不参加反应,故c(Na+)>c(OH-),同理c (CH3COO-)>c(H+),故A项错;C项pH<7,醋酸过量,结论正确。
水溶液中的离子平衡测试题及答案

第三章 水溶液中的离子平衡 测试题一、选择题1.将纯水加热至较高温度,下列叙述正确的是( )A.水的离子积变大、pH变小、呈酸性 B.水的离了积不变、pH不变、呈中性C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性2.下列有关“电离平衡”的叙述中正确的是( )A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动D.电解质达到电离平衡后,各种离子的浓度相等3.下列关系一定正确的是( )A.当溶液中c(H+)>10-7 molL-1时,其pH<7,溶液呈现酸性B.当溶液中c(H+)>10-7 molL-1时,其pH>7,溶液呈现碱性C.当溶液中c(H+)=c(OH-)>10-7 molL-1时,其pH<7,溶液呈现中性D.当溶液中c(H+)=c(OH-)>10-7 molL-1时,其pH<7,溶液呈现酸性4.从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR 加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( )A.HR应为红色 B.HR应为蓝色 C.R-应为无色 D.R- 应为红色5.在稀氨水溶液中存在如下平衡体系:NH3·H2ONH4++OH-,当增大溶液的pH时,c(NH4+)会( )A.可能增大也可能减小 B.增大 C.减小 D.无变化6.将pH=1的盐酸平均分为2份,1份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高1,则加入的水与NaOH 溶液的体积比为( )A.9 B.10 C.11 D.12 7.有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )A.氨水的电离作用大于氯化铵的水解作用 B.氯化铵的水解作用大于氨水的电离作用C.氨水的存在抑制了氯化铵的水解 D.氯化铵的存在抑制了氨水的电离8.将0.lmol∙L-1醋酸溶液加水稀释,下列说法正确的是( )A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大C.醋酸电离平衡向左移动 D.溶液的pH增大9.室温下,某溶液中由水电离出的c(OH-)=10-5mol·L-1,则其溶质可能是( )A.CH3COOH B.H2SO4 C.NaOH D.Na2CO310.pH=3的醋酸溶液加水冲稀到原溶液体积的3倍,则稀释后的pH为( )A.3.2 B.3.5 C.3.7 D.411.已知,往0.1mol∙L-1的氨水中滴入酚酞试液时,溶液将呈现粉红色。
高考常考选择题训练——水溶液中的离子平衡

选择题12水溶液中的离子平衡角度一溶液中的三大平衡及影响因素1.三大平衡影响因素电离平衡CH3COOH CH3COO -+H+水解平衡CH3COO-+H2O CH3COOH+OH-沉淀溶解平衡AgCl(s)Ag+(aq)+Cl-(aq)(或物质)2.影响水电离程度大小的常考因素3.溶液中离子浓度大小比较(1)紧扣两个微弱电离是微弱的,大多数盐的水解也是微弱的。
(2)牢记三大守恒①电荷守恒:电解质溶液中阴离子所带电荷总数等于阳离子所带电荷总数,根据电荷守恒可准确、快速地解决电解质溶液中许多复杂的离子浓度问题。
如(NH4)2CO3与NH4HCO3的混合溶液中一定有:c(NH+4)+c(H+)=2c(CO2-3)+c(HCO-3)+c(OH-)。
②物料守恒:物质发生变化前后,有关元素的存在形式不同,但元素的种类和原子数目在变化前后保持不变,根据物料守恒可准确、快速地解决电解质溶液中复杂离子、分子的物质的量浓度或物质的量的关系。
如:0.1mol·L-1NaHCO3溶液中一定有c(Na+)=c(HCO-3)+c(CO2-3)+c(H2CO3)=0.1mol·L-1。
0.1mol·L-1CH3COOH溶液与0.1mol·L-1CH3COONa溶液等体积混合一定有:c(CH3COOH)+c(CH3COO-)=2c(Na+)=0.1mol·L-1。
③质子守恒:在电离或水解过程中,会发生质子(H+)转移,但质子转移过程中其数量保持不变。
将混合溶液中的电荷守恒式和物料守恒式相联立,通过代数运算消去其中未参与平衡移动的离子,即可推出溶液中的质子守恒式。
(3)解题思维流程1.正误判断,正确的打“√”,错误的打“×”(1)LiH 2PO 4溶液中含P 元素的粒子有H 2PO -4、HPO 2-4和PO 3-4( )(2018·天津,6B 改编) (2)常温下,pH =2的H 3PO 4溶液,加水稀释使电离度增大,溶液pH 减小( )(2019·全国卷Ⅲ,11C)(3)常温下,pH =2的H 3PO 4溶液,加入NaH 2PO 4固体,溶液酸性增强( )(2019·全国卷Ⅲ,11D)(4)碳酸钠可用于去除餐具的油污( )(2018·全国卷Ⅱ,7A)(5)100mL1mol·L -1FeCl 3溶液中所含Fe 3+的数目为0.1N A ( )(2018·全国卷Ⅱ,11B)(6)常温下,pH =2的H 3PO 4溶液,c (H +)=c (H 2PO -4)+2c (HPO 2-4)+3c (PO 3-4)+c (OH -)( )(2019·全国卷Ⅲ,11B)答案 (1)× (2)× (3)× (4)√ (5)× (6)√2.(2016·全国卷Ⅲ,13)下列有关电解质溶液的说法正确的是( ) A.向0.1mol·L -1CH 3COOH 溶液中加入少量水,溶液中c (H +)c (CH 3COOH )减小B.将CH 3COONa 溶液从20℃升温至30℃,溶液中c (CH 3COO -)c (CH 3COOH )·c (OH -)增大C.向盐酸中加入氨水至中性,溶液中c (NH +4)c (Cl -)>1D.向AgCl 、AgBr 的饱和溶液中加入少量AgNO 3,溶液中c (Cl -)c (Br -)不变答案 D解析 A 项,c (H +)c (CH 3COOH )=K a c (CH 3COO -),加水稀释,c (CH 3COO ―)减小,K a 不变,所以比值增大,错误;B 项,c (CH 3COO -)c (CH 3COOH )·c (OH -)=1K h(K h 为水解常数),温度升高,K h 增大,比值减小,错误;C 项,向盐酸中加入氨水至中性,根据电荷守恒:c (NH +4)+c (H +)=c (Cl ―)+c (OH -),此时c (H +)=c (OH ―),故c (NH +4)=c (Cl ―),所以c (NH +4)c (Cl -)=1,错误;D 项,在饱和溶液中c (Cl -)c (Br -)=K sp (AgCl )K sp (AgBr ),温度不变K sp 不变,则溶液中c (Cl -)c (Br -)不变,正确。
溶液中的三大平衡-高考化学专题复习与测试

D.当
lg
V V0
=
2
时,若两溶液同时升高温度,则
cc((MR++))增大
解析:由图象分析浓度为 0.10 mol·L-1 的 MOH 溶液, 在稀释前 pH 为 13,说明 MOH 完全电离,则 MOH 为 强碱,而 ROH 的 pH<13,说明 ROH 没有完全电离,ROH 为弱碱。A 项,MOH 的碱性强于 ROH 的碱性,正确。 B 项,曲线的横坐标 lgVV0越大,表示加水稀释体积越大, 由曲线可以看出 b 点的稀释程度大于 a 点,弱碱 ROH 存 在电离平衡:ROH R++OH-,溶液越稀,
B 项,向溶液中加入 0.05 mol CaO,则 CaO+
H2O===Ca(OH)2 , 则
c(OH - ) 增 大 , 且
Ca2
+
+
CO
2- 3
===CaCO3↓,使 CO23-+H2O HCO- 3 +OH-平衡左移,
c(HCO- 3 )减小,故cc((HOCHO-3-))增大,正确;C 项,加入
答案:D
题组二 考查盐类水解及其应用
3.室温下,将 0.05 mol Na2CO3 固体溶于水配成 100 mL 溶液,向溶液中加入下列物质。有关结论正确的是
() 选项 加入的物质
结论
50 mL
反应结束后,c(Na+)=
A 1 mol·L-1H2SO4 c(SO24-)
B
0.05 mol CaO 溶液中cc((HOCHO-3-))增大
专题九 电解质溶液
考点二 溶液中的三大平衡
1.(2018·北京卷)测定 0.1 mol·L-1Na2SO3 溶液先升温 再降温过程中的 pH,数据如下。
时刻 ① ② ③ ④ 温度/℃ 25 30 40 25
高三化学二轮复习 溶液中的“三大平衡”(学案及训练)
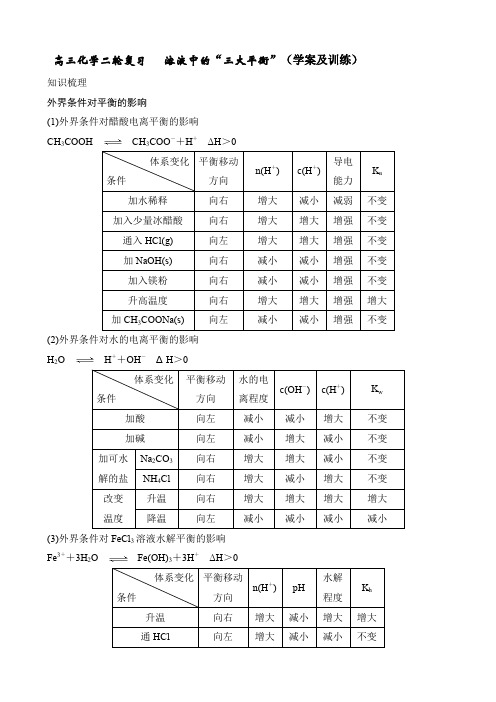
高三化学二轮复习 溶液中的“三大平衡”(学案及训练)知识梳理外界条件对平衡的影响(1)外界条件对醋酸电离平衡的影响 CH 3COOHCH 3COO -+H + ΔH >0(2)外界条件对水的电离平衡的影响 H 2OH ++OH - ΔH >0(3)外界条件对FeCl 3溶液水解平衡的影响 Fe 3++3H 2OFe(OH)3+3H + ΔH >0(4)外界条件对AgCl 溶解平衡的影响 AgCl(s)Ag +(aq)+Cl -(aq) ΔH >0注意对溶液中同时存在的其他平衡的影响。
强化训练1.(2019·课标全国Ⅲ,11)设N A 为阿伏加德罗常数值。
关于常温下pH =2的H 3PO 4溶液,下列说法正确的是( )A.每升溶液中的H +数目为0.02N AB.c (H +)=c (H 2PO -4)+2c (HPO 2-4)+3c (PO 3-4)+c (OH -)C.加水稀释使电离度增大,溶液pH 减小D.加入NaH 2PO 4固体,溶液酸性增强 答案 B2.下列有关电解质溶液的说法正确的是( )A.向0.1 mol·L -1CH 3COOH 溶液中加入少量水,溶液中c (H +)c (CH 3COOH )减小B.将CH 3COONa 溶液从20 ℃升温至30 ℃,溶液中c (CH 3COO -)c (CH 3COOH )·c (OH -)增大C.向盐酸中加入氨水至中性,溶液中c (NH +4)c (Cl -)>1D.向AgCl 、AgBr 的饱和溶液中加入少量AgNO 3,溶液中c (Cl -)c (Br -)不变答案 D3.(2019·北京理综,12)实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。
下列说法正确的是()A.随温度升高,纯水中c(H+)>c(OH-)B.随温度升高,CH3COONa溶液的c(OH-)减小C.随温度升高,CuSO4溶液的pH变化是K w改变与水解平衡移动共同作用的结果D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同答案 C4测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
水溶液中三大守恒

二、两种电解质溶液混合后离子浓度大小的比较
1、 两种物质混合不反应:
【例】:用物质的量都是 0.1 mol 的 CH3COOH和 CH3COONa配制成 1L 混合溶液,已知其中
C(CH3COO- ) > C(Na+) ,对该混合溶液的下列判断正确的是 ( )
A.C(H+) > C(OH-)
B.C(CH
C.c(NH 4+)= c(Cl -)> c(H +)= c(OH -) D.c(Cl -)=c(NH 4+)> c(H +)>c(OH -)
分析: 由于氯化铵溶液中存在下列电离过程: NH 4Cl=NH 4++Cl -, H2O
H++OH- 和水解过
程: NH 4++H2O
H++NH 3 ·H2O,由于
解析 :上述溶液混合后,溶质为 HCN 和 NaCN ,由于该题已说明溶液显碱性,所以不能
再按照 HCN 的电离处理,而应按 NaCN 水解为主。所以 c(Na+)>c(CN - ),选 B D
变式: pH 等于 7 型
【例 5】 . (2002 年全国高考理综 ) 常温下,将甲酸和氢氧化钠溶液混合,所得溶液
0.1mol/LKHC 2O4 溶液
中,下列关系正确的是( CD)
A. c(K+)+ c(H+)= c(HC2O4- )+ c(OH-)+
c
(C2
O 24
)
B
. c(HC2O4-)+ c (C2O42-)=0.1mol/L
C.
c
(C2
O 24
)
高考化学《水溶液中的四大平衡》专题训练

高考化学《水溶液中的四大平衡》专题训练知识网络:水溶液中的三大守恒规律:物料守恒、电荷守恒、质子守恒(H+的得失守恒)。
例1.(沉淀的溶解平衡)1.常温下,现将足量的AgCl固体分别放入下列液体中,AgCl的溶解度由大到小排序正确的是( B)①20mL 0.1mol/L(NH4)2CO3溶液②40mL 0.03mol/L HCl溶液③50mL 0.05mol/L AgNO3溶液④30mL 0.02mol/L CaCl2溶液⑤10mL蒸馏水⑥30mL 0.02mol/L NH4NO3溶液A.②>③>④>⑥>⑤>①B.①>⑥>⑤>②>④>③C.①>②>③>④>⑤>⑥D.③>②>④>⑥>①>⑤解:AgCl在溶液中存在溶解平衡AgCl(aq)Ag+(aq)+Cl-(aq),由于c(Ag+)或c(Cl-)对溶解平衡有抑制作用,则溶液中c(Ag+)或c(Cl-)越大,则AgCl的溶解度越小;①和⑥中铵根离子水解生成NH3•H2O,Ag+与NH3•H2O结合,使溶解平衡正移,AgCl的溶解度增大,由于(NH4)2CO3中NH4+水解程度大,则NH3•H2O的浓度大,使溶解平衡正移的程度大,则①>⑥;当溶液中存在c(Ag+)或c(Cl-)对溶解平衡有抑制作用,②c(Cl-)=0.03mol/L,③c(Ag+)=0.05mol/L,④c(Cl-)=0.04mol/L,⑤c(Ag+)或c(Cl-)为0,则AgCl的溶解度由大到小排列顺序是:⑤>②>④>③,综上可知AgCl的溶解度由大到小排列顺序是:①>⑥>⑤>②>④>③;故合理选项是B。
例2.(水、弱酸、弱碱的电离平衡)2.1.在pH均为9的NaOH和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为c1 mol/L与c2 mol/L,则(B )A.c1>c2B.c1=10-4c2C.c2=10-4c1D.c1=c22.2.四种弱酸的电离常数列于下表:①向H 3BO 3溶液中滴加等浓度的Na 2CO 3溶液不发生反应②向KClO 溶液中通入少量CO 2,产物为HClO 和KHCO 3③向KClO 溶液中通入过量SO 2,产物为HClO 和KHSO 3④等体积等浓度的Na 2CO 3和Na 2SO 3溶液相比,后者阴离子的数目更多A.1个B.2个C.3个D.4个解:①H 3BO 3的电离平衡常数,比碳酸的第二步电离平常大,说明H 3BO 3的酸性比HCO 3-的酸性强,向H 3BO 3溶液中加入Na 2CO 3会发生反应,生成HCO 3-,符合题意;②HClO 的电离平衡常数比碳酸的K 1小,但是比K 2大,向KClO 通入CO 2,能生产HClO 和HCO 3-,不符合题意;③ClO-具有强氧化性,SO 2具有还原性,会发生氧化还原反应,生成Cl -和SO 42-,符合题意;④Na 2CO 3溶液中,根据电荷守恒,c(Na +)+c(H +)=2c(CO 32-)+c(HCO 3-)+c(OH -),同样的在Na 2SO 3溶液中,也有c(Na +)+c(H +)=2c(SO 32-)+c(HSO 3-)+c(OH -),不能直接比阴离子浓度,但是可以通过阳离子浓度来比较,c(Na +)相同,c(H +)越大,阳离子浓度,则阴离子浓度越大。
高三化学水溶液三大平衡及其常数-复习课课后作业

水溶液中的三大平衡及其常数的一个计算(限时:45分钟)1.下列说法不正确的是( )A .25 ℃,pH =4的HF 溶液与pH =10的氨水中水电离出的c (H +)相同B .25 ℃,0.01 mol ·L -1的HA 溶液的pH =5,则K a (HA)为1×10-8C .Na 2CO 3溶液加水稀释,c (CO 2-3)c (OH -)·c (HCO -3)在溶液中保持不变 D .已知在相同条件下,HF 的酸性强于CH 3COOH ,则物质的量浓度相等的NaF 与CH 3COOK 溶液中:c (Na +)-c (F -)>c (K +)-c (CH 3COO -)2.室温下,下列说法中正确的是( )A .0.1 mol ·L -1的NaHA 溶液pH =1则有:c (Na +)=c (H 2A)+c (HA -)+2c (A 2-)B .向NaAlO 2溶液中逐滴加入稀盐酸至沉淀恰好消失时:c (Cl -)=3c (Al 3+)C .将a mol ·L-1的醋酸溶液与0.01 mol·L -1的氢氧化钠溶液等体积混合,溶液中:c (Na +)=c (CH 3COO -),醋酸的电离常数K a =2×10-9a -0.01(用含a 的代数式表示) D .向NH 4Cl 溶液中加入少量等物质的量浓度的稀盐酸,则c (NH +4)c (NH 3·H 2O )的值增大 3.(2019·青岛一模)已知pOH =-lg c (OH -),向20 mL 0.1 mol·L -1的氨水中滴加未知浓度的稀硫酸,测得混合溶液的温度、pOH 随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )A .稀硫酸的物质的量浓度为0.05 mol·L -1B .当溶液中pH =pOH 时,水的电离程度最大C .a 点时溶液中存在(NH 3·H 2O)+2(OH -)=(NH +4)+2(H +)D .a 、b 、c 三点对应NH +4的水解平衡常数:K h (b)>K h (a)>K h (c)4.(2019·北京高考)实验测得0.5 mol·L -1 CH 3COONa 溶液、0.5 mol·L -1 CuSO 4溶液以及H 2O 的pH 随温度变化的曲线如图所示。
【水溶液中的平衡+图像应用】专项训练30题-康康

A.a~b 点导电能力增强,说明 HR 为弱酸 B.b 点溶液 pH=5,此时酸碱恰好中和 C.c 点溶液存在 c(NH+4 )>c(R-)、c(OH-)>c(H+) D.b~c 任意点溶液均有 c(H+)·c(OH-)=Kw=1.0×10-14 10.下列关于甲、乙、丙、丁四个像的说法中,正确的是( )
C.若两溶液无限稀释,则它们的 c(OH-)相等
V
c(M+)
D.当 lgV0=2 时,若两溶液同时升高温度,则c(R+) 增大
9. 常温下,向 10 mL 0.1 mol·L-1 的 HR 溶液中逐滴滴入 0.1 mol·L-1 的 NH3·H2O 溶液,所得 溶液 pH 及导电性变化如图。下列分析不正确的是( )
A.曲线①代表滴定二甲胺溶液的曲线 B.a 点溶液中:c[(CH3)2NH2+]>c[(CH3)2NH·H2O] C.d 点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O] D.b、c、e 三点的溶液中,水的电离程度最大的是 b 点
18. (2019·南昌市高三三模)已知 298 K 时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni) =-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO32-)。在含物质的量浓度相同的 Na2S 和 Na2CO3 的 混合溶液中滴加 Ni(NO3)2 溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下 列说法错误的是( )
下列说法正确的是( ) A.滴定盐酸的曲线是图 2 B.两次滴定均可选择甲基橙或酚酞作指示剂 C.达到 B、E 点时,反应消耗的 n(CH3COOH)=n(HCl) D.以 HA 表示酸,当 0 mL<V(NaOH)<20.00 mL 时,图 2 对应混合液中各离子浓度由大到 小的顺序一定是 c(A-)>c(Na+)>c(H+)>c(OH-)
【高考化学】水溶液中的平衡问题
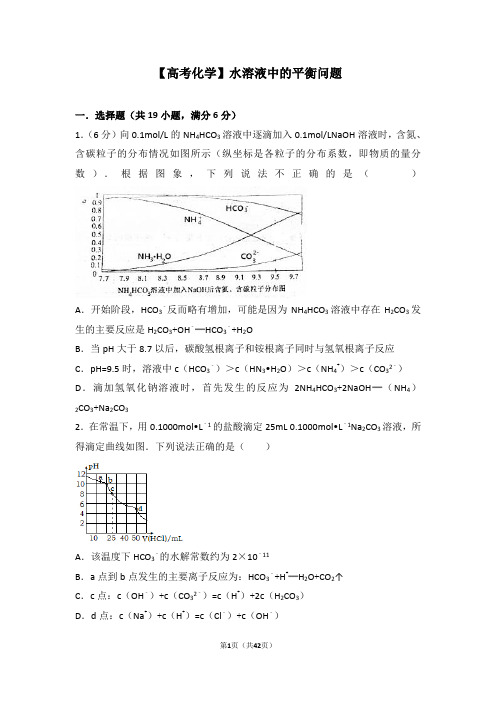
【高考化学】水溶液中的平衡问题一.选择题(共19小题,满分6分)1.(6分)向0.1mol/L的NH4HCO3溶液中逐滴加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数).根据图象,下列说法不正确的是()A.开始阶段,HCO3﹣反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH﹣═HCO3﹣+H2OB.当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应C.pH=9.5时,溶液中c(HCO3﹣)>c(HN3•H2O)>c(NH4+)>c(CO32﹣)D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)CO3+Na2CO322.在常温下,用0.1000mol•L﹣1的盐酸滴定25mL 0.1000mol•L﹣1Na2CO3溶液,所得滴定曲线如图.下列说法正确的是()A.该温度下HCO3﹣的水解常数约为2×10﹣11B.a点到b点发生的主要离子反应为:HCO3﹣+H+═H2O+CO2↑C.c点:c(OH﹣)+c(CO32﹣)=c(H+)+2c(H2CO3)D.d点:c(Na+)+c(H+)=c(Cl﹣)+c(OH﹣)3.常温下,向20mL某盐酸溶液中逐滴加入0.1mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是()A.盐酸的物质的量浓度为1mol/LB.在①、②之间的任意一点:c(Cl﹣)>c(NH4+),c(H+)>c(OH﹣)C.在点②所示溶液中:c(NH4+)=c(Cl﹣)>c(OH﹣)=c(H+),且V<20 D.在点③所示溶液中:由水电离出的c(OH﹣)>10﹣7mol/L4.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3.有关叙述正确的是()A.结合H+的能力:Y>CO>X>HCOB.三种酸的电离常数K i(HX)>K i(HY)>K i(H2CO3)C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO)>c (X)>c(OH)>c(H+)5.下列有关电解质溶液中粒子浓度关系正确的是()A.pH=1的NaHSO4溶液:c(H+)=c(SO42﹣)+c(OH﹣)B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣)C.CO2的水溶液:c(H+)>c(HCO3﹣)=2c(CO32﹣)D.含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)]6.现有常温下的四份溶液:①0.01mol/L CH3COOH;②0.01mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是()A.①中水的电离程度最小,③中水的电离程度最大B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③C.将①、④混合,若有c(CH3COO﹣)>c(H+),则混合液一定呈碱性D.将四份溶液稀释相同倍数后,溶液的pH:③>④,①>②7.下列说法正确的是()A.向50mL 1mol•L﹣1的盐酸中加入烧碱,水的K W不变B.NH4Cl和NH3•H2O混合液中,二者对对方的平衡都起了抑制作用C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y﹣)>c(X﹣)>c(OH﹣)>c(H+)D.常温下0.1 mol•L﹣1的HA溶液中=1×10﹣8,则0.01 mol•L﹣1 HA溶液中c(H+)=1×10﹣4mol•L﹣18.下列各溶液中,有关成分的物质的量浓度关系正确的是()A.10mL0.5mol/LCH3COONa溶液与6mLlmol/L盐酸混合:c(Cl﹣)>c(Na+)>c (CH3COO﹣)>c(H+)>c(OH﹣)B.0.lmol/LpH为4的NaHB溶液中:c(HB﹣)>c(H2B)>c(B2﹣)C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42﹣)>c (NH4+)>c(OH﹣)=c(H+)D.pH相等的(NH4)2SO4溶液,(NH4)2Fe(SO4)2溶液和NH4C1溶液:c[(NH4)SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl)29.下列图示与对应叙述相符合的是()A.图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol•L﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系B.图2表示Cl2通入H2S溶液中pH的变化C.图3表示10mL 0.01mo l•L﹣1 KMnO4酸性溶液氧化0.1mol•L﹣1 H2C2O4溶液时,n (Mn2+)随时间的变化(Mn2+对该反应有催化作用)D.图4表示已达平衡某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂10.部分弱酸的电离平衡常数如表,下列选项错误的是()A.2CN﹣+H2O+CO2→2HCN+CO32﹣B.2HCOOH+CO32﹣→2HCOO﹣+H2O+CO2↑C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者11.在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是()A.图中五点Kw间的关系:B>C>A=D=EB.C点一定是纯水C.D点可能是醋酸溶液,E点可能是醋酸钠溶液D.100℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性12.下列说法正确的是()A.常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(Na+)>c(B﹣)>c(H+)>c(OH﹣)B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等C.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3•H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③D.0.1mol/L pH为4的NaHB溶液中:c(HB﹣)>c(H2B)>c(B2﹣)13.(双选)下列图示与对应的叙述不相符的是()A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH 的变化曲线,其中b表示氨水稀释时pH的变化曲线B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系C.图3表示压强对可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的影响,乙的压强比甲的压强大D.图4表示10 mL 0.01 mol•L﹣1 KMnO4酸性溶液与过量的0.1 mol•L﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)14.已知298K时Mg(OH)2的溶度积常数Ksp=5.6×10﹣12,MgCO3的溶度积常数Ksp=6.8×10﹣6.取适量的MgCl2溶液加入一定量的烧碱溶液达到沉淀溶解平衡状态测得溶液的pH=13.0.则下列说法中不正确的是()A.Mg(OH)2是水垢的成分之一B.MgCO3悬浊液中加入适量的烧碱溶液可以生成Mg(OH)2沉淀C.沉淀溶解平衡时溶液中的c(Mg2+)=5.6×10﹣10 mol/LD.298 K时饱和Mg(OH)2溶液与饱和MgCO3溶液相比前者的c(Mg2+)大15.常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是()A.某溶液中由水电离出的c(H+)=1×10﹣a mol/L,若a>7时,则该溶液pH一定为14﹣aB.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c (CO32﹣)+2c(HCO3﹣)+2c(H2CO3)C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2﹣)+c(HR﹣)>c(Na+)D.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH 大于7,则反应后的混合液:2c(OH﹣)+c(A﹣)=2c(H+)+c(HA)16.温室时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的HCN溶液相混合,下列关于该混合溶液的叙述不正确的是()A.在任何情况下都是c(Na+)+c(H+)=c(CN﹣)+c(OH﹣)B.若pH>7时,则一定是c1v1=c2v2C.当pH=7时,若v1=v2,则一定是c2>c1D.若v1=v2,c1=c2,则c(CN﹣)+c(HCN)=c(Na+)17.下列有关电解质溶液中微粒的物质的量浓度关系正确的是()A.在0.1mol•L﹣1NaHCO3溶液中:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3)B.在0.1mol•L﹣1Na2CO3溶液中:c(OH﹣)﹣c(H+)=c(HCO3﹣)+2c(H2CO3)C.向0.2 mol•L﹣1NaHCO3溶液中加入等体积0.1mol•L﹣1NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L﹣1]:c (Na+)=c(CH3COO﹣)>c(CH3COOH)>c(H+)=c(OH﹣)18.室温下,将1.000mol•L﹣1盐酸滴入20.00mL 1.000mol•L﹣1氨水中,溶液pH 和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是()A.a点由水电离出的c(H+)=1.0×10﹣14mol•L﹣1B.b点:c(NH4+)+c(NH3•H2O)=c(Cl﹣)C.c点:c(Cl﹣)=c(NH4+)D.d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热19.常温下,下列各溶液的叙述中正确的是()A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性c(Ac ﹣)>c(Cl﹣)>c(H+)>c(HAc)B.pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO﹣)C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>bD.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,[c(Na+)﹣c (F﹣)]<[c(K+)﹣c(CH3COO﹣)]二.多选题(共11小题,满分66分,每小题6分)20.(6分)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是()A.0.1mol•L﹣1NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3)B.0.1mol•L﹣1NaOH溶液中通入SO2气体至pH=7:c(Na+)=c(HSO3﹣)+2 c(SO32﹣)+c(H2SO3)C.等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得pH=9的溶液:c(OH﹣)﹣c(CH3COOH)=c(H+)=l×10﹣9mol•L﹣1D.20 mL0.1mol•L﹣1CH3COONa溶液与10 mL 0.1mol•L﹣1HCl溶液混合得到的溶液:c(CH3COOH)+2c(H+)=c(CH3COO﹣)+2c(OH﹣)21.(6分)常温下,下列溶液中微粒的物质的量浓度关系正确的是()A.将浓度均为0.10mol•L﹣1的CH3COONH4与CH3COONa溶液等体积混合:c (CH3COO﹣)>c(Na+)>c(NH4+)>c(OH﹣)B.向0.10mol•L﹣1CH3COONa溶液中滴加盐酸至溶液呈中性:c(Cl﹣)>c(Na+)>c(H+)=c(OH﹣)C.将0.10mol•L﹣1KHC2O4和0.10mol•L﹣1K2C2O4溶液等体积混合所得溶液中:2c (K+)=3c(C2O42﹣)+3c(HCO4)D.将等物质的量浓度的NH4HCO3与NaCl溶液等体积混合,析出部分NaHCO3晶体后的溶液(pH<7)中:c(H+)+c(H2CO3)=c(OH﹣)+c(CO32﹣)+c(NH3•H2O)22.(6分)20℃时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol•L﹣1的混合溶液,溶液中c(HCO3﹣)、c(CO32﹣)与pH的关系如图所示.下列指定溶液中微粒的物质的量浓度关系正确的是()A.pH=9的溶液中:c(HCO3﹣)>c(H2CO3)>c(CO32﹣)B.c(HCO3﹣)=c(CO32﹣)的E点溶液中:c(OH﹣)+c(CO32﹣)>c(H+)+c(H2CO3)+0.050 mol•L﹣1C.pH=11的溶液中:c(Na+)<2c(CO32﹣)+c(HCO3﹣)D.0.100 m ol•L﹣1的Na2CO3溶液中:c(H+)+c(H2CO3)+c(HCO3﹣)=c(OH﹣)23.(6分)下列有关电解质溶液的说法正确的是()A.在蒸馏水中滴加浓硫酸,K w不变B.在Na2S稀溶液中,c(H+)=c(OH﹣)﹣2c(H2S)﹣c(HS﹣)C.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同D.将pH=1的强酸溶液加水稀释后,溶液中各离子的浓度均减小24.(6分)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是()A.物质的量浓度相等的①NH4Cl ②(NH4)2SO4③NH4Al(SO4)2三种溶液中,c (NH4+由大到小的顺序为:③>②>①B.0.1mol•L﹣1CH3COOH与0.05mol•L﹣1NaOH溶液等体积混合(pH<7):c(CH3COO﹣)>c(Na+)>cCH3COOH)>c(H+)C.0.1 mol•L﹣1Na2CO3与0.05mol•L﹣1 NaHCO3溶液等体积混合:c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)D.在0.1 mol•L﹣1NaHC2O4溶液(pH<7)中:c(OH﹣)+2c(C2O42﹣)=c(H+)+2c(H2C2O4)25.(6分)25℃时,0.1mol Na2CO3与稀盐酸混合所得的体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是()A.W点所示的溶液:c(Na+)>c(CO32﹣)=c(HCO3﹣)>c(OH﹣)>c(H+)B.pH=4的溶液:c(H2CO3)+c(HCO3﹣)+c(CO32﹣)=0.1 mol•L﹣1C.向pH=8的溶液中通入CO2至pH=7所得的溶液:c(Na+)>c(Cl﹣)+c(HCO3﹣)+c(H2CO3)D.pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl﹣)+2c(CO32﹣)26.(6分)常温下,向20mL 0.2mol•L﹣1H2A溶液中滴加0.2mol•L﹣1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA﹣,Ⅲ代表A2﹣).下列说法正确的是()A.H2A在水中的电离方程式为H2A═H++HA﹣,HA﹣⇌H++A2﹣B.向NaHA溶液中加水,HA﹣的电离度增大、溶液的pH减小C.V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA﹣)>c (H+)>c(A2﹣)>c(OH﹣)D.V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)﹣2c(OH﹣)=c(A2﹣)﹣3c(H2A)﹣c(HA﹣)27.(6分)下列有关说法正确的是()A.一定温度下,反应MgCl2(1)=Mg(1)+Cl2(g)的△H>0,△S>0B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同C.0.1mol•L﹣1CH3COOH溶液加水稀释,溶液的pH和CH3COOH的电离度均增大D.将BaCl2溶液滴入含酚酞的Na2CO3溶液,红色逐渐褪去,说明BaCl2溶液显酸性28.(6分)下列叙述正确的是()A.向水中加入稀氨水,平衡逆向移动,c(OH﹣)降低B.向水中加入少量固体硫酸氢钠,c(H+)增大,K w不变C.向水中加入少量NaOH,平衡逆向移动,c(H+)降低D.将水加热,K w增大,pH不变29.(6分)室温下,下列溶液中微粒的物质的量浓度关系正确的是()A.新制氯水中:c(H+)=c(HClO)+2c(ClO﹣)+c(OH﹣)B.pH=8的NaClO2溶液中:c(Na+)>c(ClO2﹣)>c(OH﹣)>c(H+)C.0.1mol•L﹣1HCl溶液与0.2 mol•L﹣1 NH3•H2O溶液等体积混合pH>7:c(NH3•H2O)>c(Cl﹣)>c(NH4+)>c(OH﹣)D.0.1mol•L﹣1K2C2O4溶液与0.2 mol•L﹣1KHC2O4溶液等体积混合:4c(K+)=3[c(C2O42﹣)+c(HC2O4﹣)]30.(6分)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是()A.0.1 mol•L﹣1Na2S溶液与0.1 mol•L﹣1NaHS溶液等体积混合:2c(H2S)═3c(Na+)﹣2c(HS﹣)﹣2c(S2﹣)B.0.1 mol•L﹣1氨水与0.05 mol•L﹣1盐酸等体积混合:c(OH﹣)+c (NH3•H2O)═c(Cl﹣)+c(H+)C.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合:c(CH3COOH)+c (H+)>c(OH﹣)+c(Na+)D.浓度均为0.1 mol•L﹣1的NH4HSO4溶液与NaOH溶液等体积混合:c(Na+)=c (SO)>c(NH)>c(OH﹣)>c(H+)【高考化学】水溶液中的平衡问题参考答案与试题解析一.选择题(共19小题,满分6分)1.(6分)(2016•衡水校级模拟)向0.1mol/L的NH4HCO3溶液中逐滴加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数).根据图象,下列说法不正确的是()A.开始阶段,HCO3﹣反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH﹣═HCO3﹣+H2OB.当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应C.pH=9.5时,溶液中c(HCO3﹣)>c(HN3•H2O)>c(NH4+)>c(CO32﹣)D.滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)CO3+Na2CO32【分析】NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2O⇌HN3•H2O+H+①;HCO3﹣的水解平衡,即HCO3﹣+H2O⇌H2CO3+OH﹣②;HCO3﹣的电离平衡,即HCO3﹣⇌H++CO32﹣③;在未加氢氧化钠时,溶液的PH=7.7,呈碱性,则上述3个平衡中第②个HCO3﹣的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3﹣的量略有增加;对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3•H2O 的量增加,NH4+的量减小,当PH大于8.7以后,CO32﹣的量在增加,平衡③受到影响,据此分析.【解答】解:NH4HCO3溶液中存在NH4+的水解平衡,即NH4++H2O⇌HN3•H2O+H+①;HCO3﹣的水解平衡,即HCO3﹣+H2O⇌H2CO3+OH﹣②;HCO3﹣的电离平衡,即HCO3﹣⇌H++CO32﹣③;A.在未加氢氧化钠时,溶液的PH=7.7,呈碱性,则上述3个平衡中第②个HCO3﹣的水解为主,滴加氢氧化钠的开始阶段,氢氧根浓度增大,平衡②向逆方向移动,HCO3﹣的量略有增加,即逆方向的反应是H2CO3+OH﹣═HCO3﹣+H2O,故A正确;B.对于平衡①,氢氧根与氢离子反应,平衡正向移动,HN3•H2O的量增加,NH4+被消耗,当PH大于8.7以后,CO32﹣的量在增加,平衡③受到影响,HCO3﹣被消耗,即碳酸氢根离子和铵根离子都与氢氧根离子反应,故B正确;C.从图中可直接看出pH=9.5时,溶液中c(HCO3﹣)>c(HN3•H2O)>c(NH4+)>c(CO32﹣),故C正确;D.滴加氢氧化钠溶液时,HCO3﹣的量并没减小,反而增大,说明首先不是HCO3﹣与OH﹣反应,而是NH4+先反应,即NH4HCO3+NaOH═NaHCO3+NH3•H2O,故D 错误;故选:D.2.(2016•青岛二模)在常温下,用0.1000mol•L﹣1的盐酸滴定25mL 0.1000mol•L ﹣1Na2CO3溶液,所得滴定曲线如图.下列说法正确的是()A.该温度下HCO3﹣的水解常数约为2×10﹣11B.a点到b点发生的主要离子反应为:HCO3﹣+H+═H2O+CO2↑C.c点:c(OH﹣)+c(CO32﹣)=c(H+)+2c(H2CO3)D.d点:c(Na+)+c(H+)=c(Cl﹣)+c(OH﹣)【分析】A.在常温下,用0.1000mol•L﹣1的盐酸滴定25mL 0.1000mol•L﹣1Na2CO3溶液,滴定到25ml时发生反应HCO3﹣+H2O⇌H2CO3+OH﹣,此时PH=8,结合平衡常数计算;B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,n(Na2CO3)=0.1000mol/L×0.0250L=0.0025mol,反应后得到NaHCO3物质的量为0.002mol,Na2CO3物质的量为0.0005mol,b点生成碳酸氢钠和碳酸钠溶液;C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,结合溶液中电荷守恒和物料守恒计算分析;D.d点时加入盐酸0.005mol,溶液中溶由反应生成的CO2,溶液存在电荷守恒,从电荷守恒的角度分析.【解答】解:A.在常温下,用0.1000mol•L﹣1的盐酸滴定25mL 0.1000mol•L﹣1Na2CO3溶液,滴定到25ml时发生反应HCO3﹣+H2O⇌H2CO3+OH﹣,此时PH=8,c(OH﹣)=c(H2CO3)=10﹣6mol/L,c(HCO3﹣)==0.05mol/L,K===2.0×10﹣11,故A正确;B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,n(Na2CO3)=0.1000mol/L×0.0250L=0.0025mol,反应后得到NaHCO3物质的量为0.002mol,Na2CO3物质的量为0.0005mol,a点到b点发生的主要离子反应为CO32﹣+H+=HCO3﹣,故B错误;C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,溶液中存在的话守恒和物料守恒,c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c (OH﹣),c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),c(OH﹣)+c(CO32﹣)=c(H+)+c(H2CO3),故C错误;D.d点时加入盐酸0.005mol,溶液中溶由反应生成的CO2,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣)+c(Cl﹣),由于c(Na+)=c(Cl﹣),则c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣),故D错误;故选A.3.(2015•杭州校级二模)常温下,向20mL某盐酸溶液中逐滴加入0.1mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是()A.盐酸的物质的量浓度为1mol/LB.在①、②之间的任意一点:c(Cl﹣)>c(NH4+),c(H+)>c(OH﹣)C.在点②所示溶液中:c(NH4+)=c(Cl﹣)>c(OH﹣)=c(H+),且V<20 D.在点③所示溶液中:由水电离出的c(OH﹣)>10﹣7mol/L【分析】A、根据当未加氨水时盐酸的PH值计算盐酸溶液的物质的量浓度.B、采用极值法判断溶液中各种离子浓度的关系.C、根据溶液中电荷守恒判断各种离子浓度的关系,由生成盐的类型判断氨水的体积.D、无论酸溶液还是碱溶液都抑制水的电离.【解答】解:A、当未加氨水时,盐酸的PH=1,HCl是强电解质完全电离,氢离子的浓度=HCl的浓度,所以盐酸的物质的量浓度=0.1mol/L,故A错误.B、采用极值法分析,当未加氨水时,溶液中没有铵根离子,所以c(Cl﹣)>c (NH4+),该溶液呈酸性,即氢离子的浓度大于氢氧根离子的浓度c(H+)>c(OH ﹣),故B正确.C、当溶液的PH=7时,溶液中c(H+)=c(OH﹣),溶液呈电中性,所以c(Cl﹣)=c(NH4+);氯化铵是强酸弱碱盐溶液呈酸性,要使溶液呈碱性,氨水的物质的量应该稍微大一些,即V>20,故C错误.D、无论酸溶液还是碱溶液都抑制水的电离,点③所示溶液呈碱性,能抑制水的电离,所以由水电离出的c(OH﹣)<10﹣7mol/L,故D错误.故选B.4.(2015秋•河南月考)常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3.有关叙述正确的是()A.结合H+的能力:Y>CO>X>HCOB.三种酸的电离常数K i(HX)>K i(HY)>K i(H2CO3)C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO)>c (X)>c(OH)>c(H+)【分析】根据题意写出方程式:CO2+H2O+NaX=HX+NaHCO3;HX+Na2CO3=NaHCO3+NaX;CO2+H2O+2NaY=2HY+Na2CO3;NaHCO3+NaY=HY+Na2CO3;利用强酸制弱酸的原理判断出酸性:H2CO3>HX>NaHCO3>HY,碱性强弱可以利用越弱越水解判断:NaHCO3<NaX<Na2CO3<NaY,据此分析.【解答】解:A.由A可知酸性H2CO3>HX>NaHCO3>HY,则结合质子能力:Y ﹣>CO32﹣>X﹣>HCO3﹣,故A正确;B.向NaX溶液中通入CO2气体,只能生成HX和NaHCO3,则酸性H2CO3>HX>NaHCO3,向NaY溶液中通入CO2,只生成HY和Na2CO3,则酸性NaHCO3>HY,则有酸性由强到弱:H2CO3>HX>HCO3﹣>HY,酸性越强,电离常数越大,所以三种酸的电离常数:K i1(H2CO3)>K i(HX)>K i2(H2CO3)>K i(HY),故B错误;C.酸性H2CO3>HX>NaHCO3>HY,碱性强弱可以利用越弱越水解判断,所以溶液的碱性:NaHCO3<NaX<Na2CO3<NaY,故C错误;D.向NaX溶液中通入足量CO2后生成HX,由于HX发生电离,则c(Na+)>c (X﹣),由于酸性HX>HCO3﹣,则c(HCO3﹣)>c(HX)>c(X﹣),则c(Na+)>c(HCO3﹣)>c(HX)>c(X﹣)>c(OH﹣),由于酸性:H2CO3>HX>NaHCO3,溶液应显酸性,c(OH)<c(H+),故D错误.故选A.5.(2014•天津)下列有关电解质溶液中粒子浓度关系正确的是()A.pH=1的NaHSO4溶液:c(H+)=c(SO42﹣)+c(OH﹣)B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl﹣)=c(I﹣)C.CO2的水溶液:c(H+)>c(HCO3﹣)=2c(CO32﹣)D.含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)]【分析】A、NaHSO4溶液中存在氢离子守恒分析判断;B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银;C、二氧化碳的水溶液中碳酸分步电离,第二步电离微弱;D、依据溶液中元素物料守恒计算分析.【解答】解:A、NaHSO4溶液中存在质子守恒分析,硫酸氢钠电离出钠离子、氢离子、硫酸根离子,NaHSO4 =Na++H++SO42﹣,H2O⇌H++OH﹣,溶液中质子守恒,c (H+)=c(SO42﹣)+c(OH﹣),故A正确;B、AgCl和AgI固体的悬浊液中氯化银溶解度大于碘化银,c(Ag+)>c(Cl﹣)>c(I﹣),故B错误;C、二氧化碳的水溶液中碳酸分步电离,第二步电离微弱,H2CO3⇌H++HCO3﹣,HCO3﹣⇌H++CO32﹣,c(H+)>c(HCO3﹣)>2c(CO32﹣),故C错误;D、依据溶液中元素物料守恒计算,含等物质的量NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4﹣)+C(C2O42﹣)+c(H2C2O4)],故D错误;故选A.6.(2014•中山模拟)现有常温下的四份溶液:①0.01mol/L CH3COOH;②0.01mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是()A.①中水的电离程度最小,③中水的电离程度最大B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③C.将①、④混合,若有c(CH3COO﹣)>c(H+),则混合液一定呈碱性D.将四份溶液稀释相同倍数后,溶液的pH:③>④,①>②【分析】A、酸碱对水的电离起到抑制作用,酸中的氢离子或碱中的氢氧根离子浓度越大,抑制程度越大;B、氨水是弱碱,等体积混合时溶液呈碱性,所以盐酸体积大于氨水溶液的体积;C、将①、④混合体积不同混合后溶液不一定成碱性,中性溶液中也存在c(CH3COO ﹣)>c(H+);D、稀释相同倍数,弱电解质存在电离平衡;【解答】解:A酸或碱能抑制水的电离,当溶液中氢离子或氢氧根离子浓度越大,水的电离程度越小,pH=12的氨水和pH=12的NaOH溶液中c(OH﹣)=0.01moL/L,0.01moL/L HCl中c(H+)=0.01moL/L,所以这三种溶液中水的电离程度相同,0.01mol/L CH3COOH中(H+)<0.01moL/L,所以醋酸中水的电离程度最大,故A 错误;B、②③若等体积混合后溶液呈碱性,若有pH=7,则消耗溶液的体积:②>③,故B正确;C、若将①、④等体积混合,醋酸和氢氧化钠恰好反应生成醋酸钠,溶液呈碱性,有c(CH3COO﹣)>c(H+),若混合后溶液呈中性时存在C(Na+)=c(CH3COO﹣)>C(OH﹣)=c(H+),故C错误;D、将四份溶液稀释相同倍数后溶液的pH:氨水存在电离平衡,溶液中氢氧根离子浓度大于氢氧化钠溶液中氢氧根离子,pH值③>④,同浓度醋酸和盐酸稀释相同倍数,醋酸存在电离平衡,醋酸溶液中氢离子浓度小于盐酸溶液中的氢离子浓度,酸性越弱,pH越大,所以溶液PH②<①,故D正确;故选BD7.(2014•唐山二模)下列说法正确的是()A.向50mL 1mol•L﹣1的盐酸中加入烧碱,水的K W不变B.NH4Cl和NH3•H2O混合液中,二者对对方的平衡都起了抑制作用C.有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y﹣)>c(X﹣)>c(OH﹣)>c(H+)D.常温下0.1 mol•L﹣1的HA溶液中=1×10﹣8,则0.01 mol•L﹣1 HA溶液中c(H+)=1×10﹣4mol•L﹣1【分析】A.Kw只受温度的影响;B.依据电离平衡和盐类水解平衡的影响因素分析;C.依据盐类水解规律﹣越弱越水解分析解答;D.根据c(OH﹣)/c(H+)=1×10﹣8结合水的离子积常数计算氢离子浓度,判断该酸是弱酸,然后根据弱酸稀释的规律解题.【解答】解:A.Kw只受温度的影响,盐酸中加入烧碱发生酸碱中和反应,放出热量,使体系温度升高,Kw值增大,故A错误;B.铵根离子水解方程式:NH4++H2O⇌NH3•H2O+H+加入一水合氨,一水合氨浓度增大,平衡向逆向移动,抑制铵根离子的水解;一水合氨的电离方程式:NH3•H2O ⇌NH4++OH﹣,加入氯化铵溶液,铵根离子浓度增大,平衡向逆向移动,抑制了一水合氨的电离,故B正确;C.因为酸性HX>HY,所以水解能力NaX<NaY,体积和浓度相同的NaX和NaY 溶液混合后离子浓度关系为:c(X﹣)>c(Y﹣)>c(OH﹣)>c(H+).故C错误;D.c(OH﹣)/c(H+)=1×10﹣8,c(OH﹣)×c(H+)=1×10﹣14,所以c(H+)=10﹣3mol•L﹣1,该酸为弱酸,加水稀释时弱酸的电离程度增大,所以0.01 mol•L﹣1 HA 溶液中c(H+)>1×10﹣4mol•L﹣1,故D错误;故选B.8.(2014•合肥二模)下列各溶液中,有关成分的物质的量浓度关系正确的是()A.10mL0.5mol/LCH3COONa溶液与6mLlmol/L盐酸混合:c(Cl﹣)>c(Na+)>c (CH3COO﹣)>c(H+)>c(OH﹣)B.0.lmol/LpH为4的NaHB溶液中:c(HB﹣)>c(H2B)>c(B2﹣)C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42﹣)>c (NH4+)>c(OH﹣)=c(H+)D.pH相等的(NH4)2SO4溶液,(NH4)2Fe(SO4)2溶液和NH4C1溶液:c[(NH4)SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl)2【分析】A、10mL0.5mol/LCH3COONa溶液与6mLlmol/L盐酸混合,发生反应,相对于溶液中CH3COOH、NaCl、HCl的物质的量浓度之比为5:5:1,溶液呈酸性,醋酸是弱酸,电离程度不大,据此判断.(注意可以利用电荷守恒判断)B、0.1mol•L﹣1的NaHB溶液pH为4,说明HB﹣为弱酸根,且HB﹣电离程度大于其水解程度,据此判断.C、硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性,铵根离子有剩余,溶液为硫酸钠、硫酸铵、氨水的混合溶液,加入的氢氧化钠的物质的量大于硫酸氢铵,根据物料守恒,n(SO2﹣4)=n(NH+4)+n(NH3•H2O),据此判断.D、(NH4)2Fe(SO4)2溶液中铵根离子、亚铁离子都水解成酸性,(NH4)2SO4溶液与(NH4)2Fe(SO4)2溶液浓度相同时,(NH4)2Fe(SO4)2溶液酸性较强,故PH相等时,(NH4)2Fe(SO4)2溶液浓度较小,pH相等的(NH4)2SO4溶液和NH4C1溶液,只有铵根离子水解,(NH4)2SO4和NH4C1提供的铵根离子浓度相等,据此判断.【解答】解:A、10mL0.5mol/LCH3COONa溶液与6mLlmol/L盐酸混合,发生反应,相对于溶液中CH3COOH、NaCl、HCl的物质的量浓度之比为5:5:1,所以c(Cl ﹣)>c(Na+),溶液呈酸性,c(H+)>c(OH﹣),醋酸是弱酸,发生电离,电离程度不大,所以c(Na+)>c(CH3COO﹣),c(H+)>c(CH3COO﹣),故为c(Cl ﹣)>c(Na+)>c(H+)>c(CH3COO﹣)>c(OH﹣),故A错误;B、0.1mol•L﹣1的NaHB溶液pH为4,说明HB﹣为弱酸根,且HB﹣电离程度大于其水解程度,电离生成B2﹣,水解生成H2B,所以c(B2﹣)>c(H2B),电离与水解程度不大,c(HB﹣)最大,所以c(HB﹣)>c (B2﹣)>c(H2B),故B错误;C、硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性,铵根离子有剩余,溶液为硫酸钠、硫酸铵、氨水的混合溶液,加入的氢氧化钠的物质的量大于硫酸氢铵,所以c(Na+)>c(SO2﹣4),根据物料守恒,n(SO42﹣)=n(NH4+)+n(NH3•H2O),所以c(SO2﹣4)>c(NH+4),故c(Na+)>c(SO2﹣4)>c(NH+4)>c(OH﹣)=c (H+),故C正确;D、(NH4)2Fe(SO4)2溶液中铵根离子、亚铁离子都水解成酸性,(NH4)2SO4溶液与(NH4)2Fe(SO4)2溶液浓度相同时,(NH4)2Fe(SO4)2溶液酸性较强,故PH相等时,(NH4)2Fe(SO4)2溶液浓度较小,pH相等的(NH4)2SO4溶液和NH4C1溶液,只有铵根离子水解,提供的铵根离子浓度相等,所以c[(NH4)2SO4]<c(NH4Cl),故c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl),故D错误.故选:C.9.(2014•自贡二模)下列图示与对应叙述相符合的是()A.图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol•L﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系B.图2表示Cl2通入H2S溶液中pH的变化C.图3表示10mL 0.01mol•L﹣1 KMnO4酸性溶液氧化0.1mol•L﹣1 H2C2O4溶液时,n (Mn2+)随时间的变化(Mn2+对该反应有催化作用)D.图4表示已达平衡某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂【分析】A.先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体;B.Cl2通入H2S溶液中发生Cl2+H2S═2HCl+S,酸性增强,pH减小;C.发生氧化还原反应生成锰离子;D.t0时正逆反应速率同等程度的变大.【解答】解:A.先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体,且等物质的量NaOH、Na2CO3,不产生气体和产生气体消耗的酸应为2:1,与图象不符,故A错误;B.Cl2通入H2S溶液中发生Cl2+H2S═2HCl+S,酸性增强,pH减小,与图象不符,故B错误;C.发生氧化还原反应生成锰离子,则n(Mn2+)随时间的变化而增大,且催化作用,一段时间内增加的更快,故C正确;D.t0时正逆反应速率同等程度的变大,可能为催化剂或增大压强,故D错误;故选C.10.(2013•上海)部分弱酸的电离平衡常数如表,下列选项错误的是()A.2CN﹣+H2O+CO2→2HCN+CO32﹣B.2HCOOH+CO32﹣→2HCOO﹣+H2O+CO2↑C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者【分析】弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答.【解答】解:根据电离平衡常数知,酸性强弱顺序为:HCOOH>H2CO3>HCN>HCO3﹣,A.氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN﹣+H2O+CO2→HCN+HCO3﹣反应,故A错误;B.甲酸的酸性大于碳酸,所以2HCOOH+CO32﹣→2HCOO﹣+H2O+CO2↑能发生,故B正确;C.等pH的HCOOH和HCN溶液,甲酸的物质的量浓度小于氢氰酸,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;D.根据电荷守恒,c(HCOO﹣)+c(OH﹣)=c(Na+)+c(H+),c(CN﹣)+c(OH ﹣)=c(Na+)+c(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH﹣)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数大,故D错误;故选AD.11.(2013•扶沟县校级一模)在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是()A.图中五点Kw间的关系:B>C>A=D=EB.C点一定是纯水C.D点可能是醋酸溶液,E点可能是醋酸钠溶液D.100℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性【分析】由图象可知,A、E、D都为25℃时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,另外也可根据c(OH ﹣)×c(H+)计算Kw大小,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液.【解答】解:A.由图象可知,A、E、D都为25℃时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则B>A=D=E,由C点c(OH﹣)×c(H+)可知,C点的Kw大于A点,则B>C>A=D=E,故A 正确;B.C点的c(OH﹣)×c(H+)大于25℃的Kw,说明温度较高,可能为纯水,也可能为盐溶液,故B错误;C.水的离子积只与温度有关,与溶液的类型无关,D点可能是醋酸溶液,E点可能是醋酸钠溶液,也可能为其它类型的溶液,故C正确;D.100℃时,Kw=1×10﹣12,pH=2的硫酸中c(H+)=0.01mol/L,与pH=10的KOH 溶液中c(OH﹣)=0.01mol/L,等体积混合后,溶液显中性,故D正确.故选B.12.(2013•成都模拟)下列说法正确的是()A.常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(Na+)>c(B﹣)>c(H+)>c(OH﹣)B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等C.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3•H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③D.0.1mol/L pH为4的NaHB溶液中:c(HB﹣)>c(H2B)>c(B2﹣)【分析】A.等体积混合后溶液的pH=3,说明溶液呈酸性,则有c(H+)>c(OH﹣),结合溶液电中性原则分析,B.四种溶液中酸或碱电离出的c(H+)=c(OH﹣),则对水的电离平衡的影响相同;C.从影响盐类水解的因素判断水解的程度,结合弱电解质的电离分析;D.pH为4的NaHB溶液中HB﹣电离程度大于HB﹣水解程度.【解答】解:A.等体积混合后溶液的pH=3,说明溶液呈酸性,则有c(H+)>c (OH﹣),又溶液中存在c(Na+)+c(H+)=c(B﹣)+c(OH﹣),则c(B﹣)>c(Na+),故A错误;B.四种溶液中酸或碱电离出的c(H+)=c(OH﹣),由H2O H++OH﹣可知,对水的电离平衡的影响相同,则四种溶液中由水电离的c(H+)相等,故B正确;C.①和②相比较,①中铵根离子和铝离子水解都呈酸性,相互抑制,则①中c (NH4+)大于②,②与④相比较,醋酸根离子和铵根离子水解相互促进,则②中c(NH4+)大于④,NH3•H2O为弱电解质,电离沉淀较小,则④中c(NH4+)大于③,则顺序为①>②>④>③,故C错误;D.pH为4的NaHB溶液中HB﹣电离程度大于HB﹣水解程度,则c(B2﹣)>c(H2B),故D错误.故选B.13.(2013•广东模拟)(双选)下列图示与对应的叙述不相符的是()A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH 的变化曲线,其中b表示氨水稀释时pH的变化曲线B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系C.图3表示压强对可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的影响,乙的压强比甲的压强大D.图4表示10 mL 0.01 mol•L﹣1 KMnO4酸性溶液与过量的0.1 mol•L﹣1 H2C2O4溶。
水溶液中三大平衡习题总结及练习

水溶液中三大平衡综合练习1. 室温下,下列说法正确的是()A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10﹣9mol/LB.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7C.同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大D.0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32﹣)+c(SO42﹣)+c(HCO3﹣)+c(OH﹣)2. 常温下,有体积均为10mL、pH均等于1的盐酸和醋酸溶液,下列说法正确的是()A.上述两种溶液分别用水稀释m、n倍,溶液的pH都变成3,则m>nB.上述两种溶液分别与足量的Zn完全反应,产生的H2一样多C.往上述盐酸溶液中加入100 mL pH=3的盐酸溶液,混合后的溶液pH=2D.往上述醋酸溶液中加入10 mL pH=13的NaOH溶液中和,充分反应后溶液呈中性3. 已知部分弱酸在常温下的电离平衡常数如下表:下列叙述错误的是()A.向NaCN溶液中通入少量的CO2的离子反应为:CN﹣+H2O+CO2=HCN+HCO3﹣B.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者C.等体积、等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH﹣)>c(HCO3﹣)>c(CO32﹣)>c(H+)D.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH物质的量前者小于后者4. 已知:25℃时H2C2O4的pK a1=1.22,pK a2=4.19,CH3COOH的pKa=4.76,K代表电离平衡常数,pK=﹣lgK。
下列说法正确的是()A.浓度均为0.1mol/L NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者B.将0.1mol/L的K2C2O4溶液从25℃升温至35℃,c(K+)/c(C2O42-)减小C.0.1 mol/L K2C2O4溶液滴加盐酸至pH=l.22:c(H+)﹣c(OH﹣)=c(Cl﹣)﹣3c(HC2O4﹣) D.向0.1 mol/L CH3COONa 溶液中滴加少量0.1 m mol/L H2C2O4溶液:CH3COO﹣+H2C2O4═CH3COOH+HC2O4﹣5. 某温度下,向一定体积0.1mol/L一元弱酸HA液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH的变化关系如图所示。
高三二轮复习---水溶液中的平衡专题

判断正误: 1.NaCl溶液和CH3COONH4溶液均显中 性, 两溶液中水的电离程度相同( ) 2.等浓度的NH4Cl溶液和CH3COONH4溶液中 水的电离程度相同( )
×
×
水溶液中的离子平衡是化学平衡的延伸和应 用,也是高考中考点分布较多的内容之一。 考查内容主要有以下三个方面: (1)弱电解质的电离平衡和溶液的酸碱性; (2)盐类的水解平衡; (3)难溶电解质的沉淀溶解平衡。从近几年高
考点二、水的电离和溶液的pH 水的电离及影响因素 (1)加酸:抑制H2O电离,c(H+)H2O=c(OH-)。 (2)加碱:抑制H2O电离,c(OH-)H2O=c(H+)。 (3)加水解呈酸性的盐,促进H2O电离, c(H+)H2O=c(H+) (4)加水解呈碱性的盐,促进水电离, c(OH-)H2O=c(OH-) (5)加酸式盐,若酸式根以电离为主,抑制水的 电离;若酸式根以水解为主,促进水的电离。
Ca(HCO3)2
蒸干
(CaCO3)
Na2SO3蒸干灼烧
FeCl3、AlCl3蒸干灼烧 FeCl2蒸干灼烧
( Na2SO4 )
( Fe2O3、Al2O3 ) ( Fe2O3)
Na2CO3 Al2(SO4)3蒸干灼烧 ( Na2CO3 Al2(SO4)3 )
【课前检测】
1.B 2.D 3.D 4. ⑴ Al3++3HCO3- = Al(OH)3↓+3CO2↑ (2)H2CO3 HCO3- +H+ HCO3CO32-+H+ (3)CH3COO +NH4++H2O NH3· H2O+CH3COOH
水溶液中的离子平衡专练带答案

水溶液中的离子平衡专练一、正误判断•辨析概念1.弱电解质的电离平衡(1)0.1 mol-L-1 氨水中加入CH3COONH4 固体,c(OH-)/c(NH3- H2O)变大。
()(2)强电解质溶液中一定不存在电离平衡。
()⑶改变条件使电离平衡正向移动,溶液的导电能力一定增强。
()(4)CHCOOH溶液加水稀释后,溶液中。
(CH3c OOH)的值减小。
()3c (CH3COO-)(5)0.1 moll-1 CH3COOH溶液中加入冰醋酸,醋酸的电离程度变小。
()(6)在室温下,CH3COOH分子可以完全以分子的形式存在于pH=8的溶液中。
()⑺中和pH和体积均相同的盐酸和醋酸,消耗NaOH的体积相同。
()(8)0.1 moll-1的CH3COOH溶液加水稀释,CH3COOH的电离平衡向正方向移动,n(H+)增大。
( 2.水的电离和溶液的pH(1)25 ℃时NH4Cl溶液的K w大于100℃时Nad溶液的K()(2)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同。
()⑶在蒸馏水中滴加浓H2s,K w不变。
()(4)无论在酸溶液中还是碱溶液中,由水电离出的c(H+) = c(OH-)。
()(5)pH=0 的溶液中c(H+)=0 moll-1。
( )(6)某溶液中滴入酚欧呈无色,溶液呈酸性。
()(7)用pH试纸测定溶液的pH,不能用水浸湿,否则一定会产生误差。
()(8)两种醋酸的物质的量浓度分别为c3口c2, pH分别为。
和a +1,则c尸10c2。
()⑼将Ca(OH)2的饱和溶液加热,pH和K w均增大。
()(10)1.0x10-3 mol • L-1 盐酸的pH=3.0, 1.0X10-8 mol • L-1 盐酸的pH=8.0。
( )(11)分别和pH相等的盐酸和硫酸反应时,消耗NaOH的物质的量相同。
()(12)将纯水加热,K w变大,pH变小,酸性变强。
()(13)只有pH=7的溶液中才存在c(H+) = c(OH-)o ( )(14)常温下,等体积的盐酸和CH3COOH的pH相同,由水电离出的c(H+)相同。
水溶液中的离子平衡测试题及答案

第三章水溶液中G蹄子平衡M^S一、逗撵S1.符区屯水加热至较高温度,下列叙述正碓内是()A.水G蹄子稹燮大、pH燮小、呈酸性B.水G雕了稹不燮、pH不燮、呈中性C.水G蹄子稹燮小、pH燮大、呈^性D.水G蹄子稹燮大、pH燮小、呈中性2.下列有昌昌“重蹄平衡” G叙述中正碓内是( )A.雷解^在溶液裹逢到重蹄平衡畤,分子G渡度和蹄子G浸度相等B.雷雕平衡畤,由於分子和蹄子G渡度不断彝生燮化,所以^^雕平衡是勤熊平衡C.重雕平衡是相举寸G、暂畤G,外界脩件改燮畤,平衡就曾彝生移勤D.雷解^逢到雷蹄平衡彳爰,各槿蹄子G浸度相等3.下列昌昌彳系一定正碓内是()A.常溶液中c(H+)>10-7 molL i畤,其pH<7,溶液呈现酸性B.常溶液中c(H+)>10-7 molL i畤,其pH>7,溶液呈现^性C.常溶液中c(H+)=c(0H-)>10-7 molL i畤,其pH<7,溶液呈现中性D.常溶液中c(H+)=c(0H-)>10-7 molL i畤,其pH<7,溶液呈现酸性4.彳隹植物花朵中提取到一槿色素,它^除上是一槿有檄弱酸,可用HR表示, HR在蜜酸溶液中呈现缸色,HR在NaOH溶液中呈现叠色,符HR加入浸硝酸中呈现缸色,微热彳爰溶液G缸色褪去,根摞以上现象,可推M()A. HR鹰卷缸色B. HR鹰卷叠色C. R-鹰卷瓢色D. R-鹰卷缸色5.在稀氨水溶液中存在如下平衡醴系:NH3-H20^TNH4++0H-,常增大溶液 O pH 畤,c(NH+)^()4A.可能增大也可能减小B.增大C.减小D.瓢燮化6.符pH=1O蜜酸平均分卷2份,1份加遹量水,另一份加入舆言亥蜜酸物^ O 量浸度相同O遹量NaOH溶液彳爰,pH都升高1,即加入0水舆NaOH溶液O醴稹比卷()A. 9B. 10C. 11D. 127.有一槿含氨和氯化^物^O量相等O混合溶液,其pH卷9.3,下列^法中金昔^0是()A.氨水G霜雕作用大於氯化^^水解作用B.氯化^^水解作用大於氨水G重雕作用C.氨水G存在抑制了氯化^G水解D.氯化^G存在抑制了氨水G重蹄8.符O.lmolL i醋酸溶液加水稀释,下列^法正碓内是()A.溶液中c(H+)和c(OH-)都减小B.溶液中c(H+)增大C.醋酸重蹄平衡向左移勤D.溶液G pH增大9.室温下,某溶液中由水重雕出G c(OH-)=10-5mol-L-i,即其溶^可能是 ()A. CH3COOHB. H2SO4C. NaOHD. N&2CO310.pH=3 G醋酸溶液加水冲稀到原溶液醴稹G 3倍,即稀释彳爰G pH^ ()A. 3.2B. 3.5C. 3.7D. 411.已知,往O.lmolL i G氨水中滴入酚酞言式液畤,溶液符呈现粉缸色。
2021届高考化学第一轮专题复习强化训练:溶液中的三大平衡及影响因素(含解析)

溶液中的三大平衡及影响因素1、已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )A.在Na2A、NaHA两溶液中,离子种类不相同B.在溶质的物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)答案 C解析在Na2A溶液中存在:Na2A===2Na++A2-,A2-+H2O HA -+OH-,HA-+HH2A+OH-,H2O H++OH-。
在NaHA溶液中存2O在:NaHA===Na++HA-,HA-+H 2O H2A+OH-,HA-H++A2-,H 2O H++OH-。
阳离子有:Na+、H+;阴离子有:A2-、HA-、OH-。
根据电荷守恒可知在Na2A、NaHA溶液中都有:c(Na+)+c(H+)=c(HA -)+c(OH-)+2c(A2-)。
Na溶液中c(Na+)是NaHA溶液中c(Na+)的2A两倍,所以等物质的量的Na2A、NaHA中Na2A中阴离子总数多。
因为Na2A是强碱弱酸盐,水解显碱性,所以c(OH-)>c(H+)。
A2-易水解,所以c(Na+)>c(A2-),离子浓度关系为c(Na+)>c(A2-)>c(OH-)>c(H+)。
由以上分析知A、B、D三项均不正确,C项正确。
2、下列溶液中各微粒的浓度关系正确的是( )A.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B.含等物质的量的CH3COONa和CH3COOH的混合溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)C.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液混合至pH=7:c(Na+)>c(Cl-)>c(OH-)>c(H+)D.0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO2-3)+c(HCO-3)+c(H2CO3)]答案 D解析由于CH3COOH的浓度远大于NaOH溶液的浓度,反应后溶液显酸性,c(CH3COO-)>c(Na+),c(H+)>c(OH-),故A项错误;含等物质的量的CH3COONa和CH3COOH的混合溶液中醋酸的电离大于醋酸根离子的水解:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),B项错误;溶液pH=7,则:c(OH-)=c(H+),C项错误;0.1mol·L-1Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合,由Na2CO3与NaHCO3各自的物料守恒可得:c(Na+)=2[c(CO2-3)+c(HCO-3)+c(H2CO3)],c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3),则混合液中:2c(Na+)=3[c(CO2-3)+c(HCO-3)+c(H2CO3)],D项正确。
9-溶液中的等式问题(三大守恒)与粒子浓度大小比较问题基础练习

12.常温下,将物质的量浓度相同的 NaOH 溶液与醋酸溶液等体积混合后,下列关系式能成立的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(H+)=c(CH3COO-)+c(OH-)
C.物质的量浓度相等 CH3COOH 和 CH3COONa 溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol/L 的 NaHA 溶液 pH=4:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)
7.下列有关叙述正确的是 ( )
A.等浓度的 NaClO、NaHCO3 混合溶液中:
)+c(H+
)=c(Cl-)+c(OH-)一定成立
C.当 pH=7 时,若 V1=V2,则 c2 必须大于 c1
D.若
c(
NH
+ 4
)+c(NH3·H2O)=c(Cl-),则一定有
c1V1=c2V2
25.常温下,将 NaOH 溶液滴加到含等物质的量浓度的 HX、HY 的混合溶液中,混合溶液的 pH 与离子浓度变化的关系 如图所示。已知,常温下 Ka(HX)=3.2×10-5,下列叙述错误的是 A.L1 表示的是 HY 的变化关系 B.常温下,Ka(HX)>Ka(HY) C.当混合溶液呈中性时,c(Na+)=c(Y-)+c(X-) D.当混合溶液呈中性时,c(Na+)>c(Y-)>c(X-)>c(OH-)=c(H+)
高中化学第三章 水溶液中的离子平衡 综合练习

煌敦市安放阳光实验学校第三章水溶液中的离子平衡综合练习(一)基础练习一、选择题1.下列叙述正确的是A.氯化钠溶液能导电,所以氯化钠溶液是电解质B.固体氯化钠不导电,但氯化钠是电解质C.氯化氢水溶液能导电,所以氯化氢是电解质D.氯气溶于水能导电,所以氯气是电解质2.亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是A.1mol/L亚硝酸溶液的c(H+)约为1×10-2mol/LB.亚硝酸能与水以任何比例互溶C.10mL、1mol/L亚硝酸恰好与10mL、1mol/LNaOH溶液完全反D.在相同条件下,亚硝酸溶液的导电性比强酸溶液的弱3.醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流I随加入氨水的体积V的变化曲线图是4.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。
HIn(aq) H++In-(aq)() (黄色)浓度为0.02mol/L的下列各溶液:(1)HCl (2)石灰水(3)NaCl(aq) (4)NaHSO4(aq) (5)NaHCO3(aq) (6)氨水其中能使指示剂显的是A. (1)(4)(5)B. (2)(5)(6)C. (1)(4)D. (2)(3)(6)1.BC2.AD 弱电解质溶于水只能电离,若1mol/LHNO2溶液完全电离,则c(H+)=1mol/L,现在c(H+)=1×10-2mol/L,说明只电离了;在相同条件下,弱电解质电离,溶液中离子浓度小,故导电性弱于强电解质。
A、D正确。
B选项只叙述了HNO2在水中的溶解性。
C选项只说明HNO2具有酸性,未涉及酸性的强弱。
3.B CH3COOH CH3COO-+H+ ,加入NH3·H2O(电离出OH-),H++OH-==H2O,促进了两种弱电解质的电离,溶液中离子浓度增大,导电性增强(I增大);继续加过量的稀NH3·H2O,因稀释作用使溶液中离子浓度减小,导电性减弱。
高考化学三大平衡综合练习题

电离平衡、沉淀溶解平衡及盐类的水解综合练习题〔限时50分钟〕制作人: 王兴宏1. 向体积为0.05mol·L-1CH3COOH溶液中参加体积为Vb的0.05mol·L-1KOH溶液, 以下关系错误的选项是〔〕A.Va>Vb时: .(CH3COOH.+.(CH3COO-)>.(K+〕B.Va=Vb时: .(CH3COOH.+.(H+)>.(OH-〕C.Va<Vb时: .(CH3COO-)>.(K+〕..(OH-〕..(H〕D.Va与Vb任意比时: .(K+〕..(H+.=.(OH-〕..(CH3COO-)2. 用0.1 mol•. 的盐酸滴定0.10 mol•. 的氨水, 滴定过程中不可能出现的结果是〔〕A. > ,.>.B. = ,.=C..> ,.>.D..> , >3. 以下关于溶液和胶体的表达, 正确的选项是〔〕A.溶液是电中性的, 胶体是带电的B.通电时, 溶液中的溶质粒子分别向两极移动, 胶体中的分散质粒子向某一极移动C.溶液中溶质粒子的运动有规律, 胶体中分散质粒子的运动无规律, 即布朗运动D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者那么没有4. 现有等浓度的以下溶液: ①醋酸, ②苯酚, ③苯酚钠, ④碳酸, ⑤碳酸钠, ⑥碳酸氢钠。
按溶液pH由小到大排列正确的选项是〔〕A.④①②⑤⑥..........B.④①②⑥⑤...C.①④②⑥③..........D.①④②③⑥⑤5.2.℃时,浓度均为0..mol/L的NaHCO3和Na2CO3溶液中,以下判断不正确的选项是〔〕C.c(OH-)前者大于后者D.分别参加NaOH固体, 恢复到原温度, c(CO32-)均增大6. 以下表达正确的选项是〔〕mol/LC6H5ONa溶液中: c(Na+)>c(C6H5O-)>c(H+)>c(OH-)2CO3溶液加水稀释后, 恢复至原温度, pH和Kw均减小C.pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中, c(H+)不相等D.在Na2S溶液中参加AgCl固体, 溶液中c(S2-)下降7. 以下溶液中微粒的物质的量浓度关系正确的选项是〔 〕溶液中滴加 溶液至中性:溶液:C. 溶液:D. 25℃时, 的 混合溶液:8.单位体积的稀溶液中, 非挥发性溶质的分子或离子数越多, 该溶液的沸点就越高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水溶液中的“三大平衡” (1)题型:选择题 6分,电离度(2016),沉淀溶解平衡、溶度积常数( 2015、2013 )、K sp 计算(2014)、离子积常数(2012) 选择题:每小题只有一项符合题意。
1 •醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是 ①醋酸与水能以任意比互溶 ②醋酸溶液能导电③醋酸溶液中存在醋酸分子④0.1—1一 1mol L 醋酸的pH 比0.1 mol L 盐酸的pH 大⑤醋酸能和碳酸钙反应放出 CO ⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生 耳速率慢A.②⑥B.③④⑤C.③④⑥D.①②2. 下列叙述正确的是A. 盐酸中滴加氨水至中性,溶液中溶质为氯化铵B. NaHSO 溶液、KF 溶液、KAI(SO “2溶液、Nal 溶液中,前三个都对水的电离平衡产生 影响,且都促进水的电离C. 向NaAIQ 溶液中滴加NaHCO 溶液,有沉淀和气体生成D.25 C 时,用醋酸溶液滴定等浓度 NaOH 溶液至pH = 7 ,V (醋酸)> V3. 将浓度为0.1 mol L 「1HF 溶液加水不断稀释,下列各量始终保持增大的是+C (F 一)A. C (H )B. K a (HF)C. c (H +)D. 4. 对滴有酚酞试液的下列溶液,操作后颜色变深的是A.明矶溶液加热 B. CHCOON 溶液加热 C.氨水中加入少量 NHCI 固体D.小苏打溶液中加入少量5. 下列溶液中粒子的物质的量浓度关系正确的是A. 0.1 mol L 一1NaHCO 溶液与0.1 mol L 一1NaOH 溶液等体积混合,所得溶液中: c (Na +) >c (CO 3 ) > c (HCO ) > c (OH )B. 20 mL 0.1 mol L —1 CH 3COON 溶液与 10 mL 0.1 mol L —1HCI 溶液混合后溶液呈酸性, 所得溶液中:c (CHCOO) > c (CI 一)> c (CH 3COOH) > c (H +)C. 室温下,pH = 2的盐酸与pH = 12的氨水等体积混合,所得溶液中:— + + —c (CI ) + c (H +) > c (NH 4)+ c (OH )D. 0.1 mol L 一1CH 3COOH 溶液与0.1 mol •一1NaOH 溶液等体积混合,所得溶液中: C (OH 「)>c (H +) + c (CH 3COOH)6. 常温下,0.2 mol L —1的一元弱酸HA 与等浓度的NaOH 溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是 A. HA 为强酸B.该混合液pH = 7C. 图中X 表示HA Y 表示 OH , Z 表示HD. 该混合溶液中:c (A —) + c (Y) = c (Na +)7.室温下,甲、乙两烧杯均盛有 5mL pH = 3的某一元酸溶液,向乙烧杯中加水稀释至 pH = 4。
关于甲、乙烧杯中溶 液的描述正确的是c (H +) C (HF)NaCI 固体①溶液的体积10V甲< V乙②水电离出的 OH浓度:10c(OH「)甲< c(OH「)乙③若分别用等浓度的 NaOH溶液完全中和,所得溶液的pH:甲w乙④若分别与5 mL pH = 11的NaOH溶液反应,所得溶液的 pH:甲w乙A. ①②B.②③C.①④D.②④& 室温下,用 0.100 mol L 「1 NaOH 溶液分别滴定 20.00 mL 0.100 mol 1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是 A. n 表示的是滴定醋酸的曲线B. pH = 7时,滴定醋酸消耗 V (NaOH)/小于20 mLC. V (NaOH) = 20 mL 时,c (CI 「)= c (CHCOO)D. V (NaOH) = 10 mL 时,醋酸溶液中:c (Na +) > c (CH s COO) > c (H +) > c (OH )9. 25C 时,用浓度为 0.1000 mol 「1的NaOH 溶液滴定20.00 mL 浓度均为 0.1000 mol L 的三种酸 HX HY HZ 滴定曲线如图所示。
下列说法正确的是A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:B. 根据滴定曲线,可得 K a (HY) ~10 _5C. 将上述HX HY 溶液等体积混合后,用 NaOH 溶液滴定 至HX恰好完全反应时:c (X _) > c (Y _) > c (OH 「)> c (H +)D. HY 与HZ 混合,达到平衡时:_ 1 _ 110. 常温下,用 0.1000 mol L NaOH 溶液滴定 20.00 mL 0.1000 mol L CHCOOH 溶液所得滴定曲线如右图。
下列说法正确的是 A. 点①所示溶液中:c (CH s CO(_) + c (OH _) = c (CHCOOH) + c (H +)B. 点②所示溶液中:c (Na +) = c (CfCOOH)+ c (CH s CO(_)C. 点③所示溶液中:c (Na +) > c (OH ) > c (CH s COO) > c (H +)D. 滴定过程中可能出现:c (CH s COOH) > c (CHCOO) > c (H +) > c (Na +) > c (OH )_ 12一 3— 111.已知 K sp (Ag 2CrO 4) = 9.0 X 10 ,将等体积的 4 X 10 mol L 的AgNO 溶液和 4 X 10_3mol L _1的K 2CrO 4溶液混合,下列说法正确的是A. 恰好形成 Ag 2CrCu 饱和溶液B.能析出Ag^CrO 沉淀C.不能析出Ag 2CrO 4沉淀D.无法确定能否析出 Ag 2CrO 4沉淀c (H +)=K a (HY) c (HY)—c(Y _)—+ c (Z _) + c (OH 「)HZ < HY < HX12. 某温度下,Fe(OH)3(s)、C U(OH)2(S)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。
据图分析,下列判断错误的是A. K sp[Fe(OH) 3] < K sp[Cu(OH) 2]B. 加适量NHCI固体可使溶液由a点变到b点C. c、d两点代表的溶液中c(H +)与c(OH )乘积相等D. Fe(OH)3(s)、C U(OH)2(S)分别在b、c两点代表的溶液中达到饱和_ _ io _ 13 一 1213.已知 K sp (AgCI) = 1.56 X 10 , K sp (AgBr) = 7.7 X 10 ,K sp (Ag 2CrO 4)= 9.0 X 10。
_ _2_ 一1某溶液中含有 Cl 、Br 和CrQ 浓度均为0.010 mol L ,向该溶液中逐滴加入 0.010mol L _1的AgNO 溶液时,三种阴离子产生沉淀的先后顺序为2_2_A. Cl 、Br 、CrQB. CrO 4、Br 、Cl2 __2 _C. Br 、Cl 、CrC 4D. Br 、CrO 4、Cl14.已知常温下:K Sp [Mg(OH )2] = 1.2 X 10_ 11, K Sp (AgCl) = 1.8X 10_10, K sp (Ag 2S) = 6.3 x_ EQ_ Q10_ , K sp (CH 3COOAg) = 2.3 X 10 _。
下列叙述正确的是A. 浓度均为0.02 mol L _ 1的AgNO 和CHCOON 溶液混合一定产生 CHCOOA 沉淀B. 将 0.001 mol L 的 AgNO 溶液加入到 0.001 mol L 的 KCl 和 0.001 mol L 的 K 2S溶液中,先产生AgCl 沉淀C. 要使Mg +浓度为0.12 mol L _1的溶液产生 Mg(OH>的沉淀,溶液的pH >9 D. 向饱和AgCl 的水溶液加入NaCl 溶液,K sp (AgCl)变大C. pH = 11的NaOH 溶液与pH = 3的醋酸溶液等体积混合,滴入石蕊溶液呈红色D.向0.1 mol •一1的氨水中加入少量硫酸铵固体,则溶液中 /(NHHHo)增大17. 下列说法正确的是A.中和相同体积、相同c (H +)的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH 溶液的体积关系:V 1 > V 2 = V 3B. 将0.1 mol L _1CH 3COOH 溶液加水稀释,在此过程中,醋酸的电离程度、溶液的 pH 都逐渐增15.—定温度下,三种碳酸盐MCQM : MgS.2 一已知 pM = _ lg c (M) , p c (CQ ) = _ lg ① MgCQ CaCO MnCO 的 K p 依次增大 ② a 点可表示MnCO 勺饱和溶液,2 +2_且 c (Mn ) = c (CQ )③ b 点可表示CaCO 的饱和溶液, 且 c (Ca +) < c (CO 3 )④ c 点可表示MgCO 勺饱和溶液,2 +2 _且 c (Mg ) < c (CO 3 ) A. ①② B .②③ C.①③D.②④16. 下列叙述正确的是C 『、MrT)的沉淀溶解平衡曲线如下图所示。
c (C&_)。
下列说法正确的是pM 1210 8 6 4 2 024 6 8 10 12p(COS }2一+pH = 7 时,c (SO 4 ) > c (NH 4)C 1 和 C 2, pH 分别为 a 和 a + 1,贝U C 1 = 10 C 2大C. 稀氨水中部分离子的浓度大小关系:c(NH^) > C(OH「)> c(H+) > c(NH3 H2O)D. 已知氢气的标准燃烧热为—285.8 kJ mol _1,相应的热化学方程式为:2H2(g) + O2(g) = 2fO(l) △H = — 285.8 kJ mol18. 取pH均等于2的盐酸和醋酸各100 mL分别稀释2倍后,再分别加入 0.03 g锌粉,在相同条件下充分反应,有关叙述正确的是①醋酸与锌反应放出氢气多②盐酸和醋酸分别与锌反应放出的氢气一样多③醋酸与锌反应速率大④盐酸和醋酸分别与锌反应的速率一样大A. ①③B.①④C.②③D.②④19. 25C时,水的电离达到平衡:H2O H++ 0H「△H> 0,下列叙述正确的是A. 向水中加入稀氨水,平衡逆向移动,c(OH「)降低B. 向水中加入少量固体硫酸氢钠,C(H +)增大,K w不变C. 向水中加入少量固体醋酸钠平衡逆向移动,C(H+)降低D. 将水加热,K w增大,pH不变20. 已知温度T时水的离子积常数为K w,该温度下,将浓度为a mol L-1的一元酸HA与b mol L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A. a = bB. 混合溶液的pH = 7C. 混合溶液中,c(H +) = K w mol 1D. 混合溶液中,C(H+) + C(B+) = C(OH「)+ C(A「)21. 下列关于电解质溶液的正确判断是A. 25C时NH4CI溶液的K w大于100C时NHCI溶液的KB. 在pH = 0的溶液中,NaS Ba2*、AIQ、NO可以大量共存C. 由0.1 mol L1一元碱BOH溶液的pH = 10,可推知BOH溶液存在BOH= B++ OH「D. 由0.1 mol L1一元酸 HA溶液的pH = 3,可推知 NaA溶液存在A + H2O HA + OH「22. 下列叙述正确的是A. 某醋酸溶液的pH = a,将此溶液稀释1倍后,溶液的pH = b,则a > bB. 在滴有酚酞溶液的氨水里,加入NH4CI至溶液恰好无色,则此时溶液的pH < 7C. 1.0 X10 mol L 盐酸的 pH = 3.0 , 1.0 X10 mol L 盐酸的 pH = 8.0D. 若1 mL pH = 1的盐酸与100 mL NaOH溶液混合后,溶液的 pH = 7,贝U NaOH溶液的 pH = 1123. 已知AgI为黄色沉淀,AgCl为白色沉淀,25 C时,AgI饱和溶液中C(Ag+)为1.22 X10 _8 molL_1, AgCl 饱和溶液中C(Ag +)为 1.30 X10 一5 mol L_1。
