抗缪勒氏管激素(AMH)质控品产品技术要求博粹
抗缪勒氏管激素测定试剂盒(化学发光免疫分析法)产品技术要求新产业

2. 性能指标
2.1 外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2 批内精密度
批内变异系数(CV)应≤8%。
2.3 批间精密度
批间变异系数(CV)应≤15%。
2.4 准确度
回收率应在(90.0%~110.0%)范围内。
2.5 空白限
空白限应≤0.020 ng/mL。
2.6 线性
在(0.100~25.0)ng/mL浓度区间内,线性相关性系数(r)绝对值应≥0.9900。
2.7 校准品均一性
校准品均一性(CV)应≤8%。
2.8 质控品测量准确度
质控品1测定结果应在[2.80~5.20] ng/mL范围内,质控品2测定结果应在[11.2~20.8]ng/mL范围内。
2.9 质控品均一性
质控品均一性(CV)应≤8%。
2.10 溯源性
本试剂盒校准品可以溯源至企业内部校准品。
第1页共1页。
一种抗缪勒氏管激素(AMH)定量检测试剂盒[实用新型专利]
![一种抗缪勒氏管激素(AMH)定量检测试剂盒[实用新型专利]](https://img.taocdn.com/s3/m/97a5883980eb6294dc886ca7.png)
专利名称:一种抗缪勒氏管激素(AMH)定量检测试剂盒专利类型:实用新型专利
发明人:李敏
申请号:CN201821402558.2
申请日:20180829
公开号:CN208813751U
公开日:
20190503
专利内容由知识产权出版社提供
摘要:本实用新型公开了一种抗缪勒氏管激素(AMH)定量检测试剂盒,包括底盒、盖体、药包、格挡板和说明书,所述底盒内部的中心位置处设有格挡板,格挡板一侧的底盒内部设有药包,所述格挡板远离药包一侧底盒内部设有置药海绵,第二槽体的内部皆设有档板条,所述底盒的上方设有盖体,盖体顶部的中心位置处设有说明书,所述说明书两侧的盖体顶部皆设有固定板,固定板的内部皆设有固定条,所述底盒与盖体的外壁上皆涂抹有防水层,防水层内部的中心位置处设有保温层。
本实用新型不仅提高了试剂盒使用时的稳定性,提高了试剂盒使用时的便捷程度,而且提高了试剂盒使用时的实用性。
申请人:广州市康润生物制品开发有限公司
地址:510000 广东省广州市番禺区南村镇埗东村登云大路8号2栋601B2
国籍:CN
代理机构:广州市华学知识产权代理有限公司
代理人:张泽锋
更多信息请下载全文后查看。
抗缪勒氏管激素(AMH)测定试剂盒(光激化学发光法)产品技术要求kemei

抗缪勒氏管激素(AMH)测定试剂盒(光激化学发光法)适用范围:本试剂盒用于体外定量测定人血清中抗缪勒氏管激素(AMH)的含量。
1.1 产品型号说明:1. 校准品浓度批特异,详见定值单。
2. 质控品质控范围批特异,详见定值单。
2.1 外观试剂盒组分齐全,内外包装均完整,标签清晰,液体试剂无渗漏。
2.2空白限不高于0.02ng/mL。
2.3准确性回收率应在85.00%~115.00%范围内。
2.4线性在[0.02,24.00]ng/mL区间内,试剂盒剂量-反应曲线线性相关系数(r)应不小于0.9900。
2.5重复性质控品测定结果的变异系数(CV)应不大于8.00%。
2.6批间差在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.00%。
2.7质控品测定值同一套质控品的测定结果应在本试剂盒规定的范围之内。
2.8特异性2.8.1与促黄体生成素(LH)浓度为500IU/L的LH在本试剂盒上测定的测定结果应不高于0.02ng/mL。
2.8.2 与促卵泡生成激素(FSH)浓度为500IU/L的FSH在本试剂盒上的测定结果应不高于0.02ng/mL。
2.8.3与抑制素A(Inhibin-A)浓度为100ng/mL的抑制素A在本试剂盒上的测定结果应不高于0.02ng/mL。
2.8.4与激活素A(Activin-A)浓度为100ng/mL的激活素A在本试剂盒上的测定结果应不高于0.02ng/mL。
2.9 稳定性取2℃~8℃保存至失效期3个月内的试剂盒,检测2.1、2.2、2.3、2.4、2.5、2.7、2.8项,结果应符合相应规定。
2.10 溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所用AMH校准品的来源、赋值过程以及测量不确定度等内容,本试剂盒配套校准品溯源至本公司抗缪勒试管激素工作校准品。
大鼠缪勒管抑制物质 抗缪勒管激素(MIS AMH) 酶联免疫分析试剂盒 说明书

大鼠缪勒管抑制物质/抗缪勒管激素(MIS/AMH)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用预期应用ELISA法定量测定大鼠血清、血浆或其它相关液体中缪勒管抑制物质/抗缪勒管激素(MIS/AMH)含量。
实验原理本试剂盒应用双抗体夹心酶标免疫分析法测定标本中MIS/AMH水平。
用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入MIS/AMH抗原、生物素化的抗大鼠MIS/AMH抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的MIS/AMH呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板:一块(96孔)2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为20,000pg/ml,做系列倍比稀释后,分别稀释20,000pg/ml,10,000pg/ml,5,000pg/ml,2,500pg/ml,1,250pg/ml,625pg/ml,312pg/ml,样品稀释液直接作为标准浓度0pg/ml,临用前15分钟内配制。
如配制10,000pg/ml标准品:取0.5ml20,000pg/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml/瓶。
4.检测稀释液A:1×10ml/瓶。
5.检测稀释液B:1×10ml/瓶。
6.检测溶液A:1×120ul/瓶(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(每孔100ul),实际配制时应多配制0.1-0.2ml。
如1ul检测溶液A加99ul检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
人(Human)抗缪勒管激素(AMH)ELISA试剂盒说明书

本试剂盒只能用于科学研究,不得用于医学诊断人(Human)缪勒管抑制物质/抗缪勒管激素(MIS/AMH)ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被缪勒管抑制物质/抗缪勒管激素(MIS/AMH)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的缪勒管抑制物质/抗缪勒管激素(MIS/AMH)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体-HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释底物A6mL3mL无底物B6mL3mL无终止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、250、500、1000、2000、4000pg/mL 试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
抗缪勒氏管激素测定试剂盒(化学发光法产品技术要求丽珠

2性能指标
2.1外观
试剂盒应各组分应齐全、完整,液体无渗漏;包装标签应清晰、准确、牢固。
2.2检出限
空白限(limitofblank,LoB)不大于0.01ng/mL,检出限(limitofdetection,LoD)为0.02ng/mL。
产品名称
抗缪勒氏管激素测定试剂盒(化学发光法)
型号、规格
3×14人份/盒
结构及组成
1、抗缪勒氏管激素免疫反应测试筒抗缪勒氏管激素结合磁微粒:抗抗缪勒氏管激素鼠单克隆抗体(包被抗体)包被磁微粒;抗缪勒氏管激素酶标抗体:含碱性磷酸酶标记的抗缪勒氏管激素鼠单克隆抗体(检测抗体)。2、测试筒支架
产品适用范围/预期用途
2.3准确度
将已知浓度的抗缪勒氏管激素样本加入到低值样本中,其回收率应在[85%,115%]。
2.4线性
线性范围不窄于0.05 ng/mL~23ng/mL,线性相关系数|r|应不低于0.990。
2.5重复性
测试重复性参考品,所得结果的变异系数(CV)应不大于8%。
2.6批间差
测试重复性参考品,所得结果的的变异系数(CV)应不大于10%。
抗缪勒氏管激素(AMH)测定试剂盒(光激化学发光法)产品技术要求
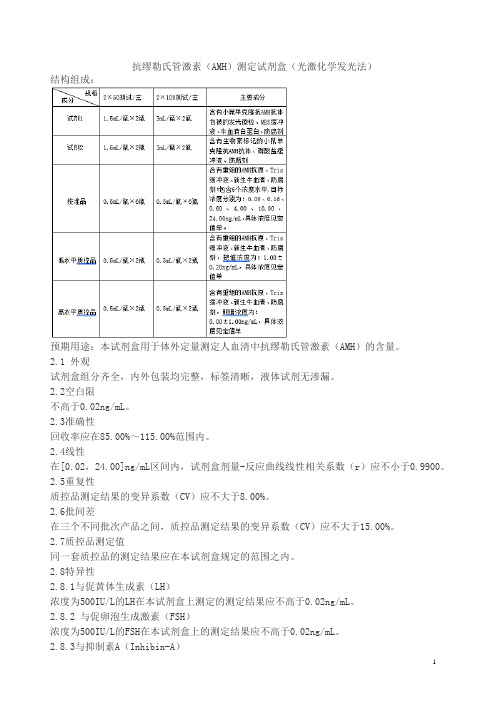
抗缪勒氏管激素(AMH)测定试剂盒(光激化学发光法)结构组成:预期用途:本试剂盒用于体外定量测定人血清中抗缪勒氏管激素(AMH)的含量。
2.1 外观试剂盒组分齐全,内外包装均完整,标签清晰,液体试剂无渗漏。
2.2空白限不高于0.02ng/mL。
2.3准确性回收率应在85.00%~115.00%范围内。
2.4线性在[0.02,24.00]ng/mL区间内,试剂盒剂量-反应曲线线性相关系数(r)应不小于0.9900。
2.5重复性质控品测定结果的变异系数(CV)应不大于8.00%。
2.6批间差在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.00%。
2.7质控品测定值同一套质控品的测定结果应在本试剂盒规定的范围之内。
2.8特异性2.8.1与促黄体生成素(LH)浓度为500IU/L的LH在本试剂盒上测定的测定结果应不高于0.02ng/mL。
2.8.2 与促卵泡生成激素(FSH)浓度为500IU/L的FSH在本试剂盒上的测定结果应不高于0.02ng/mL。
2.8.3与抑制素A(Inhibin-A)浓度为100ng/mL的抑制素A在本试剂盒上的测定结果应不高于0.02ng/mL。
2.8.4与激活素A(Activin-A)浓度为100ng/mL的激活素A在本试剂盒上的测定结果应不高于0.02ng/mL。
2.9 稳定性取2℃~8℃保存至失效期3个月内的试剂盒,检测2.1、2.2、2.3、2.4、2.5、2.7、2.8项,结果应符合相应规定。
2.10 溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所用AMH校准品的来源、赋值过程以及测量不确定度等内容,本试剂盒配套校准品溯源至本公司抗缪勒试管激素工作校准品。
抗缪勒氏管激素质控品产品技术要求博粹

抗缪勒氏管激素质控品产品技术要求博粹抗缪勒氏管激素(Anti-Müllerian Hormone, AMH)是一种重要的生物标志物,用于评估卵巢储备功能和女性生殖健康状况。
其测试结果对于评估女性的生殖健康状态、确定生育年龄、进行不孕不育疾病的诊断和治疗具有重要意义。
1.纯度要求:抗AMH质控品的纯度要求高,必须纯净且不含其他有可能对测试结果造成干扰的杂质。
其纯度可以通过高效液相色谱(HPLC)和酶联免疫吸附测定(ELISA)等技术进行验证。
2.稳定性要求:抗AMH质控品应具有良好的稳定性,以确保其在长期储存和使用过程中的一致性和可靠性。
稳定性可以通过长期储存试验、温度敏感性试验等进行验证。
3.活性要求:抗AMH质控品应具有高度的活性,能够与AMH快速、特异地结合,并能够准确地模拟AMH在生物体内的生理功能。
其活性可以通过生物活性试验、逆向酶联免疫吸附测定等进行验证。
4.重复性要求:抗AMH质控品的制备应具备良好的重复性,确保每一批制备的质控品在不同的实验条件下具有一致的检测结果。
重复性测试可以通过同批次和不同批次的重复性试验进行验证。
5.安全性要求:抗AMH质控品应符合生物安全要求,不得存在有害成分,并且对操作人员和环境无危害。
安全性可通过毒理学试验进行验证。
总之,抗缪勒氏管激素质控品的产品技术要求包括纯度、稳定性、活性、重复性和安全性等方面。
制造商在生产过程中应严格按照相关质量标准进行操作,确保质控品的质量稳定和一致,并通过严格的质量控制措施
确保质控品的合格率和可靠性,以满足AMH检测试剂盒的准确性和可靠性要求。
amh质控范围

amh质控范围
一、AMH质量控制范围
1、产品名称:AMH
2、质量控制指标:
①有机碱含量:≤98.5%
②氨基酸含量:≥86.5%
③相对聚酯量:≤0.3%
④挥发性有机物含量:≤1.0%
⑤水溶性小分子有机物含量:≤1.0%
除以上控制要求外,还应控制外观,气味,粘度等参数,使其满足AMH使用要求。
二、质量控制方法
1、抽样:按照《组织结构、管理机构和质量管理体系的规范性文件编制》(S/T 0120)规定的抽检频率及分类抽检原则,对AMH每批次产品进行抽检,以确定产品的质量状况。
2、检验:按照国际质量标准的要求,对AMH的各项物理化学指标进行精确测定,以确保AMH质量控制合格。
3、改善:在AMH的生产过程中,应及时进行对比分析,发现AMH 质量控制问题,并及时采取改善措施,确保AMH的质量稳定性。
- 1 -。
抗缪勒氏管激素(AMH)测定试剂(荧光免疫层析法) 产品技术要求万孚

1.性能指标
1.1外观检查
外观应平整,标识清晰,各组分齐全,液体无渗漏。
1.2物理检查
膜条宽为4.0±0.5mm;液体移行速度应不低于10mm/min。
1.3准确度
用参考品作为样本进行测定,其测定结果的相对偏差(Bias)不应超过±15%。
1.4最低检出限
应不大于0.1 ng/mL。
1.5线性
在0.1 ng/mL~16 ng/mL 的范围内,线性相关系数r≥0.9900。
1.6精密度
1.6.1批内精密度
用同一批号的试剂分别测定 2 个不同浓度的参考品,其测定结果的变异系数(CV)应不大于10%。
1.6.2批间精密度
用三个不同批号的试剂分别测定2 个不同浓度的参考品,其测定结果的变异系数(CV)应不大于15%。
1。
抗缪勒管激素(AMH)测定试剂盒(磁微粒化学发光法)产品技术要求北京华科泰生物
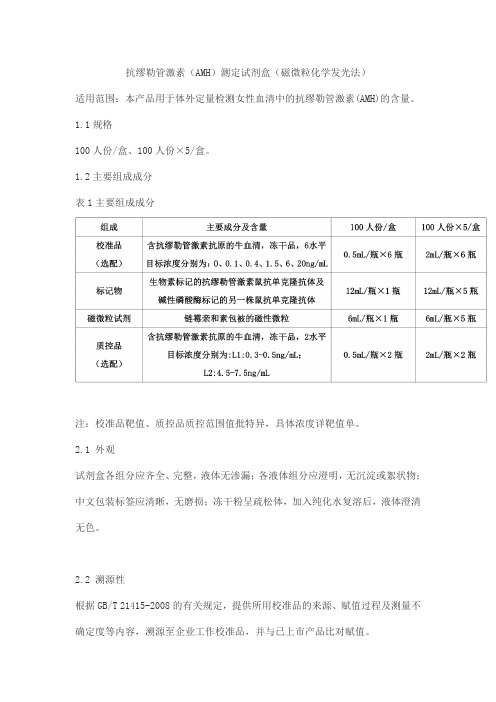
抗缪勒管激素(AMH)测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量检测女性血清中的抗缪勒管激素(AMH)的含量。
1.1规格100人份/盒、100人份×5/盒。
1.2主要组成成分表1主要组成成分注:校准品靶值、质控品质控范围值批特异,具体浓度详靶值单。
2.1 外观试剂盒各组分应齐全、完整,液体无渗漏;各液体组分应澄明,无沉淀或絮状物;中文包装标签应清晰,无磨损;冻干粉呈疏松体,加入纯化水复溶后,液体澄清无色。
2.2 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3 准确度回收率应在90%~110%之间。
2.4 线性在线性范围内[0.1,20]ng/mL,相关系数(r)应不低于0.99。
2.5 重复性分别检测高值和低值两个样本,重复性(CV%)应不高于10.0%。
2.6 批间差在三个不同批次产品之间,样本测定结果的变异系数(CV%)应不高于15.0%。
2.7 空白限空白限应不高于0.05ng/mL。
2.8 特异性表2与FSH、LH的交叉反应2.9 质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10 稳定性2.10.1 效期稳定性2℃~8℃储存,有效期12个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2 复溶稳定性2.10.2.1 校准品开瓶后(复溶后),-20℃以下储存,有效期1个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2.2 质控品开瓶后(复溶后),-20℃以下储存,有效期1个月,效期后分别检测2.5、2.9项,其结果应符合各项要求。
抗缪勒氏管激素(AMH)试剂盒已上市对照产品信息

储存,有效期12个 月。应避免阳光直接 照射。 2.铝箔袋开 封后,请在1小时内
保存,保存期限有效 期为18个月;组份2保 存于2~8℃保存,保 存期限有效期为18个
2℃~30℃保存,切勿 冷冻。有效期为18个 月
使用。
月
件下,产品稳定性符合
其质量要求。
抗缪勒氏管激素 (AMH)检测试剂盒 (免疫荧光法)
由试剂R1、R2、M、S1 、S2、C1、C2、试剂卡 和校准品卡组成。其 中:R1:生物素化的抗 AMH抗体,1瓶, 6.5mL;R2:吖啶酯标 记的抗AMH抗体,1瓶, 6.5mL;M:链霉亲和素 磁珠,1瓶,2.5 mL; S1:校准品1;S2:校 准品2;C1:质控品1; C2:质控品2
适用于体外定量测定人全血
型号:型号W,型号 L;规格: 50人份/ 盒,2×50人份/盒
100人份/盒
主要组成 成分
试剂由测试卡、样本稀释液 和ID芯片组成。其中: 试剂盒主要由磁珠 (1)测试卡由试纸条、塑 包被物(R1)、酶标 料盒组成。试纸条上的主要 记物(R2)、校准品 成分有:样本处理垫、硝酸 和质控品(选配) 纤维素膜、吸水纸、PVC板 组成。其中R1为含 及其它试纸条支持物。硝酸 有AMH抗体1包被磁 纤维素膜上包被有AMH单克 珠,R2为AMH抗体2 隆抗体和鸡IgY,样本处理 标记碱性磷酸酶标 垫含有AMH单克隆抗体和羊 记物。校准品含AMH 抗鸡IgY(GAC)。(2)样 重组抗原,质控品 本稀释液主要成分为Tris- 含AMH重组抗原 HCl缓冲液
抗缪勒氏管激素 (AMH)检测试剂盒 (荧光免疫层析法)
抗缪勒氏管激素 检测试剂盒(免 疫荧光法)
抗缪勒氏管激素 (AMH)检测试剂盒 (荧光免疫层析法)
抗缪勒管激素测定试剂盒(化学发光免疫分析法)说明书

Statistical Approach; Approved Guideline. [9] CLSI EP09C-ED3:2018 Measurement Procedure Comparison and Bias Estimation Using
I
YY/T XXXXX—XXXX
前言
本标准按照GB/T 1.1—2009给出的规则起草。 本标准的某些内容可能涉及专利,本文件的发布机构不承担识别这些专利的责任。 本标准由国家药品监督管理局提出。 全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)归口。 本标准起草单位: 本标准主要起草人:
V cs
100%
................................... (1)
式中:
R—回收率;
V—样品A液的体积;
V0—样本B液的体积; C—样本B液加入A液后的检测浓度;
C0—测量B液的浓度; Cs—样本A液的浓度。
4.4 重复性 用同一批号试剂盒,对至少2个不同浓度的质控品或临床样本(高值质控或临床样本浓度不低于
Patient Samples; Third Edition. _________________________________
5
4 试验方法 4.1 外观
在自然光下以正常视力或矫正视力目视检查,检测结果应符合3.1的要求。
4.2 检出限 生产企业应提供试剂盒的空白限、检出限及参考区间等相关信息。根据制造商提供的信息,对5
抗穆勒氏管激素(AMH)

For personal use only in study and research;not for commercial use抗穆勒氏管激素(AMH)抗穆勒氏管激素(anti-Mullerian hormone,AMH)是转化生长因子β超家族的成员之一,由Professor Alfred Jost于1974年首先发现。
AMH是由两个相同的70KD亚基,通过二硫键连接组成的二聚糖蛋白,相对分子质量为140KD;人类AMH编码基因位于19号染色体短臂,大小2.4~2.8kb,含有5个外显子。
抗穆勒氏管激素(AMH)在性腺器官发育过程中起着重要作用,是男女性腺功能的重要标记物之一。
在男性AMH主要由睾丸间质细胞产生,始于胚胎形成并贯穿生命始终;在男性胎儿的发育过程中,AMH导致穆勒氏管退化,形成正常发育的男性生殖管道。
在女性AMH主要由卵巢颗粒细胞产生,血清AMH 保持相对于男性较低的一个水平,从青春期开始,血清AMH水平随时间慢慢降低,并在更年期降低到ELISA法检测不到的水平。
AMH指标应用范围:AMH是评价卵巢储备功能的良好指标,使用方便AMH可预测绝经年龄AMH为多囊卵巢综合症(PCOS)的诊断提供新的参考指标AMH对卵巢早衰,卵巢颗粒细胞瘤,儿童性别发育异常的诊断有重要的意义AMH在辅助生殖技术(ART)前能准确地预测卵巢反应,制定个体化刺激方案,一定程度提高妊娠率,降低并发症风险AMH指标的优势1.不受月经周期影响,随时可检验FSH、LH、E2会随着月经周期而变动,通常是在月经来潮第3天进行检测;而AMH不受月经周期、怀孕、服用药物等影响而变动,任何时间的浓度都一样稳定。
2.可明确得知卵子库存量FSH、LH是依照荷尔蒙调节的原理间接评估卵巢功能,只能粗略了解卵巢功能好与坏,而AMH存在于滤泡颗粒层细胞中,通过检测数值即可得知卵子库存量。
女性的实际年龄并不完全等同于卵巢年龄,更不等于卵巢储备功能。
犬缪勒管抑制物质抗缪勒管激素(MISAMH)ELISA检测试剂盒

犬缪勒管抑制物质/抗缪勒管激素(MIS/AMH)ELISA检测试剂盒运输条件:2-8℃低温运输,用干冰或者冰袋低温运输。
待检样本:体液、血清、血浆、细胞培养上清液、尿液、组织匀浆、心房水标本等等。
ELISA试剂盒检测范围:犬缪勒管抑制物质人、绵羊、小鼠、大鼠、猪、兔、山羊、牛、马、猪、其它动物细胞因子、植物细胞因子、骨代谢、细胞凋亡、激素内分泌、活性多肽、肝纤维化、自身抗体、血栓与止血、肿瘤、自身抗体科研Elisa检测试剂盒。
ELISA试剂盒检测类型:双抗体夹心法测抗原、双抗原夹心法测抗体、间接法测抗体、竞争法测抗体、竞争法测抗原、捕获包被法测抗体、ABS-ELISA法。
犬缪勒管抑制物质/抗缪勒管激素(MIS/AMH)ELISA检测试剂盒每次实验的标准曲线一般设7个不同浓度,加上空白孔,标准曲线一共需要8个孔。
因此,一个48T试剂盒最多可以测定40个样本(不做重复且一次用完),一个96T试剂盒最多可以测定88个样本(不做重复且一次用完)。
可以根据实际样本数量和实验计划选择合适的产品规格。
操作注意事项:1.实验中不用的板条应立即放回包装袋中,密封保存,以免变质。
2.试剂应按标签说明书储存,使用前恢复到室温。
稀稀过后的标准品应丢弃,不可保存。
3.使用一次性的吸头以免交叉污染,吸取终止液和底物A、B液时,避免使用带金属部分的加样器。
4.不用的其它试剂应包装好或盖好。
不同批号的试剂不要混用。
保质前使用。
5.洗涤酶标板时应充分拍干,不要将吸水纸直接放入酶标反应孔中吸水。
6.使用干净的塑料容器配置洗涤液。
使用前充分混匀试剂盒里的各种成份及样品。
7.加入试剂的顺序应一致,以保证所有反应板孔温育的时间一样。
8.按照说明书中标明的时间、加液的量及顺序进行温育操作。
9.底物A应挥发,避免长时间打开盖子。
底物B对光敏感,避免长时间暴露于光下。
避免用手接触,有毒。
实验完成后应立即读取OD值。
犬缪勒管抑制物质/抗缪勒管激素(MIS/AMH)ELISA检测试剂盒elisa 服务,1、吸附均匀,吸附性好,空白值低,孔底透明度高2、重复性高,可靠性强3、购买ELISA试剂盒,免费代测4、Elisa试剂盒技术服务要求:专业,规范,高效犬缪勒管抑制物质/抗缪勒管激素(MIS/AMH)ELISA检测试剂盒注意事项1.试剂盒从冷藏环境中取出应在室温平衡15-30分钟后方可使用,酶标包被板开封后如未用完,板条应装入密封袋中保存。
抗缪勒氏管激素测定试剂盒(化学发光免疫分析法)产品技术要求万孚

1性能指标
1.1外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;校准品和质控品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
1.2准确度
将具有溯源性的两个浓度准确度参考品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
1.3空白限
不大于0.007ng/mL。
1.4线性
试剂盒在0.01ng/mL~23ng/mL 区间内,其相关系数(r)的绝对值不低于0.9900。
1.5重复性
变异系数CV≤8%。
1.6批间差
变异系数CV≤10%。
1.7校准品
1.7.1校准品准确度
测定校准品,C1,C2 测定结果的相对偏差在±10%范围内。
1.7.2校准品瓶内均一性
校准品C1,C2 瓶内均一性≤8%。
1.7.3校准品瓶间均一性
校准品C1,C2 瓶间均一性≤5%。
1.8质控品
1.8.1瓶内均一性
变异系数CV≤8.0%。
1.8.2瓶间均一性
变异系数CV≤5.0%。
1.8.3靶值及靶值范围
每批质控品均应提供本批产品的靶值单,并应提供赋值方法程序文件。
质控品的测试值应在靶值范围内。
抗缪勒管激素测定试剂注册审查指导原则

抗缪勒管激素测定试剂注册审查指导原则在进行抗缪勒管激素测定试剂的注册审查时,应遵循以下原则:1.试剂的合规性:试剂应符合国家和国际法规和标准,包括质量管理系统、生产工艺、产品质量控制等方面。
试剂的生产商需要提供相关的文件和证明材料,以验证试剂的合规性。
2.试剂的稳定性:试剂的稳定性是保证测定结果准确可靠的前提。
试剂应在规定的存储条件下稳定,并且在有效期内保持一致的性能。
生产商需要提供相关的稳定性数据和验证报告。
3.抗体的选择和验证:抗缪勒管激素测定试剂的关键是抗体的选择和验证。
抗体应具有高度的特异性和敏感性,以确保准确测定AMH水平。
生产商需要提供抗体的详细信息和验证数据。
4.校准和质控:试剂的校准和质控是保证测定结果准确度和可比性的关键。
试剂需要提供相应的校准品和质控品,并且校准和质控的方法和程序应符合国家和国际标准。
5.分析系统和方法:试剂的注册审查还需要考虑到使用该试剂的分析系统和方法。
分析系统应具有可靠性和稳定性,并且需要进行验证和验证试验。
生产商需要提供关于分析系统和方法的详细说明和验证数据。
6.临床试验和评估:注册审查还需要考虑试剂的临床试验和评估结果。
试剂需要经过临床试验验证其效能和可靠性,包括与现有试剂的对比试验和临床样本的测试。
生产商需要提供相关的临床试验和评估结果。
7.注册申请文件:申请人需要提供完整的注册申请文件,包括试剂的详细说明、性能验证数据、稳定性数据、校准和质控方法、分析系统和方法等。
注册机构将根据提供的文件进行审查和评估。
综上所述,抗缪勒管激素测定试剂的注册审查是确保该试剂质量可靠、性能稳定和临床应用可靠的重要环节。
在注册审查中需要关注试剂的合规性、稳定性、抗体选择和验证、校准和质控、分析系统和方法、临床试验和评估等方面的要求。
只有通过注册审查,才能确保抗缪勒管激素测定试剂的质量和可靠性。
抗缪勒氏管激素(AMH)测定试剂盒(荧光免疫层析法)产品技术要求宝创

抗缪勒氏管激素(AMH)测定试剂盒
(荧光免疫层析法)性能指标
1外观检查
试剂盒应外观整洁平整,各组分齐全、完整,包装标签应清晰、准确、牢固。
试纸条表面应平整、无划伤、无开裂、无变形、无异味及污迹,各材料附着牢固、内容齐全。
检测卡外壳应平整,上下盖应均匀合拢,无明显间隙,试纸条在壳内应附着牢固。
2物理检查
2.1试纸条宽度
试纸条宽度应在3.9mm~4.1mm之间。
2.2液体移行速度
液体移行速度应≥10mm/min。
3精密度
3.1批内精密度
批内变异系数(CV)应≤15%。
3.2批间精密度
批间变异系数(CV)应≤15%。
4准确度
用企业准确度参考品进行检测,检测结果与标示浓度的相对偏差(B)应在±15%范围内。
5最低检出限
最低检出限≤0.1ng/ml。
6线性范围
在0.1ng/ml~18ng/ml区间内,线性相关系数(r)≥0.9900。
1。
抗缪勒氏管激素(AMH)质控品产品技术要求博粹

抗缪勒氏管激素(AMH)质控
品、
1.包装规格
2.性能指标
2.1外观和性状
2.1.1颜色性状
质控品应为粉末,无杂质,无潮解现象。
复融液应为澄清无色液体,无颗粒沉淀或絮状不溶性杂质。
2.1.2包装
质控品和复融液分装瓶应为棕色玻璃瓶,盖含橡胶软塞和塑料外盖;盒贴、瓶贴、标签标识、说明书清晰牢固;橡胶软塞、塑料外盖与塑料瓶身配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2装量
复融液容量应不少于标示装量值。
2.3均一性
2.3.1瓶内均一性
质控品QC1-QC3 以变异系数CV 为指标,满足CV≤10%。
2.3.2瓶间均一性
质控品QC1-QC3 以变异系数CV 为指标,满足CV≤10%。
2.4预期结果
检测结果均应在质控品可接受区间值内。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗缪勒氏管激素(AMH)质控
品、
1.包装规格
2.性能指标
2.1外观和性状
2.1.1颜色性状
质控品应为粉末,无杂质,无潮解现象。
复融液应为澄清无色液体,无颗粒沉淀或絮状不溶性杂质。
2.1.2包装
质控品和复融液分装瓶应为棕色玻璃瓶,盖含橡胶软塞和塑料外盖;盒贴、瓶贴、标签标识、说明书清晰牢固;橡胶软塞、塑料外盖与塑料瓶身配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
2.2装量
复融液容量应不少于标示装量值。
2.3均一性
2.3.1瓶内均一性
质控品QC1-QC3 以变异系数CV 为指标,满足CV≤10%。
2.3.2瓶间均一性
质控品QC1-QC3 以变异系数CV 为指标,满足CV≤10%。
2.4预期结果
检测结果均应在质控品可接受区间值内。
