九年级下册沪教版上海化学5.2酸和碱的性质研究 课件(共20张PPT)
沪教版化学九下5.2《酸和碱的性质研究》ppt课件
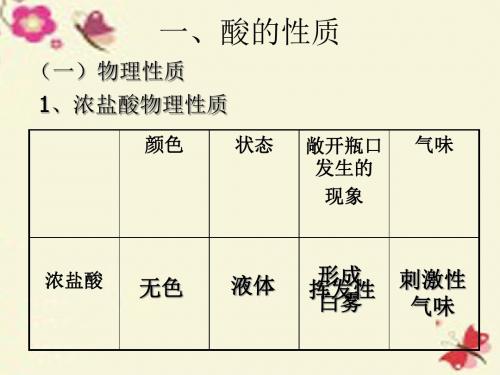
(一)物理性质 1、浓盐酸物理性质
颜色 状态 敞开瓶口 发生的 现象 气味
浓盐酸
无色
液体
形成 挥发性 白雾
刺激性 气味
• 工业用浓盐酸以含有少量杂质而略显黄色。 浓盐酸有强烈的腐蚀性。
2、浓硫酸的物理性质
颜色 状态 敞开瓶口 发生的 现象 气味
浓硫酸
无色
粘稠 无现象 油状 不易挥发 液体
高温
小结:NaOH溶液、Ca(OH)2溶液的化学性质 • 1、NaOH溶液、Ca(OH)2溶液与酸碱指示 剂反应 • 2、 NaOH溶液、Ca(OH)2溶液和酸反应, 生成盐和水 • 3、 NaOH溶液、Ca(OH)2溶液与非金属氧 化物反应 4、 NaOH溶液、Ca(OH)2溶液与盐溶液反应
多识一点
4、稀盐酸和金属氧化物的反应 实验探究:用盐酸除铁锈(铁锈主要成分Fe2O3) Fe2O3+6 HCl===2FeCl3 + 3H2O 黄色溶液 因此:工业上可用盐酸除铁锈
练一练: 1、将生锈的铁钉加入稀盐酸中,现象 ,出下列反应的化学方程式 (1)氧化铜和稀盐酸 (2)氧化铝和稀盐酸
4、与碱发生中和反应
写出氢氧化钠、氢氧化铜与稀硫酸反应的化 学方程式 5、与某些盐反应 写出碳酸钠与稀硫酸反应的化学方程式 写出硝酸钡与稀硫酸反应的化学方程式 硫酸根(SO42-)的检验:向待测液中加入硝酸钡 溶液,如果生成不溶于稀硝酸的白色沉淀, 说明待测液中含SO42- 。
(四)酸的通性
• • • • • 1、与酸碱指示剂反应 2、与活泼金属反应,生成 盐 和 氢气 3、与金属氧化物反应,生成 盐 和 水 4、与碱反应,生成 盐 和 水 5、与某些盐反应,生成 新酸 和 新盐
常见的酸和碱(PPT)-九年级化学沪教版下册

无现象 答案:B
硫酸、稀盐酸中 快速产生大量 产生大量气泡, 【答案】B
气泡,放热 放热
与稀盐酸反应
与稀硫酸反应
镁 Mg + 2HCl = MgCl2 + H2↑ Mg + H2SO4 = MgSO4 + H2↑
用小木棍蘸 少量浓硫酸
将浓硫酸滴到 一小块布上
字变黑
浓硫酸能使由碳、
氢、氧等元素组
蘸浓硫酸的
成的化合物中的
部位变黑
氢、氧元素以H2O 的形式脱下 , 生
滴浓硫酸的部位变 成黑色的炭和水。
黑,形成小黑洞。
【交流讨论】
1、某同学准备用pH试纸测定浓硫酸的酸碱度,你 觉得是否可行?请预测可能出现的现象。
HCl 37% 无色 刺激性气味 液体
(大于水)
瓶口有白雾
强挥发性
【交流讨论】
1、请解释打开浓盐酸瓶塞,瓶口有白雾出现的原因。
浓盐酸具有强烈的挥发性,挥发出来的氯化氢 气体遇到空气中的水蒸气,形成盐酸小液滴, 从而产生白雾现象。
2、浓盐酸、浓硫酸口在空气中放置一段时间, 溶质、溶液、溶剂的质量怎么变?浓度怎么变?
溶液呈蓝色),同时得到白色沉淀,说明可能是CaCO3或BaCl2和Na2SO4反应生成的BaSO4沉淀,在滤出的白色沉淀中加入足量的
①摇动试剂瓶观察:呈黏稠状的是浓硫酸; 盐酸,沉淀全部溶解,并产生无色气体,说明是CaCO3,而不是BaSO4,A、原白色粉末的组成有5组可能,1、CaCO3、BaCl2;
锌 Zn + 2HCl = ZnCl2 + H2↑ Zn + H2SO4 = ZnSO4 + H2↑
沪教化学下册第7章基础实验8 酸、碱的化学性质(共24张PPT)

回到家,小雅有些饿了,她拿出了刚 刚买来的小零食。里面有一包干燥剂, 会不会是氢氧化钠呢?她看了看成 分——生石灰,且要求勿吞食、勿浸 水……
干燥剂里有“玄机” 二
现象:生石灰部分溶解,触摸 小烧杯感觉烫手
小雅将干燥剂打 开,把生石灰小 心地放在小烧杯 中,逐渐加入少 量水,当加入的 水不能被消耗时
1、与酸碱指示剂的作用
实验记录
滴加紫色石蕊溶液
滴加无色酚酞溶液
氢氧化钠溶液
由紫色变为蓝色
由无色变为红色
氢氧化钙溶液
由紫色变为蓝色
由无色变为红色
碱的化学性质
Ca(OH)2与CO2的反应 回忆:二氧化碳使澄清石灰水变浑浊 Ca(OH)2+CO2==CaCO3↓+H2O
氢氧化钙能与空气中的二氧化碳反应,生成坚硬的碳 酸钙。将氢氧化钙、粘土和沙子混凝,用来做建筑材料,
向硫酸铜溶液
中滴加氢氧化 有蓝色沉淀生
钙溶液 成
CuSO4+Ca(OH)2=CaSO4+Cu(OH)2
底 刨
问 根
为什么碱具有相似的化学性质?
OH-
碱在生活中的应用
两种常见的碱
NaOH的物理性质及用途,Ca(OH)2用途及工业制法
总结
碱的化学性质
回顾:1、碱与酸碱指示剂的反应 2、 Ca(OH)2与CO2的反应
实验1 观察固体烧碱的颜色、状态。在表 面皿中放一些固体烧碱,露置在空气中一段时间, 观察它发生什么变化?
实验2 在试管中加一些氢氧化钠,加入水, 震荡,观察它的溶解过程,并摸一摸试管,感觉 溶液温度的变化。
常见的碱
1. 氢氧化钠(NaOH)
实验
现象
分析
沪教版九年级下册 第七章 第2节 常见的酸和碱——酸的化学性质(课件)(共42张PPT)

(2)图中①的现象是__石__蕊__溶__液__变__红__。 (3) 写 出 一 个 符 合 图 中 ③ 的 化 学 方 程 式 :
_A__g_N_O__3=__=_=_A_g_C__l↓_+__H__N_O__3(_合__理__即__可__)__________。 (4)图中性质④属于___中__和___ (填反应类型)反应。 (5)图中⑤的性质在工业上可用于__除__铁__锈__(填用途)。
【答案】A
10.[中考·自贡]归纳总结是学习化学的一种方法,请结合 小明同学对碱的四点化学性质的归纳图完成下列问题 (箭头上方的物质是指与碱反应的物质)。
(1)碱溶液能使无色酚酞溶液变________。 (2) 氢 氧 化 钠 暴 露 在 空 气 中 变 质 的 化 学 方 程 式 为
______________________________,所以氢氧化钠必 须________保存。 (3) 请 帮 小 明 补 充 完 整 性 质 3 箭 头 上 方 的 反 应 物 是 ________(填“酸”“碱”或“盐”)。 (4)碱溶液具有相似的化学性质,是因为碱溶液中都含有 ________(填化学符号)。
2.[中考·深圳]小明同学归纳总结了初中所学稀硫酸的化
学性质,并用“H2SO4+X→盐+Y”这种表达式进行 整理,下列小明的观点中错误的是( )
选项 X 的物质类别
观点描述
A
金属
若 X 为 Cu,则反应能够发生
B 金属氧化物 若 X 为 MgO,则 Y 为 H2O
C
碱
若 X 为 NaOH,则盐为 Na2SO4
(2)图中①的现象是______________。 (3) 写 出 一 个 符 合 图 中 ③ 的 化 学 方 程 式 :
《酸、碱的化学性质》酸和碱PPT课件

课堂小结
❖ 今天我们通过实验进一步探究了酸和碱的主要性 质,同学们课后要好好归纳总结,加强对酸碱性 质等知识的认识。
板书设计
实验活动6 酸、碱的化学性质 1.结论:石蕊溶液遇酸溶液变成红色,遇碱溶液变成蓝色; 酚酞溶液遇酸溶液不变色,遇碱溶液变红。 2.原理:Fe2O3+6HCl=2FeCl3+3H2O;
反 应
实验现象
步骤1中试管中出现白色浑浊液体 步骤2中白色浑浊液体变为红色 步骤3中试管中仍然是红色浑浊液体
步骤4中红色浑浊液体变为无色澄清的溶液
实验结论 氢氧化钙能和稀盐酸发生中和反应,不需要加指示剂 也可以判断反应是否发生
思考:
通过实验五:可以验证氢氧化 钙的那些性质
练习与实践
❖
某硫酸厂排出的废水中含有硫
实验结论:
酸性溶液使紫色石蕊溶液变红色,不能 使无色酚酞溶液变色,碱溶液能使紫色
石蕊变蓝,使无色酚酞变红色
铁 实验步骤:
锈 、
1、取两只生盐酸,观察现象。当观察到铁钉表面
钉 的锈去掉,铁钉变得光亮时,将其中一支试管中
和 稀 盐
的铁钉取出,洗净。 2、继续观察另一支试管中的现象,过一段时间将铁
氧
化 实验原理
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
钙
和 稀 盐
实验步骤
1、向两支试管中和各加入相同量的氢氧化钙粉末, 然后加入1mL水,振荡
2、向上述两支试管各滴入1~2滴酚酞,观察现象
3、继续向其中一只试管中加入约1mL水,振荡
酸
4、向另一支试管加入约1mL稀盐酸,振荡、
的
1、在试管中加入约1mL氢氧化钠溶液,然后滴几滴酚酞 2、向上述试管中边用滴管慢慢滴入稀盐酸,不断振荡试管, 直至溶液颜色变为无色为止。 3、取上述无色溶液约1mL置于蒸发皿中加热,使液体蒸干,观察现象。
沪教版九下化学 7基础实验8 酸与碱的化学性质 课件 (共25张PPT)

①
②②
稀酸溶液
①
②
稀碱溶液
任务一、酸液的探究
①
②
稀酸溶液
①取加有镁条,锌粒,铜片的六孔井穴板,
②用滴管向(1、2、3)号空穴中加入适量稀酸1, 用滴管向(4、5、6)号空穴中加入适量稀酸2; (滴数相同)
③观察并记录实验现象。
加入稀酸1:
加入稀酸2:
①镁表面 (迅速、较快)产生 , ①镁表面 (迅速、较快)产生 ,
②锌表面 (迅速、较快)产生 , ②锌表面 (迅速、较快)产生 ,
③铜表面________________。
③铜表面_______________。
加入稀酸1:
加入稀酸2:
①镁表面 迅速 产生 气泡 , …… ②锌表面 较快 产生 气泡 , …… ③铜表面__无明显现象__。
①镁表面 迅速 产生 气泡 ,…… ②锌表面 较快 产生 气泡 ,…… ③铜表面__无明显现象__。
异常现象: 产生气泡 。
加入稀酸2:
①铁锈 逐渐溶解消失 , ②溶液逐渐变为 黄 色。
异常现象: 产生气泡 。
稀酸1
稀酸2
碳酸钠粉末
①取编号(3、4)盛有碳酸钠粉末的 试管,
②向3号试管内缓慢加入适量稀酸1, 向4号试管内缓慢加入适量稀酸2,
③观察并记录实验现象。
加入稀酸1:
①固体:迅速溶解消失 , ② 迅速 产生 气泡 。
稀碱溶液
③取两支编号为(1、2)试管, 用镊子向试管中各加入2根 生锈铁丝;
④取两支编号为(3、4)试管, 用药匙柄端向试管中各加入 碳酸钠粉末;(取样2次!)
⑤取编号为(5、6)试管,分别倾 倒入约2ml稀碱1和稀碱2溶液。
1.比较常见酸的化学性质,认识其特征; 2.认识常见碱的一些化学性质; 3.通过探究,认识酸碱中和反应。
5.2 碱的性质的研究 沪教版(上海)九年级第二学期化学课件(共13张PPT)

产生白色沉淀 N_a_2_C__O_3_+__C_a_(_O_H__)_2=__=_=_C__a_C_O__3↓_+__2_N__a_O_H__
方法三:加盐,如 氯化
钙(或氯化钡)溶液
_产__生__白__色__沉__淀__ _N_a_2_C__O_3_+__C_a_C__l2_=_=_=__C_a_C__O_3_↓_+__2_N_a_C__l___
No
5.2 碱的性质的研究
(2)实验设计:检验是否含有碳酸钠
方法(试剂选择)
现象
方法一:加酸,如 _稀__盐__酸___
产生气泡
化学方程式 _N_a_2_C_O__3_+__2_H_C__l=_=_=__2_N_a_C__l+__C__O_2_↑__+__H__2O_
方法二:加碱,如 __氢__氧__化__钙__溶__液____
No
5.2 碱的性质的研究
1.对一瓶已变质的NaOH溶液进行如下实验,其中实验方案能达到实验目的的是( C
)
选项
实验目的
实验方案
A
证明溶液中存在Na2CO3
取样,滴加无色酚酞溶液
B
除去溶液中的Na2CO3 加入一定量的CaCl2溶液,然后过滤
C
证明溶液部分变质
取样,加入过量呈中性的BaCl2溶液 ,振荡后滴加无色酚酞溶 通入 CO2
方法二
③向①中滴加无 色酚 酞溶液
实验现象
有___白__色__沉__淀____生成 无明显现象
___溶__液__变__红____ 溶液不变色
结论
部分变质 全部变质 部分变质 全部变质
3.装有氢氧化钙溶液的试剂瓶瓶口有白色物质,能否由此判断氢氧化钙已变质, 理由是_不__能__,__氢__氧__化__钙__属__于__微__溶__物__,__该__白__色__固__体__可__能__是__析__出__的__氢__氧__化__钙__固__体__。
2020-2021学年九年级化学沪教课标版下册第七章第2节 常见的酸和碱 --酸的性质 课件

碱的共同性质:
(1)与酸碱指示剂作用 A.紫色石蕊试剂或红色石蕊试纸遇到碱溶液变蓝; B.无色酚酞遇到碱溶液变红
(2)与某些非金属氧化物反应 碱溶液 + 非金属氧化物 → 盐 + 水
(3)能与某些盐反应 碱溶液 + 盐溶液 → 新盐 + 新碱
1、(08烟台)下列物质长时间露置于空 气中,质量会减轻的是(不考虑水分蒸发) ()
,为除去铁钉上的
锈迹,小强将带锈迹的铁钉放入过量的盐酸中,他
首先观察到锈
,溶液由
色逐渐变
成
色,这是因为(用化学方程式表
示)
,不一会,又观察到
的
现象。这是因为(用化学方程式表示)
。
(强化巩固难点)
作业:
必做题:课本第50页第1.2.9题 拓展题:化学探究与训练第32页第12题
你已经知道哪些碱?了解它们的性 质吗?它们在生产、生活中有哪些应 用?
A.浓盐酸 B.浓硫酸 C.石灰水 D.固体氢氧化钠
2、(07南昌)下列属于复分解反应的是 ( )
AB..CFeaC+OC3u=S高=O温=4
=== CaO
FeSO4 + + CO2↑
Cu
C.H2SO4 D.CH4 +
+
2NaOH 点燃
===
Na2SO4
2O2 === CO2 + 2H2O
+
2H2O
镁条
金属
锌粒
铜片
金属氧化 物
碳酸盐
铁锈 石灰石 碳酸钠
稀盐酸
稀硫酸
(一)酸与金属的反应
1、镁、锌、铜三种金属中哪些能置换出酸中的 氢?哪些不能?能置换出酸中氢的金属,反应的剧 烈程度有什么差异?写出反应的化学方程式。在相 同条件下,金属与酸发生置换反应越剧烈,金属单 质的活动性越强。镁、锌、铜三种金属单质的活动 性由强到弱应怎样排列?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级下册沪教版上海化学5.2酸和碱的性质研究课件(共20张PPT)
(共20张PPT)
九年级沪教版(上海)化学
5.2酸和碱的性质研究
教学目标
理解酸和碱性质
1
2
理解酸性氧化物和碱性氧化物
掌握酸和碱的应用
3
知识点
酸的性质
1
2
碱的性质
酸和碱的应用
3
酸的性质
01
酸的性质研究
1.水对酸的化学反应的影响
酸的很多反应通常要在水溶液中才能完成。
2.浓盐酸与浓硫酸的物理性质
(1)浓盐酸的物理性质:浓盐酸(通常市售浓盐酸中溶质质量分数约为36%)是无色透明的液体,有刺激性气味,具有挥发性而产生白雾现象。
(2)浓硫酸的物理性质:纯净的硫酸是无色、粘稠、油状的液体,不容易挥发,易溶于水并放出大量的热。
浓硫酸中溶质的质量分数约为98%。
浓硫酸与稀硫酸
稀硫酸浓硫酸
物理性质密度小密度大
无吸水性有吸水性,能用作干燥剂
化学性质无脱水性有脱水性,能使许多有机物炭化
跟氢(H)前面的金属(如Zn)反应产生H2 跟金属反应不产生H2
浓盐酸与稀盐酸
(1)浓盐酸十分易挥发,从浓盐酸中挥发出来的氯化氢气体跟空气里的水蒸气接触,形成盐酸的小液滴而产生白雾,用此方法可以鉴别浓盐酸、稀盐酸。
(2)挥发性对浓盐酸的影响:浓盐酸露置在空气中一段时间以后,溶质的质量减少,溶液的质量也减少,所以溶液的浓度下降。
(1)吸水性对浓硫酸的影响:浓硫酸露置在空气中一段时间以后,溶剂的质量增加,溶液的质量增加,所以浓度下降。
(2)稀释浓硫酸时一定要将浓硫酸沿着容器壁慢慢注入水中,并不断搅动,使产生的热量迅速扩散。
酸的化学性质
酸的通性
①酸溶液的pH小于7,它能使紫色石蕊变红色,无色酚酞不变色。
②酸+ 活泼金属→ 盐+ H2↑
(2)酸与碳酸盐反应
(3)酸与碱发生中和反应
HCl + NaOH → NaCl + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
(4)酸与金属氧化物反应
稀盐酸或稀硫酸跟铁锈(主要成分是Fe2O3)反应,生成可溶性的氯化铁或硫酸铁和水。
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
黑色的氧化铜跟稀盐酸或稀硫酸反应,生成了蓝色的可溶性的氯化铜或硫酸铜和水。
CuO + 2HCl → CuCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
碱的性质
02
碱的性质
常见碱的物理性质
NaOH Ca(OH)2 Cu(OH)2 Fe(OH)3
白色固体,极易溶于水,溶解时放热,有吸水性,易潮解,有强烈的腐蚀性。
白色粉末固体,微溶,溶解度随温度升高而减小,有强烈的腐蚀性。
蓝色粉末固体,难溶于水。
红褐色同体,不溶于水。
碱溶液的化学性质
(1)碱溶液能使指示剂变色
碱溶液使紫色石蕊溶液变蓝,使无色酚酞溶液变红色。
(2)与非金属氧化物反应
2NaOH + CO2 → Na2CO3 + H2O (NaOH应密封保存)
2NaOH + SO2 → Na2SO3 + H2O
(3)与酸发生中和反应
2NaOH + H2SO4 → Na2SO3 + 2H2O
(4)与某些盐反应
FeCl3 + 3NaOH → Fe(OH)3↓+ 3NaCl(NaOH常用于制不溶性碱)
酸性碱性氧化物
像二氧化碳、二氧化硫等能跟碱溶液反应生成盐和水的氧化物叫做酸性氧化物。
非金属氧化物大多是酸性氧化物。
碱性氧化物
像氧化铁、氧化铜,能跟酸反应生成盐和水的氧化物叫做碱性氧化物。
大多数金属氧化物是碱性氧化物。
酸和碱的应用
03
酸和碱的应用
盐酸的用途
盐酸在化学工业上大量用来制造人造橡胶、染料、塑料、药剂、氯化物(如氯化钡、氯化锌)等。
此外,在焊接和电镀作业时,常用盐酸来清除金属表面的氧化物;在食品工业上,常用盐酸作制造葡萄糖的催化剂等。
2.硫酸的用途
重要的化工原料。
用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等,在实验室中还可作干燥剂。
3.氢氧化钠的用途
氢氧化钠,俗名烧碱、火碱、苛性钠,是非常重要的工业原料,用来制造化肥、人造棉、精炼石油与制造各种化工产品。
工业上,用电解饱和食盐水的方法来生产烧碱。
4.氢氧化钙的用途
建筑、制三合土、抹墙,改良酸性土壤、配制农药波尔多液,工业上用来制NaOH等。
1、下列说法中正确的是( C )
(A)打开浓盐酸的瓶盖可看到白色的烟雾
(B)敞口在空气中的浓盐酸和浓硫酸质量都会增加
(C)浓硫酸可作某些气体的干燥剂
(D)柠檬酸晶体和它的水溶液都能使紫色的石蕊试纸变红
2、在实验室常用浓硫酸作某些气体的干燥剂,这是利用浓硫酸的( B )
(A)酸性(B)吸水牲(C)脱水性(D)氧化性
3、食醋是醋酸的稀溶液。
某同学准备在家中做实验验证食醋有酸的通性.他找来了下列物质,其中不能达到目的的是( A )
(A)铜丝(B)大理石(C)铁钉(D)铁锈
4、下列物质久置于敞口容器中,发生变质的是(D )
(A)浓盐酸(B)浓硫酸
(C)食盐水(D)氢氧化钠溶液
浓盐酸具有挥发性,使溶质质量分数减小,但没有新物质生成,不会变质;浓硫酸具有吸水性,是物理性质;食盐水蒸发溶剂,也不会生成其他物质;NaOH溶液吸收空气中的CO2气体,生成Na2CO3而变质。
5、氢氧化钠是非常重要的工业原料,具有广泛的用途。
下列不属于氢氧化钠用途的是( C )
(A)精炼石油(B)制造人造棉
(C)中和胃酸过多(D)制肥皂。
