【资料】酶与蛋白质工程-第4章-基因表达与蛋白质分离纯化汇编
酶工程与蛋白质工程

酶工程与蛋白质工程酶工程与蛋白质工程是现代生物技术的重要领域,它们以分子水平为基础,通过基因工程技术来改造酶和蛋白质。
酶工程主要研究酶的结构与功能关系以及酶催化反应机理,以此来优化酶的性质和功能;而蛋白质工程则致力于蛋白质的高表达、纯化和改造,进而实现分子水平的控制和利用。
两者交叉融合,共同应用于工业、医药、环保和食品等各个领域,促进了生物技术的发展和推广。
一、酶工程简介酶是一种生物催化剂,具有极高的选择性和催化效率。
酶工程旨在通过对酶的分子结构和催化机理的研究,优化酶的性质和功能,使其在特定条件下能够更高效地催化反应。
比如,通过改变酶的氨基酸序列,可以实现酶催化活性和稳定性的提高。
再比如,通过引入新的催化中心或变异剂,可以改变酶的底物特异性和反应特性。
这些优化方法可以显著提高酶的效率和选择性,为实现工业生产和科学研究提供了有效手段。
酶工程的具体步骤如下:1. 酶的筛选和分离。
这个步骤是酶工程的基础,通常需要从自然界中分离出能够催化特定反应的酶。
现代酶工程技术一般采用高通量筛选法,通过分子筛、高速离心、色谱法等方法来分离出酶的纯品。
2. 酶的分子结构分析。
这个步骤是为了了解酶的分子结构和功能关系,找到优化方案的基础。
目前,常用的酶的分析方法有X射线晶体学和核磁共振法。
3. 酶的基因工程改造。
通过基因工程技术,改变酶的氨基酸序列和三维结构,使其获得更高的活性和稳定性。
常用的方法有扩展、交换和修饰等方法。
4. 酶的活性和特性检测。
通过活性酶测定、底物特异性、pH和温度对酶催化反应的影响等方法来检测酶的改造效果。
5. 酶的产量提高。
通过使用表达载体、调节生产菌株的生长条件等方法,使酶的产量达到最高。
二、蛋白质工程简介蛋白质工程是将目标蛋白基因从生物体内放大、纯化、定位和表达,以达到高效率和高纯度的目的。
主要应用于药物研发、工业化生产、分子诊断和分子工业等领域,对于制造可溶性蛋白、表达蛋白、纯化蛋白和修饰蛋白等方面都发挥着重要作用。
酶的分离纯化资料PPT课件

胞外酶:过滤、离心等方法出去菌体
孙利20芹20年209月1238日制作
9
◆细胞抽提液的制备
酶的提取是指在一定条件下,用适当的溶剂处理细胞 破碎后的含酶原料,使酶充分地溶解到提取液中的过 程。
通过降低溶液的介电常数,增强偶极离子间的静电吸引,从 而使分子聚集沉淀。此外,有机溶剂本身如酒精、甲醇、丙酮等, 对水的亲和力很大,能破坏蛋白质颗粒的水化膜,在等电点时使 蛋白质沉淀。在常温下,有机溶剂沉淀蛋白质往往引起变性
选择原则:
①必须与水混溶 ②不与pr反应 ③较好的沉淀效应 ④溶剂蒸汽无毒,
15
盐析法
向蛋白质水溶液中加入中性盐,可以产生两种影响:盐溶现 象和盐析现象
盐析方程:
lg0= β
Ks:盐析效率,是蛋 白质和盐种类的 特征常数。在一 定pH和温度条 件下,利用不同 蛋白质的Ks不同
β分段盐析:S0随pH和温度的变化而变化,在一定的I值下通过改变
§1.6酶的分离纯化
2013春
提纲
蛋白质纯化的一般考虑 蛋白质的粗分离 蛋白质的大规模分离纯化
孙利20芹20年209月1238日制作
2
一、蛋白质纯化的一般考虑
※从量上考虑
为测序或克隆的目的,只需几微克; 为工业或医药的用途,则可达几千克
※从纯化的标准
为临床治疗所需,纯度应达到98%或99%以上; 用于其它一般用途,要求低
高度纯化
孙利20芹20年209月1238日制作
成品加工
5
二、蛋白质的粗分离
材料的选择和细胞抽提液的制备 蛋白质的浓缩和脱盐 沉淀法分级蛋白
第四章 蛋白类酶的分离纯化 PPT课件

2、离心分离
离心分离是借助于离心机旋转所产生的离心 力,使不同大小、不同密度的物质分离的技术过 程。 在离心分离时,要根据欲分离物质以及杂质 的颗粒大小、密度和特性的不同,选择适当的离 心机、离心方法和离心条件。 常速离心机又称为低速离心机, 其最大转速 在8000 r/min以内,相对离心力(RCF)在1×104 g 以下,在酶的分离纯化过程中,主要用于细胞、 细胞碎片和培养基残渣等固形物的分离。也用于 酶的结晶等较大颗粒的分离。
亲和层析
层析聚焦
吸附层析
吸附层析是利用吸附剂对不同物质的吸附 力不同而使混合物中各组分分离的方法
吸附层析通常采用柱型装置,将吸附剂装在吸 附柱中,装置成吸附层析柱。
等电点沉淀法
有机溶剂沉淀法
复合沉淀法 选择性变性沉淀 法
在盐浓度达到某 一界限后,酶的 溶解度随盐浓度 升高而降低,这 称为盐析现象。 盐析的主要原理 在于高浓度盐离 子与蛋白质争夺 水化水,破坏蛋 白质分子表面的 水化膜,同时由 于反离子作用, 也影响蛋白质分 子所带电荷
在一定的温度和pH值条件下(β 为常数),通过 改变离子强度使不同的酶或蛋白质分离的方法称 为Ks分段盐析;
PH8~12的水溶液 可与水混溶的有 机溶剂
大多数蛋白类酶都溶于水,而且在低浓度的盐存 在的条件下,酶的溶解度随盐浓度的升高而增加, 这称为盐溶现象。
3.4 酶的分离方法
1、沉淀分离 2、离心分离 3、过滤与膜分离 4、层析分离 5、电泳分离
6、萃取分离
1、沉淀分离
沉淀分离是通过改变某些条件或添加某种物质,使酶的溶解度 降低,而从溶液中沉淀析出,与其它溶质分离的技术过程。
提高温度,降低溶液粘度、增加扩散面积、縮短 扩散距离,增大浓度差等都有利于提高酶分子的 扩散速度,从而增大提取效果。
蛋白质和酶的分离与纯化

蛋白质和酶的分离纯化及鉴定蛋白质是生命体中的重要物质基础之一。
从分子水平上认识生命现象,已成为现代生物学发展的主要方向。
要研究蛋白质,首先要得到高度纯化的目的蛋白。
蛋白质在组织或细胞中一般都是以复杂的混合物形式存在,每种类型的细胞都含有上千种不同的蛋白质。
要想从成千上万种蛋白质混合物中纯化出目的蛋白,就要根据蛋白质的理化性质不同设计出合理的分离方法。
目前研究为止酶除核酶外本质都是蛋白质,因此酶的分离纯化方法基本是采用蛋白质的分离纯化方法,但是酶的活性受到多种因素的影响,因此酶的分离纯化比一般的蛋白质要求更高。
一、质分离纯化的一般原则1. 原料的选择原则:来源方便,成本低,易操作、安全的原料。
蛋白分布:体液、组织、细胞定位2. 破碎方法:(1) 机械方法:通过机械运动产生的剪切力的作用,使细胞或组织破碎的方法。
如:捣碎法、研磨、匀桨法(2) 物理方法:通过温度、压力、声波等各种物理因素的作用,使组织细胞破碎的方法。
如:反复冻融、渗透压、超声破碎(3) 化学方法:通过各种化学试剂对细胞膜的作用,使细胞破碎的方法.如:甲苯、丙酮、氯仿和非离子型的表面活性剂(Triton和Tween)(4) 酶促法:溶菌酶、蜗牛酶等3. 目的蛋白或酶的特异、快速、精确的定性或定量方法4. 先粗后细,分级分离粗分:将得到的蛋白溶液先利用简单、快速、易处理的方法除去大部分杂蛋白。
如: 盐析、离心、有机溶剂沉淀等。
精制:利用蛋白质性质的差异,采用不同的方法,如:离子交换层析、分子筛、吸附层析、亲和层析、电泳、离心、结晶等方法进一步纯化。
5. 避免蛋白质的变性(pH、适合的温度和缓冲体系等)二、常用的蛋白质的分离纯化技术可以根据各种蛋白质的结构、理化性质不同设计分离方法。
(一)根据蛋白质的溶解度不同进行分离1. 蛋白质盐析蛋白质属于生物大分子之一,分子量从1万至100万之巨,其分子的直径可达1-100nm,为胶粒范围之内。
蛋白质的表面电荷和水化膜是其主要的稳定性因素。
蛋白质与酶的分离与纯化

蛋白质与酶的分离与纯化摘要本文主要介绍蛋白质与酶的分离与纯化方法,包括一些常用的技术和步骤。
首先介绍蛋白质和酶的定义和特性,然后探讨蛋白质与酶分离和纯化的重要性。
接着分析了三种常用的分离与纯化方法,包括盐析、层析和电泳。
最后总结了每种方法的特点和适用范围,并对未来的研究方向进行了展望。
1. 引言蛋白质和酶是生物体内最重要的分子之一,参与了生命体的许多重要生物学过程。
为了研究和了解蛋白质和酶的功能和结构,分离和纯化方法至关重要。
2. 蛋白质与酶的定义和特性蛋白质是由氨基酸残基组成的大分子化合物,具有多种功能,如催化反应、传递信号和提供结构支持等。
酶是一类特殊的蛋白质,能够催化生物体内的化学反应。
3. 蛋白质与酶分离和纯化的重要性蛋白质与酶的分离和纯化是研究其功能、结构和性质的基础。
只有纯化后的蛋白质和酶才能够进行进一步的研究和分析。
4. 盐析方法盐析是利用蛋白质和酶与盐的相互作用进行分离的方法。
通过控制溶液中的盐浓度,可以使蛋白质和酶从溶液中沉淀出来。
5. 层析方法层析是利用分离剂在固定的层析材料上进行分离的方法。
根据蛋白质和酶的性质和大小,可以选择不同类型的层析材料进行分离。
6. 电泳方法电泳是利用蛋白质和酶在电场中的迁移率差异进行分离的方法。
根据蛋白质和酶的电荷、大小和形状等特性,可以选择不同类型的电泳方法进行分离与纯化。
7. 方法比较与应用盐析、层析和电泳方法各有其优势和适用范围。
根据具体的实验目的和条件,可以选择合适的方法进行蛋白质与酶的分离与纯化。
8. 未来展望随着科学技术的不断发展,蛋白质与酶的分离与纯化方法也在不断改进和创新。
未来的研究方向包括开发更高效、更精确的方法和技术,以及应用新的纯化剂和材料等。
结论蛋白质与酶的分离与纯化是研究其结构和功能的基础,对于深入理解生物体内重要的生物学过程具有重要意义。
盐析、层析和电泳等方法可以有效地分离和纯化蛋白质与酶,并根据实验的需要选择合适的方法。
酶工程第4章酶的提取与分离纯化

3、盐析操作 硫酸铵的饱和度
(NH4)2SO4 的饱和度(%)=
饱和硫酸铵的体积 混合溶液总体积 ×100%
(2)加盐操作时,防止局部盐浓度过高,防止产生泡沫。
(3)pH值和温度:等电点附近,室温或低温操作。
(4)蛋白质浓度:样品液的蛋白质浓度一般控制在2.5~3.0% 为宜,太浓时应适当稀释,以减少杂蛋白共沉淀。 (5)脱盐:超滤、透析或层析。
(二)等电点沉淀 (isoelectric precipitation)
第四章 酶的提取与分离纯化
本章知识点:
(1)细胞的破碎、酶的抽提 ✓重点(2)酶的分离纯化:沉淀分离、离心分离、
膜过滤、层析分离、电泳分离 (3)酶液的浓缩、结晶、干燥、成型
一、生物下游加工技术
下游加工过程包括目标产物的提取、浓缩、纯化及成品化 等过程。 生物产物从原料(培养液或细胞)生产到产品的后处理技 术(分离纯化技术)的发展,使低成本、高收率地纯化目标 产物成为现实。
抽提
纯化
制剂
(二)酶分离纯化应注意以下问题 1、防止酶变性失活:热、pH、泡沫、重金属等。 2、选择有效的纯化方法。 3、酶活性测定应贯穿纯化过程的始终。
第一节 细胞破碎——只对胞内酶
许多酶存在于细胞内。为了提取这些 胞内酶,首先需要对细胞进行破碎处理。
➢细胞壁的主要成分:
细菌:肽聚糖:N-乙酰萄糖胺,N-乙酰 胞壁酸
1)超声波:通过剪切力和空穴作用 (30mg蛋白/ml, 30-60sec/次)
蛋白质的表达、分离、纯化和鉴定

实验一、蛋白质的表达、分离、纯化和鉴定第一部分蛋白质的表达、分离、纯化1、目的要求(1)了解克隆基因表达的方法和意义。
(2)了解重组蛋白亲和层析分离纯化的方法。
2、实验原理克隆基因在细胞中表达对理论研究和实验应用都具有重要的意义。
通过表达能探索和研究基因的功能以及基因表达调控的机理,同时克隆基因表达出所编码的蛋白质可供作结构与功能的研究。
大肠杆菌是目前应用最广泛的蛋白质表达系统,其表达外源基因产物的水平远高于其它基因表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的80%。
本实验中,携带有目标蛋白基因的质粒在大肠杆菌BL21中,在37℃,IPTG(异丙基-β-D-硫代半乳糖苷)诱导下,超量表达携带有6个连续组氨酸残基的重组氯霉素酰基转移酶蛋白,该蛋白可用一种通过共价偶连的次氨基三乙酸(NTA)使镍离子(Ni2+)固相化的层析介质加以提纯,实为金属熬合亲和层析(MCAC)。
蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。
3、试剂和器材一、试剂[1] LB液体培养基:Trytone 10g, yeast extract 5g, NaCl 10g, 用蒸馏水配至1000mL.[2] 氨苄青霉素:100mg/mL[3] 上样缓冲液:100 mM NaH2PO4, 10 mMTris, 8M Urea, 10 mM2-ME, pH8.0[4] Washing Buffer:100 mM NaH2PO4, 10 mM Tris, 8 M Urea, pH6.3[5] Elution Buffer:100 mM NaH2PO4, 10 mMTris, 8M Urea, 500 mM Imidazole, pH8.0[6] IPTG二、器材摇床,离心机,层析柱(1′10 cm)4、操作方法一、氯霉素酰基转移酶重组蛋白的诱导1. 接种含有重组氯霉素酰基转移酶蛋白的大肠杆菌BL21菌株于5mL LB液体培养基中(含100ug/mL 氨苄青霉素),37℃震荡培养过夜。
基因表达与蛋白质纯化技术探讨

基因表达的调控机制
转录水平调控
通过转录因子的作用,调控基因的转录起始和效率,影响RNA聚 合酶的活性,从而控制特定基因的表达。
翻译水平调控
通过mRNA的稳定性、蛋白质合成因子的调节以及蛋白质的修饰等 方式,调控蛋白质的合成效率和数量。
基因表达与蛋白质纯化的相互影响
01
相互依赖
基因表达和蛋白质纯化是相互依赖的过程,基因表达产生的蛋白质是纯
化的对象,而蛋白质纯化的结果又会影响基因表达的水平。
02
优化协同
通过优化基因表达和蛋白质纯化的条件和方法,可以实现两者的协同作
用,提高目的蛋白的产量和纯度。
03
应用拓展
基因表达与蛋白质纯化技术在生物医药、农业、工业等领域具有广泛的
基因表达与蛋白质纯化技术在生命科学领域的应用前景
1 2 3
基础研究
基因表达与蛋白质纯化技术可用于研究蛋白质的 结构和功能,深入了解生命活动的分子机制。
药物研发
通过基因表达技术生产重组蛋白药物,以及利用 蛋白质纯化技术分离和纯化抗体药物等,为药物 研发提供了新的途径。
生物技术应用
基因表达与蛋白质纯化技术在生物技术领域有着 广泛的应用,如生物催化、生物传感器等。
表观遗传调控
通过DNA甲基化、组蛋白修饰等表观遗传学机制,影响基因的表 达和沉默。
基因表达的生物学意义
生长发育调控
基因表达在生物体的生长发育过 程中发挥关键作用,如胚胎发育、 组织分化等。
代谢调控
基因表达参与生物体的代谢过程, 如糖代谢、脂肪代谢、蛋白质代 谢等,影响生物体的能量平衡和 物质转化。
酶与蛋白质工程基因表达与蛋白质分离纯化精品PPT课件

(1)复制起始点 (2)选择性基因(一般为抗生素抗性基因) (3)强的、可诱导的启动子 (4)强的转录终止序列 (5)核糖体结合位点 (6)合适的多克隆位点
基因表达体系
大肠杆菌表达载体分类
按蛋白质类型分:
单纯表达: 如pJLA系列 融合表达: 融合各种tag, GST, CBD, MAL, GFP, etc
• 应用较短的linker虽可克服蛋白酶分解的问题,但可能使两个 大分子相距最近,影响两种蛋白高级结构的折叠,从而相互干 扰,导致蛋白功能丧失,linker序列的组成对融合蛋白的折叠 有重大影响
• 另外,在设计linker序列时,尽量避免二级结构的产生,linker 中常见的氨基酸是非极性的疏水氨基酸(Gly、Ser等)
(T7 promoter, Novagen公司) (T5 promoter, Qiagen公司) (周质表达, BioLabs公司) (GST融合表达, Pharmacia公司) (Arabinose诱导型) (CBD融合, 可以自我切割, BioLabs)
基因表达体系
基因的融合
• 采用DNA重组技术将不同基因或基因片段融合,经合适的表达 系统表达后,可获得由不同功能蛋白拼合在一起而形成的新型 多功能蛋白
分泌表达: pel/ompT分泌肽
按启动子分:
lac及衍生的tac, trc, pac, rac等启动子 lamda phage PL和PR 启动子 T7 启动子 T5 启动子 ara启动子
IPTG诱导 热诱导 IPTG诱导 IPTG诱导 阿拉伯糖诱导
基因表达体系
常用表达载体
pET系列 pQE系列 pMAL系列 pGEX系列 pBAD系列 pTYB系列
✓ 其它
第4章 酶的分离与纯化

equilibrium centrifugation)。
根据颗粒的密度不同而进行分离。
离心时,在离心介质的密度梯度范围内,
不同密度的物质颗粒或向下沉降,或向上漂
浮,达到与其相同的密度时不再移动,形成
区带。
常用氯化铯(CsCl)作为梯度介质。
特点:
•介质的密度梯度范围包括所有待分离 物质的密度。 •适于分离沉降系数相近,但密度不同 的物质。
细胞粉碎机
匀浆机
(三)细胞破碎确认
1.直接测定破碎前后的细胞数:
破碎前,用显微镜或电子微粒计数器直接计数;
破碎后,用染色法区分破碎细胞与完整细胞。
2.测定导电率:
利用破碎前后导电率的变化测定破碎程度。 3.测定释放的蛋白质量或酶活力: 测定破碎液中胞内蛋白质或目的酶的释放量, 估算破碎率。
三、酶的提取(extraction)
物理破碎
通过各种物理因素的作用, 使组织、细胞的外层结构破 坏,而使细胞破碎。 化学试剂可以改变细胞壁 或细胞膜的通透性,而使 细胞内物质有选择性的渗 透出来 通过细胞本身的酶系或外 加酶制剂的催化作用,使 细胞外层结构受到破坏, 而达到细胞破碎
化学破碎
酶促破碎
高 压 细 胞 破 碎 机
JY92-II D超声波
质的溶解度降低,从而从溶液中沉淀析出。
• 浓缩作用
• 纯化作用
在生物大分子制备中最常用的几种沉淀方法:
⑴中性盐沉淀(盐析法)
⑵有机溶剂沉淀
⑶选择性沉淀(热变性和酸碱变性)
⑷等电点沉淀
⑸有机聚合物沉淀
(一)盐析沉淀法(改变离子强度)
1. 基本原理(盐溶和盐析)
向蛋白质或酶的水溶液中加入中性盐,可
02【课堂笔记】《蛋白质与酶工程》-酶的分离与纯化02部分-蛋白质的结构解析与序列测定01部分

第一章酶的分离提取与纯化1.1离心分离和层析分离1.1.1酶的提取方法离心是利用离心机旋转所产生的的离心力以及物质的沉降系数或浮力密度的差异,进行分离浓缩和提纯生物样品的一种方法。
离心分离时,要根据待分离物质以及杂志的颗粒大小、密度和特性的不同,选择适当的离心机、离心方法和离心条件。
1.1.1.1离心机的种类与用途常速离心机,高速离心机,超速离心机1)常速离心机:转速<8000r/min用途:分离细胞、细胞碎片、培养基残渣及粗结晶等较大颗粒2)高速离心机:转速:1~2.5*104r/min用途:分离各种沉淀物、细胞碎片及较大的细胞器3)超速离心机:转速:2.5~12*104r/min用途:用于DNA、RNA、蛋白质等生物大分子以及细胞器、病毒的分离纯化1.1.1.2离心方法差速离心,密度梯度离心,等密度梯度离心1)差速离心:原理:是采用不同的离心速度和离心时间,是沉降速度不同的颗粒分不分离的方法。
用途:分离沉降系数相差较大的蛋白质分子2)密度梯度离心原理:不同颗粒之间存在沉降系数差时,在一定离心力作用下,颗粒各自以一定速度沉降,在密度梯度不同区域上形成区带的方法。
常用介质:蔗糖、甘油3)等密度梯度离心:原理:当待分离的不同颗粒的密度范围在离心介质的密度梯度范围内时,不同浮力密度的颗粒在离心力作用下一直移动到与各自浮力密度相等的位置,形成区带。
介质:铯盐1.1.1.3层析分离技术又称色谱技术,是一种物理的分离方法。
利用混合物中的各组分的物理化学性质(分子的大小和形状,分子极性,吸附力,分子亲和力)的不同,使各组分以不同的程度分布在两个相中,其中一个相为固定的(固定相),另一个相则流过固定相(流动相)并使各组分以不同速度一定,从而达到分离根据分离原理分类吸附层析、分配层析、离子交换层析、凝胶层析和亲和层析等1)吸附层析原理:是利用吸附剂对不同物质的吸附力不同,而使混合物中各组分分离的方法。
2)分配层析原理:在一个有两相同时存在的溶剂系统中,根据不同物质的分配系数不同而达到分离目的的一种层析技术。
蛋白质与酶工程 酶的提取分离和纯化

(1)离心 (2)透析 (3)凝胶过滤 (4)超过滤 2、基于电荷 (1) 离子交换色谱 (2) 电泳 (3) 等电聚焦
3、基于溶解度 改变pH、离子强度、介电常数等实现的
沉淀分离: (1) 盐析法 (2) 复合沉淀法 (3) 有机溶剂沉淀法 (4) 等电点沉淀法 (5) 选择性变性沉淀法
环、脂肪酸氧化、脂肪酸合成酶以及蛋白质合成、DNA聚 合酶、RNA聚合酶等
④高尔基体:多糖、核蛋白粘液生成酶 ⑤溶酶体:各种水解酶等 ⑥叶绿体:参与光合作用形成ATP、NADPH有关的酶
类、与暗反应有关的酶系
线粒体主要酶的分布(约有120种酶)
部
位
酶的名称
单胺氧化酶、犬尿氨酸羟化酶、NADH-细胞色素C还原酶、
1-2 提取纯化之目的 1)酶催化功能的应用 2)酶学研究
酶的结构、功能、催化机制、催化动力学 酶的生物合成及其调控规律等
1-3 纯化的必要性 1)生物细胞中同时存在多种多样的酶 2)多酶可能作用于同一个底物 3)酶在生物细胞中的分布并不是均一的
二、酶的提取(extraction)
2-1 了解所分离酶在细胞中的分布 1、细胞外酶:由细胞内产生后分泌到胞外发挥作用
蛋白质与酶工程 酶的提取分离和
纯化
酶的提取、分离和纯化
一、概述 二、酶的提取 三、酶的分离纯化 四、酶的结晶 五、浓缩与干燥 六、酶纯化步骤的设计及评价
一、概述
1-1 酶提取与分离纯化的定义 将酶从细胞或其酶的技术 过程
*酶的纯化程度根据需要而定 *纯化方法多种多样,为获得较好的效 果往往是2种或2种以上联合应用
外
膜 脂类代谢有关的酶(酰基辅酶A合成酶、脂肪酸激酶等)
特征酶:单胺氧化酶
06 第四章 酶的分离纯化2思维导图
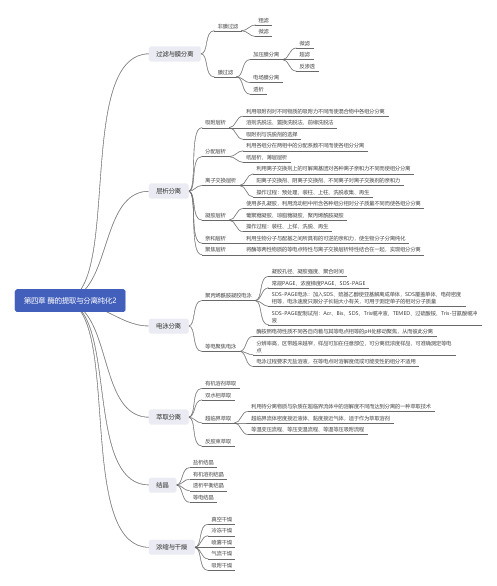
结晶
盐析结晶 有机溶剂结晶 透析平衡结晶 等电结晶
浓缩与干燥
真空干燥 冷冻干燥 喷雾干燥 气流干燥 吸附干燥
利用离子交换剂上的可解离基团对各种离子亲和力不同而使组分分离 阳离子交换剂、阴离子交换剂、不同离子对离子交换剂的亲和力 操作过程:预处理、装柱、上柱、洗脱收集、再生 使用多孔凝胶,利用流动相中所含各种组分相对分子质量不同而使各组分分离 葡聚糖凝胶、琼脂糖凝胶、聚丙烯酰胺凝胶 操作过程:装柱、上样、洗脱、再生 利用生物分子与配基之间所具有的可逆的亲和力,使生物分子分离纯化 将酶等两性物质的等电点特性与离子交换层析特性结合在一起,实现组分分离
酶按照电荷性质不同各自向着与其等电点相等的pH处移动聚焦,从而彼此分离
等电聚焦电泳
分辨率高,区带越来越窄,样品可加在任意部位,可分离低浓度样品,可准确测定等电 点
电泳过程要求无盐溶液,在等电点时溶解度低或可能变性的组分不适用
萃取分离
有机溶剂萃取 双水相萃取
超临界萃取
反胶束萃取
利用待分离物质与杂质在超临界流体中的溶解度不同而达到分离的一种萃取技术 超临界流体密度接近液体、黏度接近气体,适于作为萃取溶剂 等温变压流程、等压变温流程、等温等压与膜分离
非膜过滤
粗滤 微滤
膜过滤
加压膜分离
电场膜分离 透析
微滤 超滤 反渗透
层析分离
吸附层析 分配层析 离子交换层析
凝胶层析 亲和层析 聚焦层析
利用吸附剂对不同物质的吸附力不同而使混合物中各组分分离 溶剂洗脱法、置换洗脱法、前缘洗脱法 吸附剂与洗脱剂的选择 利用各组分在两相中的分配系数不同而使各组分分离 纸层析、薄层层析
电泳分离
凝胶孔径、凝胶强度、聚合时间
常规PAGE、浓度梯度PAGE、SDS-PAGE
酶工程 第四章 酶的提取与分离纯化

(二)离心机的种类
按离心机转速的不同,分为: 常速(低速) 高速 超速
46
离心机的种类
名称
转速(r/min)
注意事项
低速离心机 高速离心机 超速离心机
6000 6000〜 25000 >25000
常温,注意样品热变性和离心 管平衡
冷冻(防止温度升高), 离心管的精确平衡
冷冻+真空系统(减少空气阻 力和摩擦), 离心管的精确平衡
点相距较大的杂蛋白),多与其它方法联合使用 (如盐析法、有机溶剂法),因蛋白质在质的pI都在偏酸性范围内
2)无机酸(如磷酸、盐酸、硫酸)价格较低 3)无需除掉多余酸即可进行下一步纯化
4. 缺点:
酸化时,容易引起蛋白质失活
39
(四)有机聚合物沉淀法
4.酶解法(enzymatic lysis):
外加酶法: 根据细胞壁的结构和组成特点,选用适当的酶。 自溶法(autolysis): 细胞结构在本身具有的各种水解酶作用下发 生溶解的现象。
12
(三)细胞破碎确认
1.直接测定破碎前后的细胞数:
破碎前,用显微镜或电子微粒计数器直接计数;
破碎后,用染色法区分破碎细胞与完整细胞。
细菌
菌
酵母菌
霉菌
壁厚 /nm
层次
15 ~ 50 单层
10 ~ 13 同G+ 多层
100 ~ 300 多层
100 ~ 250 多层
主要 组成
肽聚糖
(40% ~ 90%) 多糖 胞壁酸 蛋白质 脂多糖 (1%〜2%)
肽聚糖 (5% ~ 10%)
脂蛋白 脂多糖 (11% ~ 22%) 磷脂 蛋白质
葡聚糖(30% ~ 40%) 多聚糖
蛋白质和酶的分离与纯化

蛋白质和酶的分离纯化及鉴定蛋白质是生命体中的重要物质基础之一。
从分子水平上认识生命现象,已成为现代生物学发展的主要方向。
要研究蛋白质,首先要得到高度纯化的目的蛋白.蛋白质在组织或细胞中一般都是以复杂的混合物形式存在,每种类型的细胞都含有上千种不同的蛋白质.要想从成千上万种蛋白质混合物中纯化出目的蛋白,就要根据蛋白质的理化性质不同设计出合理的分离方法。
目前研究为止酶除核酶外本质都是蛋白质,因此酶的分离纯化方法基本是采用蛋白质的分离纯化方法,但是酶的活性受到多种因素的影响,因此酶的分离纯化比一般的蛋白质要求更高。
一、质分离纯化的一般原则1。
原料的选择原则:来源方便,成本低,易操作、安全的原料。
蛋白分布:体液、组织、细胞定位2. 破碎方法:(1)机械方法:通过机械运动产生的剪切力的作用,使细胞或组织破碎的方法.如:捣碎法、研磨、匀桨法(2)物理方法:通过温度、压力、声波等各种物理因素的作用,使组织细胞破碎的方法.如:反复冻融、渗透压、超声破碎(3)化学方法:通过各种化学试剂对细胞膜的作用,使细胞破碎的方法。
如:甲苯、丙酮、氯仿和非离子型的表面活性剂(Triton和Tween)(4)酶促法:溶菌酶、蜗牛酶等3。
目的蛋白或酶的特异、快速、精确的定性或定量方法4. 先粗后细,分级分离粗分:将得到的蛋白溶液先利用简单、快速、易处理的方法除去大部分杂蛋白。
如: 盐析、离心、有机溶剂沉淀等.精制:利用蛋白质性质的差异,采用不同的方法,如:离子交换层析、分子筛、吸附层析、亲和层析、电泳、离心、结晶等方法进一步纯化。
5。
避免蛋白质的变性(pH、适合的温度和缓冲体系等)二、常用的蛋白质的分离纯化技术可以根据各种蛋白质的结构、理化性质不同设计分离方法。
(一)根据蛋白质的溶解度不同进行分离1。
蛋白质盐析蛋白质属于生物大分子之一,分子量从1万至100万之巨,其分子的直径可达1-100nm,为胶粒范围之内。
蛋白质的表面电荷和水化膜是其主要的稳定性因素.大多数蛋白质都溶于水,在低盐条件下,蛋白的溶解度随着盐浓度的升高而增加,这称为蛋白质的盐溶现象,而盐浓度达到一定以后,蛋白质水化膜被破坏,电荷被中和,蛋白质的溶解度会随着盐浓度的升高而降低,并且析出,这就是盐析现象。
最新蛋白质与酶工程 第四章 酶分子修饰教学讲义PPT课件

酶分子修饰的条件
修饰反应尽可能在酶稳定条件下进行,并尽量不破坏酶 活性功能的必需基团,使修饰率高,同时酶的活力回收 高。 ◦ (1)pH与离子强度 pH决定了酶蛋白分子中反应基团的解离状态。由于 它们的解离状态不同,反应性能也不同。 ◦ (2)修饰反应的温度与时间 严格控制温度和时间可以减少以至消除一些非专一 性的修饰反应。 ◦ (3)反应体系中酶与修饰剂的比例
使酶蛋白侧链上的巯基发生改变,从而改变酶的空间构 象、特性和功能的修饰方法称为巯基修饰。
常用的巯基修饰剂有:二硫苏糖醇、巯基乙醇、硫代硫 酸盐、硼氢化钠等还原剂以及各种酰化剂、烷基化剂等。
常见基团的化学修饰反应:巯基
酚基修饰
蛋白质分子的酪氨酸残基上含有酚基。使酚基发生改变, 从而改变酶蛋白的空间构象的修饰方法称为酚基修饰。
酚基修饰的方法主要有碘化法、硝化法、琥珀酰化法等。 例如,枯草杆菌蛋白酶的第104位酪氨酸残基上的酚基 经四硝基甲烷( TNM )硝化修饰后,生成硝基酚残基, 由于负电荷的引入,使酶对带正电荷的底物的结合力显 著增加;葡萄糖异构酶经过琥珀酰化修饰后,其最适 pH 值下降 0.5单位,并增加酶的稳定性。
α-淀粉酶中的钙离子(Ca2+),谷氨酸脱氢酶中的锌离子 (Zn2+),过氧化氢酶分子中的铁离子(Fe2+),酰基氨基酸酶分子 中的锌离子(Zn2+),超氧化物歧化酶分子中的铜、锌离子 (Cu2+,Zn2+)
若从酶分子中除去其所含的金属离子,酶往往会丧失其催化活 性。如果重新加入原有的金属离子,酶的催化活性可以恢复或 者部分恢复。若用另一种金属离子进行置换,则可使酶呈现出 不同的特性。有的可以使酶的活性降低甚至丧失,有的却可以 使酶的活力提高或者增加酶的稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基因表达体系
原核体系
✓ 大肠杆菌 (Escherichia coli)
遗传背景清楚,基因工程操作方便,商品化表达载体种类齐全,表达效率高; 基本不分泌,易形成包涵体(无正确折叠的立体结构),无加糖等修饰
✓ 枯草杆菌 (Bacillus subtilis)
• 构建融合蛋白的基本原则:将第一个蛋白基因的终止密码子删 除,再接上带有终止密码子的第二个蛋白或多肽基因,即可实 现两个基因的融合表达
基因表达体系
利用融合技术表达外源基因原因:
• 为蛋白质的表达和纯化提供方便 • 蛋白质结构和功能的研究 • 获得蛋白质的途径(通过体外切割) • 与其它不同功能的蛋白质融合,产生新的多功能蛋白 • 与报告分子共表达,研究蛋白定位及转基因表达 • 防止外源蛋白被宿主的蛋白水解酶降解 • 改变胞内溶解性:硫氧还蛋白,GST • 蛋白表达的空间定位:信号肽
基因表达体系
基因融合的策略
• 基因融合的方式
– 信号肽+基因 – 信号肽+基因+插入序列
融合蛋白接头设计和选择
将2个或多个不同的模块连接成为一个大分子,其中起连接 作用的氨基酸链即为linker,Linker的长度一般是在10-15 个氨基酸之间
基因表达体系
• 若使用的linker较长,由于在重组蛋白的生产过程中对蛋白裂 解比较敏感,可能会导致融合蛋白产量的降低;同时又涉及免 疫原性的问题,因接头序列本身就是新的抗原
分泌蛋白质能力强,一般有天然立体结构; 无加糖修饰功能,培养液中蛋白酶活性高,重组蛋白易受蛋白酶的水解;质粒不稳 定,尚无商品化的表达载体
✓ 其它
乳酸菌 (Lactic acid bacteria) 沙门氏菌 (Salmonella typhimurium) 苏云金杆菌 (Bacillus thuringiensis)
• 应用较短的linker虽可克服蛋白酶分解的问题,但可能使两个 大分子相距最近,影响两种蛋白高级结构的折叠,从而相互干 扰,导致蛋白功能丧失,linker序列的组成对融合蛋白的折叠 有重大影响
• 另外,在设计linker序列时,尽量避免二级结构的产生,linker 中常见的氨基酸是非极性的疏水氨基酸(Gly、Ser等)
基因表达体系
真核体系
✓ 酵母细胞
可生产分泌型蛋白;有天然立体结构,有加糖修饰功能;可进行染色体整合型基因表 达;商品化表达体系:酿酒酵母、毕氏酵母、裂殖酵母 糖链与哺乳动物加工的不一致,培养上清多糖浓度高
✓ 昆虫细胞
可以病毒感染的形式在成虫中生产,也可在体外培养细胞中生产蛋白;适合分泌型和膜 蛋白的表达,有加糖修饰; 糖链有所区别,表达量有限
• 由美国、韩国和法国的科学家组成的研究小组完成了对两种实验室常 用的大肠杆菌(E.coli)菌株基因组的测序工作,发表在《Journal of Molecular Biology》 (2009)
• 基因组大小4.6M bp
基因表达体系
目标蛋白质在大肠杆菌中的表达
细菌表达系统培养方法简单、增殖快、生产成本低,是目前广 泛应用的外源基因表达体系。但缺乏真核细胞特有的加工处理,外 源蛋白大量表达容易形成包涵体,而且在菌体中表达的外源蛋白, 在原核细胞中不稳定,易被菌体蛋白酶破坏
分泌表达: pel/ompT分泌肽
按启动子分:
lac及衍生的tac, trc, pac, rac等启动子 lamda phage PL和PR 启动子 T7 启动子 T5 启动子 ara启动子
IPTG诱导 热诱导 IPTG诱导 IPTG诱导 阿拉伯糖诱导
基因表达体系
常用表达载体
pET系列 pQE系列 pMAL系列 pGEX系列 pBAD系列 pTYB系列
(T7 promoter, Novagen公司) (T5 promoter, Qiagen公司) (周质表达, BioLabs公司) (GST融合表达, Pharmacia公司) (Arabinose诱导型) (CBD融合, 可以自我切割, BioLabs)
基因表达体系
基因的融合
• 采用DNA重组技术将不同基因或基因片段融合,经合适的表达 系统表达后,可获得由不同功能蛋白拼合在一起而形成的新型 多功能蛋白
表达载体包括的成分
(1)复制起始点 (2)选择性基因(一般为抗生素抗性基因) (3)强的、可诱导的启动子 (4)强的转录终止序列 (5)核糖体结合位点 (6)合适的多克隆位点
基因表达体系
大肠杆菌表达载体分类
按蛋白质类型分:
单纯表达: 如pJLA系列 融合表达: 融合各种tag, GST, CBD, MAL, GFP, etc
基因表达体系
融合蛋白标签
融合蛋白技术的应用可以使蛋白质的表达与纯化方便 地进行。一般来说,将目标蛋白编码基因与一段被称为 “亲和尾”(Affinity tail)的编码序列相连接,这段 “亲和尾”可以与亲和层析柱上的配基特异地结合,使 目标蛋白可以用亲和层析的方法快速而简便地纯化出来
His·tag S·Tag
Trx·tag thrombin enterokinase
硫氧还蛋白标签 凝血酶
肠激酶
目标蛋白
基因表达体系
载体分类
• 克隆载体:携带插入外源片段的质粒或噬菌体
• 表达载体:就是在克隆载体基本骨架的基础上增加表达 元件(如启动子、终止子等),使目的基因能够表达的 载体
基因表达体系
✓ 哺乳动物细胞/组织
可进行分泌表达,有天然立体结构,加糖方式与人体蛋白质完全一致; 表达量不够高,培养成本较高
✓ 植物细胞/组织
植物可大面积种பைடு நூலகம்,可以廉价大规模生产; 转基因植物制作费时,表达的组织特异性较难控制;表达量较难提高,分离纯化不便
基因表达体系
体系选择
✓ 研究基因功能
大肠杆菌、裂殖酵母、昆虫细胞、哺乳动物细胞
✓ 多肽药物生产
大肠杆菌、毕氏酵母、哺乳动物细胞组织
✓ 疫苗
大肠杆菌、酵母、动植物细胞组织
✓ 单抗生产
杂交瘤细胞
✓ 工业酶生产
各种微生物
基因表达体系
Escherichia coli
• E.coli常与一些食源性疾病有关,但从人体肠道内分离出来的两种命 名为K-12和B的良性大肠杆菌菌株却是两种重要实验用菌株。大肠杆 菌K-12的基因组的测序工作已于1997年完成。大肠杆菌B菌株自1918 年被分离出来后,在1959年被分离为两类实验用菌株:REL606和 BL21(DE3),后者在医学和工业上用于生产蛋白质
