双抗体夹心法之钩状效应
乙肝六项操作及检验结果的解释

乙肝六项操作
HBCAb测定(竞争法)
• 试剂准备同上
• 加样:每测定孔加入50l样品。对照孔中加入阴、阳性对照血清各50l。作 为临床诊断依据,必须将原倍血清样品按1:30稀释后再检验,稀释液应采用 生理盐水;(作为流行病学调查依据,使用原倍血清检验)。
• 加酶:每孔加入酶标记抗体50l,轻拍混匀。
• 结果判定:样品OD值S/C.O<=1者为HBeAb阳性
•
样品OD值S/C.O>1者为HBeAb阴性
• 注意:加底物显色,显色的强弱
与待测标本中HBeAb的含量成反
比。
乙肝六项操作
HBCAb测定(竞争法)
• 原理
• 在微孔条上预包被,被纯化乙肝核心抗原 (HBcAg),配以酶标记抗体(HbcAbHRP)及TMB等其它试剂,采用竞争抑制 法原理检测人血清(或血浆)中乙肝核心 抗体(HBcAb)。
4 钩状效应(Hook)影响
随着 ELISA 一步法的应用 ,在日常工作中会发现 HBsAg阴性而 HBeAg 阳性的现象 ,其原因就是当 标本中的抗原浓度过高时产生的钩状效应 (Hook)现 象 ,从而出现假阴性造成真阳性的漏检, 即随着被 测物浓度增高反而显色减弱甚至不显色, 往往造成 假阴性结果 ,采用同步稀释测定或用线性范围高的 乙肝六项定量法可以减少 Hook 效应的发生。
一.试剂准备同上
二.HBeAb操作 加样:分别用加样器在对照孔中加入阴、阳性对照血清各50l于相应孔中。 加酶:分别在每孔中加入酶标记抗体50l,轻轻混匀。 温育:置37℃温育30分钟,室温平衡5分钟。 洗涤:用洗涤液充分洗涤5次,洗涤完扣干(每次应保持30-60秒的浸泡时间)。 显色:每孔加入底物A、B各50l,轻拍混匀,置37℃暗处15分钟。 终止:每孔加终止液50l,混匀。
B族链球菌检测试剂

B族链球菌检测试剂检测原理产品采用胶体金免疫层析(双抗体夹心法)的原理。
B族链球菌的抗原经化学抽取后,加入到样品孔,流经结合垫时与胶体金标记的抗B族链球菌抗体反应。
此混合物流向包被有另一株抗B族链球菌抗体的硝酸纤维素膜时与之反应并形成“抗体-抗原-抗体-胶体金”复合物。
样本中含有B族链球菌时,在膜上显现出红色检测线(T)当样本为不含B族链球菌或其浓度低于本产品灵敏度时,T线不显示。
在检测线上方的包被有羊抗鼠IgG二抗,捕获胶体金结合物并形成质控线(C),即此试剂有效。
主要组成成分1.B族链球菌检测试剂由试纸条鹤塑料壳组成,试纸条上主要成分有:a)胶体金标记的抗B族链球菌抗体(固定在玻璃纤维上)b)C线:羊抗鼠IgG多克隆抗体(固定在硝酸纤维素膜上)c)T线:抗B族链球菌抗体(固定在硝酸纤维素膜上)d)PVC底板和卡壳2.1号抽取液(2M亚硝酸钠)2号抽取液(IM乙酸)储存条件及有效期检测试剂在4-30℃密封保存,有效期12个月,检测试剂铝袋开封后,请即刻使用。
试剂如不能即刻使用,建议在4-30℃,湿度小于40%的环境下放置不超过1小时。
样本要求1.主要样本为阴道宫颈拭子,样本采集不受临床症状及用药的影响。
2.采样拭子最好采用顶端为人造纤维或者涤纶材质的塑料柄擦拭棒。
3.将无菌拭子置入女性阴道下1/3,旋转3-5圈即可。
4.如果检测前24小时内发生性交、盆浴、阴道灌洗等情况,可能导致假阴性。
5.如果阴道出血,建议先用无菌拭子将血擦拭干净,再取样。
6.取样后样本应尽快进行测试,如不能及时测试可将样本置4C冰箱储存,超过3天在-20℃保存,测试前注意恢复至室温,临床标本在运输过程中要避免反复冻融,应该在2-8°C运输。
检验方法1.在抽取管中加入1号抽取液和2号抽取液各5滴,充分混匀。
2.将阴道拭子放入已加入抽取液的抽取管中,室温静置5分钟。
3.摇动拭子数秒钟,在管壁上反复挤压,旋转。
4.挤出液体后取出拭子,管内的抽取物即为检测样本。
甲胎蛋白测定

甲胎蛋白测定1.方法:双抗体夹心法2.原理:采用双抗体夹心法原理,整个过程18分钟完成。
·第1步:10μl标本、生物素化的抗AFP单克隆抗体和钌(Ru)标记的抗AFP单克隆抗体混匀形成夹心复合物。
·第2步:加入链霉亲和素包被的微粒,让上述形成的复合物通过生物素与链霉亲和素间的反应结合到微粒上。
·第3步:反应混和液吸到测量池中,微粒通过磁铁吸附到电极上,未结合的物质被清洗液洗去,电极加电压后产生化学发光,通过光电倍增管进行测定。
·检测结果由机器自动从标准曲线上查出。
此曲线由仪器通过2点定标校正,由从试剂条形码扫描入仪器的原版标准曲线而得。
3.仪器及参数:Elecsys 2010技术参数系统 30个标本位15个试剂位最大吸样头上载量为 360个最大反应杯上载量为180只标本类型 血清和血浆控制单元 触摸屏系统接口 双向串型RS232接口4.应用试剂:4.1.瑞士罗氏4.2.直接上机使用4.3 试剂组成:M:链霉亲和素包被的微粒。
R1:生物素化的抗AFP单克隆抗体。
R2:Ru(bpy)2+标记的抗AFP单克隆抗体。
5.操作方法:详见 Elecsys 2010电化学发光仪操作规程6.临床意义:6.1检测范围:0.500─1000IU/ml 或 0.605-1210 ng/ml参考值646名健康人测定结果95%<=5.8IU/ml或<=7.0ng/m100%<=11.3IU/ml或<=13.6ng/ml6.2 意义:AFP来源于卵黄囊、未分化肝细胞和胎儿胃肠道。
70-95%的原发性肝癌患者的AFP升高,越是晚期,AFP含量越高。
但尚未发现AFP含量与肿瘤大小、恶性程度等有关系。
AFP含量显著升高一般提示原发性肝细胞癌。
在转移性肝癌中,AFP一般低于350-400 IU/ml。
AFP中度升高也常见于酒精性肝硬化、急性肝炎以及HBsAg携带者。
不推荐将AFP用于普通人群的癌症筛查。
乙肝两对半检测中(南京)

目前国际上常用的HBsAg标准物质: Paul Ehrlich Institute 参考物: PEI/ml; 法国参考物: ng/ml; 雅培参考物: ng/ml(Axsym), IU/ml (i2000); NIBSC参考物:IU/ml. (英国国家生物标准与检定所,National Institute for Biological Standards and Control, NIBSC) 1 IU/ml=0.58PEI/ml=1.93“法国”ng/ml=5.59雅培 ng/ml
aa122-124 插入氨基酸
4)RF引起的假阳性 RF是一种自身抗体,能和多种动物IgG的Fc段结 合。由于固相抗体和标记抗体均为IgG,双抗体夹心 法测抗原可能有RF的干扰,产生假阳性。
固相IgG
标记IgG
固 相 载 体
RF
解决办法:
用IgG的Fab 或F(ab’)片段作酶结合物替代 完整的IgG; 标本用联有热变性IgG的固相吸附剂(G蛋白) 处理; 将热变性IgG加入到标本稀释液中; 离心分离IgM和IgG; 加入羊抗人IgG。 鼠源单克隆抗体对RF的亲和力较低,也能 明显地降低RF对结果的干扰。
HBsAg阳性+ HBsAb阳性+HBcAb阳性模式 解释:“不同亚型HBV感染” 。 两株不同亚型HBV感染及机体免疫过程:1、 两株不同亚型HBV同时或先后感染同一个 体 , 合 成 两 种 不 同 亚 型 的 HBsAg1 和 HBsAg2;2、前者刺激机体产生HBsAb1, 后 者 未 刺 激 机 体 产 生 HBsAb2 ; 3 、 HBsAb1中和了相应的HBsAg1而不能中和 HBsAg2 , HBsAg2与HBsAb1同时存在。
主治医师 (临床医学检验学)-临床免疫学和免疫学检验(A1-A2型题)

主治医师 (临床医学检验学)-临床免疫学和免疫学检验(A1/A2型题)1、散射免疫比浊法测定时,为保证能与标本中的抗原完全反应,必须使A.检测体系抗原保持过量B.检测体系抗体保持过量C.充分稀释待测样品D.具足够强的发射光E.足够强的照射光2、ELISA双抗体夹心法一步法检测中,若怀疑存在钩状效应,应采取何措施A.加入更多的酶标抗体B.增加洗涤次数C.缩短孵育时间D.降低孵育温度E.将标本稀释后再重新检测3、对感染性疾病的早期具有诊断意义的是针对病原微生物产生的A.IgMB.IgAC.sIgAD.IgEE.1gG4、Rh血型抗原属于A.异种抗原B.异嗜性抗原C.同种异型抗原D.自身抗原E.外源性抗原5、SPA协同凝集试验中抗体类别是A.IgMB.IgGC.IgAD.IgEE.IgD6、在流式细胞仪的分选方面,以下与细胞收获率存在负相关关系的是A.细胞纯度B.细胞大小C.细胞颗粒多少D.细胞自发荧光E.细胞表面的分化抗原7、在流式细胞仪的分选方面,以下与细胞分选得率密切相关的是A.分选纯度B.分选速度C.分选时间D.细胞纯度E.细胞大小8、流式细胞仪液流系统中鞘液的主要作用是A.使待测细胞成为单个细胞悬液B.使样本进入流动室形成样本流C.使样本处于喷嘴中心位置以保证检测精确性D.使细胞以稳定的速度通过流动室E.使细胞流动的方向与激光束垂直相交9、流式细胞仪中检测到的能反映细胞大小的光信号是A.荧光信号B.侧向散射光信号C.后向散射光信号D.电脉冲信号E.前向散射光10、同种肾移植时,以下检查可预防超急性排斥反应发生的是A.HLA血清学定型试验B.HLA细胞学定型试验C.PHA激发的淋巴细胞转化试验D.淋巴细胞交叉毒性试验E.预致敏淋巴细胞分型11、以下方法可判断供者与受者的HLA-D位点编码的抗原是否相容的是A.迟发型皮肤超敏反应B.PHA激发的淋巴细胞反应C.混合淋巴细胞反应D.HLA血清学定型试验E.补体依赖的淋巴细胞毒试验12、淋巴细胞功能检测的体内试验主要是A.淋巴细胞转化实验B.反向溶血空斑实验C.淋巴细胞增殖实验D.迟发型超敏反应E.细胞毒性实验13、淋巴细胞转化试验中能同时刺激T和B细胞增殖的物质是A.肿瘤抗原B.结核性纯化蛋白衍生物(PPD)C.同种异体细胞D.植物血凝素E.EB病毒14、用于测定人NK细胞活性的靶细胞通常为A.YAC细胞株B.B-9细胞株C.B9-11细胞株D.K562细胞株E.KYM-1D4细胞株15、在应用化学发光法检测中性粒细胞的吞噬功能和代谢活性时,加入体系中增强发光效率的物质是A.金黄色葡萄球菌B.鲁米诺C.硝基四氮唑蓝D.酸性磷酸酶E.碱性磷酸酶16、以下何种病不属于原发性B细胞免疫缺陷病A.Bruton综合征B.DiGeorge综合征C.选择性IgA缺乏症D.普通易变型免疫缺陷病E.性联高IgM综合征17、制备单克隆抗体通常采用A.体外培养B.小鼠腹腔内接种C.大白鼠皮下接种D.小鼠肌肉内接种E.小鼠静脉内接种18、最常用于M蛋白鉴定的方法是A.单向免疫扩散法B.免疫浊度法C.免疫电泳D.免疫固定电泳E.酶联免疫试验19、有关本一周蛋白的说法,不正确的是A.本一周蛋白即尿中游离的免疫球蛋白轻链B.本一周蛋白加热至37℃出现沉淀,继续加热至90℃后重新溶解C.本一周蛋白又称凝溶蛋白D.本一周蛋白加热至50~60℃出现沉淀,继续加热至90℃后重新溶解E.尿标本宜先用聚乙二醇,通过半透膜浓缩后再进行免疫电泳分析20、免疫浊度法测定Ig中引起测量误差的最大因素A.灵敏度低B.重复性差C.准确度低D.钩状效应E.精密度低21、在脱敏治疗中,诱导机体产生的封闭抗体是A.IgGB.IgAC.IgMD.IgEE.IgD22、孕妇,为Rh(-),第一胎分娩Rh(+)胎儿,为防止再次妊娠的胎儿产生溶血症,产后72小时内应考虑给该母亲注射A.抗Rh抗体B.Rh抗原C.免疫抑制剂D.免疫增强剂E.不需要注射23、对CFT的应用评价,下述不正确的是A.灵敏度高,几乎可与放射免疫媲美B.特异性高,还可作抗原结构差异的分析C.不需特殊器材和试剂,但操作步骤繁琐D.能检测除颗粒抗原外的诸多抗原E.影响因素多24、发光物吖啶酯标记的化学发光反应体系应在的环境是A.中性B.酸性C.碱性D.酸性或中性E.碱性或中性25、以下分析技术中灵敏度最低的是A.微粒子化学发光分析技术B.电化学发光免疫分析技术C.化学发光免疫分析技术D.酶联免疫吸附技术E.化学发光酶免疫分析技术26、CFT前的抗原抗体方阵滴定的目的在于A.使抗原抗体复合物结合补体的量最多B.使抗原抗体复合物形成最少C.使抗原抗体复合物结合补体的量最少D.避免抗原抗体复合物太多E.选择抗原抗体最适比例27、CFT检测系统中血清作56℃30分钟处理,目的在于A.提高血清中抗体的激活状态B.破坏血清中的抗羊红细胞成分C.增强血清中抗体同抗原结合的能力D.灭活补体,去除一些非特异反应因素E.破坏血清中的抗补体成分28、在CIC检测中,以下说法不正确的是A.应特别注意-20℃中保存的正常人对照血清应避免反复冻融B.各种CIC检测方法之间的相关性较好C.尽可能采取新鲜血清标本D.应备有参考标准和质控样品E.抗原特异性CIC检测法在临床上推广较难29、关于抗血清制备过程中免疫方案,不涉及A.抗原的纯化B.抗原的剂量和剂型C.接种动物的数量D.接种动物种类E.注射途径30、颗粒性抗原免疫接种方法一般采用A.皮内注射B.皮下注射C.淋巴结注射D.肌肉注射E.静脉注射31、非常稀少的纯化抗原的定量检测一般采用A.紫外光吸收法B.双缩脲法C.酚试剂法D.ELISA定量法E.化学发光法32、人源化抗体的最主要优点是A.亲和力强B.纯度高C.异源性低而有利于应用于人体D.稳定性好E.特异性强33、以下不属于可溶性抗原的制备方法的是A.酶处理法B.反复冻融法C.超声破碎法D.研磨法E.表面活性剂处理法34、最有效的单克隆抗体纯化方法是A.凝胶过滤法B.盐析法C.亲和层析法D.离子交换层析法E.辛酸提取法35、冷球蛋白定性分析中两支血细胞容积管的温度分别是A.4℃和37℃B.4℃和30℃C.10℃和56℃D.4℃和90℃E.10℃和37℃36、测定CIC时,在pH、离子强度等条件固定时,蛋白质分子量越大,用于沉淀的PEG浓度A.越大B.越小C.与蛋白质的浓度相等D.与蛋白质分子量相等E.与蛋白质分子量无关37、以下方法是测定单个补体成分含量的是A.CH50试验B.补体结合试验C.免疫溶血法D.火箭免疫电泳E.对流免疫电泳38、根据发光反应的体系和标记物不同,可将发光免疫分析分为A.直接化学发光免疫分析、间接化学发光免疫分析和化学发光酶免疫分析B.直接化学发光免疫分析、间接化学发光免疫分析、微粒子化学发光免疫分析和电化学发光免疫分析C.微粒子化学发光免疫分析、电化学发光免疫分析和化学发光酶免疫分析D.间接化学发光免疫分析、微粒子化学发光免疫分析、电化学发光免疫分析和化学发光酶免疫分析E.化学发光免疫分析、微粒子化学发光免疫分析、电化学发光免疫分析和化学发光酶免疫分析39、本周蛋白检测时应考虑到A.化学法操作烦琐,技术要求高B.血标本的检出率不如尿标本C.化学法较灵敏D.免疫学方法常用的是EUSAE.免疫学方法常用的是化学发光法40、皮肤窗试验是测定中性粒细胞的功能是A.趋化性功能B.调理功能C.吞噬功能D.杀伤功能E.抗原递呈功能41、Boyden小室法是测定中性粒细胞的功能是A.趋化性B.调理功能C.吞噬功能D.杀伤功能E.抗原递呈功能42、患儿,4岁,反复患呼吸道和胃肠道疾病,医生疑是原发性免疫缺陷病,拟进行进一步检查,以下检查项目临床意义解释不正确的是A.T淋巴细胞严重减少,提示细胞免疫缺陷B.皮肤迟发型超敏反应阴性,提示体液免疫缺陷C.白喉毒素试验阴性,提示体液免疫缺陷D.对植物血凝素的增殖反应缺如或降低提示细胞免疫缺陷病E.扁桃体发育不良或缺如,提示体液免疫缺陷43、流式细胞仪中检测侧向散射光信号的散射光检测器与激光束的夹角为A.10°B.20°C.30°D.60°E.90°44、以下成分转移给正常人可导致I型变态反应A.患者的致敏淋巴细胞B.患者的血清C.致敏淋巴细胞释放的转移因子D.巨噬细胞释放的淋巴细胞激活因子E.患者的食物45、环孢素主要通过抑制何种细胞达到延长同种器官移植存活率的作用A.巨噬细胞B.B细胞C.Th细胞D.B1细胞E.B12细胞46、HLA-DP抗原常用检测方法是A.双向混合淋巴细胞培养法B.交叉淋巴细胞毒试验C.补体依赖细胞毒试验D.预致敏淋巴细胞分型E.淋巴细胞的亚型检测47、如遇一位血清过敏者需注射破伤风抗毒素,最适的处理是A.停止注射B.用脱敏药注射后再注射C.少量多次注射D.一次性皮下注射E.与减敏药物同时注射48、抗原脱敏治疗支气管哮喘的机制是A.扩张支气管B.抑制胆碱能神经C.抑制细胞释放生物活性物质D.抑制呼吸中枢E.产生IgG阻止IgE与抗原结合49、过敏性哮喘患者,血中哪些免疫球蛋白最可能升高A.IgG、IgEB.IgM、IgEC.IgD、IgG4D.IgA、IgG4E.IgE、IgG450、患儿,5岁,有结核病人接触史。
抗原elisa双位点一步法测定中钩状效应与对策

抗原elisa双位点一步法测定中钩状效应与对策
抗原ELISA双位点一步法是一种常用的实验方法,用于检测抗原与抗体之间的相互作用。
在实验过程中,可能会出现钩状效应,这会影响实验结果的准确性。
以下是钩状效应的解释和对策:
钩状效应是指在ELISA实验中,当抗原浓度较低时,检测结果会出现一个不规则的曲线,其中抗原的浓度呈现出比预期更高的信号强度。
这种现象可能是由于抗原与抗体之间的结合造成的,导致抗原与抗体的结合部分被遮盖,难以被检测到。
这会导致低抗原浓度的误判和结果不准确。
为了避免钩状效应的影响,可以采取以下对策:
1. 选择适当的抗体:首先要选择高亲和力的抗体来进行实验,这有助于提高检测的灵敏度和准确性。
2. 优化反应条件:在实验过程中,可以调整反应条件,如反应温度,时间和缓冲液的pH值等,以尽可能减少钩状效应的发生。
3. 适当稀释样品:在实验中,可以适当稀释样品来降低抗原的浓度,从而减少钩状效应的影响。
4. 使用另一种检测方法:如果钩状效应难以避免,可以考虑使用其他检测方法,如Western blot或免疫印迹等。
总之,钩状效应可能会影响抗原ELISA双位点一步法的准确性,但通过选择适当的抗体,优化反应条件,适当稀释样品和使用其他检测方法等对策,可以降低钩状效应的影响,提高实验结果的准确性。
双抗体夹心法

1.双抗体夹心法双抗体夹心法,属于非竞争结合测定。
它是检测抗原最常用的ELISA,适用于检测分子中具有至少两个抗原决定簇的多价抗原,而不能用于小分子半抗原的检测。
其基本工作原理是:利用连接于固相载体上的抗体和酶标抗体分别与样品中被检测抗原分子上两个抗原决定簇结合,形成固相抗体-抗原-酶标抗体免疫复合物。
由于反应系统中固相抗体和酶标抗体的量相对于待测抗原是过量的,因此复合物的形成量与待测抗原的含量成正比(在方法可检测范围内)。
测定复合物中的酶作用于加入的底物后生成的有色物质量(OD值),即可确定待测抗原含量。
若固相载体上的抗体和酶标抗体分别与样品中被检测抗原分子上两个不同的抗原决定簇结合,则属于双位点夹心法。
若采用固相载体上的抗原和酶标抗原分别与样品中被检测抗体分子结合,则是双抗原夹心法。
操作步骤:⑴将特异性抗体包被固相载体McAb。
孵育一定时间,使形成固相抗体,洗涤除去未结合的抗体和杂质。
⑵加待检标本,孵育,使标本中的抗原与固相载体上的抗体充分反应,形成固相抗原抗体复合物。
洗涤除去其他未结合物质。
⑶加酶标抗体,孵育,使形成固相抗体-待测抗原-酶标抗体夹心复合物。
洗涤除去未结合酶标抗体。
⑷加底物显色。
固相上的酶催化底物产生有色产物,通过比色,测标本中抗原的量。
现多采用针对单一抗原决定簇特异性的单克隆抗体做固相化和酶标抗体,则受检样品和酶标抗体可一次性加入,简化流程,缩短反应时间。
若标本中待测抗原浓度过高,抗原可分别与酶标抗体和固相抗体结合而不形成上述夹心复合物(类似于免疫沉淀反应中抗原过剩时的后带现象),使最终结果低于实际含量(钩状效应),甚至出现假阴性现象。
因此对此类标本应适当稀释后再测定。
另外,当血清中存在类风湿因子(RF)时,类风湿因子(RF)可充当抗原,而形成固相抗体-类风湿因子-酶标抗体夹心复合物,从而出现假阳性结果。
2.间接法此法是测定抗体最常用的方法,属非竞争结合试验。
其原理是将抗原连接到固相载体上,样品中待测抗体与之结合成固相抗原-受检抗体复合物,再用酶标二抗(针对受检抗体的抗体,如羊抗人IgG抗体)与固相免疫复合物中的抗体结合,形成固相抗原-受检抗体-酶标二抗复合物,测定加底物后的显色程度,确定待测抗体含量。
警惕化学发光检测中的“钩状效应”

警惕化学发光检测中的“钩状效应”化学发光法具有⾼灵敏度和⾼特异性,可以定量检测多种激素、肿瘤标志物、感染性疾病标志物等,为很多疾病的诊治提供了极⼤的便利。
近年来,在我国各级医院中化学发光分析仪逐渐得到普及,使其与⾎液分析仪、⽣化分析仪等⼀样,成为检验科的标配和主⼒仪器。
化学发光仪及其配套试剂的⽣产⼚商中,既有各⼤国外品牌,也有诸多国内后起⼚商。
笔者所在医院,虽地处西北⼩城,但也赶上了这股“春风”,除了原有的罗⽒电化学发光分析仪e411和e602外,最近⼜新添了⼀台国产化学发光分析仪(以下称“A仪器”),其主要⽤于性激素六项和感染性疾病标志物的检测。
化学发光法的普遍应⽤,虽然为疾病的诊治提供了强有⼒的⽀持。
但是,与许多实验室检测⽅法⼀样,化学发光法在实际应⽤中会受到⼀些因素的明显⼲扰,检验⼈员和临床医师如不能对这些潜在的⼲扰因素存在认知,就很有可能导致误诊误治,使患者权益受损,并为医疗纠纷埋下隐患。
下⾯就对近期笔者遇到的⼀例异常结果,及其背后的⼲扰因素叙述如下,希望能对诸位读者起到⼀点警⽰作⽤。
案例描述⼀份妇科住院患者的⾎清⼈绒⽑膜促性腺激素(HCG)标本,在罗⽒e602上第⼀次测得的结果为>10000mIU/mL, 进⽽选择1:20仪器⾃动稀释后,结果为>200000mIU/mL。
为了看⼀下对于这样⾼值的标本,装机时间不长的A仪器表现如何,我们把原⾎清放到了A仪器上检测,却测出HCG为6647 mIU/mL。
同⼀份标本怎么会有如此⼤的差异呢?通过查询得知,该患者的临床诊断是葡萄胎,那么HCG 浓度明显偏⾼是很有可能的。
因此,在e602上对该标本进⼀步稀释后,最终得到HCG浓度是1246970mIU/mL,我们将此结果报告临床。
之后在A仪器上,选择⾃动1:100稀释后,也测得HCG为553951mIU/mL。
可见A仪器在未稀释时,测出的6647mIU/mL是⼀份“虚假”的低值结果。
六天后,该患者复查HCG,结果为8565mIU/mL(未稀释,E602测得)。
酶联免疫吸附实验(ELISA)基本原理

酶联免疫吸附实验(ELISA)基本原理基本原理1971年Engvall和Perlmann发表了酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELIS A)用于IgG定量测定的文章,使得1966年开始用于抗原定位的酶标抗体技术发展成液体标本中微量物质的测定方法。
这一方法的基本原理是:①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。
②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。
在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。
用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。
加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅刊物定性或定量分析。
由于酶的催化频率很高,故可极大地地放大反应效果,从而使测定方法达到很高的敏感度。
方法类型和操作步骤ELISA可用于测定抗原,也可用于测定抗体。
在这种测定方法中有3种必要的试剂:①固相的抗原或抗体,②酶标记的抗原或抗体,③酶作用的底物。
根据试剂的来源和标本的性状以及检测的具备条件,可设计出各种不同类型的检测方法。
(一)双抗体夹心法双抗体夹心法是检测抗原最常用的方法,操作步骤如下:(1)将特异性抗体与固相载体连接,形成固相抗体:洗涤除去未结合的抗体及杂质。
(2)加受检标本:使之与固相抗体接触反应一段时间,让标本中的抗原与固相载体上的抗体结合,形成固相抗原复合物。
洗涤除去其他未结合的物质。
(3)加酶标抗体:使固相免疫复合物上的抗原与酶标抗体结合。
彻底洗涤未结合的酶标抗体。
此时固相载体上带有的酶量与标本中受检物质的量正相关。
(4)加底物:夹心式复合物中的酶催化底物成为有色产物。
根据颜色反应的程度进行该抗原的定性或定量。
酶联免疫吸附实验(ELISA)基本原理

更新时间:2004-12-210:30:001971年Engvall和Perlmann发表了酶联免疫吸附剂测定(enzyme linkedassay,ELISA)用于IgG定量测定的文章,使得1966年开始用于抗原定加入酶反应的底物后,ELISA可用于测定抗原,也可用于测定抗体。
在这种测定方法中有3种必要的试剂:(一)双抗体夹心法双抗体夹心法是检测抗原最常用的方法,操作步骤如下:(1)将特异性抗体与固相载体连接,形成固相抗体:洗涤除去未结合的抗体及杂质。
(2)加受检标本:使之与固相抗体接触反应一段时间,让标本中的抗原与固相载体上(3)加酶标抗体:使固相免疫复合物上的抗原与酶标抗体结合。
彻底洗涤未结合的酶(4)加底物:夹心式复合物中的酶催化底物成为有色产物。
根据颜色反应的程度进行根据同样原理,将大分子抗原分别制备固相抗原和酶标抗原结合物,即可用双抗原夹(二)双位点一步法在双抗体夹心法测定抗原时,如应用针对抗原分子上两个不同抗原决定簇的单克隆抗15-5)。
这种双位点一步不但简化了操作,缩短了反应时间,如应用高亲和力的单克隆抗体,测定的敏感性和特异性也显著提高。
单克隆抗体的应用使测定抗原的ELISA 提高到新水平。
在一步法测定中,应注意钩状效应(hookeffect),类同于沉淀反应中抗原过剩的后带现象。
当标本中待测抗原浓度相当高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成夹心复合物,所得结果将低于实际含量。
钩状效应严重时甚至可出现假阴性结果。
(三)间接法测抗体间接法是检测抗体最常用的方法,其原理为利用酶标记的抗抗体以检测已与固相结合的受检抗体,故称为间接法。
操作步骤如下:(1)将特异性抗原与固相载体连接,形成固相抗原:洗涤除去未结合的抗原及杂质。
(2)加稀释的受检血清:其中的特异抗体与抗原结合,形成固相抗原抗体复合物。
经洗涤后,固相载体上只留下特异性抗体。
其他免疫球蛋白及血清中的杂质由于不能与固相抗原结合,在洗涤过程中被洗去。
hook效应--浅谈

谈谈HOOK效应日期:2016-04-25 11:36:01 来源: 小桔灯点击:1469 次1、HOOK效应钩状效应即HOOK效应,是指由于抗原抗体比例不合适而导至假阴性的现象,其中抗体过量叫做前带效应;抗原过量叫做后带效应。
2、产生的原因抗原抗体特异性反应时,生成结合物的量与反应物的浓度有关。
无论在一定量的抗体中加入不同量的抗原或在一定量的抗原中加入不同量的抗体,均可发现只有在两者分子比例合适时才出现最强的抗原-抗体反应。
以沉淀反应为例,若向一排试管中加入一定量的抗体,然后依次向各管中加入递增量的相应可溶性抗原,根据所形成的沉淀物及抗原抗体的比例关系可绘制出反应曲线。
3、前带、后带效应从图中可见,曲线的高峰部分是抗原抗体分子比例合适的范围,称为抗原抗体反应的等价带(zone ofequivalence)。
在此范围内,抗原抗体充分结合,形成的沉淀物最多,表明抗原与抗体浓度的比例最为合适,称为最适比(optimalratio)。
在等价带前后分别为抗体、抗原过剩则影响沉淀物的形成,这种现象称为带现象(zone phenomenon)。
带现象在临床检验中经常出现,特别是ELISA反应中。
出现在抗体过量时,称为前带(prezone),出现在抗原过剩时,称为后带(postzone)。
所以在临床工作中一定要注意前带和后带现象,以免出现假阴性结果,尤其以前带效应明显,这种情况可以通过进一步稀释样本进行解4、HD-HOOK效应的分子基础HD-HOOK效应,实际上就是当检测高剂量样本时,会出现假低值、甚至假阴性的结果,从而导至试验结果错误。
该现象是固相测定方法特有的异常现象,但不是所有的固相法都存在这样的问题。
迄今为止,尚未发现在使用竞争法的固相测定法中报道出现HD-HOOK效应。
(1)二步夹心法的问题:二步法基本的试验过程是:加入待测抗原标本到预先包被第一抗体的微孔板内,未结合的抗原被洗涤出去,在加入标记第二抗体与被捕捉的抗原分子相结合,未结合的标记二抗被洗出。
免疫分析技术基本原理

免疫分析技术基本原理利用抗原、抗体之间的特异性结合来测定、分析特定物质的方法✧抗原:可诱导动物免疫系统产生免疫应答的物质。
按其引起免疫应答的能力分半抗原、抗原、超抗原。
✧抗体:由动物免疫系统产生,可特异性结合某种物质的免疫球蛋白。
分IgG、IgM、IgE、IgA、IgD五个亚型。
不同亚型针对同一抗原表位的结合位点的结构相同。
不同亚型出现的先后顺序不同,在血清中的含量不同,在机体中出现的地点不同。
抗原抗体反应的特性1可逆性抗原与抗体结合形成抗原抗体复合物的过程是一种动态平衡,其反应式为:Ag+Ab→Ag·Ab抗体的亲和力(affinity),可以用平衡常数K表示:K=[Ag·Ab]/[Ag][Ab] ,Ag·Ab的解离程度与K值有关。
高亲和力抗体的抗原结合点与抗原的决定簇在空间构型上非常适合,两者结合牢固,不易解离。
解离后的抗原或抗体均能保持原有的结构和活性2特异性抗原抗体的结合发生在抗原的决定簇与抗体的结合位点之间。
化学结构和空间构型互补关系,具有高度的特异性。
测定某一特定的物质,而不需先分离待检物。
3最适比例4敏感性化学比色法的敏感度为mg/ml水平。
酶反应测定法的敏感度约为5-10μg/ml。
免疫测定中凝胶扩散法和浊度法的敏感度与酶反应法相仿。
标记的免疫敏感度可提高数千倍,达ng/ml水平。
例如,HBsAg,其敏感度可达0.1ng/ml。
固相免疫测定的原理基础:抗原或抗体的固相化及抗原或抗体的酶标记。
加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,由此进行定性或定量分析。
双抗体夹心法原理此法适用于检验各种蛋白质等大分子抗原,例如HBsAg、HBeAg、AFP等。
只要获得针对受检抗原的异性抗体,就可用于包被固相载体和制备酶结合物而建立此法。
双抗原夹心法原理用特异性抗原进行包被和制备酶结合物。
此法中受检标本不需稀释,可直接用于测定,因此其敏感度相对高于间接法。
ELISA分类
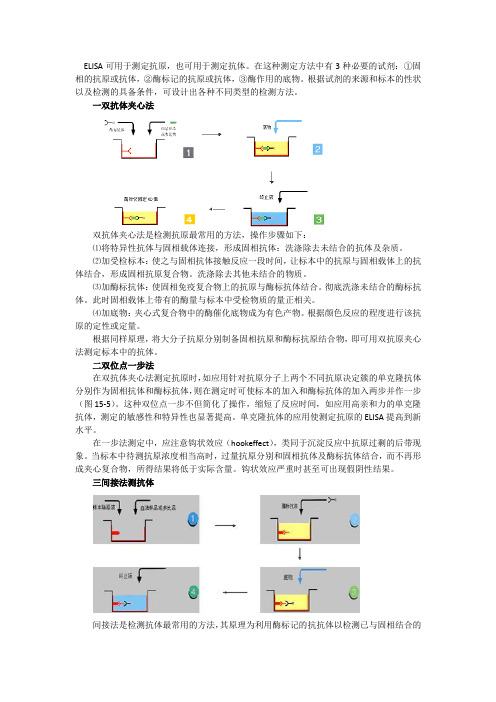
ELISA可用于测定抗原,也可用于测定抗体。
在这种测定方法中有3种必要的试剂:①固相的抗原或抗体,②酶标记的抗原或抗体,③酶作用的底物。
根据试剂的来源和标本的性状以及检测的具备条件,可设计出各种不同类型的检测方法。
一双抗体夹心法双抗体夹心法是检测抗原最常用的方法,操作步骤如下:⑴将特异性抗体与固相载体连接,形成固相抗体:洗涤除去未结合的抗体及杂质。
⑵加受检标本:使之与固相抗体接触反应一段时间,让标本中的抗原与固相载体上的抗体结合,形成固相抗原复合物。
洗涤除去其他未结合的物质。
⑶加酶标抗体:使固相免疫复合物上的抗原与酶标抗体结合。
彻底洗涤未结合的酶标抗体。
此时固相载体上带有的酶量与标本中受检物质的量正相关。
⑷加底物:夹心式复合物中的酶催化底物成为有色产物。
根据颜色反应的程度进行该抗原的定性或定量。
根据同样原理,将大分子抗原分别制备固相抗原和酶标抗原结合物,即可用双抗原夹心法测定标本中的抗体。
二双位点一步法在双抗体夹心法测定抗原时,如应用针对抗原分子上两个不同抗原决定簇的单克隆抗体分别作为固相抗体和酶标抗体,则在测定时可使标本的加入和酶标抗体的加入两步并作一步(图15-5)。
这种双位点一步不但简化了操作,缩短了反应时间,如应用高亲和力的单克隆抗体,测定的敏感性和特异性也显著提高。
单克隆抗体的应用使测定抗原的ELISA提高到新水平。
在一步法测定中,应注意钩状效应(hookeffect),类同于沉淀反应中抗原过剩的后带现象。
当标本中待测抗原浓度相当高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成夹心复合物,所得结果将低于实际含量。
钩状效应严重时甚至可出现假阴性结果。
三间接法测抗体间接法是检测抗体最常用的方法,其原理为利用酶标记的抗抗体以检测已与固相结合的受检抗体,故称为间接法。
操作步骤如下:⑴将特异性抗原与固相载体连接,形成固相抗原:洗涤除去未结合的抗原及杂质。
⑵加稀释的受检血清:其中的特异抗体与抗原结合,形成固相抗原抗体复合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钩状效应是指在双抗体夹心法测抗原的一步法ELISA中,测定显色随着待测标本中抗原浓度的增加而升高至一定程度后,测定吸光度即随抗原浓度的增加而开始下降直到不显色,而出现假阴性结果。
抗原抗体最适比例
在恒定量的抗体中加入递增量的抗原形成抗体复合物(沉淀)的量见图1。
曲线的高峰部分是抗原抗体比例最合适的范围,称为等价带(zone of equivalence)。
在等价带前后分别为抗体过剩带和抗原过剩带。
如果抗原或抗体极度过剩,则无沉淀物形成,在免疫测定中称为带现象(zone phenomenon)。
抗体过量称为前带(prezone),抗原地过量称为后带(postzone)。
在用免疫学方法测定抗原时,应使反应系统中有足够的抗体量,否则测得的量会小于实际含量,甚至出现假阴性。
图1沉淀反应中沉淀量与抗原抗体的比例关系
(RF)的双抗体夹心法测抗原
双抗体夹心法是检测抗原最常用的方法,操作步骤如下:
1)将特异性抗体与固相载体联结,形成固相抗体。
洗涤除去未结合的抗体及杂质。
2)加受检标本,保温反应。
标本中的抗原与固相抗体结合,形成固相抗原抗体复合物。
洗涤除去其他未结合物质。
3)加酶标抗体,保温反应。
固相免疫复合物上的抗原与酶标抗体结合。
彻底洗涤未结合的酶标抗体。
此时固相载体上带有的酶量与标本中受检抗原的量相关。
4)加底物显色。
固相上的酶催化底物成为有色产物。
通过比色,测知标本中抗原的量。
在临床检验中,此法适用于检验各种蛋白质等大分子抗原,例如HBsAg、HBeAg、AFP、hCG等。
只要获得针对受检抗原的特异性抗体,就可用于包被固相载体和制备酶结合物而建立此法。
如抗体的来源为抗血清,包被和酶标用的抗体最好分别取自不同种属的动物。
如应用单克隆抗体,一般选择两个针对抗原上不同决定簇的单抗,分别用于包被固相载体和制备酶结合物。
这种双位点夹心法具有很高的特异性,而且可以将受检标本和酶标抗体一起保温反应,作一步法检测。
在一步法测定中,当标本中受检抗原的含量很高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成"夹心复合物"。
类同于沉淀反应中抗原过剩的后带现象,此时反应后显色的吸光值(位于抗原过剩带上)与标准曲线(位于抗体过剩带上)某一抗原浓度的吸光值相同,如按常法测读,所得结果将低于实际的含量,这种现象被称为钩状效应(hook effect),
因为标准曲线到达高峰后呈钩状弯落。
钩状效应严重时,反应甚至可不显色而出现假阴性结果。
因此在使用一步法试剂测定标本中含量可异常增高的物质(例如血清中HBsAg、AFP和尿液hCG等)时,应注意可测范围的最高值。
用高亲和力的单克隆抗体制备此类试剂可削弱钩状效应。
假使在被测分子的不同位点上含有多个相同的决定簇,例如HBsAg的a决定簇,也可用针对此决定簇的同一单抗分别包被固相和制备酶结合物。
但在HBsAg的检测中应注意亚型问题,HBsAg有adr、adw、ayr、ayw4个亚型,显然每种亚型均有相同的a决定簇的反应性,这也是用单抗作夹心法应注意的问题。
双抗体夹心法测抗原的另一注意点是类风湿因子干扰。
RF是一种自身抗体,多为IgM 型,能和多种动物IgG的Fc段结合。
用作双抗体夹心法检测的血清标本中如含有RF,它可充当抗原成份,同时与固相抗体和酶标抗体结合,表现出假阳性反应。
采用F(ab')或Fab 片段作酶结合物的试剂,由于去除了Fc段,从而可消除RF的干扰。
双抗体夹心法ELISA试剂是否受RF的影响,已被列为这类试剂的一项考核指标(参见6.2)。
双抗体夹心法适用于测定二价或二价以上的大分子抗原,但不适用于测定半抗原及小分子单价抗原,因其不能形成两位点夹心。
本文来源于:生物问问博客,原文地址:/html/1023.html。
